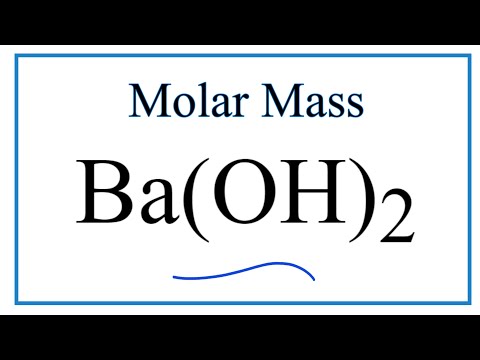Урок 17. Реакция нейтрализации » Kupuk.net
В уроке 17 «Реакция нейтрализации» из курса «Химия для чайников» рассмотрим процесс нейтрализации, а также понятия химический эквивалент вещества и грамм-эквивалент; кроме того научимся вычислять нормальную концентрацию раствора. С реакцией нейтрализации тесно связаны понятия «кислота» и «основание», поэтому настоятельно рекомендую подробно изучить урок 16 «Кислоты и основания»
Нейтрализация
Важным свойством кислот и оснований является их способность образовывать в растворе ионы H+ и OH-, которые могут атаковать другие имеющиеся там молекулы и вызывать химические превращения, с трудом или медленно протекающие в их отсутствии. Когда кислоты и основания реагируют друг с другом, ионы H+ и OH— соединяются, образуя молекулы воды. Этот процесс называется нейтрализацией:
- H+ + OH— → h3O
Химический эквивалент
С реакцией нейтрализации тесно связано процедура кислотно-основного титрования. Грубо говоря, титрование — это способ определения имеющегося количества кислоты или основания в растворе, путем измерения количества основания или кислоты с заданной концентрацией необходимого для полной нейтрализации имеющегося реагента. При титровании пользуются понятием химический эквивалент.
Грубо говоря, титрование — это способ определения имеющегося количества кислоты или основания в растворе, путем измерения количества основания или кислоты с заданной концентрацией необходимого для полной нейтрализации имеющегося реагента. При титровании пользуются понятием химический эквивалент.
Химический эквивалент кислоты — количество кислоты, которое при нейтрализации основания высвобождает 1 моль ионов H+.
Химический эквивалент основания — количество основания, которое при нейтрализации основания высвобождает 1 моль ионов OH—.
Полная нейтрализация происходит в том случае, если в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания.
Грамм-эквивалент — это масса кислоты (или основания) в граммах, которая образует 1 моль ионов H+ (или OH—)
Для кислот, способных высвобождать 1 ион H+ на молекулу, как, например, HCl или HNO3, химический эквивалент представляет собой то же самое количество вещества, что и моль, а 1 грамм-эквивалент — то же самое, что и молекулярная масса. Однако поскольку h3SO4 способна высвобождать два иона H+ на молекулу, 1 молю h3SO4 соответствуют два эквивалента, и поэтому в реакциях кислотно-основной нейтрализации грамм-эквивалент серной кислоты равен половине ее молекулярной массы. Грамм-эквивалент фосфорной кислоты h4PO4, т.е. такая ее масса в граммах, которая образует 1 моль ионов H+, равен 1/3 молекулярной массы этой кислоты. Точно так же для NaOH, KOH и Nh4, молекулярные массы совпадают с грамм-эквивалентами этих веществ, но грамм-эквивалент Ca(OH)2 равен половине его молекулярной массы.
Однако поскольку h3SO4 способна высвобождать два иона H+ на молекулу, 1 молю h3SO4 соответствуют два эквивалента, и поэтому в реакциях кислотно-основной нейтрализации грамм-эквивалент серной кислоты равен половине ее молекулярной массы. Грамм-эквивалент фосфорной кислоты h4PO4, т.е. такая ее масса в граммах, которая образует 1 моль ионов H+, равен 1/3 молекулярной массы этой кислоты. Точно так же для NaOH, KOH и Nh4, молекулярные массы совпадают с грамм-эквивалентами этих веществ, но грамм-эквивалент Ca(OH)2 равен половине его молекулярной массы.
В удобстве использования понятий химического эквивалента и грамм-эквивалента можно убедиться при рассмотрении нейтрализации фосфорной кислоты гидроксидом магния:
Рассмотрим решение конкретной задачи по химическим эквивалентам и грамм-эквивалентам:
Пример 1. Используя метод эквивалентов, найдите число граммов HNO3 необходимо для нейтрализации 100,0 г Ba(OH)2.
Решение:
Первым делом выпишем молекулярные массы и грамм-эквиваленты для HNO3 и Ba(OH)2:
| Реагент | Молекулярная масса, г/моль | Грамм-эквивалент, г/экв |
| Азотная кислота, HNO3 | 63,01 | 63,01 / 1 = 63,01 |
| Гидроксид бария, Ba(OH)2 | 171,34 | 171,34 / 2 = 85,67 |
Отлично! Теперь найдем сколько химических эквивалентов гидроксида бария содержится в 100,0 г:
- 100,0 г / 85,67 г/экв = 1,167 экв Ba(OH)2
В начале урока мы говорили, что полная нейтрализация получается, когда в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания. Поэтому для нейтрализации 1,167 экв Ba(OH)2 потребуется 1,167 экв HNO3:
Поэтому для нейтрализации 1,167 экв Ba(OH)2 потребуется 1,167 экв HNO3:
- 1,167 экв × 63,01 г/экв = 73,53 г HNO3
Ответ получен! Кстати, данную задачу можно решить по другому, используя полное уравнение реакции:
- 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2h3O
Число моль Ba(OH)2, вступающего в реакцию, равно:
- 100,0 г / 171,3 г/моль = 0,5838 моля Ba(OH)2
Из полного уравнения реакции следует, что в ней должно принять участие вдвое большее молярное количество азотной кислоты, чем гидроксида бария:
- 0,5838 моля × 2 = 1,167 моля HNO3
А в граммах это составит:
- 1,167 моля × 63,01 г/моль = 73,53 г HNO3
Ответы совпадают, т.е оба метода решения верны, однако метод эквивалентов позволяет обойтись без использования полного уравнения реакции.
Нормальная концентрация
Нормальная концентрация, или нормальность раствора (н.) показывает, сколько эквивалентов вещества содержится в 1 л его раствора. Например, по аналогии с молярной концентрацией, 1,00 М раствор h4PO4 имеет нормальность 3,00 н, а 0,010 М раствор Mg(OH)2 имеет нормальность 0,020 н.
Например, по аналогии с молярной концентрацией, 1,00 М раствор h4PO4 имеет нормальность 3,00 н, а 0,010 М раствор Mg(OH)2 имеет нормальность 0,020 н.
Пример 2. Определите молярность и нормальность 500 мл раствора, полученного при растворении в воде 4,00 г NaOH.
Решение:
По таблице Менделеева находим молекулярную массу гидроксида натрия, она равна 40,0 г/моль. В нашем распоряжении ровно 4,00 г NaOH, и в них содержится:
- 4,00 г / 40,0 г/моль = 0,100 моля NaOH
Нам уже известно, что молярная концентрация представляет собой отношение числа моль растворенного вещества на общий объем раствора, следовательно молярность раствора гидроксида натрия равна:
- 0,100 моля NaOH / 0,500 л раствора = 0,200 моль/л, или 0,2 М NaOH
В данном случае молярность раствора совпадает с его нормальностью, поскольку каждый моль гидроксида натрия дает 1 эквивалент OH— ионов. Следовательно нормальность полученного раствора равна также 0,200 н.
Пример 3. В 750 мл раствора содержится 10,0 г серной кислоты h3SO4. Определите молярность и нормальность данного раствора.
Решение:
- 10,0 г / 98,1 г/моль = 0,102 моля серной кислоты
- 0,102 моля / 0,750 л = 0,136 М раствор серной кислоты
Поскольку каждый моль серной кислоты высвобождает 2 эквивалента ионов H+, полученный раствор серной кислоты имеет нормальность, равную 2·0,136=0,272 н., т.е. представляет собой 0,272 н. раствора h3SO4.
Надеюсь урок 17 «Реакция нейтрализации» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Контрольные вопросы
1. Основные химические понятия и законы
1. Дайте формулировки основных стехиометрических законов (постоянства состава, простых объемных отношений, простых кратных отношений, Авогадро, эквивалентов).
2. Дайте определения
химическим понятиям: атом, молекула,
атомная и молекулярная масса, элемент,
эквивалент, простое и сложное вещество.
3. Дайте определения химическим понятиям: моль, молярная масса, молярный объем, молярная масса эквивалента, молярный объем эквивалента, относительная плотность газа.
4. Охарактеризуйте типы химических реакций (соединения, разложения, обмена, замещения).
5. Дайте определения основным классам неорганических соединений (оксиды, основания, кислоты, соли).
6. Изложите основные принципы номенклатуры неорганических соединений.
7. Приведите классификацию и охарактеризуйте свойства оксидов.
8. Приведите классификацию и охарактеризуйте общие химические свойства кислот.
9. Приведите классификацию и охарактеризуйте общие химические свойства оснований.
10. Приведите классификацию, опишите свойства и способы получения солей.
Пример 1.
Напишите уравнения реакций, с помощью
которых можно осуществить следующие
превращения: CoCoOCo(OH)2CoCl2.
Данное задание направлено на актуализацию знаний о классах неорганических соединений и их генетических связях. Необходимо написать соответствующие реакции и расставить коэффициенты.
Для получения из кобальта его оксида необходимо окислить металл кислородом:
2Co + O2 = 2CoO
оксид кобальта (II)
2) Оксиду кобальта соответствует нерастворимый гидроксид, поэтому его нельзя получить непосредственно реакцией с водой. Необходимо растворить оксид в сильной кислоте, а затем из раствора полученной соли осадить нерастворимый гидроксид реакцией со щелочью.
а) CoO + H2SO4 = CoSO4 + H2O
б) CoSO4+2KOH=Co(OH)2+Na2SO4
гидроксид
кобальта(II)
3) Получить соль из гидроксида кобальта (II) можно реакцией нейтрализации с соответствующей кислотой:
Co(OH)2 + 2HCl = 2H2O + CoCl2
хлорид кобальта(II)
Пример 2
 Какой объем при н.у. займет углекислый
газ, полученный при термическом разложении
10 г карбоната кальция? Какова масса этой
порции газа? Сколько молекул она содержит?
Какой объем при н.у. займет углекислый
газ, полученный при термическом разложении
10 г карбоната кальция? Какова масса этой
порции газа? Сколько молекул она содержит?Дано: m(CaCO3)= 10 г | Решение. Напишем уравнение реакции: 10 г х (л), у (г) CaCO 3 = CaO + CO2 |
Найти: V(CO2), N(CO2), m(CO2). | М=100 г/моль, Vm=22,4 л/моль М=44 г/моль |
| По уравнению реакции из одного моля карбоната кальция получается 1 моль углекислого газа, определим, сколько молей СаСО3 взято для реакции: =m/М,
(СаСО3)=10/100=0,1(моль). Найдем объем этого количества газа: V=Vm, V=0,122,4=2,24(л). Найдем массу газа: m=M, m=0,144=4,4 (г) Найдем число молекул: N=NA, NA=6,021023 моль-1, N=0,16,021023=6,021022(молекул) Ответ: V(CO2)=2,24 л, m(CO2)=4,4 г, N(CO2)=6,021022 молекул. | |
Пример 3.
Определите массу углекислого газа,
который при 17
Дано: | Решение. Воспользуемся уравнением Менделеева – Клапейрона: |
p = 95 кПа = 95103 Па tо = 17oC; V=2 л = 210-3 м3 | pV=mRT/M, откуда m=pVM/RT р=95103Па, V=210-3 м3, Т=17+273=290 К, R=8,314 Дж/мольК, М(СО2)=4410-3 кг/моль, |
Найти: m(СО2) |
Ответ: m(CO2)=
346,75 г.
Пример 4. Вычислите молекулярную массу газа, если плотность его по кислороду 1,38.
Дано: D(O2)=1,38 | Решение. D(O2)=Мr(газа )/Мr(О2), Мr(газа ) = D(O2) Мr(О2) |
Найти: Мr(газа) | Мr(O2) = 162=32 , Мr(газа )=1,3832=44. |
Ответ: Мr(газа)=44.
Пример 5. При восстановлении водородом 2,68 г оксида металла образовалось 0,648 г воды. Вычислите молярную массу эквивалента металла.
Дано: m(MexOy)=2,68 г | Решение. |
M(H2O) = 0,648 г | |
Найти: МЭ(Ме) | MexOy + H2 Me + H2O |
M(H2O)=18 г/моль, (H2O) =O,648:18=0,036 (моль)
(O) = (H2O) = 0,036 моль
М(О) = 16 г/моль
m(O) = 0,03616 = 0,576 (г)
Найдем массу металла.
M (Me) = m (MexOy) – m (O)
m (Me) = 2,68 – 0,576 = 2,104 (г)
Найдем молярную массу эквивалента металла, пользуясь законом эквивалентов, учитывая, что МЭ (О)=8 г/моль-экв:
Ответ: МЭ(Ме)
= 29,2 г/моль-экв.
Пример 6. Рассчитайте молярную массу эквивалента соли – Cr2(SO4)3.
Дано: Cr | Решение: МЭ=Мf, fсоли=1/число атомов металлавалентность металла |
Найти: МЭ | М(Cr2(SO4)3)=252+3(32+416)=392(г/моль), f(Cr2(SO4)3)= МЭ=3691/6=65,3 (г/моль-экв) |
Ответ: МЭ=65,3 г/моль-экв.
Пример 7. При взаимодействии 2,33 г смеси железа и
цинка с кислотой выделилось 896 мл водорода
при н.у. Вычислите массу железа и цинка
в смеси.
Дано: | Решение: x моль х моль y моль y моль |
m(Zn+Fe)=2,33 г | 2HCl + Zn= ZnCl2 + H2 , Fe + 2HCl = H2 + FeCl2 |
V(H2)=896 мл=0,896 л | 1 моль 1 моль 1 моль 1 моль |
Найти: m(Zn), m(Fe). | M=M, M(Zn)=65 г/моль, M(Fe)=56 г/моль m(Zn)=65x (г), m(Fe)=56y (г) |
(моль) 65х+56у=2,33
х + у = 0,04
х=0,01 моль, m(Zn)=650,01=0,65 (г)
у=0,03 моль, m(Fe)=560,03=1,68 (г).
Ответ: m(Zn)=0,65
г; m(Fe)=1,68
г.
Задания для самостоятельного решения
Вариант 1
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ZnZnOZnSO4Zn(OH)2ZnO.
2. Сколько цинка надо растворить в кислоте для получения 2,8 л водорода (при н.у.)?
3. Какой объем займут 8 г кислорода при 27оС и давлении 5 атмосфер? Сколько молекул содержится в этой порции газа?
4. Чему равна молярная масса эквивалента гидроксида бария в реакции: Ba(OH)2+H2SO4=BaSO4+2H2O?
5. Определите молекулярную массу газа, если его относительная плотность по азоту равна 2,54.
Вариант 2
1. Напишите уравнения
реакций, с помощью которых можно
осуществить следующие превращения:
PP2O5H3PO4Na3PO4Ca3(PO4)2.
2. Какое количество вещества водорода потребуется для восстановления меди из 20 г CuO? Какой объем при нормальных условиях займет это количество газа?
3. Вычислите молекулярную массу газа, если плотность его при 127оС и давлении 3 атмосферы равна 4 г/л.
4. Чему равна молярная масса эквивалента фосфорной кислоты в реакции: H3PO4+Ca(OH)2=CaHPO4+2H2O?
5. Относительная плотность газа по воздуху 0,97. Определите молекулярную массу газа.
Вариант 3
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:CaCaOCa(OH)2CaCO3CaCl2.
2. Какова масса хлорида меди, образовавшегося при взаимодействии меди с 11,2 л хлора? Определите число молекул хлора в данной порции газа.
3. Вычислите
молекулярную массу газа, если плотность
его по воздуху 2,45.
4. Чему равна молярная масса эквивалента кальция, если 1 г его вытесняет из кислоты 560 мл водорода?
5. Какой объем займут 56 г азота при температуре 25оС и давлении 120 кПа?
Вариант 4
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: SSO2SO3H2SO4BaSO4.
2. Какой объем и какое количество вещества кислорода потребуется для полного сжигания 1 л сероводорода?
3. Стальной баллон емкостью 20 л наполнен кислородом при температуре 17оС и давлении 108 Па. Вычислите массу кислорода.
4. Молярная масса эквивалента металла равна 23 г/моль. Сколько граммов этого металла необходимо взять для выделения 135,6 мл водорода из кислоты при н.у?
5. Определите
молекулярную массу газа, если его
относительная плотность по воздуху
2,45.
Вариант 5
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: MgMgOMg(NO3)2Mg(OH)2MgO.
2. Какой объем и какое количество вещества углекислого газа образуется при сжигании 32 г метана?
3. Вычислите массу 400 м3 оксида углерода(II) при 27оС и давлении 107 кПа.
4. Рассчитайте молярную массу эквивалента соли – Ca3(PO4)2.
5. Относительная плотность газа по кислороду равна 0,5. Рассчитайте его молекулярную массу.
Вариант 6
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: NNONO2HNO3Al(NO3)2.
2. Вычислите, сколько
моль углекислого газа выделится при
термическом разложении 10 г карбоната
кальция? Какой объем займет этот газ
при н. у.?
у.?
3. Вычислите, какой объем займут 40 м3 газа, взятого при н.у., если температура газа станет равной 36оС, а давление 10 атм.
4. На восстановление 9,2 г металла из его оксида израсходовалось 3,36 л водорода, взятого при н.у. Определите молярную массу эквивалента металла.
5. Рассчитайте молекулярную массу газа, если его относительная плотность по водороду 35,5.
Вариант 7
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: BaBaOBa(OH)2BaCl2BaSO4.
2. Какой объем при н.у. занимает 2,51021 молекул азота? Сколько г аммиака можно получить из такого количества азота?
3. Определите молекулярную массу газа, если при 17оС и давлении 95 кПа 2,15 г его занимают объем 2 л.
4. На восстановление
12,8 г двухвалентного металла из его
оксида потребовалось 4,48 л водорода при
н. у. Определите молярную массу эквивалента
металла.
у. Определите молярную массу эквивалента
металла.
5. Чему равна молекулярная масса газа, относительная плотность которого по кислороду 0,94?
Вариант 8
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CCO2H2CO3Na2CO3CaCO3
2. Определите относительную молекулярную массу газа, если 1,65 г (н.у.) его занимают объем 0,52 л.
3. Вычислить объем 200 г метана (СН4) при температуре 50оС и давлении 253,25 кПа.
4. Рассчитайте молярную массу эквивалента гидроксида алюминия в реакции: Al(OH)3+2HCl=AlOHCl2+2H2O.
5. Сколько молей хлороводорода можно получить из газовой смеси, содержащей при н.у. 10 л водорода и 11 л хлора?
Вариант 9
1. Напишите уравнения
реакций, с помощью которых можно
осуществить следующие превращения:
SiSiO2K2SiO3H2SiO3SiO2.
Напишите уравнения
реакций, с помощью которых можно
осуществить следующие превращения:
SiSiO2K2SiO3H2SiO3SiO2.
2. Какова масса 12,041025 молекул воды? Какой объем кислорода потребуется для получения такой массы воды?
3. Какой объем займут10 л газа, взятого при н.у., если температура его станет равной 17оС, а давление 20 атмосфер?
4. Рассчитайте молярную массу эквивалента соли – Fe2(SO4)3.
5. Рассчитайте молекулярную массу газа, относительная плотность которого по водороду 22.
Вариант 10
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: FeFe2O3FeCl3Fe(OH)3Fe2O3.
2. Какова масса 5 л
хлора при н. у? Сколько молекул хлора
содержится в этом объеме газа? Какой
объем хлороводорода можно получить из
этого газа?
у? Сколько молекул хлора
содержится в этом объеме газа? Какой
объем хлороводорода можно получить из
этого газа?
3. Вычислите объем 350 г хлора при температуре 37оС и давлении 5 атмосфер.
4. Рассчитайте молярную массу эквивалента СаСО3.
5. Относительная плотность газа по азоту равна 1,57. Какова относительная молекулярная масса этого газа?
Вариант 11
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: AlAl2O3Al(NO3)3Al(OH)3Al2O3.
2. Сколько молекул содержится в 3 л аммиака при н.у.? Какой объем водорода потребуется для получения такого объема аммиака?
3. Какой объем займут 40 г хлора при 27оС и давлении 1012 кПа?
4. Рассчитайте
молярную массу эквивалента Н3РО4.
5. Относительная плотность газа по воздуху равна 0,55. Определите относительную молекулярную массу газа
Вариант 12
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: LiLi2OLiOHLi2SO4LiCl.
2. Определите относительную молекулярную массу газа, если при н.у. 0,4 г его занимают объем 0,56 л. Сколько молекул содержится в данной порции газа?
3. Какова масса 1 м3 воздуха при 27оС и давлении 105 Па, если средняя молекулярная масса воздуха равна 29?
4. Рассчитайте молярную массу эквивалента борной кислоты Н3ВО3.
5. Относительная плотность газа по воздуху 1,17. Определите относительную молекулярную массу газа.
Вариант 13
1. Напишите уравнения
реакций, с помощью которых можно
осуществить следующие превращения:
CrCr2O3CrCl3Cr(OH)3Cr2O3.
2. Какое количество вещества содержится в 10 л азота при н.у? Сколько молекул содержит данная порция газа? Какой объем аммиака можно получить из этого газа?
3. Какова масса 1 л воздуха при температуре 25оС и давлении 105 Па, если при н.у. масса 1 л воздуха 1,293 г?
4. Рассчитайте молярную массу эквивалента ВаСО3.
5. Чему равна относительная плотность углекислого газа по воздуху?
Вариант 14
1..Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: SrSrOSr(OH)2Sr(NO3)2SrSO4.
2. Сколько молекул содержится в 3 л кислорода?
3. Какой объем займут 10 г водорода при 100оС и давлении 10 атм?
4. Рассчитайте
молярную массу эквивалента серной
кислоты в реакции: H2SO4+Ca(OH)2=CaSO4+2H2O.
5. Рассчитайте относительную плотность этилена (С2Н4) по азоту.
Вариант 15
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Cl2O7HclO4Ca(ClO4)2CaCO3CO2.
2. Какой объем водорода выделится (н.у.) при взаимодействии 0,2 моль соляной кислоты с цинком? Сколько молекул водорода содержится в этом объеме?
3. Вычислите массу 1 л ацетилена (С2Н2) при температуре 60оС и давлении 5 атм.
4. Рассчитайте молярную массу эквивалента соли — ZnSO4.
5. Чему равна относительная плотность кислорода по воздуху?
Учебные материалы по химии, ЗФ
Skip to main content
Sorry, the requested file could not be found
More information about this error
Jump to. ..
Jump to…ОбъявленияЛекции по химии почвСвойства и особенности формирования почв Томской областиТемы рефератовВопросы для подготовки к зачетуХимический состав почвХимия. Сборник задач и упражнений. Часть 2
..
Jump to…ОбъявленияЛекции по химии почвСвойства и особенности формирования почв Томской областиТемы рефератовВопросы для подготовки к зачетуХимический состав почвХимия. Сборник задач и упражнений. Часть 2
| No events, Saturday, 1 October 1 | No events, Sunday, 2 October 2 | |||||
| No events, Monday, 3 October 3 | No events, Tuesday, 4 October 4 | No events, Wednesday, 5 October 5 | No events, Thursday, 6 October 6 | No events, Friday, 7 October 7 | No events, Saturday, 8 October 8 | No events, Sunday, 9 October 9 |
| No events, Monday, 10 October 10 | No events, Tuesday, 11 October 11 | No events, Wednesday, 12 October 12 | No events, Thursday, 13 October 13 | No events, Friday, 14 October 14 | No events, Saturday, 15 October 15 | No events, Sunday, 16 October 16 |
| No events, Monday, 17 October 17 | No events, Tuesday, 18 October 18 | No events, Wednesday, 19 October 19 | No events, Thursday, 20 October 20 | No events, Friday, 21 October 21 | No events, Saturday, 22 October 22 | No events, Sunday, 23 October 23 |
| No events, Monday, 24 October 24 | No events, Tuesday, 25 October 25 | No events, Wednesday, 26 October 26 | No events, Thursday, 27 October 27 | No events, Friday, 28 October 28 | No events, Saturday, 29 October 29 | No events, Sunday, 30 October 30 |
| No events, Monday, 31 October 31 |
- Hide site events
- Hide category events
- Hide course events
- Hide group events
- Hide user events
- Hide other events
No online users (last 5 minutes)
Skip StatisticsBA (OH) 2
Chembk On Mobile
Название: гидроксид бария
CAS: 17194-00-2
Молекулярная формула: BA (OH) 2
Молекулярная масса: 171,342
- 63.

- CAS
- CAS 171
- CAS 17194-00-2
ba(oh)2 —
Имена и идентификаторы| Имя | Barium hydroxide |
| Synonyms | Ba(OH)2 Barium hydroxide, alpha bariumdihydroxide bariumhydroxide(ba(oh)2) Bariumhydroxide,anhydrous dihydroxybarium |
| CAS | 17194-00- 2 |
| EINECS | 241-234-5 |
| ИнЧИ | ИнЧИ=1/Ba.2h3O/h;2/1h3/q+2;;/3p-2 -3/h3-3H |
ba(oh)2 —
Физико-химические свойства| Молекулярная формула | BA (OH) 2 |
| Molar Mass | 171,342 |
| . Точка смещения | > 300 ° Shert. Характерный белый моноклинный кристалл. температура плавления 78 ℃ относительная плотность 2,18 (16 ℃) Растворимость мало растворим в этаноле. |
BA (OH) 2 —
Риск и безопасность| Символы опасности | C — Corrosive | ||||||||||||||||||||||||||||||||||||
| Коды риска | r20/22 — 22 — 22 — 22 — 22 — 22 — 2 22 — 2 22 — 2 22 — 2 22 — 2 22 — 22. R34 — Вызывает ожоги | ||||||||||||||||||||||||||||||||||||
| Описание безопасности | S26 — При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу. S36/37/39 — Носите подходящую защитную одежду, перчатки и средства защиты глаз/лица. S45 — В случае несчастного случая или при плохом самочувствии немедленно обратитесь за медицинской помощью (по возможности покажите этикетку).
Последнее обновление:2022-03-07 23:08:54 ba(oh)2 —Информация о безопасности
Последнее обновление:2022-03-07 23:08:55 Jinan Shiji Tongda Chemical Co. Название продукта: Гидроксид бария Тел. 053185917586 Qianyan Chemical Co., Ltd 9)0005 Название продукта : Barium Hydroxide Buy in Stock 9000 2 9000 2 9000 2 . , ООО Product Name: Barium hydroxide Wuhan Hotian Chemicals Limited Название продукта : Гидроксид бария Hosky Group Limited Название продукта : Barium Hydroxide XINJI XIBO CHEMICAL INDUSTRY CO., LTD. Название продукта : Barium Hydroxide Acroyali Holdings Qingdao Co., Ltd Название продукта: Гидроксид бария ба(о)2 16454-60-7 7 | НЕОДИМА НИТРАТА ГЕКСАГИДРАТ (3-Аминопропил)трифенилфосфония бромид DXD BMPO Стандартный раствор AS Цитратного буфера Диэтиламиноэтил-декстр гидрохлорид Botyryl-Coenzyme Aly-wydrate L-4-гидроксифенил-3,5-дилеране L-4-гидроксифенил-3,5-дилевой L-4-гидроксифенил-3,5-дилевой L-4-гидроксифенил-3,5-дилевой L-4-гидроксифенил-3,5-дилевой L-4-гидроксифенил-3,5-дилевой L-4-гидроксифенил-3,5-дилевой L-4-гидроксифенил-3,5-дилеране. 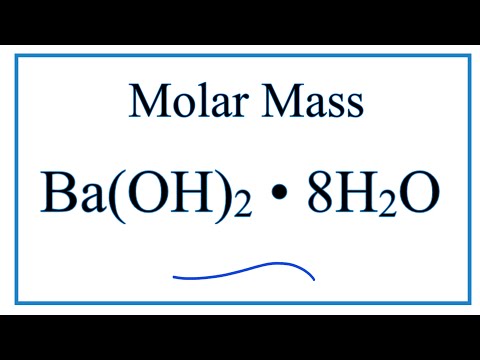 N,N-ДИЭТИЛ-N-МЕТИЛ-N-(2-МЕТОКСЕТИЛ)АММОНИЙ БИС(ТРИФТОРМЕТАНСУЛУФОНИЛ)ИМИД N,N-ДИЭТИЛ-N-МЕТИЛ-N-(2-МЕТОКСЕТИЛ)АММОНИЙ БИС(ТРИФТОРМЕТАНСУЛУФОНИЛ)ИМИД Поли(пропиленгликоль) 2-Гидрокситетрагидрофуран N-БУТИЛЦИКЛОГЕКСАН САМАРИЯ НИТРАТА ГЕКСАГИДРАТ КСИЛОЛЦИАНОЛ FF Поли(имино-1,2-этандиилгидрохлорид) Стандартный раствор формазина Гидроксид бария: подробная концепция выделяется как пятый элемент под группой 2 как мягкий и серебристый щелочной металл. Но что, если мы скажем вам, что в этом элементе есть нечто большее, чем кажется на первый взгляд?В этом всеобъемлющем обзоре элемента и его влияния на общий аспект химии. Давайте начнем! Гидроксид бария: обзор Гидроксид бария, также называемый баритом или баритовой водой, является не только важным химическим соединением, но и предметом обсуждения в этой статье. Это соединение можно представить в химии как Ba(OH) 2 . Следовательно, это химическая формула гидроксида бария. Это прозрачный белый порошок без заметного запаха, когда он доступен в продаже. Как мы уже упоминали, формула гидроксида бария: Ba(OH) 2 . Чтобы лучше понять структуру, вы должны сначала узнать, как она готовится. Гидроксид бария образуется в результате химической реакции между оксидом бария (Bao) и водой. Bao растворяется в воде с образованием гидроксида бария. Во-первых, он появляется в кристаллической форме, называемой октагидратом гидроксида бария. На открытом воздухе он превращается в моногидрат или желаемую форму гидроксида бария. Но как нам доказать, что в этой реакции есть какая-то логика или это оксид бария, который в реакции с водой дает гидроксид бария? В качестве доказательства исследователи доказали, что если гидроксид бария проходит в вакууме при 100°C, он дает Бао и воду. Как мы видим, химическая формула гидроксида бария содержит Ba и OH. Теперь возникает вопрос, почему тогда формула гидроксида бария представлена как Ba(OH) 2 , а не NaOH? Ну, для этого вам нужно понять концепцию валентности. Каждая молекула имеет атомный номер в универсальной периодической таблице. Для бария это 56. Теперь, согласно известной теории, конфигурация бария имеет вид 1s22s22p63s23p63d104s24p64d105s25p66s2, что намекает на наличие у него двух неспаренных электронов на внешней оболочке. В случае ОН отрицательный ион, иначе называемый анионом, имеет один неспаренный электрон на внешней орбите. Он должен дополнять валентность, чтобы смешать эти два вещества с образованием одного соединения. Ну, это возможно только тогда, когда один ион бария с валентностью +2 связывается с 2 ионами ОН с валентностью +1 каждый. Чтобы дать вам лучшее представление, вот обзорная таблица, которая определяет основные свойства гидроксида бария – Ba(OH) 2 .
Октагидрат гидроксида бария Первый продукт, получаемый в процессе получения химической формулы гидроксида бария в форме октагидрата. Октагидрат гидроксида бария химически представлен формулой Bah28O10 или Ba(OH)2,8h3O. Это неорганическое основание широко используется в процедурах химического анализа и титрования. Октагидрат гидроксида бария имеет центры Ba2+ с восемью координатными центрами. Но он отличается от формы моногидрата тем, что не имеет общих лигандов. В этом разделе мы описываем основные физические и химические свойства гидроксида бария. Молярная масса гидроксида барияГидроксид бария имеет молекулярную массу или молярную массу 137,33, причем в состав соединения входит только барий. Чтобы разбить его дальше, водород имеет молярную массу 1,008, а формула включает два разных атома водорода с общей массой 2,016. Прибавив к этому, молярная масса кислорода составляет 15,9.99. Учитывая формулу Ba(OH) 2 с двумя атомами кислорода, двумя атомами водорода и одним атомом бария, общая молярная масса гидроксида бария составляет 171,344 г/моль. Является ли гидроксид бария сильным основанием?Согласно химии, соединение называется основанием, если оно нейтрализует кислоты при взаимодействии с ионами водорода. Гидроксид бария. Итак, является ли гидроксид бария сильным основанием или сильной кислотой? Барий — это металл, относящийся к группе IIA периодической таблицы. Гидроксид бария может быть полностью лизирован с образованием ионов бария и гидроксильных ионов. Температура кипения гидроксида барияТемпература кипения оксида бария составляет 780 градусов Цельсия. Кипячение вещества до температуры 800 градусов по Цельсию приведет к его распаду и выделению оксида бария. Температура плавления Температура плавления относится к точной температуре, при которой соединение начинает плавиться. Количество воды в соединении играет важную роль в определении его температуры плавления. Чем больше содержание воды, тем меньше температура плавления. В случае гидроксида бария октагидрат представляет собой форму, которая содержит максимальное количество воды, поэтому плавится при 78 градусах Цельсия. Говоря о растворимости гидроксида бария в воде, можно с уверенностью сказать, что он не так растворим. Из-за уменьшения энергии решетки наименьшая молярная концентрация, необходимая для растворения гидроксида бария в воде, составляет 0,1 М. Не только вода, но и менее растворима даже в других растворителях. Практическое применение гидроксида барияГидроксид бария, как в форме моногидрата, так и в форме октагидрата, находит широкое применение во всем мире. Вот обзор различных практических применений металла: Получение органических соединений и солей бария Ионы, присутствующие в водном состоянии солей бария и сульфата, объединяются для получения сульфата бария в лаборатории. Здесь отходы, состоящие из соли бария, иногда смешивают с сульфатом натрия для детоксикации и иммобилизации химического элемента. Гидроксид бария обладает многими свойствами. Он обладает всеми свойствами идеальной щелочи, которую можно использовать в нефтяной промышленности. Работа, которую он выполняет в нефтяной промышленности, заключается в том, что он используется в качестве присадки к маслу. Используется в качестве аналитической химии для титрования слабыми кислотамиЭта обработка благоприятствует неорганическим кислотам. Здесь гарантировано, что прозрачный водный раствор не содержит карбонатов, в отличие от гидроксида калия и гидроксида натрия, такого как углерод бария, который нерастворим в воде. Таким образом, раствор можно использовать в качестве индикатора тимолфталеина или фенолфталеина (с щелочным изменением цвета) без риска для процесса титрования из-за присутствия ионов углерода. Ниже приведены некоторые другие применения этого соединения:
На этом мы подошли к концу нашего обширного блога о соединении гидроксида бария. Теперь, когда вы прочитали его здесь, мы надеемся, что у вас есть все необходимые сведения об особенностях и функциях этого уникального соединения. Помните, что состав очень эффективен внутри лаборатории, но опасен вне ее. Будьте осторожны и следите за наличием таких химических соединений в вашем окружении. Всего наилучшего! Часто задаваемые вопросы о гидроксиде бария 1. Является ли гидроксид бария ионным?Да, соединение гидроксида бария является ионным в исходном состоянии; Гидроксид бария является ионным. Он состоит из катиона (Ba2 + ) и аниона (OH – ), что делает его нейтрализуемым в этой форме. Поэтому для нейтрализации пласта ионы OH – умножаются в два раза. 2. Каковы физические свойства гидроксида бария? Ba(OH) 2 – это химическая формула гидроксида бария. Гидроксид бария представляет собой быстро реагирующее соединение. Он не только вступает в реакцию с кожей, но и опасен во многих аспектах. Соединение может вызвать несколько опасностей, таких как повреждение глаз, раздражение кожи и отравление. Гидроксид бария Гидрат | AMERICAN ELEMENTS®РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ. BA-OH-02-C.XHYD , BA-OH-03-C.XHYD , BA-OH-04-C.XHYD , BA-OH-05-C.XHYDНомер CAS: 40226-30-0 Соответствующие установленные области применения вещества: Научные исследования и разработки Подробная информация о поставщике: 6 Телефон службы экстренной помощи2: 9, Северная Америка: +1 800-424-9300 РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ ИДЕНТИФИКАЦИЯ ОПАСНОСТИ Внешний вид: твердое вещество белого цвета. РАЗДЕЛ 3. СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ CAS# Химическое название Процент EINECS/ELINCS РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ Глаза: Немедленно промыть глаза большим количеством воды в течение не менее 15 минут, время от времени поднимая верхние и нижние веки. РАЗДЕЛ 5. ПРОТИВОПОЖАРНЫЕ МЕРЫ Общая информация: Как и при любом пожаре, надевайте автономный дыхательный аппарат в условиях давления-требования, MSHA/NIOSH (утвержденный или эквивалентный), РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ Общая информация: Используйте соответствующие средства индивидуальной защиты, как указано в Разделе 8. РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ Обращение: Не вдыхайте пыль, туман или пары. Не допускать попадания в глаза, на кожу или одежду. Использовать только в химическом вытяжном шкафу. РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ Технические меры: Помещения, где хранится или используется этот материал, должны быть оборудованы средствами для промывки глаз и аварийным душем. РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА Физическое состояние: твердое вещество РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ Химическая стабильность: Стабилен при нормальных температурах и давлениях. Поглощает углекислый газ из воздуха. Поглощает углекислый газ из воздуха до РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ RTECS#: РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯНет доступных данных. РАЗДЕЛ 13. СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ Производители химических отходов должны определить, классифицируется ли выбрасываемое химическое вещество как опасные отходы. Рекомендации Агентства по охране окружающей среды США для РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ Наименование: КОРРОЗИОННОЕ ТВЕРДОЕ ВЕЩЕСТВО ТОКСИЧНОЕ, Н. РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ US FEDERAL |

 Следовательно (СО2)=0,1
моль.
Следовательно (СО2)=0,1
моль. Найдем массу кислорода. Из схемы
реакции видно, что весь кислород,
входивший в состав оксида, перешел в
воду:
Найдем массу кислорода. Из схемы
реакции видно, что весь кислород,
входивший в состав оксида, перешел в
воду:
 Растворим в воде, его водный раствор сильно щелочной.
Растворим в воде, его водный раствор сильно щелочной. com
com  В формулу гидроксида бария входят химические молекулы, придающие ему ироничный характер. Помимо свойства катализировать реакции металлизации карбоксамида, он также может быть опасен.
В формулу гидроксида бария входят химические молекулы, придающие ему ироничный характер. Помимо свойства катализировать реакции металлизации карбоксамида, он также может быть опасен.


 Это означает, что он легко растворяется в воде и дает раствор сильного основания, что является предметом нашего беспокойства. Итак, что вы думаете сейчас? Является ли гидроксид бария сильной кислотой? Это действительно так! Не просто прочный, но такой же прочный, как гидроксиды металлов IA.
Это означает, что он легко растворяется в воде и дает раствор сильного основания, что является предметом нашего беспокойства. Итак, что вы думаете сейчас? Является ли гидроксид бария сильной кислотой? Это действительно так! Не просто прочный, но такой же прочный, как гидроксиды металлов IA. В то время как безводная форма, содержащая наименьшее количество воды, плавится при 407 градусах Цельсия. Моногидратная форма плавится между этими двумя температурами, которые составляют 300 градусов Цельсия.
В то время как безводная форма, содержащая наименьшее количество воды, плавится при 407 градусах Цельсия. Моногидратная форма плавится между этими двумя температурами, которые составляют 300 градусов Цельсия. Таким образом, процесс исключает наиболее опасную соль на основе бария из-за ее нерастворимости.
Таким образом, процесс исключает наиболее опасную соль на основе бария из-за ее нерастворимости. Вот что делает его важным компонентом нефтеперерабатывающих заводов и отраслей промышленности.
Вот что делает его важным компонентом нефтеперерабатывающих заводов и отраслей промышленности.
 По физическим свойствам это прозрачный белый гранулированный порошок без запаха. Однако следует отметить, что химическое соединение ядовито.
По физическим свойствам это прозрачный белый гранулированный порошок без запаха. Однако следует отметить, что химическое соединение ядовито. Немедленно обратитесь за медицинской помощью
Немедленно обратитесь за медицинской помощью 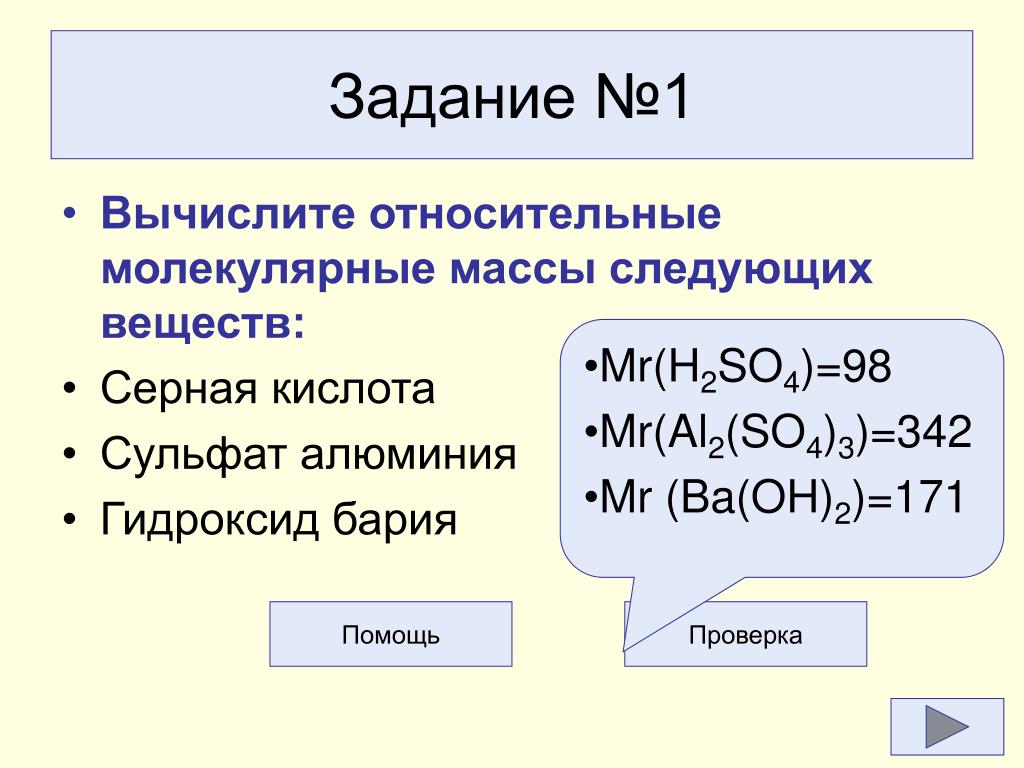
 Используйте адекватную вентиляцию
Используйте адекватную вентиляцию 


 У.К.
У.К.