Презентация для урока «Окислительно-восстановительные реакции»
| 12+ Свидетельство СМИ ЭЛ № ФС 77 — 70917 Лицензия на образовательную деятельность №0001058 | Пользовательское соглашение Контактная и правовая информация |
Педагогическое сообщество | Бесплатные всероссийские конкурсы | Бесплатные сертификаты | Нужна помощь? Инструкции для новых участников | Бесплатная онлайн-школа для 1-4 классов |
Всё для аттестацииПубликация в сборникеВебинарыЛэпбукиПрофтестыЗаказ рецензийНовости
Библиотека▪Публикации▪Статьи
Материал опубликовал
#9 класс #Химия #Учебно-методические материалы #Презентация #Учитель-предметник #Школьное образование
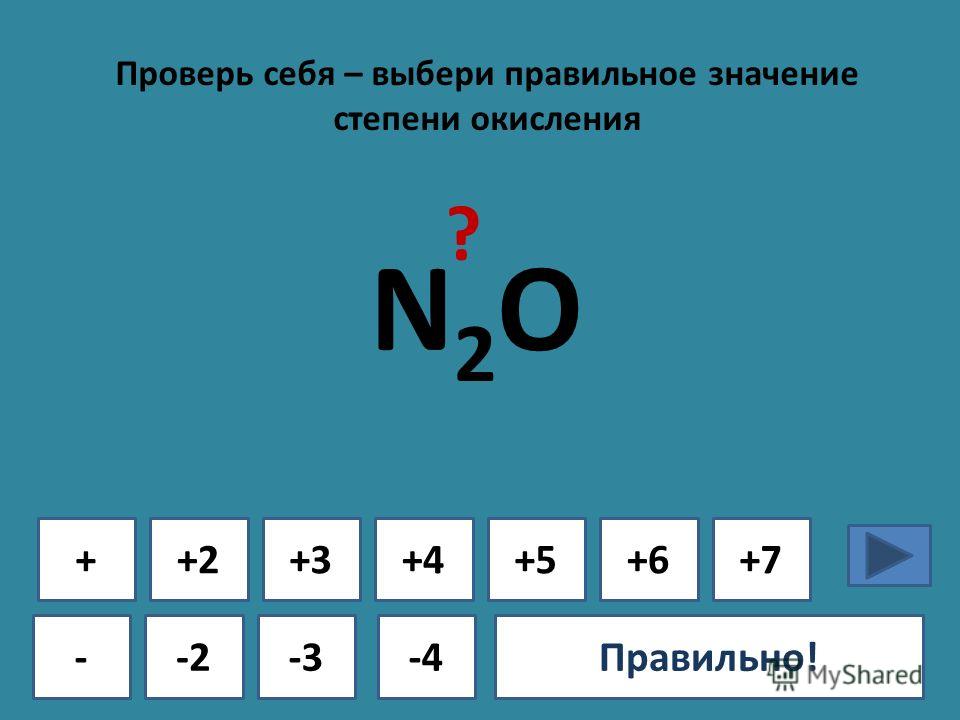
Расставьте степень окисления элементов в соединениях. K2SO4 + BaCl2 → BaSO4 + KCl
HCl + Al → AlCl3 + h3
Чем отличаются реакции?
K2SO4 + BaCl2 → BaSO4 + KCl
HCl + Al → AlCl3 + h3
Чем отличаются реакции?
Чем отличаются реакции? K2SO4 + BaCl2 → BaSO4 + KCl +1 +6 -2 +2 -1 +2 +6 -2 +1 -1 HCl + Al → AlCl3 + h3 +1 -1 +3 -1 0 0
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) – реакции, протекающие с изменением степени окисления. ОВР – реакции, в результате которых происходят два взаимопротивоположных процесса: отдачи электронов (окисления) и их принятия (восстановления). Окислитель – вещество, содержащее атомы или ионы, принимающие электроны. Восстановитель – вещество, содержащее атомы или ионы, отдающие электроны.
Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается.
Восстановление – процесс приема электронов атомом, молекулой или ионом, степень окисления элемента понижается. Часто используются условные обозначения:
ок-ль – окислитель,
восст-ль – восстановитель,
ок-е – окисление,
восст-е – восстановление.
Часто используются условные обозначения:
ок-ль – окислитель,
восст-ль – восстановитель,
ок-е – окисление,
восст-е – восстановление.
Расстановка коэффициентов с использованием метода электронного баланса.
1. Расставить степени окисления элементов в веществах.
HCl + Al → AlCl3 + h3
+1 -1
+3 -1
0
0
2. Подчеркнуть элементы, меняющие свою степень окисления.
HCl + Al → AlCl3 + h3
+1 -1
+3 -1
0
0
3. Выписать элементы, меняющие степень окисления, количество отданных и принятых электронов.
2H + 2 ē → h3
+1
0
Al — 3 ē → Al
0
+3
Окислитель
Восстановитель
Окисление
Восстановление
4. Составить баланс электронов, указать восстановитель, окислитель, процессы окисления и восстановления.
2H + 2 ē → h3
+1
0
Al — 3 ē → Al
0
+3
2
3
6
3
2
5. Расставить коэффициенты, сначала полученные, затем методом подбора.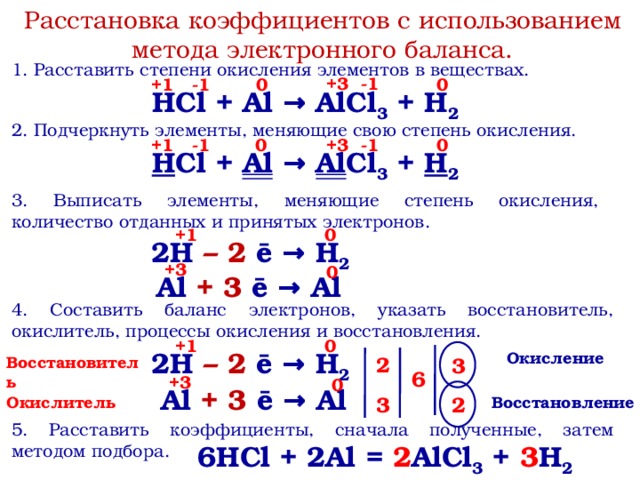
Расставить коэффициентов, используя метод электронного баланса: 1) Al + CuO Cu + Al2O3 2) Nh4 + O2 NO + h3O 3) MnO2 + HCl MnCl2 + Cl2 + h3O 4) HNO3 + Cu Cu(NO3)2 + NO + h3O
Презентация — Степень окисления (21 слайд)
Слайд 1
Слайд 2
Разделите вещества на группы
AlCl3, O2, Al, SO3, Na, HCl, Cl2, Na2S
Слайд 3
Классификация веществ в зависимости от типа химической связи
Ионная AlCl3, Na2S
Ковалентная полярная SO3, HCl
Ковалентная неполярная O2, Cl2
Металлическая Al, Na
Слайд 4
Степень окисления
это заряд,
который может возникнуть у атома
в соединении,
если представить, что
связь в этом соединении
ионная
Слайд 5
Правила определения cтепени окисления
Слайд 6
1. У свободных атомов и у атомов в составе простых веществ СО равна 0.
Na2O, h3, Ba, h3SO4, N2, S, h3O, Al, Cu, HNO3, F2, CaO
Слайд 7
2. Металлы во всех соединениях имеют положительную СО, её максимальное значение равно номеру группы: А) у металлов главной подгруппы I группы +1 Б) у металлов главной подгруппы II группы +2 В) у металлов главной подгруппы III группы +3
Na, K2O, Fe, CaCO3, CrO3, AlCl3, Li3N, BaSO4, Zn, Mg(NO3)2, Mn2O7
Слайд 8
K2O Li3N
CaCO3 BaSO4 Mg(NO3)2
AlCl3
Слайд 9
3. Неметаллы в соединениях имеют положительную и отрицательную степень окисления. Её максимальное значение равно номеру группы, а минимальное можно рассчитать по формуле СО = № группы — 8
SO3, h3S, Nh4, N2O5, HCl, Cl2O7
Слайд 10
4. В соединениях кислород имеет СО -2 (исключения OF2 и пероксиды Н2О2, К2О2)
h3CO3, O3, OF2, CuSO4, NaOH, O2, SO3
Слайд 11
5. У водорода в соединениях с неметаллами СО +1, с металлами -1
HCl, KH, h3, KOH, Bah3, h3O, h3SO4, Nh4
Слайд 12
6. В соединениях сумма степеней окисления всех атомов равна 0.
В соединениях сумма степеней окисления всех атомов равна 0.
Слайд 13
Группа 1
N2+1O-2, N-3 h4+1,
N2+5O5-2, Fe2+3O3-2,
Al2+3S3-2
Слайд 14
Группа 2
Na2+1S-2, Na3+1N-3,
S+4O2-2, S+6O3-2,
h3+1S-2
Слайд 15
Группа 3
Mg+2S-2, Mg3+2N2-3,
P2+5O5-2, P-3h4+1,
P2+3O3-2
Слайд 16
Группа 4
Ca3+2N2-3, Ca+2Cl2-1,
Cl2+3O3-2, H+1Cl-1,
Cl2+7O7-2
Слайд 17
Запишем значение постоянной степени окисления.
Умножим значение постоянной степени окисления на число атомов элемента.
Полученное число разделим на число атомов второго элемента.
Полученное число – значение степени окисления второго элемента.
Необходимо помнить, что сумма степеней окисления элементов в соединении равна 0.
Алгоритм определения cтепени окисления
Слайд 18
Составим уравнение. Для этого
определим значение постоянной степени окисления и умножим его на число атомов элемента;
неизвестную степень окисления обозначим Х и умножим на число атомов элемента;
сложим полученные произведения;
их сумма равна 0, так как сумма степеней окисления элементов в соединении равна 0.
Алгоритм определения cтепени окисления
Слайд 19
На уроке я узнал ….
На уроке я научился …
Сегодня мне удалось…
При подготовке домашнего задания мне надо обратить внимание на ….
Я хочу узнать …
Слайд 20
Степень окисления. Определение степени окисления по формуле вещества.
Слайд 21
Домашнее задание
1. Прочитайте текст §18 с. 100 – 104
2. Выучите определение и правила.
3. Выполните задания 5, 7 на с. 106
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Fe | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите количество протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Ру | ||
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Кр | ||
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| Найдите массу 1 моля | О | ||
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите количество протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите количество протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Fe | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
WebElements Periodic Table » Барий » сульфат бария
- Формула: BaSO 4
- Формула системы Хилла: Ba 1 O 4 S 1
- Регистрационный номер CAS: [7727-43-7]
- Вес формулы: 233,391
- Класс: сульфат
- Цвет: белый
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 1580°C
- Температура кипения: разлагается при > 1600
- Плотность: 4500 кг·м -3
Ниже приведены некоторые синонимы сульфата бария :
- сульфат бария
- бария(II) сульфат
- барит
- сульфат бария
- бария(II) сульфат
Степень окисления бария в сульфате бария составляет 2 .
Синтез
Недоступно
Элементный анализ
В таблице показано процентное содержание элементов для BaSO 4 (сульфат бария).
| Элемент | % |
|---|---|
| Ба | 58,84 |
| О | 27,42 |
| С | 13,74 |
Изотопная схема BaSO
4На приведенной ниже диаграмме показана рассчитанная изотопная картина для формулы BaSO 4 с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из первичной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Рейнхольд, Нью-Йорк, США, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.

- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , Джон Вили и сыновья, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Wyckoff, in Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (редактор) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лид, (редактор) в справочнике по химии и физике Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.
- Дж.В. Меллор в г. Всеобъемлющий трактат по неорганической и теоретической химии , тома 1–16, Longmans, Лондон, Великобритания, 1922–1937 гг.