СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
20.10.2022
УрКОП: шаг вперёд сделан!
Учащийся СУНЦ в составе команды стал победителем командной олимпиады по программированию.
19.10.2022
«Любите общагу!»
Лицеисты, живущие в интернате, поздравили воспитателей.
14.10.2022
СУНЦ как кузница ученых будущего
Лицеист СУНЦ стал победителем международного конкурса в номинации «Математика».
07.10.2022
Все учителя СУНЦ — бриллианты!
Под этим девизом пятого октября в СУНЦ прошел концерт в честь Дня учителя.
29.09.2022
Лицеисты СУНЦ покорили хребет Зюраткуль!
В последние выходные сентября учащиеся СУНЦ побывали в национальном парке «Зюраткуль».
22.09.2022
Наградили достойных!
Обучающимся СУНЦ и их педагогам вручены премии губернатора Свердловской области.
Больше новостей
Видеогалерея:
Концерт к Дню учителя (2022)
Репортаж ТРК «Вести-Урал» о гаджетах у школьника (2022)
Концерт, посвященный Дню Победы (5 мая 2022 года)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б. Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9 и 10 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул.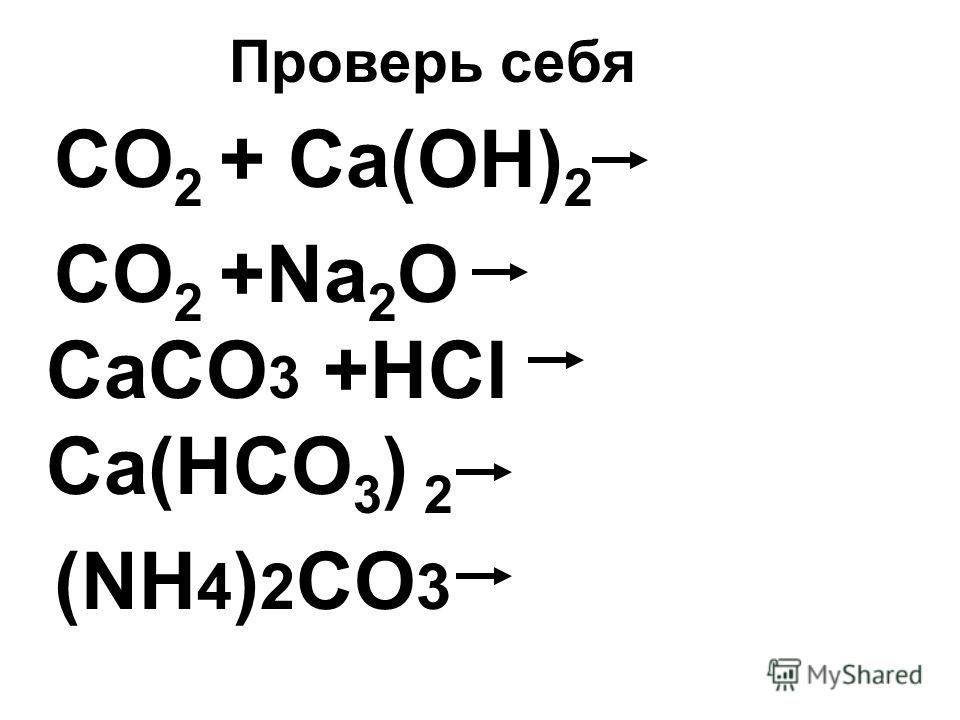 , 30, Екатеринбург. N56°52´4˝ E60°39´16˝
, 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 12, 19 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
Ca(OH)2+Co2 → CaCO3+ HNO3→ (No3)2 составить уравнени… -reshimne.ru
Новые вопросы
Ответы
Ca(OH)2+ CO2 -> CaCO3(осадок — стрелка вниз) +h3O
CaCO3 + 2HNO3 -> Ca(NO3)2 + CO2 + h3O
Как я понял, в конце получается Ca(NO3)2, а не (No3)2.
Недописал, наверное.
Похожие вопросы
Вычислите объем воздуха для сжигания 32 г алюминия массовая доля кислорода в воздухе 21%.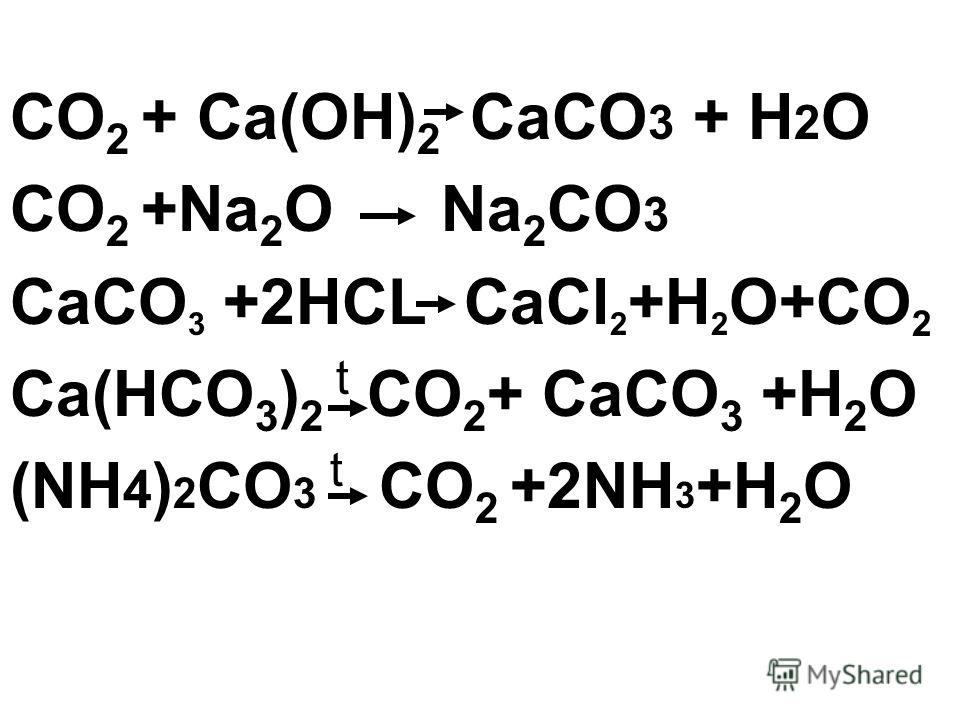 ..
..
KOH+CaSO4
LiCO3+ MgNO3…
Как мужик работая на золотом цехе, крал от туда золото, в течении нескольких месяцев, а потом его заполили, как? Как он это делал?!…
Помогите прошу рабочая тетрадка по химии 8 класса 7 и 8 номер помогите срочно…
KOH+CaSO4
LiCO3+ MgNO3
Ионные уравнения…
В результате взаимодействия 120 г 6% раствора соли сульфата меди с едким натром выпал осадок. вычислете массу этого осадка…
Математика
Литература
Алгебра
Русский языкГеометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
Психология
Реакция диоксида углерода с известковой водой
В этой статье мы подробно обсудим и ответим на все вопросы, связанные с реакцией оксида меди и серной кислоты. Но прежде чем перейти к вопросам и соответствующим ответам на них, сначала позвольте познакомить вас с серной кислотой и оксидом меди. Серная кислота — сильная кислота, образующаяся при окислении растворов диоксида серы. Формула серной кислоты. Эта кислота в больших количествах используется в промышленности и лабораториях в качестве реагента. Концентрированная форма серной кислоты является плотной, маслянистой и коррозионно-активной. Другой сложный оксид меди представляет собой соединение, которое образуется, когда два элемента, медь и кислород, реагируют друг с другом. Его формула CuO.
Но прежде чем перейти к вопросам и соответствующим ответам на них, сначала позвольте познакомить вас с серной кислотой и оксидом меди. Серная кислота — сильная кислота, образующаяся при окислении растворов диоксида серы. Формула серной кислоты. Эта кислота в больших количествах используется в промышленности и лабораториях в качестве реагента. Концентрированная форма серной кислоты является плотной, маслянистой и коррозионно-активной. Другой сложный оксид меди представляет собой соединение, которое образуется, когда два элемента, медь и кислород, реагируют друг с другом. Его формула CuO.
Реакция оксида меди с серной кислотой
Смешивание оксида меди и серной кислоты представляет собой эксперимент, включающий нерастворимый оксид металла , который реагирует с разбавленной кислотой с образованием растворимой соли . Оксид меди (II) представляет собой черное твердое вещество, которое при реакции с серной кислотой образует химическое вещество голубовато-голубого цвета, называемое сульфатом меди II. Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Написание уравнения оксида меди + серная кислота
Эту химическую реакцию можно записать следующим образом: ) Чтобы узнать, как сделать сульфат меди в домашних условиях, ознакомьтесь с этой статьей.
Что происходит, когда медь реагирует с концентрированной серной кислотой?
Восстановительный потенциал разбавленной серной кислоты выше, чем у водорода. Медь не способна вытеснять водород из неокисляющих кислот, например соляной или разбавленной серной кислоты. Другими словами, можно сказать, что медь не реагирует с разбавленной серной кислотой. Однако он реагирует с концентрированной серной кислотой, потому что серная кислота в концентрированной форме является окислителем. При нагревании меди с концентрированной серной кислотой происходит окислительно-восстановительная реакция, и кислота превращается в диоксид серы. Уравнение этой химической реакции приведено ниже:
Уравнение этой химической реакции приведено ниже:
Какое сбалансированное уравнение для оксида меди и серной кислоты?
Балансное уравнение оксида меди и серной кислоты приведено ниже:
Почему оксид меди и серная кислота окрашиваются в синий цвет?
Все мы знаем, что реакция оксида меди + серная кислота приводит к химическому веществу синего цвета. Но задумывались ли вы когда-нибудь, почему реакция оксида меди с серной кислотой приводит к химическому веществу синего цвета? Что ж, мы подробно ответим на этот вопрос здесь. Оксид меди представляет собой твердое вещество черного цвета. Когда он реагирует с серной кислотой, он производит химическое вещество голубовато-синего цвета, известное как сульфат меди. Синий цвет обусловлен образованием растворимой соли. Ионы меди и сульфата диссоциируют, когда сульфат меди растворяется в воде. Хотя эффект не меняется, однако природа расщепления между t2g и eg-орбиталями в этом новом комплексе такова, что он поглощает красновато-оранжевый свет. Из-за этого поглощения вы увидите раствор голубоватого цвета.
Из-за этого поглощения вы увидите раствор голубоватого цвета.
Растворяет ли серная кислота медь?
Нет, серная кислота не может растворить медь. Однако, если наблюдается растворение, это может быть вызвано одной из следующих двух причин:
- Существует вероятность того, что поверхность порошка металлической меди частично окислена до . Серная кислота может растворить окисленную поверхность меди
- Образование вихря при перемешивании. Небольшое количество воздуха (кислорода), введенное в выщелачивающий раствор, действовало как окислитель.
Какая соль образуется при взаимодействии оксида меди с соляной кислотой?
Реакция меди и соляной кислоты невозможна. Однако оксид меди может реагировать с этой кислотой. Когда металл реагирует с кислотой, происходит окислительно-восстановительная реакция. Из-за более высокого восстановительного потенциала меди по сравнению с водородом она не может реагировать с неокисляющими кислотами, такими как серная кислота и соляная кислота.
Но оксид меди — это не металл, а оксид металла. Оксиды металлов являются основными веществами, которые могут реагировать с кислотами с образованием соли и воды. Эти кислотно-щелочные реакции также известны как нейтрализация и не являются окислительно-восстановительными по своей природе.
Будучи слабым основанием, оксид меди легко реагирует с HCl с образованием растворимого хлорида меди и воды. Уравнение этой химической реакции приведено ниже:
Каково уравнение Ca OH 2 CO2? – Gzipwtf.com
Каково уравнение Ca OH 2 CO2?
Это кислотно-щелочная реакция (нейтрализация): Ca(OH) 2 является основанием, CO 2 является кислотой. ; Белый порошок без запаха. [Примечание: легко поглощает CO2 из воздуха с образованием карбоната кальция.]…
| 1 | CO2 + Ca(OH)2 → h3O + CaCO3 |
|---|---|
| 2 | CO2 + Ca(OH)2 → Ca(HCO3)2 |
| 3 | CO2 + Ca(OH)2 → Ca(OH)(HCO3) |
| 4 | CO2 + Ca(OH)2 → CaCO3CO2h3O |
Что является продуктом Ca OH 2 CO2?
Двуокись углерода реагирует с гидроксидом кальция с образованием карбоната кальция и воды. Ca(OH)2 + CO2 → CaCO3 + h3O Эта реакция известна как .
Ca(OH)2 + CO2 → CaCO3 + h3O Эта реакция известна как .
Реагирует ли Ca OH 2 с CO2?
Двуокись углерода вступает в реакцию с известковой водой (раствор гидроксида кальция, Ca(OH) 2) с образованием белого осадка (выглядящего как молочный) карбоната кальция, CaCO 3. Добавление большего количества двуокиси углерода приводит к растворению осадка с образованием бесцветный раствор гидрокарбоната кальция.
Как еще называется Ca Oh 2?
гашеная известь
соединения кальция Гидроксид кальция, также называемый гашеной известью, Ca(OH)2, получают действием воды на оксид кальция. При смешивании с водой небольшая часть его растворяется, образуя раствор, известный как известковая вода, а остальная часть остается в виде суспензии, называемой известковым молоком.
Что такое CA CO2?
н. (Элементы и соединения) белая кристаллическая соль, встречающаяся в известняке, меле, мраморе, кальците, коралле и жемчуге: используется в производстве извести и цемента. Формула: CaCO3.
Формула: CaCO3.
Как сбалансировать CA HCO3 2?
Ca(HCO3)2 → CaCO3 + CO2 + h3O – Сбалансированное уравнение | Химические уравнения онлайн!
Является ли caoh3 CO2 экзотермическим?
Реакция носит экзотермический характер.
Как называется CO?
Монооксид углерода
Монооксид углерода/IUPAC ID
Как называется соединение с формулой CA CN 2?
Цианамид кальция
Цианамид кальция представляет собой неорганическое соединение с формулой CaCN2. Это кальциевая соль аниона цианамида (CN2−2). Это химическое вещество используется в качестве удобрения и известно как нитролим. Впервые он был синтезирован в 1898 году Адольфом Франком и Никодемом Каро (процесс Франка-Каро).
CaOh 2 водный или твердый?
Гидроксид кальция, обычно называемый гашеной известью, имеет химическую формулу Ca(OH)2. Это неорганическое соединение, имеющее белый порошкообразный вид в твердом состоянии.
Как называется соединение с формулой Ca OH?
Гидроксид кальция. Гидроксид кальция (традиционно называемый гашеной известью) представляет собой неорганическое соединение с химической формулой Ca (OH) 2. Это бесцветный кристалл или белый порошок, который получают при смешивании или гашении оксида кальция (называемого известью или негашеной известью) с водой. У него много названий, в том числе гашеная известь, каустическая известь,…
Каково химическое название гидроксида кальция?
Гидроксид кальция, обычно называемый гашеной известью, имеет химическую формулу Ca(OH) 2 . Это неорганическое соединение, имеющее белый порошкообразный вид в твердом состоянии. Однако Ca(OH) 2 в кристаллической форме имеет бесцветный вид. Альтернативные названия этого соединения включают гашеную известь, гашеную известь, травление.
Какова формула гашеной извести с гидроксидом кальция?
Гидроксид кальция – Ca(OH)2. Гидроксид кальция, обычно называемый гашеной известью, имеет химическую формулу Ca(OH) 2 .
