что, как сбалансировать и часто задаваемые вопросы —
Гидроксид кальция обладает основным свойством и может легко реагировать с сильной кислотой, такой как соляная кислота. Давайте посмотрим на химическое поведение реакции между HCl и CaOCl.2.
Водный раствор хлористого водорода представляет собой соляную кислоту. (HCl),, часто называемая соляной кислотой. Соляная кислота хорошо растворяется в воде. Гидроксид кальция (Са (ОН)2) представляет собой белое твердое вещество при комнатной температуре, слабо растворимое в воде. Когда Са(ОН)2 и HCl реагируют, происходит реакция слабое основание-сильная кислота.
В этой статье мы подробно обсудим некоторые свойства этой реакции, такие как ее продукт, тип реакции, энтальпия и межмолекулярные силы.
Что является продуктом HCL и CA(OH)2?
Когда гидроксид кальция Ca(OH)2 и соляной кислоты (HCl), хлорид кальция (CaCl2) и производится вода ( H2О), при протекании реакции образуется бесцветный раствор после растворения белого осадка.
Са (ОН)2 (т) + 2HCl (водн.) → CaCl2 (водн.) + 2H2О (л)
Какой тип реакции представляет собой HCL + CA(OH)2?
Реакция соляной кислоты (HCl) и гидроксида кальция Ca(OH)2 есть кислотно-щелочная реакция. Ее также можно отнести к категории реакций нейтрализации, поскольку кислота и щелочь прореагировали из соли и воды.
Как сбалансировать HCL + CA(OH)2?
Шаг 1: Написание общего уравненияОбщее уравнение Ca (OH)2 (т) + HCl (водн.) → CaCl2 (вод) + H2О (л)
Шаг 2
: Установление сходства между реагентом и продуктомВ реакции количество молей реагента должно быть равно количеству молей продукта и реакция имеет сбалансированные моли.
Так как в продукте 2 моля атома Cl. Добавляют 2 моля HCl. Со стороны реагента 2 моля кислорода. Таким образом, 2 моля H2О добавляют на стороне продукта.
Таким образом, 2 моля H2О добавляют на стороне продукта.
Шаг 3
: Написание сбалансированного уравненияПосле добавления необходимого количества молей со стороны реагента и продукта общая сбалансированная реакция определяется выражением:
Са (ОН)2 (т) + 2HCl (водн.) → CaCl2 (вод) + H2О (л)
HCL + CA(OH)2 титрование
An кислотно-основное титрование между гидроксидом кальция и соляной кислотой можно измерить количество кальция. Используются различные условия и аппаратура, которые поясняются ниже.
Используемый аппарат
Бюретка, пипетка, коническая колба, держатель бюретки, промывная бутыль, капельница, мерная колба и химический стакан.
Титр и титрант
Соляная кислота используется в качестве титрованный раствор и заполнил бюретку. Химическое соединение анализируют с гидроксидом кальция, так как титр измеряют в конической колбе.
Индикаторные
фенолфталеин кислотно-щелочной индикатор, используемый для определения конечной точки титрования.
Процедура
- В бюретку отбирали стандартизированную HCl, а в коническую колбу отбирали данный гидроксид кальция.
- Добавляют 1-2 капли индикатора фенолфталеина.
- Медленно добавляли HCl из бюретки в коническую колбу при постоянном перемешивании до тех пор, пока раствор не становился бесцветным до светло-розового.
- Повторил процедуру, чтобы получить 3 конкордантных показания.
HCL + CA(OH)2 результирующее ионное уравнение
Поскольку реакция между гидроксидом кальция Ca(OH)2 и соляная кислота (HCl) является реакция нейтрализации, чистая ионная реакция следует за реакцией нейтрализации, которая выглядит следующим образом:
H+ (вод) + ОН– (водн.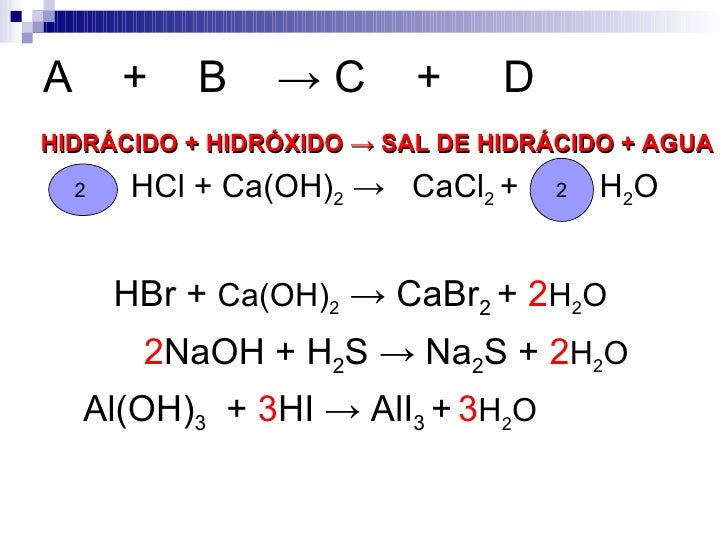 ) → H2О (л)
) → H2О (л)
Сопряженные пары HCL + CA(OH)2
Компания сопряженная пара Схема реакции между соляной кислотой и гидроксидом кальция выглядит следующим образом:
HCl + ОН– → Кл– + H2O
(кислота) (основание) (основание) (кислота)
В этой реакции HCl и Cl – представляют собой сопряженные кислотно-основные пары и ОН– и Н2O — еще одна сопряженная кислотно-основная пара.
Межмолекулярные силы HCL и CA(OH)2
- В HCl диполь-дипольные взаимодействия и межмолекулярные силы лондонской дисперсии представляют собой межмолекулярные силы, которые удерживают ионы водорода и хлорида вместе.
- Са (ОН)2 представляет собой ионное соединение с сильными силами электростатического притяжения между Ca2+ и ОН– ионов.
Энтальпия реакции HCL + CA(OH)2
Компания стандартная энтальпия реакции реакция между соляной кислотой и гидроксидом кальция отрицательная.
Является ли HCL + CA(OH)2 буферным раствором?
HCl + Са (ОН)2 пары растворенных веществ не образуют сильного буферный раствор так как HCl является сильной кислотой, а не слабой кислотой. Кислота должна быть слабой, поэтому добавление большего количества кислоты не приведет к существенному изменению pH.
Является ли HCL + CA(OH)2 полной реакцией?
Вышеупомянутая реакция является неполной, так как не происходит образования продукта. Мы можем определить, будет ли реакция завершена, только если мы увидим какой-либо продукт в правой части.
Является ли HCL + CA(OH)2 экзотермической или эндотермической реакцией?
Реакция между соляной кислотой и гидроксидом кальция экзотермический. Следовательно, это тепло будет движущей силой для завершения реакции.
Является ли HCL + CA(OH)2 окислительно-восстановительной реакцией?
HCl + Са (ОН)2 не окислительно-восстановительная реакция так как не изменяется степень окисления реагентов и продуктов.
Является ли HCL + CA(OH)2 реакцией осаждения?
HCl + Са (ОН)2 не является реакцией осаждения. HCl представляет собой водный раствор, тогда как Ca(OH)2 представляет собой белый осадок. При протекании реакции после растворения белого осадка образуется бесцветный раствор.
Является ли реакция HCL + CA(OH)2 обратимой или необратимой?
Реакция между гидроксидом кальция Ca(OH)2 а соляная кислота (HCl) необратима, потому что образующиеся продукты не реагируют вместе с реагентами реформинга.
Является ли реакция замещения HCL + CA(OH)2?
Вышеупомянутая реакция является реакцией двойного замещения, потому что катионы и анионы меняются местами, образуя воду и соль.
Заключение
В этой статье обобщена реакция HCl + Ca(OH)2 как разновидность кислотно-щелочной реакции нейтрализации.
3. 2 Опыт 2.
1.
Название эксперимента.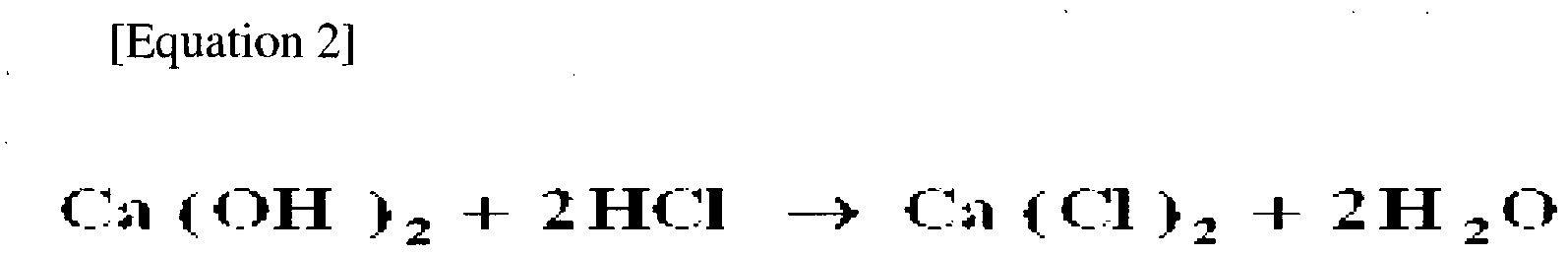
Получение оксида меди.
2. Ход эксперимента.
Кусочек медной пластины вносим в пламя горелки и нагреваем его.
3. Наблюдения.
Образуется черный налет.
4. Уравнение реакции.
2Cu + O2 = 2CuO
Cu0 – 2e = Cu+2 2 восстановитель
O20 + 4e = 2O-2 1 окислитель
5. Иллюстрационный материал
CuO
6. Вывод.
При нагревании кусочка медной пластины на ней образуется черный налет.
7. Ход эксперимента.
Нальем
в пробирку 3 капли разбавленной соляной
кислоты и опустим в нее прокаленный
кусочек меди.
8. Наблюдения.
Черный налет растворился, и раствор стал темно – зеленым.
9. Уравнение реакции.
CuO + 2HCl = CuCl2 + H2O
10. Иллюстрационный материал.
11. Вывод.
При взаимодействии оксида меди CuO с соляной кислотой HCl раствор зеленеет, получается раствор хлорида меди CuCl2. Так как оксид меди CuO растворяется в кислоте, то он является основным.
3. 3 Опыт 3.
1. Название эксперимента.
Получение оксида реакцией разложения.
2. Ход эксперимента.
Взять тигельными щипцами белый кусочек мела СaCO3 и прокалить его в пламени горелки
3. Наблюдения.
При
нагревании мел темнеет.
4. Уравнение реакции.
CaCO3 → CO2 + CaO
СаО
5. Иллюстрационный материал.
6. Вывод.
Мел СaCO3.при нагревании разлагается на оксид кальция СаО и углекислый газ СО2
7. Ход эксперимента.
Опускаем прокаленный мел (оксид кальция СаО) в пробирку с дистиллированной водой и добавляем фенолфталеин.
Раствор становится малиновым.
9. Уравнение реакции.
CaO + H2O = Ca(OH)2
10. Иллюстрационный материал.
11. Вывод.
В
результате проведенного эксперимента,
мы путем разложения мела СaCO3 получили оксид кальция и гидроксид
кальция Са(ОН)2,
на что указывает малиновый окрас
полученного раствора.
3. 4 Опыт 4.
1. Название эксперимента.
Получение гидроксида никеля.
2. Ход эксперимента.
Вносим 2 капли раствора сульфата никеля NiSO4 в 3 ячейки капельного планшета и добавляем в каждую ячейку по 2 капли раствора гидроксида натрия NaOH.
3. Наблюдения.
В ячейках образуется салатовый осадок гидроксида никеля Ni(OH)2 и раствор сульфата натрия Na2SO4.
4. Уравнение реакции.
NiSO4 + 2NaOH = Ni(OH)2 ↓ + Na2SO4
5. Иллюстрационный материал.
6.Вывод.
При взаимодействии солей никеля со щелочами образуется осадок гидроксида никеля.
7. Ход эксперимента.
Ход эксперимента.
Проверим растворимость гидроксида никеля в щелочи и кислоте. Для этого сначала добавим к гидроксиду никеля Ni(OH)2 избыток гидроксид натрия NaOH, а затем соляную кислоту HCl.
8. Наблюдения.
При добавлении щелочи NaOH осадок Ni(OH)2 не растворяется, но при добавлении кислоты HCl Ni(OH)2 растворяется полностью.
9. Уравнения реакций
Ni(OH)2 ↓ + NaOH = реакция не идет, осадок не растворяется
Ni(OH)2 ↓ + 2HCl = NiCl2 + 2H2O
10. Иллюстрационный материал.
11. Вывод.
Таким
образом, в результате опыта мы выяснили,
что гидроксид никеля Ni(OH)2 обладает
основными свойствами, так как он
растворяется в кислоте и не растворяется
в щелочи.
What, How to Balance & FAQs —
Манси Капур
Гидроксид кальция обладает основным свойством и может легко вступать в реакцию с сильной кислотой, такой как соляная кислота. Посмотрим на химическое поведение реакции между HCl и CaOCl 2 .
Водный раствор хлористого водорода представляет собой соляную кислоту (HCl) , часто называемую соляной кислотой. Соляная кислота хорошо растворима в воде. Гидроксид кальция ( Ca(OH) 2 ) представляет собой белое твердое вещество при комнатной температуре, которое лишь немного растворяется в воде. При взаимодействии Ca(OH) 2 и HCl происходит реакция слабое основание-сильная кислота.
В этой статье мы подробно обсудим некоторые свойства этой реакции, такие как ее продукт, тип реакции, энтальпия и межмолекулярные силы.
Что является продуктом HCL и CA(OH)2?
При объединении гидроксида кальция Ca(OH) 2 и соляной кислоты (HCl) образуется хлорид кальция (CaCl 2 ) и образуется вода (H 2 O), при протекании реакции образуется бесцветный раствор после растворения белого осадка.
Ca(OH) 2 (т)+ 2HCl (водн.) → CaCl 2 (водн.) + 2H 2 O (л)
Какой тип реакции представляет собой HCl + CAOH(a) 2 ?
Реакция между соляной кислотой (HCl) и гидроксидом кальция Ca(OH) 2 является кислотно-щелочной реакцией. Ее также можно отнести к категории реакций нейтрализации, поскольку кислота и щелочь прореагировали из соли и воды.
Как сбалансировать HCL + CA(OH)2 ?
Шаг 1: Написание общего уравненияОбщее уравнение Ca(OH) 2 (т)+ HCl (водн.) → CaCl 2 (водн.) + H 2 O (л)
Стадия 2
: Установление подобия между реагентом и продуктомВ реакции количество молей реагента должно быть равно количеству молей продукта , и реакция имеет сбалансированное количество молей.
Так как продукт имеет 2 моля атома Cl. Добавляют 2 моля HCl. Со стороны реагента 2 моля кислорода. Таким образом, со стороны продукта добавляют 2 моля H 2 O.
Добавляют 2 моля HCl. Со стороны реагента 2 моля кислорода. Таким образом, со стороны продукта добавляют 2 моля H 2 O.
Этап 3
: Написание сбалансированного уравнения )+ 2HCl (водн.) → CaCl 2 (водн.) + H 2 O (л)HCL + CA(OH)2 титрование
Кислотно-основное титрование между гидроксидом кальция и соляной кислотой может быть выполнено для измерения количества кальция. Используются различные условия и аппаратура, которые поясняются ниже.
Используемый аппарат
Бюретка, пипетка, коническая колба, держатель бюретки, промывочная бутыль, пипетка, мерная колба и химические стаканы.
Титр и титрант
Соляная кислота используется в качестве титранта и заполняется бюреткой. Химическое соединение анализируют с гидроксидом кальция, так как титр измеряют в конической колбе.
Индикатор
Фенолфталеин – кислотно-щелочной индикатор, используемый для определения конечной точки титрования.
Методика
- В бюретку отбирали стандартизированную HCl, в коническую колбу отбирали данный гидроксид кальция.
- Добавлено 1-2 капли индикатора фенолфталеина.
- Медленно добавляли HCl из бюретки в коническую колбу при постоянном взбалтывании до тех пор, пока раствор из бесцветного не становился светло-розовым.
- Повторил процедуру, чтобы получить 3 согласующихся показания.
HCL + CA(OH)2 суммарное ионное уравнение
Поскольку реакция между гидроксидом кальция Ca(OH) 2 и соляной кислотой (HCl) является реакцией нейтрализации, результирующая ионная реакция следует за реакцией нейтрализации, которая выглядит следующим образом:
H + (водн.) + OH – (водн.) → H 2 O (л)
Сопряженные пары HCL + CA(OH)2
2 9 Гидрохловая кислота и гидроксид кальция следующим образом:HCl + OH — → CL — + H 2 O
(кислота) (базовая база) (кислота)
999999999999999999999 (кислота) (базовая база) (кислота) 9000 000 000 000 000 000 99000 (кислота) (база) (кислотная В этой реакции HCl и Cl – представляют собой сопряженные кислотно-основные пары, а OH – и H 2 O представляют собой еще одну сопряженную кислотно-основную пару.
Межмолекулярные силы HCL и CA(OH)2
- В HCl диполь-дипольные взаимодействия и лондоновские дисперсионные межмолекулярные силы представляют собой межмолекулярные силы, которые удерживают ионы водорода и хлорида вместе.
- Ca(OH) 2 представляет собой ионное соединение с сильными силами электростатического притяжения между Ca 2+ и ионы ОН – .
Энтальпия реакции HCL + CA(OH)2
Стандартная энтальпия реакции между соляной кислотой и гидроксидом кальция отрицательна.
Диаграмма профиля энергии для экзотермической реакцииЯвляется ли HCL + CA(OH)2 буферным раствором?
HCl + Ca(OH) 2 пар растворенных веществ не образуют сильный буферный раствор, поскольку HCl является сильной, а не слабой кислотой. Кислота должна быть слабой, поэтому добавление большего количества кислоты не приведет к существенному изменению pH.
Является ли HCL + CA(OH)2 полной реакцией?
Вышеуказанная реакция является неполной, так как не происходит образования продукта. Мы можем определить, будет ли реакция завершена, только если мы увидим какой-либо продукт в правой части.
Является ли реакция HCL + CA(OH)2 экзотермической или эндотермической?
Реакция между соляной кислотой и гидроксидом кальция экзотермическая . Следовательно, это тепло будет движущей силой для завершения реакции.
Является ли HCL + CA(OH)2 окислительно-восстановительной реакцией?
HCl + Ca(OH) 2 не является окислительно-восстановительной реакцией, поскольку степень окисления реагентов и продуктов не изменяется.
Является ли HCL + CA(OH)2 реакцией осаждения?
HCl + Ca(OH) 2 не является реакцией осаждения. HCl представляет собой водный раствор, тогда как Ca(OH) 2 представляет собой белый осадок. При протекании реакции после растворения белого осадка образуется бесцветный раствор.
HCl представляет собой водный раствор, тогда как Ca(OH) 2 представляет собой белый осадок. При протекании реакции после растворения белого осадка образуется бесцветный раствор.
Является ли реакция HCL + CA(OH)2 обратимой или необратимой?
Реакция между гидроксидом кальция Ca(OH) 2 и соляной кислотой (HCl) является необратимой, поскольку образующиеся продукты не реагируют вместе с реагентами риформинга.
Является ли реакция замещения HCL + CA(OH)2?
Вышеупомянутая реакция является реакцией двойного замещения, потому что катионы и анионы меняются местами, образуя воду и соль.
Вывод
В этой статье описана реакция HCl + Ca(OH) 2 как тип реакции кислотно-щелочной нейтрализации.
Для химической реакции 2 HCl + Ca ( OH ) 2 ⟶ CaCl 2 + 2 H 2 O сколько молей хлорида кальция (CaCl2) образуется из 2,0 моль соляной кислоты (HCl)
Химия Венди М.
Подписаться І 2
Подробнее
Отчет
2 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Фрэнк А. ответил 17.03.20
Репетитор
5 (16)
Четверть века преподавания физики IB, GCSE, AP и фармацевтической математики.
Смотрите таких репетиторов
Смотрите таких репетиторов
Коэффициент представляет количество молей каждого ингредиента в химическом уравнении. Это число слева от ингредиента. В этом случае HCl имеет 2 слева, а CaCl 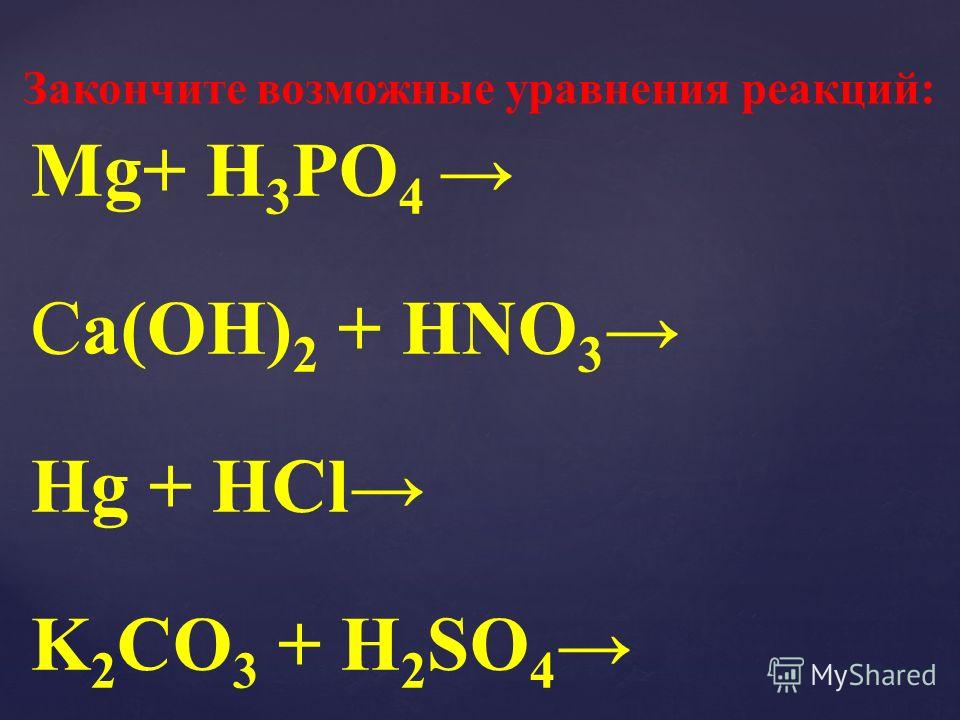
Надеюсь, это поможет.
г-н А
Голосовать за 0 Понизить голос
Подробнее
Отчет
Дж. Р. С. ответил 17.03.20
Репетитор
5,0 (140)
к.т.н. Профессор университета со стажем репетиторства более 10 лет
Об этом репетиторе ›
Об этом репетиторе ›
Чтобы решить эти типы задач, вам нужно посмотреть на сбалансированное уравнение и обратить внимание на МОЛЬНЫЕ ОТНОШЕНИЯ, то есть на стехиометрию.
2HCl + Ca(OH) 2 ==> CaCl 2 + 2H 2 O
Здесь молярное отношение HCl к CaCl 2 равно 2:1, или, другими словами, требуется ДВА молей HCl для получения ОДНОГО моля CaCl 2 .
