что, как сбалансировать и часто задаваемые вопросы —
Гидроксид кальция обладает основным свойством и может легко реагировать с сильной кислотой, такой как соляная кислота. Давайте посмотрим на химическое поведение реакции между HCl и CaOCl.2.
Водный раствор хлористого водорода представляет собой соляную кислоту. (HCl),, часто называемая соляной кислотой. Соляная кислота хорошо растворяется в воде. Гидроксид кальция (Са (ОН)2) представляет собой белое твердое вещество при комнатной температуре, слабо растворимое в воде. Когда Са(ОН)2 и HCl реагируют, происходит реакция слабое основание-сильная кислота.
В этой статье мы подробно обсудим некоторые свойства этой реакции, такие как ее продукт, тип реакции, энтальпия и межмолекулярные силы.
Что является продуктом HCL и CA(OH)2?
Когда гидроксид кальция Ca(OH)2 и соляной кислоты (HCl), хлорид кальция (CaCl2) и производится вода ( H2О), при протекании реакции образуется бесцветный раствор после растворения белого осадка.
Са (ОН)2 (т) + 2HCl (водн.) → CaCl2 (водн.) + 2H2О (л)
Какой тип реакции представляет собой HCL + CA(OH)2?
Реакция соляной кислоты (HCl) и гидроксида кальция Ca(OH)2 есть кислотно-щелочная реакция. Ее также можно отнести к категории реакций нейтрализации, поскольку кислота и щелочь прореагировали из соли и воды.
Как сбалансировать HCL + CA(OH)2?
Шаг 1: Написание общего уравненияОбщее уравнение Ca (OH)2 (т) + HCl (водн.) → CaCl2 (вод) + H2О (л)
Шаг 2
: Установление сходства между реагентом и продуктомВ реакции количество молей реагента должно быть равно количеству молей продукта и реакция имеет сбалансированные моли.
Так как в продукте 2 моля атома Cl. Добавляют 2 моля HCl. Со стороны реагента 2 моля кислорода. Таким образом, 2 моля H2О добавляют на стороне продукта.
Таким образом, 2 моля H2О добавляют на стороне продукта.
Шаг 3
: Написание сбалансированного уравненияПосле добавления необходимого количества молей со стороны реагента и продукта общая сбалансированная реакция определяется выражением:
Са (ОН)2 (т) + 2HCl (водн.) → CaCl2 (вод) + H2О (л)
HCL + CA(OH)2 титрование
An кислотно-основное титрование между гидроксидом кальция и соляной кислотой можно измерить количество кальция. Используются различные условия и аппаратура, которые поясняются ниже.
Используемый аппарат
Бюретка, пипетка, коническая колба, держатель бюретки, промывная бутыль, капельница, мерная колба и химический стакан.
Титр и титрант
Соляная кислота используется в качестве титрованный раствор и заполнил бюретку. Химическое соединение анализируют с гидроксидом кальция, так как титр измеряют в конической колбе.
Индикаторные
фенолфталеин кислотно-щелочной индикатор, используемый для определения конечной точки титрования.
Процедура
- В бюретку отбирали стандартизированную HCl, а в коническую колбу отбирали данный гидроксид кальция.
- Добавляют 1-2 капли индикатора фенолфталеина.
- Медленно добавляли HCl из бюретки в коническую колбу при постоянном перемешивании до тех пор, пока раствор не становился бесцветным до светло-розового.
- Повторил процедуру, чтобы получить 3 конкордантных показания.
HCL + CA(OH)2 результирующее ионное уравнение
Поскольку реакция между гидроксидом кальция Ca(OH)2 и соляная кислота (HCl) является реакция нейтрализации, чистая ионная реакция следует за реакцией нейтрализации, которая выглядит следующим образом:
H+ (вод) + ОН– (водн. ) → H2О (л)
) → H2О (л)
Сопряженные пары HCL + CA(OH)2
Компания сопряженная пара Схема реакции между соляной кислотой и гидроксидом кальция выглядит следующим образом:
HCl + ОН– → Кл– + H2O
(кислота) (основание) (основание) (кислота)
В этой реакции HCl и Cl – представляют собой сопряженные кислотно-основные пары и ОН– и Н2O — еще одна сопряженная кислотно-основная пара.
Межмолекулярные силы HCL и CA(OH)2
- В HCl диполь-дипольные взаимодействия и межмолекулярные силы лондонской дисперсии представляют собой межмолекулярные силы, которые удерживают ионы водорода и хлорида вместе.
- Са (ОН)2 представляет собой ионное соединение с сильными силами электростатического притяжения между Ca2+ и ОН– ионов.
Энтальпия реакции HCL + CA(OH)2
Компания стандартная энтальпия реакции реакция между соляной кислотой и гидроксидом кальция отрицательная.
Является ли HCL + CA(OH)2 буферным раствором?
HCl + Са (ОН)2 пары растворенных веществ не образуют сильного буферный раствор так как HCl является сильной кислотой, а не слабой кислотой. Кислота должна быть слабой, поэтому добавление большего количества кислоты не приведет к существенному изменению pH.
Является ли HCL + CA(OH)2 полной реакцией?
Вышеупомянутая реакция является неполной, так как не происходит образования продукта. Мы можем определить, будет ли реакция завершена, только если мы увидим какой-либо продукт в правой части.
Является ли HCL + CA(OH)2 экзотермической или эндотермической реакцией?
Реакция между соляной кислотой и гидроксидом кальция экзотермический. Следовательно, это тепло будет движущей силой для завершения реакции.
Является ли HCL + CA(OH)2 окислительно-восстановительной реакцией?
HCl + Са (ОН)2 не окислительно-восстановительная реакция так как не изменяется степень окисления реагентов и продуктов.
Является ли HCL + CA(OH)2 реакцией осаждения?
HCl + Са (ОН)2 не является реакцией осаждения. HCl представляет собой водный раствор, тогда как Ca(OH)2 представляет собой белый осадок. При протекании реакции после растворения белого осадка образуется бесцветный раствор.
Является ли реакция HCL + CA(OH)2 обратимой или необратимой?
Реакция между гидроксидом кальция Ca(OH)2 а соляная кислота (HCl) необратима, потому что образующиеся продукты не реагируют вместе с реагентами реформинга.
Является ли реакция замещения HCL + CA(OH)2?
Вышеупомянутая реакция является реакцией двойного замещения, потому что катионы и анионы меняются местами, образуя воду и соль.
Заключение
В этой статье обобщена реакция HCl + Ca(OH)2 как разновидность кислотно-щелочной реакции нейтрализации.
Составьте уравнения реакций между HCl, h3SO4, KOH, Ca(OH)2
Реакции нейтрализации не всегда протекают до конца, с образованием обычных солей. При недостатке кислоты (или избытке щелочи) могут образовываться кислые или основные соли. В начале рассмотрим простые примеры, какие и должны быть у вас в ответах. Далее идет продвинутый уровень.
При недостатке кислоты (или избытке щелочи) могут образовываться кислые или основные соли. В начале рассмотрим простые примеры, какие и должны быть у вас в ответах. Далее идет продвинутый уровень.
KOH + HCl = KCl + H2O
KCl – хлорид калия
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
CaCl2 – хлорид кальция
2KOH + H2SO4 = K2SO4 + 2H2O
K2SO4 – сульфат калия
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
CaSO4 – сульфат кальция
Более продвинутый уровень:
Ca(OH)2 + HCl = Ca(OH)Cl + H2O
Ca(OH)Cl – гидроксохлорид кальция
KOH + H2SO4 = KHSO4 + H2O
KHSO4 – гидросульфат калия
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
Ca(HSO4)2 – гидросульфат кальция
А вот получить гидроксосульфат кальция (CaOH)2SO4 напрямую не получится.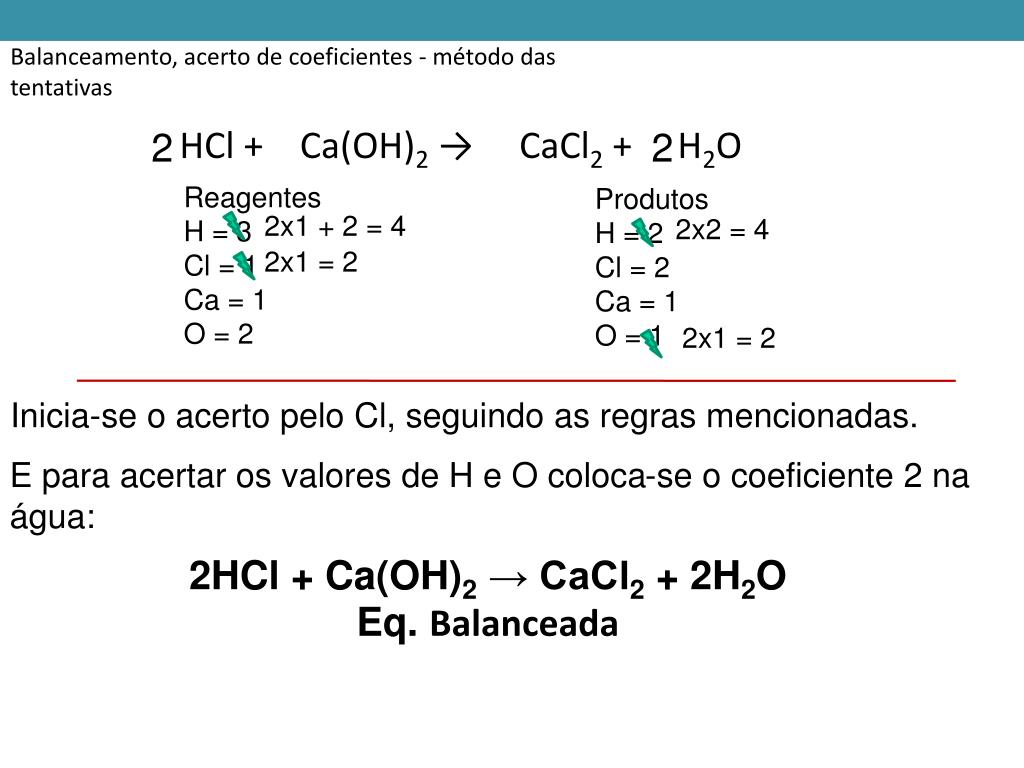 Его получают иным путём:
Его получают иным путём:
Ca(HSO4)2 + 3Ca(OH)2 = 2(CaOH)2SO4 + 2H2O
1. Приведите определение реакции нейтрализации. Объясните её суть своими словами.
2. В трёх пробирках находятся растворы веществ: CaCl2, HCl, Ca(OH)2. Как можно распознать данные растворы?
3. Запишите формулы двух веществ, которые можно использовать для нейтрализации гидроксида калия в водном растворе.
5. Составьте уравнения реакций, протекающих при нейтрализации хлороводородной кислотой основаниями, которым соответствуют оксиды BaO, K2O.
6. Кислотность среды в желудке человека обусловлена выработкой в нём хлороводородной (соляной) кислоты. Если её количество в желудке оказывается избыточным, наступает состояние повышенной кислотности желудочного сока. В результате этого могут появиться изжога, тошнота, боли, нарушение пищеварения. В таких случаях врачи часто рекомендуют использовать препарат «Алмагель», в состав которого входит гидроксид магния.
В таких случаях врачи часто рекомендуют использовать препарат «Алмагель», в состав которого входит гидроксид магния.
а) Составьте формулу гидроксида магния;
б) запишите уравнение реакции этого вещества с соляной кислотой;
в) назовите продукты реакции;
г) укажите тип данной реакции.
7. Гродненское производственное объединение ОАО «Гродно Азот» производит различные азотные удобрения. При этом используется азотная кислота HNO
Домашний эксперимент.
What, How to Balance & FAQs —
Манси Капур
Гидроксид кальция обладает основным свойством и может легко вступать в реакцию с сильной кислотой, такой как соляная кислота. Посмотрим на химическое поведение реакции между HCl и CaOCl 2 .
Посмотрим на химическое поведение реакции между HCl и CaOCl 2 .
Водный раствор хлористого водорода представляет собой соляную кислоту (HCl) , часто называемую соляной кислотой. Соляная кислота хорошо растворима в воде. Гидроксид кальция ( Ca(OH) 2 ) представляет собой белое твердое вещество при комнатной температуре, которое лишь немного растворяется в воде. При взаимодействии Ca(OH) 2 и HCl происходит реакция слабое основание-сильная кислота.
В этой статье мы подробно обсудим некоторые свойства этой реакции, такие как ее продукт, тип реакции, энтальпия и межмолекулярные силы.
Что является продуктом HCL и CA(OH)2?
При объединении гидроксида кальция Ca(OH) 2 и соляной кислоты (HCl) образуется хлорид кальция (CaCl 2 ) и образуется вода (H 2 O), при протекании реакции образуется бесцветный раствор после растворения белого осадка.
Ca(OH) 2 (т)+ 2HCl (водн.) → CaCl 2 (водн.) + 2H 2 O (л)
Какой тип реакции H КЛ + КА(ОН) 2 ?
Реакция между соляной кислотой (HCl) и гидроксидом кальция Ca(OH) 2 является кислотно-щелочной реакцией. Ее также можно отнести к категории реакций нейтрализации, поскольку кислота и щелочь прореагировали из соли и воды.
Как сбалансировать HCL + CA(OH)2 ?
Шаг 1: Написание общего уравненияОбщее уравнение Ca(OH) 2 (т)+ HCl (водн.) → CaCl 2 (водн.) + H 2 O ( л)
Стадия 2
: Установление подобия между реагентом и продуктомВ реакции количество молей реагента должно быть равно количеству молей продукта , и реакция имеет сбалансированное количество молей.
Так как продукт имеет 2 моля атома Cl. Добавляют 2 моля HCl. Со стороны реагента 2 моля кислорода. Таким образом, со стороны продукта добавляют 2 моля H 2 O.
Добавляют 2 моля HCl. Со стороны реагента 2 моля кислорода. Таким образом, со стороны продукта добавляют 2 моля H 2 O.
Этап 3
: Написание сбалансированного уравненияПосле добавления необходимого количества молей со стороны реагента и продукта общая сбалансированная реакция определяется как:
Ca(OH) 2 9000 6 (с )+ 2HCl (водн.) → CaCl 2 (водн.) + H 2 O (л)
HCL + CA(OH)2 титрование
Кислотно-основное титрование между гидроксидом кальция и соляной кислотой может быть выполнено для измерения количества кальция. Используются различные условия и аппаратура, которые поясняются ниже.
Используемый аппарат
Бюретка, пипетка, коническая колба, держатель бюретки, промывочная бутыль, пипетка, мерная колба и химические стаканы.
Титр и титрант
Соляная кислота используется в качестве титранта и заполняется бюреткой. Химическое соединение анализируют с гидроксидом кальция, так как титр измеряют в конической колбе.
Химическое соединение анализируют с гидроксидом кальция, так как титр измеряют в конической колбе.
Индикатор
Фенолфталеин – кислотно-щелочной индикатор, используемый для определения конечной точки титрования.
Методика
- В бюретку отбирали стандартизированную HCl, в коническую колбу отбирали данный гидроксид кальция.
- Добавлено 1-2 капли индикатора фенолфталеина.
- Медленно добавляли HCl из бюретки в коническую колбу при постоянном перемешивании до тех пор, пока раствор из бесцветного не становился светло-розовым.
- Повторил процедуру, чтобы получить 3 согласующихся показания.
HCL + CA(OH)2 суммарное ионное уравнение
Поскольку реакция между гидроксидом кальция Ca(OH) 2 и соляной кислотой (HCl) является реакцией нейтрализации, результирующая ионная реакция следует за реакцией нейтрализации, которая выглядит следующим образом:
H + (водн. ) + OH – (водн.) → H 2 O (л)
) + OH – (водн.) → H 2 O (л)
Сопряженные пары HCL + CA(OH)2
90 002 Сопряженная пара реакции между соляной кислоты и гидроксида кальция:HCl + OH – → Cl – + H 2 O
(кислота ) (Основной) (Основной) (Кислотный)
В этой реакции HCl и Cl – представляют собой сопряженные кислотно-основные пары, а OH – и H 2 O представляют собой еще одну сопряженную кислотно-основную пару.
Межмолекулярные силы HCL и CA(OH)2
- В HCl диполь-дипольные взаимодействия и лондоновские дисперсионные межмолекулярные силы представляют собой межмолекулярные силы, которые удерживают ионы водорода и хлорида вместе.
- Ca(OH) 2 представляет собой ионное соединение с сильными силами электростатического притяжения между Ca 2+ и ионы ОН – .

Энтальпия реакции HCL + CA(OH)2
Стандартная энтальпия реакции между соляной кислотой и гидроксидом кальция отрицательна.
Диаграмма профиля энергии для экзотермической реакцииЯвляется ли HCL + CA(OH)2 буферным раствором?
HCl + Ca(OH) 2 пар растворенных веществ не образуют сильный буферный раствор, поскольку HCl является сильной, а не слабой кислотой. Кислота должна быть слабой, поэтому добавление большего количества кислоты не приведет к существенному изменению pH.
Является ли HCL + CA(OH)2 полной реакцией?
Вышеуказанная реакция является неполной, так как не происходит образования продукта. Мы можем определить, будет ли реакция завершена, только если мы увидим какой-либо продукт в правой части.
Является ли реакция HCL + CA(OH)2 экзотермической или эндотермической?
Реакция между соляной кислотой и гидроксидом кальция экзотермическая . Следовательно, это тепло будет движущей силой для завершения реакции.
Следовательно, это тепло будет движущей силой для завершения реакции.
Является ли HCL + CA(OH)2 окислительно-восстановительной реакцией?
HCl + Ca(OH) 2 не является окислительно-восстановительной реакцией, поскольку степень окисления реагентов и продуктов не изменяется.
Является ли HCL + CA(OH)2 реакцией осаждения?
HCl + Ca(OH) 2 не является реакцией осаждения. HCl представляет собой водный раствор, тогда как Ca(OH) 2 представляет собой белый осадок. При протекании реакции после растворения белого осадка образуется бесцветный раствор.
Является ли реакция HCL + CA(OH)2 обратимой или необратимой?
Реакция между гидроксидом кальция Ca(OH) 2 и соляной кислотой (HCl) является необратимой, поскольку образующиеся продукты не реагируют вместе с реагентами риформинга.
Является ли реакция замещения HCL + CA(OH)2?
Вышеупомянутая реакция является реакцией двойного замещения, потому что катионы и анионы меняются местами, образуя воду и соль.
Вывод
В этой статье описана реакция HCl + Ca(OH) 2 как тип реакции кислотно-щелочной нейтрализации.
ChemTeam: Титрование до точки эквивалентности: Использование масс (задачи №1)
ChemTeam: Титрование до точки эквивалентности: Использование масс (задачи №1–10)Титрование до точки эквивалентности с использованием масс: определение неизвестной молярности при титровании сильной кислоты (основания) сильным основанием (кислотой)
Задачи №1 — 10
Десять примеров
Задачи №11-25
Вернуться в меню Acid Base
Задача №1: Сколько мл 1,80 М соляной кислоты требуется для полной реакции с 30,0 г гидроксида кальция?
Решение:
1) Моли Ca(OH) 2 :
30,0 г / 74,0918 г/моль = 0,4049031 моль
2) Химическое уравнение реакции:
2HCl + Ca(OH) 2 —> CaCl 2 + 2H 2 OМолярное соотношение между HCl и гидроксидом кальция составляет 2:1.
Два моля HCl расходуются на каждый моль прореагировавшего Ca(OH) 2 .
3) Моль использованной HCl:
0,4049031 моль умножить на 2 = 0,8098062 моль
4) Требуемый объем HCl:
молей = МВ0,8098062 моль = (1,80 моль/л) (x)
х = 0,449892 л
x = 450 мл (до трех знаков цифры, обратите внимание на явную десятичную точку)
Проблема №2: Сколько миллилитров 0,122 М HCl потребуется для титрования 6,45 г Ba(OH)
Решение:
1) Сбалансированное уравнение реакции:
2HCl(водн.) + Ba(OH) 2 (т) —> BaCl 2 (водн.) + 2H 2 O(л)
2) Моль Ba(OH) 2 :
6,45 г / 171,3438 г/моль = 0,0376436 моль
3) Существует молярное соотношение между HCl и Ba(OH) 2:1 2 . Следовательно:
(0,0376436 моль) (2) = 0,0752872 моль используемой HCl
4) Требуемый объем HCl:
0,0752872 моль / 0,122 моль/л = 0,617 л = 617 мл
Обратите внимание, что MV = масса/молярная масса не использовалась. MV = масса/молярная масса работает только при молярном соотношении 1:1.
MV = масса/молярная масса работает только при молярном соотношении 1:1.
Задача №3: Какова молярность вашего раствора HCl, если для достижения второй точки эквивалентности при титровании против 0,2225 г стандартного карбоната натрия требуется 35,25 мл?
Решение №1:
Достижение второй точки эквивалентности означает эту реакцию:2HCl(водн.) + Na 2 CO 3 (т) —> 2NaCl(водн.) + CO 2 (г) + H 2 O(ℓ)Это соотношение 2:1: два моля HCl необходимы для реакции с одним молем карбоната натрия.
0,2225 г / 105,988 г/моль = 0,0020993 моль Na
0,0041986 моль/0,03525 л = 0,1191 М
Решение №2:
Рассмотрим эту реакцию:HCl(водн.) + Na 2 CO 3 (т) —> NaHCO 3 (водн.) + NaCl(водн.)Это реакция для первой точки эквивалентности.
35,25 мл разделить на 2, чтобы получить первое экв. точка —>
17,625 мл0,2225 г / 105,988 г/моль = 0,0020993 моль карбоната натрия
HCl и Na 2 CO 3 реагируют в молярном соотношении 1:1 с образованием NaHCO 3
Потребовалось 0,0020993 моль HCl.
0,0020993 моль/0,017625 л = 0,1191 М
Задача №4: Сколько миллилитров 0,200 М HCl может вступить в реакцию с 6,25 г CaCO 3 ?
Решение:
CaCO 3 (т) + 2HCl(водн.) —> CaCl 2 (водн.) + CO 2 (г) + H 2 O(л)моль CaCO 3 —> 6,25 г / 100,086 г/моль = 0,0624463 моль
Согласно сбалансированному уравнению, на каждый моль CaCO требуется 2 моля HCl 3 .
моль HCl —> 0,0624463 моль умножить на 2 = 0,1248926 моль
Требуемый объем HCl —> 0,1248926 разделить на 0,200 моль/л = 0,624463 л
624 мл (до трех знаков инжира)
Задача № 5: Какова молярность серной кислоты, если для нейтрализации 0,455 г гидрокарбоната натрия требуется 43,90 мл H 2 SO 4 ?
Решение:
1) Реакция:
H 2 SO 4 (водн.) + 2NaHCO 3 (водн.) —> Na 2 SO 4 (водн.) + 2CO 2 9 0006 (г) + 2Н 2 О (ℓ)
Ключевым соотношением является то, что на каждые 2 моля NaHCO 3 требуется 1 моль серной кислоты.
2) Моли NaHCO 3 :
0,455 г / 84,0059 г/моль = 0,0054163 моль
3) Моли H 2 SO 4 требуется:
0,0054163 моль / 2 = 0,00270815 мольТо, что я разделил на два, вытекает из того, как была сформулирована задача. Обычно это формулируется так, чтобы произвести умножение на два. Не в этой проблеме.
4) Молярность:
0,00270815 моль/0,04390 л = 0,0617 М
Задача № 6: Какова молярность азотной кислоты, если для нейтрализации 0,555 г карбоната натрия требуется 42,60 мл HNO 3 ?
Решение:
1) Реакция:
2HNO 3 (водн.) + Na 2 CO 3 (водн.) —> 2NaNO 3 (водн.) + CO 2 + H 2 О(л)
Ключевое молярное соотношение заключается в том, что на каждый моль нейтрализуемого карбоната натрия требуется 2 моля азотной кислоты.
2) Моли Na 2 CO 3 :
0,555 г / 105,988 г/моль = 0,00523644 моль
3) Необходимые моли азотной кислоты:
(0,00523644 моль) (2) = 0,01047288 моль
4) Молярность:
0,01047288 моль/0,04260 л = 0,246 М
Задача №7: Какова молярность гидроксида натрия, если для нейтрализации 0,631 г щавелевой кислоты H 2 C 2 O 4 требуется 35,60 мл NaOH?
Решение №1:
1) Реакция:
H 2 C 2 O 4 (водн.) + 2NaOH (водн.) —> Na 2 C 2 O 4 (водн.) + 2H 2 O(ℓ)
Ключевым моментом является молярное соотношение между щавелевой кислотой и гидроксидом натрия 1:2.
2) Моль щавелевой кислоты:
0,631 г / 90,0338 г/моль = 0,0070085 моль
3) Требуемые моли NaOH:
(0,0070085 моль) (2) = 0,014017 моль
4) Молярность:
0,014017 моль/0,03560 л = 0,394 М
Решение №2:
Это решение основано на идее, что требуется половина объема раствора гидроксида натрия, чтобы достичь первая точка эквивалентности .
1) Реакция на первую точку эквивалентности:
H 2 C 2 O 4 (водн.) + NaOH (водн.) —> NaHC 2 O 4 (водн.) + H 2 О (ℓ)Основная идея заключается в том, что молярное соотношение между реагентами составляет один к одному.
2) Моль щавелевой кислоты:
0,631 г / 90,0338 г/моль = 0,0070085 моль
3) Требуемые моли NaOH:
0,0070085 моль (при соотношении 1:1)
4) Молярность:
0,0070085 моль/0,0178 л = 0,394 МОбратите внимание на использование объема, равного половине 35,60 мл.
Это потому, что мы титровали только до первой точки эквивалентности.
Задача №8: Какой объем 0,189 М гидроксида бария потребуется для нейтрализации 1,228 г гидрофталата калия KHC 8 H 4 O 4 (204,23 г/моль)?
Решение:
1) Реакция:
2KHC 8 H 4 O 4 (водн.) + Ba(OH) 2 (водн.) —> BaC 8 H 4 O 4 (с) + К 2 C 8 H 4 O 4 (водный) + 2H 2 O(ℓ)Ключевым соотношением является молярное соотношение 2:1 между KHP и гидроксидом бария.
2) моль КНР:
1,228 г / 204,23 г/моль = 0,006013 моль
3) моль гидроксида бария:
0,006013 моль/2 = 0,0030065 моль
4) требуемый объем:
0,189 моль/л = 0,0030065 моль/хx = 0,0159 л (или 15,9 мл)
Задача №9: Какой объем 0,765 M H 3 PO 4 требуется для точной нейтрализации 2,000 г гидроксида кальция?
Решение:
2,000 г / 74,0918 г/моль = 0,02699354 моль Ca(OH) 22H 3 PO 4 (водн.
) + 3Ca(OH) 2 (с) —> Ca 3 (ПО 4 ) 2 (с) + 6H 2 О(ℓ)
Два моля H 3 PO 4 требуется на каждые три моля Ca(OH) 2
2 к 3, как x к 0,02699354 моль
x = 0,01799569 моль H 3 PO 4 требуется
0,01799569 моль разделить на 0,765 моль/л = 0,0235 л = 23,5 мл
Задача №10: 2,61 М раствор фосфорной кислоты (H 3 PO 4 ) должен реагировать с гидроксидом алюминия с образованием фосфата алюминия и воды. Сколько мл раствора ортофосфорной кислоты потребуется для реакции с 26,7 г гидроксида алюминия?
Решение:
H 3 PO 4 (водн.) + Al(OH) 3 (т) —> AlPO 4 (т) + 3H 2 O(ℓ)Один моль H 3 PO 4 требуется на один моль Al(OH) 3
26,7 г / 78,00367 г/моль = 0,342292 моль Al(OH) 3
Благодаря молярному соотношению реагентов 1:1 прореагировало 0,342292 моль H 3 PO 4 .
0,342292 моль / 2,61 моль/л = 0,131 л = 131 мл (до трех цифр)
Бонусная задача №1: Искусственный фруктовый напиток содержит 12,00 г винной кислоты (двуосновная кислота), H 2 C 4 H 4 O 6 , для достижения t искусство. Его титруют основным раствором плотностью 1,045 г/см 9 .0161 3 и содержит 5000 массовых процентов КОН. Какой объем основного раствора требуется?
Решение:
1) Нам нужно знать моли кислоты:
12,00 г / 150,0854 г/моль = 0,0799545 моль
2) Кислота двухосновная, поэтому мы знаем, что нам нужно в два раза больше молей основания, чем молей кислоты. Вот химическое уравнение (H 2 T = винная кислота):
H 2 T + 2KOH —> K 2 T + 2H 2 О0,0799545 моль x 2 = необходимо 0,159909 моль КОН
3) Поскольку для концентрации раствора существует массовый процент, переведем в граммы КОН:
0,159909 моль умножить на 56,1049 г/моль = 8,97168 г
4) При какой массе 5% раствора получится 8,97168 г КОН?
8,97168 г / 0,05 = 179,4336 г
5) Каков объем 179,4336 г 5% раствора КОН?
179,4336 г / 1,045 г/см 3 = 171,7068 см 3Четыре значащих цифры дают 171,7 см 3 для ответа.
Бонусное задание №2: Студент хотел определить процентное содержание NaCl по массе в смеси (3000 г), содержащей NaCl и KHP. Ему дали немного раствора KOH неизвестной концентрации и немного 0,2470 M H 2 SO 4 . Что он должен сделать?
Обсуждение:
Для тех из вас, кто не знает, KHP означает гидрофталат калия, C 8 Н 5 КО 4 . Более полное название – 1,2-бензолдикарбоновая кислота, монокалиевая соль. Он широко используется в качестве основного стандарта в кислотно-щелочном мире, и широко используется KHP.На всякий случай убедитесь, что вы понимаете, что буква P означает фталат, а не фосфор.
Кроме того, 20,00 мл и 1,500 г были просто выбраны автором вопроса. zОн/она мог бы использовать любой набор цифр, который он/она пожелал
Решение:
1) Он оттитровал 20,00 мл H 2 SO 4 и обнаружил, что потребовалось 33,70 мл KOH. Рассчитайте молярность раствора КОН.
Рассчитайте молярность раствора КОН.
H 2 SO 4 + 2KOH —> K 2 SO 4 + 2H 2 Oммоль H 2 SO 4 —> (0,2470 ммоль/мл) ( 20,00 мл) = 4,94 ммоль
H 2 SO 4 и КОН реагируют в молярном соотношении 1:2
Израсходованоммоль КОН —> (4,940 ммоль) (2) = 9,880 ммоль
молярность раствора КОН —> 9,880 ммоль / 33,70 мл = 0,293175 М (сохранить некоторые защитные цифры)
2) Оттитровать 1,500 г смеси KOH, обнаружив, что для достижения конечной точки требуется 11,50 мл KOH. Определить массу вступившего в реакцию КГП.
KHP + KOH —> K 2 P +H 2 Oммоль KOH —> (0,293175 ммоль/мл) (11,50 мл) = 3,3715125 ммоль
КОН и КГП реагируют в молярном соотношении 1:1, поэтому израсходовано 3,3715125 ммоль КГП.
3,3715125 ммоль = 0,0033715125 моль
(204,2215 г/моль) (0,0033715125 моль) = 0,68853534 г
3) Определить массовую долю NaCl:
0,68853534 г / 1,500 г = 0,4590 (десятичные проценты КНР)1 — 0,4590 = 0,5410 (десятичные проценты NaCl)
NaCl 54,10%
Другим способом было бы сначала вычесть, чтобы получить массу NaCl.




 ) + 2NaHCO 3 (водн.) —> Na 2 SO 4 (водн.) + 2CO 2 9 0006 (г) + 2Н 2 О (ℓ)
) + 2NaHCO 3 (водн.) —> Na 2 SO 4 (водн.) + 2CO 2 9 0006 (г) + 2Н 2 О (ℓ) ) + Na 2 CO 3 (водн.) —> 2NaNO 3 (водн.) + CO 2 + H 2 О(л)
) + Na 2 CO 3 (водн.) —> 2NaNO 3 (водн.) + CO 2 + H 2 О(л)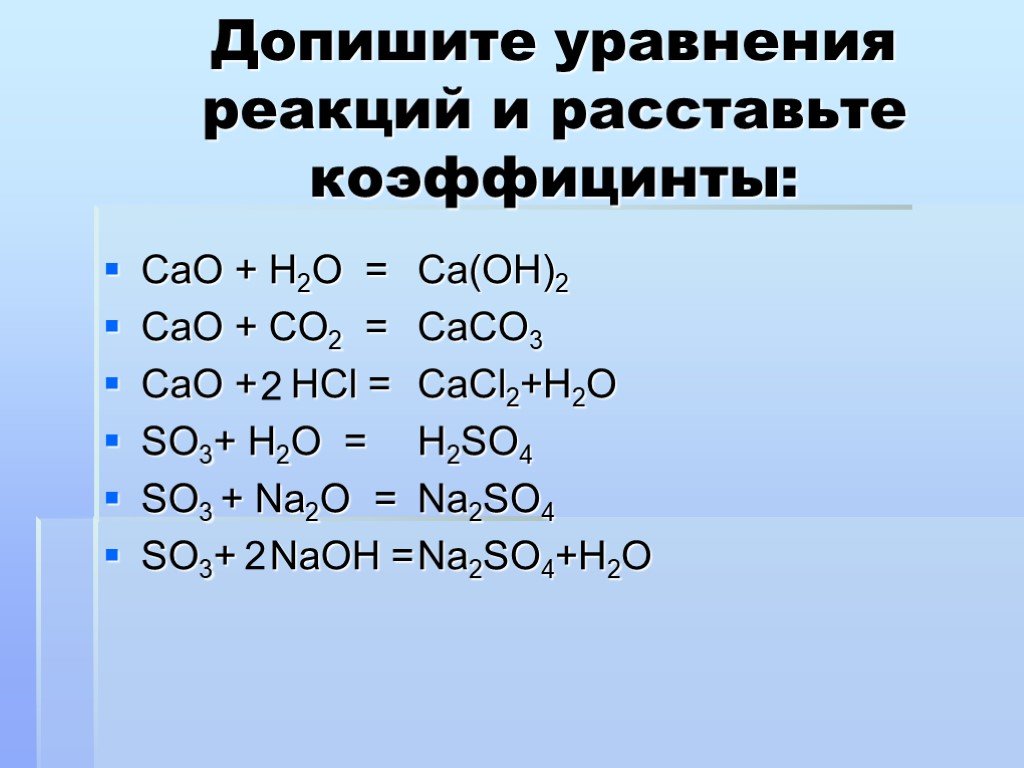 ) + 2H 2 O(ℓ)
) + 2H 2 O(ℓ) Это потому, что мы титровали только до первой точки эквивалентности.
Это потому, что мы титровали только до первой точки эквивалентности.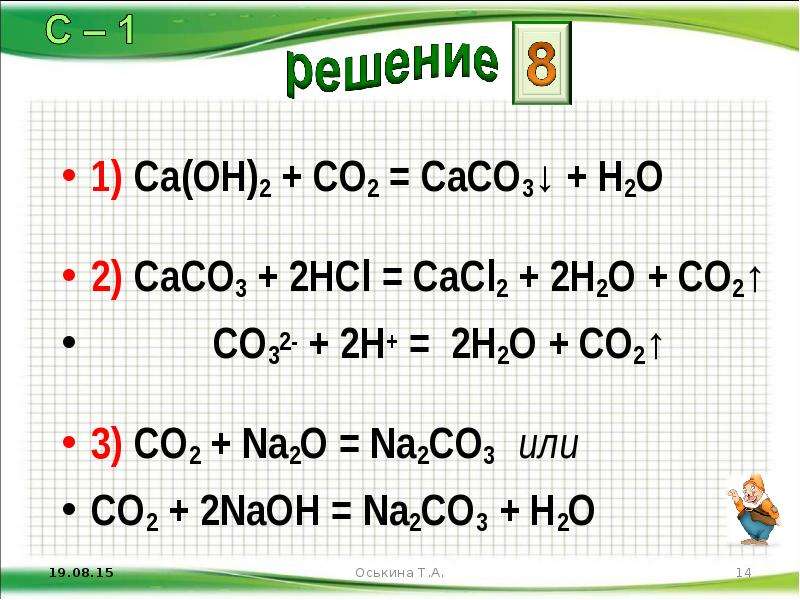 ) + 3Ca(OH) 2 (с) —> Ca 3 (ПО 4 ) 2 (с) + 6H 2 О(ℓ)
) + 3Ca(OH) 2 (с) —> Ca 3 (ПО 4 ) 2 (с) + 6H 2 О(ℓ)

