ФГБОУ ВО ПГФА Минздрава России
Пермская государственная
фармацевтическая академия
Для слабовидящих
Всероссийский тест на знание Конституции Российской Федерации, 12 декабря 2022 г.
Ежегодно 12 декабря проводится общенациональная Акция «Всероссийский тест на знание Конституции Российской Федерации». Акция нацелена на качественное повышение …
«Профессиональные планы», 1 декабря 2022 года
01 декабря 2022 года состоится мероприятие «Профессиональные планы». Собрание будет проходить в очном формате по адресу ул. Полевая, 2, ауд. 121. Начало в 16-…
еще …
Наши новости
ПГФА развивает международное сотрудничество
18 ноября 2022
Торжества к 85-летию Пермской государственной фармацевтической академии
15 ноября 2022
еще …
Наши события
Краевая студенческая олимпиада «Луч в науку»
22 ноября 2022
Презентация Клуба иностранных студентов ПГФА
14 ноября 2022
еще . ..
..
Конференции, олимпиады, форумы…
Пермская государственная фармацевтическая академия на VII Пермском инженерно-промышленном форуме
05 декабря 2022
Всероссийский междисциплинарный научный семинар «Высоко- и супрамолекулярные соединения: исследования, контроль, мониторинг»
05 декабря 2022
Краевая студенческая Олимпиада «Луч в науку»
02 декабря 2022
еще …
Новости спорта
Документальный фильм об истории Российского студенческого спортивного союза
29 ноября 2022
Второй тур Чемпионата Пермского края по мини-футболу среди мужских команд
26 ноября 2022
Стартовал Чемпионат Пермского края по мини-футболу
07 ноября 2022
еще . ..
..
Button
Ученый совет
Научный полк
Обращение советов ректоров вызов Пермского края
Мисс Фармация-2019
Галерея новостей
День открытых дверей
Информация об аккредитации специалистов
Видеообзор — введение в профессию
Ректор ПГФА Алексей Юрьевич Турышев рассказывает о перспективах специальности и приёме в 2019 году
В ПГФА имеется 200 бюджетных мест для абитуриентов. Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Смотреть все видеообзоры о професии
Условия проживания студентов в общежитии № 2 (более новое первое общежитие не показано).
 Съёмка 2016 года.
Съёмка 2016 года.Имеющиеся у ПГФА два общежития неизменно входят в десятку лучших общежитий образовательных учреждений города Перми. В общежитиях имеются столовая, кухни на каждом этаже, библиотека, спортзал, бытовая, душевая и постирочная комнаты (общежитие № 1 новее).
Первокурсники на лабораторных занятиях по физике в ПГФА. Съёмка 25 февраля 2019 года
На первом курсе студенты изучают биологию, физиологию, математику, физику, неорганическую химию, физическую химию, латинский язык, информатику, экономическую теорию, историю. Основной предмет — химия. За годы учёбы её будет 9 видов.
Впечатления первокурсника
после двух месяцев учёбы в 2018 году.
Ректор
Проректоры
Помощник ректора по воспитательной работе
Ученый совет
Административно — управленческие подразделения
Ведущий юрисконсульт
Учебные подразделения
Кафедры
Научные подразделения
Корпуса и общежития
Отдел качества
Региональный испытательный центр «Фарматест»
Полиграфический отдел
Стоматологическая клиника
Столовая
Здравпункт
Музей
Профком сотрудников
Профком студентов
Социально-психологическая служба
Лаборатория 10.
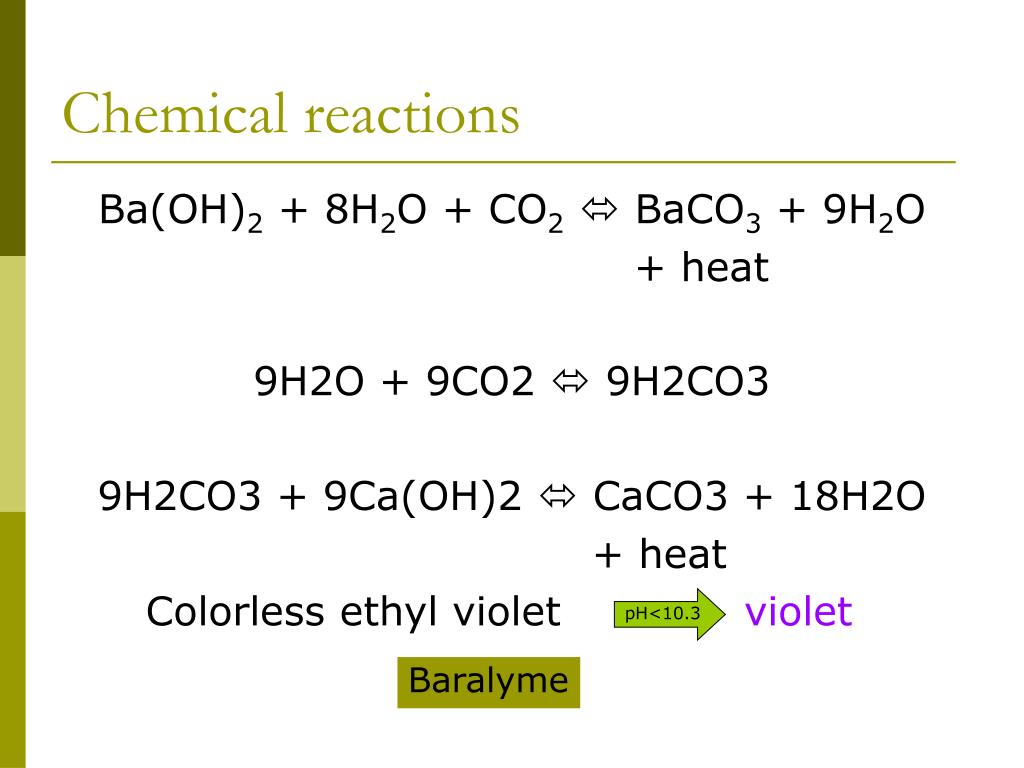
 Продукт растворимости гидроксида кальция
Продукт растворимости гидроксида кальцияЦель и обзор
Насыщенный раствор Ca(OH) 2 получают путем взаимодействия металлического кальция с водой с последующим фильтрованием твердых веществ.
( 1 )
Ca(s) + H 2 O → Ca(OH) 2 (s) Ca 2+ (водн.) + 2 OH − (водн.)
Концентрацию растворенного гидроксида определяют кислотно-основным титрованием стандартизированным раствором HCl.
K sp
для Ca(OH) 2
Цели и научные навыки
•
Качественно и количественно опишите равновесие малорастворимой соли Ca(OH) 2 в воде.•
Выполните объемное разведение и рассчитайте полученную молярность.
•
Выполните гравитационную фильтрацию насыщенного водного раствора Ca(OH) 2 и титруйте аликвоты кислотой.•
Обработайте уравнение K sp для Ca(OH) 2 и рассчитайте его значение по концентрации OH – в растворе, определенной по данным титрования.•
Определите и обсудите факторы или эффекты, которые могут способствовать расхождениям между теоретическими и экспериментальными результатами, и сформулируйте стратегии оптимизации.•
Качественно опишите влияние растворенного CO 2 на результаты.
Предлагаемый обзор и внешнее чтение
•
справочная информация о равновесии и растворимости; соответствующая справочная и справочная информация по растворимости, кислотам и основаниям
Фон
Всякий раз, когда твердый гидроксид кальция, Ca(OH) 2 (известный как известь ), присутствует в воде, растворяется в соответствии с уравнением
. 2
2Ca(OH) 2 (т) Ca 2+ (водн.) + 2 OH − (водн.)
до тех пор, пока скорость обратной реакции не сравняется со скоростью прямой реакции и раствор не станет насыщенным .
( 2 )
Ca(OH) 2 (s) Ca
Константой равновесия реакции является константа произведения растворимости,
K sp ,
дается следующим образом.
( 3 )
K sp = [Ca 2+ ][OH − ] 2
Концентрация Ca(OH) 2 ( s ) не фигурирует в выражении константы равновесия, потому что он всегда присутствует в виде чистого твердого вещества (активность равна 1), независимо от того, сколько или мало его присутствует. Насыщенный раствор Ca(OH) 2 можно приготовить реакцией металлического кальция с водой. Кальций окисляется водой с образованием гидроксида кальция и газообразного водорода.
Насыщенный раствор Ca(OH) 2 можно приготовить реакцией металлического кальция с водой. Кальций окисляется водой с образованием гидроксида кальция и газообразного водорода.
(4)
Ca(s) + 2 H 2 O(l) → Ca(OH) 2 (s) + H 2 (g)Методика
7
7
Проверьте необходимое оборудование на складе (или одолжите необходимые предметы на столе с реагентами). Перед использованием все хорошо очистите.
Если ваш ТА готовит насыщенный раствор Ca(OH) 2 , осторожно отлейте приблизительно 30 мл жидкости над осадком в колбу Эрленмейера и немедленно закройте ее пробкой. ПОЖАЛУЙСТА, не забудьте закрыть крышку контейнера с реагентом (раствор, приготовленный ТА). Перейдите к шагу 5.
2
Чтобы приготовить насыщенный раствор Ca(OH) 2 , используйте пинцет, чтобы безопасно добавить небольшой кусочек металлического кальция в 150 мл дистиллированной воды в химическом стакане.
•
Если вы добавите слишком много металла, может образоваться большой избыток твердого гидроксида кальция, который будет трудно удалить фильтрованием.•
Если вы добавите слишком мало металла, вы не сформируете достаточное количество гидроксида кальция для насыщения раствора, что является целью добавления металла в воду.•
Металлический кальций является сильным восстановителем и не должен контактировать с кожей.•
Возможно, вам придется поцарапать металл, чтобы стереть потускнение, и обнажить чистую поверхность, чтобы началась реакция.
3
Вы должны увидеть белый осадок твердого Ca(OH) 2 , что указывает на то, что надосадочная жидкость представляет собой насыщенный раствор известковой воды.
4
Перемешайте раствор и дайте осадку осесть.
5
Медленно перелейте раствор через воронку, выстланную фильтровальной бумагой, в колбу Эрленмейера, чтобы собрать свободный от твердого вещества супернатант (насыщенный раствор Ca(OH) 2 ). Чтобы лучше отделить мелкие частицы осадка от супернатанта, вы можете использовать два куска фильтровальной бумаги или дважды профильтровать раствор. Фильтрация может занять много времени, поэтому сделайте разбавления для остальной части эксперимента, пока ждете. Не использовать вакуумную фильтрацию. Не смывать осадок.
6
После завершения фильтрации немедленно закройте колбу с надосадочной жидкостью. Известковая вода может реагировать с углекислым газом с образованием очень нерастворимого карбоната кальция.
( 5 )
Ca 2+ (водн.) + 2 OH − (водн.) + CO Углекислый газ из воздуха действует как кислота и нейтрализует часть ОН – вы измеряете. Сведите к минимуму контакт вашего насыщенного раствора с воздухом, закрыв ваши колбы после того, как вы собрали фильтрат.
Сведите к минимуму контакт вашего насыщенного раствора с воздухом, закрыв ваши колбы после того, как вы собрали фильтрат.
7
Ваш фильтрат должен быть прозрачным . Любое твердое вещество Ca(OH) 2 мешает определению концентрации насыщения ионов OH – . Поскольку ионы ОН – удаляются из пробы при титровании кислотой, оставшееся твердое вещество диссоциирует, в результате чего избыток ОН – в раствор для достижения равновесия. Этот дополнительный ОН – исказит определение концентрации насыщенного ОН – .
8
Приблизительное значение
K sp
для гидроксида кальция составляет 6,5 × 10 –6 , поэтому вычислите приблизительное значение концентрации иона OH – , [OH – ], в насыщенной решение (см. предварительный вопрос по WebAssign; до двух значащих цифр).
предварительный вопрос по WebAssign; до двух значащих цифр).
9
Приготовьте раствор HCl для использования в качестве титранта.
и
Запишите точную концентрацию исходного раствора HCl (примерно от 2 М до 0,001 М).б
Сделайте объемное разбавление исходного раствора HCl.с
Спланируйте размер аликвоты и количество, на которое вы будете разбавлять кислоту, чтобы для титрования требовалось около 10 мл HCl (см. вопрос перед лабораторной работой на веб-сайте WebAssign). Подсказка: разведение 1:100 — хорошее начало.д
Запишите объем исходного раствора, использованный до 0,01 мл, и окончательный объем раствора после разбавления деионизированной водой до 0,01 мл.и
Рассчитайте молярность разбавленного раствора HCl, используяM 1 V 1 = M 2 V 2
до трех значащих цифр.
10
Титруйте насыщенный Ca(OH) 2 раствор с HCl. Вы должны получить четыре хороших набора данных титрования.
и
Пипеткой внесите аликвоту насыщенного супернатанта в колбу, содержащую 100 мл дистиллированной воды и 3 или 4 капли индикатора бромтимолового синего. Можно добавить дополнительное количество деионизированной воды после того, как вы запишете, сколько Ca(OH) 2 ( aq ) вы используете.-
б
Запишите объем Ca(OH) 2 ( водный раствор ) аликвоту, которую вы используете до 0,01 мл. Используйте 5,00 мл или 10,00 мл для испытаний. Вы должны стремиться использовать около 10 мл разбавленной HCl для каждого титрования. Увеличьте или уменьшите размер аликвоты по мере необходимости. Если на поверхности надосадочной жидкости есть пена, не набирайте ее в пипетку. с
Подготовьте эти колбы только тогда, когда вы будете готовы к их титрованию, и держите все растворы закрытыми, когда вы не работаете с ними.
д
Титруйте каждый раствор до точки эквивалентности HCl (запишите необходимый объем HCl до 0,05 мл).
| Утилизация отходов: | Когда вы закончите, следуйте инструкциям своего ассистента по утилизации отходов. | |
| В задней части капота будут контейнеры для жидких и твердых отходов. | ||
| Ничего не уходит в раковину или в мусорное ведро. |
Из стехиометрии
экв. 2Ca(OH) 2 (s) Ca 2+ (водн.) + 2 OH − (водн.)
получается следующее.
( 6 )
[OH − ] = 2[Ca 2+ ] (после диссоциации)
Это можно заменить в
Eq. 3K sp = [Ca 2+ ][OH − ] 2
.
( 7 )
К sp = 1/2[OH − ] 3
11
Рассчитайте [OH – ] в насыщенном растворе Ca(OH) 2 для каждого из ваших четырех испытаний.
12
Найдите среднюю концентрацию и ее стандартное отклонение.
13
Используйте среднее значение [OH – ] для определения среднего значения для
K sp
(включая распространение ошибки с использованием стандартного отклонения среднего [OH – ]). Можно использовать коэффициент масштабирования x10 -6 (в онлайн-версии). Если ваше среднее значение
K sp
увеличено не до -6, а до -5, у вас будет две цифры перед запятой в вашем значении
K sp
. Например, если ваш экспериментальный
Например, если ваш экспериментальный
K sp
равен 6,46×10 -5 , масштабированное значение будет 64,6×10 -6 . Пожалуйста, обратитесь за помощью, если вы не уверены в этом.
14
Сравните свое значение со значением из литературы, рассчитав процентную ошибку вашего значения относительно значения из литературы. Включите обсуждение того, почему ваше значение может быть больше или меньше литературного значения.
Результаты
Заполните резюме лабораторной работы или напишите отчет (в соответствии с инструкциями).
Реферат
Результаты
nOH − (каждое титрование), nOH − (титрование) среднее , [OH − ] ср. (фильтрат), K sp (среднее) с ошибкой
Расчет образцов
титрованные моли гидроксида средняя концентрация гидроксида в аликвоте произведение растворимости анализ ошибок
Обсуждение/Выводы
Обсудите, что вы узнали и как, для каждой части. Сравните произведение растворимости с литературным значением, включая возможные причины различий. Какие хорошие..
Сравните произведение растворимости с литературным значением, включая возможные причины различий. Какие хорошие..
•
метод, который вы использовали для определения вашего произведения растворимости?•
ваши результаты?
Контрольные вопросы
Термическое разложение карбоната кальция | Эксперимент
- Пять из пяти
Карбонат кальция сильно нагревают до тех пор, пока он не подвергнется термическому разложению с образованием оксида кальция и диоксида углерода. Оксид кальция (негашеная известь) растворяется в воде с образованием гидроксида кальция (известковой воды). Пропуская через него углекислый газ, образуется молочная суспензия карбоната кальция
Этот эксперимент удобно проводить в группах по два или три человека, и он занимает около 40–45 минут.
Оборудование
Аппаратура
- Защита для глаз
- Штатив
- Марля
- Горелка Бунзена
- Щипцы
- Трубки для кипячения, 2 шт. (примечание 1)
- Соломинка для питья (примечание 2)
- Пипетка-капельница
- Воронка для фильтра, маленькая
- Фильтровальная бумага
Примечания к аппарату
- Используйте большие (150 x 25 мм) пробирки (кипячения).
- Необходимо использовать свежеприобретенные соломинки для питья, и каждому учащемуся должна быть выдана собственная соломинка.
Химикаты
- Карбонат кальция
- Универсальный индикаторный раствор (ЛЕГКО ОГНЕОПАСНЫЙ)
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Используйте защитные очки.
- Карбонат кальция, CaCO 3 (s) — см.
 CLEAPSS Hazcard HC019b. Используемый карбонат кальция должен быть в виде кусков мела размером с горошину. Мел для школьной доски не следует использовать, так как он, скорее всего, состоит в основном из сульфата кальция.
CLEAPSS Hazcard HC019b. Используемый карбонат кальция должен быть в виде кусков мела размером с горошину. Мел для школьной доски не следует использовать, так как он, скорее всего, состоит в основном из сульфата кальция. - Универсальный индикаторный раствор (ВЫСОКО ВОСПЛАМЕНЯЕМЫЙ) — см. карточку опасности CLEAPSS HC032 и книгу рецептов CLEAPSS RB047.
Процедура
Источник: RSC
- Прежде чем приступать к экспериментам, вам необходимо подготовить табличный лист результатов. Пример таблицы приведен ниже в методических заметках.
- Насыпьте на марлю кусочек мела (карбоната кальция). Если у вашей марли есть центральный круг с покрытием, используйте край без покрытия.
- Сильно нагрейте мел в течение 5–10 минут. Запишите, что вы наблюдаете.
- Дайте мелу остыть и с помощью щипцов переместите его в кипящую трубку. Пипеткой добавить 2–3 капли воды. Запишите свои наблюдения.
- Добавьте еще около 10 см 3 воды к твердому веществу.
 Что происходит?
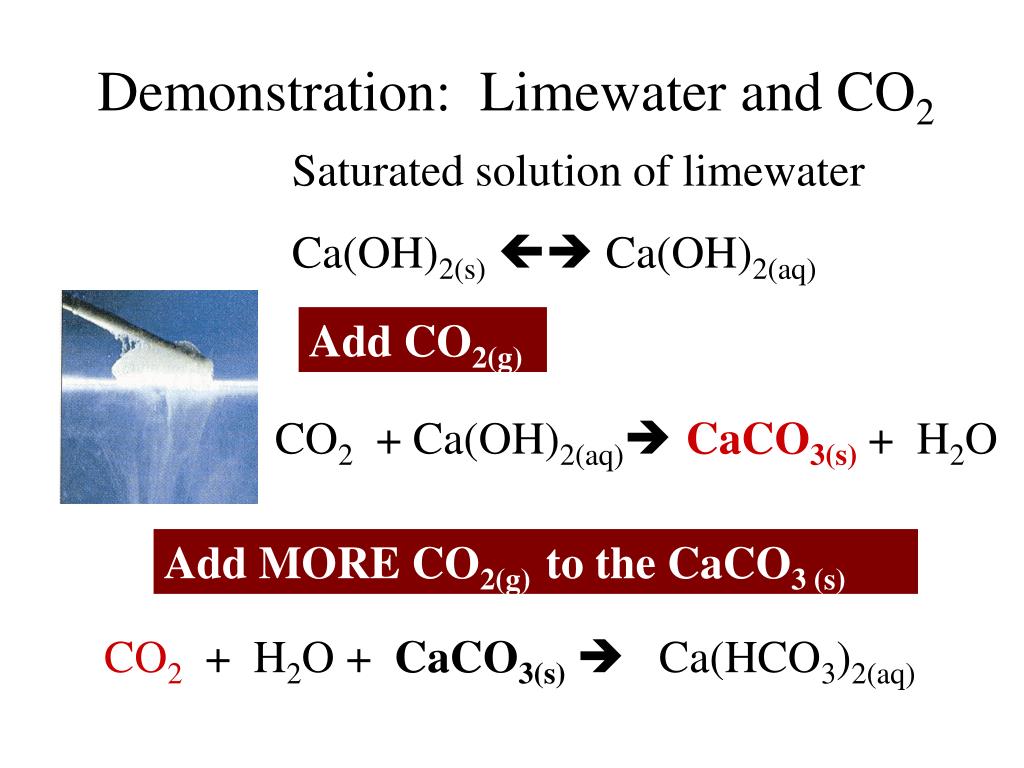
Что происходит? - Отфильтруйте половину смеси в другую пробирку для кипячения и, используя соломинку, осторожно выпустите поток пузырьков через фильтрат. Что ты видишь?
- Проверьте оставшуюся половину смеси раствором универсального индикатора. Запишите, что вы наблюдаете.
Учебные заметки
Следите за менее зрелыми учениками, у которых может возникнуть соблазн сосать, а не выдувать фильтрат.
Ожидаемые результаты:
Метод | Наблюдение |
Нагрев в течение 10 минут | Мел должен слегка крошиться |
Добавьте 2–3 капли воды | Больше крошится, идет пар, свидетельство того, что смесь стала горячей |
Добавить 10 см 3 больше воды | Часть твердого вещества растворяется, белая суспензия |
Продуйте раствор | Известковая вода мутнеет |
Добавить универсальный индикатор | Индикатор меняет цвет с зеленого на синий/фиолетовый |
Этот набор экспериментов включает множество важных реакций и типов реакций, с несколькими ссылками на промышленные процессы. Обжиг известняка и гидратация образовавшейся негашеной извести имеют значение при производстве гипса и цемента, а в лабораторных условиях известковая вода является обычным реагентом для тестирования углекислого газа. Студентов можно попросить провести веб-исследование этих приложений.
Обжиг известняка и гидратация образовавшейся негашеной извести имеют значение при производстве гипса и цемента, а в лабораторных условиях известковая вода является обычным реагентом для тестирования углекислого газа. Студентов можно попросить провести веб-исследование этих приложений.
Несколько вопросов и ответов к классу после эксперимента
- Почему при сильном нагревании мел слегка крошится?
Углекислый газ/газ выделяется; это выбивается из твердого тела и разрушает его структуру. - Какой тип реакции происходит в процессе нагревания? Напишите уравнение реакции.
Термическое разложение; CaCO 3 (т) → CaO(т) + CO 2 (г) - Почему при добавлении капель воды выделяется пар? Напишите уравнение протекающей реакции.
Реакция сильно экзотермична, и небольшое количество добавленной воды частично превращается в пар в процессе: CaO(s) + H 2 O(l) → Ca(OH) 2 (s) - Почему мутнеет известковая вода? Напишите уравнение протекающей реакции.



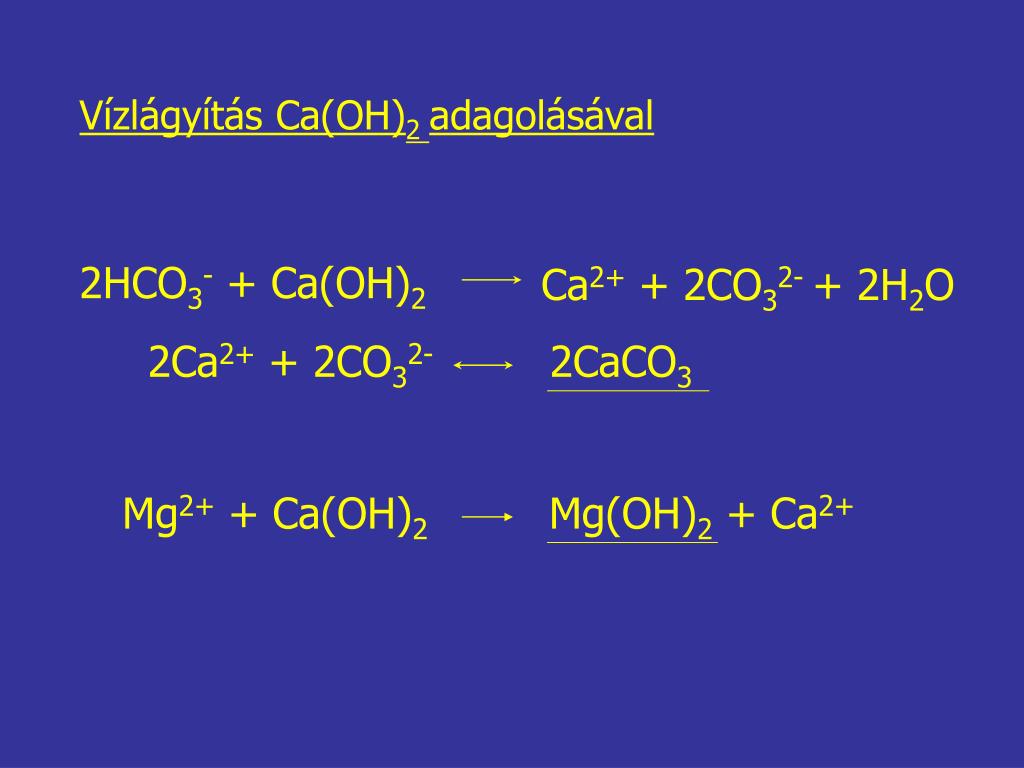
 CLEAPSS Hazcard HC019b. Используемый карбонат кальция должен быть в виде кусков мела размером с горошину. Мел для школьной доски не следует использовать, так как он, скорее всего, состоит в основном из сульфата кальция.
CLEAPSS Hazcard HC019b. Используемый карбонат кальция должен быть в виде кусков мела размером с горошину. Мел для школьной доски не следует использовать, так как он, скорее всего, состоит в основном из сульфата кальция. Что происходит?
Что происходит?