| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
СУНЦ УрФУ
Расписание
Электронный журнал
ПоступающимОлимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
07.05.2023
Учимся и побеждаем!
Лицеисты заняли I и II места в Школе практического программирования.
06.05.2023
Поэзии чарующие звуки…
В СУНЦ стартует регистрация на поэтический вечер, который пройдёт 15 мая в 15:30 в актовом зале.
05.05.2023
Заключительный этап. Успех!
Наши лицеисты достойно выступили на заключительном этапе Всероссийской олимпиады школьников.
04.05.2023
Успехи на международном форуме в Кыргызстане
Лицеисты привезли из солнечного Кыргызстана золотую и бронзовую медали международного форума «Мы — интеллектуалы XXI века!».
04.05.2023
Зарядись «Энергией будущего»!
Лицеисты СУНЦ с успехом выступили на всероссийском конкурсе научно-исследовательских работ и проектов.
25.04.2023
Время зарабатывать!
Соцэки СУНЦ совершенствуют свои практические навыки.
Больше новостей
Видеогалерея:
Мужчины СУНЦ о 8 Марта (2023)
Концерт к 8 Марта (2023)
Поздравление с Днем защитника Отечества (2023)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9, 10 и 11 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул., 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 19, 32 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
Основное исследование электронных, термодинамических и диэлектрических свойств монослоя Ca(OH)2 и Mg(OH)2
. 2022 23 мая; 12 (10): 1774.
2022 23 мая; 12 (10): 1774.
дои: 10.3390/nano12101774.
Мехрдад Ростами Осанлу 1 , Коладе А Оекан 2 , Уильям Дж. Ванденберге 2
Принадлежности
Принадлежности
- 1 Факультет физики Техасского университета в Далласе, Ричардсон, Техас 75080, США.
- 2 Факультет материаловедения и инженерии, Техасский университет в Далласе, Ричардсон, Техас 75080, США.
- PMID: 35630994
- PMCID: PMC9147085
- DOI:
10.
 3390/нано12101774
3390/нано12101774
Бесплатная статья ЧВК
Мехрдад Ростами Осанлу и др. Наноматериалы (Базель). .
Бесплатная статья ЧВК
. 2022 23 мая; 12 (10): 1774.
дои: 10.3390/nano12101774.
Авторы
Мехрдад Ростами Осанлу 1 , Коладе А Оекан 2 , Уильям Дж. Ванденберге 2
Принадлежности
- 1 Факультет физики Техасского университета в Далласе, Ричардсон, Техас 75080, США.

- 2 Факультет материаловедения и инженерии, Техасский университет в Далласе, Ричардсон, Техас 75080, США.
- PMID: 35630994
- PMCID: PMC9147085
- DOI: 10.3390/нано12101774
Абстрактный
Мы выполняем первопринципные расчеты для изучения электронных, термодинамических и диэлектрических свойств двумерных (2D) слоистых гидроксидов щелочноземельных металлов Ca(OH)2 и Mg(OH)2. Мы рассчитываем параметры решетки, энергии расслоения и фононные спектры монослоев, а также исследуем тепловые свойства этих монослоев, такие как свободная энергия Гельмгольца, теплоемкость при постоянном объеме и энтропия как функция температуры. Мы используем теорию возмущений функционала плотности (DFPT) для расчета статической диэлектрической проницаемости в плоскости и вне плоскости объемных и монослойных образцов. Мы вычисляем значения ширины запрещенной зоны и сродства к электрону с помощью функционала HSE06 и оцениваем плотность тока утечки транзисторов с монослоями Ca(OH)2 и Mg(OH)2 в качестве диэлектриков в сочетании с HfS2 и WS2 соответственно. Наши результаты показывают, что бислой Mg(OH)2 (EOT∼0,60 нм) с более низкой растворимостью в воде обеспечивает более высокие диэлектрические проницаемости вне плоскости и более низкие токи утечки, чем бислой Ca(OH)2 (EOT∼0,56 нм). Кроме того, внеплоскостная диэлектрическая проницаемость, ток утечки и EOT Mg(OH)2 превосходят двухслойный h-BN. Мы проверяем применимость правила Андерсона и делаем вывод, что бислои Ca(OH)2 и Mg(OH)2, соответственно, в паре с согласованными по решетке монослоями HfS2 и WS2 являются эффективными структурными комбинациями, которые могут привести к развитию инновационных многослойных структур.
Мы используем теорию возмущений функционала плотности (DFPT) для расчета статической диэлектрической проницаемости в плоскости и вне плоскости объемных и монослойных образцов. Мы вычисляем значения ширины запрещенной зоны и сродства к электрону с помощью функционала HSE06 и оцениваем плотность тока утечки транзисторов с монослоями Ca(OH)2 и Mg(OH)2 в качестве диэлектриков в сочетании с HfS2 и WS2 соответственно. Наши результаты показывают, что бислой Mg(OH)2 (EOT∼0,60 нм) с более низкой растворимостью в воде обеспечивает более высокие диэлектрические проницаемости вне плоскости и более низкие токи утечки, чем бислой Ca(OH)2 (EOT∼0,56 нм). Кроме того, внеплоскостная диэлектрическая проницаемость, ток утечки и EOT Mg(OH)2 превосходят двухслойный h-BN. Мы проверяем применимость правила Андерсона и делаем вывод, что бислои Ca(OH)2 и Mg(OH)2, соответственно, в паре с согласованными по решетке монослоями HfS2 и WS2 являются эффективными структурными комбинациями, которые могут привести к развитию инновационных многослойных структур. функциональные полевые транзисторы (FET).
функциональные полевые транзисторы (FET).
Ключевые слова: гетеробислой (OH)2/HfS2; двумерные диэлектрические материалы; 2D-диэлектрики с TMD-каналами; двумерные гетероструктуры для полевых транзисторов; двумерные ван-дер-ваальсовые диэлектрики; Гетеробислой Mg(OH)2/W2.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Цифры
Рисунок 1
Схематический вид…
Рисунок 1
Схематическое изображение полевого транзистора из монослойного диэлектрика M(OH) 2…
Рисунок 1 Схематическое изображение полевого транзистора, изготовленного из монослойного диэлектрика M(OH)2 и монослойного TMD-канала.
Рисунок 2
Структуры гидроксидов щелочноземельных металлов…
Рисунок 2
Структуры гидроксидов щелочноземельных металлов. Вид сбоку ( и ) и сверху…
фигура 2Структуры гидроксидов щелочноземельных металлов. Вид сбоку ( a ) и вид сверху монослоя ( d ) в дополнение к виду бислоя сбоку ( c ). ( b ) демонстрирует длину связи Ca-O/Mg-O (l1) и O-H (l2), а также углы между связями (α и β). Толщина монослоя ( t ) указана на двухслойных конструкциях.
Рисунок 3
M(OH) 2 фононная дисперсия…
Рисунок 3
M(OH) 2 Дисперсионные кривые фононов. ( a ) Фононный дисперсионный спектр…
( a ) Фононный дисперсионный спектр…
M(OH)2. ( a ) Фононный дисперсионный спектр Ca(OH)2. ( b ) Фононный дисперсионный спектр Mg(OH)2. Моды Eg (синий), A1g (красный), Eg(OH) (оранжевый) и A1g(OH) (зеленый) соответственно представляют собой поступательное движение и возвратно-поступательное движение связей O-H. На вставках визуализируются плоские и внеплоскостные колебательные моды OH. Ломаная ось показывает, что между 9 и 9 фононными ветвями нет.0 и 450 мэВ. Плоские энергетические кривые на высокоэнергетических модах (∼470 мэВ) связаны с внеплоскостными смещениями водорода и кислорода.
Рисунок 4
Термодинамические свойства Ca(OH) 2…
Рисунок 4
Термодинамические свойства Ca(OH) 2 и Mg(OH) 2 . Энтропия( S v (…
Энтропия( S v (…
Термодинамические свойства Ca(OH)2 и Mg(OH)2. Энтропия (Sv(T)), теплоемкость при постоянном объеме (Cv), внутренняя энергия ( U ( T )) и свободная энергия Гельмгольца ( A ( T )) Mg(OH)2 (Ca (OH)2) показаны сплошными (пунктирными) синими, зелеными, голубыми и красными линиями соответственно. Меньшая свободная энергия Гельмгольца означает, что с термодинамической точки зрения монослой Ca(OH)2 является лучшим материалом по сравнению с монослоем Mg(OH)2.
Рисунок 5
Структура полосы и общий DOS…
Рисунок 5
Полосная структура и суммарная ПЭС монослоя ( a ) Ca(OH) 2 и…
Рисунок 5 Зонная структура и суммарная ПЭС монослоя ( a ) Ca(OH)2 и ( b ) Mg(OH)2. Гибридные функционалы HSE06 используются для коррекции обычной недооценки ширины запрещенной зоны. Оба материала имеют прямую запрещенную зону с шириной запрещенной зоны Ca(OH)2 (5,19эВ) немного больше ширины запрещенной зоны Mg(OH)2 (4,93 эВ).
Гибридные функционалы HSE06 используются для коррекции обычной недооценки ширины запрещенной зоны. Оба материала имеют прямую запрещенную зону с шириной запрещенной зоны Ca(OH)2 (5,19эВ) немного больше ширины запрещенной зоны Mg(OH)2 (4,93 эВ).
Рисунок 6
Выравнивание полос Ca(OH) 2…
Рисунок 6
Выравнивание полос Ca(OH) 2 и Mg(OH) 2 . ( и ) В…
Рисунок 6 Выравнивание полос Ca(OH)2 и Mg(OH)2. ( a ) Смещение полос HfS2 и WS2 с Ca(OH)2, Mg(OH)2. Уровень вакуума установлен на ноль, и для сравнения включен монослой h-BN. ( b ) Средний потенциал гетероструктур (Ca(OH)2/HfS2 и Mg(OH)2/WS2) показан относительно направления z, перпендикулярного плоскости листов. Максимум зоны проводимости (CBM) и минимум валентной зоны (VBM) каждого материала показаны цветными сплошными и пунктирными линиями.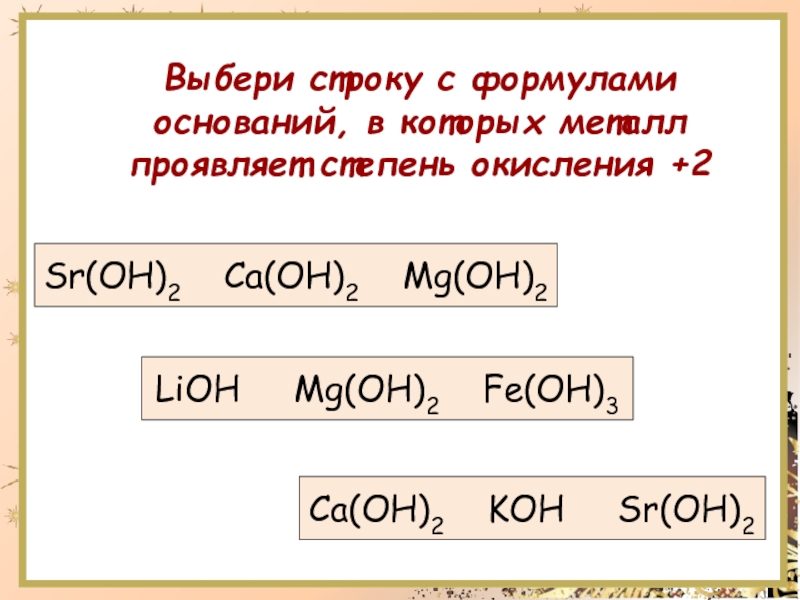 CBM и VBM каждой гетероструктуры показаны длинными сплошными горизонтальными линиями. Правило Андерсона используется для расчета ширины запрещенной зоны и сродства к электрону каждой гетероструктуры.
CBM и VBM каждой гетероструктуры показаны длинными сплошными горизонтальными линиями. Правило Андерсона используется для расчета ширины запрещенной зоны и сродства к электрону каждой гетероструктуры.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Нитрид-галогенидные диэлектрики переходных металлов для дихалькогенидных транзисторов переходных металлов.
Ростами Осанлу М., Саадат А., Ван де Пут М.Л., Латурия А., Ванденберге В.Г. Ростами Осанлу М. и др. Наномасштаб. 2021 23 декабря; 14 (1): 157-165. дои: 10.1039/d1nr05250k. Наномасштаб. 2021. PMID: 348
Идентификация двумерных слоистых диэлектриков из первых принципов.
Осанлоо М.
 Р., Ван де Пут М.Л., Саадат А., Ванденберге В.Г.
Осанлу М.Р. и соавт.
Нац коммун. 2021 19 августа; 12 (1): 5051. doi: 10.1038/s41467-021-25310-2.
Нац коммун. 2021.
PMID: 34413289
Бесплатная статья ЧВК.
Р., Ван де Пут М.Л., Саадат А., Ванденберге В.Г.
Осанлу М.Р. и соавт.
Нац коммун. 2021 19 августа; 12 (1): 5051. doi: 10.1038/s41467-021-25310-2.
Нац коммун. 2021.
PMID: 34413289
Бесплатная статья ЧВК.Сверхвысокое внеплоскостное пьезоэлектричество, низкая теплопроводность и фотокаталитическая способность в сверхтонких двумерных ван-дер-ваальсовых гетероструктурах монофосфида бора и нитрида галлия.
Моханта М.К., Рават А., Димпл, Джена Н., Ахамед Р., Де Саркар А. Моханта М.К. и др. Наномасштаб. 21 ноября 2019 г .; 11 (45): 21880-21890. дои: 10.1039/c9nr07586k. Наномасштаб. 2019. PMID: 31697290
Структуры и характеристики атомарно тонкого ZrO 2 от монослоя к бислою и двумерного гетероперехода ZrO 2 -MoS 2 .

Венг Дж., Гао С.П. Венг Дж. и соавт. RSC Adv. 2019 16 октября; 9 (57): 32984-32994. дои: 10.1039/c9ra06074j. Электронная коллекция 2019 15 октября. RSC Adv. 2019. PMID: 35529155 Бесплатная статья ЧВК.
Сотовый монослой HfO 2 и расчет статической диэлектрической проницаемости, исключающий влияние вакуумного зазора.
Венг Дж., Гао С.П. Венг Дж. и соавт. Phys Chem Chem Phys. 2018 7 ноября; 20 (41): 26453-26462. дои: 10.1039/c8cp04743j. Epub 2018 11 октября. Phys Chem Chem Phys. 2018. PMID: 30306170
Посмотреть все похожие статьи
Рекомендации
- Гейм А.К., Новоселов К.С. Нанонаука и технологии: сборник обзоров журналов Nature.
 Всемирный научный; Сингапур: 2010 г. Расцвет графена; стр. 11–19.
Всемирный научный; Сингапур: 2010 г. Расцвет графена; стр. 11–19.
- Гейм А.К., Новоселов К.С. Нанонаука и технологии: сборник обзоров журналов Nature.
- Новоселов К.С., Фалхо В.И., Коломбо Л., Геллерт П., Шваб М., Ким К. Дорожная карта для графена. Природа. 2012; 490:192–200. дои: 10.1038/природа11458. — DOI — пабмед
- Нето А.С., Гвинея Ф., Перес Н.М., Новоселов К.С., Гейм А.К. Электронные свойства графена. Преподобный Мод. физ. 2009;81:109. doi: 10.1103/RevModPhys.81.109. — DOI
- Ванденберге В.
 Г. Определение электронных, структурных, диэлектрических, магнитных и транспортных свойств в новых электронных материалах: использование методов первых принципов. IEEE Нанотехнологии. Маг. 2021;15:68-C3. дои: 10.1109/МНАНО.2021.3113223.
—
DOI
Г. Определение электронных, структурных, диэлектрических, магнитных и транспортных свойств в новых электронных материалах: использование методов первых принципов. IEEE Нанотехнологии. Маг. 2021;15:68-C3. дои: 10.1109/МНАНО.2021.3113223.
—
DOI
- Ванденберге В.
- Гао Э., Линь С.З., Цинь З., Бюлер М.Дж., Фэн С.К., Сюй З. Механическое расслоение двумерных материалов. Дж. Мех. физ. Твердые вещества. 2018; 115: 248–262. doi: 10.1016/j.jmps.2018.03.014. — DOI
Грантовая поддержка
- 1802166/Национальный научный фонд
Растворимость гидроксидов, сульфатов и карбонатов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3679
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждается растворимость гидроксидов, сульфатов и карбонатов элементов 2-й группы — бериллия, магния, кальция, стронция и бария — в воде
Основность оксида металла группы II и растворимость гидроксида в воде увеличиваются по мере продвижения вниз по колонке. BeO и Be(OH)2 амфотерны и реагируют с кислотами и сильными основаниями, такими как NaOH. MgO является основным, а Mg(OH)2 является слабоосновным и не растворяется в растворе NaOH. Оксиды кальция, стронция и бария являются основными, а гидроксиды — сильноосновными. Растворимость гидроксидов в воде следует в следующем порядке: Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2.
BeO и Be(OH)2 амфотерны и реагируют с кислотами и сильными основаниями, такими как NaOH. MgO является основным, а Mg(OH)2 является слабоосновным и не растворяется в растворе NaOH. Оксиды кальция, стронция и бария являются основными, а гидроксиды — сильноосновными. Растворимость гидроксидов в воде следует в следующем порядке: Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2.
Оксиды металлов Основность
Оксиды металлов группы II становятся более щелочными по мере продвижения вниз по колонке. Эту тенденцию легко увидеть, если сравнить электроотрицательность металла II группы с электроотрицательностью кислорода.
| Элемент | Электроотрицательность | ∆Электроотрицательность |
|---|---|---|
| О | 3,44 | |
| Быть | 1,57 | 1,87 |
| мг | 1,31 | 2,13 |
| Са | 1,00 | 2,44 |
| Старший | 0,95 | 2,49 |
| Ба | 0,89 | 2,55 |
Как вы можете видеть, электроотрицательность металлов уменьшается вниз по столбцу, в результате чего изменение электроотрицательности увеличивается вниз по группе. Чем больше разница в электроотрицательности, тем более ионной становится связь металл-кислород. Чем более ионна связь металл-кислород, тем более основным является оксид.0003
Чем больше разница в электроотрицательности, тем более ионной становится связь металл-кислород. Чем более ионна связь металл-кислород, тем более основным является оксид.0003
Растворимость гидроксидов
Гидроксиды металлов группы II становятся более растворимыми в воде по мере продвижения вниз по колонке. Эту тенденцию можно объяснить уменьшением энергии решетки гидроксида соли и увеличением координационного числа иона металла по мере спуска по колонке.
| Элемент | Энергия решетки (кДж/моль) | Координационный номер |
|---|---|---|
| Be | 3620 | 4 |
| мг | 2998 | 6 |
| Са | 2637 | 6 |
| Старший | 2474 | 8 |
| Ба | 2330 | 8 |
Чем больше энергия решетки, тем больше энергии требуется для ее разрушения на ионы металла и гидроксида. Поскольку атомные радиусы увеличиваются вниз по группе, имеет смысл, что координационные числа также увеличиваются, потому что чем больше ион металла, тем больше места для координации с ним молекул воды.
Поскольку атомные радиусы увеличиваются вниз по группе, имеет смысл, что координационные числа также увеличиваются, потому что чем больше ион металла, тем больше места для координации с ним молекул воды.
Следующие примеры иллюстрируют эту тенденцию:
- Гидроксид магния нерастворим в воде. Однако, если его встряхнуть в воде и профильтровать, раствор будет слегка щелочным. Это свидетельствует о том, что в растворе больше гидроксид-ионов, чем в исходной воде. Это связано с тем, что часть гидроксида магния растворилась.
- Раствор гидроксида кальция называют «известковой водой». В литре чистой воды растворяется около 1 г гидроксида кальция при комнатной температуре.
- Гидроксид бария достаточно растворим для получения раствора с концентрацией около 0,1 моль дм -3 при комнатной температуре.
Растворимость сульфатов
- Сульфаты становятся менее растворимыми вниз по группе.
Эта простая тенденция верна при условии, что рассматривается гидратированный сульфат бериллия, а не безводный сульфат бериллия. В книге данных Наффилда любой водный сульфат бериллия BeSO 4 указан как нерастворимый, тогда как гидратированная форма BeSO 4 .4H 2 O растворим, с растворимостью около 39 г BeSO 4 на 100 г воды при комнатной температуре. Показатели растворимости сульфата магния и сульфата кальция также варьируются в зависимости от того, гидратирована ли соль или нет, но изменения менее значительны.
В книге данных Наффилда любой водный сульфат бериллия BeSO 4 указан как нерастворимый, тогда как гидратированная форма BeSO 4 .4H 2 O растворим, с растворимостью около 39 г BeSO 4 на 100 г воды при комнатной температуре. Показатели растворимости сульфата магния и сульфата кальция также варьируются в зависимости от того, гидратирована ли соль или нет, но изменения менее значительны.
Два распространенных примера иллюстрируют эту тенденцию:
- Известная реакция — это реакция между магнием и разбавленной серной кислотой с образованием газообразного водорода и бесцветного раствора сульфата магния. Обратите внимание, что образуется раствор, а не осадок, что означает растворимость сульфата магния.
- Сульфат бария существует в виде белого осадка в растворе. Быстрое образование осадка указывает на то, что сульфат бария совершенно нерастворим. Фактически, 1 литр воды растворяет около 2 мг сульфата бария при комнатной температуре.



 аммиака, 1780г 20% раствора щелочи потребуется для реакции.
аммиака, 1780г 20% раствора щелочи потребуется для реакции. narod.ru/
narod.ru/  3390/нано12101774
3390/нано12101774
 Р., Ван де Пут М.Л., Саадат А., Ванденберге В.Г.
Осанлу М.Р. и соавт.
Нац коммун. 2021 19 августа; 12 (1): 5051. doi: 10.1038/s41467-021-25310-2.
Нац коммун. 2021.
PMID: 34413289
Бесплатная статья ЧВК.
Р., Ван де Пут М.Л., Саадат А., Ванденберге В.Г.
Осанлу М.Р. и соавт.
Нац коммун. 2021 19 августа; 12 (1): 5051. doi: 10.1038/s41467-021-25310-2.
Нац коммун. 2021.
PMID: 34413289
Бесплатная статья ЧВК.
 Всемирный научный; Сингапур: 2010 г. Расцвет графена; стр. 11–19.
Всемирный научный; Сингапур: 2010 г. Расцвет графена; стр. 11–19. Г. Определение электронных, структурных, диэлектрических, магнитных и транспортных свойств в новых электронных материалах: использование методов первых принципов. IEEE Нанотехнологии. Маг. 2021;15:68-C3. дои: 10.1109/МНАНО.2021.3113223.
—
DOI
Г. Определение электронных, структурных, диэлектрических, магнитных и транспортных свойств в новых электронных материалах: использование методов первых принципов. IEEE Нанотехнологии. Маг. 2021;15:68-C3. дои: 10.1109/МНАНО.2021.3113223.
—
DOI