Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.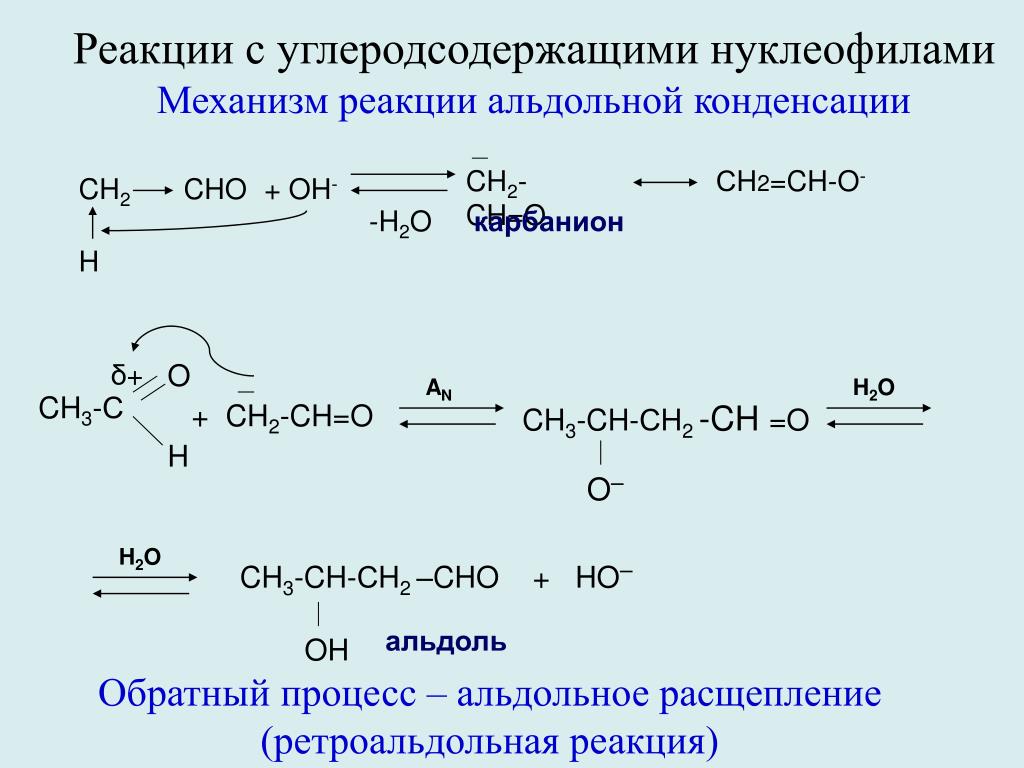
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.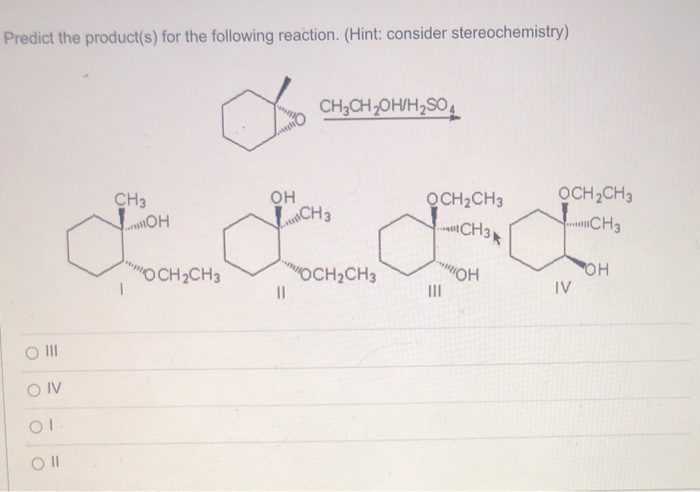
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
ТЕРМОХИМИЧЕСКИЕ РЕАКЦИИ. ЭКЗОТЕРМИЧЕСКИЕ И ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИ Survey
Question Title
* 7. CH
4 + 2O2 = CO2 + 2H2O| Эндотермическая реакция(H>0) | Экзотермическая реакция(H<0) | |
| Ch5 + 2O2 = CO2 + 2h3O | Ch5 + 2O2 = CO2 + 2h3O Эндотермическая реакция(H>0) | Ch5 + 2O2 = CO2 + 2h3O Экзотермическая реакция(H<0) |
| Ca(OH)2 = CaO + h3O | Ca(OH)2 = CaO + h3O Эндотермическая реакция(H>0) | Ca(OH)2 = CaO + h3O Экзотермическая реакция(H<0) |
| CaO + h3O = Ca(OH)2 | CaO + h3O = Ca(OH)2 Эндотермическая реакция(H>0) | CaO + h3O = Ca(OH)2 Экзотермическая реакция(H<0) |
| (Nh5)2Cr2O7 = N2 + Cr2O3 + 4h3O | (Nh5)2Cr2O7 = N2 + Cr2O3 + 4h3O Эндотермическая реакция(H>0) | (Nh5)2Cr2O7 = N2 + Cr2O3 + 4h3O Экзотермическая реакция(H<0) |
| 2KMnO7 = K2MnO4 + MnO2 + O2 | 2KMnO7 = K2MnO4 + MnO2 + O2 Эндотермическая реакция(H>0) | 2KMnO7 = K2MnO4 + MnO2 + O2 Экзотермическая реакция(H<0) |
Question Title
* 8.
 Выбери процессы эндотермических реакций.
Выбери процессы эндотермических реакций. h3(г) + I2(г) ⟶ 2HI(г)
H= 52 кДж/моль
CaO(тв) ⟶ Ca(тв) + O2(г)
H= 635 кДж/моль
N2(г) + 3h3(г) ⟶ 2Nh4(г)
H= –683 кДж/моль
0 из 8 с ответом
Урок 13. Составление химических уравнений » Kupuk.net
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана Ch5 в кислороде O2 образуются диоксид углерода CO2 и вода h3O. Эта реакция может быть описана химическим уравнением:
- Ch5 + O2 → CO2 + h3O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу Ch5 и сколько молекул CO2 и h3O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы Ch5, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1Ch5 + O2 → 1CO2 + h3O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле h5 = 4H) в составе молекулы Ch5, а в правой – всего 2 атома H в составе молекулы h3O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой h3O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1Ch5 + O2 → 1CO2 + 2h3O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды h3O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2h3O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1Ch5 + 2O2 → 1CO2 + 2h3O или Сh5 + 2O2 → CO2 + 2h3O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя h3O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
- C7H5N3O6 + O2 → CO2 + h3O + N2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + h3O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C7H5N3O6 + O2 → 14CO2 + 5h3O + 3N2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
- 2C7H5N3O6 + 10,5O2 → 14CO2 + 5h3O + 3N2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C7H5N3O6 + 21O2 → 28CO2 + 10h3O + 6N2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C7H5N3O6 + 5,25O2 → 7CO2 + 2,5h3O + 1,5N2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·1023, мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей h3O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C7H5N3O6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- h3O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г h3O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г h3O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2:
Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2:
- CaCO3 + 2HCl → CaCl2 + CO2 + h3O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и h3O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H+ и Cl—. Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H+ и Cl—. Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO3(тв.) + 2H+(водн.) → Ca2+(водн.) + CO2(г.) + h3O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H+, образуя при этом положительный ион Ca2+, CO2 и h3O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Если у вас возникли вопросы, пишите их в комментарии.
Закон сохранения массы веществ. Уравнения химических реакций
Похожие презентации:
Закон сохранения массы веществ. Химические уравнения
Физические и химические явления. Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций
Закон сохранения массы веществ. Химические уравнения
Химическое уравнение. Закон сохранения массы веществ
Химические реакции. Закон сохранения массы веществ
Составление уравнений химических реакций
Уравнения химических реакций. Алгоритм расстановки коэффициентов
Закон сохранения массы веществ
Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ
Закон сохранения
массы веществ.
Уравнения
химических реакций
2. Назовите химические явления. Каковы признаки химических реакций?
скисание молока,
подгорание пищи на сковороде,
испарение жидкой ртути,
почернение серебряных изделий,
образование тумана,
испарение воды,
образование ржавчины,
горение древесины,
таянье льда,
кипение воды,
3.
 Условия хим.реакцийизмельчение
Условия хим.реакцийизмельчение1. Соприкосновение,
или перемешивание
2. Нагревание (t)
3. Увеличение или уменьшение
давления(p) (вакуум)
4. Облучение (hv)
5. Электрический ток или разряд
6. Катализ (kat)
4. Признаки хим.реакций
1. Выделяется газ2. Выпадет осадок
3. Происходит изменение окраски
веществ
4. Выделяется или поглощается тепло,
свет
5. Появление запаха (иногда резкого,
ядовитого)
5. Основные понятия для повторения
Химический знакХимическая формула
Атом
Молекула
Коэффициент
Индекс
Химическая реакция
6. Химическая реакция
Химическими реакциями называютсяявления,
в процессе которых происходит
образование
новых веществ – продуктов реакции
называются явления,
7. Новые понятия
Закон сохранения массы веществУравнение химической реакции
Реагенты
Продукты
8. Разложение молекул воды
2 Н2О = 2Н2 + О29.
 Схема разложения воды↯
Схема разложения воды↯Кислород
и водород
Вода
Атом водорода
Атом кислорода
При химических явлениях
происходит разрушение молекул
исходных веществ и образование
новых молекул из тех же атомов, из
которых состояли исходные
вещества.
11. Формулировка закона сохранения массы веществ
Массавеществ,
вступивших в
реакцию
Масса веществ,
получившихся в
результате
реакции
Число атомов каждого элемента должно
быть одинаково до и после реакции
12. Закон сохранения массы веществ
2 Н О → 2Н + О2
2
2
4Н + 2О → 4Н + 2О
m1
Лавуазье
(1789)
m2
m3
4 • 1 + 2 • 16 = 4 • 1 + 2 • 16
Ломоносов
(1756)
36 =36
m1 = m2 + m3
Пишем уравнения ХР
Решаем задачи по
уравнениям ХР
13. Михаил Васильевич Ломоносов (1711 – 1765)
1. Родился в 1711 году в России2. Русский ученый – природовед
3. Основатель первого в России Московского университета
4.
 Развивал атомно-молекулярные представления о строении веществ
Развивал атомно-молекулярные представления о строении веществ5. Открыл закон
массы веществ
сохранения
14. Значение закона
Способствует дальнейшему развитию химииПозволяет производить важные вычисления
стр 39
На основе данного закона составляют
уравнения химических реакций!
15. Решите задачки
Медь соединяется с серой в массовом отношении 2:1. Дляприготовления 21г сульфида меди (II) сколько
потребуется меди, а сколько серы.
a) Cu – 14 г, S – 7 г
c) Cu – 7 г, S – 14 г
b) Cu – 12 г, S – 9 г
d) Cu – 16 г, S – 5 г
При разложении 4,34 г оксида ртути () образовалось 4,02
г ртути. Масса выделившегося при этом кислорода
равна?
Метан, сгорая в кислороде, образует
углекислый газ и воду.
Эта фраза описывает химическую реакцию
– реакцию горения. Прочитать её может
только умеющий читать по-русски.
Можно ли сократить запись?
Можно ли сделать запись
понятной для не знающего
русского языка?
Так ли это необходимо?
Давайте подчеркнём в исходной фразе
названия веществ.

Метан сгорая в кислороде образует
углекислый газ и воду.
Вместо названий мы можем использовать
химические формулы и тогда каждый знающий
химию поймёт, о каких веществах идёт речь.
метан – СН4
углекислый газ – СО2
кислород – О2
вода – Н2О
18. Метан, сгорая в кислороде, образует углекислый газ и воду.
Этого недостаточно. Остались слова,которые тоже требуют замены.
Метан, сгорая в кислороде, образует
углекислый газ и воду.
Язык какой науки Вы бы предложили для
использования?
Какие знаки этого языка Вы бы отобрали
для решения поставленной перед Вами
проблемы?
Язык науки математики
сгорая в означает «взаимодействует» –
«+»
образует означает «получается» –
«=»
и – это перечисление, веществ может быть и больше
двух –
«+»
На основе того, что вы знаете о
математических уравнениях,
попробуйте записать
химическое
кислороде,
Метан,
сгорая в
СН4
+
углекислый газ
образует
О2
=
воду
и
СО2
+ Н2О
Всё ли мы учли? Проведите вычисления, чтобы
проверить, выполняется ли закон сохранения массы
веществ!
Мr(СН4 ) = 12 + 4*1 = 16
Mr(О2 ) = 2*16 = 32
Mr(СО2 ) = 12 + 2*16 = 44
Mr(Н2О ) = 2*1 + 16 = 18
СН4 + О2 = СО2 + Н2О
16 + 32 = 44
+ 18
?
СН4 + 2О2 = СО2 + 2Н2О
Полученная нами краткая
запись химической реакции
называется уравнением
химической реакции.
Уравнением химической реакции называют
условную запись химической реакции с
помощью химических формул, коэффициентов и
математических знаков.
А почему запись условная?
Запись отражает только какие вещества
вступают в реакцию и какие образуются,
но не учитывает как протекает процесс
превращения.
Вместо знака равенства иногда
используется стрелка:
Например, если не расставлены коэффициенты:
СН4 + О2
СО2 + Н2О
Такую запись называют СХЕМОЙ реакции.
На основе услышанного
составьте уравнение реакции
Красный фосфор энергично сгорает в
кислороде. Подожжем порошок фосфора и
опустим в колбу с кислородом.
В кислороде фосфор горит ослепительным белым пламенем.
Выделяется белый дым — это оксид фосфора пэ-двао-пять или фосфорный ангидрид (оксид фосфора V).
Фосфорный ангидрид (оксид фосфора V) в виде порошка
оседает на стенках колбы.
27. Уравнение химической реакции
2KOH + CuCl2 = Cu(OH)2 + 2KClРеагенты
Вещества, вступившие
в реакцию
Продукты
реакции
Вещества,
образующиеся
в результате реакции
28.
 Запишите названия исходных веществ и продуктов реакции для следующих уравнений химических реакций:а) Fe + S = FeS,
Запишите названия исходных веществ и продуктов реакции для следующих уравнений химических реакций:а) Fe + S = FeS,Исходные вещества ____________________,
Продукты реакции _____________________;
б) Cu (OH)2 = CuO + h3O,
Исходные вещества ____________________,
Продукты реакции _____________________;
в) HCl + NaOH = NaCl + h3O
Исходные вещества ____________________,
Продукты реакции _____________________;
29. Алгоритм составления уравнений химических реакций
1. В левой части записываются формулы веществ,которые вступают в реакцию:
2. В правой части (после стрелки) – формулы
веществ, которые получаются в результате реакции:
3. Затем с помощью коэффициентов уравнивается
число атомов одинаковых химических элементов в
правой и левой частях уравнения :
30. Основные правила расстановки коэффициентов
Расстановку коэффициентов начинают с элемента, чьихатомов в реакции участвует больше.
Количество атомов кислорода до и после реакции в
большинстве случаев должно быть четным.

Если в реакции (обмена) участвуют сложные вещества, то
расстановку коэффициентов начинают с атомов металлов
или с кислотных остатков.
Расстановка коэффициентов
в уравнении химической реакции
4:2
4
2
2 Н2О → 2 Н2 + О2
2
1
Коэффициент
2:1
32. Что показывает химическое уравнение
Какие вещества вступают в реакцию.Какие вещества образуются в результате реакции.
Массу реагирующих веществ и веществ, образующихся
в результате химической реакции.
Отношение масс реагирующих веществ и веществ,
образующихся в результате химической реакции.
33. Расставьте коэффициенты в уравнениях реакции.
1. Cu + O2 CuO2. HCl h3 +Cl2
3. Ag2O + C Ag +CO2
4. ZnO + HNO3 Zn(NO3)2 + h3O
34. Домашнее задание
Расставьте коэффициенты в следующих уравнениях химических реакций:N2 + h3 → Nh4,
MnO2 + h3 → Mn + h3O,
Al + Cl2 → AlCl3,
CaO + P2O5 → Ca3(PO4)2,
KOH + h3SO4 → K2SO4 + h3O,
ZnS + O2 → ZnO + SO2.

35. Домашнее задание
1. При взаимодействии цинка массой 65 г с серойобразовался сульфид цинка (ZnS) массой 97 г. Какая
масса серы вступила в реакцию?
2. В реакцию вступило 9 г алюминия и 127 г йода. Какая
масса йодида алюминия (AlI3) при этом образуется?
36. Составьте уравнения реакций по названию веществ. Расставьте коэффициенты.
1.2.
3.
4.
5.
Цинк + хлорид водорода = хлорид цинка + водород
Железо + хлор = хлорид железа (II)
Калий + сера = сульфид калия
Оксид углерода (II) + кислород = оксид углерода (IV)
Хлорид алюминия = алюминий + хлор
Обратите внимание, что газы
записываются с индексом 2! Стр 39
Нефть – это
чистое вещество
Горение свечи –
химическая реакция
Соль – сложное
вещество
С УХР
ФИНИШ
Составление
уравнений
химических реакций
Фосфор – металл
Кальций – метал
Плавление сахара –
химическое явление
Формула
воды – Н2О
Сера имеет
постоянную
валентность
СТАРТ
Атом химически
делим
Сложное вещество
состоит из разных
веществ
Сложное вещество
состоит из разных хим.
элементов
Снег – это тело
Валентность
водорода
равна I
Кислород –
простое вещество
Морская вода –
чистое вещество
Да
Нет
SO2 + O2 SO3
CO + O2 CO2
K2O + h3O KOH
KClO3 KCl + O2
Al + O2 Al2O3
P2O5 + h3O h4PO4
h3S + O2 h3O + S
Cr2O3 + h3 Cr + h3O
CuO + C Cu + CO2
h3S + O2 h3O + SO2
C2h5 + O2 CO2 + h3O
Mg + h4PO4 Mg3(PO4)2 + h3
Al2O3 + HCl AlCl3 + h3O
CaO + h4PO4 Ca3(PO4)2 + h3O
Ba(OH)2 + HCl BaCl2 + h3O
KOH + h3SO4 K2SO4 + h3O
NaOH + h4PO4 Na3PO4 + h3O
Al2O3 + h3SO4 Al2(SO4)3 + h3O
Nh4 + O2 N2 + h3O
HI h3 + I2
Мg + O2 MgO
Na + S Na2S
HgO Hg + O2
Al + S Al2S3
Ag2O Ag + O2
P + Cl2 PCl5
Pb + O2 PbO
Ch5 C + h3
Al + Br2 AlBr3
Fe + O2 Fe3O4
Na + Cl2 NaCl
English Русский Правила
стехиометрическое соотношение окислителя к горючему
При проектировании и эксплуатации газопламенного оборудования часто возникает вопрос об определении оптимального соотношения количества горючего и окислителя, обеспечивающего их полное сгорание с выделением максимального количества тепловой энергии.
Рассмотрим методику определения оптимального соотношения количества горючего и окислителя на примере: горючий газ – метан (Ch5), окислитель – кислород (O2).
Реакция окисления (горения) метан/кислород:
CH4+2xO2→CO2+2xh3O (1)
Молярная масса одной молекулы: водорода (Н) – 1 г/моль, углерода (C) составляет 12 г/моль, кислород (O) – 16 г/моль. Тогда, молярная масса молекулы метана (CH4) составляет 16 г/моль, а молярная масса молекулы кислорода (O2) составляет 32 г/моль. Как следует из формулы (1), для полного окисления одной молекулы метана (CH4) требуется две молекулы кислорода (O2).
Введем понятие стехиометрического отношения [1] окислителя к горючему (по массе):
где m – масса газа;
ν — количество вещества, моль [2];
M – молярная масса газа;
индекс «ок» — окислитель;
индекс «гг» – горючий газ.
Количество вещества определяется в молях и характеризует число структурных единиц (ими могут быть атомы или молекулы) определяемого вещества, отнесенного к числу структурных единиц (атомов) в 0,012 кг (12 гр) изотопа углерода C12. Из этого следует, что в 0,012 кг (12 гр) изотопа углерода C12 содержится один моль количества вещества. Само число структурных единиц, содержащихся в одном моле вещества, называется числом Авогадро и равно NA = 6,023×1023 моль-1 = 6,023×1026 кмоль-1 [2].
В таком случае количество вещества определяется соотношением:
где N — число структурных единиц (молекул) веществ, участвующих в реакции окисления.
Как указывалось выше, в одном моле любого вещества содержится NA число структурных единиц, при этом у каждого вещества структурная единица обладает своей массой (масса атома, масса молекулы). Следовательно, массой обладает и один моль вещества, эта масса называется молярной массой. В таком случае, если вещество (в частности газ) имеет массу m, а число структурных единиц этого вещества таково, что количества вещества составляет ν, то:
В таком случае, если вещество (в частности газ) имеет массу m, а число структурных единиц этого вещества таково, что количества вещества составляет ν, то:
Тогда, в частном случае, при сгорании метана в кислороде, можно записать:
индекс «O2» — кислород;
индекс «CH4» – метан.
На практике измерять массу газа неудобно и используется измерение объемов газа. Для того, что бы определить потребный объем кислорода для полного сгорания 1 м3 метана, запишем уравнение состояния [2] для каждого из газов:
где p – давление газа;
V – объем газа;
R – универсальная газовая постоянная;
T – температура газа.
Следует заметить, что в момент реакции давление и температура газов будут одинаковыми.
Решим соотношения (5а) и (5б) относительно объемов соответствующих газов и определим стехиометрическое отношение кислорода к метану (по объему):
Т. к. стехиометрическое соотношение кислорода к метану для полного сгорания определено в (4), то определим следующие значения для соотношения (6):
к. стехиометрическое соотношение кислорода к метану для полного сгорания определено в (4), то определим следующие значения для соотношения (6):
В таком случае отношение объема кислорода к объему метана равно 2, т.е. для сжигания 1 м3 метана потребуется 2 м3 кислорода.
Соотношение (6) можно записать более универсально:
Очень часто в газопламенном оборудовании в качестве окислителя используется воздух, а именно содержащийся в воздухе кислород. По данным, приведенным в [1], процентное содержание кислорода в воздухе (по массе) составляет 23,2%. Запишем соотношение:
где индекс «вз» — воздух;
Если в соотношение (8) числитель (масса кислорода) и знаменатель (масса воздуха) помножить на массу горючего газа, который необходимо сжечь (окислить), то можно перейти к стехиометрическим соотношениям (по массе):
Для исследования процесса горения метана в воздухе необходимо в соотношение (9б) подставить значение
тогда получим
т. е. для полного сжигания 1 кг метана требуется 17,24 кг воздуха.
е. для полного сжигания 1 кг метана требуется 17,24 кг воздуха.
Для определения объема воздуха, необходимого для сжигания 1м3 метана, воспользуемся соотношением (7):
где МВЗ = 29 г/моль [1].
В общем виде соотношение (10а) примет вид:
Подставив значения в соотношение (10б), получим, что для сжигания 1 м3 метана потребуется
9,512 м3 воздуха.
Так же в качестве горючих газов часто используются пропан (C3H8) и бутан (C4H10).
Реакция окисления (горения) пропан/кислород и бутан/кислород:
C3H8 + 5xO2 → 3xCO2 + 4xH2O (11)
2xC4H10 + 13xO2 → 8xCO2+10xH2O (12)
Молярные массы: пропана – MC3H8 = 44 г/моль; бутана – MC4H10 = 58 г/моль.
Используя выводы, сделанные для реакции окисления метана и кислорода, получаем, что требуемая масса кислорода (O2) для сжигания 1 кг пропана (C3H8) – 3,636 кг кислорода (O2), а для сжигания 1 кг бутана (C4H10) – 3,586 кг кислорода (O2).
Тогда можем записать:
Учитывая соотношение (9б), определяем, что
т.е. для сжигания 1 кг пропана необходимо 15,672 кг воздуха, а для сжигания 1 кг бутана – 15,457 кг воздуха.
Используя соотношение (7) или (10б), определяем объем кислорода (O2) и воздуха, которые соответственно необходимы для сжигания 1 м3 пропана и 1 м3 бутана, что показано в таблице 1.
Таблица 1. Расход окислителя на 1 кг (1 м3) горючего газа
| Окислитель | Горючий газ | Метан (CH4) | Пропан (C3H8) | Бутан (C4H10) |
| Кислород (O2) | 4 кг (2 м3) | 3,636 кг (5 м3) | 3,586 кг (6,5 м3) |
| Воздух | 17,24 кг (9,512 м3) | 15,672 кг (23,779 м3) | 15,457 кг (30,914 м3) |
Пропан (C3H8) и бутан (C4H10) чаще всего используются не по отдельности, а как смесь горючих газов. Поэтому требуемое количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов.
Поэтому требуемое количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов.
Пусть γ — доля (по массе) содержания пропана в смеси, а β — доля (по массе) содержания бутана в смеси. γ и β подчинены следующему соотношению:
γ + β=1 (13)
Т.к. пропан и бутан не вступают в химические реакции, то стехиометрическое отношение для каждого из газов не будет меняться, а стехиометрическое отношение для пропанобутановой смеси в зависимости от окислителя будет определяться соотношением:
индекс «C3H8 – C4H10» – пропанобутановая смесь.
Значения стехиометрических соотношений в зависимости от процентного содержания пропана и бутана в смеси представлены в таблице 2.
Таблица 2. Стехиометрические отношения (по массе) для пропанобутановых смесей
| Окислитель | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| Кислород (O2) | 3,621 | 3,616 | 3,611 |
| Воздух | 15,607 | 15,586 | 15,565 |
Для того, чтобы определить отношение объема окислителя к объему пропанобутановой смеси, обеспечивающее полное сгорание, согласно соотношению (7) необходимо определить молярную массу пропанобутановой смеси — MC3H8-C4H10.
Для этого воспользуемся законом Дальтона [1]:
Надо учитывать, что в законе Дальтона как температура каждого из газов и их смеси, так и объем, занимаемый как отдельным газом, так и их смесью, одинаковы.
Выразив давление для пропана, бутана, а так же их смеси через уравнение состояния, аналогично (5а) и (5б), можем перейти к следующему соотношению:
Учитывая, что
соотношение (16) можно переписать:
Значения молярных масс пропанобутановых смесей для наиболее используемых соотношений γ и β, приведены в таблице 3.
Таблица 3. Молярные массы пропанобутановых смесей
| Молярная масса | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| MC3H8-C4H10 | 47,435 | 48,702 | 50,039 |
Тогда в соответствии с соотношением (7) или (10б) можно рассчитать стехиометрические соотношения (по объему) для различных пропанобутановых смесей, что и приведено в таблице 4.
Таблица 4. Стехиометрические отношения (по объему) для пропанобутановых смесей
| Окислитель | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| Кислород (O2) | 5,368 | 5,503 | 5,647 |
| Воздух | 25,529 | 26,175 | 26,857 |
Следует заметить, что полученные значения расхода окислителя (как по массе, так и по объему) на единицу горючего газа, следует увеличить на 2-5%, т.к. в воздухе и техническом кислороде присутствуют другие компоненты, которые под действием высоких температур горения сами вступают в реакцию окисления и тем самым снижают долю окислителя, приходящуюся на горючий газ.
Так же согласно [1] и [2] закон Дальтона и уравнение состояния соблюдаются в диапазоне низких давлений. Тем не менее, большинство газопламенного оборудования используется при давлениях
до 5 МПа, что позволяет применять как полученные соотношения, так и приведенные значения.
Газопламенное оборудование, спроектированное ООО «Машпроект» (сайт: машпроект.рф
E-mail:
Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript
), обеспечивает оптимальное сгорание горючих газов, как в кислороде, так и в воздухе. Поэтому наша продукция обладает высокой топливной эффективностью и, как следствие, низкими эксплуатационными затратами.
СПИСОК ЛИТЕРАТУРЫ
1. Глинка Н.Л. Общая химия – Л.: Химия, 1979. – 720 с.
2. Савельев И.В. Общий курс физики. Т. 1 – М.: Наука, 1977 – 416 с.
Acetyl
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
3.9: Энергия химических реакций
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 17002
- Сюзанна Ваким и Мандип Грюал
- Колледж Бьютт
Медленное горение
Эти старые железные цепи выделяют небольшое количество тепла при ржавчине. Ржавление железа — это химический процесс. Это происходит, когда железо и кислород вступают в химическую реакцию, похожую на горение или горение. Химическая реакция, которая происходит, когда что-то горит, очевидно, выделяет энергию. Вы можете чувствовать жар, и вы можете увидеть свет пламени. Ржавление железа — гораздо более медленный процесс, но он все же выделяет энергию. Просто он высвобождает энергию так медленно, что вы не можете обнаружить изменение температуры.
Ржавление железа — гораздо более медленный процесс, но он все же выделяет энергию. Просто он высвобождает энергию так медленно, что вы не можете обнаружить изменение температуры.
Что такое химическая реакция?
химическая реакция — это процесс, в ходе которого одни химические вещества превращаются в другие. Вещество, которое начинает химическую реакцию, называется реагентом , , а вещество, образующееся в результате химической реакции, называется продуктом . В ходе реакции реагенты расходуются на создание продуктов.
Другим примером химической реакции является горение газообразного метана, показанное на рисунке \(\PageIndex{2}\). В этой химической реакции реагентами являются метан (Ch5) и кислород (O2), а продуктами являются углекислый газ (CO2) и вода (h3O). Как показывает этот пример, химическая реакция включает разрыв и образование химических связей. Химические связи – это силы, удерживающие вместе атомы молекулы. Связи возникают, когда атомы разделяют электроны. Например, при горении метана разрываются связи внутри молекул метана и кислорода, а в молекулах углекислого газа и воды образуются новые связи.
Химические связи – это силы, удерживающие вместе атомы молекулы. Связи возникают, когда атомы разделяют электроны. Например, при горении метана разрываются связи внутри молекул метана и кислорода, а в молекулах углекислого газа и воды образуются новые связи.
Химические уравнения
Химические реакции могут быть представлены химическими уравнениями. Химическое уравнение — это символический способ показать, что происходит во время химической реакции. Например, горение метана можно представить химическим уравнением:
\[\ce{CH_4 + 2O_2 \rightarrow CO_2 + 2 H_2O}\]
Стрелка в химическом уравнении отделяет реагенты от продуктов и показывает направление, в котором протекает реакция. Если бы реакция могла происходить и в противоположном направлении, использовались бы две стрелки, указывающие в противоположных направлениях. Цифра 2 перед О 2 и H 2 O показывает, что в реакции участвуют две молекулы кислорода и две молекулы воды. Если задействована только одна молекула, перед химическим символом не ставится число.
Если задействована только одна молекула, перед химическим символом не ставится число.
Роль энергии в химических реакциях
Ржавление или горение вещества являются типичными примерами химических изменений. Химические изменения включают химические реакции, в которых некоторые вещества, называемые реагентами, изменяются на молекулярном уровне с образованием новых веществ, называемых продуктами. Все химические реакции требуют энергии. Однако не все химические реакции выделяют энергию, как при ржавчине и горении. В некоторых химических реакциях энергия поглощается, а не выделяется.
Экзергонические реакции
Химическая реакция, которая высвобождает энергию, называется экзергонической реакцией . Этот тип реакции может быть представлен общим химическим уравнением:
\[\mathrm{Реагенты \rightarrow Продукты + Энергия}\]
Помимо ржавчины и горения, примеры экзотермических реакций включают соединение хлора с натрием с образованием поваренной соли. При разложении органического вещества также выделяется энергия из-за экзергонических реакций. Иногда холодным утром из-за этих химических реакций из компостной кучи поднимается пар (см. рис. \(\PageIndex{3}\)). Экзергонические химические реакции происходят и в клетках живых существ. В химическом процессе, похожем на горение, называемом клеточным дыханием, сахарная глюкоза «сгорает», чтобы обеспечить клетки энергией.
При разложении органического вещества также выделяется энергия из-за экзергонических реакций. Иногда холодным утром из-за этих химических реакций из компостной кучи поднимается пар (см. рис. \(\PageIndex{3}\)). Экзергонические химические реакции происходят и в клетках живых существ. В химическом процессе, похожем на горение, называемом клеточным дыханием, сахарная глюкоза «сгорает», чтобы обеспечить клетки энергией.
Эндергонические реакции
Химическая реакция, которая поглощает энергию, называется эндергонической реакцией . Этот тип реакции также может быть представлен общим химическим уравнением:
\[\mathrm{Реагенты + Энергия \rightarrow Продукты}\]
Использовали ли вы когда-нибудь химический холодный компресс, как на картинке ниже? Пачка остывает из-за эндергонической реакции. Когда трубка внутри упаковки разрывается, выделяется химическое вещество, которое вступает в реакцию с водой внутри упаковки. Эта реакция поглощает тепловую энергию и быстро охлаждает содержимое упаковки.
Когда трубка внутри упаковки разрывается, выделяется химическое вещество, которое вступает в реакцию с водой внутри упаковки. Эта реакция поглощает тепловую энергию и быстро охлаждает содержимое упаковки.
Многие другие химические процессы включают эндергонические реакции. Например, в большинстве случаев приготовления пищи и выпечки используется энергия для проведения химических реакций. Вы не можете испечь пирог или сварить яйцо без добавления тепловой энергии. Возможно, наиболее важные эндергонические реакции происходят во время фотосинтеза. Когда растения производят сахар путем фотосинтеза, они потребляют световую энергию для обеспечения необходимых эндергонических реакций. Сахар, который они производят, обеспечивает растения и практически все другие живые существа глюкозой для клеточного дыхания.
Энергия активации
Для запуска всех химических реакций требуется энергия. Даже реакции, которые высвобождают энергию, нуждаются в энергии, чтобы начаться. Энергия, необходимая для начала химической реакции, называется , энергия активации . Энергия активации подобна толчку, который нужен ребенку, чтобы начать спускаться с горки на игровой площадке. Толчок дает ребенку достаточно энергии, чтобы начать двигаться, но как только он начинает двигаться, он продолжает двигаться, и его снова не подталкивают. Энергия активации показана на рисунке \(\PageIndex{5}\).
Энергия, необходимая для начала химической реакции, называется , энергия активации . Энергия активации подобна толчку, который нужен ребенку, чтобы начать спускаться с горки на игровой площадке. Толчок дает ребенку достаточно энергии, чтобы начать двигаться, но как только он начинает двигаться, он продолжает двигаться, и его снова не подталкивают. Энергия активации показана на рисунке \(\PageIndex{5}\).
Почему для запуска всех химических реакций требуется энергия? Чтобы началась реакция, молекулы реагентов должны столкнуться друг с другом, поэтому они должны двигаться, а движение требует энергии. Когда молекулы реагентов сталкиваются, они могут отталкиваться друг от друга из-за межмолекулярных сил, раздвигающих их. Преодоление этих сил, чтобы молекулы могли собраться вместе и вступить в реакцию, также требует энергии.
Рисунок \(\PageIndex{5}\): На этой диаграмме энергии активации реагенты показаны слева, а продукты справа. Обратите внимание, что реагенты имеют более высокий энергетический уровень, чем продукты; так что эта реакция высвобождает энергию в целом. Но для запуска реакции требуется энергия — это энергия активации реакции.
Но для запуска реакции требуется энергия — это энергия активации реакции.Обзор
- Что такое химическая реакция?
- Определите реагенты и продукты химической реакции.
- Перечислите три примера обычных изменений, связанных с химическими реакциями.
- Дайте определение химической связи.
- Что такое химическое уравнение? Приведите пример.
- Наши клетки используют глюкозу (C 6 H 12 O 6 ) для получения энергии в ходе химической реакции, называемой клеточным дыханием. В этой реакции шесть молекул кислорода (O 2 ) реагируют с одной молекулой глюкозы. Ответьте на следующие вопросы об этой реакции.
- Сколько атомов кислорода содержится в одной молекуле глюкозы?
- Напишите, как будет выглядеть реагентная часть этого уравнения.
- Сколько всего атомов кислорода содержится в реагентах? Объясните, как вы рассчитали ответ.

- Сколько всего атомов кислорода содержится в продуктах? Можно ли ответить на этот вопрос, не зная, что это за продукты? Почему или почему нет?
- Ответьте на следующие вопросы относительно уравнения, которое вы видели выше: CH 4 + 2O 2 → CO 2 + 2H 2 O
- Может ли диоксид углерода (CO 2 ) превратиться в метан (CH 4 ) и кислород (O 2 ) в этой реакции? Почему или почему нет?
- Сколько молекул двуокиси углерода (CO 2 ) образуется в этой реакции?
- Является ли превращение жидкой воды в водяной пар химической реакцией? Почему или почему нет
- Почему рвутся связи в реагентах во время химической реакции?
- Сравните эндергонические и экзергонические химические реакции. Приведите пример каждого.
- Определить энергию активации.
- Объясните, почему для всех химических реакций требуется энергия активации.

- Тепло – это форма ____________.
- В какой реакции происходит подвод тепла к реагентам?
- В какой реакции выделяется тепло?
- Если бы к эндотермической реакции не добавлялась тепловая энергия, происходила бы эта реакция? Почему или почему нет?
- Если бы к экзотермической реакции не добавлялась тепловая энергия, происходила бы эта реакция? Почему или почему нет?
- Объясните, почему химический охлаждающий компресс кажется холодным при активации.
- Объясните, почему клеточное дыхание и фотосинтез «противоположны» друг другу.
- Объясните, как солнце косвенно дает энергию нашим клеткам.
Принадлежности
- Цепочка от Daplaza, лицензия CC BY-SA 3.0 через Wikimedia Commons
- Горелка газовой плиты Blue Flame от Federico Cardoner, лицензия CC BY 2.0 через Flickr
- Пропаривание компоста от Lucabon, CC BY-SA 4.0 через Wikimedia Commons
- Cooler pack от Julie Magro, лицензия CC BY 2.
 0 через Flickr
0 через Flickr - Энергия активации от Ханы Завадской для лицензии CK-12 CC BY-NC 3.0
- Текст адаптирован из книги «Биология человека» по лицензии CK-12, лицензия CC BY-NC 3.0
Эта страница под названием 3.9: Энергия в химических реакциях распространяется под лицензией CK-12 и была создана, изменена и/или курирована Сюзанной Ваким и Мандипом Грюалом с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts. ; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Сюзанна Ваким и Мандип Гревал
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- СК-12
- Версия лицензии
- 3,0
- Программа OER или Publisher
- Программа ASCCC OERI
- Показать оглавление
- да
- Теги
- энергия активации
- Химические связи
- химическое уравнение
- эндергонические реакции
- экзергоническая реакция
- продукт
- реагент
- источник@https://www.
 ck12.org/book/ck-12-human-biology/
ck12.org/book/ck-12-human-biology/
Теплоты, свободные энергии и константы равновесия некоторых реакций с участием O2, h3, h3O, C, CO, CO2 и Ch5
%PDF-1.4 % 298 0 объект > эндообъект 293 0 объект >поток application/pdf
 0 Paper Capture2011-01-25T10:48:52-05:00Adobe Acrobat 9.02012-04-16T15:12:59-04:002012-04-16T15:12:59-04:00uuid:0eae586f-6907 -4a2e-a115-870f1d11e5fbuuid:e34d84d3-e213-4316-9270-6db3fd4ecad0uuid:0eae586f-6907-4a2e-a115-870f1d11e5fbdefault1
0 Paper Capture2011-01-25T10:48:52-05:00Adobe Acrobat 9.02012-04-16T15:12:59-04:002012-04-16T15:12:59-04:00uuid:0eae586f-6907 -4a2e-a115-870f1d11e5fbuuid:e34d84d3-e213-4316-9270-6db3fd4ecad0uuid:0eae586f-6907-4a2e-a115-870f1d11e5fbdefault1 OriginalDocumentIDURI
OriginalDocumentIDURIВлияние O2 и Ch5 на присутствие и активность местного метанотрофного сообщества в почве рисовых полей
. 2000 г., декабрь; 2(6):666-79.
2000 г., декабрь; 2(6):666-79.
doi: 10.1046/j.1462-2920.2000.00149.x.
Т Хенкель 1 , П. Рослев, Р. Конрад
принадлежность
- 1 Макс-Планк-Институт наземной микробиологии, Марбург, Германия.
- PMID: 11214799
- DOI: 10.1046/j.1462-2920.2000.00149.x
T Хенкель и соавт. Окружающая среда микробиол. 2000 9 декабря0034
. 2000 г., декабрь; 2(6):666-79.
doi: 10. 1046/j.1462-2920.2000.00149.x.
1046/j.1462-2920.2000.00149.x.
Авторы
Т Хенкель 1 , П. Рослев, Р. Конрад
принадлежность
- 1 Макс-Планк-Институт наземной микробиологии, Марбург, Германия.
- PMID: 11214799
- DOI: 10.1046/j.1462-2920.2000.00149.x
Абстрактный
Активность и распространение метанотрофов в почве зависят от наличия Х5 и О2. Поэтому мы исследовали активность и структуру метанотрофного сообщества в почве рисового поля при четырех факторных сочетаниях высоких и низких концентраций Х5 и О2. Структура метанотрофной популяции была определена с помощью денатурирующего градиентного гель-электрофореза (DGGE) с использованием различных наборов праймеров для ПЦР, нацеленных на ген 16S рРНК и два функциональных гена, кодирующих ключевые ферменты метанотрофов, т.е. ). Изменения биомассы метанотрофных бактерий типа I и II в рисовой почве определяли путем анализа биомаркеров жирных кислот, связанных с фосфолипидами и эфирами (PLFA). Относительный вклад метанотрофов I и II типов в измеренную метанокислительную активность определяли путем мечения образцов почвы 14Ch5 с последующим анализом [14C]-PLFA. Окисление Ch5 подавлялось высоким содержанием O2 (20,5%) и усиливалось низким содержанием O2 (1%). В зависимости от соотношения смешивания Ch5 и O2, различные метанотрофные сообщества развивались с более высоким разнообразием при низкой, чем при высокой концентрации Ch5, что было выявлено методом PCR-DGGE. Однако преобладания популяций типа I или II не было обнаружено. Отпечатки пальцев [14C]-PLFA, с другой стороны, показали, что активность окисления Ch5 преобладала у метанотрофов типа I в инкубациях с низкими соотношениями смешивания Ch5 (1000 p.
Структура метанотрофной популяции была определена с помощью денатурирующего градиентного гель-электрофореза (DGGE) с использованием различных наборов праймеров для ПЦР, нацеленных на ген 16S рРНК и два функциональных гена, кодирующих ключевые ферменты метанотрофов, т.е. ). Изменения биомассы метанотрофных бактерий типа I и II в рисовой почве определяли путем анализа биомаркеров жирных кислот, связанных с фосфолипидами и эфирами (PLFA). Относительный вклад метанотрофов I и II типов в измеренную метанокислительную активность определяли путем мечения образцов почвы 14Ch5 с последующим анализом [14C]-PLFA. Окисление Ch5 подавлялось высоким содержанием O2 (20,5%) и усиливалось низким содержанием O2 (1%). В зависимости от соотношения смешивания Ch5 и O2, различные метанотрофные сообщества развивались с более высоким разнообразием при низкой, чем при высокой концентрации Ch5, что было выявлено методом PCR-DGGE. Однако преобладания популяций типа I или II не было обнаружено. Отпечатки пальцев [14C]-PLFA, с другой стороны, показали, что активность окисления Ch5 преобладала у метанотрофов типа I в инкубациях с низкими соотношениями смешивания Ch5 (1000 p. p.m.v.) и во время инициации потребления Ch5 независимо от O2 или соотношения смешивания Ch5. При высоких соотношениях смеси метана (10 000 частей на миллион по объему) метанотрофы типа I и II в равной степени вносили вклад в измеренный метаболизм Ch5. В совокупности метанотрофы I типа реагировали быстро и с выраженными сдвигами в структуре популяции и доминировали в активности на всех четырех газовых смесях. С другой стороны, метанотрофы типа II, хотя, по-видимому, более многочисленны, всегда присутствуют и демонстрируют в значительной степени стабильную структуру популяции, становятся активными позже и вносят свой вклад в активность окисления Ch5, главным образом, при высоких соотношениях смешивания Ch5.
p.m.v.) и во время инициации потребления Ch5 независимо от O2 или соотношения смешивания Ch5. При высоких соотношениях смеси метана (10 000 частей на миллион по объему) метанотрофы типа I и II в равной степени вносили вклад в измеренный метаболизм Ch5. В совокупности метанотрофы I типа реагировали быстро и с выраженными сдвигами в структуре популяции и доминировали в активности на всех четырех газовых смесях. С другой стороны, метанотрофы типа II, хотя, по-видимому, более многочисленны, всегда присутствуют и демонстрируют в значительной степени стабильную структуру популяции, становятся активными позже и вносят свой вклад в активность окисления Ch5, главным образом, при высоких соотношениях смешивания Ch5.
Похожие статьи
Разнообразие гена метанмонооксигеназы твердых частиц в метанотрофных образцах из разных почв рисовых полей в Китае и на Филиппинах.
Хоффманн Т.
 , Хорц Х.П., Кемниц Д., Конрад Р.
Хоффманн Т. и соавт.
Сист Appl Microbiol. 2002 авг; 25 (2): 267-74. дои: 10.1078/0723-2020-00104.
Сист Appl Microbiol. 2002.
PMID: 12353882
, Хорц Х.П., Кемниц Д., Конрад Р.
Хоффманн Т. и соавт.
Сист Appl Microbiol. 2002 авг; 25 (2): 267-74. дои: 10.1078/0723-2020-00104.
Сист Appl Microbiol. 2002.
PMID: 12353882Применение зондирования стабильных изотопов фосфолипидных жирных кислот и рРНК на китайском рисовом поле для изучения активности и состава метанотрофных бактериальных сообществ in situ.
Цю Кью, Нолл М., Абрахам В.Р., Лу Ю., Конрад Р. Цю Кью и др. ISME J. 2008 Jun;2(6):602-14. doi: 10.1038/ismej.2008.34. Epub 2008 3 апр. ИСМЕ Дж. 2008. PMID: 18385771
Численность и активность некультивируемых метанотрофных бактерий, участвующих в потреблении атмосферного метана в двух лесных почвах.
Колб С., Книф С., Данфилд П.Ф., Конрад Р.
 Колб С. и др.
Окружающая среда микробиол. 2005 г., август 7(8):1150-61. doi: 10.1111/j.1462-2920.2005.00791.x.
Окружающая среда микробиол. 2005.
PMID: 16011752
Колб С. и др.
Окружающая среда микробиол. 2005 г., август 7(8):1150-61. doi: 10.1111/j.1462-2920.2005.00791.x.
Окружающая среда микробиол. 2005.
PMID: 16011752Почвенные микроорганизмы как регуляторы атмосферных малых газов (h3, CO, Ch5, OCS, N2O, NO).
Конрад Р. Конрад Р. Microbiol Rev. 1996 Dec;60(4):609-40. doi: 10.1128/мр.60.4.609-640.1996. Microbiol Rev. 1996. PMID: 8987358 Бесплатная статья ЧВК. Обзор.
Физиология, биохимия и специфические ингибиторы окисления Ch5, Nh5+ и СО метанотрофами и нитрификаторами.
Бедар С, Ноулз Р. Бедар С и др. Microbiol Rev. 1989 Mar; 53(1):68-84. дои: 10.1128/мр.53.1.68-84.1989. Microbiol Rev. 1989. PMID: 2496288 Бесплатная статья ЧВК.
 Обзор.
Обзор.
Посмотреть все похожие статьи
Цитируется
Вариации концентрации и изотопного состава углерода биомаркеров метанотрофов в осоковых торфяниках по градиенту высот в горах Чанбайшань, Китай.
Чжао М., Ван М., Чжао И., Цзян М., Ван Г. Чжао М. и др. Фронт микробиол. 2022 18 мая; 13:892430. doi: 10.3389/fmicb.2022.892430. Электронная коллекция 2022. Фронт микробиол. 2022. PMID: 35663857 Бесплатная статья ЧВК.
Филогения и метаболический потенциал метанотрофной линии MO3 у Beijerinckiaceae из рисовой почвы посредством реконструкции генома на основе метагенома.
Цай Ю, Юн Дж, Цзя З. Кай Ю и др. Микроорганизмы. 2022 1 мая; 10 (5): 955. doi: 10.
 3390/microorganisms10050955.
Микроорганизмы. 2022.
PMID: 35630399
Бесплатная статья ЧВК.
3390/microorganisms10050955.
Микроорганизмы. 2022.
PMID: 35630399
Бесплатная статья ЧВК.Множественные группы метанотрофных бактерий опосредуют окисление метана в бескислородных отложениях озер.
Су Г., Цопфи Дж., Ниманн Х., Леманн М.Ф. Су Г и др. Фронт микробиол. 2022 9 мая; 13:864630. doi: 10.3389/fmicb.2022.864630. Электронная коллекция 2022. Фронт микробиол. 2022. PMID: 35615497 Бесплатная статья ЧВК.
Генерация кислорода посредством расщепления воды новым биогенным соединением, связывающим ионы металлов.
Дершвиц П., Бандоу Н.Л., Ян Дж., Семрау Дж.Д., МакЭллистрем М.Т., Хайнце Р.А., Фонсека М., Ледесма Дж.К., Дженнетт Дж.Р., ДиСпирито А.М., Атвал Н.С., Харгроув М.С., Бобик Т.А., Зишка Х., ДиСпирито А.
 А.
Дершвиц П. и соавт.
Appl Environ Microbiol. 2021 25 июня; 87 (14): e0028621. doi: 10.1128/AEM.00286-21. Epub 2021 25 июня.
Appl Environ Microbiol. 2021.
PMID: 33962982
Бесплатная статья ЧВК.
А.
Дершвиц П. и соавт.
Appl Environ Microbiol. 2021 25 июня; 87 (14): e0028621. doi: 10.1128/AEM.00286-21. Epub 2021 25 июня.
Appl Environ Microbiol. 2021.
PMID: 33962982
Бесплатная статья ЧВК.Влияние напряжения кислорода на микробное сообщество и функциональную экспрессию генов аэробного окисления метана в сочетании с системами денитрификации.
Chu YX, Ma RC, Wang J, Zhu JT, Kang YR, He R. Чу YX и др. Environ Sci Pollut Res Int. 2020 апр;27(11):12280-12292. doi: 10.1007/s11356-020-07767-8. Epub 2020 28 января. Environ Sci Pollut Res Int. 2020. PMID: 31993906
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Какие продукты в Ch5 O2 Ch5 CO2 h3O?
Сгорание метана или октана экзотермическое; он высвобождает энергию. Ch5 + 2 O2 → CO2 + 2 h3O + энергия Энергии продуктов ниже, чем энергии реагентов.
Что представляют собой продукты Adobe? Adobe Acrobat .
Ch5 + 2 O2 → CO2 + 2 h3O + энергия Энергии продуктов ниже, чем энергии реагентов.
Что представляют собой продукты Adobe? Adobe Acrobat .
Какие продукты Ch5 O2 CO2 h3O?
Реакция называется реакцией горения. Когда эта реакция имеет место, результатом является 90 488 углекислого газа (CO2), вода (h3O) 90 489 и большое количество энергии. При сжигании метана выделяется только углекислый газ и вода.
Что является продуктом Ch5 и O2?
Это также одна из многих окислительно-восстановительных реакций. Чтобы распознать горение углеводорода, должно быть соединение, в котором есть только углерод и водород или только углерод, водород и кислород. Он также будет иметь O2 в качестве другого реагента. Продуктами будут углекислого газа и воды.
Что является продуктом Ch5 h3O?
Ch5 + h3O → Ch4OH + h3 – Сбалансированное уравнение | Химические уравнения онлайн!
Какие продукты реакции полного сгорания?
Полное сгорание углеводородов (без примесей) в присутствии достаточного количества кислорода дает водяной пар и двуокись углерода .
Что такое Ch5 в химии?
Метан (Ch5) Метан – это бесцветный легковоспламеняющийся газ без запаха, который является простейшим углеводородом и основным компонентом природного газа. … Метан присутствует в атмосфере Земли в низких концентрациях и действует как парниковый газ.
Что восстанавливается в реакции ниже Ch5 O2 CO2 h3O?
Ch5 + 2O2 -> CO2 + 2ч30. Это окислительно-восстановительная реакция? … В этой реакции на стороне реагента углерод теряет водород с образованием двуокиси углерода . Итак, здесь углерод окисляется, а кислород получает водород и восстанавливается.
Является ли Ch5 h30 эндотермическим?
При более высокой температуре первоначально образовавшиеся CO2 и h3O превращались в CO и h3 в результате реакций Ch5+h3O и Ch5+CO2, которые являются эндотермическими реакциями .
Сколько молей CO2 и h3O образуется?
1 моль молекул C12h32O11 дает 12 молей молекул CO2 и 11 молей молекул h3O.
Какой продукт образуется в результате химического превращения?
Физическое изменение, такое как изменение состояния или растворение, не создает новую субстанцию, но химическое изменение создает. В химической реакции взаимодействующие друг с другом атомы и молекулы называются реагентами. В химической реакции атомы и молекулы, образующиеся в результате реакции, называются продуктами.
Что является продуктом сгорания водорода?
В пламени чистого газообразного водорода, горящего на воздухе, водород (h3) реагирует с кислородом (O2) с образованием воды (h3O) и выделяет энергию. При сжигании водорода вместо чистого кислорода, как это обычно бывает, в атмосферном воздухе вместе с водяным паром могут образовываться небольшие количества окислов азота.
Как реагенты превращаются в продукты в ходе химической реакции?
Реагенты и продукты химической реакции содержат одни и те же атомы, но в ходе реакции они перегруппировываются. В результате атомов попадают в различные комбинации в продукты . Это делает продукты новыми веществами, химически отличными от реагентов.
В результате атомов попадают в различные комбинации в продукты . Это делает продукты новыми веществами, химически отличными от реагентов.
Какой продукт образуется при взаимодействии диоксида углерода с водой?
Углекислый газ растворяется в воде и медленно реагирует с водой с образованием угольной кислоты .
Какие продукты образуются во всех реакциях горения в модели 2?
Все реакции горения включают соединение углеводорода с кислородом с образованием воды и двуокиси углерода .
Ответы на вопросы: Что такое продукты реакции горения?
Реакция горения связана с газообразным кислородом, и продуктом обычно является двуокись углерода и вода . Реакции горения также могут высвобождать энергию в виде тепла или света.
Какие побочные продукты сжигания метана?
Когда метан горит в воздухе, он имеет голубое пламя. При достаточном количестве кислорода метан сгорает с выделением углекислого газа (CO2) и воды (h3O) . Когда он подвергается сгоранию, он выделяет большое количество тепла, что делает его очень полезным в качестве источника топлива.
Когда он подвергается сгоранию, он выделяет большое количество тепла, что делает его очень полезным в качестве источника топлива.
Какие 3 молекулы являются продуктами сгорания метана?
Метан соединяется с 2 кислородом с образованием двуокиси углерода, воды и тепла .
Какие продукты фотосинтеза?
Фотосинтез превращает углекислый газ и воду в кислород и глюкозу. Глюкоза используется растением в качестве пищи, а кислород является побочным продуктом.
Какие продукты CO2 h3O h3CO3?
Если снять крышку с бутылки с газированным безалкогольным напитком, угольная кислота высвободит углекислый газ: h3CO3 (водн.) → h3O (л) + CO2 (г) .
Какова формула CO2·h3O?
CO2 + h3O → h3CO3 – Сбалансированное уравнение | Химические уравнения онлайн!
Какие продукты C6h22O6 O2?
C6h22O6 — глюкоза, сахар. Если он полностью сгорит, единственными двумя продуктами будут углекислый газ и вода . Кислород также будет присутствовать из атмосферы. Ниже показано несбалансированное уравнение.
Кислород также будет присутствовать из атмосферы. Ниже показано несбалансированное уравнение.
Является ли CO2 продуктом или реагентом?
Кислород и глюкоза являются реагентами. Реагенты – это вещества, изменяющиеся в ходе химической реакции. Углекислый газ и вода являются продуктами .
Что такое C6h22O6 6O2 → 6CO2 6h3O?
C6h22O6 + 6O2 -> 6CO2 + 6h3O. Выход 2755 кДж/моль глюкозы . Обратная реакция — соединение углекислого газа и воды с образованием сахара — называется фотосинтезом. Фотосинтез — это процесс, ответственный за хранение всей энергии, которую мы извлекаем из ископаемого топлива, сельскохозяйственных культур и всей нашей пищи.
Что является восстановителем в Ch5 2O2 → CO2 2h3O?
Окислителем здесь является кислород (O2). Кислород окисляет монооксид углерода (CO) до диоксида углерода (CO2), который является высшим оксидом углерода. Таким образом, кислород является окислителем и окись углерода восстановитель в этой реакции.
Ch5 окисляется или восстанавливается?
Наиболее восстановленная форма углерода – Ch5, наиболее окисленная – CO2.
Является ли Ch5 восстановителем?
При сгорании метана молекулярный кислород является окислителем, а метан — восстановителем . … При каталитическом гидрировании пропилена молекулярный водород является восстановителем, а пропилен – окислителем.
Является ли O2 реагентом или продуктом?
Они указывают количество каждого химического вещества, которое вступает в реакцию или образуется. Метан и кислород (кислород — двухатомный — двухатомный — элемент) — реагенты , а углекислый газ и вода — продукты.
Что такое реагент в химическом уравнении?
Вещества слева от стрелки в химическом уравнении называются реагентами. Реагент — это вещество, присутствующее в начале химической реакции . Вещества справа от стрелки называются продуктами.
Как найти моли произведенного CO2?
Рассчитайте количество молей CO2 по формуле n=PV/RT , где P — давление, полученное на этапе 3, V — объем, полученный на этапе 2, T — температура, полученная на этапе 1, а R — константа пропорциональности. равно 0,0821 л атм/К моль.
равно 0,0821 л атм/К моль.
Сколько молей CO2 образуется?
Если молярное отношение равно 1 к 2 (где 1 моль кислорода реагирует с реагентом и дает 2 моля диоксида углерода), то 2 x 0,2732 моля 9будет произведено 0489 углекислого газа.
Сколько молей CO2 образуется из 2,5 молей O2?
Таким образом, получается 1,5 моль углекислого газа.
Какой образуется новый продукт?
Ответ: Химические изменения заставляют вещество превращаться в полностью вещество с новой химической формулой. Химические изменения также известны как химические реакции. «Ингредиенты» реакции называются реагентами, а конечные результаты называются продуктами 9.0489 .
Какие продукты химической реакции?
Химические реакции происходят при образовании или разрыве химических связей между атомами. Вещества, вступающие в химическую реакцию, называются реагентами, а вещества, образующиеся в конце реакции , называются продуктами.
Как образуются продукты?
Продукты – вещества, образующиеся в результате химических реакций . В ходе химической реакции реагенты превращаются в продукты после прохождения высокоэнергетического переходного состояния. Этот процесс приводит к потреблению реагентов. … Материалы реактивны, а реагенты перестраиваются во время химической реакции.
В ходе химической реакции реагенты превращаются в продукты после прохождения высокоэнергетического переходного состояния. Этот процесс приводит к потреблению реагентов. … Материалы реактивны, а реагенты перестраиваются во время химической реакции.
Wolfram|Alpha Примеры: Химия
О-о! Wolfram|Alpha не работает без JavaScript.
Пожалуйста, включите JavaScript. Если вы не знаете, как это сделать, вы можете найти инструкции здесь. Как только вы это сделаете, обновите эту страницу, чтобы начать использовать Wolfram|Alpha.
Примеры для
Химия изучает материю, от отдельных атомов и ионов до больших биомолекул. С помощью Wolfram|Alpha вы можете исследовать данные о химических соединениях, реакциях, в которых они участвуют, растворимости и теории химических графов. Он также содержит информацию о химических количествах, преобразовании единиц измерения, расчетах молярности и стехиометрии. Используйте Wolfram|Alpha, чтобы ответить на вопросы по химии, будь то домашнее задание или просто любопытство.
Используйте Wolfram|Alpha, чтобы ответить на вопросы по химии, будь то домашнее задание или просто любопытство.
Используйте Wolfram|Alpha для изучения элементов периодической таблицы.
Найти количество элементов:
сколько элементов в таблице МенделееваПолучить информацию о химическом элементе:
углеродНайти элементы, отвечающие заданным критериям:
10 самых плотных элементовНачертить свойство класса элементов:
точки плавления щелочноземельных металловБольше примеровИоныУзнайте о положительно и отрицательно заряженных ионах и их свойствах.
Получить информацию об ионе:
хрома(III)Сравнить несколько ионов:
Nh5+, N-3, PO4-3Сравнить ионы данного элемента:
ионы марганцаНайти конкретное значение свойства для класса ионов :
заряда многоатомных ионовБольше примеровХимические реакции Используйте Wolfram|Alpha, чтобы сбалансировать химические уравнения, определить стехиометрию реакции и предсказать продукты.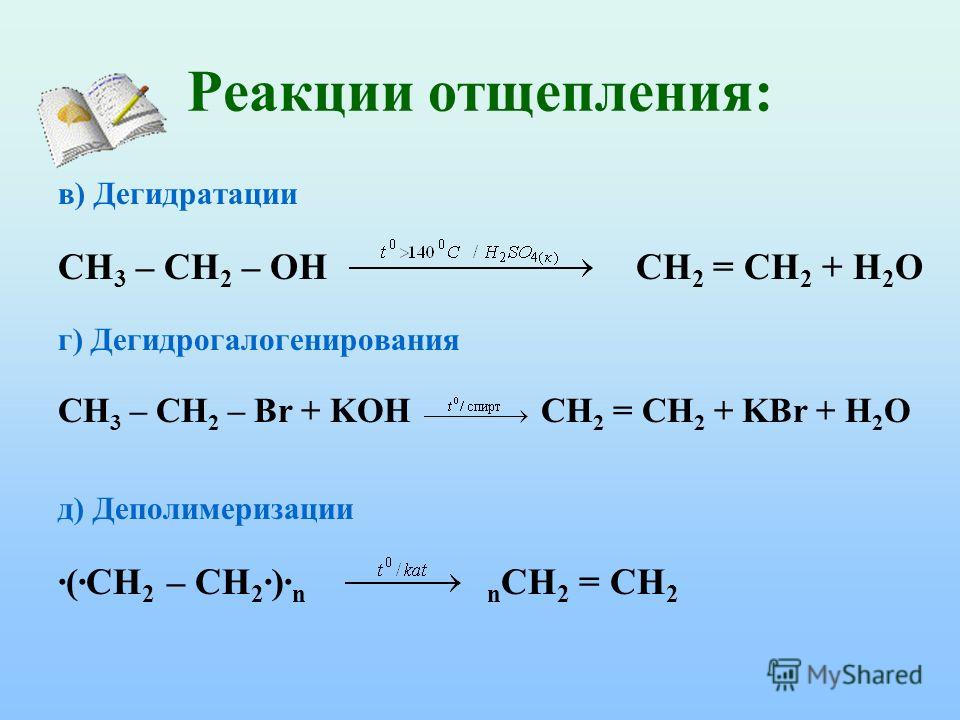
Сбалансируйте химическое уравнение:
октан + O2 -> вода + CO2Рассчитайте стехиометрию реакции:
0,2 моль Ch5 + O2 -> 7 мл h3O + CO2Поиск химических реакций с использованием реагентов или продуктов:
водород + кислород -> нитратыДругие примерыХимияИспользуйте Wolfram|Alpha для изучения химико-информатических свойств с помощью инвариантов графов, таких как индекс J Балабана или индекс Индекс Hosoya для дескрипторов QSAR, таких как количество доноров водорода или самая длинная цепь.
Найдите наибольшую общую подструктуру между двумя молекулами:
максимальная общая подструктура АТФ и кофеинаНайдите ароматические атомы:
какова ароматическая структура 4-метокситрифениламинаНайдите доноров и акцепторов водородных связей:
сколько акцепторов водородных связей в фуретидинеВычислите набор топологических индексов для молекулы:
графические свойства L- 2-аминомасляная кислотаБольше примеровЯдерная химия Исследуйте ядерную химию с помощью Wolfram|Alpha.
Напишите символ нуклида:
Какой символ нуклида у кислорода-14Найдите номер нейтрона:
кальций-40 номер нейтронаРассчитать энергию связи:
энергия связи тантала-175Исследовать источник элементов:
Откуда взялся вольфрам? Дополнительные примерыХимические соединенияПоиск химических веществ по названию, химической формуле или другому идентификатору.
Получить информацию о химическом соединении:
Указать соединение по химическому идентификатору:
InChI=1/C8H8O3/c1-11-8-4-6(5-9)2-3-7(8)10/h3 -5,10H,1h4Сравните различные органические химические вещества:
оксалилдигидразид и N,N-ди-N-бутилформамидСм. примеры липидов, включая глицерофосфолипиды, жирные кислоты и т. д.:
фосфатидилхолинДругие примерыХимические количестваВычислите экстенсивные свойства химических веществ, которые зависят от количества присутствующего вещества, и преобразуйте количества в различные единицы.
Введите количества по массе:
500 мг нитрата серебра 12 фунтов 4-цианоиндолаНайдите количество молей из заданной массы:
2 кг гидрофосфата кальция в молиПереведите количества в объемы: 930 атомов гелия в литрыДругие примерыХимическая термодинамика
Вычисление термодинамических свойств, таких как энтропия, теплоемкость или давление паров, для самых разных химических веществ.
Найти свойства вещества в заданной фазе:
газ триметиламинВычислить свойства при заданной температуре:
давление паров этанола при 300KВыполнить расчеты по уравнению Аррениуса:
2,3-метано-5,6-дихлоринденДругие примерыКвантовая химияСвяжите химические свойства с лежащей в основе квантово-механической природой атомов и молекул.
Соберите электронную конфигурацию:
Электронную конфигурацию никеляСоберите орбитальную диаграмму основного состояния:
Орбитальную диаграмму железаНайдите атомный радиус:
Каков атомный радиус S?Подсчитайте количество валентных электронов:
Сколько валентных электронов в Bi?Еще примерыGO Далее
Пошаговые растворы для химии
Связанные примеры
Связанная WOLFRAM668
3. 9007 Связанная WOLFRAM668
Исследуйте свойства различных растворов, которые зависят от растворителя, растворенного вещества и концентрации.
Вычислить свойства химического раствора:
концентрированная уксусная кислотаВычислите свойства количества раствора:
100 мл 1,5 молярного K2CO3 в ТГФВыполните расчеты титрования:
титрование сильной кислотой водаБольше примеровФункциональные группыИсследуйте функциональные группы, такие как цианаты, пероксиды, алканы и галогениды.
Получить информацию о функциональной группе:
нитрил функциональная группа альдегидная группаПолучить информацию о защитной группе:
Эфир МОМНайдите поведение защитной группы в определенных условиях:
стабильность амида FMOC + цинкДругие примерыСвязи и орбитали Исследуйте свойства электронных орбиталей и связей, которые они образуют. Найдите связи по составляющим их атомам, по типу связи или по исходному химическому веществу.
Получить сводную информацию о связях для химического вещества:
информация о связях цис-циклононеновой цепи какова энергия связи в ацетонитрилеВычислить гибридизацию в соединении:
гибридизация триметиламинаСравните гибридизацию в двух соединениях:
гибридизация тротила и бензолаБольше примеровИсследование эволюции Pd-Pt, нанесенного на оксид церия, для сухого и влажного окисления метана
Исследование эволюции Pd-Pt, нанесенного на оксид церия, для сухого и мокрое окисление метана
Скачать PDF
Скачать PDF
- Артикул
- Открытый доступ
- Опубликовано:
- Нурия.
 Дж. Дивинс
ORCID: orcid.org/0000-0001-6010-5419 1,2,3 ,
Дж. Дивинс
ORCID: orcid.org/0000-0001-6010-5419 1,2,3 , - Андреа Брага ORCID: orcid.org/0000-0001-6913-4013 1,2 ,
- Ксавьер Вендрелл 1,2 ,
- Изабель Серрано ORCID: orcid.org/0000-0002-4996-9280 1 ,
- Ксения Гарсия 1,2,3 ,
- Луис Солер ORCID: orcid.org/0000-0003-1591-3366 1,2,3 ,
- Илария Лучентини 1,2 ,
- Майла Даниэлис ORCID: orcid.org/0000-0001-8469-9282 4 ,
- Andrea Mussio 4 ,
- Sara Colussi 4 ,
- Ignacio J. Villar-Garcia 5 ,
- Carlos Escudero ORCID: orcid.org/0000-0001-8716-9391 5 ,
- Алессандро Троварелли 4 и
- …
- Хорди Льорка
ORCID: orcid.
 org/0000-0002-7447-9582 1,2,3
org/0000-0002-7447-9582 1,2,3
Связь с природой том 13 , Номер статьи: 5080 (2022) Процитировать эту статью
1600 доступов
27 Альтметрический
Сведения о показателях
Субъекты
- Синтез катализаторов
- Каталитические механизмы
- Гетерогенный катализ
Abstract
Эффективная очистка выбросов метана на транспорте остается сложной задачей. Здесь мы исследуем палладиевые и платиновые моно- и биметаллические катализаторы на основе церия, синтезированные механическим измельчением и традиционной пропиткой для полного окисления метана в сухих и влажных условиях, воспроизводящие катализаторы, присутствующие в выхлопных газах транспортных средств, работающих на природном газе. Применяя набор синхротронных методов in situ (рентгеновская дифракция, рентгеновская абсорбция и фотоэлектронная спектроскопия при атмосферном давлении) вместе с просвечивающей электронной микроскопией, мы показываем, что метод синтеза сильно влияет на взаимодействие и структуру в наномасштабе. Наши результаты показывают, что компоненты размолотых катализаторов обладают более высокой способностью превращать металлический Pd в разновидности оксида Pd, сильно взаимодействующие с носителем, и достигать модулированного соотношения PdO/Pd, чем катализаторы, синтезированные традиционным способом. Мы демонстрируем, что уникальные структуры, получаемые при измельчении, являются ключевыми для каталитической активности и коррелируют с более высокой конверсией метана и более длительной стабильностью во влажном сырье.
Здесь мы исследуем палладиевые и платиновые моно- и биметаллические катализаторы на основе церия, синтезированные механическим измельчением и традиционной пропиткой для полного окисления метана в сухих и влажных условиях, воспроизводящие катализаторы, присутствующие в выхлопных газах транспортных средств, работающих на природном газе. Применяя набор синхротронных методов in situ (рентгеновская дифракция, рентгеновская абсорбция и фотоэлектронная спектроскопия при атмосферном давлении) вместе с просвечивающей электронной микроскопией, мы показываем, что метод синтеза сильно влияет на взаимодействие и структуру в наномасштабе. Наши результаты показывают, что компоненты размолотых катализаторов обладают более высокой способностью превращать металлический Pd в разновидности оксида Pd, сильно взаимодействующие с носителем, и достигать модулированного соотношения PdO/Pd, чем катализаторы, синтезированные традиционным способом. Мы демонстрируем, что уникальные структуры, получаемые при измельчении, являются ключевыми для каталитической активности и коррелируют с более высокой конверсией метана и более длительной стабильностью во влажном сырье.
Введение
Материалы на основе палладия-платины, отдельно или в сочетании с Rh, являются современными катализаторами для различных систем доочистки выхлопных газов мобильных источников 1,2,3,4 . Биметаллические составы, содержащие Pd и Pt, используются в транспортных средствах, работающих на природном газе (NGV), для сокращения выбросов несгоревшего метана 5,6,7 , который является мощным парниковым газом с потенциалом глобального потепления в 86 раз больше, чем у CO 2 на 20-летнем периоде и в 34 раза выше на 100-летнем горизонте 8 . Из-за экспоненциального роста числа автомобилей на природном газе за последние несколько лет, чему также способствовало увеличение числа транспортных средств, работающих на возобновляемом природном газе 9,10 , решение проблемы и сокращение выбросов метана в атмосферу стало вызывать все большую озабоченность, и оптимизация каталитическая система вызывает растущий интерес 7,11,12 . Добавление платины в катализаторы на основе Pd, которые широко признаны наиболее активными в окислении метана, доказало свою эффективность в повышении устойчивости катализатора к отравлению серой 13,14,15 и деактивация, вызванная большим содержанием пара в выхлопных газах 16,17,18,19 .
Добавление платины в катализаторы на основе Pd, которые широко признаны наиболее активными в окислении метана, доказало свою эффективность в повышении устойчивости катализатора к отравлению серой 13,14,15 и деактивация, вызванная большим содержанием пара в выхлопных газах 16,17,18,19 .
В последние несколько лет было предпринято много усилий для определения роли платины в активности и стабильности катализатора. Подавляющее большинство результатов было получено с использованием инструментов ex situ. Тем не менее, идентификация фактически работающих активных сайтов и понимание их эволюции требует методов in situ и operando 20,21 . В связи с этим с помощью рентгеновской абсорбционной спектроскопии тонкой структуры (XAFS) in situ было обнаружено, что окисление Pd является необходимым условием для CH 4 активность горения 22 . Улучшенная активность биметаллических Pd-Pt катализаторов во влажных условиях сопровождалась недостатком поверхностного кислорода, чего не происходило при сухом обедненном метаном сырье, где кислород отравлял Pt 23 . В условиях низкотемпературного сжигания обедненной смеси CH 4 также было обнаружено, что в то время как монометаллический Pd-катализатор полностью окислялся при температуре 473–773 K, катализатор Pd-Pt (отношение Pd:Pt 2:1) показал сосуществование Pd и PdO в том же диапазоне температур. Это указывало на то, что Pt способствовала образованию восстановленной фазы Pd, которая считалась менее активной, чем PdO, для горения метана 24 . С помощью XAFS in situ проследили эволюцию биметаллического катализатора PtPd, оценив его более высокую устойчивость к спеканию по сравнению с образцом, содержащим только Pd, благодаря образованию структуры ядро-оболочка 25 . Недавнее исследование с помощью рентгеновской фотоэлектронной спектроскопии (AP-XPS) при давлении, близком к атмосферному, показало, что в бедных условиях Pd имеет тенденцию к полному окислению, что делает менее ясным вклад платины в каталитическую активность по сравнению с поведением в стехиометрические условия, где биметаллический катализатор показывает более низкую температуру зажигания, приписываемую сосуществованию Pd 2+ и Pd 0 , чему способствует присутствие Pt 26 .
В условиях низкотемпературного сжигания обедненной смеси CH 4 также было обнаружено, что в то время как монометаллический Pd-катализатор полностью окислялся при температуре 473–773 K, катализатор Pd-Pt (отношение Pd:Pt 2:1) показал сосуществование Pd и PdO в том же диапазоне температур. Это указывало на то, что Pt способствовала образованию восстановленной фазы Pd, которая считалась менее активной, чем PdO, для горения метана 24 . С помощью XAFS in situ проследили эволюцию биметаллического катализатора PtPd, оценив его более высокую устойчивость к спеканию по сравнению с образцом, содержащим только Pd, благодаря образованию структуры ядро-оболочка 25 . Недавнее исследование с помощью рентгеновской фотоэлектронной спектроскопии (AP-XPS) при давлении, близком к атмосферному, показало, что в бедных условиях Pd имеет тенденцию к полному окислению, что делает менее ясным вклад платины в каталитическую активность по сравнению с поведением в стехиометрические условия, где биметаллический катализатор показывает более низкую температуру зажигания, приписываемую сосуществованию Pd 2+ и Pd 0 , чему способствует присутствие Pt 26 . Ранее с помощью XPS in situ было определено, что поверхностная доля Pd 2+ зависит от содержания Pt 27 . Несмотря на некоторое кажущееся противоречие в результатах, которое, вероятно, связано с разными условиями эксперимента, соотношением Pd:Pt и содержанием кислорода, все эти работы сходятся во мнении о сильном влиянии платины на электронное состояние Pd и, следовательно, на каталитические свойства.
Ранее с помощью XPS in situ было определено, что поверхностная доля Pd 2+ зависит от содержания Pt 27 . Несмотря на некоторое кажущееся противоречие в результатах, которое, вероятно, связано с разными условиями эксперимента, соотношением Pd:Pt и содержанием кислорода, все эти работы сходятся во мнении о сильном влиянии платины на электронное состояние Pd и, следовательно, на каталитические свойства.
Все вышеупомянутые исследования in situ относятся к катализаторам Pd-Pt, нанесенным на оксид алюминия. Однако ключевым фактором, влияющим на активность катализаторов на основе Pd, является носитель, и среди протестированных оксидов CeO 9Известно, что 0058 2 играет решающую роль в повышении каталитической активности и стабильности при окислении метана 28 . Более того, подложка также оказывает большое влияние на перестройку биметаллических наночастиц, и для успешного отслеживания их реорганизации in situ требуются оперативные методы 21,29 . Кроме того, было продемонстрировано, что метод синтеза оказывает огромное влияние на каталитическую эффективность 30,31,32,33 . В связи с этим с помощью механохимического измельчения, которое является простым, экологически чистым (без использования растворителей) методом и легко внедряется в промышленность, повышена активность и стабильность PtPd/CeO 9Катализатор 0058 2 сравнивали с монометаллическим Pd/CeO 2 и с тем же образцом, приготовленным с помощью традиционной пропитки для начального увлажнения, испытанного при окислении обедненного метана во влажном состоянии 34 .
Кроме того, было продемонстрировано, что метод синтеза оказывает огромное влияние на каталитическую эффективность 30,31,32,33 . В связи с этим с помощью механохимического измельчения, которое является простым, экологически чистым (без использования растворителей) методом и легко внедряется в промышленность, повышена активность и стабильность PtPd/CeO 9Катализатор 0058 2 сравнивали с монометаллическим Pd/CeO 2 и с тем же образцом, приготовленным с помощью традиционной пропитки для начального увлажнения, испытанного при окислении обедненного метана во влажном состоянии 34 .
В этой работе мы исследуем серию моно- и биметаллических Pd и Pt CeO 2 катализаторов, полученных механическим измельчением с использованием набора методов in situ, включая синхротронную рентгеновскую дифракцию, XAFS и AP-XPS. и наблюдения с помощью просвечивающей электронной микроскопии высокого разрешения (HRTEM). Объединяя результаты этих методов, мы получаем фундаментальное представление о границе раздела металл-церий, влиянии добавления Pt на его эволюцию, структуре и поверхности катализаторов горения метана в соответствующих условиях газомоторного топлива, т. е. в присутствии пара и низкие температуры, условия, необходимые для соответствия будущим нормам. Исследования in situ и наблюдения HRTEM показывают наличие высокодинамичной структуры в механически синтезированных катализаторах с модулированным отношением Pd/PdO, претерпевающих отчетливую реорганизацию в условиях реакции, и мы в конечном итоге соотносим эту информацию с каталитическими характеристиками.
е. в присутствии пара и низкие температуры, условия, необходимые для соответствия будущим нормам. Исследования in situ и наблюдения HRTEM показывают наличие высокодинамичной структуры в механически синтезированных катализаторах с модулированным отношением Pd/PdO, претерпевающих отчетливую реорганизацию в условиях реакции, и мы в конечном итоге соотносим эту информацию с каталитическими характеристиками.
Результаты и обсуждение
Синтез и активация катализаторов
Механохимический синтез является простым, экологически чистым и легко масштабируемым методом, при котором для приготовления катализаторов не используются растворители 32 . Методом механического измельчения были синтезированы четыре катализатора (обозначены ММ): 1) монометаллический катализатор Pd-CeO 2 с концентрацией 1,5 мас.%; (2) монометаллический катализатор Pt-CeO 2 1,5 мас.%; (3) катализатор PtPd-CeO 2 , где 1,5 мас.% Pd сначала измельчали с CeO 2 , и затем его измельчали с 1,5 мас. % Pt; и (4) катализатор PdPt-CeO 2 , где порядок измельчения был обратным (1,5 % масс. Pt сначала размалывали с CeO 2 , а затем добавляли 1,5 % масс. Pd и впоследствии измельчали; обратите внимание на разницу в порядке измельчения). металлы в номенклатуре) 34 . Кроме того, катализатор PdPt/CeO 2 , приготовленный традиционной пропиткой по начальной влажности (обозначаемый как IWI), также был синтезирован в качестве эталонного материала (см. Методы), где совместно пропитывались Pd и Pt, и он был прокален при 1173 K.
% Pt; и (4) катализатор PdPt-CeO 2 , где порядок измельчения был обратным (1,5 % масс. Pt сначала размалывали с CeO 2 , а затем добавляли 1,5 % масс. Pd и впоследствии измельчали; обратите внимание на разницу в порядке измельчения). металлы в номенклатуре) 34 . Кроме того, катализатор PdPt/CeO 2 , приготовленный традиционной пропиткой по начальной влажности (обозначаемый как IWI), также был синтезирован в качестве эталонного материала (см. Методы), где совместно пропитывались Pd и Pt, и он был прокален при 1173 K.
Первоначально была проведена обработка старением в условиях сжигания сухого обедненного метана до максимальных температур выхлопа газовых двигателей 11 . Обработка состояла из цикла температурно-программируемого сжигания (TPC) до 1173 K (обозначается как обработка TPC1173) в сухой обедненной метановой смеси (0,5% CH 4 , 2% O 2 , сбалансированная по He, GHSV = 2 × 10 5 h −1 ). При 1173 K температуру выдерживали в течение 1 мин, а затем катализаторы охлаждали до комнатной температуры (КТ) (рис. S1a).
При 1173 K температуру выдерживали в течение 1 мин, а затем катализаторы охлаждали до комнатной температуры (КТ) (рис. S1a).
Эволюция кристаллической структуры при сухом сжигании метана
Кристаллическая структура образцов и их эволюция в условиях реакции (подробности см. в разделе «Методы») были исследованы методом SXRD in situ. В таблице S1 указан размер кристаллитов, полученный с помощью уравнения Шеррера. (1) для свежеприготовленных катализаторов и после обработки TPC1173.
Первоначально отслеживалась структурная реорганизация, происходившая во время обработки TPC1173. На рисунке 1 показаны дифрактограммы пяти катализаторов, исследованных в условиях ТФХ при комнатной температуре (свежие образцы), при 1173 K и при 443 K во время линейного охлаждения (см. рис. S2 для серии дифрактограмм и S3 для эволюции нормированная массовая доля при нагреве и охлаждении образца Pd-CeO 2 ММ). Свежие катализаторы ММ показывают только широкие пики, что указывает на присутствие небольших металлических наночастиц (НЧ) Pd и Pt (рис. 1а). PdO можно обнаружить только для катализатора PdPt/CeO 2 IWI, так как он уже прокален. Ясно, что во время линейного нагрева НЧ становятся больше и более кристаллическими (рис. 1b). Интересно, что фазы, образующиеся при 1173 K, зависят от метода синтеза, ММ по сравнению с ИВИ и порядка процесса измельчения. В областях металлических Pd и Pt размолотые биметаллические образцы показывают два пика, из которых более заметным является пик, соответствующий последнему добавленному в процессе измельчения металлу. Напротив, биметаллический катализатор IWI показывает один асимметричный пик. Во время линейного охлаждения фазы реорганизуются (рис. 1c и S2). При 443 K Pd-CeO 2 Катализатор MM демонстрирует наименее кристаллическую фазу Pd вместе с наибольшим вкладом PdO. С другой стороны, Pt-CeO 2 MM и биметаллические катализаторы демонстрируют более высокую степень кристалличности. Катализатор PdPt/CeO 2 IWI демонстрирует асимметричный пик, что, вероятно, указывает на образование сплава PdPt, поскольку положение этого пика находится между положениями Pd(111) и Pt(111), как и ожидалось для сплав.
1а). PdO можно обнаружить только для катализатора PdPt/CeO 2 IWI, так как он уже прокален. Ясно, что во время линейного нагрева НЧ становятся больше и более кристаллическими (рис. 1b). Интересно, что фазы, образующиеся при 1173 K, зависят от метода синтеза, ММ по сравнению с ИВИ и порядка процесса измельчения. В областях металлических Pd и Pt размолотые биметаллические образцы показывают два пика, из которых более заметным является пик, соответствующий последнему добавленному в процессе измельчения металлу. Напротив, биметаллический катализатор IWI показывает один асимметричный пик. Во время линейного охлаждения фазы реорганизуются (рис. 1c и S2). При 443 K Pd-CeO 2 Катализатор MM демонстрирует наименее кристаллическую фазу Pd вместе с наибольшим вкладом PdO. С другой стороны, Pt-CeO 2 MM и биметаллические катализаторы демонстрируют более высокую степень кристалличности. Катализатор PdPt/CeO 2 IWI демонстрирует асимметричный пик, что, вероятно, указывает на образование сплава PdPt, поскольку положение этого пика находится между положениями Pd(111) и Pt(111), как и ожидалось для сплав. Асимметрия пика, вероятно, связана с некоторыми металлическими Pd и/или Pt, которые остаются сегрегированными. Что касается концентрации PdO, катализаторы MM содержат большее количество, чем IWI.
Асимметрия пика, вероятно, связана с некоторыми металлическими Pd и/или Pt, которые остаются сегрегированными. Что касается концентрации PdO, катализаторы MM содержат большее количество, чем IWI.
a При комнатной температуре, b 1173 K и c 443 K (во время охлаждения). Положение пиков, отмеченных *, смещено из-за температуры ( λ = 0,5157 Å). Механическое фрезерование ММ, пропитка IWI по начальной влажности.
Увеличить
Эволюция кристаллической структуры при влажном горении метана
После цикла TPC1173 была дозирована влажная обедненная метановая горючая смесь, в которой присутствовало 10 % водяного пара (0,5 % CH 4 , 2 % O 2 , 10 % H 2 O, остальное He). . Под влажной смесью образцы нагревались от 443 до 723 К (10 К мин -1 ), при этом температура выдерживалась в течение 2 ч для отслеживания эволюции фаз при работе СПГ. На рис. 2 показано изменение массовой доли, полученной в результате уточнения Ритвельда, в условиях влажного горения метана (серия дифрактограмм показана на рис. S4 и S5). Монометаллический Pd-CeO 9Катализатор 0058 2 MM показывает наибольшую долю PdO (около 95 мас.%) среди всех образцов, которая остается постоянной в течение 2 часов во влажных условиях (рис. 2а), и металлический Pd в качестве неосновной фазы. В монометаллическом Pt-CeO 2 MM обнаруживается только металлическая Pt и не наблюдаются намеки на оксиды Pt (рис. S6). Интересно, что в двух биметаллических размолотых образцах отчетливо видны разные фазы. В начале влажных экспериментов при 443 K PtPd-CeO 2 MM состоит в основном из металлического Pd и, в меньших количествах, из PdO, сплава PdPt и Pt (рис. 2b). В течение 2 часов в условиях влажной реакции при 723 К количество PdO монотонно увеличивалось за счет металлического Pd, что указывает на то, что присутствие влажной смеси постепенно окисляет металлический Pd с образованием PdO.
На рис. 2 показано изменение массовой доли, полученной в результате уточнения Ритвельда, в условиях влажного горения метана (серия дифрактограмм показана на рис. S4 и S5). Монометаллический Pd-CeO 9Катализатор 0058 2 MM показывает наибольшую долю PdO (около 95 мас.%) среди всех образцов, которая остается постоянной в течение 2 часов во влажных условиях (рис. 2а), и металлический Pd в качестве неосновной фазы. В монометаллическом Pt-CeO 2 MM обнаруживается только металлическая Pt и не наблюдаются намеки на оксиды Pt (рис. S6). Интересно, что в двух биметаллических размолотых образцах отчетливо видны разные фазы. В начале влажных экспериментов при 443 K PtPd-CeO 2 MM состоит в основном из металлического Pd и, в меньших количествах, из PdO, сплава PdPt и Pt (рис. 2b). В течение 2 часов в условиях влажной реакции при 723 К количество PdO монотонно увеличивалось за счет металлического Pd, что указывает на то, что присутствие влажной смеси постепенно окисляет металлический Pd с образованием PdO. И наоборот, биметаллический PdPt-CeO 9Катализатор 0058 2 MM изначально показывает более низкую массовую долю металлического Pd, чем PtPd-CeO 2 MM, и большую концентрацию Pt, при этом массовые доли PdO, Pd и Pt аналогичны (рис. 2c). Для этого катализатора окисление Pd в PdO происходит более резко, чем для PtPd-CeO 2 MM, и концентрация PdO увеличивается в меньшей степени с течением времени (TOS).
И наоборот, биметаллический PdPt-CeO 9Катализатор 0058 2 MM изначально показывает более низкую массовую долю металлического Pd, чем PtPd-CeO 2 MM, и большую концентрацию Pt, при этом массовые доли PdO, Pd и Pt аналогичны (рис. 2c). Для этого катализатора окисление Pd в PdO происходит более резко, чем для PtPd-CeO 2 MM, и концентрация PdO увеличивается в меньшей степени с течением времени (TOS).
a – e Для указанных катализаторов. f Конверсия PtPd-CeO в метан 2 MM в режиме непрерывной работы при 723°K в течение 24 ч в условиях влажного обедненного метана (0,5% CH 4 , 2% O 2 , 10% H 2 О, остальное Не). Механическое фрезерование ММ, пропитка IWI по начальной влажности.
Изображение в полный размер
Дальнейшее исследование постепенного увеличения PdO для PtPd-CeO 2 MM, который был лучшим катализатором во влажной атмосфере среди рассмотренных 34 , катализатор PtPd-CeO 2 MM, обработанный в лаборатории в течение 24 часов под TOS во влажном состоянии при 723 K, был изучен в условиях in situ. Измерения на месте начинались с непосредственного дозирования влажной реакционной смеси при комнатной температуре и повышения температуры до 723 К (10 К мин 90 334 –1 90 335 ). Этот эксперимент также имитирует операцию старт-стоп рабочего цикла. Как видно на рис. 2д, на этой стадии реакции концентрация PdO сохраняет тенденцию к росту, а количество металлического Pd продолжает снижаться. Примечательно, что тест каталитической активности был проведен в течение 24 часов во влажных условиях в лаборатории, и была получена не только стабильная работа, но и было зарегистрировано устойчивое увеличение конверсии метана в течение 24 часов во влажных условиях по сравнению с TOS (рис. 2f). , демонстрируя, что измельченный катализатор не дезактивируется в присутствии пара. Это согласуется с каталитическими характеристиками, о которых сообщалось в нашей предыдущей работе, где образец, измельченный с металлическим Pd, а затем с металлическим Pt, проявлял одновременно улучшенную каталитическую активность и стабильность при длительном воздействии реакции 34 . Здесь анализ SXRD in situ дополнительно показывает, что увеличение конверсии метана происходит параллельно увеличению концентрации PdO, что позволяет сопоставить постепенное образование PdO с улучшением каталитических характеристик. Этот результат ранее также наблюдался для систем PtPd-оксид алюминия 22,35,36 . Однако в отношении этих образцов PtPd-церия следует подчеркнуть, что, согласно последним литературным данным, катализатор, проявляющий наибольшую активность и стабильность, т. е. PtPd-CeO 2 ММ, для которого отношение PdO/Pd становится близким к единице (рис. 2б) и остается таким (рис.
2f). , демонстрируя, что измельченный катализатор не дезактивируется в присутствии пара. Это согласуется с каталитическими характеристиками, о которых сообщалось в нашей предыдущей работе, где образец, измельченный с металлическим Pd, а затем с металлическим Pt, проявлял одновременно улучшенную каталитическую активность и стабильность при длительном воздействии реакции 34 . Здесь анализ SXRD in situ дополнительно показывает, что увеличение конверсии метана происходит параллельно увеличению концентрации PdO, что позволяет сопоставить постепенное образование PdO с улучшением каталитических характеристик. Этот результат ранее также наблюдался для систем PtPd-оксид алюминия 22,35,36 . Однако в отношении этих образцов PtPd-церия следует подчеркнуть, что, согласно последним литературным данным, катализатор, проявляющий наибольшую активность и стабильность, т. е. PtPd-CeO 2 ММ, для которого отношение PdO/Pd становится близким к единице (рис. 2б) и остается таким (рис. 2д) во время ТОС, что ясно указывает на то, что не только увеличение фазы PdO, но и подходящее соотношение PdO/Pd необходимо для достижения активных и стабильных каталитических характеристик 37,38,39 . Это также подтверждается различными каталитическими характеристиками, достигаемыми PtPd-CeO 2 MM (наиболее активный и стабильный катализатор) и PdPt-CeO 2 MM, т.е. образцом с обратным порядком измельчения.
2д) во время ТОС, что ясно указывает на то, что не только увеличение фазы PdO, но и подходящее соотношение PdO/Pd необходимо для достижения активных и стабильных каталитических характеристик 37,38,39 . Это также подтверждается различными каталитическими характеристиками, достигаемыми PtPd-CeO 2 MM (наиболее активный и стабильный катализатор) и PdPt-CeO 2 MM, т.е. образцом с обратным порядком измельчения.
Наблюдаются очевидные различия между катализаторами IWI (рис. 2d) и катализаторами MM. Первоначально катализатор PdPt/CeO 2 IWI состоит в основном из металлического Pd и большей доли сплава PdPt, чем катализаторы MM. Что наиболее важно, для образца IWI количество металлического Pd становится выше с увеличением температуры в условиях влажной реакции, что является противоположной тенденцией, наблюдаемой для катализаторов MM.
Эволюция параметров решетки для пяти исследованных катализаторов представлена на рис. С7 и С8. Ни для одного из катализаторов искажение CeO 2 или решетки металлов, и можно было обнаружить только тепловое расширение из-за температуры.
Ни для одного из катализаторов искажение CeO 2 или решетки металлов, и можно было обнаружить только тепловое расширение из-за температуры.
Эволюция электронной структуры при сухом сжигании метана
Получить информацию о взаимодействии между Pd, Pt и Ce на наиболее активных и представительных катализаторах, а именно Pd-CeO 2 MM и PtPd-CeO 2 MM 34 , локальное электронное окружение и структура Pd K-края и Pt L 3 -края были исследованы методом XAS in situ в условиях работы NGV (см. Методы) и сравнивались с образцами IWI.
На рис. 3a, b показаны спектры рентгеновского поглощения Pd K-края (XANES) свежеприготовленного Pd-CeO 2 MM и PtPd-CeO 2 MM, соответственно, во время обработки TPC1173. . Первоначально свежий монометаллический образец состоит из смеси восстановленных и окисленных частиц Pd, которые постепенно окисляются по мере повышения температуры реакции и проявляют локальную структуру, подобную PdO, в соответствии с результатами SXRD, изложенными выше. Величина преобразования Фурье (FT) данных расширенной тонкой структуры рентгеновского поглощения (EXAFS) показана на рис. 3c, d. Они показывают сосуществование связей Pd-Pd от металлического Pd и связей Pd-O в свежих катализаторах и постепенное увеличение вклада связей Pd-O, параллельное уменьшению вклада Pd-Pd, при повышении температуры реакции 40 . Данные FT-EXAFS для свежего Pd-CeO 2 MM показывают, что Pd очень хорошо диспергирован, поскольку координационное число (КЧ) для первой координационной оболочки Pd-Pd составляет 7,5 ± 0,6, что соответствует НЧ размером ок. 1 нм 41 , а КЧ для связей Pd-O составляет 0,7 ± 0,2 (таблица S2 и рис. S10). Аналогичная локальная структура Pd обнаружена в PtPd-CeO 2 MM с КЧ первой оболочки Pd-M (M = Pd, Pt) 6,9 ± 0,4 и Pd-O КЧ 1,0 ± 0,2. При 650 К Pd практически полностью окисляется в образце Pd-CeO 2 MM и аналогичная тенденция наблюдается для PtPd-CeO 2 MM. При температурах выше 650 К связи Pd-Pd не обнаружены ни для одного из образцов, что свидетельствует о полном окислении катализаторов выше этой температуры.
Величина преобразования Фурье (FT) данных расширенной тонкой структуры рентгеновского поглощения (EXAFS) показана на рис. 3c, d. Они показывают сосуществование связей Pd-Pd от металлического Pd и связей Pd-O в свежих катализаторах и постепенное увеличение вклада связей Pd-O, параллельное уменьшению вклада Pd-Pd, при повышении температуры реакции 40 . Данные FT-EXAFS для свежего Pd-CeO 2 MM показывают, что Pd очень хорошо диспергирован, поскольку координационное число (КЧ) для первой координационной оболочки Pd-Pd составляет 7,5 ± 0,6, что соответствует НЧ размером ок. 1 нм 41 , а КЧ для связей Pd-O составляет 0,7 ± 0,2 (таблица S2 и рис. S10). Аналогичная локальная структура Pd обнаружена в PtPd-CeO 2 MM с КЧ первой оболочки Pd-M (M = Pd, Pt) 6,9 ± 0,4 и Pd-O КЧ 1,0 ± 0,2. При 650 К Pd практически полностью окисляется в образце Pd-CeO 2 MM и аналогичная тенденция наблюдается для PtPd-CeO 2 MM. При температурах выше 650 К связи Pd-Pd не обнаружены ни для одного из образцов, что свидетельствует о полном окислении катализаторов выше этой температуры. После измерений ТФХ катализаторы охлаждали в гелии до комнатной температуры и собирали спектры, где для монометаллического катализатора обнаруживается более развитая структура PdO.
После измерений ТФХ катализаторы охлаждали в гелии до комнатной температуры и собирали спектры, где для монометаллического катализатора обнаруживается более развитая структура PdO.
a , b XANES спектры Pd-CeO 2 MM и PtPd-CeO 2 MM соответственно. c , d Величина FT спектров EXAFS катализаторов Pd-CeO 2 MM и PtPd-CeO 2 MM. Спектры, обозначенные как 298 K/He, были получены после серии реакций при комнатной температуре в He. Также показаны эталонные спектры для фольги Pd и эталона PdO. Механическое фрезерование ММ.
Полноразмерное изображение
Образцы, которые были подвергнуты обработке TPC1173 в лаборатории, также были исследованы (рис. S1b). После TPC1173 очевидные различия уже видны на K-крае Pd при КТ (рис. 4). Спектр XANES монометаллического катализатора Pd-CeO 2 MM показывает, что частицы Pd окисляются и имеют локальную структуру, аналогичную PdO (рис. 4а). Напротив, спектры биметаллических катализаторов MM и IWI показывают комбинацию PdO и металлического Pd, что указывает на то, что добавление Pt к Pd-CeO 2 катализаторов приводит к более восстановленному состоянию Pd, что согласуется с результатами SXRD и предыдущими отчетами 23 . Интересно, что спектры XANES измельченного PtPd-CeO 2 MM демонстрируют более высокий вклад частиц PdO, чем аналог IWI (сравните рис. 4b, c). В условиях in situ при 723 K в спектрах XANES для трех катализаторов наблюдается лишь незначительное окисление.
4а). Напротив, спектры биметаллических катализаторов MM и IWI показывают комбинацию PdO и металлического Pd, что указывает на то, что добавление Pt к Pd-CeO 2 катализаторов приводит к более восстановленному состоянию Pd, что согласуется с результатами SXRD и предыдущими отчетами 23 . Интересно, что спектры XANES измельченного PtPd-CeO 2 MM демонстрируют более высокий вклад частиц PdO, чем аналог IWI (сравните рис. 4b, c). В условиях in situ при 723 K в спектрах XANES для трех катализаторов наблюдается лишь незначительное окисление.
XANES спектры a Pd-CeO 2 MM, b PtPd-CeO 2 MM и c PdPt/CeO 2 IWI после обработки TPC1173 в условиях сухого и влажного сжигания бедного метана. Показано состояние в начале влажных измерений при 723 K и через 2 ч, последние отмечены *. Величина FT спектров EXAFS d Pd-CeO 2 MM, e PtPd-CeO 2 MM и f PdPt/CeO 2 IWI после обработки в сухом и влажном ТФХ31 условия горения обедненного метана при 723 К. Показаны состояния в начале влажных измерений при 723 К и через 2 ч, последние отмечены *. г наложение величины FT спектров EXAFS трех образцов через 2 часа во влажной атмосфере горения метана при 723 K. Также показаны справочные данные для фольги Pd и стандарта PdO. Механическое фрезерование ММ, пропитка IWI по начальной влажности.
Показаны состояния в начале влажных измерений при 723 К и через 2 ч, последние отмечены *. г наложение величины FT спектров EXAFS трех образцов через 2 часа во влажной атмосфере горения метана при 723 K. Также показаны справочные данные для фольги Pd и стандарта PdO. Механическое фрезерование ММ, пропитка IWI по начальной влажности.
Изображение в полный размер
Данные EXAFS, полученные при комнатной температуре для образцов TPC1173, подтвердили, что монометаллический Pd-CeO 2 MM сильно окислен, и показали, что это единственный образец, показывающий четко развитую оболочку прибл. 3,0 Å (без поправки на фазовый сдвиг), что соответствует связям Pd-Pd1 и Pd-Pd2 структуры PdO (рис. 4d). Эти результаты показывают, что во время TPC1173 Pd сильно окислился и превратился в объемный PdO. С другой стороны, оба биметаллических катализатора (MM и IWI) имеют связи Pd-O прибл. 1,5 Å, но с меньшим вкладом, чем для монометаллического катализатора (см. дополнительную информацию, СИ). При выдержке в сухой реакционной смеси при различных температурах (для наглядности на рис. 4 показаны только данные при 723 К) биметаллические катализаторы подвергаются окислению, что следует из снижения характеристик Pd-M (M = Pd, Pt). . В катализаторе ММ признаки Pd-M почти исчезают, а связи Pd-O более заметны, чем в катализаторе IWI. Примечательно, что катализатор IWI показывает самый высокий вклад свойств Pd-M и самый низкий вклад Pd-O, подтверждая, что это наиболее восстановленный катализатор (сравните рис. 4e, f).
При выдержке в сухой реакционной смеси при различных температурах (для наглядности на рис. 4 показаны только данные при 723 К) биметаллические катализаторы подвергаются окислению, что следует из снижения характеристик Pd-M (M = Pd, Pt). . В катализаторе ММ признаки Pd-M почти исчезают, а связи Pd-O более заметны, чем в катализаторе IWI. Примечательно, что катализатор IWI показывает самый высокий вклад свойств Pd-M и самый низкий вклад Pd-O, подтверждая, что это наиболее восстановленный катализатор (сравните рис. 4e, f).
Эволюция электронной структуры при сжигании влажного метана
После экспериментов по окислению бедного метана in situ температуру понизили до 443 K и к смеси реагентов добавили водяной пар. На рис. 4 представлены данные в условиях in situ, полученные в начале реакции во влажной смеси при 723 К и через 2 ч. Монометаллический катализатор за это время практически не изменяется, оставаясь окисленным в течение всего измерения. PtPd-CeO 2 ММ окисляется, так как его связи Pd-M немного уменьшаются, в то время как вклад связей Pd-O слегка увеличивается при работе во влажных условиях. Напротив, для катализатора IWI обнаруживаются лишь незначительные изменения. Эти результаты хорошо согласуются с общими данными, полученными методом SXRD in situ. На рис. 4g наложены данные EXAFS для трех катализаторов после 2 часов пребывания во влажной смеси при 723 К. Характерно, что монометаллический Pd-CeO 2 MM является наиболее окисленным образцом, демонстрирующим сильное развитие структуры PdO и низкий вклад связей Pd-Pd. Сравнение биметаллических катализаторов показывает, что механохимически синтезированный катализатор показывает более высокий вклад Pd-O и Pd-Pd2 из структуры PdO и более низкий показатель Pd-M, чем аналог IWI. В серии in situ на Pt L 9 почти не наблюдается изменений.0058 3 -данные XAS края (см. рис. S9).
Напротив, для катализатора IWI обнаруживаются лишь незначительные изменения. Эти результаты хорошо согласуются с общими данными, полученными методом SXRD in situ. На рис. 4g наложены данные EXAFS для трех катализаторов после 2 часов пребывания во влажной смеси при 723 К. Характерно, что монометаллический Pd-CeO 2 MM является наиболее окисленным образцом, демонстрирующим сильное развитие структуры PdO и низкий вклад связей Pd-Pd. Сравнение биметаллических катализаторов показывает, что механохимически синтезированный катализатор показывает более высокий вклад Pd-O и Pd-Pd2 из структуры PdO и более низкий показатель Pd-M, чем аналог IWI. В серии in situ на Pt L 9 почти не наблюдается изменений.0058 3 -данные XAS края (см. рис. S9).
Эволюция поверхностных активных центров
Самые внешние слои катализаторов играют ключевую роль в явлении катализа. Поэтому, чтобы понять происхождение более высокой активности и стабильности измельченных катализаторов, поверхностно-активные центры были исследованы с помощью синхротрона AP-XPS в сухих и влажных смесях. Объединение результатов AP-XPS с результатами in situ SXRD и XAS позволяет получить полную картину объемных и поверхностных свойств катализаторов в их рабочем состоянии.
Объединение результатов AP-XPS с результатами in situ SXRD и XAS позволяет получить полную картину объемных и поверхностных свойств катализаторов в их рабочем состоянии.
Атомные доли палладия и Pt и степени окисления, полученные с тремя энергиями фотонов, показаны на рис. 5. Каждая половина круговой диаграммы схематически представляет NP, где три полукруга представляют три глубины выборки. Зарегистрированные спектры Pd 3d и Ce 3d представлены на рис. S11 и S12 соответственно.
Рис. 5: Атомные доли палладия и Pt и степени окисления, рассчитанные для Pd-CeO 2 MM и PtPd-CeO 2 MM. a – d были получены в условиях сухого окисления обедненной смеси метана, а e – г во влажных условиях. Внешний полукруг соответствует данным, полученным при КЭ 230 эВ, промежуточный полукруг соответствует КЭ 450 эВ, а внутренний полукруг соответствует КЭ 1000 эВ. T указывает на предыдущую предварительную обработку катализатора (программируемое по температуре сжигание TPC, TOS time-on-stream). A указывает газовую атмосферу, присутствующую во время измерений. Цифры указывают атомную концентрацию. Механическое фрезерование ММ.
A указывает газовую атмосферу, присутствующую во время измерений. Цифры указывают атомную концентрацию. Механическое фрезерование ММ.
Изображение полного размера
Анализ спектров Pd 3d (рис. S11) показывает наличие трех различных степеней окисления: (1) металлический Pd при энергиях связи (BE) между 334,9 и 335,3 эВ, (2) a компонента на BE между Pd 0 + 0,5 эВ и Pd 0 + 1,2 эВ, что соответствует Pd 2+ и (3) другой оксидный компонент в BE между Pd 0 + 2,1 эВ и Pd 0 + 2,4 эВ. Примечательно, что последний компонент появляется при BE между Pd 2+ и Pd 4+ . Этот сдвиг BE может быть приписан поверхностным формам оксида Pd, сильно взаимодействующим с церием 42,43,44 , и поэтому мы назвали их PdO X -Ce. В атмосфере сухого окисления метана при 723 К (рис. 5а) Pd в свежем катализаторе Pd-CeO 2 MM преимущественно окисляется, хотя в ядре НЧ обнаруживается до 45% металлического Pd. Интересно, что наблюдается сильное ядро-оболочка степеней окисления, увеличивающее количество окисленного Pd по направлению к поверхности НЧ. Принимая во внимание различия между глубинами, измеренными с каждой энергией фотона, эти результаты указывают на то, что явление окисления сильно локализовано в первых атомных слоях. Это также хорошо видно на рис. S11a. В условиях сухого окисления метана относительная атомная концентрация Pd [Pd/(Pd+Ce)·100] на поверхности составляет ок. 33 ат.% по сравнению с 11 ат.% под поверхностью (Таблица S4), что указывает на то, что Pd тонко диспергирован на поверхности оксида церия. Это полностью согласуется с CN, извлеченным из анализа EXAFS, и характеристикой HRTEM, опубликованной в другом месте 9.0334 32 , где аморфная оболочка Pd-O-Ce ок. На подложке из оксида церия была идентифицирована толщина 2 нм.
Интересно, что наблюдается сильное ядро-оболочка степеней окисления, увеличивающее количество окисленного Pd по направлению к поверхности НЧ. Принимая во внимание различия между глубинами, измеренными с каждой энергией фотона, эти результаты указывают на то, что явление окисления сильно локализовано в первых атомных слоях. Это также хорошо видно на рис. S11a. В условиях сухого окисления метана относительная атомная концентрация Pd [Pd/(Pd+Ce)·100] на поверхности составляет ок. 33 ат.% по сравнению с 11 ат.% под поверхностью (Таблица S4), что указывает на то, что Pd тонко диспергирован на поверхности оксида церия. Это полностью согласуется с CN, извлеченным из анализа EXAFS, и характеристикой HRTEM, опубликованной в другом месте 9.0334 32 , где аморфная оболочка Pd-O-Ce ок. На подложке из оксида церия была идентифицирована толщина 2 нм.
Обработка TPC1173 привела к сильному окислению Pd в трех оболочках, что увеличило вклад компонента PdO X -Ce прибл. 90% для трех глубин выборки, таким образом теряя ядро-оболочку степеней окисления, как видно на рис. 5с и S11b. Также была обнаружена сильная реструктуризация поверхности, поскольку относительная концентрация Pd на поверхности уменьшилась примерно с 33 ат.% до 10 ат.%, в то время как в приповерхностной области относительная концентрация Pd оставалась практически постоянной, что свидетельствует о спекании Pd за счет ТПК1173. лечение. При дозировании пара (влажные условия) при 723 K дисперсия Pd на поверхности не изменилась (рис. 5e и S11c и таблица S4). Это указывает на то, что обработка старением TPC1173 приводит к реорганизации и стабилизации частиц Pd на поверхности, что особенно способствует более окисленному состоянию Pd в условиях реакции. Примечательно, что степень окисления сохраняется после дозирования пара и в условиях влажной реакции прибл. 9На поверхности присутствуют частицы PdO X -Ce с содержанием 5 ат. %.
5с и S11b. Также была обнаружена сильная реструктуризация поверхности, поскольку относительная концентрация Pd на поверхности уменьшилась примерно с 33 ат.% до 10 ат.%, в то время как в приповерхностной области относительная концентрация Pd оставалась практически постоянной, что свидетельствует о спекании Pd за счет ТПК1173. лечение. При дозировании пара (влажные условия) при 723 K дисперсия Pd на поверхности не изменилась (рис. 5e и S11c и таблица S4). Это указывает на то, что обработка старением TPC1173 приводит к реорганизации и стабилизации частиц Pd на поверхности, что особенно способствует более окисленному состоянию Pd в условиях реакции. Примечательно, что степень окисления сохраняется после дозирования пара и в условиях влажной реакции прибл. 9На поверхности присутствуют частицы PdO X -Ce с содержанием 5 ат. %.
Интересно, что монометаллический образец Pt-CeO 2 MM показал гораздо более низкую дисперсию Pt по сравнению с дисперсией Pd в монометаллическом образце Pd-CeO 2 MM после TPC1173 (таблица S5). Относительная атомная концентрация Pt составляет ок. 3 ат.% и 5 ат.% на самой внешней и подповерхностной оболочках, соответственно, что указывает на более низкую дисперсию Pt на поверхности CeO 2 при измельчении. Это согласуется с предыдущими измерениями с помощью ВРПЭМ, где на подложке из оксида церия были идентифицированы НЧ Pt размером около 5–10 нм 9.0334 34 и в соответствии с нашими измерениями SXRD (таблица S1). В отличие от организации Pd в Pd-CeO 2 MM, в Pt-CeO 2 MM Pt демонстрирует ядро-оболочку степеней окисления в условиях горения сухого метана при 723 K (рис. S14 и S15), где 53, 69 и 74 ат.% частиц Pt 2+ (по отношению к частицам Pt) обнаружены в ядре, приповерхностных и крайних слоях соответственно, остальное металлическое Pt 0 (рис. S14 и С15). Учитывая, что в результатах, полученных для ядра, также исследуются самые внешние слои, наши результаты показывают, что окисление в основном ограничивается первыми атомными слоями НЧ Pt, которые находятся в прямом контакте с реакционной атмосферой.
Относительная атомная концентрация Pt составляет ок. 3 ат.% и 5 ат.% на самой внешней и подповерхностной оболочках, соответственно, что указывает на более низкую дисперсию Pt на поверхности CeO 2 при измельчении. Это согласуется с предыдущими измерениями с помощью ВРПЭМ, где на подложке из оксида церия были идентифицированы НЧ Pt размером около 5–10 нм 9.0334 34 и в соответствии с нашими измерениями SXRD (таблица S1). В отличие от организации Pd в Pd-CeO 2 MM, в Pt-CeO 2 MM Pt демонстрирует ядро-оболочку степеней окисления в условиях горения сухого метана при 723 K (рис. S14 и S15), где 53, 69 и 74 ат.% частиц Pt 2+ (по отношению к частицам Pt) обнаружены в ядре, приповерхностных и крайних слоях соответственно, остальное металлическое Pt 0 (рис. S14 и С15). Учитывая, что в результатах, полученных для ядра, также исследуются самые внешние слои, наши результаты показывают, что окисление в основном ограничивается первыми атомными слоями НЧ Pt, которые находятся в прямом контакте с реакционной атмосферой. В условиях влажного окисления метана при 723 K относительная атомная концентрация Pt остается почти такой же, как и в сухих условиях, что, как и в случае Pd, указывает на то, что реструктуризация поверхности во время обработки TPC1173 придает устойчивость НЧ в условиях реакции. Добавление пара не вызывало изменения степени окисления Pt. Это замечательные результаты, поскольку обычно утверждается, что Pt находится в восстановленном состоянии в условиях сжигания обедненного метана 9.0334 23,45 , как показывают наши результаты объемных измерений SXRD in situ. Примечательно, что поверхностная чувствительность, обеспечиваемая AP-XPS, показывает, что Pt 2+ сильно расположен на поверхности НЧ, что ускользает от обнаружения с помощью объемно-чувствительных методов, сосуществующих с Pt 0 . Во всех случаях, как в сухих, так и во влажных условиях сжигания обедненного метана, церий в основном присутствует в виде соединений Ce 4+ (> 95%) (таблица S6).
В условиях влажного окисления метана при 723 K относительная атомная концентрация Pt остается почти такой же, как и в сухих условиях, что, как и в случае Pd, указывает на то, что реструктуризация поверхности во время обработки TPC1173 придает устойчивость НЧ в условиях реакции. Добавление пара не вызывало изменения степени окисления Pt. Это замечательные результаты, поскольку обычно утверждается, что Pt находится в восстановленном состоянии в условиях сжигания обедненного метана 9.0334 23,45 , как показывают наши результаты объемных измерений SXRD in situ. Примечательно, что поверхностная чувствительность, обеспечиваемая AP-XPS, показывает, что Pt 2+ сильно расположен на поверхности НЧ, что ускользает от обнаружения с помощью объемно-чувствительных методов, сосуществующих с Pt 0 . Во всех случаях, как в сухих, так и во влажных условиях сжигания обедненного метана, церий в основном присутствует в виде соединений Ce 4+ (> 95%) (таблица S6).
Результаты для биметаллического PtPd-CeO 2 MM (рис. 5 и S11d–f и S13), который является катализатором с самой высокой активностью и стабильностью, обнаруживают заметные отличия по сравнению с монометаллическими аналогами. Для свежего PtPd-CeO 2 MM в атмосфере сухого обедненного метана при 723 K относительные общие атомные концентрации металлов [(Pd + Pt)/(Pd + Pt + Ce)·100] на поверхности и в приповерхностных областях составляют около 13 и 17 ат.% соответственно (таблица S7), что в случае самого внешнего слоя существенно ниже относительной атомной концентрации Pd, зарегистрированной для Pd-CeO 2 ММ (33 ат.%). Кроме того, концентрация Pd увеличивается по направлению к поверхности НЧ для биметаллического образца (88 ат.% Pd на поверхности против 78 ат.% в ядре), что приводит к образованию ядра-оболочки композиций с обогащенной палладием оболочкой 25 . Это интересный результат, так как Pd сначала измельчали с оксидом церия, а затем в процесс измельчения добавляли Pt. Следовательно, эта тенденция к сегрегации указывает на то, что Pt образует более крупные агрегаты, в то время как Pd сильно диспергирован по поверхности катализатора и имеет тенденцию к сегрегации по направлению к поверхности при сжигании метана.
5 и S11d–f и S13), который является катализатором с самой высокой активностью и стабильностью, обнаруживают заметные отличия по сравнению с монометаллическими аналогами. Для свежего PtPd-CeO 2 MM в атмосфере сухого обедненного метана при 723 K относительные общие атомные концентрации металлов [(Pd + Pt)/(Pd + Pt + Ce)·100] на поверхности и в приповерхностных областях составляют около 13 и 17 ат.% соответственно (таблица S7), что в случае самого внешнего слоя существенно ниже относительной атомной концентрации Pd, зарегистрированной для Pd-CeO 2 ММ (33 ат.%). Кроме того, концентрация Pd увеличивается по направлению к поверхности НЧ для биметаллического образца (88 ат.% Pd на поверхности против 78 ат.% в ядре), что приводит к образованию ядра-оболочки композиций с обогащенной палладием оболочкой 25 . Это интересный результат, так как Pd сначала измельчали с оксидом церия, а затем в процесс измельчения добавляли Pt. Следовательно, эта тенденция к сегрегации указывает на то, что Pt образует более крупные агрегаты, в то время как Pd сильно диспергирован по поверхности катализатора и имеет тенденцию к сегрегации по направлению к поверхности при сжигании метана. Это согласуется с результатами EXAFS и наблюдениями HRTEM. На рисунке 6а показано изображение HRTEM свежего PtPd-CeO 9.Катализатор 0058 2 MM, который показывает сосуществование аморфной оболочки размером около 2 нм на носителе оксида церия (отмечено белыми стрелками) и НЧ Pt (размером 5–8 нм и идентифицируется по полосам решетки при 2,3 и 2,0 Å, соответствующим (111) и (200) плоскости металлической платины соответственно). Примечательно, что аморфная оболочка покрывает не только носитель оксида церия, но и наночастицы Pt, даже несмотря на то, что Pt была добавлена на последней стадии процесса измельчения. Аморфная оболочка идентична той, о которой сообщалось ранее для монометаллического Pd-CeO 2 MM 32 и может быть источником наблюдаемого сдвига энергии связи. С другой стороны, как для Pd, так и для Pt наблюдается ядро-оболочка степеней окисления, представляя большую долю окисленных частиц в самом внешнем слое. Из-за аморфной природы этой фазы она ускользает от обнаружения SXRD.
Это согласуется с результатами EXAFS и наблюдениями HRTEM. На рисунке 6а показано изображение HRTEM свежего PtPd-CeO 9.Катализатор 0058 2 MM, который показывает сосуществование аморфной оболочки размером около 2 нм на носителе оксида церия (отмечено белыми стрелками) и НЧ Pt (размером 5–8 нм и идентифицируется по полосам решетки при 2,3 и 2,0 Å, соответствующим (111) и (200) плоскости металлической платины соответственно). Примечательно, что аморфная оболочка покрывает не только носитель оксида церия, но и наночастицы Pt, даже несмотря на то, что Pt была добавлена на последней стадии процесса измельчения. Аморфная оболочка идентична той, о которой сообщалось ранее для монометаллического Pd-CeO 2 MM 32 и может быть источником наблюдаемого сдвига энергии связи. С другой стороны, как для Pd, так и для Pt наблюдается ядро-оболочка степеней окисления, представляя большую долю окисленных частиц в самом внешнем слое. Из-за аморфной природы этой фазы она ускользает от обнаружения SXRD.
a Свежий PtPd-CeO 2 MM и b после сжигания метана во влажной атмосфере при 723 K в течение 24 ч.
Изображение полного размера
После обработки TPC1173 наблюдается существенно иной сценарий в сухой смеси при 723 K (рис. 5d и S11e) по сравнению с монометаллическими катализаторами. В то время как Pd-CeO 2 MM демонстрировал однородное распределение концентрации Pd и степеней окисления по трем оболочкам, биметаллический образец сохраняет концентрацию и степени окисления ядро-оболочка, как и до обработки TPC1173. Это дополнительное доказательство роли Pt в стабилизации Pd. И Pd, и Pt кажутся более восстановленными, чем их соответствующие монометаллические аналоги: в условиях сухой реакции при 723 K в PdO 9 обнаружено 67 ат.% Pd.0058 X -Ce состояние на поверхности, в то время как Pd-CeO 2 MM состоит из ок. 90 ат.% PdO X -Ce. С другой стороны, Pt находится в сильно восстановленном состоянии, с 74 ат.% и 95 ат.% Pt 0 на поверхности и в сердцевине соответственно, в отличие от найденных ранее значений 26 ат.% и 47 ат.%. ат.% для монометаллического Pt-CeO 2 ММ.
90 ат.% PdO X -Ce. С другой стороны, Pt находится в сильно восстановленном состоянии, с 74 ат.% и 95 ат.% Pt 0 на поверхности и в сердцевине соответственно, в отличие от найденных ранее значений 26 ат.% и 47 ат.%. ат.% для монометаллического Pt-CeO 2 ММ.
При влажной подаче при 723 К оба металла восстанавливаются незначительно, при этом внутренние слои НЧ восстанавливаются сильнее, а Pt почти полностью восстанавливается. При этом дальнейшей перестройки металлов не наблюдается (рис. 5f и S11f). Это показывает, что взаимодействие между обоими металлами приводит к более высокой степени восстановления первых слоев как Pd, так и Pt и более стабильной системе, чем Pd-CeO 2 ММ. Чтобы подтвердить это, образец, обработанный в лаборатории в течение 24 часов в условиях влажного сжигания обедненного метана TOS, был изучен с помощью AP-XPS непосредственно во влажных условиях при 723 K. Как видно на рис. 5g, получены аналогичные результаты, что демонстрирует надежность системы PtPd-CeO 2 MM. Рисунок 6b соответствует репрезентативному HRTEM-изображению биметаллического образца после обработки TPC1173 и 24 ч во влажном состоянии TOS. Неожиданная реорганизация была обнаружена после цикла TPC, как сообщалось в другом месте 9.0334 34 : при сжигании обедненного метана по всему образцу выросли уникальные структуры с основанием из PdO, прикрепленным к опоре из оксида церия и покрытым головкой из Pt, как показано на рис. S16. Грибовидные структуры остаются во время мокрой операции. Следовательно, НЧ Pt находятся в тесном контакте с PdO, который, в свою очередь, имеет прочный контакт с носителем из оксида церия. Эти сборки заключены в аморфную оболочку, подобную той, что распознается в свежем образце (рис. 6а). Кроме того, анализ профиля энергодисперсионной рентгеновской спектроскопии, проведенный вдоль сборки Ce-PdO-Pt, показанной на вставке к рис. 6b, ясно показывает присутствие Pd в Pt NP, как и в линейном сканировании, выполненном как Pd, так и Pt. сигналы обнаруживаются между 30 и 45 нм.
Рисунок 6b соответствует репрезентативному HRTEM-изображению биметаллического образца после обработки TPC1173 и 24 ч во влажном состоянии TOS. Неожиданная реорганизация была обнаружена после цикла TPC, как сообщалось в другом месте 9.0334 34 : при сжигании обедненного метана по всему образцу выросли уникальные структуры с основанием из PdO, прикрепленным к опоре из оксида церия и покрытым головкой из Pt, как показано на рис. S16. Грибовидные структуры остаются во время мокрой операции. Следовательно, НЧ Pt находятся в тесном контакте с PdO, который, в свою очередь, имеет прочный контакт с носителем из оксида церия. Эти сборки заключены в аморфную оболочку, подобную той, что распознается в свежем образце (рис. 6а). Кроме того, анализ профиля энергодисперсионной рентгеновской спектроскопии, проведенный вдоль сборки Ce-PdO-Pt, показанной на вставке к рис. 6b, ясно показывает присутствие Pd в Pt NP, как и в линейном сканировании, выполненном как Pd, так и Pt. сигналы обнаруживаются между 30 и 45 нм. Эти наблюдения хорошо согласуются с результатами in situ SXRD и XAS, а также с AP-XPS. Примечательно, что богатая Pd аморфная оболочка, которая, как считается, является источником PdO 9Вид 0058 X -Ce сохраняется при окислении метана при 723 K даже во влажных условиях. Тесный контакт частиц PdO X -Ce со сборками Pt-Pd/PdO представляет собой беспрецедентную архитектуру, которую можно приписать происхождению каталитической активности и устойчивости биметаллической системы. Эта наноструктура достигается только механохимическим синтезом.
Эти наблюдения хорошо согласуются с результатами in situ SXRD и XAS, а также с AP-XPS. Примечательно, что богатая Pd аморфная оболочка, которая, как считается, является источником PdO 9Вид 0058 X -Ce сохраняется при окислении метана при 723 K даже во влажных условиях. Тесный контакт частиц PdO X -Ce со сборками Pt-Pd/PdO представляет собой беспрецедентную архитектуру, которую можно приписать происхождению каталитической активности и устойчивости биметаллической системы. Эта наноструктура достигается только механохимическим синтезом.
Изучение поверхностных и подповерхностных областей с помощью AP-XPS с использованием трех энергий фотонов и объединение этих результатов с in situ SXRD и XAS, а также наблюдениями HRTEM проливают свет на эволюцию поверхности и объемной структуры Pd, Pt, Pd, Pt, нанесенных на оксид церия. и биметаллические катализаторы Pd-Pt, приготовленные механохимическими методами и обычной пропиткой по начальной влажности во время окисления метана в сухих и влажных условиях, применимых для транспортных средств, работающих на природном газе. Мы продемонстрировали, что как состав, так и метод синтеза оказывают прямое и сильное влияние на расположение и химическое окружение Pd и Pt, а также на их эволюцию в условиях реакции. В размолотых катализаторах окисленный PdO X -Ce, сильно взаимодействующие с церием, сохраняются при окислении метана во влажных условиях, что, вероятно, связано с уникальной богатой палладием аморфной оболочкой, возникшей в результате механохимического метода получения и стабилизированной тесным контактом со сборками Pt-Pd/PdO. возник в условиях реакции TPC. Наши данные показывают, что структура механохимически приготовленных катализаторов является более динамичной, что позволяет постепенное образование PdO за счет металлического Pd даже во время влажного сжигания метана из-за тесного взаимодействия, полученного между Pd и CeO 2 в измельченных катализаторах, который модулирует отношение PdO/Pd и достигает значения, близкого к единице, в условиях влажной реакции. Это превращение происходит параллельно наблюдаемому увеличению конверсии метана, что позволяет избежать хорошо известной дезактивации катализаторов на основе Pd во влажных условиях.
Мы продемонстрировали, что как состав, так и метод синтеза оказывают прямое и сильное влияние на расположение и химическое окружение Pd и Pt, а также на их эволюцию в условиях реакции. В размолотых катализаторах окисленный PdO X -Ce, сильно взаимодействующие с церием, сохраняются при окислении метана во влажных условиях, что, вероятно, связано с уникальной богатой палладием аморфной оболочкой, возникшей в результате механохимического метода получения и стабилизированной тесным контактом со сборками Pt-Pd/PdO. возник в условиях реакции TPC. Наши данные показывают, что структура механохимически приготовленных катализаторов является более динамичной, что позволяет постепенное образование PdO за счет металлического Pd даже во время влажного сжигания метана из-за тесного взаимодействия, полученного между Pd и CeO 2 в измельченных катализаторах, который модулирует отношение PdO/Pd и достигает значения, близкого к единице, в условиях влажной реакции. Это превращение происходит параллельно наблюдаемому увеличению конверсии метана, что позволяет избежать хорошо известной дезактивации катализаторов на основе Pd во влажных условиях. Эти данные показывают, что уникальные структурные свойства достигаются при механохимическом синтезе, экологически чистом и легко масштабируемом методе синтеза, который приводит к превосходной конверсии метана даже в присутствии пара.
Эти данные показывают, что уникальные структурные свойства достигаются при механохимическом синтезе, экологически чистом и легко масштабируемом методе синтеза, который приводит к превосходной конверсии метана даже в присутствии пара.
Методы
Синтез катализаторов
Носитель CeO 2 был синтезирован путем осаждения с использованием H 2 O 2 46 . Нитрат церия (Ce(NO 3 ) 2 ·6H 2 O, Treibacher Industrie AG) растворяли в деионизированной воде (0,2 M) и выдерживали при перемешивании перед соответствующим количеством перекиси водорода (H 2 O 2 , Aldrich, 35%) вливали в раствор для получения молярного H 2 9Соотношение 0059 O 2 :Ce равно 3. Осаждение предшественника затем получали путем добавления водного гидроксида аммония (NH 4 OH, Aldrich, 30%) до достижения pH 10,5. Суспензию перемешивали в течение 4 ч, промывали деионизированной водой и фильтровали. Затем осадок высушивали в стационарном воздухе при 393°К в течение 15 ч и затем прокаливали в стационарном воздухе при 1173°К в течение 3 ч. Площадь поверхности после прокаливания составила 2,6 м 2 /г для оксида церия.
Затем осадок высушивали в стационарном воздухе при 393°К в течение 15 ч и затем прокаливали в стационарном воздухе при 1173°К в течение 3 ч. Площадь поверхности после прокаливания составила 2,6 м 2 /г для оксида церия.
Палладий и платина были включены в носитель оксида церия путем измельчения наночастиц Pd (NPs) (Aldrich, площадь поверхности 40 м 2 /г, средний размер частиц 10 мкм) или НЧ Pt (Sigma-Aldrich, площадь поверхности 33 м 2 /г, средний размер частиц ≤20 мкм) с оксидом церия в мини-мельнице Pulverisette 23 в течение 10 мин при частота 15 Гц, с использованием чаши из диоксида циркония объемом 15 мл с 1 мелющим шаром из ZrO 2 (диаметр = 15 мм, вес = 10 г, отношение шариков к порошку = 10). Добавляли необходимое количество Pd или Pt, чтобы получить номинальное содержание каждого металла 1,5 мас.%. Для биметаллических катализаторов использовали предыдущую процедуру для включения одного металла, а затем добавляли второй металл. Катализаторы получили название PtPd-CeO 9.0058 2 MM, когда Pd сначала измельчали с оксидом церия, а затем добавляли Pt, и PdPt-CeO 2 MM, когда порядок добавления был обратным, и Pt сначала измельчали, а затем добавляли Pd. Катализаторы исследовали без дополнительной обработки. Поэтому в катализаторах, приготовленных механохимическими методами, растворители не используются.
Катализаторы получили название PtPd-CeO 9.0058 2 MM, когда Pd сначала измельчали с оксидом церия, а затем добавляли Pt, и PdPt-CeO 2 MM, когда порядок добавления был обратным, и Pt сначала измельчали, а затем добавляли Pd. Катализаторы исследовали без дополнительной обработки. Поэтому в катализаторах, приготовленных механохимическими методами, растворители не используются.
Для приготовления катализаторов IWI CeO 2 пропитывали соответствующим количеством водного раствора нитрата палладия (Pd(NO 3 ) 2 , 4,8 мас.% PD, 99,999%, Sigma-Aldrich) и Tetraammineplatinum (II) нитрат ([PT (NH 3 ) 4 ] (№ 3 ) 2 9, ] (№ 3 ) 2 9, ] (№ 3 ) 2 9, ] (№ 3 ) 2 , ] (№ 3 ) %, Strem Chemicals) для достижения номинальной загрузки 1,5 мас. % Pd и 1,5 мас. % Pt. Полученный катализатор сушили в течение ночи при 373 К, а затем прокаливали в стационарном воздухе в течение 3 ч при 1173 К.
Измерения каталитического окисления метана
Оценку каталитической активности проводили в кварцевом трубчатом реакторе, загруженном 120 мг порошка катализатора. на подушке из кварцевой ваты. Общая скорость потока была установлена на уровне 180 мл/мин, что соответствует GHSV примерно 180 000 ч.0334 −1 . Состав газа на входе составлял 0,5% об. CH 4 и 2% об. O 2 в He для сухих экспериментов. Для экспериментов во влажной атмосфере добавляли 10 % об. H 2 O с помощью насоса высокоэффективной жидкостной хроматографии (ВЭЖХ), который обеспечивал поток деионизированной воды, которую затем испаряли с помощью нагревательных лент для получения дополнительных 10 % об. пара в сырьевом газе. Термопару К-типа помещали внутрь реактора рядом со слоем катализатора для непрерывного контроля температуры образца. Реактор помещали внутрь печи, оборудованной ПИД-регулятором.
In situ синхротронная рентгеновская порошковая дифракция (SXRD)
In situ синхротронная рентгеновская дифракция проводилась на линии материаловедения и порошковой дифракции (BL) синхротрона ALBA (Серданьола-дель-Вальес, Барселона, Испания). ШМ была установлена на энергию, соответствующую длине волны λ = 0,5157 Å, и все данные были собраны в режиме передачи. Катализаторы загружали в кварцевые капилляры с внутренним диаметром 0,58±0,1 мм (Hilgenberg GmbH) и иммобилизовали кварцевой ватой. Газы (метан, кислород, аргон) дозировались с помощью системы подачи газа, имеющейся на БС (система управления газом от ITQ-ALBA), с использованием независимых регуляторов массового расхода. Состав газа на входе: 0,5 об.% CH 4 и 2 об.% O 2 в Ar для сухих экспериментов. Для экспериментов во влажной атмосфере воду дозировали, пропуская смесь реагентов через сатуратор, заполненный водой с милли-Q, поддерживаемой при комнатной температуре. Температуру образца контролировали с помощью калиброванного термофена. На выходе из реактора был подключен масс-спектрометр для контроля газообразного потока, выходящего из реактора. Дифрактограммы записывали в диапазоне от 5 до 46,8° с шагом 0,006°.
ШМ была установлена на энергию, соответствующую длине волны λ = 0,5157 Å, и все данные были собраны в режиме передачи. Катализаторы загружали в кварцевые капилляры с внутренним диаметром 0,58±0,1 мм (Hilgenberg GmbH) и иммобилизовали кварцевой ватой. Газы (метан, кислород, аргон) дозировались с помощью системы подачи газа, имеющейся на БС (система управления газом от ITQ-ALBA), с использованием независимых регуляторов массового расхода. Состав газа на входе: 0,5 об.% CH 4 и 2 об.% O 2 в Ar для сухих экспериментов. Для экспериментов во влажной атмосфере воду дозировали, пропуская смесь реагентов через сатуратор, заполненный водой с милли-Q, поддерживаемой при комнатной температуре. Температуру образца контролировали с помощью калиброванного термофена. На выходе из реактора был подключен масс-спектрометр для контроля газообразного потока, выходящего из реактора. Дифрактограммы записывали в диапазоне от 5 до 46,8° с шагом 0,006°.
Уточнение Ритвельда выполнено с использованием программного обеспечения GSAS-II 47 . Уточнения были выполнены, включая стандартные материалы CeO 2 (01-080-5549), Pd (00-046-1043), Pt (00-004-0802) и PdO (00-041-1107). В доработках также рассматривался модельный сплав Pd 0,5 Pt 0,5 (01-072-2839).
Уточнения были выполнены, включая стандартные материалы CeO 2 (01-080-5549), Pd (00-046-1043), Pt (00-004-0802) и PdO (00-041-1107). В доработках также рассматривался модельный сплав Pd 0,5 Pt 0,5 (01-072-2839).
Размер кристаллитов определяли по уравнению Шеррера. (1):
$$\tau=\frac{K\lambda}{\beta {\cos}\theta}$$
(1)
где τ — средний размер кристаллитов; K — коэффициент формы (в данной работе выбрано K = 0,9), λ = 0,5157 Å, β — полная ширина на полувысоте. В таблице S1 перечислены результаты, полученные для исследованных катализаторов.
In situ рентгеновская абсорбционная спектроскопия тонкой структуры (XAS)
in situ XAS измерения были выполнены на основном уровне абсорбционной и эмиссионной спектроскопии BL синхротрона ALBA. Катализаторы были гранулированы и разбавлены нитридом бора для оптимизации поглощения образца. Образцы устанавливались в ячейке твердогазового реактора, расположенной на линии 9. 0334 48 . Эта ячейка позволяет контролировать дозировку газа с помощью той же системы управления газом, что и для измерений XRD in situ (система управления газом ITQ-ALBA), а также контролировать температуру образца. С помощью этой ячейки можно достичь максимальной температуры ~1000 К (в зависимости от газовой смеси). Спектры K-края Pd записывали в режиме пропускания. Эталонная фольга Pd также была измерена вместе со спектрами образцов для энергетической калибровки. Для энергетического отбора использовался монохроматор Si(311). Соответствующая смесь инертных газов (He, N 2 , Ar, Kr и Xe) был выбран для заполнения ионизационных камер, которые используются в качестве детекторов рентгеновского излучения в экспериментах по пропусканию. Спектры Pt L 3 регистрировали в режиме флуоресценции с использованием 6-элементного кремниевого дрейфового детектора.
0334 48 . Эта ячейка позволяет контролировать дозировку газа с помощью той же системы управления газом, что и для измерений XRD in situ (система управления газом ITQ-ALBA), а также контролировать температуру образца. С помощью этой ячейки можно достичь максимальной температуры ~1000 К (в зависимости от газовой смеси). Спектры K-края Pd записывали в режиме пропускания. Эталонная фольга Pd также была измерена вместе со спектрами образцов для энергетической калибровки. Для энергетического отбора использовался монохроматор Si(311). Соответствующая смесь инертных газов (He, N 2 , Ar, Kr и Xe) был выбран для заполнения ионизационных камер, которые используются в качестве детекторов рентгеновского излучения в экспериментах по пропусканию. Спектры Pt L 3 регистрировали в режиме флуоресценции с использованием 6-элементного кремниевого дрейфового детектора.
Измерения на месте заключались в дозировании обедненной метановой горючей смеси (0,5 CH 4 + 2 O 2 + 97,5 He — сухая смесь) при комнатной температуре, повышая температуру с использованием линейного изменения 10 Kmin –1 . Катализаторы измеряли в виде прессованных гранул, оптимизируя вес катализатора для Pd K-края и Pt L 3 -кромка. Потоки реагентов регулировали таким образом, чтобы поддерживать такое же отношение веса к потоку, как и соотношение, используемое в каталитических испытаниях, проведенных в лаборатории. Рентгеновские спектры поглощения вблизи края (XANES) были получены непрерывно при изменении температуры, а расширенные рентгеновские спектры поглощения тонкой структуры (EXAFS) были получены при постоянных температурах и при комнатной температуре после завершения серии in situ. По крайней мере, три скана были получены на каждом шаге температуры, чтобы обеспечить спектральную воспроизводимость и хорошее отношение сигнал/шум. Анализ и обработка данных проводились с использованием программного обеспечения Athena 49 . Анализ данных EXAFS был выполнен с использованием программного обеспечения Arthemis 49 , а фаза и амплитуда были рассчитаны с использованием кода FEFF6.
Катализаторы измеряли в виде прессованных гранул, оптимизируя вес катализатора для Pd K-края и Pt L 3 -кромка. Потоки реагентов регулировали таким образом, чтобы поддерживать такое же отношение веса к потоку, как и соотношение, используемое в каталитических испытаниях, проведенных в лаборатории. Рентгеновские спектры поглощения вблизи края (XANES) были получены непрерывно при изменении температуры, а расширенные рентгеновские спектры поглощения тонкой структуры (EXAFS) были получены при постоянных температурах и при комнатной температуре после завершения серии in situ. По крайней мере, три скана были получены на каждом шаге температуры, чтобы обеспечить спектральную воспроизводимость и хорошее отношение сигнал/шум. Анализ и обработка данных проводились с использованием программного обеспечения Athena 49 . Анализ данных EXAFS был выполнен с использованием программного обеспечения Arthemis 49 , а фаза и амплитуда были рассчитаны с использованием кода FEFF6.
Поскольку максимальная температура, достигаемая на ШС, составляла 1000 К, максимальная температура, достигаемая в ходе экспериментов на сухой смеси, составляла 923 К. Поэтому для исследования катализаторов в условиях горения мокрого обедненного метана была проведена предварительная обработка ТПК при 1173 К при 0,5 CH 4 + 2 O 2 + 97,5 Проведено в наших лабораториях на той же сухой смеси. Протокол, использованный для влажных измерений, был следующим: предварительно обработанные катализаторы сначала подвергались воздействию сухой реакционной смеси при температуре до 723 К для освежения катализаторов (запись спектров), температура снижалась до 443 К, при которой в реакционную смесь вводилась вода. подавали реагенты, а затем температуру ступенчато повышали до 723 K, где проводились 2-часовые измерения (см. рис. S1). Для влажных измерений добавляли 10 об.% воды с использованием насоса для ВЭЖХ (Knauer Smartline). Серия реакций схематически представлена на рис. S1.
S1.
Мы подогнали данные EXAFS для получения количественной информации. Мы начали подгонять первую оболочку из палладиевой фольги, чтобы получить значение коэффициента уменьшения амплитуды S 0 2 . Полученное значение использовалось для последующего анализа данных EXAFS наших катализаторов. Подгонка эталонной фольги и катализаторов производилась в тех же диапазонах в k- и R-пространстве. Только до первой координационной оболочки Pd-M была установлена.
Синхротронная рентгеновская фотоэлектронная спектроскопия (AP-XPS) измерения давления при атмосферном давлении
Измерения AP-XPS проводились на конечной станции NAPP на линии луча CIRCE источника синхротронного света ALBA. Для анализа излучаемых фотоэлектронов использовался коммерческий энергоанализатор PHOIBOS 150 NAP (SPECS GmbH), оснащенный четырьмя каскадами с дифференциальной накачкой, соединенными малыми апертурами. Размер пятна луча на образце составлял ~100 × 300 мкм 2 (по горизонтали × по вертикали). Спектры были получены с энергией пропускания 20 эВ и шагом по энергии 0,05 эВ. Давление образца поддерживали на уровне 1 мбар для всех измерений, регулирующих активную откачку. Для этого газы, составляющие смесь реагентов, дозировали в камеру анализа с помощью независимых регуляторов массового расхода и регулировали и стабилизировали давление внутри камеры анализа на уровне 1 мбар для всех экспериментов с помощью системы вакуумных клапанов. Постоянный поток 25 мл/мин для сухой смеси (1 CH 4 +4 O 2 +20 N 2 ) и 27,5 мл/мин для влажной смеси (1 CH 4 +4 O 2 +20 N 2 +2,5 H 2 +20 N 2 +2,5 H 2 +20 N 2 +2,5 H 2 +20 N 2 +2,5 H 2 +20 N O) вводили в камеру для анализа. Во время этих измерений максимально достижимая температура составляла ок. 973 K и, следовательно, тот же протокол, который применялся для измерений XAS in situ, использовался для исследований AP-XPS, чтобы убедиться, что в сухой реакционной смеси была достигнута температура 1173 K.
Спектры были получены с энергией пропускания 20 эВ и шагом по энергии 0,05 эВ. Давление образца поддерживали на уровне 1 мбар для всех измерений, регулирующих активную откачку. Для этого газы, составляющие смесь реагентов, дозировали в камеру анализа с помощью независимых регуляторов массового расхода и регулировали и стабилизировали давление внутри камеры анализа на уровне 1 мбар для всех экспериментов с помощью системы вакуумных клапанов. Постоянный поток 25 мл/мин для сухой смеси (1 CH 4 +4 O 2 +20 N 2 ) и 27,5 мл/мин для влажной смеси (1 CH 4 +4 O 2 +20 N 2 +2,5 H 2 +20 N 2 +2,5 H 2 +20 N 2 +2,5 H 2 +20 N 2 +2,5 H 2 +20 N O) вводили в камеру для анализа. Во время этих измерений максимально достижимая температура составляла ок. 973 K и, следовательно, тот же протокол, который применялся для измерений XAS in situ, использовался для исследований AP-XPS, чтобы убедиться, что в сухой реакционной смеси была достигнута температура 1173 K. На рисунке S1 схематично показан протокол. Поэтому для проведения влажных измерений были исследованы образцы, предварительно обработанные TPC1173 в лаборатории. Затем в камеру анализа дозировали сухую смесь и повышали температуру до 723 К. После этого образцы охлаждали до 443 К под сухой реакционной смесью и при этой температуре в камеру анализа вводили пар. Затем образцы во влажных условиях исследовались до 723 K (см. рис. S1b).
На рисунке S1 схематично показан протокол. Поэтому для проведения влажных измерений были исследованы образцы, предварительно обработанные TPC1173 в лаборатории. Затем в камеру анализа дозировали сухую смесь и повышали температуру до 723 К. После этого образцы охлаждали до 443 К под сухой реакционной смесью и при этой температуре в камеру анализа вводили пар. Затем образцы во влажных условиях исследовались до 723 K (см. рис. S1b).
Температуру образца контролировали с помощью инфракрасного лазера ( λ = 808 нм), сфокусированного на W-пластине, поверх которой устанавливались образцы. Температуру контролировали во время всех экспериментов термопарой К-типа, находящейся в непосредственном контакте с образцами.
Для каждого условия реакции были изучены XP-спектры областей Ce 3d , Pd 3d , Pt 4f , O 1s и C 1s . Чтобы получить информацию о профиле глубины и иметь возможность определять концентрацию металла и степень окисления на разных глубинах, каждую спектральную область возбуждали тремя разными энергиями фотонов, сохраняя кинетическую энергию (KE) сгенерированного Pd 3d , Pt 4f , Ce 3d , C 1s и O 1s фотоэлектроны постоянны при ~1000, 450 и 230 эВ. Соответствующие неупругие длины свободного пробега (IMFP) для каждого КЭ, рассчитанные для соответствующих областей спектра с учетом чистых металлов, приведены в таблице S3 50 . Поэтому для приблизительного расчета IMFP в наших измерениях для НЧ был принят состав Pd:Pt = 1:1, что позволяет нам рассчитать IMFP фотоэлектронов в наших NP как среднее значение IMFP для двух чистых разные элементы.
Соответствующие неупругие длины свободного пробега (IMFP) для каждого КЭ, рассчитанные для соответствующих областей спектра с учетом чистых металлов, приведены в таблице S3 50 . Поэтому для приблизительного расчета IMFP в наших измерениях для НЧ был принят состав Pd:Pt = 1:1, что позволяет нам рассчитать IMFP фотоэлектронов в наших NP как среднее значение IMFP для двух чистых разные элементы.
Атомные доли Pd и Pt были получены из калиброванных площадей пиков Pd 3d и Pt 4f . Коэффициенты относительной чувствительности (RSF) рассчитывались с учетом сечения ионизации, потока фотонов, соответствующего энергии фотона, используемой для каждого измерения 51 , и функции пропускания анализатора. Спектры AP-XPS анализировали без калибровки по энергии. Присутствие газов и температуры приводило к незначительным сдвигам из-за заряда. Поправки на угловое распределение не применялись, так как угол между осью анализатора и вектором горизонтальной линейной поляризации приходящего синхротронного излучения составляет 54,7°, магический угол 52 . Так как КЕ оставался постоянным, параметр средней длины свободного пробега был установлен равным 1 в RSF. Атомную концентрацию каждого металла рассчитывали с учетом скорректированных площадей и по формуле: (M + N)/(M + N + Ce)·100; M, N = Pd или Pt.
Так как КЕ оставался постоянным, параметр средней длины свободного пробега был установлен равным 1 в RSF. Атомную концентрацию каждого металла рассчитывали с учетом скорректированных площадей и по формуле: (M + N)/(M + N + Ce)·100; M, N = Pd или Pt.
Доступность данных
Данные, подтверждающие результаты этого исследования, включены в опубликованную статью (и дополнительную информацию к ней) или доступны у соответствующих авторов по обоснованному запросу.
Ссылки
Твигг, М. В. Каталитический контроль выбросов от автомобилей. Катал. Сегодня 163 , 33–41 (2011).
КАС Статья Google ученый
Auvray, X. & Olsson, L. Стабильность и активность Pd-, Pt- и Pd-Pt катализаторов, нанесенных на оксид алюминия, для окисления NO. Заяв. Катал. Б Окружающая среда. 168–169 , 342–352 (2015).

Артикул КАС Google ученый
Gremminger, A. et al. Катализаторы на основе МПГ для доочистки выхлопных газов в типичных условиях дизельных, бензиновых и газовых двигателей с упором на окисление метана и формальдегида. Заяв. Катал. Б Окружающая среда. 265 , 118571 (2020).
КАС Статья Google ученый
Wang, T., Chen, K. & Zhou, R. Биметаллический эффект Pt–Pd в Pt x Pd 1-x /(Ce,Zr,La)O 2 катализаторы для удаления NOx, углеводородов и CO. Катал. науч. Технол. 11 , 2782–2791 (2021).
КАС Статья Google ученый
Радж А. Контроль выбросов метана. Джонс. Мэтью Технол. 60 , 228–235 (2016).
КАС Статья Google ученый
«>Кариншак, К., Чен, П. В., Лю, Р.-Ф., Голден, С. Дж. и Гарольд, М. П. Оптимизация регулирования подачи для совместной конверсии метана и NOx с помощью Pd-Pt/Mn 0,5 Fe 2,5 O 4 /Al 2 O 3 монолитный катализатор. Заяв. Катал. Б Окружающая среда. 304 , 120607 (2022).
КАС Статья Google ученый
Питерс, Дж. К. Природный газ и распространение Плана экологически чистой энергии США в Парижское соглашение. Energy Policy 106 , 41–47 (2017).
Артикул Google ученый
«>Ортега, А., Гкумас, К., Цакалидис, А. и Пекар, Ф. Альтернативная энергия с низким уровнем выбросов для транспорта в ЕС: состояние исследований и инноваций. Энергия 14 , 7764 (2021).
КАС Статья Google ученый
Farrauto, R. J. Низкотемпературное окисление метана. Наука 337 , 659–660 (2012).
ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
Суарес-Бертоа, Р., Пехоут, М., Войтишек, М. и Асторга, К. Регулируемые и нерегулируемые выбросы дизельных, бензиновых и газовых автомобилей стандарта Евро 6 в реальных условиях вождения.
 Атмосфера 11 , 204 (2020).
Атмосфера 11 , 204 (2020).ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Corro, G., Cano, C. & Fierro, J.L.G. Исследование катализаторов Pt-Pd/γ-Al 2 O 3 для окисления метана, устойчивых к дезактивации отравлением серой. Дж. Мол. Катал. Хим. 315 , 35–42 (2010).
КАС Статья Google ученый
Wilburn, M.S. & Epling, W.S. Дезактивация серы и регенерация моно- и биметаллических Pd-Pt катализаторов окисления метана. Заяв. Катал. Б Окружающая среда. 206 , 589–598 (2017).
КАС Статья Google ученый
Лотт, П. и др. Понимание отравления серой биметаллических Pd-Pt катализаторов окисления метана и их регенерации. Заяв. Катал. Б Окружающая среда. 278 , 119244 (2020).

КАС Статья Google ученый
Садохина Н., Смедлер Г., Найлен У., Олофссон М. и Олссон Л. Влияние состава газа на активность катализатора на основе палладия в окислении метана – ингибирование и промотирование NO. Заяв. Катал. Б Окружающая среда. 200 , 351–360 (2017).
КАС Статья Google ученый
Goodman, E.D. et al. Однородные биметаллические нанокристаллы Pt/Pd демонстрируют влияние платины на активность и стабильность горения метана палладия. ACS Катал. 7 , 4372–4380 (2017).
КАС Статья Google ученый
Нассири, Х., Хейс, Р. Э. и Семагина, Н. Стабильность катализаторов Pd-Pt при низкотемпературном влажном сжигании метана: соотношение металлов и восстановление частиц. Хим. англ. науч.
 186 , 44–51 (2018).
186 , 44–51 (2018).КАС Статья Google ученый
Chen, J. et al. Взгляд на роль катализатора Pt на Pd, стабилизированного магнезиально-глиноземной шпинелью на гамма-глиноземе, для сжигания обедненного метана: повышение гидротермальной стабильности. мол. Катал. 496 , 111185 (2020).
КАС Статья Google ученый
Чжан, С. и др. Динамическая структурная эволюция нанесенных катализаторов ядро-оболочка палладий-церий, выявленная с помощью электронной микроскопии in situ. Нац. коммун. 6 , 7778 (2015).
ОБЪЯВЛЕНИЯ пабмед Статья Google ученый
Divins, N.J. et al. Оперативное исследование катализаторов CuZn контролируемого размера под высоким давлением для реакции синтеза метанола.
 Нац. коммун. 12 , 1435 (2021).
Нац. коммун. 12 , 1435 (2021).ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Статья Google ученый
Goodman, E.D. et al. Окисление палладия приводит к активности горения метана: влияние размера частиц и легирования платиной. J. Chem. физ. 151 , 154703 (2019).
ОБЪЯВЛЕНИЯ пабмед Статья КАС Google ученый
Нассири Х. и др. Вода переводит сжигание бедного метана, катализируемое PdO, в богатое сжигание, катализируемое Pt, в Pd-Pt катализаторах: рентгеновская абсорбционная спектроскопия in situ. J. Катал. 352 , 649–656 (2017).
КАС Статья Google ученый
Нассири, Х. и др. Платина ингибирует сжигание низкотемпературного сухого бедного метана за счет восстановления палладия в Pd-Pt/Al 2 O 3 : исследование поглощения рентгеновских лучей in situ.
 ChemPhysChem 18 , 238–244 (2017).
ChemPhysChem 18 , 238–244 (2017).КАС пабмед Статья Google ученый
Сараев А.А. и др. Атомная структура катализаторов полного окисления метана на основе Pd, Pt и PdPt: исследование EXAFS in situ. Катализаторы 11 , 1446 (2021).
КАС Статья Google ученый
Большой А. и др. Операционная характеристика биметаллических Pd-Pt катализаторов, нанесенных на оксид алюминия, в процессе окисления метана в сухих и влажных условиях. J. Phys. Д. Заявл. физ. 54 , 174006 (2021).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Четырин И. А., Бухтияров А. В., Просвирин И. П., Худорожков А. К., Бухтияров В. И. In situ XPS и MS исследование окисления метана на Pd–Pt/Al 2 O 3 катализаторы.
 Топ. Катал. 63 , 66–74 (2020).
Топ. Катал. 63 , 66–74 (2020).КАС Статья Google ученый
Colussi, S., Fornasiero, P. & Trovarelli, A. Взаимосвязь структура-активность в катализаторах окисления метана Pd/CeO 2 . Подбородок. Дж. Катал. 41 , 938–950 (2020).
КАС Статья Google ученый
Дивинс, Н. Дж., Ангурелл, И., Эскудеро, К., Перес-Диесте, В. и Льорка, Дж. Влияние носителя на перегруппировку поверхности биметаллических наночастиц в реальных катализаторах. Наука 346 , 620–623 (2014).
ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
Xiong, H. et al. Технический катализатор поддерживает стабилизацию двумерных плотов PdO x для устойчивого к воде окисления метана. Нац.
 Катал. 4 , 830–839 (2021).
Катал. 4 , 830–839 (2021).КАС Статья Google ученый
Карньелло, М. и др. Исключительная активность в отношении сжигания метана на модульных субъединицах Pd@CeO 2 на функционализированном Al 2 O 3 . Наука 337 , 713–717 (2012).
ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
Danielis, M. et al. Выдающиеся характеристики окисления метана катализаторами на основе диоксида церия с палладием, приготовленными методом одностадийного сухого измельчения в шаровой мельнице. Анжю. хим. Междунар. Эд. 57 , 10212–10216 (2018).
КАС Статья Google ученый
Петров А.В. и др. Стабильное полное окисление метана на цеолитных катализаторах на основе палладия.
 Нац. коммун. 9 , 2545 (2018).
Нац. коммун. 9 , 2545 (2018).ОБЪЯВЛЕНИЕ пабмед ПабМед Центральный Статья КАС Google ученый
Mussio, A. et al. Структурная эволюция биметаллических катализаторов окисления метана PtPd/CeO 2 , полученных методом сухого помола. Приложение ACS Матер. Интерфейсы 13 , 31614–31623 (2021 г.).
КАС пабмед ПабМед Центральный Статья Google ученый
Jang, E.J., Lee, J., Oh, D.G. & Kwak, J.H. CH 4 активность окисления в биметаллических катализаторах Pd и Pt-Pd: корреляция с поверхностным PdO x , количественно определенная из исследования DRIFTS. ACS Катал. 11 , 5894–5905 (2021).
КАС Статья Google ученый
Перссон К., Эрссон А.
 , Колусси С., Троварелли А. и Ярос С. Г. Каталитическое сжигание метана на биметаллических катализаторах Pd-Pt: влияние материалов носителя. Заяв. Катал. Б Окружающая среда. 66 , 175–185 (2006).
, Колусси С., Троварелли А. и Ярос С. Г. Каталитическое сжигание метана на биметаллических катализаторах Pd-Pt: влияние материалов носителя. Заяв. Катал. Б Окружающая среда. 66 , 175–185 (2006).КАС Статья Google ученый
Franken, T. et al. Влияние коротких восстановительных импульсов на динамическую структуру, активность и стабильность Pd/Al 2 O 3 при влажном окислении обедненного метана. ACS Катал. 11 , 4870–4879 (2021).
КАС Статья Google ученый
Ли, X., Ван, X., Рой, К., Ван Боховен, Дж. А. и Артилья, Л. Роль воды в структуре палладия для полного окисления метана. ACS Катал. 10 , 5783–5792 (2020).
КАС Статья Google ученый
Мурата, К.
 и др. Использование взаимодействия металл-носитель для настройки окислительно-восстановительных свойств нанесенных катализаторов Pd для сжигания метана. ACS Катал. 10 , 1381–1387 (2020).
и др. Использование взаимодействия металл-носитель для настройки окислительно-восстановительных свойств нанесенных катализаторов Pd для сжигания метана. ACS Катал. 10 , 1381–1387 (2020).КАС Статья Google ученый
Nilsson, J. et al. Эксперименты по ступенчатой реакции кислорода для окисления метана на Pd/Al 2 O 3 : исследование XAFS in situ. Катал. коммун. 109 , 24–27 (2018).
КАС Статья Google ученый
Кальвин, С. и др. Определение размера кристаллитов в магнитном нанокомпозите с использованием тонкой структуры с расширенным поглощением рентгеновских лучей. J. Appl. физ. 94 , 778–783 (2003).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Славинская Е.
 М. и др. Взаимодействие металл-носитель в модельных катализаторах окисления СО Pd/CeO 2 : от импульсно-лазерно-аблированных наночастиц до высокоактивного состояния катализатора. Катал. науч. Технол. 6 , 6650–6666 (2016).
М. и др. Взаимодействие металл-носитель в модельных катализаторах окисления СО Pd/CeO 2 : от импульсно-лазерно-аблированных наночастиц до высокоактивного состояния катализатора. Катал. науч. Технол. 6 , 6650–6666 (2016).КАС Статья Google ученый
Su, Y.-Q., Liu, J.-X., Filot, I.A.W., Zhang, L. & Hensen, E.J.M. Высокоактивный и стабильный CH 4 окисление путем замещения Ce 4+ на два иона Pd 2+ в CeO 2 (111). ACS Катал. 8 , 6552–6559 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Кибис Л.С., Симаненко А.А., Стадниченко А.И., Зайковский В.И., Боронин А.И. Зондирование Pd 4+ видов в системе PdO x –CeO 2 методом рентгеновской фотоэлектронной спектроскопии.
 J. Phys. хим. C. 125 , 20845–20854 (2021).
J. Phys. хим. C. 125 , 20845–20854 (2021).КАС Статья Google ученый
Weng, X., Ren, H., Chen, M. & Wan, H. Влияние поверхностного кислорода на активацию метана на палладиевых и платиновых поверхностях. ACS Катал. 4 , 2598–2604 (2014).
КАС Статья Google ученый
Мозер, М. и др. Структура и реакционная способность церий-циркониевых катализаторов производства брома и хлора окислением галогеноводородов. J. Катал. 331 , 128–137 (2015).
КАС Статья Google ученый
Тоби, Б. Х. и Фон Дриле, Р. Б. GSAS-II: зарождение современного универсального программного пакета для кристаллографии с открытым исходным кодом. J. Appl. Кристаллогр. 46 , 544–549 (2013).
КАС Статья Google ученый
«>Равель Б. и Ньювилл М. АФИНА, АРТЕМИДА, ГЕФЕСТ: анализ данных рентгеновской абсорбционной спектроскопии с использованием IFEFFIT. J. Синхротронное излучение. 12 , 537–541 (2005).
КАС пабмед Статья Google ученый
Пауэлл, С. Дж. и Яблонски, А. База данных NIST по неупругому среднему свободному пути электронов — Версия 1.2 . (Национальный институт стандартов и технологий, 2010 г.).
Пульезе Р. и Паолуччи Г. Атомный расчет сечений фотоионизации и параметров асимметрии. https://vuo.elettra.eu/services/elements/WebElements.html (2020 г.).
Сарма, Д. Д. и Рао, С. Н. Р. XPES-исследования оксидов переходных металлов второго и третьего ряда, включая редкоземельные элементы.
 J. Электронные спектры. Относ. Феном. 20 , 25–45 (1980).
J. Электронные спектры. Относ. Феном. 20 , 25–45 (1980).КАС Статья Google ученый
Инглунд, Дж. и др. Дезактивация биметаллического катализатора окисления Pd/Pt, используемого в установке двигателя большой мощности стандарта Euro VI, работающего на биогазе. Катализаторы 9 , 1014 (2019).
КАС Статья Google ученый
Прусси, М., Джулеа, А., Лонза, Л. и Тиль, К. Биометан как альтернативное топливо для дорожного сектора ЕС: анализ существующей и планируемой инфраструктуры. Энергетическая стратегия. Ред. 33 , 100612 (2021 г.).
Артикул Google ученый
Simonelli, L. et al. CLAESS: линия поглощения жесткого рентгеновского излучения синхротрона ALBA CELLS. Cogent Phys . 3 , 1231987 (2016).
Ссылки на скачивание
Благодарности
N.J.D. признает финансирование, полученное в рамках исследовательской и инновационной программы Horizon 2020 Европейского Союза в рамках соглашения о гранте Марии Склодовской-Кюри № 897197. Работа выполнена при поддержке проектов MICINN/FEDER PID2021-124572OB-C31, PID2021-124572OB-C33 и GC 2017 SGR 128. Л.С. выражает благодарность программе MICINN Ramon y Cajal за индивидуальное соглашение о предоставлении стипендии RYC2019-026704-I. JL является научным сотрудником Serra Húnter и благодарен программе ICREA Academia. Эти эксперименты проводились на каналах CIRCE, CLAESS и MSPD на синхротроне ALBA в сотрудничестве с персоналом ALBA.
Информация об авторе
Авторы и организации
Институт энергетических технологий Каталонского политехнического университета, EEBE, Eduard Maristany 10-14, 08019, Барселона, Испания
Núria.
 J. Divins, Andrea Braga, Xavier Vendrell, Isabel Serrano, Xènia Garcia, Lluís Soler, Ilaria Lucentini & Jordi Llorca
J. Divins, Andrea Braga, Xavier Vendrell, Isabel Serrano, Xènia Garcia, Lluís Soler, Ilaria Lucentini & Jordi LlorcaФакультет химического машиностроения, Политехнический университет Каталонии, EEBE, Eduard Maristany 10-19, Barcelona, 08014 Испания
Нурия. Дж. Дивинс, Андреа Брага, Ксавьер Вендрелл, Ксения Гарсия, Луис Солер, Илария Лучентини и Хорди Льорка
Барселонский исследовательский центр многомасштабной науки и техники, Политехнический университет Каталонии, EEBE, Eduard Maristany 10-14, 08019, Барселона, Испания
Núria. J. Divins, Xènia Garcia, Lluís Soler & Jordi Llorca
Dipartimento Politecnico, Università Di Udine и Instm, Via Del Cotonificio 108, 33100, Udine, Италия
Mail
Синхротронный источник света ALBA, Carrer de la Llum 2-26, 08290, Серданьола-дель-Вальес, Барселона, Испания
Игнасио Х. Вильяр-Гарсия и Карлос Эскудеро
Авторы
- Нурия.
 J. Divins
J. DivinsПосмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Andrea Braga
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ксавьер Вендрелл
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Isabel Serrano
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Xènia Garcia
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Lluís Soler
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ilaria Lucentini
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Maila Danielis
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Andrea Mussio
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Sara Colussi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ignacio J.
 Villar-Garcia
Villar-GarciaПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Carlos Escudero
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Алессандро Троварелли
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jordi Llorca
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
N.J.D. и JL задумали проект. NJD, AB, XV, IS, XG, LS, IL, IJV-G и CE провели синхротронные эксперименты. Нью-Джерси и А.Б. интерпретировали данные РСА. Нью-Джерси интерпретировали данные XAS. Нью-Джерси и JL интерпретировали данные AP-XPS. ЯВЛЯЮСЬ. и MD синтезировали катализаторы. JL получил и интерпретировал данные HRTEM. М.Д. провел испытания каталитической активности. NJD, SC и JL написали рукопись. Все авторы обсуждали и комментировали рукопись. В. и JL получили финансирование и управляли проектом.
NJD, SC и JL написали рукопись. Все авторы обсуждали и комментировали рукопись. В. и JL получили финансирование и управляли проектом.
Авторы переписки
Переписка с Нурия. Дж. Дивинс или Хорди Льорка.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Рецензирование
Информация о рецензировании
Nature Communications благодарит анонимных рецензентов за их вклад в рецензирование этой работы.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате.


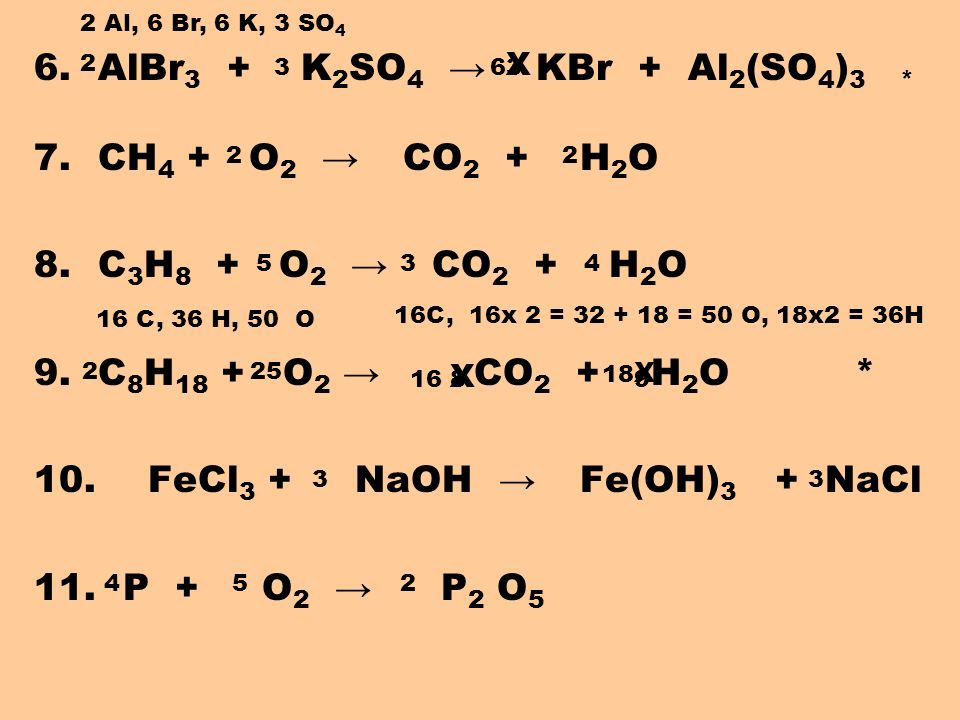
 0 через Flickr
0 через Flickr ck12.org/book/ck-12-human-biology/
ck12.org/book/ck-12-human-biology/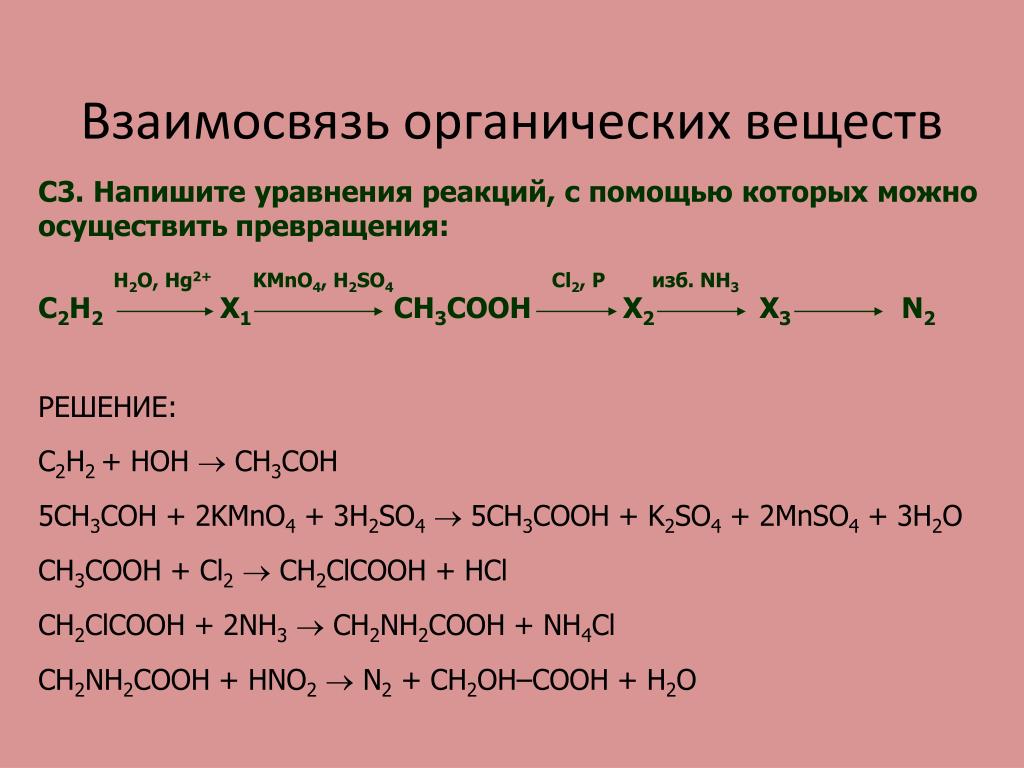 , Хорц Х.П., Кемниц Д., Конрад Р.
Хоффманн Т. и соавт.
Сист Appl Microbiol. 2002 авг; 25 (2): 267-74. дои: 10.1078/0723-2020-00104.
Сист Appl Microbiol. 2002.
PMID: 12353882
, Хорц Х.П., Кемниц Д., Конрад Р.
Хоффманн Т. и соавт.
Сист Appl Microbiol. 2002 авг; 25 (2): 267-74. дои: 10.1078/0723-2020-00104.
Сист Appl Microbiol. 2002.
PMID: 12353882 Колб С. и др.
Окружающая среда микробиол. 2005 г., август 7(8):1150-61. doi: 10.1111/j.1462-2920.2005.00791.x.
Окружающая среда микробиол. 2005.
PMID: 16011752
Колб С. и др.
Окружающая среда микробиол. 2005 г., август 7(8):1150-61. doi: 10.1111/j.1462-2920.2005.00791.x.
Окружающая среда микробиол. 2005.
PMID: 16011752 Обзор.
Обзор. 3390/microorganisms10050955.
Микроорганизмы. 2022.
PMID: 35630399
Бесплатная статья ЧВК.
3390/microorganisms10050955.
Микроорганизмы. 2022.
PMID: 35630399
Бесплатная статья ЧВК.