Реактор на быстрых нейтронах
Одной, если не самой существенной проблемой при использовании
энергии деления является проблема утилизации отходов и их радиотоксичность.
В течении десятилетий в результате работы реакторов на тепловых нейтронов в мире накопилось около 300 тысяч тонн ОЯТ. Предполагается,
что к 2030 году накопится уже 400 тысяч тонн. Частичная
переработка облученного топлива позволяет снизить объемы отходов. Однако, она
производится далеко не всегда. В отходах тепловых реакторов содержатся уран, в
частности большое количество 238U, плутоний, минорные актиниды,
продукты деления. Радиотоксичность продуктов деления относительно быстро спадает
и через ~200 лет она почти полностью определяется плутонием и америцием. В
тепловых реакторах не происходит сжигания четных изотопов плутония и минорных
актинидов. Их эффективная трансмутация нуждается в нейтронах с энергиями >0.75
МэВ. 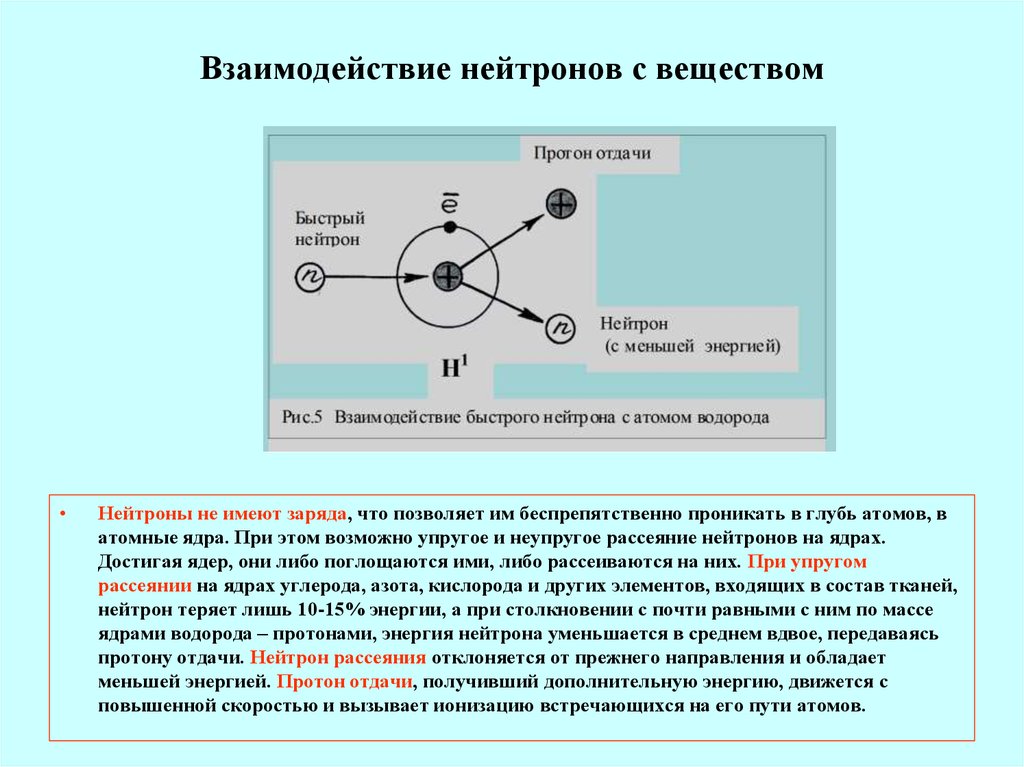 Этот тип
реакторов может работать на плутониевом топливе, произведенном на тепловых реакторах, и эксплуатироваться в замкнутом
цикле с собственным заводом по переработке отработанного топлива.
Они могут быть сконструированы так,
чтобы производить больше делящихся изотопов (239Pu, 241Pu),
чем используют − реакторы
размножители (бридеры). Использование бридеров позволит обеспечить нас энергией
на многие миллионы лет. Однако быстрые реакторы дороже и в
постройке и в эксплуатации. Их неоспоримое преимущество перед реакторами на
тепловых нейтронах заключается в том, что они
позволяют сжигать актиниды, которые составляют долгоживущую и высокоактивную
часть ядерных отходов реакторов на медленных нейтронах. Этот тип
реакторов может работать на плутониевом топливе, произведенном на тепловых реакторах, и эксплуатироваться в замкнутом
цикле с собственным заводом по переработке отработанного топлива.
Они могут быть сконструированы так,
чтобы производить больше делящихся изотопов (239Pu, 241Pu),
чем используют − реакторы
размножители (бридеры). Использование бридеров позволит обеспечить нас энергией
на многие миллионы лет. Однако быстрые реакторы дороже и в
постройке и в эксплуатации. Их неоспоримое преимущество перед реакторами на
тепловых нейтронах заключается в том, что они
позволяют сжигать актиниды, которые составляют долгоживущую и высокоактивную
часть ядерных отходов реакторов на медленных нейтронах.  В случае быстрых нейтронов для реализации цепной реакции
необходимо больше делящихся изотопов. Обычно быстрые реакторы в качестве
базового топлива используют 239Pu. При делении 239Pu выделяется на 25%
больше нейтронов, чем у 235U. Таким образом, при делении 239Pu
получается столько нейтронов (даже с учетом потерь), чтобы не только
поддерживать цепную реакцию, но и конвертировать 238U
в 239Pu. В реакторе на тепловых нейтронах отношение делящихся ядер к «новым»
делящимся ядрам приблизительно 0.6. В быстрых реакторах это отношение может быть
больше 1. Таким образом, запустив быстрый реактор, заложив в него достаточное
количество делящихся изотопов, в результате бридинга через некоторое время в
него можно будет добавлять естественный и даже обедненный уран. В случае быстрых нейтронов для реализации цепной реакции
необходимо больше делящихся изотопов. Обычно быстрые реакторы в качестве
базового топлива используют 239Pu. При делении 239Pu выделяется на 25%
больше нейтронов, чем у 235U. Таким образом, при делении 239Pu
получается столько нейтронов (даже с учетом потерь), чтобы не только
поддерживать цепную реакцию, но и конвертировать 238U
в 239Pu. В реакторе на тепловых нейтронах отношение делящихся ядер к «новым»
делящимся ядрам приблизительно 0.6. В быстрых реакторах это отношение может быть
больше 1. Таким образом, запустив быстрый реактор, заложив в него достаточное
количество делящихся изотопов, в результате бридинга через некоторое время в
него можно будет добавлять естественный и даже обедненный уран.Использование бридера позволяет снабжать топливом один или несколько реакторов на медленных нейтронах. Меняя материал бланкета, быстрый реактор может и не быть бридером, например, если у него заменить урановые бланкеты на стальные рефлекторы.  В этом случае он применяется, чтобы сжигать оружейный плутоний и другие
трансураны. В этом случае он применяется, чтобы сжигать оружейный плутоний и другие
трансураны. У быстрых реакторов отрицательный температурный коэффициент − при увеличении температуры цепная реакция затухает и при потере теплоносителя реакция прекращается. В реакторах на тепловых нейтронах в качестве теплоносителя в основном используется вода. Однако она замедляет нейтроны. В качестве теплоносителя в быстрых реакторах нужно использовать вещество, которое при температурах, существующих в реакторе, не поглощало и не замедляло нейтроны. Что касается ртути, то первое использование ее на малых экспериментальных установках показал неприемлемость ртути из-за коррозионного воздействия. Ртуть относительно быстро растворяет конструкционные материалы реактора. Кроме того ртуть имеет довольно большое сечение (n,γ), что приводит к ее активации, а также уменьшает количество нейтронов, необходимых для взаимодействия с топливом.  Натриевый теплоноситель
Рассмотрим для примера устройство быстрого реактора БН-600. Быстрый реактор БН-600 БН-600 − энергетический реактор на быстрых нейтронах,
введенный в эксплуатацию в апреле 1980 года в 3-м энергоблоке на Белоярской АЭС в
Свердловской области. 600 МВт. Быстрый
реактор БН-600 состоит из двух
частей − активной зоны, куда помещают
диоксид урана (UO2),
обогащенного по урану-235 до 17-26 процентов. Такое обогащение по
урану-235 необходимо для запуска реактора. В активной зоне
происходит в основном деление урана-235 и плутония-239. Теплоносителем в первых контурах реактора служит жидкий натрий. Одним из следствий применения натрия в БР стало то, что процессы получения энергии деления и производства плутония в этих реакторах пространственно разделены. Новые делящиеся изотопы образуются в боковой и торцевых зонах воспроизводства, окутывающих активную зону наподобие одеяла – откуда и пошло их английское название Давление в реакторе держится чуть выше атмосферного даже если температура натрия около 600 °С. Таким образом, реактор работает под небольшим давлением, что достаточно безопасно. Натрий практически не вызывает коррозию конструкционных материалов.  Кроме того, натрий обладает
прекрасными теплофизическими свойствами: он хорошо принимает,
проводит и отдает тепло. Натрий практически не снижает энергию
нейтронов и не является замедлителем, что существенно для быстрых
реакторов. Кроме того, натрий обладает
прекрасными теплофизическими свойствами: он хорошо принимает,
проводит и отдает тепло. Натрий практически не снижает энергию
нейтронов и не является замедлителем, что существенно для быстрых
реакторов.Активная зона и зона воспроизводства расположены в баке реактора. Через активную зону циркулирует натрий первого контура, который разогревается с 347 до 550 °С. В теплообменнике он передает тепло натрию второго контура. Второй контур служит для того, чтобы радиоактивный натрий из первого контура не мог проникнуть во второй, а затем и в третий контур. Теплоносителем третьего контура служит вода. Вода закипает, и пар поступает на турбину. Основания для выбора натрия были понятны.
Прогнозировались очень высокие темпы развития ядерной энергетики во
всём мире. Удвоение суммарных мощностей АЭС должно было происходить
за 5-10 лет. Стало понятно, что натрий
является безальтернативным теплоносителем для реакторов-размножителей, если стоит задача получить короткое время
удвоения плутония 10 лет и менее. Свинцовый теплоноситель Натриевый теплоноситель первого контура БН-реакторов (БН-600,
БН-350, PHENIX, SUPERPHENIX, PFR, FFTF, MONJU и др.) обладает
высокой наведенной активностью — Na-22, высокой активностью
долгоживущих продуктов деления и коррозии — Cs-137, Cs-134, Sb-125,
Mn-54, Co-60, Ag-110m, Zn-65, Ru-106, Ce-144, H-3, загрязнен ядерным
топливом, а также пожаро- и взрывоопасен. Натрий слишком активен для
безопасной эксплуатации. Альтернатива натрия с точки зрения
безопасности — свинец. У свинца малая замедляющая способность, что
позволяет иметь быстрый спектр нейтронов при широкой решетке
тепловыделяющих элементов, обеспечивая тем самым эффективную
циркуляцию во всех режимах работы. Свинец хорошо экранирует
гамма-излучение. В свинцовом теплоносителе удерживаются летучие
продукты деления урана — цезий и йод. Свинец инертен при
взаимодействии с водой и воздухом, что исключает пожары и взрывы, и
не нужен промежуточный контур и многочисленные изолируемые модули
парогенераторов. БРЕСТ — Быстрый Реактор с ЕСТественной безопасностью. В состав реакторной установки бассейновой конструкции входят
активная зона с отражателями и рабочими органами системы управления и защиты (РО
СУЗ), выполненный в виде четырех петель контур циркуляции свинцового
теплоносителя с парогенераторами, насосами, оборудованием системы перегрузки ТВС,
которые вместе с системами безопасности и вспомогательными системами размещены в
облицованных сталью центральной и четырех периферийных полостях бетонного
корпуса с тепловой защитой.
Циркуляция свинца через активную зону и парогенераторы
осуществляется не напором насосов, а создаваемой ими разницей
уровней «холодного» и «горячего» теплоносителей. Такая схема
исключает попадание в активную зону вместе с теплоносителем паровых
и газовых пузырей, что при определенных условиях могло бы привести к
неконтролируемому росту мощности. Замкнутый ядерный топливный цикл (ЗЯТЦ) Плутоний в
этой АЭС не выделяется, что обеспечивает технологическую поддержку
режима нераспространения. Отделяются осколки деления от тяжелых
металлов, в полученную композицию из урана, плутония и минорных
актиноидов добавляется уран-238 и из этой смеси формируются твэлы.
Это происходит прямо на АЭС в пристанционном модуле
регенерации-рефабрикации топлива. В результате долгоживущие МА в
составе регенерированного топлива возвращаются в активную зону для
сжигания, а выделенные продукты деления (РАО) направляются на
длительную контролируемую выдержку перед их окончательной изоляцией. Свинцово-висмутовый теплоноситель
Важным недостатком теплоносителя
свинец-висмут является накопление α-активного полония-210
образующего в результате взаимодействия висмута с нейтронами.
Скорость образования 210Po в свинце-висмуте примерно в 10
тысяч раз выше скорости его образования в свинце. В условиях
нормальной эксплуатации опасность полония-210 минимальна, однако её
нужно учитывать при рассмотрении аварийных ситуаций с попаданием
теплоносителя первого контура в помещения реакторного здания. Свинцово-висмутовый быстрый реактор СВБР-100 СВБР-100 – это двухконтурный
быстрый реактор малой мощности (100 МВт-э) модульного типа со
свинцово-висмутовым теплоносителем. Цель проекта – разработка
прототипа реактора на быстрых нейтронах модульного типа,
адаптированного к проектам гражданского назначения. На базе
испытанного модуля могут создаваться модульные ядерные
паропроизводящие установки для атомных станций различной мощности,
кратной мощности реактора. Кроме производства электроэнергии они
могут применяться при опреснении воды, производстве водорода, в
нефтехимии и др.
Особенностью реактора является
моноблочная компоновка оборудования первого контура, при которой все
оборудование первого контура (собственно реактор, модули
парогенераторов, главные циркуляционные насосы и др. |
Ответы | 2. По приведённому в тексте параграфа плану составьте описание следующих химических элементов: а) сера; б) хлор; в) алюминий; г) натрий. — Химия, 11 класс
а) сера
1. Элемент сера имеет химический знак S, атомный номер Z = 16. Сера расположена в третьем периоде, малом, в VI A-группе, главной. Относительная атомная масса Ar(S) = 32.
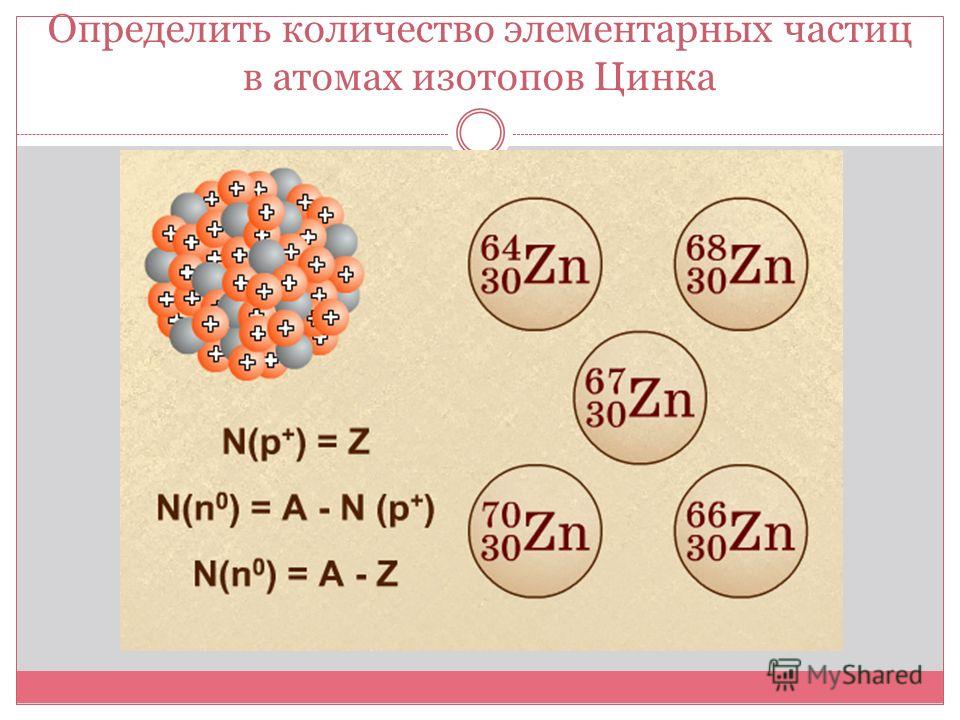
2. Строение атома:
а) заряд ядра атома серы +16. В состав ядра атома серы входят 16 протонов. Самый распространённый в природе изотоп — это нуклид 32S. Число нейтронов в ядре этого нуклида равно 32 – 16 = 16;
б) электронная оболочка атомов серы содержит 16 электронов, которые распределены по трем энергетическим уровням; электронная схема: 16S 2e, 8e, 6e; формула электронной конфигурации: 16S 1s22s22p63s23p4; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s23p4, значит, сера — р-элемент.
3. Степени окисления атомов элемента: высшая +6, так как на внешнем энергетическом уровне атома находится 6 электронов, низшая –2. Электроотрицательность: x(S) = 2.5. megaresheba.ru megareslieba.ru
4. Простое вещество азот является неметаллом, агрегатное состояние при н. у. — твердое, химическая формула S.
5. Формула высшего оксида S+6O3, оксид серы (VI), кислотный; формула гидроксида, соответствующего высшему оксиду, H2S+6O4, гидроксид кислотный, серная кислота; водородное соединение H2S-2, летучее, так как сера является неметаллом.
б) хлор
1. Элемент хлор имеет химический знак Cl, атомный номер Z = 17. Хлор расположен в третьем периоде, малом, в VII A-группе, главной. Относительная атомная масса Ar(Сl) = 35.5.
2. Строение атома:
а) заряд ядра атома хлора +17. В состав ядра атома хлора входят 17 протонов. Самый распространённый в природе изотоп — это нуклид 35Cl. Число нейтронов в ядре этого нуклида равно 35 – 17 = 18.
Число нейтронов в ядре этого нуклида равно 35 – 17 = 18.
б) электронная оболочка атомов содержит 17 электронов, которые распределены по трем энергетическим уровням; электронная схема: 17Cl 2e, 8e, 7e; формула электронной конфигурации: 17Cl 1s22s22p63s23p5; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s23p5, значит, хлор — р-элемент.
3. Степени окисления атомов элемента: высшая +7, так как на внешнем энергетическом уровне атома находится 7 электронов, низшая –1. Электроотрицательность: х(Сl) = 3.0.
4. Простое вещество хлор является неметаллом, агрегатное состояние при н. у. — газ, химическая формула Cl2.
5. Формула высшего оксида Cl+72O7, оксид серы (VII), кислотный; формула гидроксида, соответствующего высшему оксиду, HCl+7O4, гидроксид кислотный, хлорная кислота; водородное соединение HCl-1, летучее, так как хлор является неметаллом.
в) алюминий
1. Элемент алюминий имеет химический знак Al, атомный номер Z = 13. Алюминий расположен в третьем периоде, малом, в III A-группе, главной. Относительная атомная масса Ar(Al) = 27.
2. Строение атома:
а) заряд ядра атома алюминия +13. В состав ядра атома входят 13 протонов. Единственный в природе изотоп — это нуклид 27Al. Число нейтронов в ядре этого нуклида равно 27 – 13 = 14.
б) электронная оболочка атомов содержит 13 электронов, которые распределены по трем энергетическим уровням; электронная схема: 13Al 2e, 8e, 3e; формула электронной конфигурации: 13Al 1s22s22p63s23p1; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s23p1, значит, алюминий — р-элемент.
3. Степени окисления атомов элемента: высшая +3, так как на внешнем энергетическом уровне атома находится 3 электронов, низшая 0. Электроотрицательность: х(Al) = 1.5.
Электроотрицательность: х(Al) = 1.5.
4. Простое вещество алюминий является металлом, агрегатное состояние при н. у. —твердое, химическая формула Al.
5. Формула высшего оксида Al+32O3, оксид алюминия, амфотерный; формула гидроксида, соответствующего высшему оксиду, Al(OH)3, гидроксид алюминия, амфотерный; водородное соединение Al-3H3, нелетучее, так как алюминий является метал.
г) натрий
1. Элемент натрий имеет химический знак Na, атомный номер Z = 11. Натрий расположен в третьем периоде, малом, в I A-группе, главной. Относительная атомная масса Ar(Na) = 23.
2. Строение aтома:
а) заряд ядра атома натрия +11. В состав ядра атома входят 11 протонов. Самый распространённый в природе изотоп — это нуклид 23Na. Число нейтронов в ядре этого нуклида равно 23 – 11 = 12.
б) электронная оболочка атомов содержит 11 электронов, которые распределены по трем энергетическим уровням; электронная схема: 11Na 2e, 8e, 1e; формула электронной конфигурации: 11Na 1s22s22p63s1; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s1, значит, натрий — s-элемент.
3. Степени окисления атомов элемента: высшая +1, так как на внешнем энергетическом уровне атома находится 1 электронов, низшая 0. Электроотрицательность: x(Na) = 0.9.
4. Простое вещество натрий является металлом, агрегатное состояние при н. у. — твердое, химическая формула Na.
5. Формула высшего оксида Na+12O, оксид натрия, основный; формула гидроксида, соответствующего высшему оксиду, NaOH, гидроксид натрия, основный (щелочь), водородное соединение Al-3H3 нелетучее, гак как алюминий является металлом.
Карта сайта — Гимназия Святителя Василия Великого
Гимназия Святителя Василия Великого Гимназия Святителя Василия Великогоhomemapmail
|
|
 Зайцево
Зайцево
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Fe | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Fe | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
Натрий — Протоны — Нейтроны — Электроны
Натрий — мягкий серебристо-белый металл с высокой реакционной способностью. Натрий — это щелочной металл, относящийся к группе 1 периодической таблицы Менделеева, потому что он имеет единственный электрон во внешней оболочке, который он легко отдает, создавая положительно заряженный атом — катион Na+.
Натрий — это щелочной металл, относящийся к группе 1 периодической таблицы Менделеева, потому что он имеет единственный электрон во внешней оболочке, который он легко отдает, создавая положительно заряженный атом — катион Na+.
Металлический натрий используется в основном для производства боргидрида натрия, азида натрия, индиго и трифенилфосфина. При использовании только в довольно специализированных приложениях ежегодно производится только около 100 000 тонн металлического натрия. В настоящее время натрий производится в промышленных масштабах путем электролиза расплавленного хлорида натрия.
Протоны и нейтроны в натрии
Натрий — это химический элемент с атомным номером 11 , что означает, что в его ядре 11 протонов. Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулон .
Общее количество нейтронов в ядре атома называется нейтрон номер атома и обозначен символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно существует множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Натрий являются 23.
Основные изотопы натрия
Его единственный стабильный изотоп – 23 Na. Два радиоактивных космогенных изотопа являются побочным продуктом расщепления космическими лучами: период полураспада 22Na составляет 2,6 года, а период полураспада 24Na — 15 часов; все остальные изотопы имеют период полураспада менее одной минуты.
Натрий-23 состоит из 11 протонов, 12 нейтронов и 11 электронов. Острое нейтронное облучение (например, в результате аварии с ядерной критичностью) превращает некоторое количество стабильного 23Na в плазме крови человека в 24
На. Измерив концентрацию этого изотопа, можно рассчитать дозу нейтронного облучения жертвы.
Натрий-22 состоит из 11 протонов, 11 нейтронов и 11 электронов. натрий-22 представляет собой радиоактивный изотоп натрия, подвергающийся эмиссии позитронов до 22Ne с периодом полураспада 2,605 года. Он также широко используется в качестве источника позитронов в спектроскопии аннигиляции позитронов.
Натрий-24 состоит из 11 протонов, 12 нейтронов и 11 электронов. Натрий-24 — один из важнейших изотопов. Он радиоактивен и создается из обычного натрия-23 под действием нейтронной бомбардировки. Поэтому на его активность приходится большая часть активности теплоносителя реактора, когда реактор работает на полной мощности.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме натрия составляет ·11. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Следовательно, число электронов в нейтральном атоме натрия составляет ·11. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение определяют химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Натрия : [Ne] 3s1 .
Возможные степени окисления -1; +1 .
Атомы натрия имеют 11 электронов, что на один больше, чем в стабильной конфигурации благородного газа неона. Натрий обычно образует ионные соединения с участием катиона Na+. Натрий обычно довольно активно реагирует с воздухом, и эта реакционная способность зависит от относительной влажности или содержания водяного пара в воздухе. Коррозия твердого натрия кислородом также ускоряется наличием в натрии небольших количеств примесей. В обычном воздухе металлический натрий вступает в реакцию с образованием пленки гидроксида натрия, которая может быстро поглощать углекислый газ из воздуха, образуя бикарбонат натрия.
Натрий обычно образует ионные соединения с участием катиона Na+. Натрий обычно довольно активно реагирует с воздухом, и эта реакционная способность зависит от относительной влажности или содержания водяного пара в воздухе. Коррозия твердого натрия кислородом также ускоряется наличием в натрии небольших количеств примесей. В обычном воздухе металлический натрий вступает в реакцию с образованием пленки гидроксида натрия, которая может быстро поглощать углекислый газ из воздуха, образуя бикарбонат натрия.
Металлический натрий легко режется ножом, он является хорошим проводником электричества и тепла, поскольку имеет только один электрон в своей валентной оболочке, что приводит к слабой металлической связи и свободным электронам, переносящим энергию.
Наиболее распространенное соединение натрия
Соль в основном представляет собой хлорид натрия, ионное соединение с формулой NaCl, представляющее равные пропорции натрия и хлора. Морская соль и свежедобытая соль (большая часть которой представляет собой морскую соль из доисторических морей) также содержат небольшое количество микроэлементов (которые в этих небольших количествах обычно полезны для здоровья растений и животных). 0911
0911
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной протонов много, и они составляют 90 921 примерно половины 90 922 всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и это спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонами , связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон — это одна из субатомных частиц, составляющих материю. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. У него нет электрического заряда , а масса покоя равна 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой из-за своего положительного заряда. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильные ядра .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны, что помогает компенсировать электрическое отталкивание между протонами. В результате с увеличением числа протонов для образования стабильного ядра требуется увеличивающееся отношение нейтронов к протонам . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или электронному захвату. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующий выброс гамма-излучения . Чистые альфа- или бета-распады очень редки.
В результате с увеличением числа протонов для образования стабильного ядра требуется увеличивающееся отношение нейтронов к протонам . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или электронному захвату. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующий выброс гамма-излучения . Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях.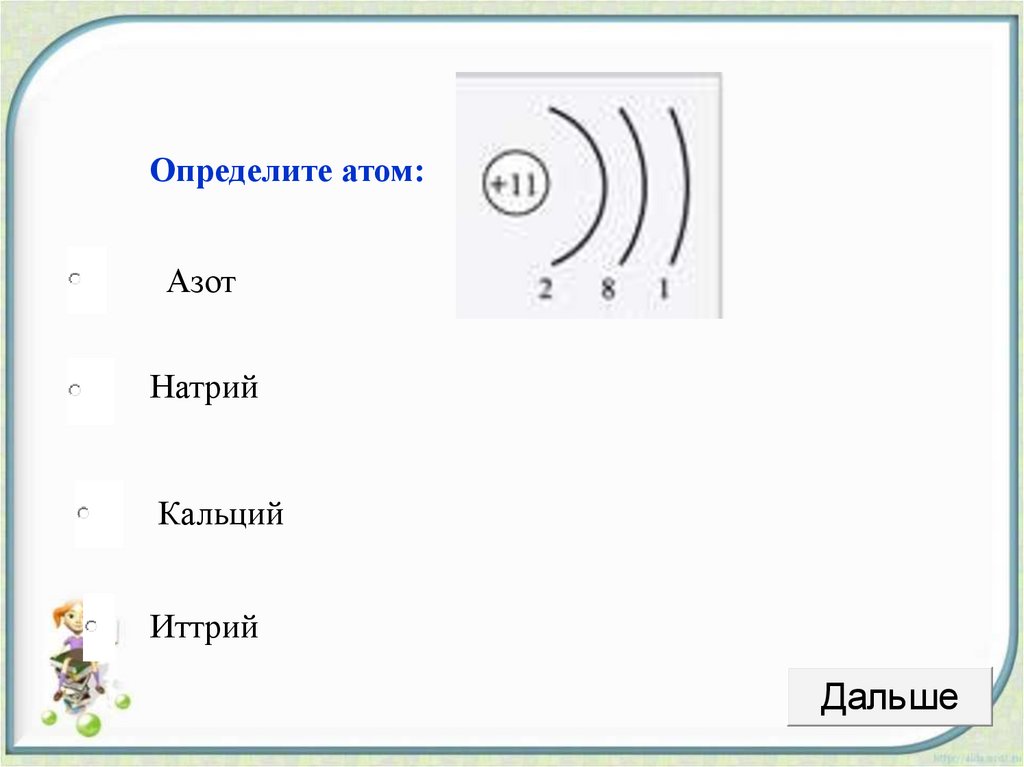 Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов.
Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически количеством и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип запрета Паули , который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел.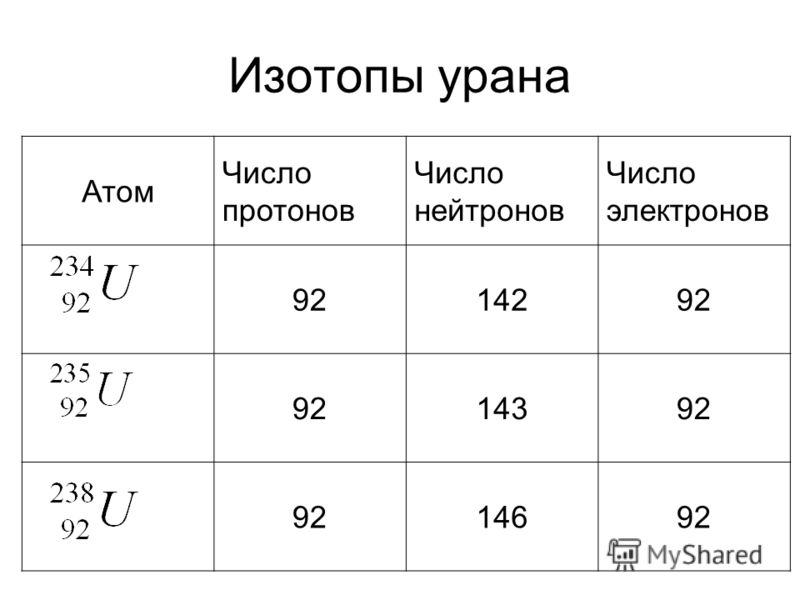 Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочки. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d представляет собой 10 средних столбцов периодической таблицы, а блок f представляет собой раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Натрий |
| Количество протонов | 11 |
| Количество нейтронов (типичные изотопы) | 23 |
| Количество электронов | 11 |
| Электронная конфигурация | [Не] 3s1 |
| Степени окисления | -1; +1 |
Источник: www.luciteria.com
Свойства других элементов
Другие свойства натрия
Натрий – информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к магнию >
| Группа | 1 | Температура плавления | 97,794 ° С, 208,029 ° F, 370,944 К |
| Период | 3 | Температура кипения | 882,940°С, 1621,292°F, 1156,090 К |
| Блок | с | Плотность (г см -3 ) | 0,97 |
| Атомный номер | 11 | Относительная атомная масса | 22. 990 990 |
| Состояние при 20°C | Твердый | Ключевые изотопы | 23 На |
| Электронная конфигурация | [Ne] 3s 1 | Номер КАС | 7440-23-5 |
| ChemSpider ID | 4514534 | ChemSpider — бесплатная база данных химической структуры.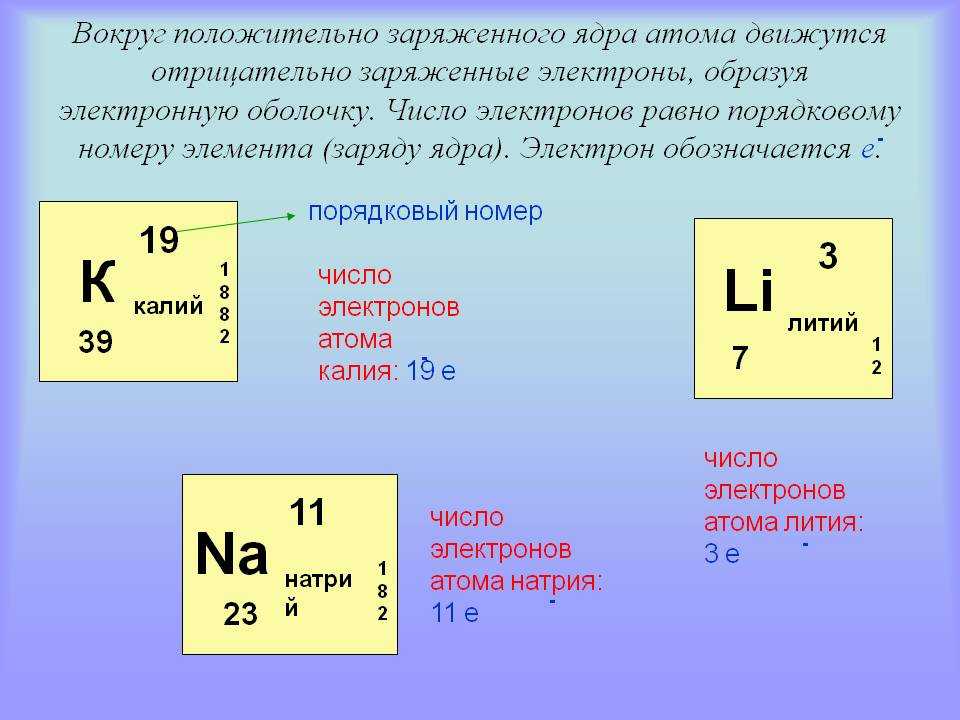 | |
Две линии в круге представляют натрий и являются одним из символов элемента, разработанным Джоном Дальтоном в 19 веке. Оранжевое свечение похоже на цвет уличного освещения натрия, а символ «вспышка» с шипами отражает высокую реакционную способность элемента.
Натрий — мягкий металл, который тускнеет в течение нескольких секунд после контакта с воздухом. Он также бурно реагирует с водой.
Натрий используется в качестве теплообменника в некоторых ядерных реакторах и в качестве реагента в химической промышленности. Но соли натрия имеют больше применений, чем сам металл.
Наиболее распространенным соединением натрия является хлорид натрия (поваренная соль). Его добавляют в пищу и используют для размораживания дорог зимой. Он также используется в качестве сырья для химической промышленности.
Карбонат натрия (стиральная сода) также является полезной натриевой солью. Используется как смягчитель воды.
Используется как смягчитель воды.
Натрий необходим всем живым существам, и люди знали об этом с доисторических времен. В нашем организме содержится около 100 граммов, но мы постоянно теряем натрий разными путями, поэтому нам необходимо восполнить его. Мы можем получить весь необходимый нам натрий из пищи, не добавляя ничего лишнего. В среднем человек съедает около 10 граммов соли в день, но на самом деле нам нужно всего около 3 граммов. Любой дополнительный натрий может способствовать повышению кровяного давления. Натрий важен для многих различных функций человеческого организма. Например, он помогает клеткам передавать нервные сигналы и регулировать уровень воды в тканях и крови.
Натрий является шестым наиболее распространенным элементом на Земле и составляет 2,6% земной коры. Наиболее распространенным соединением является хлорид натрия. Эта хорошо растворимая соль выщелачивалась в океаны на протяжении всей жизни планеты, но многие соляные залежи или «озера» находятся там, где испарились древние моря. Он также содержится во многих минералах, включая криолит, цеолит и содалит.
Он также содержится во многих минералах, включая криолит, цеолит и содалит.
Поскольку натрий настолько реактивен, он никогда не встречается в природе как металл. Металлический натрий получают электролизом сухого расплавленного хлорида натрия.
Элементы и история периодической таблицы
Соль (хлорид натрия, NaCl) и сода (карбонат натрия, Na 2 CO 3 ) были известны с доисторических времен, первая использовалась в качестве ароматизатора и консерванта, а вторая для производства стекла. Соль получали из морской воды, а соду — из долины Натрон в Египте или из пепла некоторых растений. Их состав обсуждался ранними химиками, и решение, наконец, пришло из Королевского института в Лондоне в октябре 1807 года, где Хамфри Дэви подверг едкий натр (гидроксид натрия, NaOH) электрическому току и получил глобулы металлического натрия, как он это сделал ранее. для калия, хотя ему нужно было использовать более сильный ток.
В следующем году Луи-Жозеф Гей-Люссак и Луи-Жак Тенар получили натрий, нагрев до красного каления смесь едкого натра и железных опилок.
| Атомный радиус, несвязанный (Å) | 2,27 | Ковалентный радиус (Å) | 1,60 |
| Сродство к электрону (кДж моль −1 ) | 52,867 | Электроотрицательность (шкала Полинга) | 0,93 |
| Энергии ионизации (кДж моль -1 ) | 1 ст 495. 2 и 4562.444 3 рд 6910,28 4 -й 9543,36 5 -й 13353,6 6 -й 16612,85 7 -й 20117. 8 -й 25496,25 | ||
| Общие степени окисления | 1 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 23 На | 22.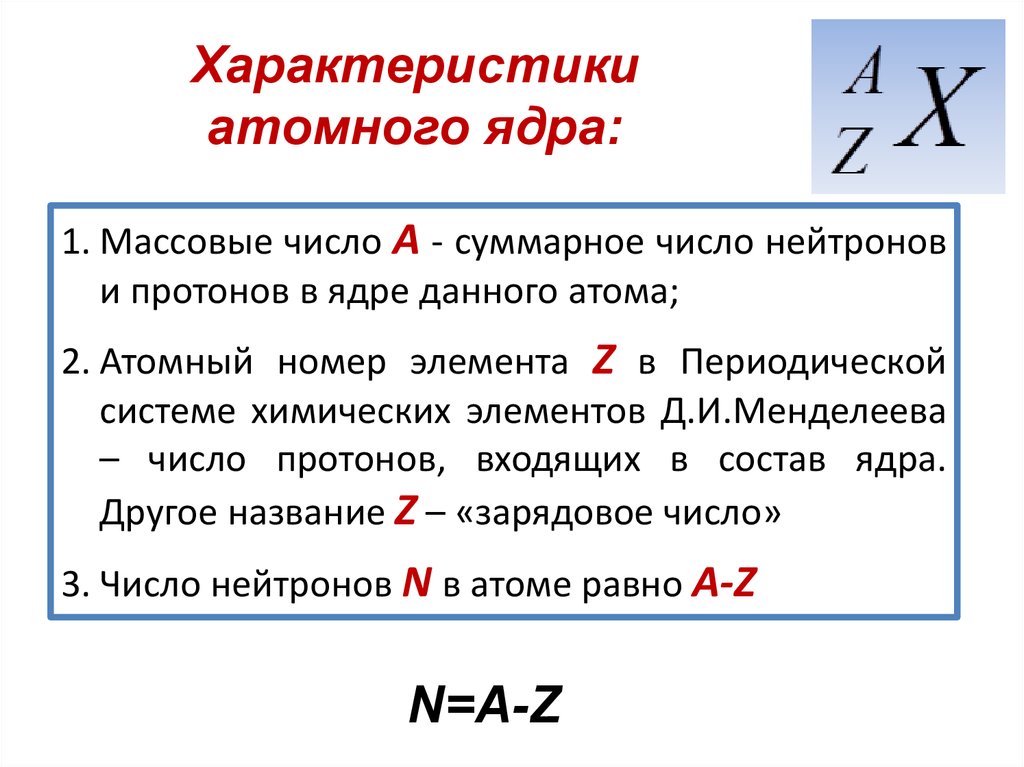 990 990 | 100 | — | — | |
|
|
| Удельная теплоемкость (Дж кг −1 К −1 ) | 1228 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | 6. 3 3 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст натрия |
Стенограмма: (Promo) Вы слушаете химию в ее стихии, представленную вам Chemistry World , журнал Королевского химического общества. (Конец промо) Мира Сентилингам На этой неделе важный элемент с раздвоением личности. Вот Дэвид Рид. Дэвид Рид Натрий, как и большинство элементов периодической таблицы, может иметь двойственную природу. С одной стороны, это необходимое питательное вещество для большинства живых существ, и все же, благодаря своей реактивной природе, оно также способно сеять хаос, если вы сочетаете его с чем-то, чего не следует делать. Как таковой натрий встречается в природе только в виде соединений и никогда не встречается в виде свободного элемента. Несмотря на это, он очень распространен, составляя около 2,6% земной коры по весу. Его наиболее распространенные соединения включают растворенный хлорид натрия (или поваренную соль), его твердую форму, галит и катион, уравновешивающий заряд в цеолитах. Помимо того, что это важное питательное вещество, история человека и натрия, как говорят, началась еще во времена фараонов в Древнем Египте, с первого письменного упоминания о соединении натрия в виде иероглифов. Однако в средневековой Европе карбонат натрия также использовался как лекарство от головной боли, поэтому он получил название sodanum от арабского suda, что означает головная боль. Именно эта терминология вдохновила сэра Хамфри Дэви назвать элемент натрием, когда он впервые выделил его, пропуская электрический ток через едкий натр или гидроксид натрия в 1807 году. Этот процесс известен как электролиз, и, используя его, Дэви продолжил выделение элементарного калий, кальций, магний и барий очень похожим методом. Учителя химии часто путают детей, рассказывая им о химических символах. В то время как H, N, C и O кажутся совершенно логичными, сокращение натрия до Na поначалу кажется нелогичным. Однако если мы рассмотрим слово натрон, то увидим, откуда взялась сокращенная форма. При выделении в металлической форме серебристо-белый натрий является агрессивным элементом, немедленно окисляющимся при контакте с воздухом и бурно выделяющим газообразный водород, который может воспламениться при контакте с водой. Это один из высокореакционноспособных элементов первой группы, которые называют щелочными металлами. Как и другие щелочные металлы, он имеет очень характерный тест на пламя — ярко-оранжевый цвет из-за эмиссии D-линии. Это то, что вы видели во всех застроенных районах в виде уличных фонарей, в которых используется натрий для получения неестественного желтого света, омывающего наши улицы. Этот эффект был впервые отмечен в 1860 году Кирхгофом и Бунзеном, известными как Bunsen Burner. Почти все молодые химики в какой-то момент проводят испытание пламенем, и хлорид натрия является популярным выбором. К сожалению, интенсивность цвета такова, что если какое-либо соединение прольется в горелку Бунзена, оно обречено гореть синим и оранжевым пятнистым пламенем, казалось бы, вечно. Реакция натрия с водой — любимая демонстрация, и в Интернете полно роликов с ней. Применение натрия и его соединений настолько разнообразно, что перечислить их все здесь просто невозможно. Пара примеров включает в себя тот факт, что натрий используется для охлаждения ядерных реакторов, поскольку он не кипит, как вода, при высоких температурах. достигнуты. Гидроксид натрия можно использовать для удаления серы из бензина и дизельного топлива, хотя образующийся токсичный бульон из побочных продуктов привел к тому, что этот процесс объявлен вне закона в большинстве стран. Гидроксид натрия также используется в производстве биодизельного топлива и в качестве ключевого компонента продуктов, удаляющих засоры из канализации. Пищевая сода на самом деле содержит натрий (это указано в названии!), и ее химическое название — бикарбонат натрия, где, я уверен, вы сталкивались с ней при выпечке или приготовлении пищи, где она подвергается термическому разложению при температуре выше 70°C с выделением углерода. диоксид — который затем заставляет ваше тесто подниматься. Однако именно в виде иона натрий становится действительно важным. Среднестатистическому человеку необходимо потреблять около двух граммов натрия в день, и практически все это будет поступать в виде соли с пищей. Ионы натрия используются для создания электрических градиентов при возбуждении нейронов в головном мозге. При этом натрий (и его старший брат калий) диффундирует через клеточные мембраны. Натрий диффундирует внутрь и откачивается обратно, в то время как калий совершает обратное путешествие. На это может уйти огромное количество энергии тела — иногда до 40 процентов. Я хотел бы закончить краткой историей, в которой подчеркивается двойственность натрия. Мира Сентилингам Это был Дэвид Рид из Саутгемптонского университета с двуличной химией натрия. На следующей неделе химический эквивалент обнаружения поезда. Брайан Клегг Легко обвинить ученых, производящих новые, очень тяжелые элементы, в том, что они следят за движением поездов в химии. Мира Сентилингам И чтобы узнать, почему элемент 114 стоит усилий, присоединяйтесь к Брайану Клеггу в программе Химия в своей стихии на следующей неделе. (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (конец акции) |
Нажмите здесь, чтобы посмотреть видео о натрии
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Мюррей Робертсон, 1998–2017.
W.M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г.
9 Таблица 917 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Строительные блоки природы: руководство по элементам от А до Я , Oxford University Press, 2nd, New York, 2nd, New York, Publishing.


 Переработка
использованного топлива, особенно в бланкете, типична для циклов в
быстрых реакторах. Обычно, выделенный с помощью переработки,
плутоний вводится в активную зону как MOX-топливо.
Причем, такая переработка топлива бланкета может осуществляться до
трех раз.
Переработка
использованного топлива, особенно в бланкете, типична для циклов в
быстрых реакторах. Обычно, выделенный с помощью переработки,
плутоний вводится в активную зону как MOX-топливо.
Причем, такая переработка топлива бланкета может осуществляться до
трех раз. Разведанных запасов урана для
обеспечения топливом столь большого числа атомных энергоблоков не
хватало. В сценариях с одними только тепловыми реакторами быстро
наступил бы топливный голод. Поэтому во всех странах,
развивавших быстрые программы, в конечном итоге было выбрано
натриевое направление. Однако строительство тепловых реакторов пошло
гораздо более медленными темпами, чем предполагалось и на
сегодняшний день отсутствует острая необходимость достижения высоких
значений КВ, так как природный уран всё ещё относительно доступен и
дёшев, а на складах скопились значительные запасы ОЯТ/плутония.
Таким образом, можно считать, что выбор в пользу натрия перестал
быть безальтернативным, и стало возможным вернуться к
рассмотрению других теплоносителей для быстрых реакторов.
Возникла потребность в скорейшем развитии быстрых реакторов и
замкнутого топливного цикла. Причём для быстрых реакторов
требовались высокие параметры воспроизводства.
Разведанных запасов урана для
обеспечения топливом столь большого числа атомных энергоблоков не
хватало. В сценариях с одними только тепловыми реакторами быстро
наступил бы топливный голод. Поэтому во всех странах,
развивавших быстрые программы, в конечном итоге было выбрано
натриевое направление. Однако строительство тепловых реакторов пошло
гораздо более медленными темпами, чем предполагалось и на
сегодняшний день отсутствует острая необходимость достижения высоких
значений КВ, так как природный уран всё ещё относительно доступен и
дёшев, а на складах скопились значительные запасы ОЯТ/плутония.
Таким образом, можно считать, что выбор в пользу натрия перестал
быть безальтернативным, и стало возможным вернуться к
рассмотрению других теплоносителей для быстрых реакторов.
Возникла потребность в скорейшем развитии быстрых реакторов и
замкнутого топливного цикла. Причём для быстрых реакторов
требовались высокие параметры воспроизводства.
 Кроме того, свинец удерживает в теплоносителе особо неприятных
летучих продукты деления урана — йод и цезий. У свинца высокая
температура кипения (1745°C), что исключает аварии с кризисом
теплообмена и быстрым разрушением тепловыделяющих элементов. Минус
свинца — высокая температуры плавления
327о С превращается в плюс — при возможной аварии с
разрушением корпуса, свинец застынет.
Кроме того, свинец удерживает в теплоносителе особо неприятных
летучих продукты деления урана — йод и цезий. У свинца высокая
температура кипения (1745°C), что исключает аварии с кризисом
теплообмена и быстрым разрушением тепловыделяющих элементов. Минус
свинца — высокая температуры плавления
327о С превращается в плюс — при возможной аварии с
разрушением корпуса, свинец застынет. Высокая теплопроводность обеспечивает надежность и
температурную стойкость топлива, позволяют работать при температуре
до 700о С. Выход агрессивных продуктов деления (цезий,
йод, селен, теллур и др.) из таблеток нитрида значительно меньше,
чем из оксидного топлива, — меньше коррозия оболочек твэлов.
Недостатком мононитридного топлива является образование
бета-активного улерода-14 по реакции 14N(n,p)14С.
Высокая теплопроводность обеспечивает надежность и
температурную стойкость топлива, позволяют работать при температуре
до 700о С. Выход агрессивных продуктов деления (цезий,
йод, селен, теллур и др.) из таблеток нитрида значительно меньше,
чем из оксидного топлива, — меньше коррозия оболочек твэлов.
Недостатком мононитридного топлива является образование
бета-активного улерода-14 по реакции 14N(n,p)14С. Ограничение температуры бетона поддерживается
естественной циркуляцией воздуха.
Ограничение температуры бетона поддерживается
естественной циркуляцией воздуха.
 Допускается также подмешивание к регенерату сторонних МА из ОЯТ
тепловых реакторов. При добавлении 241Am в количестве 3-5% от массы
загружаемого топлива за каждую кампанию будет выжигаться до 30%
этого радионуклида.
Допускается также подмешивание к регенерату сторонних МА из ОЯТ
тепловых реакторов. При добавлении 241Am в количестве 3-5% от массы
загружаемого топлива за каждую кампанию будет выжигаться до 30%
этого радионуклида.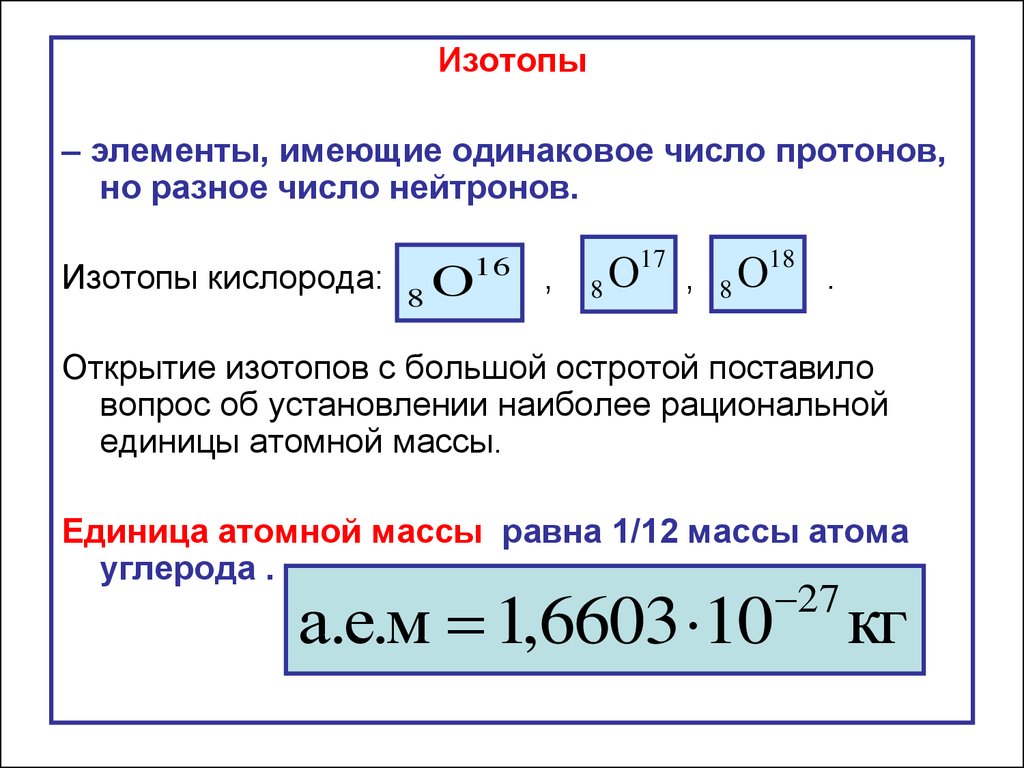 Таким образом, уже к началу четвертого цикла
(через три года) в активную зону загружаются ТВС из собственного
регенерированного топлива, которое было выгружено после облучения в
течение первого цикла. Расчеты показывают, что уже к началу восьмого
цикла реактор, загруженный только регенератом собственного
облученного топлива с добавкой отвального урана, начинает работать в
равновесном топливном режиме.
Таким образом, уже к началу четвертого цикла
(через три года) в активную зону загружаются ТВС из собственного
регенерированного топлива, которое было выгружено после облучения в
течение первого цикла. Расчеты показывают, что уже к началу восьмого
цикла реактор, загруженный только регенератом собственного
облученного топлива с добавкой отвального урана, начинает работать в
равновесном топливном режиме. Следовательно, нет необходимости поддерживать высокое давление в
первом контуре реакторной установки.
Следовательно, нет необходимости поддерживать высокое давление в
первом контуре реакторной установки. Это позволяет
существенно расширить диапазон рабочих температур для реакторов
со свинцом-висмутом).
Это позволяет
существенно расширить диапазон рабочих температур для реакторов
со свинцом-висмутом).
 ) размещено в
едином корпусе. Тракт теплоносителя первого контура сформирован
внутри корпуса моноблока без трубопроводов и арматуры. Утечки из
первого контура за пределы моноблока исключаются.
) размещено в
едином корпусе. Тракт теплоносителя первого контура сформирован
внутри корпуса моноблока без трубопроводов и арматуры. Утечки из
первого контура за пределы моноблока исключаются. Реактор СВБР-100 при
использовании МОКС-топлива (коэффициент воспроизводства в активной
зоне КВА~1) может работать в режиме топливного самообеспечения без
потребления природного урана.
Реактор СВБР-100 при
использовании МОКС-топлива (коэффициент воспроизводства в активной
зоне КВА~1) может работать в режиме топливного самообеспечения без
потребления природного урана. 845
845 2
2 1
1