Ca ca(oh)2 ca(hco3)2 caco3 cacl2 сделать
Ответ:
Ivan1128
03.07.2020 09:30
Ca + 2Н2О = Са (ОН) 2 + Н2
Са (ОН) 2 + 2СО2 = Са (НСО3)2
Са (НСО3)2 = СаСО3 + СО2 + Н2О
СаСО3 + 2HCl = CaCl2 + CO2 + h3O
0,0(0 оценок)
Ответ:
GNOM888
03.07.2020 09:30
1)Ca + 2Н2О = Са (ОН) 2 + Н2
2)Са (ОН) 2 + 2СО2 = Са (НСО3)2
3)Са (НСО3)2 = СаСО3 + СО2 + Н2О
4)СаСО3 + 2HCl = CaCl2 + CO2 + h3O
0,0(0 оценок)
Ответ:
Азрет2002
19.10.2020 23:10
1) 2ca+o2=2cao
2)cao+h3o=ca(oh)2
3)ca(oh)2+2co2=Ca(hco3)2+h3o
4)ca(hco3)2+ca(oh)2=CaCo3
5)CaCo3+co2+h3o=Ca(hco3)2
6)Ca(hco3)2+h3so4=Caso4+Co2+h3o
0,0(0 оценок)
Ответ:
ELIZA200425
19.10.2020 23:10
1) MnO2 + 4HCl = MnCl2 + Cl2 + 2h3O окислительно-восстановительная реакция коэффициенты подбираем методом электронного баланса: Mn(+4) + 2e = Mn(+2)x1 2Cl(-) — 2e = Cl2x1 2) MnCl2(электролиз расплава) = Mn + Cl2 3) Mn + h3SO4(разб) = h3 + MnSO4 4) MnSO4 + 2KOH = K2SO4 + Mn(OH)2 (осадок —в ионном виде: Mn(2+) + 2K(+) + 2OH(-) = 2K(+) + SO4(2-) + Mn(OH)2 —в кратком виде: Mn(2+) + 2OH(-) = Mn(OH)2 Остальные могу дописать вечером, если нужно Пиши в почту, тогда получишь утром.
0,0(0 оценок)
Ответ:
charaX
19.10.2020 23:10
1)2Ca+O2=2CaO
2) CaO+h3O=Ca(OH)2
3) Ca(OH)2+2CO2(избыток)=Ca(HCO3)2
4)Ca(HCO3)2=CaCO3+CO2+h3O
5) CaCO3+CO2+h3O=Ca(HCO3)2
6) Ca(HCO3)2+Na2SO4=CaSO4+2NaHCO3 (по идее так)
0,0(0 оценок)
Ответ:
474886
19.10.2020 23:10
1) 2Сa+O₂=2CaO (реакция соединения)
2) CaO+H₂O=Ca(OH)₂ (реакция соединения)
3) Ca(OH)₂+2CO₂=Ca(HCO₃)₂ (реакция соединения)
5) СaCO₃=CaO+CO₂ (реакция разложения; условие t)
0,0(0 оценок)
Ответ:
миша1089
19.10.2020 23:10
2Mg+O2→2MgO
MgO+h3O→Mg (OH)2
Mg (OH) 2+CO2→MgCO3+h3O
MgCO3+O2→MgO+CO2
MgO+h3→Mg+h3O
Mg+Cl2→MgCl2
0,0(0 оценок)
Ответ:
Unikorn111
19. 10.2020 23:10
10.2020 23:10
1)Ca+h3(t)=Cah3
2)Cah3+2h3O=Ca(OH)2+2h3*стрелочка вверх*
3)Ca(OH)2+2CO2=Ca(HCO3)2
или
Ca(OH)2+CO2=CaCO3*стрелочка вниз*+h3O
CaCO3+CO2+h3O=Ca(HCO3)2 (не знаю, как вам надо — в одну стадию, или можно в две)
4)Ca(HCO3)2(t)=CaCO3*стрелочка вниз*+h3O
5)CaCO3+2HCl=CaCl2+CO2*стрелочка вверх*+h3O
6)3CaCl2+2Na3PO4=6NaCl+Ca3(PO4)2*стрелочка вниз*
Ответ:
1234567891011121314з
19.10.2020 23:10
2Ca + O2 = 2CaO
CaO + 2HNO3 = Ca(NO3)2 + h3O
Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3
CaCO3 + CO2 + h3O = Ca(HCO3)2
Ca(HCO3)2 (t) = CaCO3 + CO2 + h3O
CaCO3 (t)= CaO + CO2
CaO + h3O = Ca(OH)2
0,0(0 оценок)
Ответ:
likaoolika
19.10.2020 23:10
a) Fe—>FeCl—>Fe(OH)3—>Fe2O2—>Fe
1) 2Fe + 3Cl2 = 2FeCl3 (хлорид железа (III))
2) FeCl3 + 3KOH = Fe(OH)3 + 3KCl (гидроксид железа(III) и хлорид калия)
3) 2Fe(OH)3 = Fe2O3 + 3h3O (оксид железа (III) и вода)
4) Fe2O3 + 3CO = 2Fe + 3CO2 (железо и углекислый газ)
б)Ca—>Ca(OH)2—>Ca(HCO3)2—>CaCO3—>CaCl2
1) Ca + 2h3O = Ca(OH)2 + h3↑ (гидроксид кальция и водород)
2) Ca(OH)2 + 2CO2 = Ca(HCO3)2 (гидрокарбонат кальция)
3) Ca(HCO3)2 = CaCO3 + h3O + CO2↑ (карбонат кальция, вода, углекислый газ)
4) CaCO3 + 2HCl = CaCl2 + h3O + CO2↑ (хлорид кальция, вода, углекислый газ)
0,0(0 оценок)
Ответ:
alyonaSidorenk
19. 10.2020 23:10
10.2020 23:10
Ca + 2Н2О = Са(ОН)2 + Н2
Са(ОН)2 + 2СО2 = Са(НСО3)2
Са(НСО3)2 = СаСО3 + СО2 + Н2О
СаСО3 + 2HCl = CaCl2 + CO2 + h3O
Ca + h3 = Cah3
Cah3 + h3O -> Ca(OH)2 + h3
CaO +h3O= Ca (OH) 2
Ca ( OH ) 2 + 2HNO3 =Ca(NO3) 2 +2h3O
0,0(0 оценок)
Ответ:
bellatrissa21
19.10.2020 23:10
Ca + 2Н2О = Са(ОН)2 + Н2
Са(ОН)2 + 2СО2 = Са(НСО3)2
Са(НСО3)2 = СаСО3 + СО2 + Н2О
СаСО3 + 2HCl = CaCl2 + CO2 + h3O
Ca + h3 = Cah3
Cah3 + h3O -> Ca(OH)2 + h3
CaO +h3O= Ca (OH) 2
незнаю правильно ли я решила ,но всё равно вот
0,0(0 оценок)
Ответ:
аввввввввввввввввввв
19.10.2020 23:10
Ca+2h3O = Ca(OH)2+h3
Са(ОН)2+СО2 = СаСО3+Н2О
CaCO3 +h3O +CO2 = Ca(HCO3)2
Ca(HCO3)2 = CaCO3+h3O+CO2
CaCO3 = CaO+CO2
0,0(0 оценок)
Ответ:
Никk
19. 10.2020 23:10
10.2020 23:10
Во всех веществах есть Ca, значит, это генетический ряд кальция.
1. Ca+2h3O = Ca(OH)2+h3
2. Ca(OH)2+K2CO3 = 2KOH+CaCO3(белый осадок, входит в состав мрамора и извстняка)
3.CaCO3+h3O+CO2 = Ca(HCO3)2
4.Ca(HCO3)2(t) = CaCO3+h3O+CO2
5.CaCO3 = CaO+CO2
0,0(0 оценок)
Ответ:
adamannik
19.10.2020 23:10
Оолклк~=гыш2гшцовлудвдыллцлылылылыл
Объяснение:
коулклкллулул
6пмемп6с5у5ри76ем
0,0(0 оценок)
Ответ:
слизеринсязмейка
19.10.2020 23:10
Вот так должно быть!!
0,0(0 оценок)
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.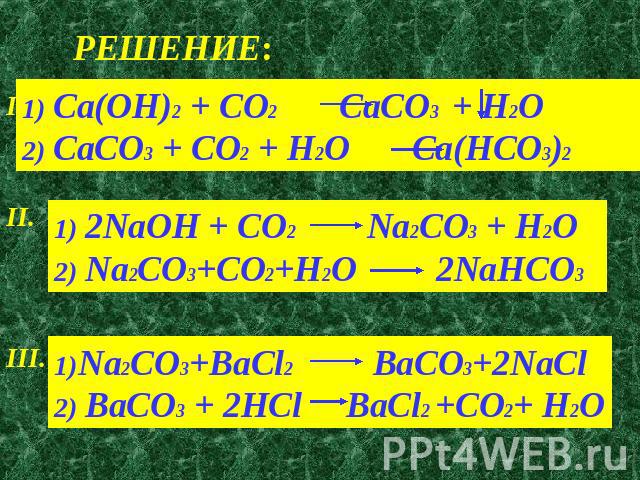
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/vOuj6t2Zyeg» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Структурная формула всех изомеров С7Н16
В каком году была сформулирована теория — предшественница кислородной теории горения.
Решено
В ходе какой/каких реакции(ий) не происходит удлинение углеродной цепи в два раза? Принять, что во всех реакциях участвует только одно органическое…
электронный баланс Nh4+O2=NO+h3O
Решено
C2h6 -> c2h5 -> c2h5oh…
Пользуйтесь нашим приложением
Химические свойства солей — реакции, определение и примеры
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl—
Термическое разложение:
CaCO3 = CaO + CO2
Нитраты разлагаются в зависимости от активности металла соли:
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
Чем (или как) определить концентрацию кислорода? | Страница 2
JavaScript отключён. Чтобы полноценно использовать наш сайт, включите JavaScript в своём браузере.
- Автор темы mutabor
- Дата начала
Darkcat
- #21
mutabor написал(а):
Понятно.
Т.е. это можно заметить и вовремя сделать ноги, что радует
Нажмите для раскрытия…
Можно. Если знать, чего ожидать. Так что советую попробовать «надышаться» до глюков дома.
mutabor написал(а):
А как же страшилки про «два вдоха и потерю сознания» (рассказывали нам на занятиях по пожарной безопасности, комментируя, что может произойти, если тушить огонь жидким азотом)?
Нажмите для раскрытия…
Ну… Если кислорода не останется совсем сознание вы потеряете действительно быстро. Если кислорода мало — сначала начнут отказывать мышцы.
Baron
- #22
mutabor написал(а):
Разве такое возможно, если кислород в норме? СО2 ведь не токсичен
Нажмите для раскрытия.
..
mutabor написал(а):
…что чувствуешь при повышении концентрации СО2? Ощущается ли она субъективно как нехватка кислорода, или ещё как-нибудь?
Нажмите для раскрытия…
Значит так. По поводу нетоксичности углекислого газа. Человек начинает задыхатся от избытка углекислоты, а не от недостатка кислорода. Субъективно (отвечаю на второй вопрос) человек ощущает именно избыток углекислоты как удушье, на недостаток кислорода организм вообще не реагирует! То есть всё ОК, пока сознание не теряется. Почему это происходит? Потому что дыхательный центр головного мозга «настроен» на углекислоту, вернее, на определённую концентрацию её в крови. Если концентрация углекислоты превышает определённое значение, дыхательный центр (своеобразный биологический датчик) автоматически увеличивает частоту дыхательных движений, при это выдавая сигнал для сознания » Удушье!» Человек может задохнуться при процентном содержании кислорода выше нормы! Чистого кислорода! Если, при этом, концентрация углекислоты будет равна 50% (кислород+углекислота пополам. Норма кислорода 20% норма углекислоты — 0,03% соответственно) то есть приготовить дыхательную смесь без азота: кислород+углекислота. Явления удушья начинаются при превышении порога углекислоты 5% во вдыхаемом воздухе. При 50 процентом содержании углекислоты последует смерть от шока — вследствии раздражения дыхательного центра.
Норма кислорода 20% норма углекислоты — 0,03% соответственно) то есть приготовить дыхательную смесь без азота: кислород+углекислота. Явления удушья начинаются при превышении порога углекислоты 5% во вдыхаемом воздухе. При 50 процентом содержании углекислоты последует смерть от шока — вследствии раздражения дыхательного центра.
- #23
mutabor написал(а):
Понятно. Т.е. это можно заметить и вовремя сделать ноги, что радует А как же страшилки про «два вдоха и потерю сознания» (рассказывали нам на занятиях по пожарной безопасности, комментируя, что может произойти, если тушить огонь жидким азотом)?
И того вырисовывается следующее:
СО2 — если его много, начинает хотеться дышать.
Т.е. почувствовать можно.
Метан: почувствовать нельзя, но не ядовит.
Сероводород и аммиак: хорошо чувствуются по запаху, можно вовремя надеть противогаз.Приходим к выводу что датчика только концентрации кислорода в принципе достаточно. Эх, научиться бы его делать на коленке!…
Нажмите для раскрытия…
Качественная реакция
Помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3(белый осадок) + h3O
Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + h3O + CO2 = Сa(HCO3)2
Гидроксид кальция{ Ca(OH)2 + CO2 } — гашёная известь — представляет собой белое мелкокристаллическое мало растворимое в воде вещество, обладает основным характером. Гидроксид кальция относят к сильным основаниям (все растворённые молекулы полностью распадаются на ионы) и, несмотря на малую растворимость в воде, — к щелочам. Нефильтрованный раствор гидроксида кальция называют «известковым молоком», а прозрачный раствор гидроксида кальция — «известковой водой».
Ca(OH)2 — по идее стабилен, в осадок выпадать не должен с попутными газами реагировать тоже. Не опасен (в слабой концентрации, всетаки щелочь).
Запасамся пробирками с Ca(OH)2 и клизмами (использовать надо правильно, в интересуещем нас месте ??? набираем воздух(желательно ближе к полу) и пропускаем его через раствор.
Прям щас представляю позвякивающий рюкзак с пробирками и перепуганные глаза милиции ???
- #24
Re: Чем (или как) определить концентрацию кис&
Ага, ещё к известковой воде желательно иметь таблицу зависимости растворимостей Ca(OH)2 и CO2 от температуры, маленький компрессор (потому что клизмой прокачивать убьёшься и повторяемость результатов-никакая будет), ph-метр (с термокомпенсацией). .. Зато можно отмазываться, что прjводишь анализы воздуха. В 3 часа ночи в люке )))
.. Зато можно отмазываться, что прjводишь анализы воздуха. В 3 часа ночи в люке )))
- #25
Датчики http://www.chip-dip.ru/library/DOC000052164.pdf
Цены http://www.chip-dip.ru/catalog/1566.aspx?mode=parm&sort1=0&sort2=2&gmnf=
Баксов в 300 можно уложиться (СН4, СО2, О2). Хотя гарантий никаких не будет и калибровать замучаешься.
Darkcat
- #26
Еще раз — CO2 ловится ощущениями, недостаток кислорода — карбидкой. Это самое простое. Остальное или имеет запах, или неопасно для здоровья.
Это самое простое. Остальное или имеет запах, или неопасно для здоровья.
Негр
- #27
Darkcat написал(а):
Еще раз — CO2 ловится ощущениями, недостаток кислорода — карбидкой. Это самое простое. Остальное или имеет запах, или неопасно для здоровья.
Нажмите для раскрытия…
Болотный газ не имеет запаха, встречается в концентрациях опасных для здоровья. Пытаться уловить его карбидкой, конечно можно, но лучше этого не делать.
Darkcat
- #28
Re: Чем (или как) определить концентрацию кис&
Метан? Взрывоопасен от 6% в воздухе. Карбидка его взорвет, но вы будете не в эпицентре, тоесть шанс попасть под завал уменьшается.
Карбидка его взорвет, но вы будете не в эпицентре, тоесть шанс попасть под завал уменьшается.
А вообще в болотном газе присутствует N2O, оно имеет характерный запах. Слабый, но перепутать невозможно. Кто хоть раз был на болоте поймут.
[добавлено]
Darkcat написал(а):
присутствует N2O
Нажмите для раскрытия…
С этими тегами я написал не то, что думал. Должно быть NO2
Негр
- #29
Darkcat написал(а):
Метан? Взрывоопасен от 6% в воздухе.
Карбидка его взорвет, но вы будете не в эпицентре, тоесть шанс попасть под завал уменьшается.
А вообще в болотном газе присутствует N2O, оно имеет характерный запах. Слабый, но перепутать невозможно. Кто хоть раз был на болоте поймут.
Нажмите для раскрытия…
1. Всё же приятного мало будет оказаться в скольких там сантиматрах от эпицентра.
2. на болтах бывал, но специфического запаха не припомню. А последнее время у меня вобще проблемы с обонянием. Так что метод распознования газа по слабому запаху не годится.
Иногда в речках со двна из под ног всплывают пузырьки газа практически без запаха. Тут уж карбидку совсем не хочется.
El Wizardo
- #30
Darkcat написал(а):
Метан? Взрывоопасен от 6% в воздухе.
Карбидка его взорвет, но вы будете не в эпицентре, тоесть шанс попасть под завал уменьшается.
А вообще в болотном газе присутствует N2O, оно имеет характерный запах. Слабый, но перепутать невозможно. Кто хоть раз был на болоте поймут.
Нажмите для раскрытия…
да и в речках подземных аналогично болоту и пузырьки из ила и ароматец спецЫфицкий…
Негр
- #31
El Wizardo написал(а):
да и в речках подземных аналогично болоту и пузырьки из ила и ароматец спецЫфицкий.
..
Нажмите для раскрытия…
Итого: как же определить в подземной речке можно ли идти дальше, или пора срочно выбрасываться?
El Wizardo
- #32
не знаю. я по своему состоянию определяю.. если совсем сильно ароматно и помаленьку крыша подъезжать начинает, то ноги оттуда пошустрее.
да и ходим с напарником а не поодиночке, на некотором отдалении, чтоб в случае чего помочь друг другу..
Отмодерировано. Selingary
Последнее редактирование модератором:
angel
- #33
N2O — Нужен только в машине чтобы ездить ночью
Сколько стоит газоанализатор,такой нормальный и сколько стоит дозиметр. Где это все можно купить?
Где это все можно купить?
Dhaitya
Guest
- #34
Концентрацию кислорода следует определять датчиком кислорода.
Достаточно интересно наблюдать развитие темы, точнее, как технически тривиальный вопрос увяз в нелепицах и безответственных выдумках дилетантов, первое место там делят использование карбидной лампы и себя в качестве датчика.
Теория использования подручных средств для создания анализатора не выдерживает критики, обнаруживая свою истинную цель: бесполезный и беспредметный диспут с алгоритмом «нет, это мне не подходит, что вы ещё можете предложить?».
В ваших, т.е. мобильных условиях концентрацию кислорода следует определять полупроводниковым датчиком кислорода, как наименее дорогостоящим и наиболее надёжным. Электрохимические и спектрометрические ячейки использовать не следует. Другие газы следует определять также полупроводниковыми датчиками. Стандартный набор должен включать в себя детекторы горючих газов и летучих органиков, совмещённые в одном датчике, детекторы моноксида и диоксида углерода, выполненные на 2-х разных датчиках и детектор кислорода на датчике с ограниченным временем жизни. Следует помнить, что в целях повышения оперативности срабатывания желательно осуществлять принудительный поддув анализируемой атмосферы. Учитывая крайне низкий уровень изготовления электронных устройств участниками форума, речь идёт только о покупке готового прибора.
С другой стороны, обсуждение ценового аспекта средств обеспечения жизнедеятельности, безусловно, имеет смысл при условии низкой сравнительной стоимости защищаемой особи.
Darkcat
- #35
Darkcat написал(а):
присутствует N2O
Нажмите для раскрытия…
С этими тегами я написал не то, что думал. Должно быть NO2
Войдите или зарегистрируйтесь для ответа.
Поделиться:
Twitter Reddit WhatsApp Электронная почта Ссылка
Почему молочность исчезает из известковой воды при пропускании через нее избытка СО2?
Полезные советы
Автор
Содержание
- 1 Почему молочность исчезает из известковой воды при пропускании через нее избытка СО2?
- 2 Что такое Млечность и почему она исчезает?
- 3 Когда газообразный CO2 пропускают через известковую воду, она становится молочного цвета, но в случае избытка CO2 молочный цвет исчезает утверждение, приводя соответствующие уравнения реакции?
- 4 Что происходит, когда газообразный диоксид углерода реагирует с гидроксидом натрия?
- 5 При пропускании диоксида углерода через известковую воду она становится молочной, но этот белый цвет исчезает при дальнейшем добавлении СО2 Это связано с образованием?
- 6 Что происходит, когда диоксид углерода реагирует с гидроксидом натрия Mcq?
- 7 При пропускании через известковую воду избытка углекислого газа ее молочность исчезает за счет образования a CA hco3 2 B CaCO3 C nahco3 D na2co3?
- 8 Почему исчезает молочность при пропускании углекислого газа через известь?
- 9 Что такое осадок CaCO3 и что вызывает помутнение?
- 10 Как амеба избавляется от углекислого газа и избытка воды?
Почему молочность исчезает из известковой воды при пропускании через нее избытка СО2?
При пропускании углекислого газа через известковую воду она мутнеет из-за образования карбоната кальция. При пропускании через известковую воду избытка углекислого газа образовавшаяся молочность исчезает. Это связано с образованием карбоната кальция, бесцветного и нерастворимого в воде.
При пропускании через известковую воду избытка углекислого газа образовавшаяся молочность исчезает. Это связано с образованием карбоната кальция, бесцветного и нерастворимого в воде.
Что такое Млечность и почему она исчезает?
При пропускании диоксида углерода в избытке карбонат кальция (который имеет молочный цвет) превращается в растворимый гидрокарбонат кальция. Следовательно, молочность исчезает.
Что такое молочность при пропускании CO2 через известковую воду?
CO2+Ca(OH)2 –> CaCO3+ h3O. Известковая вода — это не что иное, как Ca(OH)2, растворенный в воде. При добавлении СО2 раствор мутнеет из-за образования нерастворимого СаСО3.
Когда газообразный CO2 пропускают через известковую воду, она становится молочного цвета, но в случае избытка CO2 молочный цвет исчезает утверждение путем предоставления подходящих уравнений реакции?
При пропускании CO2 становится молочным из-за образования карбоната кальция. Но когда выходит избыток CO2, молочность исчезает, потому что карбонат кальция превращается в бикарбонат кальция.
Что происходит, когда газообразный диоксид углерода реагирует с гидроксидом натрия?
2 NaOH (т) + CO2 (г) → Na2CO3 (водн.) + h3O (л) Это означает, что твердый гидроксид натрия недостаточно чистый, чтобы его можно было взвешивать и использовать непосредственно. Эта реакция также протекает в водной фазе, где гидроксид натрия в растворе реагирует с СО2 из воздуха с образованием карбоната натрия.
При пропускании СО2 через известковую воду она мутнеет Молочность за счет образования a CaCO3 B Ca OH 2 C h3O D CO2?
Пояснение: Когда CO2 пропускают через известковую воду, она мутнеет из-за образования карбоната кальция, нерастворимого в известковой воде. Ca(OH)2+CO2⇒CaCO3+h3O. Однако при пропускании через этот раствор избытка СО2 молочность исчезает.
При пропускании диоксида углерода через известковую воду она становится молочной, но этот белый цвет исчезает при дальнейшем добавлении СО2 Это связано с образованием?
Известковая вода представляет собой гидроксид кальция, и когда газообразный диоксид углерода пропускают через известковую воду в течение короткого времени, она становится молочной из-за образования карбоната кальция. Таким образом, правильный ответ — B, т. е. карбонат кальция.
Таким образом, правильный ответ — B, т. е. карбонат кальция.
Что происходит, когда диоксид углерода реагирует с гидроксидом натрия Mcq?
Следовательно, ответ на этот вопрос будет заключаться в том, что гидроксид натрия реагирует с углекислым газом с образованием карбоната натрия.
Какой оксид образуется при взаимодействии диоксида углерода с гидроксидом натрия?
2NaOH +CO2———>Na2CO3 +h3O. Гидроксид натрия поглощает углекислый газ и образует карбонат натрия.
При пропускании избытка углекислого газа через известковую воду ее молочность исчезает за счет образования a CA hco3 2 B CaCO3 C nahco3 D na2co3?
Когда через известковую воду пропускают избыток диоксида углерода, карбонат кальция превращается в растворимый бикарбонат кальция, поэтому молочность из-за карбоната кальция исчезает.
Почему исчезает молочность при пропускании углекислого газа через известь?
Млечность исчезает при пропускании углекислого газа через известковую воду в избытке, потому что гидрокарбонат кальция растворим в воде, поэтому он растворяется.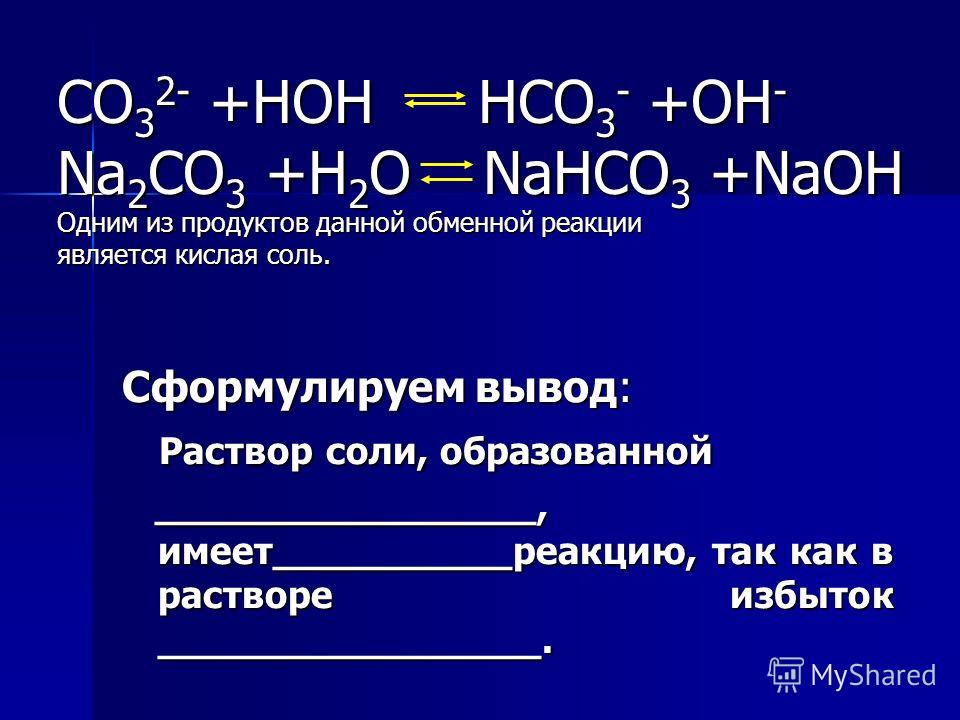 надеюсь, это поможет вам…
надеюсь, это поможет вам…
Что происходит, когда углекислый газ реагирует с известковой водой?
Водный раствор гашеной извести в воде известен как известковая вода. Когда известковая вода реагирует с углекислым газом, она превращается в нерастворимый карбонат кальция, что дает молочно-белый цвет, но при дальнейшем воздействии углекислого газа она превращается в гидрокарбонат кальция, который растворяется и становится прозрачным.
Что такое осадок CaCO3 и что вызывает помутнение?
Осадок CaCO3 вызывает помутнение. Если вы пропускаете избыток CO2 через известковую воду, CaCO3 реагирует с избытком CO2 и водой с образованием гидрокарбоната кальция или бикарбоната кальция. Гидрокарбонат кальция растворим в воде, поэтому молочко растворяется в воде.
Как амеба избавляется от углекислого газа и избытка воды?
Амеба избавляется от углекислого газа и избытка воды в процессе экзоцитоза. Это процесс, при котором газы и другие отходы покидают клетку через клеточную мембрану. Если углекислый газ пропустить в известковую воду, то мутнеет, при избытке углекислого газа молочность исчезает, почему?
Если углекислый газ пропустить в известковую воду, то мутнеет, при избытке углекислого газа молочность исчезает, почему?
|
Экспериментальное исследование реактора непрерывного действия для улавливания CO2 и осаждения CaCO3
1 Введение
В настоящее время производство осажденного карбоната кальция (PCC) для использования в таких продуктах, как чистящие средства, бумага или пластик, вызывает выбросы углекислого газа . Большая часть этих выбросов связана с процессом, поскольку исходный известняк CaCO 3 прокаливается при температуре около 1000°C для его разложения на оксид кальция CaO и диоксид углерода CO 9 .0437 2 . В то время как CO 2 из известняка, около двух третей от общего количества, вместе с тем, что образуется в результате сжигания топлива, необходимого для прокаливания, около одной трети (Anantharaman et al., 2017), обычно выбрасывается в атмосферу, CaO затем реагировал с водой в процессе гашения извести с образованием гидроксида кальция Ca(OH) 2 . Наконец, взвесь Ca(OH) 2 в воде карбонизируется CO 2 в количестве, точно равном количеству, выделяемому при прокаливании, с образованием конечного продукта, PCC. Если СО 2 для карбонизации были получены из самого дымового газа прокаливания, что позволило бы избежать части прямых выбросов. Однако, поскольку обычные продукты, использующие ПХК, сжигаются в конце срока службы, этот CO 2 снова выбрасывается в атмосферу (см. подробный анализ жизненного цикла, LCA, представленный в Mattila et al. (2014), Mattila и Zevenhoven). (2014а)). Недавно был предложен вариант замены известняка в качестве источника кальция известняком, не содержащим геогенного углерода. Такой подход позволил бы перейти от линейного подхода к производству РСС к циклическому подходу, который может сократить выбросы парниковых газов, сэкономить природные ресурсы и соответствовать требованиям, которые предписывает будущий устойчивый, углеродно-нейтральный мир.
Наконец, взвесь Ca(OH) 2 в воде карбонизируется CO 2 в количестве, точно равном количеству, выделяемому при прокаливании, с образованием конечного продукта, PCC. Если СО 2 для карбонизации были получены из самого дымового газа прокаливания, что позволило бы избежать части прямых выбросов. Однако, поскольку обычные продукты, использующие ПХК, сжигаются в конце срока службы, этот CO 2 снова выбрасывается в атмосферу (см. подробный анализ жизненного цикла, LCA, представленный в Mattila et al. (2014), Mattila и Zevenhoven). (2014а)). Недавно был предложен вариант замены известняка в качестве источника кальция известняком, не содержащим геогенного углерода. Такой подход позволил бы перейти от линейного подхода к производству РСС к циклическому подходу, который может сократить выбросы парниковых газов, сэкономить природные ресурсы и соответствовать требованиям, которые предписывает будущий устойчивый, углеродно-нейтральный мир.
Существует множество литературы о лабораторных процессах, в которых используются промышленные минеральные отходы для получения углеродно-нейтрального или даже углеродно-отрицательного ПКК (см. обзор (Sanna et al., 2014). ступенчатые процессы карбонизации минералов. На первой стадии кальций селективно извлекается из щелочного прекурсора с помощью растворителя. Остатки прекурсора удаляются фильтрованием. Богатый кальцием фильтрат контактирует с CO 2 на втором этапе, когда PCC осаждается из раствора. По сравнению с описанным выше обычным процессом карбонизации из известкового шлама, в таких процессах используются добавки, которые повышают растворимость кальцийсодержащих минералов, но в то же время имеют серьезные недостатки по причинам, подробно описанным ниже.
обзор (Sanna et al., 2014). ступенчатые процессы карбонизации минералов. На первой стадии кальций селективно извлекается из щелочного прекурсора с помощью растворителя. Остатки прекурсора удаляются фильтрованием. Богатый кальцием фильтрат контактирует с CO 2 на втором этапе, когда PCC осаждается из раствора. По сравнению с описанным выше обычным процессом карбонизации из известкового шлама, в таких процессах используются добавки, которые повышают растворимость кальцийсодержащих минералов, но в то же время имеют серьезные недостатки по причинам, подробно описанным ниже.
Постоянный состав жидкой фазы имеет решающее значение для качества РСС, поскольку он обеспечивает постоянный уровень пересыщения и, следовательно, постоянную движущую силу для зарождения и роста кристаллов, т. е. процессы, контролирующие окончательный размер, форму и морфологию частиц (см. Gullichsen et и др. (2000)), о том, как эти три характеристики определяют, соответствует ли PCC требованиям для промышленных и коммерческих приложений).
Обычные процессы карбонизации работают в периодическом режиме. Постоянный состав жидкой фазы, следовательно, постоянное пересыщение поддерживается благодаря взаимодействию между растворением Ca(OH) 2 , взвешенного в воде, и осаждением PCC в результате реакции с барботирующим CO 2 . Водный раствор богат ионами кальция благодаря относительно высокой растворимости Ca(OH) 2 и ионами карбоната благодаря образованию CO 2 ; они расходуются на осаждение CaCO 3 , который обладает очень низкой растворимостью. Только что описанный буферный эффект позволяет процессу работать при постоянном составе жидкой фазы до тех пор, пока не будет израсходован весь Ca(OH) 2 . Обратите внимание, что карбонат кальция может осаждаться в виде метастабильных полиморфных модификаций ватерита и арагонита или в виде стабильного полиморфного кальцита.
Двухстадийные процессы, в которых в качестве источника кальция используются промышленные отходы, имеют тенденцию работать при исходных концентрациях кальция на стадии осаждения на порядок выше, чем в случае, описанном выше. Это необходимо для максимизации цикличности процесса и достигается введением добавок, повышающих растворимость присутствующих кальцийсодержащих минералов, например Ca(OH) 2 , который представляет большой интерес, так как присутствует в больших количествах в наиболее распространенных промышленных минеральных отходах, т.е. бетоне для сноса. Следствием этого является то, что карбонизация происходит в водном растворе, богатом ионами кальция, но без буферного эффекта взвешенного Ca(OH) 2 . В таких периодических процессах изменяется состав жидкой фазы по мере прохождения карбонизации, что приводит к ухудшению свойств частиц. Обзоры литературы о текущих технологических маршрутах и влиянии условий синтеза на свойства частиц были проведены Chang et al. (2017b) и Jimoh et al. (2018).
Это необходимо для максимизации цикличности процесса и достигается введением добавок, повышающих растворимость присутствующих кальцийсодержащих минералов, например Ca(OH) 2 , который представляет большой интерес, так как присутствует в больших количествах в наиболее распространенных промышленных минеральных отходах, т.е. бетоне для сноса. Следствием этого является то, что карбонизация происходит в водном растворе, богатом ионами кальция, но без буферного эффекта взвешенного Ca(OH) 2 . В таких периодических процессах изменяется состав жидкой фазы по мере прохождения карбонизации, что приводит к ухудшению свойств частиц. Обзоры литературы о текущих технологических маршрутах и влиянии условий синтеза на свойства частиц были проведены Chang et al. (2017b) и Jimoh et al. (2018).
Чтобы использовать преимущества обоих подходов, т. е. постоянное перенасыщение и высокое содержание кальция, может быть реализован процесс непрерывной карбонизации, который является предметом и новизной данной работы. Разработка такого процесса требует глубокого понимания термодинамики и кинетики. В этой статье мы исследуем пространство дизайна непрерывного процесса карбонизации посредством экспериментального исследования.
Разработка такого процесса требует глубокого понимания термодинамики и кинетики. В этой статье мы исследуем пространство дизайна непрерывного процесса карбонизации посредством экспериментального исследования.
2 Экспериментальный
2.1 Материалы
Синтетическое сырье готовили из сверхчистой деионизированной воды (Millipore, 18,2 МОм·см), гидроксида кальция (Sigma-Aldrich, ≥ 96%) в качестве источника кальция и нитрата аммония (Sigma-Aldrich, ≥ 99%). В качестве источника CO 2 использовались синтетические газовые смеси (относительная погрешность ±1%) 25 и 85% CO 2 в N 2 (Pangas AG, Швейцария). Эксперименты были засеяны семенами карбоната кальция со средним диаметром 27 мкм. Семена были синтезированы в лаборатории и содержали фазы кальцита, ватерита и арагонита.
2.2 Экспериментальная установка
Упрощенная технологическая схема установки, построенной для экспериментов по непрерывному осаждению карбоната кальция, показана на рисунке 1. 850 мл стакан с двойными стенками, перемешиваемый (с использованием четырехлопастной верхней мешалки, работающей с помощью IKA, EUROSTAR, цифровой электродвигатель 40 и вращающийся со скоростью 30–2000 об/мин) кристаллизатор, который термостатируется с помощью термостата Huber CC 230. Для сохранения газонепроницаемости реактора вал мешалки был смазан консистентной смазкой и вставлен в стеклянную опорную втулку (Möller AG), которая снаружи охлаждалась льдом для сохранения вязкой консистенции смазки. Перистальтический насос (Watson-Marlow 502S) непрерывно перекачивал исходный раствор из резервуара для хранения в реактор. Насос был предварительно откалиброван и обеспечивал скорость потока 10–50 г раствора в минуту. Суспензию сливали периодически возникающими импульсами по 100–150 мл с помощью выпускного клапана, установленного на дне реактора. Суспензию переносили в устройство для фильтрации под давлением (BHS Sonthofen, Taschenmessgerät PLF), где ее фильтровали сжатым воздухом под давлением 6 бар.
850 мл стакан с двойными стенками, перемешиваемый (с использованием четырехлопастной верхней мешалки, работающей с помощью IKA, EUROSTAR, цифровой электродвигатель 40 и вращающийся со скоростью 30–2000 об/мин) кристаллизатор, который термостатируется с помощью термостата Huber CC 230. Для сохранения газонепроницаемости реактора вал мешалки был смазан консистентной смазкой и вставлен в стеклянную опорную втулку (Möller AG), которая снаружи охлаждалась льдом для сохранения вязкой консистенции смазки. Перистальтический насос (Watson-Marlow 502S) непрерывно перекачивал исходный раствор из резервуара для хранения в реактор. Насос был предварительно откалиброван и обеспечивал скорость потока 10–50 г раствора в минуту. Суспензию сливали периодически возникающими импульсами по 100–150 мл с помощью выпускного клапана, установленного на дне реактора. Суспензию переносили в устройство для фильтрации под давлением (BHS Sonthofen, Taschenmessgerät PLF), где ее фильтровали сжатым воздухом под давлением 6 бар. Частицы собирали на бумажных фильтрах (Macherey-Nagel, MN 625). Размер частиц измеряли с помощью устройства для лазерной дифракции (Sympatec, Helos BR). Морфологию частиц определяли методом XRD (Bruker, D2 Phaser). Изображения частиц были получены с помощью СЭМ (Hitachi, S-4800). Массу фильтрата и сухую массу частиц измеряли на весах. Газ подавали в реактор с помощью регулятора массового расхода (F-201-CV, Bronkhorst High-Tech BV). Барботер (спеченный металл, поры <10 мкм), установленный в нижней части реактора, создавал очень маленькие пузырьки газа, которые поднимались через суспензию к верхнему газовому погону реактора. Дефлегматор, подключенный к контуру охлаждающей воды (температура охлаждающей воды около 15°C), уменьшал потери воды и осушал газ перед его подачей в массовый расходомер газа (F-111-C, Bronkhorst High-Tech BV) и масс-спектрометр (ThermoStar GSD 301 C, Pfeiffer Vacuum Schweiz AG). Давление в системе поддерживалось на уровне 1,25 бар с помощью регулятора обратного давления (LFO, Equilibar, США) в сочетании с манометром.
Частицы собирали на бумажных фильтрах (Macherey-Nagel, MN 625). Размер частиц измеряли с помощью устройства для лазерной дифракции (Sympatec, Helos BR). Морфологию частиц определяли методом XRD (Bruker, D2 Phaser). Изображения частиц были получены с помощью СЭМ (Hitachi, S-4800). Массу фильтрата и сухую массу частиц измеряли на весах. Газ подавали в реактор с помощью регулятора массового расхода (F-201-CV, Bronkhorst High-Tech BV). Барботер (спеченный металл, поры <10 мкм), установленный в нижней части реактора, создавал очень маленькие пузырьки газа, которые поднимались через суспензию к верхнему газовому погону реактора. Дефлегматор, подключенный к контуру охлаждающей воды (температура охлаждающей воды около 15°C), уменьшал потери воды и осушал газ перед его подачей в массовый расходомер газа (F-111-C, Bronkhorst High-Tech BV) и масс-спектрометр (ThermoStar GSD 301 C, Pfeiffer Vacuum Schweiz AG). Давление в системе поддерживалось на уровне 1,25 бар с помощью регулятора обратного давления (LFO, Equilibar, США) в сочетании с манометром. Это небольшое избыточное давление облегчило снятие подвески.
Это небольшое избыточное давление облегчило снятие подвески.
РИСУНОК 1 . В упрощенной технологической карте синие буквы обозначают условия работы и подачи, а буквы органов указывают последующие данные, измеренные на протяжении всего эксперимента.
2.3 Методы и анализ
Перед каждым экспериментом готовили водные растворы с кажущейся концентрацией кальция cCa,in 0,2, 0,25, 0,3 и 0,35 моляля и кажущейся концентрацией нитрата аммония cNh5NO3,in 0,4, 0,6 и 0,7 моляля. . Для сокращения времени до выхода системы на циклический стационарный режим реактор первоначально заполняли 350 мл водного раствора с составом, близким к стационарному. Кроме того, в раствор вносили затравку 5 г затравок карбоната кальция. Первоначальная затравка кристаллами PCC может значительно уменьшить переходную фазу (Verdoes et al., 19).92). Перед началом эксперимента газовое верхнее пространство реактора было заполнено азотом. Кроме того, система была протестирована, чтобы убедиться в отсутствии утечек газа. Для проведения изотермических экспериментов термостат устанавливали на заданную температуру T , т. е. преимущественно 25°С.
Для проведения изотермических экспериментов термостат устанавливали на заданную температуру T , т. е. преимущественно 25°С.
В нулевое время перистальтический насос начал подавать питательный раствор со скоростью Qin и желаемого состава. Одновременно верхнеприводная мешалка была переключена на 250 об/мин, и регулятор массового расхода начал подавать CO 9 .0437 2 Поток богатого газа с расходом Fin и заданным составом, yi,in. Регулятор обратного давления был установлен на 1,25 бар. Поскольку выпускное отверстие для жидкости периодически открывалось, уровень жидкости поднимался до тех пор, пока не достигал верхнего уровня. В этот момент выпускной клапан жидкости открывался на несколько секунд до тех пор, пока суспензия реактора не опускалась до нижнего уровня. Усредненный по времени объем суспензии составлял 0,4 л. Суспензию фильтровали и твердые вещества сушили в печи в течение ночи при 70°C. Измеряли массу твердых веществ, чтобы получить mCaCO3. Кроме того, распределение частиц по размерам измеряли с помощью лазерной дифракции, а присутствующие полиморфы идентифицировали с помощью XRD. Изображения сканирующей электронной микроскопии (СЭМ) использовали для двойной проверки типа присутствующего полиморфа и для идентификации различных морфологий.
Изображения сканирующей электронной микроскопии (СЭМ) использовали для двойной проверки типа присутствующего полиморфа и для идентификации различных морфологий.
2.4 Планирование эксперимента
В ходе экспериментальной кампании было исследовано влияние различных условий подачи газа и жидкости на результат процесса. Рабочие параметры сгруппированы в две категории, причем вторая состоит из комбинированных величин, которые называются ключевыми рабочими параметрами из-за их важности.
2.4.1 Рабочие параметры
Условия работы системы определяются температурой T , давление P , состав газа на входе yi,in, расход газа на входе Fin, состав жидкой фазы на входе ci,in, расход исходной жидкости Qin, геометрия системы и скорость перемешивания n . Температура, давление и геометрия системы оставались неизменными. В частности, в экспериментах варьировались Qin, Fin, ci,in и yi,in, а также n (см. табл. 1), тогда как предполагалось, что усредненный по времени объем суспензии Vs в реакторе остается постоянным.
ТАБЛИЦА 1 . Условия подачи, KOP, а также данные по нисходящему потоку и эффективность процесса перечислены в таблице ниже. Все перечисленные эксперименты проводились при 250 об/мин, 25 °C и давлении в системе 1,25 бар. Эксперимент m проводили при скорости перемешивания 350 об/мин.
2.4.2 Основные рабочие параметры
Карбонат кальция осаждается по следующей реакции: -один. Стехиометрическое соотношение в сырье для реактора, ψF, определяется как:
ψF=FinyCO2,inQincCa,in(2-2)
В то время как термодинамика определяет теоретические пределы зарождения и роста кристаллов, кинетика определяет, насколько близко система приближается к этим пределам в зависимости от времени пребывания τ суспензии в реактор, который определяется как:
τ=VsρsQin(2-3)
В ходе экспериментальной кампании был проверен широкий диапазон рабочих условий, чтобы понять, как они влияют на скорость CO 2 , скорость зарождения и роста кристаллов CaCO 3 , а также размер и форма частиц. С этой целью значения ψF и τ варьировались в 3 раза.
С этой целью значения ψF и τ варьировались в 3 раза.
2.5 Обработка исходных данных
В этом разделе мы описываем, как измеренные исходные данные преобразуются в более полезные данные процесса, на основе которых рассчитываются характеристики процесса. .
2.5.1 Измерения
В ходе экспериментов расход газа на выходе Fout и концентрация CO 2 yCO2,out измеряются в режиме онлайн. Также измеряется масса кристаллов, выходящих из реактора в единицу времени mCaCO3. После фильтрации размер и форма частиц могут быть непосредственно проанализированы с помощью лазерной дифракции, XRD и SEM. В предположении, что обратный холодильник полностью осушает выходящий газовый поток, расход выходящей жидкости Qout равен расходу исходной жидкости Qin.
2.5.2 Расчеты
Из данных измерений определяются объемная удельная скорость поглощения CO 2 fMT и объемная удельная скорость осаждения CaCO 3 rc. Первое вычисляется из материального баланса CO 2 как:
fMT=(Fin yCO2,in-Fout yCO2,out)Vs(2-4)
Поскольку эксперименты проводятся с бинарным CO 2 — газовая смесь N 2 , выходящий газовый поток считается сухим, а N 2 9Предполагается, что 0438 не абсорбируется в растворе, следовательно, материальный баланс N 2 равен:
Fin yN2,in=Fout yN2,out(2-5)
вычислено из (уравнения 2-4, 2-5) как:
fMT=FinVs (yCO2,вх-1– yCO2,вх1-yCO2,вых yCO2,вых)(2-6)
Объемная удельная скорость PCC осадки rc можно рассчитать из материального баланса по твердой фазе как:
rc=mCaCO3Vs MCaCO3 (2-7)
2.
 5.3. Эффективность процесса
5.3. Эффективность процессаСО 2 эффективность поглощения ηCO2,абс. определяется и рассчитывается как:
ηCO2,абс.= fMTVsFinyCO2,in(2-8)
Произведение стехиометрии сырья ψF и эффективности абсорбции CO 2 ηCO2,абс. определяет эффективное стехиометрическое соотношение двух реагентов, поступающих в водный раствор, ψ, которое составляет:
ψ=fMTVs Qin cCa,in=ηCO2,abs. ψF(2-9)
Эффективность осаждения CO 2 из водного раствора, ηCO2,расч., определяется как:
ηCO2,prec.=rc fMT(2-10)
Наконец, CO 2 эффективность минерализации процесса по отношению к CO 2 , ηCO2, определяется как:
ηCO2=ηCO2,абс. ηCO2, предв. =rc VsFin yCO2,in(2-11)
, в то время как общая эффективность процесса по кальцию, ηCa, рассчитывается как:
ηCa=rcVsQin cCa,in (2-12)
Обратите внимание, что ηCa= ηCO2ψF(2-13)
Эти ключевые показатели эффективности (КПЭ) будут использоваться для сравнительной оценки процесса непрерывного осаждения и влияния условий эксплуатации.
3 Результаты
Мы провели двадцать три эксперимента, перечисленных в таблице 1, в соответствии с процедурой, описанной ниже. После этого мы сначала анализируем и обсуждаем воспроизводимость, затем влияние рабочих параметров на yCO2,out, mCaCO3 и L50 и, наконец, влияние ключевых рабочих параметров (KOP), то есть ψF, τ и pCO2,in, на поглощение CO. 2 и осаждение CaCO 3 , а также на конечные свойства частиц.
3.1 Феноменология экспериментов
Рисунок 2 иллюстрирует поведение в переходном и установившемся режимах, наблюдаемое в ходе трех типичных экспериментов с непрерывным осаждением. Сначала реактор заполняется раствором, богатым ионами кальция, в котором суспендированы затравочные кристаллы CaCO 3 , который контактирует с газовым потоком, состоящим из диоксида углерода и азота, 25/75 об./об., и с жидким ручей. Часть газа не абсорбируется и выходит из кристаллизатора с расходом и мольной долей CO 2 , которые представлены в зависимости от времени на рисунках 2A, B. Разница между СО 2 мольная доля сырья, т.е. 0,25, и приведенные значения показывают, что CO 2 действительно поглощается предпочтительно. Стабильное состояние достигается между 30 и 60 мин, в то время как концентрация газовой фазы изменяется от начальной концентрации CO 2 , равной 0,5%, до примерно 4% (стандартное отклонение 0,13%) (рис. 2B). Благодаря тому, что подача жидкости непрерывна, а выходной поток жидкости пульсирует, достигается циклический установившийся режим с периодом 8 мин, что можно наблюдать как в расходе газа на выходе (рис. 2А), так и в расходе на выходе СО 2 концентрация (рис. 2В). Основываясь на его определении (уравнение 2-6), удельная объемная скорость поглощения CO 2 уменьшается, когда скорость потока газа на выходе и концентрация CO 2 увеличиваются, как видно на рисунках 2A, B и рисунке 2B в первом случае. 30 мин эксперимента. Это является следствием того, что исходный раствор не содержит CO 2 и богат кальцием.
Разница между СО 2 мольная доля сырья, т.е. 0,25, и приведенные значения показывают, что CO 2 действительно поглощается предпочтительно. Стабильное состояние достигается между 30 и 60 мин, в то время как концентрация газовой фазы изменяется от начальной концентрации CO 2 , равной 0,5%, до примерно 4% (стандартное отклонение 0,13%) (рис. 2B). Благодаря тому, что подача жидкости непрерывна, а выходной поток жидкости пульсирует, достигается циклический установившийся режим с периодом 8 мин, что можно наблюдать как в расходе газа на выходе (рис. 2А), так и в расходе на выходе СО 2 концентрация (рис. 2В). Основываясь на его определении (уравнение 2-6), удельная объемная скорость поглощения CO 2 уменьшается, когда скорость потока газа на выходе и концентрация CO 2 увеличиваются, как видно на рисунках 2A, B и рисунке 2B в первом случае. 30 мин эксперимента. Это является следствием того, что исходный раствор не содержит CO 2 и богат кальцием. Окончательные установившиеся условия, в частности установившийся расход газа на выходе и CO 2 концентрации в газе и в растворе соответствуют тем, где скорость поглощения СО 2 и осаждение карбоната кальция уравновешивают друг друга.
Окончательные установившиеся условия, в частности установившийся расход газа на выходе и CO 2 концентрации в газе и в растворе соответствуют тем, где скорость поглощения СО 2 и осаждение карбоната кальция уравновешивают друг друга.
РИСУНОК 2 . Осаждение CaCO 3 при 25°C, 25% CO 2 в N 2 , 1,25 бар, ψF 1,08 и rmin 10,73 ммоль/мин/л: Три повторения (A) на выходе массовый расход газа, (B) CO 2 концентрация на выходе и (C) гранулометрический состав частиц, выходящих из процесса.
При абсорбции CO 2 распадается на ионы бикарбоната и карбоната, создавая таким образом пересыщение в отношении образования карбоната кальция в растворе, содержащем ионы кальция в различных формах. Механизм образования ПКК до сих пор является предметом дискуссий, хотя, безусловно, имеет сложный и многостадийный характер, т. е. сначала происходит образование аморфного карбоната кальция, который затем переходит в кристаллическую форму. Какой полиморф образуется, будь то ватерит, арагонит или кальцит (в порядке возрастания стабильности в условиях окружающей среды), также зависит от других факторов, помимо поглощения СО 2 (Пламмер, Бузенберг, 1982; Declet et al., 2016; Chang et al., 2017a). После осаждения кристаллы собирают фильтрованием, сушат в печи и характеризуют. На рис. 2C показано распределение частиц по размерам в зависимости от объема по диаметру частиц. В этом случае большинство частиц находятся в диапазоне от 10 до 120 мкм, при этом средний размер частиц составляет 57 мкм (стандартное отклонение 2,6 мкм). При этом скорость осаждения в представленных экспериментах составляет 0,26 г в минуту при стандартном отклонении 0,0005 г в минуту. В этой статье основное внимание уделяется стационарному поведению реактора карбонизации, поэтому переходная фаза не будет показана для дальнейших экспериментов.
Какой полиморф образуется, будь то ватерит, арагонит или кальцит (в порядке возрастания стабильности в условиях окружающей среды), также зависит от других факторов, помимо поглощения СО 2 (Пламмер, Бузенберг, 1982; Declet et al., 2016; Chang et al., 2017a). После осаждения кристаллы собирают фильтрованием, сушат в печи и характеризуют. На рис. 2C показано распределение частиц по размерам в зависимости от объема по диаметру частиц. В этом случае большинство частиц находятся в диапазоне от 10 до 120 мкм, при этом средний размер частиц составляет 57 мкм (стандартное отклонение 2,6 мкм). При этом скорость осаждения в представленных экспериментах составляет 0,26 г в минуту при стандартном отклонении 0,0005 г в минуту. В этой статье основное внимание уделяется стационарному поведению реактора карбонизации, поэтому переходная фаза не будет показана для дальнейших экспериментов.
3.2 Динамическая и стационарная воспроизводимость
Эксперименты k и l соответствуют двум повторениям одного и того же эксперимента; как показано на рисунках 2, 3, параметры процесса как в переходном, так и в установившемся режиме, а также свойства кристаллов продукта, в том числе тот факт, что они состоят из агломератов сферического ватерита, воспроизводимы.
РИСУНОК 3 . Показаны СЭМ-изображения частиц, собранных в ходе экспериментов по воспроизводимости.
Третий эксперимент, а именно эксперимент m, был проведен в идентичных условиях, за исключением того, что концентрация нитрата аммония, cNh5NO3,in, была уменьшена с 0,7 моляля до 0,6 моляля (зеленые точки данных на рисунке 2). Процесс протекает очень похоже, что снова наблюдается на рисунках 2, 3, что можно объяснить тем фактом, что хотя концентрация NH 4 NO 3 контролирует растворимость Ca(OH) 2 , в обоих этих рабочих условиях раствор недонасыщен по отношению к Ca(OH) 2 , следовательно, NH 4 NO 3 в избытке оказывает незначительное влияние на рН раствора. Экспериментальные результаты показывают, что это изменение cNh5NO3,in оказывает незначительное влияние на поглощение CO 2 и скорость осаждения CaCO 3 , а также на размер и морфологию частиц.
3.
 3 Влияние рабочих условий на входе
3 Влияние рабочих условий на входе На рис. 4 показано влияние изменения характеристик двух потоков на входе на результат процесса с точки зрения скорости абсорбции CO 2 , т. е. оцененное через значение CO 2 выходная концентрация в газовой фазе, выходящей из реактора, yCO2,out, количества осажденного карбоната кальция, mCaCO3, и среднего размера частиц, L50. Измерения показаны в зависимости от расхода исходной жидкости, Qin, и концентрации кальция в исходной жидкости, в верхнем и нижнем ряду, соответственно, для двух различных расходов исходного газа, Fin; красные и синие символы относятся к 14,8 и 18,5 ммоль мин -1 соответственно. Стоит отметить, что увеличение либо скорости потока жидкого сырья, либо содержания в нем кальция приводит к увеличению поступления кальция в раствор в реакторе, что увеличивает его щелочность, следовательно, его способность поглощать CO 2 . Однако только изменение расхода жидкого сырья влияет и на время пребывания в кристаллизаторе, т. е. последнее уменьшается при увеличении первого.
е. последнее уменьшается при увеличении первого.
РИСУНОК 4 . Концентрация CO 2 на выходе, CaCO 3 скорость потока на выходе и средневзвешенный размер частиц по объему нанесены как функция скорости подачи жидкости (подграфик A–C ) и как функция концентрации исходного кальция (подграфик D–F ). Буквы соответствуют экспериментальному ID точки данных согласно Таблице 1.
Рисунки 4A,D ясно показывают, что действительно концентрация CO 2 на выходе уменьшается почти до нуля, когда щелочность раствора увеличивается; СО 2 , который отсутствует по сравнению с сырьем, был абсорбирован (см. столбец, обозначенный fMT в таблице 1), и попадает либо в твердую фазу продукта (см. столбец, обозначенный rc в таблице 1), либо в маточный раствор. выходя из кристаллизатора.
Когда это происходит из-за увеличения концентрации кальция в корме, увеличение щелочности вызывает увеличение количества образующихся РСС (рис. 4Е). Однако увеличение расхода исходной жидкости, Qin, приводит к максимальному количеству образующегося PCC, что, возможно, связано с конкуренцией между положительным эффектом повышенной щелочности и отрицательным эффектом из-за соответствующего уменьшения времени пребывания. Также стоит отметить, что увеличение либо Qin, либо cCa,in приводит к переходу системы из условий с ограниченным содержанием кальция в режим CO 2 -ограниченный режим, при котором повышение щелочности не может принести дополнительных преимуществ.
4Е). Однако увеличение расхода исходной жидкости, Qin, приводит к максимальному количеству образующегося PCC, что, возможно, связано с конкуренцией между положительным эффектом повышенной щелочности и отрицательным эффектом из-за соответствующего уменьшения времени пребывания. Также стоит отметить, что увеличение либо Qin, либо cCa,in приводит к переходу системы из условий с ограниченным содержанием кальция в режим CO 2 -ограниченный режим, при котором повышение щелочности не может принести дополнительных преимуществ.
Средний размер кристаллов монотонно уменьшается с увеличением щелочности, как видно на рисунках 4C,F. Это комбинированный эффект сокращения времени пребывания для увеличения значений Qin и изменения химической среды, в которой происходит осаждение, при изменении состава раствора путем изменения значений cCa,in.
Наконец, влияние скорости потока газа на входе (красный: 14,8 ммоль мин −1 ; синий: 18,5 ммоль мин 90 115 -1 90 116 ), показанный шестью графиками на рисунке 4, менее примечательна, чем свойства потока жидкости, возможно, также потому, что все эти эксперименты проводились с одним и тем же составом газа.
3.4 Влияние основных рабочих параметров
Экспериментально исследовано влияние относительной величины ψF на эффективность процесса и свойства частиц. Такое понимание позволит спроектировать высокоэффективный процесс с точки зрения CO 2 и кальция в CaCO 3 эффективность преобразования и использование растворителя. Кроме того, будет изучено влияние этих параметров процесса на размер, форму и морфологию частиц.
3.4.1 Роль стехиометрического соотношения в сырье
В осадительный реактор, использованный в данном исследовании, два реагента подают в жидкой и газовой фазах, при этом происходит реакция, ведущая к осаждению карбоната кальция. только в растворе. Такое осаждение зависит от состава раствора, который, в свою очередь, зависит от того, сколько углекислого газа поглощается, а не от того, сколько его подается в реактор.
Такая важная особенность изучаемого здесь непрерывного процесса проиллюстрирована на рисунке 5А, где эффективность поглощения CO 2 , ηCO2,абс. , представлена как функция стехиометрического соотношения в сырье. Можно легко заметить, что эффективность абсорбции СО 2 равна единице при избытке кальция в корме, тогда как она неуклонно снижается, фактически почти линейно, при все большем и большем избытке СО 2 в корме. питание, следовательно, щелочность в растворе все ниже и ниже. Стоит отметить, что все эксперименты проводились с 25% об. CO 2 в подаче газа, за исключением экспериментов q и r, где мольная доля CO 2 составляла 0,85. Также легко заметить, что символы, соответствующие этим двум экспериментам, являются выбросами по отношению к идеальной линии тренда.
, представлена как функция стехиометрического соотношения в сырье. Можно легко заметить, что эффективность абсорбции СО 2 равна единице при избытке кальция в корме, тогда как она неуклонно снижается, фактически почти линейно, при все большем и большем избытке СО 2 в корме. питание, следовательно, щелочность в растворе все ниже и ниже. Стоит отметить, что все эксперименты проводились с 25% об. CO 2 в подаче газа, за исключением экспериментов q и r, где мольная доля CO 2 составляла 0,85. Также легко заметить, что символы, соответствующие этим двум экспериментам, являются выбросами по отношению к идеальной линии тренда.
РИСУНОК 5 . (A) Эффективность поглощения и (B) эффективное соотношение реагентов нанесено на ψF.
Такие соображения могут быть переведены в значение эффективного стехиометрического отношения в растворе, которое рассчитывается на основе ηCO2 и представлено на рисунке 6B. Он увеличивается с ψF, когда последний меньше единицы (избыток кальция), и выравнивается при значении около 1,1, когда последний становится больше примерно 1,2. Такая верхняя граница эффективного стехиометрического соотношения в растворе отражает тот факт, что способность раствора поглощать CO 2 в основном контролируется концентрацией кальция для данной мольной доли CO 2 в газе. За пределами определенного уровня избытка CO 2 в сырье раствор больше не способен поглощать CO 2 . Только изменение мольной доли CO 2 в газе (см. пример, обозначенный q) приводит к увеличению поглощения CO 2 раствором, следовательно, к значению эффективного стехиометрического отношения выше 1,1 (фактически около 1,7).
Он увеличивается с ψF, когда последний меньше единицы (избыток кальция), и выравнивается при значении около 1,1, когда последний становится больше примерно 1,2. Такая верхняя граница эффективного стехиометрического соотношения в растворе отражает тот факт, что способность раствора поглощать CO 2 в основном контролируется концентрацией кальция для данной мольной доли CO 2 в газе. За пределами определенного уровня избытка CO 2 в сырье раствор больше не способен поглощать CO 2 . Только изменение мольной доли CO 2 в газе (см. пример, обозначенный q) приводит к увеличению поглощения CO 2 раствором, следовательно, к значению эффективного стехиометрического отношения выше 1,1 (фактически около 1,7).
РИСУНОК 6 . (A) Эффективность поглощения (B) L50, (C) CO 2 эффективность улавливания и (D) эффективность осаждения кальция нанесена на ψ.
Мы считаем, что экспериментальные данные о KPI процесса должны быть проанализированы в свете значения эффективного стехиометрического отношения, которое отражает соотношение количеств реагентов, присутствующих в месте интересующей реакции. Соответственно, мы ожидаем, что область, где и ψF, и ψ примерно равны единице, представляет собой наиболее многообещающее рабочее окно, поскольку стехиометрия в растворе равна стехиометрии реакции, что может привести к эффективному использованию как растворителя, так и CO 2 .
3.4.2 Роль эффективного стехиометрического соотношения в растворе
Используя эффективное стехиометрическое соотношение реагентов в растворе, ψ, можно концептуализировать тенденции, наблюдаемые 1) для различных показателей эффективности процесса, 2) для средний размер частиц продукта и 3) полученный полиморф продукта.
Роль ψ на показатели эффективности процесса, в частности СО 2 эффективность поглощения, ηСО2,абс., СО 2 эффективность улавливания, ηCO2, и эффективность осаждения кальция, ηCa, показаны на рисунках 6A,C,D. Во-первых, на рисунке 6A ηCO2, абс. равно 1 для условий избытка кальция, когда CO 2 , подаваемый с газом, почти полностью поглощается богатым кальцием раствором; она неуклонно снижается для условий избытка CO 2 по тем же причинам, которые обсуждались со ссылкой на фиг. 5B. Затем можно легко увидеть, что эффективность улавливания CO 2 (рис. 6C) и эффективность осаждения кальция (рис. 6D) демонстрируют аналогичную качественную тенденцию с тупым максимумом при ψ, приблизительно равном 1. Чтобы объяснить это, мы делаем следующее. замечания. Неудивительно, что такие показатели зависят от условий в растворе, где происходит осаждение. С одной стороны, когда при ψ >1 CO 2 в избытке, его улавливание ограничено недостатком соответствующего стехиометрического количества кальция. С другой стороны, при избытке кальция при ψ < 1 его осаждение ограничивается недостатком стехиометрического количества СО 2 . Из уравнения 2-13, которая устанавливает пропорциональную зависимость между двумя KPI на рисунках 6C,D, в первом случае также снижается эффективность осаждения кальция с увеличением ψF, а во втором случае также снижается CO 2 эффективность захвата уменьшается с уменьшением ψF .
Во-первых, на рисунке 6A ηCO2, абс. равно 1 для условий избытка кальция, когда CO 2 , подаваемый с газом, почти полностью поглощается богатым кальцием раствором; она неуклонно снижается для условий избытка CO 2 по тем же причинам, которые обсуждались со ссылкой на фиг. 5B. Затем можно легко увидеть, что эффективность улавливания CO 2 (рис. 6C) и эффективность осаждения кальция (рис. 6D) демонстрируют аналогичную качественную тенденцию с тупым максимумом при ψ, приблизительно равном 1. Чтобы объяснить это, мы делаем следующее. замечания. Неудивительно, что такие показатели зависят от условий в растворе, где происходит осаждение. С одной стороны, когда при ψ >1 CO 2 в избытке, его улавливание ограничено недостатком соответствующего стехиометрического количества кальция. С другой стороны, при избытке кальция при ψ < 1 его осаждение ограничивается недостатком стехиометрического количества СО 2 . Из уравнения 2-13, которая устанавливает пропорциональную зависимость между двумя KPI на рисунках 6C,D, в первом случае также снижается эффективность осаждения кальция с увеличением ψF, а во втором случае также снижается CO 2 эффективность захвата уменьшается с уменьшением ψF . Более того, эта тенденция согласуется с наблюдениями Nehrke et. Al., которые наблюдали миксий в скорости роста при соотношении концентраций раствора ([Ca 2+ ]/CO 3 2− ]), равном единице (Han et al., 2006; Nehrke et al., 2007; Вольтерс и др., 2012). Более того, Хан и др. Ал. также признал влияние ψ на морфологию частиц (Han et al., 2006).
Более того, эта тенденция согласуется с наблюдениями Nehrke et. Al., которые наблюдали миксий в скорости роста при соотношении концентраций раствора ([Ca 2+ ]/CO 3 2− ]), равном единице (Han et al., 2006; Nehrke et al., 2007; Вольтерс и др., 2012). Более того, Хан и др. Ал. также признал влияние ψ на морфологию частиц (Han et al., 2006).
Кроме того, средний размер частиц продукта, L50 (рис. 6B), показывает поразительную, довольно плавную квазиэкспоненциальную эволюцию с ψ. Стоит отметить, что измеренный средний размер частиц отражает не только размер первичных частиц, но и размер агломератов, которых, как видно из рисунка, много. Кроме того, поскольку точки, выровненные экспоненциально на рисунке 6B, соответствуют экспериментам, в которых многие рабочие параметры менялись независимо друг от друга, определить основную причину такого регулярного поведения непросто. Возможно, это та ситуация, когда модель действительно необходима для оценки взаимозависимости между рабочими параметрами. Это связано с тем, что на размер частиц обычно влияет взаимодействие различных факторов. Фэн и др. Ал. изучал влияние CO 2 скорость потока и CO 2 парциальное давление, pH , температура реакции и добавки на размер частиц. Он определил, что размер частиц увеличивался с увеличением концентрации CO 2 и уменьшался с увеличением pH (Feng et al., 2007).
Это связано с тем, что на размер частиц обычно влияет взаимодействие различных факторов. Фэн и др. Ал. изучал влияние CO 2 скорость потока и CO 2 парциальное давление, pH , температура реакции и добавки на размер частиц. Он определил, что размер частиц увеличивался с увеличением концентрации CO 2 и уменьшался с увеличением pH (Feng et al., 2007).
Среди которых добавки (эталон), pH (эталон), температура (эталон) CO 2 парциальное давление (эталон.
Наконец, состав раствора и, в частности, соотношение карбонатные полиморфные формы Карбонат кальция, CaCO 3 , может осаждаться в виде метастабильного ватерита, арагонита или стабильного кальцита. На рисунке 7 представлены рентгенограммы и изображения РЭМ частиц РСС, которые были осаждены в репрезентативных экспериментах, а именно в экспериментах t, a, k, d, v и q, при возрастающих значениях ψ.
РИСУНОК 7 . Выбранные рентгенограммы и СЭМ-изображения экспериментов с осаждением нанесены на график как функция ψ. Сферические частицы соответствуют ватериту, а кубы — кристаллам кальцита.
Сферические частицы соответствуют ватериту, а кубы — кристаллам кальцита.
Как рентгенограммы, так и микрофотографии SEM убедительно свидетельствуют о том, что ватерит образуется при низких значениях ψ (эксперименты t, a и k) при очень высокой чистоте. Напротив, при более высоких значениях ψ (опыты d, v и q) также образуется кальцит, так как кристаллы конечного продукта представляют собой смесь ватерита и кальцита, причем последний присутствует в процентах от 37 до 62% (см. Таблицу 1). . Обратите внимание, что состав твердой фазы был оценен по рентгенограммам с использованием метода, описанного в литературе (Контояннис и Вагенас, 2000). Также стоит отметить, что пересыщение по кальциту уменьшается в три раза при переходе от ψ, примерно равной 0,65, к ψ, равной примерно 1,15, тогда как pH раствора снижается свыше 9до чуть выше 8 в том же интервале (данные здесь не показаны).
Обратите внимание, что эксперимент по непрерывной карбонизации, о котором сообщалось в литературе (Mattila and Zevenhoven 2014b), подтвердил тенденцию, показанную на рисунке 7. Они использовали свой реактор непрерывного осаждения с водным растворителем NH 4 Cl при ψF 0,4 и 100% CO. 2 . Из раствора осаждался ватерит с частицами очень малого размера (10 мкм). При этом при рН ниже 9,5 выпадает преимущественно кальцит, а при рН выше 9.5 преобладающей полиморфной модификацией является ватерит (Hostomsky, Jones, 1991; Jung et al., 2010). Оба доказательства согласуются с результатами, представленными в этой статье. Также другие исследователи определили, что рН раствора оказывает сильное влияние на морфологию и форму частиц (Han et al., 2005; Ramakrishna et al., 2016). Чанг и др. Ал. получили при аналогичных температурах смесь кристаллов кальцита и ватерита, при этом все больше и больше кальцита выпадало в осадок по мере снижения рН (Chang et al., 2017a).
Они использовали свой реактор непрерывного осаждения с водным растворителем NH 4 Cl при ψF 0,4 и 100% CO. 2 . Из раствора осаждался ватерит с частицами очень малого размера (10 мкм). При этом при рН ниже 9,5 выпадает преимущественно кальцит, а при рН выше 9.5 преобладающей полиморфной модификацией является ватерит (Hostomsky, Jones, 1991; Jung et al., 2010). Оба доказательства согласуются с результатами, представленными в этой статье. Также другие исследователи определили, что рН раствора оказывает сильное влияние на морфологию и форму частиц (Han et al., 2005; Ramakrishna et al., 2016). Чанг и др. Ал. получили при аналогичных температурах смесь кристаллов кальцита и ватерита, при этом все больше и больше кальцита выпадало в осадок по мере снижения рН (Chang et al., 2017a).
3.4.3 Роль CO
2 Парциальное давление Эксперименты r и q проводились при повышенном парциальном давлении CO 2 . Несмотря на ограниченность имеющихся данных, было сделано несколько наблюдений. Во-первых, удивительно, что при ψ > 1 кальцит является преобладающим присутствующим полиморфом, что согласуется с наблюдениями при более низких парциальных давлениях CO 2 (см. рис. 7). Более того, способность поглощать CO 2 значительно увеличивается при высоких значениях ψF. Однако большая часть этого CO 2 выходит из реактора с маточным раствором, не превращаясь в CaCO 3 .
Во-первых, удивительно, что при ψ > 1 кальцит является преобладающим присутствующим полиморфом, что согласуется с наблюдениями при более низких парциальных давлениях CO 2 (см. рис. 7). Более того, способность поглощать CO 2 значительно увеличивается при высоких значениях ψF. Однако большая часть этого CO 2 выходит из реактора с маточным раствором, не превращаясь в CaCO 3 .
4 Заключительные замечания
В этой работе мы использовали кристаллизатор непрерывного действия для осаждения карбоната кальция, полученного реакцией диоксида углерода, подаваемого через входной поток газа и затем поглощаемого реагирующим раствором, с гидроксидом кальция, подаваемым через входной раствор. Проведена экспериментальная кампания, в ходе которой кристаллизация проводилась при постоянной температуре и давлении, но с различным составом газа и, что наиболее важно, скоростью подачи газа и жидкости и их составом. Непрерывный процесс реактивной кристаллизации работает успешно, и его рабочие условия могут быть настроены таким образом, чтобы эмпирически оптимизировать ключевые рабочие параметры процесса.
Мы заметили, что, как и ожидалось, поглощение CO 2 из входящего газового потока в раствор играет решающую роль, потому что концентрация CO 2 в растворе, а не только в газе, это — вместе с концентрацией кальция, следовательно, pH — регулирует условия, при которых происходит осаждение. Ключевым рабочим параметром здесь является — при постоянном составе газа на входе — эффективное стехиометрическое соотношение реагентов в растворе. Благодаря обширной экспериментальной кампании удалось продемонстрировать, что высокие уровни CO 2 эффективность улавливания и эффективность осаждения кальция могут быть получены. Интересно, что такие высокие уровни возникают в условиях, когда эффективное стехиометрическое соотношение в растворе близко к единице.
Также удалось показать, что такое соотношение также определяет ключевые характеристики, характеризующие кристаллы продукта. Более конкретно, с одной стороны, было замечено, что при значениях такого параметра ниже 1 карбонат кальция выпадает в осадок в виде ватерита высокой чистоты (>97%), тогда как при значениях выше единицы выпадает смесь кристаллов ватерита и кальцита. На последнюю приходится 13% до 90% по массе. С другой стороны, окончательный средний размер частиц сильно увеличивается с увеличением эффективного стехиометрического соотношения в растворе, хотя мы могли измерить размер агломератов, а не первичных частиц. Эти наблюдения согласуются с литературными данными (Jung et al., 2000), хотя литературные данные в целом относятся к довольно разным процессам и контекстам.
На последнюю приходится 13% до 90% по массе. С другой стороны, окончательный средний размер частиц сильно увеличивается с увеличением эффективного стехиометрического соотношения в растворе, хотя мы могли измерить размер агломератов, а не первичных частиц. Эти наблюдения согласуются с литературными данными (Jung et al., 2000), хотя литературные данные в целом относятся к довольно разным процессам и контекстам.
Представленные здесь экспериментальные измерения представляют собой очень обнадеживающие результаты. За этим последует исследование того же процесса на основе моделирования, которое послужит основой для его оптимизации на основе моделей, направленной на изучение его прикладного потенциала.
Заявление о доступности данных
Первоначальные материалы, представленные в исследовании, включены в статью/дополнительный материал. Дальнейшие запросы можно направлять соответствующему автору.
Вклад автора
JT отвечал за содержание и написание публикации. М.М. участвовал во многих подробных обсуждениях содержания рукописи, рецензировании и редактировании.
М.М. участвовал во многих подробных обсуждениях содержания рукописи, рецензировании и редактировании.
Финансирование
Это исследование частично финансировалось Швейцарским центром компетенций по исследованиям в области энергетики — Эффективность промышленных процессов и частично ETH Zurich.
Конфликт интересов
JT, студент Лаборатории процессов разделения в ETH Zurich и соучредитель, член правления и акционер ETH-Spinoff neustark, целью которого является расширение масштабов и коммерциализация представленной технологии. ММ: профессор Лаборатории процессов разделения Швейцарской высшей технической школы Цюриха и член консультативного совета ETH-Spinoff Neustark.
Примечание издателя
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций или издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Благодарности
Мы хотели бы поблагодарить Даниэля Тротманна за создание экспериментальной установки, Маркуса Хубера за поддержку с аналитикой и Назгола Раззаги за (не опубликованное) предварительное экспериментальное исследование. Кроме того, мы хотели бы поблагодарить Yago Nel Vila Gracia за его вклад в экспериментальную кампанию.
Ссылки
Анантараман Р., Дэвид Б., Джованн К., Лена Д., Мануэле Г., Гельмут Х. и др. (2017). Структура CEMCAP для сравнительного технико-экономического анализа улавливания CO2 цементными заводами. Энерг. Обработано 114, 6175–6180. doi:10.1016/j.egypro.2017.03.1755
CrossRef Полный текст | Google Scholar
Чанг Р., Чой Д., Ким М. Х. и Парк Ю. (2017a). Настройка кристаллических полиморфизмов и структурное исследование осажденных карбонатов кальция на CO 2 Минерализация. ACS Sustain. хим. англ. 5 (2), 1659–1667. doi:10.1021/acssuschemeng.6b02411
Полный текст CrossRef | Google Scholar
Чанг Р. , Ким С., Ли С., Чой С., Ким М. и Пак Ю. (2017b). Осаждение карбоната кальция для хранения и использования CO2: обзор кристаллизации и полиморфизма карбоната. Фронт. Энерг. Рез. 5, 17. doi:10.3389/fenrg.2017.00017
, Ким С., Ли С., Чой С., Ким М. и Пак Ю. (2017b). Осаждение карбоната кальция для хранения и использования CO2: обзор кристаллизации и полиморфизма карбоната. Фронт. Энерг. Рез. 5, 17. doi:10.3389/fenrg.2017.00017
CrossRef Full Text | Google Scholar
Декле А., Рейес Э. и Суарес О. (2016). Осаждение карбоната кальция: обзор процесса кристаллизации карбоната и применения в биоинспирированных композитах. Ред. Доп. Матер. науч. 44 (1), 87–107.
Google Scholar
Фенг Б., Юн А.К. и Ан Х. (2007). Влияние различных факторов на размер частиц карбоната кальция, образующегося в процессе осаждения. Матер. науч. англ. А 445-446, 170-179. doi:10.1016/j.msea.2006.09.010
Полный текст CrossRef | Google Scholar
Гуллихсен Дж., Паулапуро Х. и Лехтинен Э. (2000). Наука и технология изготовления бумаги, Книга 11: Пигментное покрытие и проклейка поверхности бумаги . Ювяскюля: Fapet Oy.
Google Scholar
Хан Ю. С., Хадико Г., Фудзи М. и Такахаши М. (2005). Влияние скорости потока и содержания СО2 на фазу и морфологию СаСО3, приготовленного барботажным методом. Дж. Кристалл. Рост 276 (3-4), 541–548. doi:10.1016/j.jcrysgro.2004.11.408
С., Хадико Г., Фудзи М. и Такахаши М. (2005). Влияние скорости потока и содержания СО2 на фазу и морфологию СаСО3, приготовленного барботажным методом. Дж. Кристалл. Рост 276 (3-4), 541–548. doi:10.1016/j.jcrysgro.2004.11.408
Полный текст CrossRef | Google Scholar
Хан Ю. С., Хадико Г., Фудзи М. и Такахаши М. (2006). Факторы, влияющие на фазу и морфологию CaCO3, полученного барботажным методом. Дж. Евро. Керам. соц. 26 (4-5), 843–847. doi:10.1016/j.jeurceramsoc.2005.07.050
CrossRef Полный текст | Google Scholar
Хостомский Дж. и Джонс А.Г. (1991). Кристаллизация, агломерация и форма карбоната кальция при непрерывном осаждении из раствора. J. Phys. Д: заявл. физ. 24 (2), 165–170. doi:10.1088/0022-3727/24/2/012
CrossRef Full Text | Google Scholar
Джимо, О. А., Ариффин, К. С., Хуссин, Х. Б., и Темитоп, А. Э. (2018). Синтез осажденного карбоната кальция: обзор. Карбонаты Эвапориты 33 (2), 331–346. doi:10.1007/s13146-017-0341-x
doi:10.1007/s13146-017-0341-x
Полный текст CrossRef | Google Scholar
Юнг В.-М., Хун Канг С., Ким К.-С., Ким В.-С. и Кюн Чой К. (2010). Осаждение частиц карбоната кальция газожидкостной реакцией: морфология и распределение частиц по размерам в реакторах Куэтта-Тейлора и реакторах с перемешиванием. Дж. Кристалл. Рост 312 (22), 3331–3339. doi:10.1016/j.jcrysgro.2010.08.026
CrossRef Полный текст | Google Scholar
Jung, WM, Kang, S.H., Kim, W.-S., and Choi, CK (2000). Морфология частиц карбоната кальция, осажденного газожидкостной реакцией в реакторе Куэтта-Тейлора. Хим. англ. науч. 55 (4), 733–747. doi:10.1016/s0009-2509(99)00395-4
Полный текст CrossRef | Google Scholar
Контояннис, К.Г., и Вагенас, Н.В. (2000). Фазовый анализ карбоната кальция с использованием XRD и FT-Raman спектроскопии. Аналитик 125 (2), 251–255. doi:10.1039/a
9i
Полный текст CrossRef | Google Scholar
Маттила Х.-П., Хадд Х. и Зевенховен Р. (2014). Оценка жизненного цикла производства осажденного карбоната кальция из шлака сталеплавильного конвертера от колыбели до ворот. Дж. Чистый. Произв. 84, 611–618. doi:10.1016/j.jclepro.2014.05.064
и Зевенховен Р. (2014). Оценка жизненного цикла производства осажденного карбоната кальция из шлака сталеплавильного конвертера от колыбели до ворот. Дж. Чистый. Произв. 84, 611–618. doi:10.1016/j.jclepro.2014.05.064
Полный текст CrossRef | Google Scholar
Маттила, Х.-П., и Зевенховен, Р. (2014b). Проект непрерывной технологической установки для получения осажденного карбоната кальция из сталеплавильного шлака. ХимСусХим 7 (3), 903–913. doi:10.1002/cssc.201300516
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Маттила, Х.-П., и Зевенховен, Р. (2014a). «Производство осажденного карбоната кальция из шлака сталеплавильного конвертера и других кальцийсодержащих промышленных отходов и остатков», в Advances in Inorganic Chemistry (Турку, Финляндия: Elsevier), 66, 347–384. doi:10.1016/b978-0-12-420221-4.00010-x
Полный текст CrossRef | Академия Google
Нерке Г., Рейхарт Г. Дж., Ван Каппеллен П. , Мейле К. и Бийма Дж. (2007). Зависимость скорости роста кальцита и распределения Sr от стехиометрии раствора: рост кристаллов без косселя. Geochimica et Cosmochimica Acta 71 (9), 2240–2249. doi:10.1016/j.gca.2007.02.002
, Мейле К. и Бийма Дж. (2007). Зависимость скорости роста кальцита и распределения Sr от стехиометрии раствора: рост кристаллов без косселя. Geochimica et Cosmochimica Acta 71 (9), 2240–2249. doi:10.1016/j.gca.2007.02.002
Полный текст CrossRef | Google Scholar
Пламмер Л. Н. и Бузенберг Э. (1982). Растворимость кальцита, арагонита и ватерита в CO 2 -H 2 O Растворы между 0 и 90°C, и оценка водной модели для системы CaCO 3 -CO 2 -H 2 O. Geochimica et космохимика acta 46 (6), 1011–1040. doi:10.1016/0016-7037(82)-4
Полный текст CrossRef | Google Scholar
Ramakrishna, C., Thenepalli, T., Huh, J.-H. and Ahn, JW (2016). Синтез осажденного карбоната кальция путем одновременной закачки для получения нановискерного арагонита. J. Корейская керамика. соц. 53 (2), 222–226. Дои: 10.4191/kcers.2016.53.2.222
CrossRef Полный текст | Google Scholar
Санна А. , Уибу М., Караманна Г., Куусик Р. и Марото-Валер М. М. (2014). Обзор технологий карбонизации минералов для Sequester CO 2 . Хим. соц. 43 (23), 8049–8080. doi:10.1039/c4cs00035h
, Уибу М., Караманна Г., Куусик Р. и Марото-Валер М. М. (2014). Обзор технологий карбонизации минералов для Sequester CO 2 . Хим. соц. 43 (23), 8049–8080. doi:10.1039/c4cs00035h
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вердоус Д., Кащиев Д. и Ван Росмален Г. (1992). Определение скорости зарождения и роста по времени индукции в засеянных и незасеянных осадках карбоната кальция. Дж. Кристалл. Рост 118 (3-4), 401–413. doi:10.1016/0022-0248(92)-2
Полный текст CrossRef | Google Scholar
Вольтерс М., Нерке Г., Густафссон Дж. П. и Ван Каппеллен П. (2012). Кинетика роста кальцита: моделирование влияния стехиометрии раствора. Geochimica et Cosmochimica Acta 77, 121–134. doi:10.1016/j.gca.2011.11.003
Полный текст CrossRef | Google Scholar
Глоссарий
ci,in Кажущаяся концентрация водного растворенного вещества i, поступающего в реактор (моль/кг H 2 O)
ci Кажущаяся концентрация водного растворенного вещества i в реакторе (моль/кг H 2 O)
Fin Молярный расход газа, поступающего в реактор (моль/с)
Fout Молярный расход газа на выходе из реактора (моль/с)
fMT CO 2 скорость абсорбции (моль/м 3 /с)
ψ Эффективное соотношение реагентов в жидкой фазе (-)
ψF Молярная подача стехиометрическая коэффициент (-)
mCaCO3 CaCO 3 расход на выходе (г CaCO 3 /s)
MCaCO3 Молярная масса CaCO 3 (кг/моль)
P Полное давление (бар)
pCO2,in Парциальное давление CO 2 на входе газа
Qin Расход водного раствора (кг H 2 O/с)
rC Скорость осаждения (моль/м 3 /с)
T Температура водного раствора (°C)
12
Время (мин)Vс Объем жидкой фазы (м 3 )
yi,in Мольная доля компонента i в газе, поступающем в реактор (-)
yi,out Молярная доля компонента i в газе, выходящем из реактора (-)
ηCa Эффективность осаждения Ca (-)
ηCO2 CO 2 эффективность минерализации (-)
ηCO2, абс. Эффективность поглощения CO 2 (-)
Эффективность поглощения CO 2 (-)
ηCO2, предв. Эффективность осаждения углерода (-)
ρs Плотность раствора (кг/л)
τ Время пребывания водного раствора (мин)
Химия карбонатов — Science Learning Hub
Добавить в коллекцию
Карбонат кальция является основным минеральным компонентом известняка. Его химические и физические свойства лежат в основе современного использования известняка, а также уникальных известняковых ландшафтов сельской местности.
Карбонат кальция – минеральные формы
Основным минеральным компонентом известняка является кристаллическая форма карбоната кальция, известная как кальцит. Хотя кристаллы кальцита принадлежат к тригональной кристаллической системе, показанной ниже, встречается большое разнообразие форм кристаллов.
Одиночные кристаллы кальцита обладают оптическим свойством, называемым двойным лучепреломлением (двойное лучепреломление). Это сильное двойное лучепреломление приводит к тому, что объекты, рассматриваемые через чистый кусок кальцита, кажутся двойными.
Это сильное двойное лучепреломление приводит к тому, что объекты, рассматриваемые через чистый кусок кальцита, кажутся двойными.
Другая минеральная форма карбоната кальция называется арагонит. Его кристаллическая решетка отличается от кальцита, что приводит к другой форме кристаллов – орторомбической системе с игольчатыми кристаллами.
Растворимость
Карбонат кальция имеет очень низкую растворимость в чистой воде (15 мг/л при 25°C), но в дождевой воде, насыщенной углекислым газом, его растворимость увеличивается за счет образования более растворимого бикарбоната кальция. Карбонат кальция необычен тем, что его растворимость увеличивается при понижении температуры воды.
Повышенная растворимость карбоната кальция в дождевой воде, насыщенной углекислым газом, является движущей силой эрозии известняковых пород, приводящей к образованию в течение длительных периодов времени каверн, пещер, сталагмитов и сталактитов. Дождевая вода слабокислая, и когда она встречается с известняком, часть карбоната кальция вступает в реакцию с образованием раствора бикарбоната кальция.
CaCO 3 ( с ) | + | CO 2 ( g ) | + | H 2 O( l ) | → | Ca(HCO 3 ) 2 ( aq ) |
| В течение длительного времени дождевая вода растворяет часть известняка, создавая подземные полости и пещеры. Образование сталактитов и сталагмитов, по сути, представляет собой обратный процесс растворения, поскольку богатая бикарбонатом вода, капающая с потолка пещеры, частично испаряется, оставляя после себя отложения карбоната кальция. | ||||||
Ca(HCO 3 ) 2 ( aq ) | → | CaCO 3 ( s ) | + | CO 2 ( g ) | + | H 2 O ( L ) |
Термальный развязка
Термальный депозиция
Термальный развязка
.
 и оставляя после себя оксид кальция – белое твердое вещество.
и оставляя после себя оксид кальция – белое твердое вещество.CACO 3 ( S ) | → | CO 2 ( G ) | 7 2 ( G )7 2 ( G )7 2 .
Оксид кальция известен как известь и является одним из 10 основных химических веществ, ежегодно производимых путем термического разложения известняка.
Термическое разложение карбоната кальция с образованием извести является одной из старейших известных химических реакций. В течение нескольких тысяч лет известь использовалась в растворе (паста из извести, песка и воды) для склеивания камней друг с другом в зданиях, стенах и дорогах. Схватывание раствора включает несколько химических реакций.
First, the lime is ‘slaked’ by the water to produce calcium hydroxide (slaked lime
CaO( s ) | + | H 2 O( L ) | → | CA (OH) 2 ( S ) |
Время с течением времени с Carbine с Carbide с Carbide с Carbide с Carbide с Carbyx. карбонат кальция, который связывает песчинки вместе, образуя твердый материал, похожий на камень.0003
карбонат кальция, который связывает песчинки вместе, образуя твердый материал, похожий на камень.0003
Ca(OH) 2 ( s ) | + | CO 2 ( g ) | → | CaCO 3 ( s ) | + | H 2 O( l ) |
Reaction with acids
Как и все карбонаты металлов, карбонат кальция реагирует с кислыми растворами с образованием углекислого газа. Именно эта реакция отвечает за шипение известняка при попадании на его поверхность разбавленной соляной кислоты.
CaCO 3 ( s ) | + | 2HCl( aq ) | → | CO 2 ( g ) | + | H 2 O ( L ) | + | CACL 2 ( AQ 2 . , используется в сельском хозяйстве на протяжении веков. Его разбрасывают по полям для нейтрализации кислых соединений в почве и снабжения кальцием, который является важным питательным веществом для растений. Сегодня, в зависимости от требований к почве, фермеру доступны следующие варианты: , используется в сельском хозяйстве на протяжении веков. Его разбрасывают по полям для нейтрализации кислых соединений в почве и снабжения кальцием, который является важным питательным веществом для растений. Сегодня, в зависимости от требований к почве, фермеру доступны следующие варианты:
In medicine, антациды, содержащие небольшое количество карбоната кальция, используются при лечении «кислотного желудка». Происходящая химическая реакция включает нейтрализацию избытка кислоты карбонатом кальция. Такие бренды, как Quick-Eze и TUMS, содержат карбонат кальция в качестве «активного» ингредиента.
Природа науки Пытаясь понять мир вокруг нас, ученые часто ищут модели поведения, которые позволяют сформулировать общие правила или принципы. Опубликовано 10 октября 2012 г. Статьи Reference Hub Перейти к полному глоссарию Добавить 0 пунктов в коллекцию Скачать 0 пунктов Загрузить все Химия 1 (Практика), май/июнь 20121 .
Почему известковая вода становится прозрачной при избытке СО2? – Fast-AdvicesСодержание
Почему известковая вода становится прозрачной при избытке СО2?Известковая вода мутнеет от углекислого газа при пропускании через нее из-за образования нерастворимого CaCO3 (карбоната кальция). Но становится ясно из-за образования растворимого бикарбоната кальция (гидрокарбоната кальция). Raj. 6, 1439 AH Что происходит при избытке углекислого газа в известковой воде? При пропускании углекислого газа через известковую воду она мутнеет из-за образования карбоната кальция. При пропускании через известковую воду избытка углекислого газа образовавшаяся молочность исчезает. Почему молочность известковой воды исчезает при пропускании через нее избытка углекислого газа? При барботаже углекислого газа в избытке молочность известковой воды исчезает за счет образования бикарбоната, растворимого в воде. При пропускании диоксида углерода через известковую воду она становится молочной, но этот белый цвет исчезает при дальнейшем добавлении СО2 Это связано с образованием?Ca(OH)2 + co2 = CaCO3 + h3O . CaCo3 + co2 (избыток) + h30 = Ca(HCO3)2. Надеюсь, поможет!!!! за счет образования бикарбоната кальция исчезает молочная окраска раствора.Jum. II 7, 1439 г.AH При пропускании диоксида углерода через известковую воду она мутнеет из-за образования соединения A. Определите соединение A? карбонат кальция Что происходит, когда известковая вода обрабатывается избытком углекислого газа? Напишите сбалансированное химическое уравнение? Образовавшийся диоксид углерода пропускали через известковую воду в правой трубке, образуя молочный раствор за счет осаждения нерастворимой взвеси карбоната кальция: Ca(OH)2(водн.) + CO2(г) → CaCO3(т) + h3O. При добавлении избытка CO2: происходит следующая реакция: CaCO3(т) + h3O(ж) + CO2(г) → Ca(HCO3) Что образуется при пропускании углекислого газа через известковую воду?Углекислый газ вступает в реакцию с известковой водой (раствор гидроксида кальция, Ca(OH) 2) с образованием белого осадка (выглядит как молочный) карбоната кальция, CaCO 3. Когда СО2 пропускают через известковую воду, она превращается в известковую воду получается молочный и caco3. Природа caco3 кислая B Основная C Нейтральная D Нет? Ответ на ваш вопрос: двуокись углерода. Известковая вода представляет собой раствор гидроксида кальция. Что происходит, когда избыток углекислого газа проходит через известковую воду?( Постановка и уравнение? CaCo3 + co2 (избыток) + h30 = Ca(HCO3)2 .Jum. II 7, 1439 AH Почему известковая вода мутнеет от углекислого газа?Двуокись углерода (CO2) делает известковую воду мутной из-за образования нерастворимого карбоната кальция CaCO3 Двуокись серы (SO2) также делает то же самое, но медленно, так как реагирует с гидроксидом кальция с образованием нерастворимого сульфит кальция О нас Контакты Почему известковая вода мутнеет от углекислого газа? Почему известковая вода становится молочно-белой? Водный раствор гашеной извести в воде известен как известковая вода. Когда известковая вода реагирует с углекислым газом, она превращается в нерастворимый карбонат кальция, что дает молочно-белый цвет, но при дальнейшем воздействии углекислого газа она превращается в гидрокарбонат кальция, который растворяется и становится прозрачным. | ||||||||||||||||||||||||||||||||||||||||||||||

 09.15
09.15
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу: Т.е. это можно заметить и вовремя сделать ноги, что радует
Т.е. это можно заметить и вовремя сделать ноги, что радует ..
.. Т.е. почувствовать можно.
Т.е. почувствовать можно. Карбидка его взорвет, но вы будете не в эпицентре, тоесть шанс попасть под завал уменьшается.
Карбидка его взорвет, но вы будете не в эпицентре, тоесть шанс попасть под завал уменьшается. Карбидка его взорвет, но вы будете не в эпицентре, тоесть шанс попасть под завал уменьшается.
Карбидка его взорвет, но вы будете не в эпицентре, тоесть шанс попасть под завал уменьшается. ..
.. Следовательно, аквариумисты очень обеспокоены
поддержание этих параметров на должном уровне. Там
есть много успешных способов дополнения кальция и щелочности,
и каждая из этих систем имеет свою относительную
Достоинства для разных типов аквариумов. 4 Лучшими из этих методов являются те, которые принудительно добавляют
кальция и щелочности в сбалансированном
мода. 5 По принуждению
сбалансированные добавки, эти добавки очень успешны в
предотвращение дисбаланса между кальцием и щелочностью,
может привести к тому, что один из этих двух параметров будет выше или ниже оптимального
уровни.
Следовательно, аквариумисты очень обеспокоены
поддержание этих параметров на должном уровне. Там
есть много успешных способов дополнения кальция и щелочности,
и каждая из этих систем имеет свою относительную
Достоинства для разных типов аквариумов. 4 Лучшими из этих методов являются те, которые принудительно добавляют
кальция и щелочности в сбалансированном
мода. 5 По принуждению
сбалансированные добавки, эти добавки очень успешны в
предотвращение дисбаланса между кальцием и щелочностью,
может привести к тому, что один из этих двух параметров будет выше или ниже оптимального
уровни.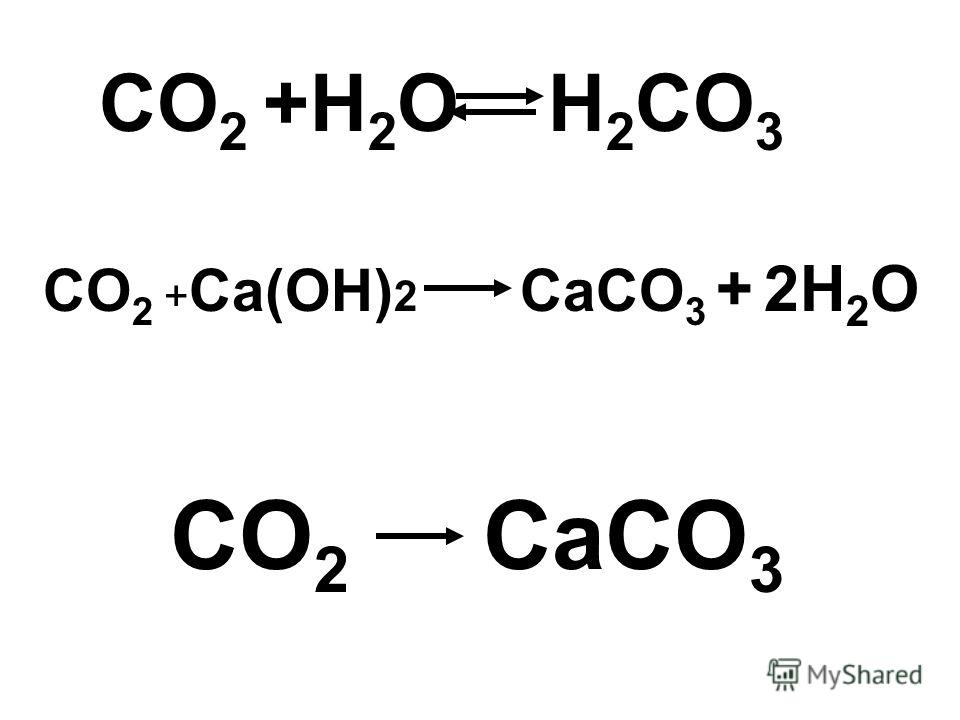 В последнее время многие аквариумисты заинтересовались использованием
реактор, часто называемый реактором Нильсена.
реактор, чтобы доставить известковую воду в их аквариумы. Один из
предполагаемые преимущества таких реакторов в том, что они
проще в использовании, а раствор известковой воды менее склонен к
разложение атмосферным углекислым газом (CO2)
чем путем дозирования из неподвижных резервуаров.
В последнее время многие аквариумисты заинтересовались использованием
реактор, часто называемый реактором Нильсена.
реактор, чтобы доставить известковую воду в их аквариумы. Один из
предполагаемые преимущества таких реакторов в том, что они
проще в использовании, а раствор известковой воды менее склонен к
разложение атмосферным углекислым газом (CO2)
чем путем дозирования из неподвижных резервуаров.
 7 Еженедельная реклама CVS
был хорошим источником сделок аптеки в этом месяце. Тем не менее,
этот факт не является существенным для остальной части этого обсуждения
о разложении известковой воды и моногидроксид-иона
полностью диссоциирует при pH бака.
7 Еженедельная реклама CVS
был хорошим источником сделок аптеки в этом месяце. Тем не менее,
этот факт не является существенным для остальной части этого обсуждения
о разложении известковой воды и моногидроксид-иона
полностью диссоциирует при pH бака. Он может соединяться с кальцием в растворе для
образуют нерастворимый карбонат кальция:
Он может соединяться с кальцием в растворе для
образуют нерастворимый карбонат кальция:
 10 Я не буду обсуждать эти методы непосредственного сложения в дальнейшем.
эта статья.
10 Я не буду обсуждать эти методы непосредственного сложения в дальнейшем.
эта статья.
 Вся система известковых вод расположена
удаленно от моего аквариума (у меня в подвале), поэтому размер
водохранилище не имеет значения. В моем случае я часто
не используйте насыщенную известковую воду, потому что мой аквариум не нуждается
что много добавок кальция и щелочности. Следовательно,
Я добавляю меньше CaO, чем требуется для получения насыщенного
лимонад. Если аквариумисту нужна насыщенная известковая вода,
это не реальная причина, чтобы попытаться добавить определенную сумму. Любые дополнительные
твердые вещества просто сидят на дне и ждут следующей воды
пополнение (эти твердые вещества также поглощают примеси, такие как медь, из
воды, но это тема другой статьи).
Вся система известковых вод расположена
удаленно от моего аквариума (у меня в подвале), поэтому размер
водохранилище не имеет значения. В моем случае я часто
не используйте насыщенную известковую воду, потому что мой аквариум не нуждается
что много добавок кальция и щелочности. Следовательно,
Я добавляю меньше CaO, чем требуется для получения насыщенного
лимонад. Если аквариумисту нужна насыщенная известковая вода,
это не реальная причина, чтобы попытаться добавить определенную сумму. Любые дополнительные
твердые вещества просто сидят на дне и ждут следующей воды
пополнение (эти твердые вещества также поглощают примеси, такие как медь, из
воды, но это тема другой статьи). В этом
тип системы, известковая вода готовится один раз, а затем допускается
сидеть без движения столько, сколько потребуется системе доставки
отправить в аквариум. Так как этот тип резервуара может
доставить известковую воду в аквариум на несколько недель, многие
аквариумисты ошибочно пришли к выводу, что существенная потенция
теряется по мере разложения известковой воды, и что такая система
не удастся. Более того, это утверждение является причиной того, что многие аквариумисты
утверждают, что реакторы Нильсена проще: потому что простые
доставка с большого водоема не получится и то только ежедневно
смешивание известковой воды может быть успешным. По правде говоря, это занимает
мне пять минут на подпитку известковой воды каждые 2-3 недели, так что
Представление о том, что какую-то другую систему проще использовать, просто необоснованно.
В этом
тип системы, известковая вода готовится один раз, а затем допускается
сидеть без движения столько, сколько потребуется системе доставки
отправить в аквариум. Так как этот тип резервуара может
доставить известковую воду в аквариум на несколько недель, многие
аквариумисты ошибочно пришли к выводу, что существенная потенция
теряется по мере разложения известковой воды, и что такая система
не удастся. Более того, это утверждение является причиной того, что многие аквариумисты
утверждают, что реакторы Нильсена проще: потому что простые
доставка с большого водоема не получится и то только ежедневно
смешивание известковой воды может быть успешным. По правде говоря, это занимает
мне пять минут на подпитку известковой воды каждые 2-3 недели, так что
Представление о том, что какую-то другую систему проще использовать, просто необоснованно. Далее в этой статье я покажу, что такие простые системы
не теряют существенной активности и, следовательно, должны рассматриваться
аквариумистами, у которых есть место для больших водоемов.
Далее в этой статье я покажу, что такие простые системы
не теряют существенной активности и, следовательно, должны рассматриваться
аквариумистами, у которых есть место для больших водоемов.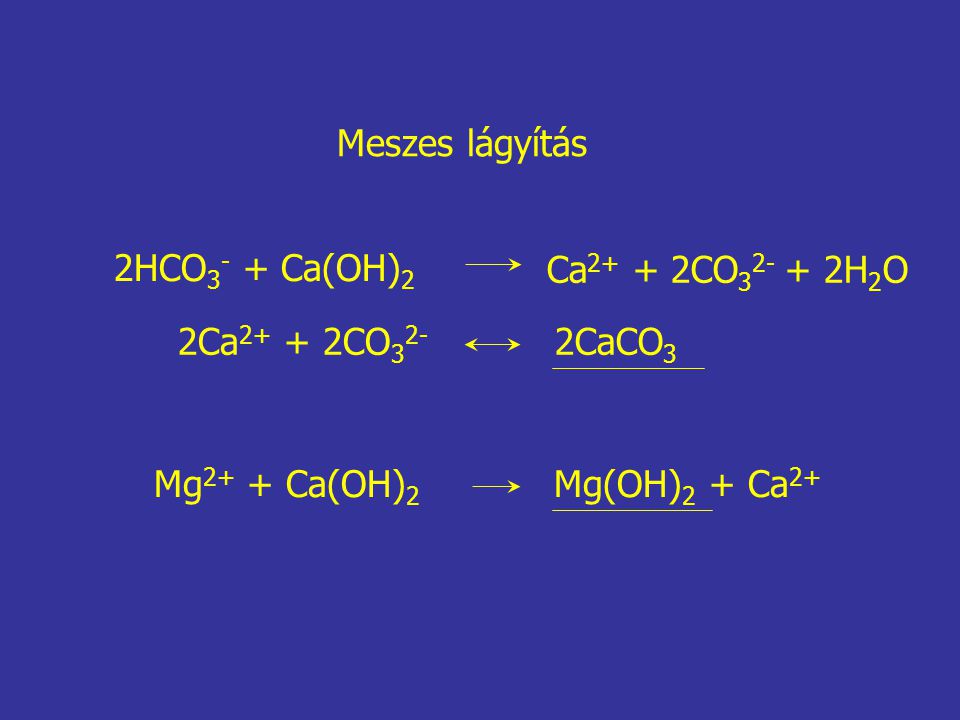 Так как реактор в основном
закрытый для атмосферы, реакция с атмосферным углеродом
диоксид сведен к минимуму. Одно потенциальное преимущество реакторов Нильсена
заключается в том, что не нужны значительные удерживающие резервуары,
поэтому их легко спрятать под аквариумом (много
как CaCO3/CO2
реакторы).
Так как реактор в основном
закрытый для атмосферы, реакция с атмосферным углеродом
диоксид сведен к минимуму. Одно потенциальное преимущество реакторов Нильсена
заключается в том, что не нужны значительные удерживающие резервуары,
поэтому их легко спрятать под аквариумом (много
как CaCO3/CO2
реакторы). Точно так же измерение кальция может
та же участь постигнет и многие наборы для тестирования, в которых твердые вещества могут
раствориться и быть обнаруженным. Другие методы, такие как индуктивно
Связанная плазма (ICP), используемая для кальция и примесей,
также обнаружить твердые частицы. Фильтрация может уменьшить количество твердых частиц
нагрузки, но многие частицы, образующиеся при известковом растворе
взаимодействует с углекислым газом, будет меньше любого нормального
фильтры (менее 0,1 мм). 11
Точно так же измерение кальция может
та же участь постигнет и многие наборы для тестирования, в которых твердые вещества могут
раствориться и быть обнаруженным. Другие методы, такие как индуктивно
Связанная плазма (ICP), используемая для кальция и примесей,
также обнаружить твердые частицы. Фильтрация может уменьшить количество твердых частиц
нагрузки, но многие частицы, образующиеся при известковом растворе
взаимодействует с углекислым газом, будет меньше любого нормального
фильтры (менее 0,1 мм). 11 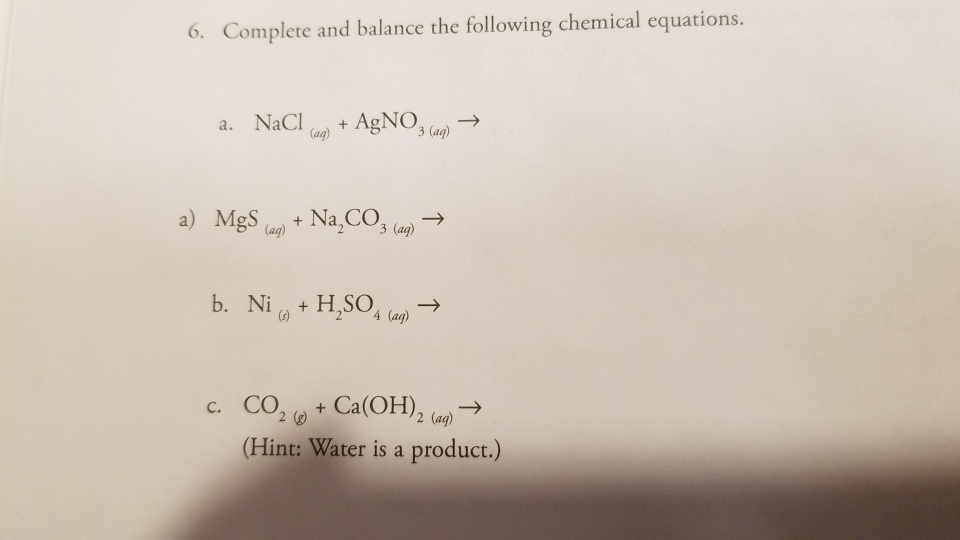 Тем не менее, аквариумисты могут контролировать рН известковой воды, чтобы
посмотрите, сохраняет ли он большую часть своей силы. Вместо того, чтобы сравнивать
с абсолютным числом, аквариумистам следует сравнивать рН
рассматриваемая известковая вода в известковую воду, которая, как известно,
насыщенные (например, две чайные ложки, растворенные в чашке
чистая пресная вода). В то время как точно, насколько рН падает с
падение потенции осложняется наличием CaOH + ,
в качестве приблизительного ориентира капля на 0,3 единицы pH эквивалентна
падение концентрации гидроксида в два раза (т. е.
падение потенции в два раза).
Тем не менее, аквариумисты могут контролировать рН известковой воды, чтобы
посмотрите, сохраняет ли он большую часть своей силы. Вместо того, чтобы сравнивать
с абсолютным числом, аквариумистам следует сравнивать рН
рассматриваемая известковая вода в известковую воду, которая, как известно,
насыщенные (например, две чайные ложки, растворенные в чашке
чистая пресная вода). В то время как точно, насколько рН падает с
падение потенции осложняется наличием CaOH + ,
в качестве приблизительного ориентира капля на 0,3 единицы pH эквивалентна
падение концентрации гидроксида в два раза (т. е.
падение потенции в два раза).