с реакцией на несколько соединений
Неорганическая реакция (KOH + Cr2O3) дает KCrO2 в виде порошка.
В этой статье мы видим реакцию различных компонентов с Cr2O3 в основной среде, KOH, где Cr2O3 действует как восстановитель.
Что такое Cr2o3 + Koh?При определенном давлении и температуре оксид хрома (III) и гидроксид калия реагируют, в результате чего мы получаем KCrO2 и воду (h3O), где степень окисления остается таким же для хрома (Cr), который составляет (3+).
Что является продуктом Cr2o3 + Koh?В реакции KCrO2 и вода (h3O), образующиеся после реакции Cr2O3 и KOH, если мы сбалансируем реакцию как по реагентам, так и по продуктам, мы получим 2KOH + Cr2O3 = h3O + 2 KCrO2, где степень окисления хрома (Cr) равна (3+).
Реакция Cr2O3 + КОНКак сбалансировать Cr2o3 + Koh?Если мы уравновешиваем реакцию, мы можем найти, сколько молекул требуется для получения продукта, для этого мы обозначаем каждый компонент реакции a, b, c, d и т. д. в виде коэффициентов, скажем, как для a KOH + b Cr2O3 = с h3O + d KCrO2.
д. в виде коэффициентов, скажем, как для a KOH + b Cr2O3 = с h3O + d KCrO2.
Затем создайте уравнения с помощью коэффициентов, так как количество компонентов совпадает; (1) a = d для «K», (2) 2b = d для «Cr», (3) a + 3b = c + 2d для кислорода и (4) a = 2c для водорода. После этого, решая решения, мы получаем числа.
Здесь a = d = 2b = 2c, поэтому, если мы рассматриваем a и d как 2, тогда b и c становятся равными, и мы получаем коэффициенты компонентов реакции.
Какой тип реакции Cr2o3 + Koh?Химическая реакция CrO3 + KOH является реакцией нейтрализации, так как среда реагента является щелочной, где оксид хрома (CrO3) реагирует с основным KOH с образованием KCrO2 с молекулой воды (h3O).
Cr2O3+KOH+h3OВ этой реакции образуется гексагидроксохромат (III) калия, представляющий собой молекулу сложного типа. Уравновешивая реагент и продукт, мы получаем Cr2O3 + 6 KOH + 3 h3O = 2 K3[Cr(OH)6].
Если мы проверим степень окисления хрома (Cr) на стороне реагента, а на стороне продукта она изменится с (3+) на (6+), степень окисления увеличится, что означает, что Cr высвобождает больше трех электронов, поэтому он действует как Восстановитель.
В продукте [Cr(OH)6](3-) является координационным соединением где Cr(III) — центральный атом, так как к нему присоединены лиганды 6 (-ОН), поэтому координационное число будет равно 6, так как такое количество лигандов присоединено к центральному атому.
cr2o3+koh+kclo3В реакции образуются хромат калия (K2CrO4), хлорид калия (KCl) и вода (h3O), где, уравновешивая реакцию, получаем KClO3 (водн.) + Cr2O3 (тв.) + 4 KOH (водн.) = KCl (водн.) + 2 K2CrO4 (водн.) + 2 h3O (л).
Если мы проверим степени окисления хрома (Cr) и хлора (Cl), мы обнаружим, что они меняются со стороны реагента на сторону продукта, поскольку Cr2O3 переходит в K2CrO4, где степень окисления хрома увеличивается с (+3) до (+6) поскольку два Cr (+3) высвобождают шесть электронов.
Таким образом, Cr2O3 является восстановителем в реакции, поскольку эти высвобождающие шесть электронов принимаются хлором KClO3 и изменяют свою степень окисления с (+5) на (-1), поэтому KClO3 действует как восстановитель. окислитель здесь.
реакция KClO3 с Cr2O3 + KOHCr2o3+Koh+Kno3В реакции образуются нитрит калия (KNO2), хромат калия (K2CrO4) и вода (h3O), уравновешивая реакцию как со стороны реагента, так и со стороны продукта, мы получаем 3 KNO3 (водн.) + Cr2O3 (тв.) + 4 KOH (водн. ) = 3 KNO2 (водн.) + 2 K2CrO4 (водн.) + 2 h3O (ж.).
В окислительно-восстановительной реакции реакция восстановления происходит, когда KNO3 превращается в KNO2, где степень окисления атома азота переходит с (+5) на (+3) за счет принятия всего 6 электронов для трех атомов азота от Cr (III), поэтому KNO3 является окислителем.
Одновременно происходит и процесс окисления (процесс переноса электрона), где Cr2O3 ведет себя как Восстановитель поскольку хром увеличивает свою степень окисления с (+3) до (+6), когда Cr2O3 переходит в K2CrO4, высвобождающиеся электроны восстанавливают азот KNO3.
В реакции образуются хлорид калия (KCl), хромат калия (K2CrO4) и вода (h3O), уравновешивая как реагент, так и продукт, мы получаем 3 Cl2 (г) + Cr2O3 (т) + 10 КОН (водн.) = 2 K2CrO4 (водн.) + 5 h3O (л).
В процессе окисления, когда происходит перенос электрона с атомной орбитали на акцептор, Cr2O3 действует как восстановитель, поскольку хром изменяет свою степень окисления с (+3) на (+6) путем переноса электронов при переносе Cr2O3 на хромат калия.
В процессе восстановления, когда атомная вакантная орбиталь принимает электроны, Cl2 действует как окислитель, поскольку хлор снижает свою степень окисления с нуля (0) до (-1), принимая электроны, когда 3 молекулы хлора (Cl) образуют 6 молекул хлорида калия.
cr2o3+koh+ca(clo)2В окислительно-восстановительной реакции образуются хромат калия (K2CrO4), хлорид кальция (CaCl2) и вода (h3O), где, уравновешивая обе стороны реакции, получаем 3 Ca(ClO)2 (т) + 2 Cr2O3 (т) + 8 KOH (водн. ) = 3 CaCl2 (водн.) + 4 K2CrO4 (водн.) + 4 h3O (ж.).
) = 3 CaCl2 (водн.) + 4 K2CrO4 (водн.) + 4 h3O (ж.).
Если мы проверим степени окисления хрома (Cr) и хлора (Cl), мы обнаружим, что они меняются со стороны реагента на сторону продукта, поскольку оксид хрома (III) переходит в K2CrO4, где степень окисления хрома изменяется с (+3) до ( +6), представляет собой реакцию окисления.
Таким образом, Cr2O3 действует как восстановитель в реакции, поскольку эти высвобождающие шесть электронов принимаются атомом хлора трех Ca(ClO)2 и изменяют свою степень окисления с (+1) на (-1), поэтому Ca(ClO)2 действует здесь в качестве окислителя, принимая электроны от Cr (III).
cr2o3+koh+o2В реакции хромат калия (K2CrO4) и вода (h3O) образуются при уравновешивании как реагентов, так и продуктов, мы получаем 3 O2 (г) + 2 Cr2O3 (т) + 8 KOH (водн.) = 4 K2CrO4 (водн.) + 4 Н2О (л).
В процессе окисления, когда добавляется кислород или передаются электроны от атома, Cr2O3 действует как восстановитель, поскольку хром увеличивает свою степень окисления с (+3) до (+6) за счет переноса электронов, когда Cr2O3 переносится на K2CrO4.
В процессе восстановления, когда добавляется водород или атом принимает электроны, O2 действует как окислитель, поскольку кислород снижает свою степень окисления с нуля (0) до (-2), принимая электроны, когда 3 молекулы кислорода образуют 4 молекулы воды (h3O).
реакция O2 с Cr2O3 + KOHcr2o3+koh+h3o2В реакции образуются хромат калия (K2CrO4) и вода (h3O), при этом балансируя как реагент, так и продукт, мы получаем 3 h3O2 (водн.) + Cr2O3 (тв.) + 4 KOH (водн.) = 2 K2CrO4 (водн.) + 5 Н2О (л).
В процессе окисления, когда к атому добавляется кислород, Cr2O3 действует как восстановитель, поскольку хром увеличивает свою степень окисления с (+3) до (+6) за счет переноса электронов, когда Cr2O3 переносится на K2CrO4, где одновременно происходит реакция восстановления.
В процессе восстановления, когда водород добавляется к атому или кислород удаляется из атома, h3O2 действует как окислитель, поскольку кислород снижает свою степень окисления с (-1) до (-2), принимая электроны, когда молекулы перекиси водорода образуют воду (h3O ) молекулы.
В реакции а комплексное соединение, K4[Fe(CN)6], хромат калия (K2CrO4) и вода (h3O), где уравновешивая реакцию получаем, 6 K3[Fe(CN)6] (водн.) + Cr2O3 (т.) + 10 KOH (водн.) = 6 K4[Fe(CN)6] (водн.) + 2 K2CrO4 (водн.) + 5 h3O (ж).
Если мы проверим степени окисления хрома (Cr) и железа (Fe), мы обнаружим, что они меняются со стороны реагента на сторону продукта, поскольку Cr2O3 производит K2CrO4, где степень окисления хрома (Cr) увеличивается с (+3) до (+ 6) поскольку Cr(+3) высвобождает еще три электрона.
Таким образом, Cr2O3 является восстановителем в реакции, так как эти высвобождающие шесть электронов принимаются шестью Fe (III) комплексного соединения и изменяют свою степень окисления с (+3) на (+2), поэтому K3[Fe(CN)6 ] действует здесь как окислитель, принимая электрон.
реакция K3[Fe(CN)6] с Cr2O3 + KOHkclo4+cr2o3+kohВ реакции образуются хромат калия (K2CrO4), хлорид калия (KCl) и вода (h3O), где уравновешивая реакцию получаем, 3 KClO4 (водн. ) + 4 Cr2O3 (тв.) + 16 KOH (водн.) = 3 KCl ( водный раствор + 8 K2CrO4 (водный раствор) + 8 h3O (ж).
) + 4 Cr2O3 (тв.) + 16 KOH (водн.) = 3 KCl ( водный раствор + 8 K2CrO4 (водный раствор) + 8 h3O (ж).
Если мы проверим степени окисления стороны реагента по сравнению со стороной продукта хрома (Cr) и хлора (Cl), мы обнаружим, что они меняются, поскольку 4 Cr2O3 переходит в 8 K2CrO4, где степень окисления Cr увеличивается с (+3) до (+ 6) так как два Cr(+3) освобождают шесть электронов.
Таким образом, Cr2O3 является восстановителем в реакции, так как они высвобождают шесть электронов, которые переходят на орбиталь хлора KClO4 и изменяют свою степень окисления с (+7) на (-1), образуя молекулу KCl, поэтому KClO4 действует как окислитель здесь.
kclo+cr2o3+kohВ окислительно-восстановительной реакции образуются хромат калия (K2CrO4), хлорид калия (KCl) и вода (h3O), где, уравновешивая обе стороны реакции, получаем 3 KClO (ж) + Cr2O3 (т) + 4 KOH (вод) = 3 KCl (водн.) + 2 K2CrO4 (водн.) + 2 h3O (ж.).
Если мы проверим степени окисления хрома (Cr) и хлора (Cl), мы обнаружим, что они меняются со стороны реагента на сторону продукта, поскольку оксид хрома (III) переходит в K2CrO4, где степень окисления хрома увеличивается с (+3) до (+6), так как два Cr(+3) высвобождают шесть электронов.
Таким образом, Cr2O3 действует как восстановитель в реакции, поскольку эти высвобождающие шесть электронов принимаются хлором из трех KClO3 и изменяют свою степень окисления с (+1) на (-1), поэтому KClO действует здесь как окислитель, принимая электроны. .
най+cr2o3+кохПосле взаимодействия с NaI и KOH образуются KI и NaOH. KI может реагировать с Cr2O3 в кислой среде, как h3SO4, но реакция не наблюдается в щелочной среде, такой как NaOH.
kcl+cr2o3+kohРеакцию Cr2O3 можно наблюдать с хлоратом калия или перхлоратом калия, но не с хлоридом калия.
cr2o3+nano3+kohВ реакции образуются нитрит натрия (NaNO2), хромат калия (K2CrO4) и вода (h3O), уравновешивая реакцию, получаем 3 NaNO3 (водн.) + Cr2O3 (тв.) + 4 KOH (водн.) = 3 NaNO2 (водн.) + 2 K2CrO4 (водн.) + 2 h3O (ж).
В окислительно-восстановительной реакции реакция восстановления происходит, когда NaNO3 превращается в NaNO2, где степень окисления атома азота переходит с (+5) на (+3) за счет принятия всего 6 электронов для трех атомов азота, поэтому NaNO3 является окислителем.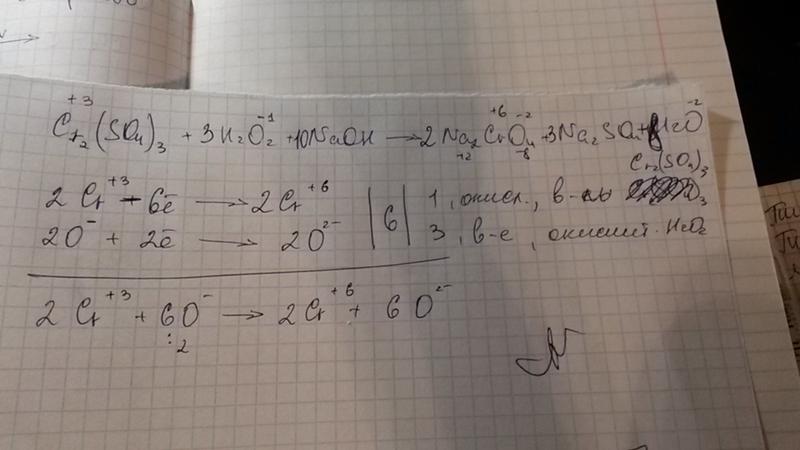 .
.
Одновременно процесс окисления также протекает с реакцией восстановления, в которой Cr2O3 переходит в K2CrO4, в которой степень окисления хрома увеличивается с (+3) до (+6), так как два Cr(+3) высвобождают шесть электронов (по три на каждый), поэтому Cr2O3 становится восстановитель.
cr2o3+br2+кохВ реакции образуются бромид калия (KBr), хромат калия (K2CrO4) и вода (h3O), что является окислительно-восстановительной реакцией, в которой одновременно образуются окисление и восстановление компонентов реагентов.
Уравновешивая обе стороны реакции, получаем Cr2O3 (т) + 3 Br2 (водн.) + 10 KOH (водн.) = 6 KBr (водн.) + 2 K2CrO4 (водн.) + 5 h3O (ж), где (s) означает твердая молекула, (aq) указывает, что компонент находится в водной среде, а (l) показывает, что компонент находится в жидком состоянии.
В реакции степень окисления Br (окислителя) изменяется от 0 до (-1), поэтому образование Br2 в KBr является восстановительным процессом, где изменение степени окисления Cr с (+3) до (+4) означает, что он переходит еще на один электрон, который является реакцией окисления, Cr2O3 является восстановителем.
Изучая приведенные выше реакции, мы можем сказать, что Cr2O3 является хорошим восстановителем, может отдавать электроны и проявлять множество степеней окисления хрома (Cr), что возможно, поскольку Cr имеет d-орбиталь.
X-KOH-Cr(OH)3-Cr2O3 Напишите молекулярные уравнения реакций, с которых можно осуществить указанные превращения. 1) 2) 3)
Химия, 13.12.2021 03:17, arisazenina783
Всего ответов: 3
Посмотреть ответы
Другие вопросы по Химии
Химия, 28.02.2019 09:20, mai31
Перечислите все амфотерные элементы или объясните как их находить в таблице менделеева.
Ответов: 3
Посмотреть
Химия, 28.02.2019 13:20, марик11092
.(Рассчитайте количество и объем (н. у.) кислорода, который потребуется на сжигание металлического кальция массой 100г.).
Ответов: 3
Посмотреть
Химия, 01.03.2019 09:10, Lena111115
Получение углекислого газа. в пробирку поместите несколько кусочков мрамора и мела, прилейте к ним 2-3 см кубических разбавленой соляной кислоты. закройте пробирку пробкой с газоотводной трубой. соберите выделяющийся газ в
в пробирку поместите несколько кусочков мрамора и мела, прилейте к ним 2-3 см кубических разбавленой соляной кислоты. закройте пробирку пробкой с газоотводной трубой. соберите выделяющийся газ в
пробирку методом выделения воздуха. как надо расположить пробирку? почему?
Ответов: 3
Посмотреть
Химия, 01.03.2019 14:20, Никита111116644
Осуществить превращение : al4c3 -> ch5 -> c2h3 -> c2h6 -> c2h5br -> c4h20 -> бутадиен -> каучук. ! задали на завтра
Ответов: 4
Посмотреть
Химия, 02.03.2019 05:00, alekss1234
Имеется смесь газов, состоящая из 56л co и 28л co2. рассчитайте количество веществ каждого газа в этой смеси.
Ответов: 3
Посмотреть
Химия, 02.03.2019 18:00, duk73p07117
Как называются методы разделения смесей, при которых можно разделить смесь песка и воды
Ответов: 2
Посмотреть
Знаешь правильный ответ?
X-KOH-Cr(OH)3-Cr2O3 Напишите молекулярные уравнения реакций, с которых можно осуществить указанные п. ..
..
Вопросы по предметам
Литература, 11.05.2020 10:57
Когда родидся Пушкин Нужно и быстро…
Русский язык, 11.05.2020 10:57
Образование не есть только школьное дело. Школа даёт лишь ключи к этому образованию. Внешкольное образование есть вся жизнь! Никогда не беритесь за последующее, не окончив предыдущ…
История, 11.05.2020 10:57
Монополия-1-й аргумент
2-й аргумент
3-й аргумент
4-й аргумент
…
История, 11.05.2020 10:57
Задача 1: Отметьте, для каких эпох сделаны следующие заявления. А) Человек — венец творения. Б) Право человека на счастье и свободу. В) Отражение совершенства организма человека да…
Биология, 11.05.2020 10:57
Какой пример сукцессию можно привести с городом Алматы…
Литература, 11.05.2020 10:57
Сравните русалок в произведениях М. Ю. Лермонтова и К. Д. Бальмонта.
Английский язык, 11.05.2020 10:57
Алгоритм в котором выполнение задачи зависит от выполнения условий называется. ..
..
Английский язык, 11.05.2020 10:57
1Соедини два предложения в одно, используя относительные местоимения
1. Alfred Hitchcock was a film director. He made over fifty films.
Alfred Hitchcock, who was a film d…
Математика, 11.05.2020 10:57
2мин 15с = □ с 68 с = □ мин □ с
3мин 30с = □ с 140 с = □ мин □ с
5мин 42с = □ с 162 с = □ мин □ с…
Химия, 11.05.2020 10:57
Х
ХИМИЯ Запишите ионные уравнения из цепочки реакции
Ca(OH)2 = Ca(HCO3) 2 = Ca(HCO3)2…
Больше вопросов по предмету: Химия Случайные вопросы
KClO3 + 4KOH + Cr2O3 = 2h3O + KCl + 2K2CrO4
| Поиск |
хлорат калия + гидроксид калия + оксид хрома(iii) = вода + хлорид калия + |
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| png» substance-weight=»122.5495″> KClO 3 | + | 1903″> 2K 2 CRO 4 | |||||||||
| Хлорат калия | Гидроксид калия | 9005 Хроксиий (III).0074 | water | potassium chloride | |||||||
| 1 | 4 | 1 | 2 | 1 | 2 | Hệ số | |||||
| Nguyên — Phân tử khối (g/ Моль) | |||||||||||
| Số MOL | |||||||||||
| KHốI LượNG (G) |
Реклама
Дополнительная информация об уравнении KCLO
3 + 4KOH + CR 2 O 3 → 2H 2 O + KCL + 2K 2 CRO 4What Constormation of KCLO3 (POTSIUM SHASSIUM) (POTSIUM) (POTSIUM) (POTSIMIUM) реагирует с KOH (гидроксид калия) реагирует с Cr2O3 (оксид хрома(iii)) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3O (вода) и KCl (хлорид калия) и K2CrO4 () ?
В полном предложении вы также можете сказать, что KClO3 (хлорат калия) реагирует с KOH (гидроксид калия) реагирует с Cr2O3 (оксидом хрома (iii)) и производит h3O (воду) и KCl (хлорид калия) и K2CrO4 ()
Феномен после реакции KClO3 (хлората калия) с KOH (гидроксидом калия) реакции с Cr2O3 (оксидом хрома(iii))
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта K2CrO4 , появляющийся в конце реакции.
Или если какое-либо из следующих реагентов Cr2O3 (оксид хрома(iii)), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Другие вопросы, связанные с химическими реакциями KClO
3 + 4KOH + Cr 2 O 3 → 2H 2 O + KCl + 2K 2 CrO 4Вопросы, связанные с реагентом KClO3 (хлорат калия)
Каковы химические и физические характеристики KClO3 (хлорат калия)? (хлорат калия) в качестве реагента?
Вопросы, связанные с реагентом КОН (гидроксид калия)
Каковы химические и физические характеристики КОН (гидроксида калия)? Какие химические реакции происходят с КОН (гидроксидом калия) в качестве реагента?
Вопросы, связанные с реагентом Cr2O3 (оксид хрома(iii))
Каковы химические и физические характеристики Cr2O3 (оксид хрома(iii))?Каковы химические реакции, в которых Cr2O3 (оксид хрома(iii)) используется в качестве реагента ?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (оксида хрома (iii))? Каковы химические реакции, в результате которых образуется h3O (вода)?
Вопросы, связанные с продуктом KCl (хлорид калия)
Каковы химические и физические характеристики KCl (оксид хрома (iii))? Какие химические реакции происходят с KCl (хлоридом калия) в качестве продукта?
Вопросы, связанные с продуктом K2CrO4 ()
Каковы химические и физические характеристики K2CrO4 (оксид хрома (iii))? Какие химические реакции происходят с K2CrO4 () в качестве продукта?
Уравнения с KClO3 в качестве реагента
хлорат калия
5KClO 3 + 6P → 5KCl + 3P 2 O 5 3C + 2KClO 3 → 2KCl + 3CO 2 18H 2 O + 14KClO 3 + 3As 2 S 3 → 9H 2 SO 4 + 14KCl + 6H 3 AsO 4 Просмотреть все уравнения с KClO3 в качестве реагентаУравнения с КОН в качестве реагента
гидроксид калия
2KOH + Mg(NO 3 ) 2 → 2KNO 3 + Mg(OH) 2 KOH + FECL 3 → KCL + FE (OH) 3 2KOH + CH 3 NH 3 HCO 3 → H 2 O + K 2 CO 3 + Ch 2 CO 3 + Ch 2 CO 3 + CH + CH + CH + Ch 2 CO 3 . НХ 2 Просмотреть все уравнения с KOH в качестве реагента
НХ 2 Просмотреть все уравнения с KOH в качестве реагента
Уравнения с Cr2O3 в качестве реагента
оксид хрома(iii)
3H 2 SO 4 + Cr 2 O 3 → 3H 2 O + Cr 2 (SO 3 9 1 9003)0032 6HCl + CR 2 O 3 → 3H 2 O + 2CRCL 3 2AL + CR 2 O 3 → AL 2 O 3 + 2CR CR. Просмотреть все уравнения с Cr2O3 в качестве реагента
Реклама
Уравнения с Cr2O3 в качестве продукта
оксид хрома(iii)
2NH 3 + 2CrO 3 → 3H 2 O + N 2 + Cr 2 O 3 ) 903 2(NH 40032 CRO 4 → 5H 2 O + N 2 + 2NH 3 + CR 2 O 3 K 2 CR 2 O 7 + S. 2 O 7 + S. 2 O 7 + S. . 3 + К 2 СО 4 Просмотреть все уравнения с Cr2O3 в качестве продукта
2 O 7 + S. 2 O 7 + S. . 3 + К 2 СО 4 Просмотреть все уравнения с Cr2O3 в качестве продукта
Уравнения с Cr2O3 в качестве продукта
оксид хрома(iii)
2(NH 4 ) 2 CrO 4 → 5H 2 O + N 2 + 2NH 3 + CR 2 O 3 2NH 3 + 2CRO 3 → 3H 2 O + N 2 + CR 2 O 3 5K 2 2 O 3 5K 2 2 3 3 5K 2 131131 3 3 3 3 3 3 131131 3 1 3 3 3 3 3 3 3 1 3 3 1 3 1 3 1 3 1 3 1 3 1 3 . + 6P → 5K 2 O + 3P 2 O 5
Уравнения с Cr2O3 в качестве продукта
оксид хрома(iii)
2NH 3 + 2CrO 3 → 3H 2 O + N 2 + CR 2 O 3 2 (NH 4 ) 2 CRO 4 → 5H 2 O + N 2 + 2N 2H 2 O + N 2 + 2N. 2 O 3 2C + Na 2 Cr 2 O 7 → 2CO + Na 2 CO 3 + 3 903 Cr 2 9
Просмотреть все уравнения с Cr2O3 в качестве продукта
2 O 3 2C + Na 2 Cr 2 O 7 → 2CO + Na 2 CO 3 + 3 903 Cr 2 9
Просмотреть все уравнения с Cr2O3 в качестве продукта
koh+cr2o3 → h3o+kcro2Tất cả phương trình điều chế từ koh+cr2o3 ra h3o+kcro2
- Транг чо
Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ koh+cr2o3 ra h3o+kcro2.
 Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.
Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học. Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(версия 1.204.214, полная загрузка)
Những Điều Thú Vị Chỉ 5% Ngời Biet
Реклама
2KOH + Cr
2 O 3 → H 2 O + 2KCrO 2Điều kiện khác: khi nấu kot
Xem trạng thái chất và chi tiết của phương trình KOH + Cr2O3 => h3O + KCrO2
Có 1 kết quả được tìm thấy
— Hiển thị kết quả từ 1 đến 1
Trang 1
Thong tin thêm về phương trình hoa học
Phản ứng cho KOH (кали гидроксит) tác dụng vóiPhong Ậong ng chất KOH (гидроксит калия) (гидроксид калия)
2NaOH + K 2 HPO 4 → 2KOH + Na 2 HPO 4 3C 2 H 4 + 4H 2 O + 2KMnO 4 → 2KOH + 2MnO 2 + 3C 2 H 4 (OH) 2 H 2 O + K 2 O → 2KOH
Phương trình để tó ra chất Cr2O3 (Crom(III) оксит) (хром(iii) оксид)
2NH 3 + 2CrO 3 → 3H 2 O + N 2 + Cr 2 O 3 2(NH 4 ) 2 CrO 4 → 5H 2 O + N 2 + 2NH 3 + Cr 2 O 3 O 2 + 4CrO → 2Cr 2 O 3
Phương trình để tạo ra CHấT H3O (NướC) (вода)
NaOH + C 6 H 5 BR → C 6 H 5 ONA + H 2 O + NABR 2 (NH 4 ) 3 o + NABR 2H 4 ) 3 3 3 3 9 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 .
