What, How to Balance & FAQs —
By Neeloy Bhattacharya
В последовательности реакций обычно образуется один или несколько продуктов. Посмотрим, как протекает реакция H 2 SO 4 и Cu.
Серная кислота в основном существует в виде водного раствора, поскольку она гигроскопична по своей природе. Медь (Cu) — переходный металл с красноватым блеском, играющий огромную роль в промышленности. Медь не подвергается коррозии благодаря нанесению защитного поверхностного слоя в присутствии воздуха. Медь относительно менее активна.
В статье будет рассмотрен процесс реакции и свойства между серной кислотой и медью.
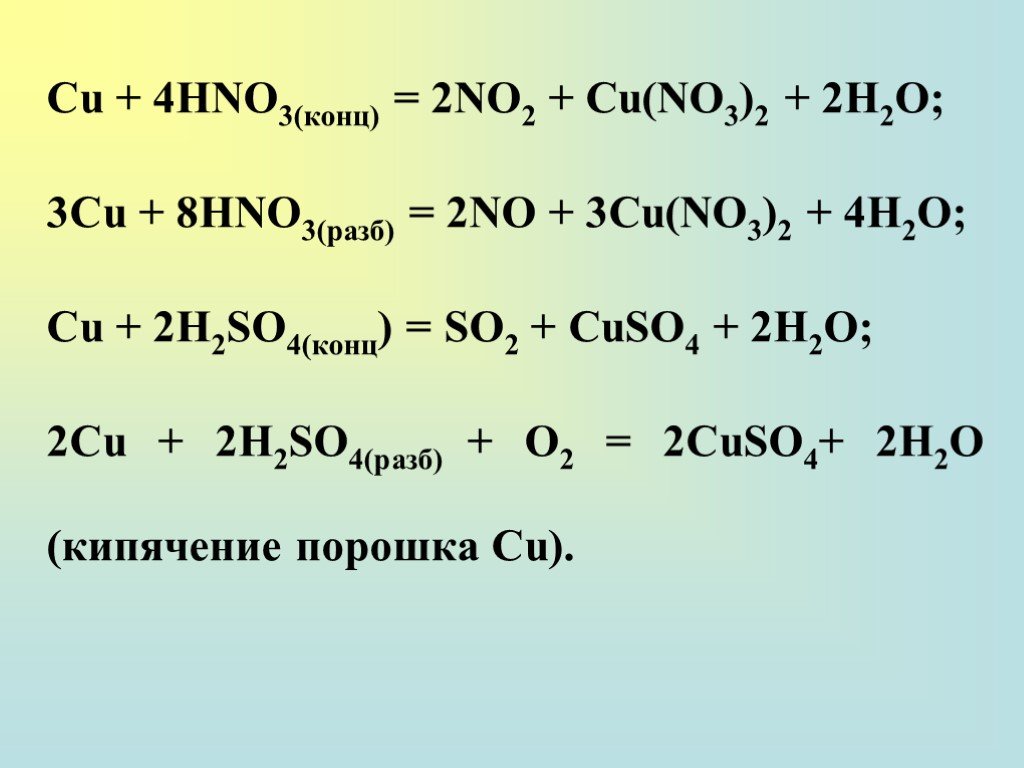
Что является продуктом H 2 SO 4 и Cu? Концентрированный H 2 SO 4 и Cu реагируют с образованием сульфата меди(II), газообразного диоксида серы и воды. Однако возможны и другие параллельные реакции, приводящие к сульфидам и оксидам.
- Cu(s) + 2H 2 SO 4 (aq) → cuso 4 (aq) + so 2 (g) + 2H 2 O (L)
- Медный (II) Сольфид. Создано:
- 4CU (II). s) + 4H 2 SO 4 (водн.) → 3CuSO 4 (водн.) + CuS(g) + 4H 2 O(l)
- Медь также является оксидом меди(II) параллельный продукт:
- Cu(тв) + H 2 SO 4 (водн.) → CuO(тв) + SO 2 (г) + 2H 2 O(l)
Реакция H 2 SO 4 с Cu является окислительно-восстановительной реакцией, в которой для завершения реакции необходимо сконцентрировать кислоту.
Как сбалансировать H 2 SO 4 и Cu?Схема реакции H 2 SO 4 и Cu приведена ниже:
- Составим общее химическое уравнение:
- Cu(s) + H 2 SO 4 (водн.
 ) → CuSO 4 (водн.) + SO 6 0 5 H0 2 (00006 г) O(l)
) → CuSO 4 (водн.) + SO 6 0 5 H0 2 (00006 г) O(l) - Так как обе стороны должны быть равны по количеству атомов, помня о стехиометрии, умножьте серную кислоту на 2, чтобы уравнять атомы водорода.
- Cu(s) + 2H 2 SO 4 (водн.) → CuSO 4 (водн.) + SO 2 (г) + 2H 2 O(l)
Титрование меди серной кислотой невозможно. Однако сульфатные соли меди могут помочь в оценке серной кислоты.
Apparatus Used- Graduated Burette
- Volumetric Flask
- Conical Flask
- Burette Stands
- Химические стаканы
- Сульфат растворяют в слабом количестве уксусной кислоты в конической колбе, чтобы раствор не стал щелочным.

- N/10 концентрированного спирта добавляют к раствору для лучшей оценки. Йодид калия используется в качестве индикатора.
- Используется немного разбавленный раствор H 2 SO 4 . Среда не должна нагреваться.
- При титровании выпадает небольшое количество меди. Его немедленно удаляют из среды.
- Полученный осадок небольшими порциями выпаривают досуха. Его переносят в мензурки.
- В конечной точке заметно изменение цвета.
- Расчет содержания серной кислоты в условиях растворимых сульфатов производится путем математических расчетов.
H 6 SO 005 4 + Cu Суммарное ионное уравнение означает образование ионов меди(II), сульфат-ионов, а также протонных и гидроксильных ионов из воды.
- CU (S) + 2H + (AQ) + SO 4 2- (AQ) → CU 2+ (AQ) + SO 4 2-й водн.) + SO 2 (г) + H + (водн.) + OH – (водн.)
H 2 SO 4 + Cu reaction has the following conjugate pairs ,
- The conjugate base of H 2 SO4= HSO 4 –
- The conjugate base H 2 O = OH —
H 2 SO 4 + CU -реакция.0012
- H 2 SO 4 обладает высокой полярностью, демонстрируя большие межмолекулярные силы, повышая температуру кипения.

- Твердое тело Cu существует в прочной гранецентрированной кубической решетке.
- CuSO 4 встречается в гидратированных формах, в основном пентагидрат CuSO 4 . 5H 2 O.
- Пентагидрат состоит из всех связей — ионных, ковалентных и координатных.
H 2 SO 4 + CU Entalpy Entalpy реакции выше -12,6 KJ/MOL.
- Энтальпия формирования Cu = 0 (элементы не могут быть сформированы)
- Энтальпия формирования H 2 SO 4 = -814 KJ
- Entally of Forpporty of Forpporty of Cus/Mol
- of Forpporty of Cus. 4 = -771 кДж/моль
- Энтальпия формирования SO 2 = -298 кДж/моль
- Энтальпия формации H 2 o = -285,8 KJ/MOL
- 11111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111 Реакция = [-771 -298 -(285,8 x 2)] – [- 2 x 814 ]
H 2 SO 4 + Cu сильная комбинация не может дать идеального буферный раствор как сильная кислота, такая как серная кислота, уже присутствует.
H 2 SO 4 + Cu реакцию можно назвать завершенной, так как в определенный момент времени достигается равновесие.
Является ли H 2 SO 4 + Cu экзотермической реакцией?H 2 SO 4 + Cu реакция носит экзотермический характер, поскольку энтальпия реакции отрицательна, что приводит к повышению температуры системы.
Является ли H 2 SO 4 + Cu окислительно-восстановительной реакцией?H 2 SO 4 + Cu реакция является окислительно-восстановительной реакцией, в которой серная кислота действует как хороший окислитель.
Является ли H 2 SO 4 + Cu Реакцией осаждения? H 2 SO 4 + Cu реакцию можно назвать реакцией осаждения, поскольку сульфат меди может образовывать осадок в концентрированном растворе.
H 2 SO 4 + Cu Реакция необратима по своей природе, так как мы не можем получить обратно продукты после достижения равновесия, если только мы радикально не изменим условия реакции.
Является ли H 2 SO 4 + Cu Реакцией замещения?H 2 SO 4 + Cu реакция не является реакцией двойного замещения, так как ионы не замещаются в конце реакции, уступая место другим продуктам.
ЗаключениеТак как реакция серной кислоты с водой сильно экзотермична, мы используем концентрированную кислоту. В результате на поверхности наблюдаются черные отложения по мере растворения меди. Продукты могут быть обнаружены методами общего анализа.
Сопоставьте следующее уравнение Cu + h3SO4 с CuSO4 + SO2 + h3O
ICSE-ЯЗЫК ХИМИИ-УПРАЖНЕНИЕ 1(C) (Исправьте следующее утверждение)
21 видео Khareedo DN Pro и дехо сари видео бина киси объявление ки rukaavat ке! Обновлено: 27 июня 2022 г.
Текст Решение
Решение
Шаг 1: Подсчитайте количество атомов всех элементов по обе стороны химического уравнения.
Шаг 2: Медь и водород равны с обеих сторон, поэтому, чтобы уравнять атомы серы, умножьте h3SO4 на 2.
Cu+2h3SO4→CuSO4+SO2+h3O
Шаг 3: Чтобы уравнять атомы водорода, умножьте h3O на 2.
Это дает сбалансированное уравнение.
Cu+2h3SO4→CuSO4+SO2+2h3O
Ответ
Пошаговое решение, разработанное экспертами, чтобы помочь вам избавиться от сомнений и получить отличные оценки на экзаменах.
Расшифровка
, поэтому волосы класса — это левая сторона, где показано, что это реагент элементы из реагента и элементы с веб-сайта могли видеть, что покрытие одинаковое водород одинаков с обеих сторон, но сера не одинакова в слева нам нужно X, чтобы в основном мы должны умножить so4 на это Храм, каков шаг, умножьте h3 S o4 на 2 x 2 аукциона головок, также получите X и водород, также умножьте, так что теперь мы увидели, что сера является балансом, теперь мы должны сбалансировать кислород и водород
Итак, сначала мы сбалансируем водород, чтобы сбалансировать водород, теперь мы умножим на 2 шаг 2 умножим на 2 x 2 водородный газ X результаты теперь водород — это баланс баланс баланс баланс мы должны сбалансировать кислород так сколько кислорода здесь он есть Станьте, поэтому мы заметили, что все религии равны окончательной реакции, это класс. Этот Cu + Tour H3 S O4 дает нам CUSO4 + SO2 + H3O
Этот Cu + Tour H3 S O4 дает нам CUSO4 + SO2 + H3O
является окончательным уравнением класса
Связанные видео
समीकरण को in.
0579 Cu+h3SO4→CuSO4+h3O+SO2
225661117
Уравняйте следующие химические уравнения: NaOH+h3SO4+h3O
642833622
Уравновесьте следующее уравнение:
642893356
Напишите ионо-электрическое уравнение для следующего: Cu +H_2SO_4 RARR CUSO_4 +SO_2 +2H_2O
642895875
0579 S+h3SO4→SO2+h3O
643055996
निम्नलिखित समीकरणों को पूर्ण एवं संतुलित करें
Cu+h3SO4→ _______ + _________
643056073
निम्न रासायनिक समीकरणों को संतुलित करें-
h3S+O2→h3O+SO2
643530481
Сбалансируйте следующее уравнение:
S+h3SO4→SO2+h3O.
643741984
Сбалансируйте следующее уравнение:
C+h3SO4→CO2+h3O+SO2.
643741986
Напишите сбалансированные химические уравнения для каждого из следующих
Fe+CUSO4 → FESO4+CU
643924785
Балансировать химические уравнения:
CL2+SO2+H3O → H3SO4+HCL
643924788
Баланс.

 ) → CuSO 4 (водн.) + SO 6 0 5 H0 2 (00006 г) O(l)
) → CuSO 4 (водн.) + SO 6 0 5 H0 2 (00006 г) O(l)