1)Определить ЭДС гальванического элемента — Спрашивалка
ПК
Павел Комаров
1)Определить ЭДС гальванического элемента, построенного из следующих полуэлементов:
а) цинка, погруженного в 0,001М раствора ZnSo4
б) меди, погруженной в 1М раствора CuSo4
2)Рассчитать ЭДС элемента, образованного никелевым электродом, погруженным в раствор 0,1М концентрации NiSo4 и медным электродом, погруженным в 1М раствора CuSo4,считая диссоциацию солей полной.
- элемент
Св
Светлана
Первая задача
См (ZnSO4) = 0,001 M
Cм (CuSO4) = 1 M
В гальваническом элементе анодом становится металл, обладающий меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала. Медь в электрохимическом ряду напряжений стоит правее, чем цинк, следовательно, медь имеет большее значение электродного потенциала восстановления, чем цинк.
Е°(Cu(2+)/Cu) = + 0,338 B
Е°(Cu(2+)/Cu) > E°(Zn(2+)/Zn)
Значит, в данном гальваническом элементе цинк будет анодом, а медь – катодом.
На аноде протекает процесс окисления металла, а на катоде – процесс восстановления металла.
Процессы окисления-восстановления на электродах.
Анод (-) Zn(0) – 2е → Zn(2+) │1 — процесс окисления на аноде
Катод (+) Cu(2+) + 2е → Cu(0) │1 — процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение токообразующей реакции, которое в ионной форме, выражает происходящую в элементе реакцию.
Zn + Cu(2+) → Zn(2+) + Cu↓
В молекулярном виде
Zn + CuSO4 → ZnSO4 + Cu↓
Схема гальванического элемента
А (-) Zn | ZnSO4 (0,001 M) || CuSO4 (1M) | Cu К (+)
Будем считать, что диссоциация электролитов была полной, тогда молярные концентрации ионов Cu(2+) и Zn(2+) в растворах электролитов.
[Zn(2+)] = См (ZnSO4) = 0,001 M
[Cu(2+)] = См (CuSO4) = 1,0 M
Электродные потенциалы анода и катода по уравнению Нернста при 298°K.
Е (анода) = Е (Zn(2+)/Zn) = Еº(Zn(2+)/Zn) + (0,059/2)*lg[Zn(2+)] = – 0,76 + 0,0295*lg0,001 = – 0,76 + 0,0295*(–3) = – 0,849 B
Е (катода) = Е (Cu(2+)/Cu) = Еº(Cu(2+)/Cu) + (0,059/2)*lg[Сu(2+)] = + 0,338 + 0,0295*lg1 = + 0,338 B
ЭДС гальванического элемента.
ЭДС = Е (катода) – Е (анода) = E(Cu(2+)/Cu) – E(Zn (2+)/Zn) = 0,338 – (– 0,849) = 1,187 В
Вторая задача
См (NiSO4) = 0,1 M
Cм (CuSO4) = 1 M
Медь в электрохимическом ряду напряжений стоит правее, чем никель, следовательно, медь имеет большее значение электродного потенциала восстановления, чем никель.
Еº(Zn(2+)/Zn) = − 0,76 B
E°(Ni(2+)/Ni) = – 0,234 B
Е°(Cu(2+)/Cu) > E°(Ni(2+)/Ni)
Значит, в данном гальваническом элементе никель будет анодом, а медь – катодом.
Процессы окисления-восстановления на электродах.
Анод (-) Ni(0) – 2е → Ni(2+) │1 — процесс окисления на аноде
Катод (+) Cu(2+) + 2е → Cu(0) │1 — процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение токообразующей реакции, которое в ионной форме, выражает происходящую в элементе реакцию.

Ni + Cu(2+) → Ni(2+) + Cu↓
В молекулярном виде
Ni + CuSO4 → NiSO4 + Cu↓
Схема гальванического элемента
А (-) Ni | NiSO4 (0,1 M) || CuSO4 (1M) | Cu К (+)
Поскольку диссоциация электролитов была полной, тогда молярные концентрации ионов Cu(2+) и Ni(2+) в растворах электролитов.
[Ni(2+)] = См (NiSO4) = 0,1 M
[Cu(2+)] = См (CuSO4) = 1,0 M
Электродные потенциалы анода и катода по уравнению Нернста при 298°K.
Е (анода) = Е (Ni(2+)/Ni) = Еº(Ni(2+)/Ni) + (0,059/2)*lg[Ni(2+)] = – 0,234 + 0,0295*lg0,1 = – 0,234 + 0,0295*(–1) = – 0,264 B
Е (катода) = Е (Cu(2+)/Cu) = Еº(Cu(2+)/Cu) + (0,059/2)*lg[Сu(2+)] = + 0,338 + 0,0295*lg1 = + 0,338 B
ЭДС гальванического элемента.
ЭДС = Е (катода) – Е (анода) = E(Cu(2+)/Cu) – E(Zn (2+)/Zn) = 0,338 – (– 0,264) = 0,602 В
Alexandr
пипец..
Похожие вопросы
Помогите пожалуйста! Гальванические элементы!
Вычислите электродный потенциал серебра в 0,001 М AgNO3. 2)определить ЭДС цинк- платинового гальванического элемента
2)определить ЭДС цинк- платинового гальванического элемента
вычислите эдс гальванического элемента, состоящего из железного электрода, погруженного в 0,01М раствор нитрата железа.
Помогите рассчитать ЭДС гальванических элементов
составьте схему напишите электронные уравнения электродных процессов и вычислите эдс гальванического элемента
как определить ЭДС гальванической цепи?
Написать формулу гальванического элемента, составленного из свинцового и железного электродов. Вычислить эдс элемента,
Чем электролиз отличается от гальванического элемента? чем?
Рассчитайте ЭДС гальванического элемента
Составить схему и рассчитать ЭДС гальванического элемента
Какая реакция обратима? (A) $ Cu + \,\,ZnS{O_4}\,\, \to \,\,CuS{O_4}\,\, + \,\,Zn $ (B) $ CuO + \,\,{H_2}S{O_4}\,\, \к \,\,CuS{O_4}\,\, + \,\,{H_2}O $ (C) $ CuO + \,\, {H_2}\,\, \to \,\,Cu\,\, + \,\,{H_2}O $ (D) $ CuS{O_4} \cdot 5{H_2}O\,\, \to \ ,\,CuS{O_4}\,\, + \,\,5{H_2}O $
Ответ
Подтверждено
198. 9k+ просмотров
9k+ просмотров
Подсказка: Чтобы решить этот вопрос, мы должны сначала понять весь понятие об обратимой реакции. Затем нам необходимо оценить основные положения концепции, которые помогут нам найти, какая из данных реакций является обратимой, и только тогда мы сможем сделать вывод о правильном ответе.
Полное пошаговое решение:
Прежде чем перейти к решению данного вопроса, давайте сначала разберемся с некоторыми основными понятиями об обратимой реакции:
Обратимая реакция: определяется как химическая реакция, в которой реагенты и продукты реагируют вместе, чтобы вернуть реагенты. Простыми словами можно сказать, что это реакция с одновременным превращением реагентов в продукты и наоборот.
Характерным для такого типа реакции является то, что реагенты и продукты никогда полностью не исчерпываются. Это означает, что каждый из них постоянно реагирует и производится. Обратимая реакция указывается или выражается следующим образом:
$ A + \,\,B\,\, \rightleftarrows \,\,C\,\, + \,\,D $
A и B могут реагировать с образованием C и D и в обратной реакции C и D может реагировать с образованием форм A и B. Двойная стрелка указывает на то, что химическая реакция обратима.
Двойная стрелка указывает на то, что химическая реакция обратима.
Таким образом, пройдя все пункты, изложенные выше, мы легко можем сделать вывод, что единственная реакция, которую можно назвать обратимой из заданных вариантов, это:
$ CuS{O_4} \cdot 5{H_2}O\,\, \to \ ,\,CuS{O_4}\,\, + \,\,5{H_2}O $
В обратимой реакции реагирующие молекулы в замкнутой системе сталкиваются друг с другом и используют энергию для разрыва химических связей и образования новых продуктов . Энергия активации присутствует в системе для того, чтобы тот же процесс происходил с продуктами.
Следовательно, реагенты и продукты будут находиться в постоянном равновесии, т. е. между реагентами и продуктом будет происходить непрерывное взаимопревращение.
Таким образом, мы можем заключить, что правильный ответ — вариант D.
Примечание:
Обратимые реакции не могут протекать с одинаковой скоростью в обоих направлениях. Тем не менее, достигается состояние равновесия. Это также зависит от начальных концентраций реагентов и продуктов и константы равновесия К.
Это также зависит от начальных концентраций реагентов и продуктов и константы равновесия К.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Химический класс кальция 12 JEE_Main
Сомнительные тенденции
16.
 2: Гальванические элементы и электроды
2: Гальванические элементы и электроды- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 260
- Стивен Лоуэр
- Университет Саймона Фрейзера
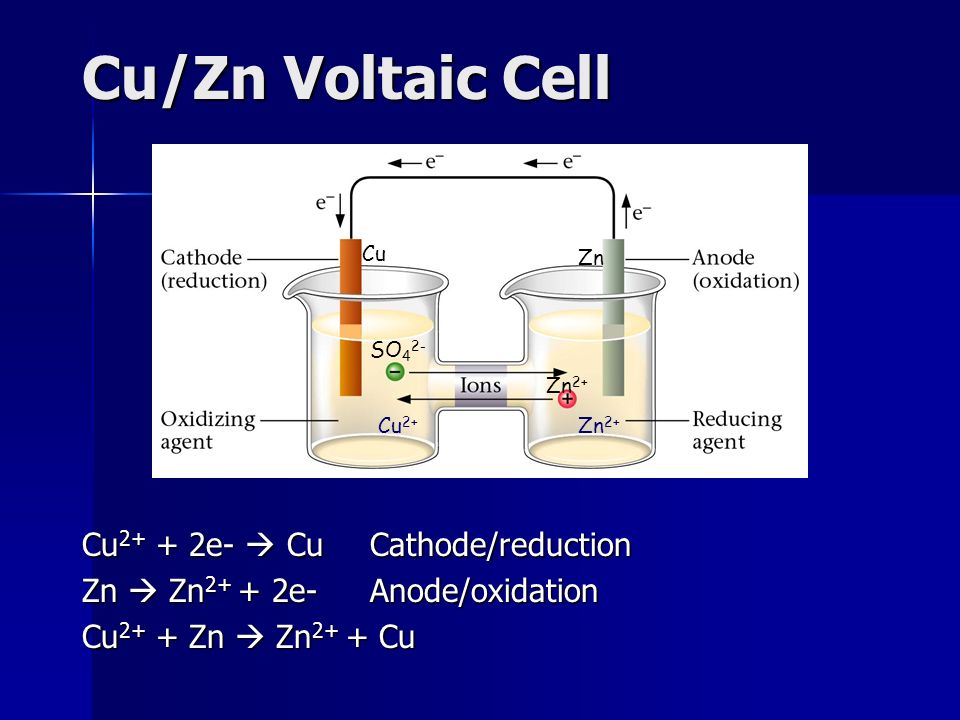
Физически невозможно измерить разность потенциалов между куском металла и раствором, в который он погружен. Однако мы можем измерить разность между потенциалами двух электродов, погруженных в один и тот же раствор или, что более полезно, находящихся в двух разных растворах. В последнем случае каждая пара электрод-раствор представляет собой окислительно-восстановительный полуячейка , и мы измеряем сумму двух потенциалов полуячейки .
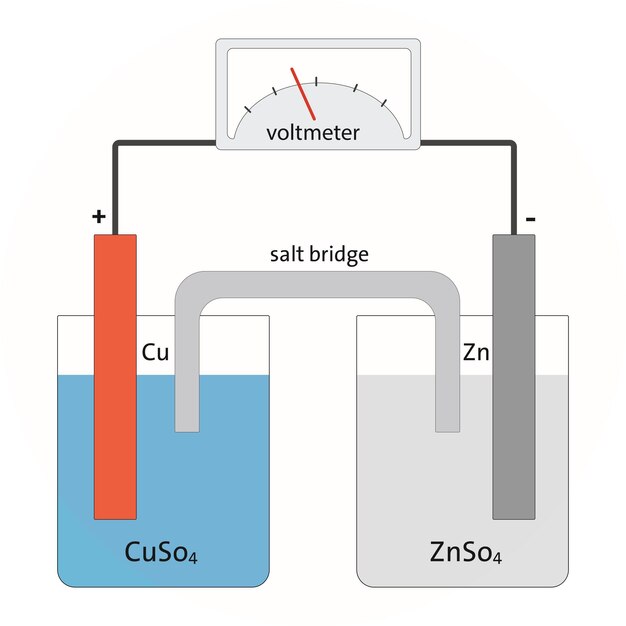
Это устройство называется гальваническим элементом . Типичная ячейка может состоять из двух кусков металла, одного из цинка и другого из меди, каждый из которых погружен в раствор, содержащий растворенную соль соответствующего металла. Два раствора разделены пористым барьером, который предотвращает их быстрое смешивание, но позволяет ионам диффундировать.
Если мы соединим цинк и медь с помощью металлического проводника, избыточные электроны, которые останутся, когда Zn 9{2+} + Cu_{(s)}\]
, но на этот раз стадии окисления и восстановления (полуреакции) происходят в разных местах:
левый электрод: | Zn (s) → Zn 2 + + 2 e – | окисление |
Правый электрод: | Cu 2 + + 2 e – → Cu (s) | переходник |
Электрохимические ячейки позволяют измерять и контролировать окислительно-восстановительную реакцию
Реакцию можно запустить и остановить, подключив или отсоединив два электрода. Если мы поместим в цепь переменное сопротивление, мы сможем даже контролировать скорость общей реакции клетки, просто поворачивая ручку. Подключив к двум электродам батарею или другой источник тока, мы можем заставить реакцию протекать в ее несамопроизвольном или обратном направлении. Поместив амперметр во внешнюю цепь, мы можем измерить количество электрического заряда, прошедшего через электроды, и, таким образом, количество молей реагентов, которые превращаются в продукты реакции в клетке.
Если мы поместим в цепь переменное сопротивление, мы сможем даже контролировать скорость общей реакции клетки, просто поворачивая ручку. Подключив к двум электродам батарею или другой источник тока, мы можем заставить реакцию протекать в ее несамопроизвольном или обратном направлении. Поместив амперметр во внешнюю цепь, мы можем измерить количество электрического заряда, прошедшего через электроды, и, таким образом, количество молей реагентов, которые превращаются в продукты реакции в клетке.
Электрический заряд q измеряется в кулонах. Количество заряда, переносимого одним молем электронов, известно как Фарадея , которое мы обозначаем как F . Тщательные эксперименты определили, что 1 F = 96467 C. Для большинства целей вы можете просто использовать 96 500 кулонов в качестве значения фарадея. Когда мы измеряем электрический ток, мы измеряем скорость, с которой электрический заряд переносится по цепи. Ток в один ампер соответствует потоку в один кулон в секунду.
Перенос заряда в ячейке
Чтобы ячейка работала, не только должна быть внешняя электрическая цепь между двумя электродами, но и два электролита (растворы) должны находиться в контакте. Необходимость этого можно понять, если рассмотреть, что произошло бы, если бы два решения были физически разделены. Положительный заряд (в виде Zn 2 + ) добавляется к электролиту в левом отсеке и снимается (как Cu 2 + ) с правой стороны, в результате чего раствор, находящийся в контакте с цинком, приобретает суммарный положительный заряд, в то время как суммарный отрицательный заряд накапливается в растворе на медной стороне элемента. Эти нарушения электронейтральности затруднили бы (потребовали больше работы) введение дополнительных ионов Zn 2 + в положительно заряженный электролит или поток электронов в правый отсек, где они необходимы для восстановления Cu 2 + ионов, таким образом эффективно останавливая реакцию после того, как произошло только химически незначительное количество.
Для поддержания клеточной реакции заряд, переносимый электронами по внешней цепи, должен сопровождаться компенсирующим переносом ионов между двумя клетками. Это означает, что мы должны предоставить путь для прямого перемещения ионов из одной клетки в другую. В этом ионном транспорте участвуют не только электроактивные частицы Cu 2 + и Zn 2 + , а также противоионов , которые в данном примере являются нитратами, NO 3 — . Таким образом, избыток Cu 2 + в левом отделении может быть уменьшен за счет дрейфа этих ионов в правую сторону или с таким же успехом за счет диффузии ионов нитрата влево. Более подробные исследования показывают, что происходят оба процесса и что относительное количество заряда, переносимого через раствор положительными и отрицательными ионами, зависит от их относительного подвижности , которые выражают скорость, с которой ионы могут проходить через раствор. Поскольку отрицательные ионы имеют тенденцию быть больше, чем положительные ионы, последние, как правило, имеют более высокую подвижность и несут большую долю заряда.
Поскольку отрицательные ионы имеют тенденцию быть больше, чем положительные ионы, последние, как правило, имеют более высокую подвижность и несут большую долю заряда.
В простейших ячейках барьером между двумя растворами может быть пористая мембрана, но для точных измерений используется более сложная конструкция, известная как солевой мостик . Солевой мост состоит из промежуточного отсека, заполненного концентрированным раствором KCl и снабженного пористыми барьерами на каждом конце. Цель соляного моста состоит в том, чтобы свести к минимуму естественную разность потенциалов, известную как 9.0100 потенциал соединения , который возникает (как упоминалось в предыдущем разделе), когда любые две фазы (например, два раствора) находятся в контакте. Эта разность потенциалов будет сочетаться с двумя потенциалами полуклеток, что внесет некоторую неопределенность в любое измерение потенциала клетки. С соляным мостом у нас есть два потенциала жидкостного соединения вместо одного, но они имеют тенденцию компенсировать друг друга.
Условные обозначения для описания элементов
Чтобы облегчить описание данного электрохимического элемента, были приняты специальные символические обозначения. В этих обозначениях ячейка, которую мы описали выше, будет
Zn (с) | Zn 2 + (водн.) || Cu 2 + (водн.) | Cu (s)
Существует несколько других условных обозначений и номенклатуры ячеек, которые вы должны знать:
- Анод — место, где происходит окисление, а катод — место восстановления. В реальной ячейке идентичность электродов зависит от направления, в котором протекает суммарная клеточная реакция.
- Если электроны текут от левого электрода к правому электроду (как показано в обозначении ячейки выше), когда ячейка работает в своем спонтанном направлении, потенциал правого электрода будет выше, чем у левого, и потенциал ячейки будет будь позитивным.

- «Обычный поток тока» идет от положительного к отрицательному, что противоположно направлению потока электронов. Это означает, что если электроны текут от левого электрода к правому, гальванометр, помещенный во внешнюю цепь, покажет, что ток течет справа налево.
Электроды и электродные реакции
Электродная реакция относится к чистому процессу окисления или восстановления, происходящему на электроде. Эта реакция может происходить в виде одной стадии переноса электрона или в виде последовательности двух или более стадий. Вещества, которые принимают и теряют электроны, называются электроактивными частицами.
Рис. 4: Перенос электронов на аноде Этот процесс происходит в очень тонкой межфазной области на поверхности электрода и включает квантово-механическое туннелирование электронов между электродом и электроактивными частицами. Работа, необходимая для перемещения H 2 молекул О в гидратных сферах ионов составляет часть энергии активации процесса. {3+}\). Если ни один из электроактивных частиц не является металлом, какой-то другой металл должен служить проводником для доставки или удаления электронов из системы. Чтобы избежать осложнений, которые могут возникнуть при электродных реакциях с участием этого металла, обычно используют относительно инертное вещество, такое как платина. Такая полуячейка будет представлена как 9-\]
{3+}\). Если ни один из электроактивных частиц не является металлом, какой-то другой металл должен служить проводником для доставки или удаления электронов из системы. Чтобы избежать осложнений, которые могут возникнуть при электродных реакциях с участием этого металла, обычно используют относительно инертное вещество, такое как платина. Такая полуячейка будет представлена как 9-\]
Реакция происходит на поверхности электрода (рис. 4 выше). Электроактивный ион диффундирует к поверхности электрода и адсорбируется (прикрепляется) к ней за счет сил Ван-дер-Ваальса и Кулона. При этом гидратные воды, которые обычно связаны с любыми ионными частицами, должны быть вытеснены. Этот процесс всегда эндотермичен, иногда до такой степени, что только небольшая часть ионов может контактировать с поверхностью достаточно близко, чтобы осуществить перенос электрона, и реакция будет медленной. Фактический перенос электрона происходит посредством квантово-механического туннелирования. 9– (водный) | AgCl (с) | Ag (s)\]
Хотя полезность такого электрода может быть не очевидна сразу, этот тип электрода находит очень широкое применение в электрохимических измерениях, как мы увидим позже.
Электроды сравнения
В большинстве электрохимических экспериментов наш интерес сосредоточен только на одной из электродных реакций. Поскольку все измерения должны проводиться на полной ячейке с двумя электродными системами, общепринятой практикой является использование электрода сравнения 9.0101 как другая половина ячейки. Основные требования к электроду сравнения заключаются в том, чтобы его было легко изготовить и обслуживать, а также чтобы его потенциал был стабильным. Последнее требование по существу означает, что концентрация любых ионных частиц, участвующих в электродной реакции, должна поддерживаться на фиксированном уровне. Наиболее распространенным способом достижения этого является использование электродной реакции с участием насыщенного раствора нерастворимой соли иона. Об одной такой системе, хлорсеребряном электроде, уже упоминалось: 9–\]
Этот электрод обычно представляет собой кусок серебряной проволоки, покрытой AgCl. Покрытие делается путем превращения серебра в анод в электролитической ячейке, содержащей HCl; ионы Ag + соединяются с ионами Cl – по мере их образования на поверхности серебра.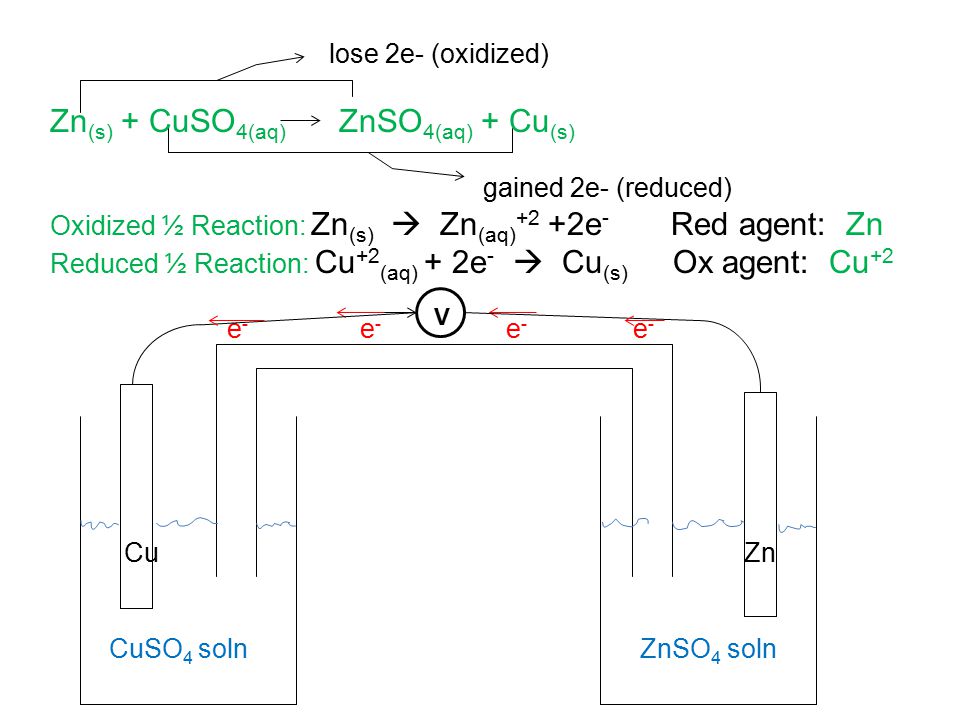
Другим распространенным электродом сравнения является каломельный электрод ; каломель — это общее название хлорида ртути (I). Такая полуячейка будет представлена как 9–\]
Потенциалы обоих этих электродов были очень точно определены относительно водородного электрода. Последний редко используется в рутинных электрохимических измерениях, поскольку его сложнее приготовить; поверхность платины должна быть специально обработана предварительным электролизом. Кроме того, существует потребность в подаче газообразного водорода, что делает его несколько громоздким и опасным.
Резюме и дополнительные примечания
Убедитесь, что вы полностью поняли следующие основные идеи, которые были представлены выше. Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
- Гальванический элемент (иногда более уместно называемый гальваническим элементом ) состоит из двух полуэлементов , соединенных солевым мостиком или некоторым другим путем, позволяющим ионам проходить между двумя сторонами для поддерживать электронейтральность .

- Обычный способ представления любого электрохимического элемента состоит в том, чтобы записать полуреакцию окисления слева и восстановление справа. Таким образом, для реакции
Zn (S) + CU 2 + → ZN 2 + + CU (S)
Мы записываем
Zn (S) 99999999999999999 9999 99999999999 гг. Zn 2 + (водн.) || Cu 2 + (водн.) | Cu (s)
, в котором одиночные вертикальные полосы представляют фазовых границ . Двойная черта обозначает границу жидкость-жидкость , которая в лабораторных ячейках состоит из солевого мостика или барьера, проницаемого для ионов. Если бы результирующая реакция ячейки была записана в обратном порядке, запись ячейки стала бы
Cu (с) | Cu 2 + (водн.