Получение иерархических микросфер оксида меди CuO в бытовой микроволновой печи
Иерархические микросферы оксида меди (CuO) были получены обработкой с помощью микроволновой печи в домашнем хозяйстве. Микросферы CuO были проанализированы с помощью сканирующей электронной микроскопии, просвечивающей электронной микроскопии, рентгеновской дифракции, рентгеновской фотоэлектронной спектроскопии и термогравиметрического анализа. Полученные результаты показывают, что иерархические микросферы CuO имеют значение удельной поверхности по методу БЭТ (Брунауэра-Эммета-Теллера) равное 25,0 м2/г.
Введение
Оксид меди (CuO) является одним из наиболее распространенных электродных материалов, благодаря своей химической стабильности, нетоксичности, экономичности, применяемый при создании таких устройств, как катализаторы, биосенсоры и конденсаторы и др. Однако низкая электропроводность CuO является основным ограничением для достижения высокой производительности создаваемых устройств. Одним из эффективных решений является оптимизация микроструктуры CuO для увеличения площади поверхностного контакта между активными материалами и электролитом, а также уменьшения путей диффузии носителей заряда. В этом отношении иерархическая структура CuO особенно привлекательна для получения превосходных электрохимических характеристик. Хотя иерархические микроструктуры CuO обладают хорошими электрохимическими характеристиками, способы изготовления обычно сложны. Для их изготовления часто требуются органические поверхностно-активные вещества, специальные подложки и др. Необходим простой, эффективный и экологичный способ приготовления иерархического CuO.
Одним из эффективных решений является оптимизация микроструктуры CuO для увеличения площади поверхностного контакта между активными материалами и электролитом, а также уменьшения путей диффузии носителей заряда. В этом отношении иерархическая структура CuO особенно привлекательна для получения превосходных электрохимических характеристик. Хотя иерархические микроструктуры CuO обладают хорошими электрохимическими характеристиками, способы изготовления обычно сложны. Для их изготовления часто требуются органические поверхностно-активные вещества, специальные подложки и др. Необходим простой, эффективный и экологичный способ приготовления иерархического CuO.
В последние годы экологичный синтез наноматериалов становится очень привлекательным в связи с растущей заботой об окружающей среде. Микроволновая энергия более экологична и требует меньше энергии, чем обычные процессы нагрева. Кроме того, по сравнению с мокрым химическим методом обработки или обработки с помощью шаблонов, приготовление структур с использованием микроволновой печи имеет явные преимущества: короткое время обработки, простота в эксплуатации и проста контроля морфологии.
В описываемом эксперименте мы использовали простой микроволновый метод обработки с использованием одной емкости для изготовления иерархических микросфер CuO. Рост этой иерархической микроструктуры CuO в этой работе был выполнен в обычной бытовой микроволновой печи, в то время как другие наноструктуры CuO (из прошлого эксперимента) были изготовлены в микроволновых печах, изготовленных на заказ, которые стоят во много раз дороже, чем бытовые микроволновые печи. Кроме того, в отличие от прошлых наноструктур CuO, полученных в закрытой камере с высоким давлением, в этой работе CuO был получен при атмосферном давлении. В этом отношении наш процесс синтеза относительно прост, безопасен и недорог.
Экспериментальные данные, оборудование и методика измерения
200 мл аликвоты 0,2 М раствора CuSO4 быстро заливали в 200 мл 0,8 М раствора K2CO3, а затем смешанный раствор немедленно помещали в обычную бытовую микроволновую печь (Panasonic NN-GF352MXPE). Мощность излучателя печи была установлена в 300 Вт, а время работы в микроволновой печи составляло 6 мин. Полученный твердый продукт последовательно фильтровали, промывали деионизированной водой и затем сушили при 50°C для дальнейшего измерения. Для сравнения, для получения CuO использовали стандартный метод химического осаждения. 40 мл аликвоты 4 М раствора K2CO3 добавляли по каплям в 400 мл 0,1 М раствора CuSO4 при механическом перемешивании. Осадок фильтровали, промывали, сушили и, наконец, отжигали при 250°C в течение 3 ч. Для удобства образец, приготовленный с помощью метода с использованием микроволновой печи был назван W-CuO, а образец, полученный обычным методом химического осаждения, был обозначен как H–CuO.
Полученный твердый продукт последовательно фильтровали, промывали деионизированной водой и затем сушили при 50°C для дальнейшего измерения. Для сравнения, для получения CuO использовали стандартный метод химического осаждения. 40 мл аликвоты 4 М раствора K2CO3 добавляли по каплям в 400 мл 0,1 М раствора CuSO4 при механическом перемешивании. Осадок фильтровали, промывали, сушили и, наконец, отжигали при 250°C в течение 3 ч. Для удобства образец, приготовленный с помощью метода с использованием микроволновой печи был назван W-CuO, а образец, полученный обычным методом химического осаждения, был обозначен как H–CuO.
Измерения методом сканирующей электронной микроскопии (СЭМ) проводили с помощью прибора JSM-7500 (JEOL, Япония). Просвечивающую электронную микроскопию (ПЭМ) проводили с помощью прибора Tecnai-G20 (FEI, США). Рентгеновская фотоэлектронная спектроскопия (РФЭС) была выполнена с помощью бюджетного спектрометра Amicus (Shimadzu, Япония) с использованием источника рентгеновского излучения Mg Ka (1253,6 эВ), работающего при напряжении 10 кВ и 10 мА. Дифракцию рентгеновских лучей (РФА) проводили с помощью рентгеновского дифрактометра XR3500 (Китай) с медной мишенью CuKa (λ = 1,5418 Å). Термогравиметрический анализ (ТГА) проводили с помощью оборудования для термического анализа (STA 449F3, NETZSCH, Германия). Эксперименты проводились при скорости нагрева 10 К мин−1 при температуре в диапазоне от комнатной температуры до 500°C со скоростью потока N2 50 мл мин−1. БЭТ измерения (Брунауэра-Эммета-Теллера) удельной поверхности методом проводились при 77 К при N2 с помощью прибора ASAP2000 (Micromeritics, США).
Дифракцию рентгеновских лучей (РФА) проводили с помощью рентгеновского дифрактометра XR3500 (Китай) с медной мишенью CuKa (λ = 1,5418 Å). Термогравиметрический анализ (ТГА) проводили с помощью оборудования для термического анализа (STA 449F3, NETZSCH, Германия). Эксперименты проводились при скорости нагрева 10 К мин−1 при температуре в диапазоне от комнатной температуры до 500°C со скоростью потока N2 50 мл мин−1. БЭТ измерения (Брунауэра-Эммета-Теллера) удельной поверхности методом проводились при 77 К при N2 с помощью прибора ASAP2000 (Micromeritics, США).
Результаты измерений
Типичные изображения СЭМ показаны на рис. 1. В отличие от неправильной зернистой структуры H–CuO (рис. 1a), W–CuO демонстрирует более правильную сферическую морфологию с диаметром от 300 нм до 1 мкм (рис. 1б). На рис. 1а также показано несколько больших кластеров, которые можно ожидать при использовании метода химического осаждения, поскольку оксиды металлов, образовавшие на более поздней стадии, нарастают на наночастицы, образовавшиеся на ранней стадии. Кроме того, на СЭМ снимке с большим увеличением видны иерархические структуры в виде микросфер с вытянутым хвостиком (вставка на рис. 1б).
Кроме того, на СЭМ снимке с большим увеличением видны иерархические структуры в виде микросфер с вытянутым хвостиком (вставка на рис. 1б).
Рис. 1 СЭМ–изображения a. H–CuO и b. W–CuO. Вставка (b) представляет собой изображение микросфер W–CuO с большим увеличением
Изображение ТГА, которое было использовано для исследования детальной микроструктуры, дополнительно подтверждает иерархическую сферическую морфологию W-CuO, похожую на микросферы с вытянутым хвостиком (рис. 2б). Иерархические микросферы W–CuO собраны с помощью шиповидных наностержней (рис. 2д). Изображения ТГА с высоким разрешением (ВРТГА) показывают, что случайно ориентированные нанокристаллы H-CuO имеют размер ≈7-10 нм (рис. 2е). В отличие от зернистой структуры H–CuO, W–CuO демонстрирует пластинчатую структуру, обычно наблюдаемую в некоторых 2D-материалах, таких как графен или MoS2 (рис. 2ж). Расстояние между решетками на изображениях ВРТГА составляет ≈0,25 нм, что соответствует плоскости (002) кристаллической фазы CuO.
2ж). Расстояние между решетками на изображениях ВРТГА составляет ≈0,25 нм, что соответствует плоскости (002) кристаллической фазы CuO.
Рис. 2 ТГА–изображения. a. H–CuO 500 нм; b. W–CuO 500 нм; c. H-CuO 100 нм; d. W–CuO100 нм; e. ПЭМ-изображения с высоким разрешением H-CuO 5 нм; f. W–CuO 5 нм
Рентгенограммы CuO, полученные на порошковом рентгеновском дифрактометре XR3500, показаны на рис. 3. Дифракционные пики могут быть отнесены к моноклинной структуре CuO (запись № 80-1916 базы данных порошковых дифракционных картин от Международного центра дифракционных данных ICDD, поставляемых с дифрактометром XR3500). Никаких характерных пиков возможных примесей, таких как Cu(OH)2 или Cu2O, не появляется, что указывает на чистоту фаз W–CuO и H–CuO.
Рис. 3 Рентгенограммы H–CuO и W–CuO, полученные на XR3500
Полные спектры РФЭС от 0 до 1000 эВ показаны на рис. 4а. Увеличение фона РФЭС можно объяснить рассеянием фотоэлектронов от ионов Cu во время переноса фотоэлектронов на поверхность CuO. Спектры Cu 2p используются для определения степени окисления Cu. Четко видны основные пики Cu 2p3/2 и Cu 2p1/2, а также соседние пики. CuO и Cu2O являются двумя полупроводниковыми фазами CuO. Наличие соседних пиков указывает на образование CuO. Однако пик Cu 2p3/2, который может быть интегрирован из любой комбинации пика Cu2O, Cu или CuO, трудно интерпретировать, поскольку Cu и Cu2O имеют почти одинаковые энергии связи. В этой ситуации пик оже-перехода LMM-2 в спектрах РФЭС, а именно 568 эВ для Cu и 570 эВ для Cu2O, обычно используется в качестве убедительного доказательства их присутствия. Мы обнаружили, что в этой области не появляется ни одного пика, что указывает на единственное существование CuO. Следовательно, согласно исследованию РФЭС Cu 2p, степень окисления Cu составляет + 2, и CuO подтверждается в качестве конечного продукта.
Спектры Cu 2p используются для определения степени окисления Cu. Четко видны основные пики Cu 2p3/2 и Cu 2p1/2, а также соседние пики. CuO и Cu2O являются двумя полупроводниковыми фазами CuO. Наличие соседних пиков указывает на образование CuO. Однако пик Cu 2p3/2, который может быть интегрирован из любой комбинации пика Cu2O, Cu или CuO, трудно интерпретировать, поскольку Cu и Cu2O имеют почти одинаковые энергии связи. В этой ситуации пик оже-перехода LMM-2 в спектрах РФЭС, а именно 568 эВ для Cu и 570 эВ для Cu2O, обычно используется в качестве убедительного доказательства их присутствия. Мы обнаружили, что в этой области не появляется ни одного пика, что указывает на единственное существование CuO. Следовательно, согласно исследованию РФЭС Cu 2p, степень окисления Cu составляет + 2, и CuO подтверждается в качестве конечного продукта.
Рис. 4. РФА спектры образцов. a. Полный даиапазон РФА; b Рентгеновские спектры Cu 2p уровня; c Рентгеновский спектр O 1s уровня W–CuO; d Рентгеновский спектр O 1s уровня H–CuO
Спектры O 1s используются для определения поверхностного состава CuO . Пик O 1s может быть разложен на три значимых составляющих пика, которые помечены как I, II и III. Пик I может быть отнесен к кислороду из кристаллического оксида. Пики II и III возникают из поверхностных химических соединений, содержащих атомы кислорода. В частности, пик II связан с атомами кислорода в гидроксильных и карбонатных группах, тогда как пик III соответствует поглощенной поверхности вода. Сравнение интегрированной площади пика I с суммой интегрированных площадей показывает, что процентное содержание кислорода в решеточном оксиде составляет 33,6 и 45,8% для W–CuO и H–CuO, соответственно, что указывает на то, что W–CuO имеет больше поверхностных соединений, таких как гидроксильная группа и адсорбированная вода, чем H–CuO.
Пик O 1s может быть разложен на три значимых составляющих пика, которые помечены как I, II и III. Пик I может быть отнесен к кислороду из кристаллического оксида. Пики II и III возникают из поверхностных химических соединений, содержащих атомы кислорода. В частности, пик II связан с атомами кислорода в гидроксильных и карбонатных группах, тогда как пик III соответствует поглощенной поверхности вода. Сравнение интегрированной площади пика I с суммой интегрированных площадей показывает, что процентное содержание кислорода в решеточном оксиде составляет 33,6 и 45,8% для W–CuO и H–CuO, соответственно, что указывает на то, что W–CuO имеет больше поверхностных соединений, таких как гидроксильная группа и адсорбированная вода, чем H–CuO.
Два широких пика в производной термогравиметрии (ДТГ) кривая четко показывает две стадии процесса нагрева от температуры окружающей среды до 500°C (рис. 5). Первая стадия связана с испарением поверхностно-адсорбированной воды, а вторая стадия – с потерей гидроксильных и карбонатных групп. Кривые ТГА показывают, что конечные оставшиеся весовые проценты W–CuO и H–CuO составляют ≈87,13 и 95,57% соответственно. Возможная причина связана с иерархической сферической микроструктурой, благодаря которой W–CuO обладает большей площадью поверхности и, следовательно, имеет больше центров адсорбции, чем H–CuO. Кривая ТГА–ДТГ почти достигает плато при температуре более 350 ° C, что указывает на то, что как W–CuO, так и H–CuO претерпевают незначительную потерю веса в этом температурном диапазоне.
Кривые ТГА показывают, что конечные оставшиеся весовые проценты W–CuO и H–CuO составляют ≈87,13 и 95,57% соответственно. Возможная причина связана с иерархической сферической микроструктурой, благодаря которой W–CuO обладает большей площадью поверхности и, следовательно, имеет больше центров адсорбции, чем H–CuO. Кривая ТГА–ДТГ почти достигает плато при температуре более 350 ° C, что указывает на то, что как W–CuO, так и H–CuO претерпевают незначительную потерю веса в этом температурном диапазоне.
Рис. 5 Кривые ДТГ-ТГА для H–CuO и W–CuO
Метод адсорбции/десорбции азота был использован для дальнейшего исследования площади поверхности и пористости W–CuO. Профиль изотермы показан на рис. 6. Изотерма представляет собой типичную кривую IV типа. Количество адсорбированного N2 увеличивается с увеличением давления, что указывает на пористую структуру W–CuO. Расчетная удельная площадь поверхности W–CuO (25,0 м2/г) намного выше, чем у H–CuO (18,0 м2/г) и коммерческой CuO (0,1 м2/г).
Рис. 6 Изотермическая кривая адсорбции–десорбции N2 для W–CuO
Для исследования свойств переноса заряда микросфер была проведена электрохимическая импедансная спектроскопия. График Найквиста, который показывает полукруг в высокочастотной области и линию в низкочастотной области (показан на рис. 7).
Рис. 7 Графики импеданса Найквиста для электродов H–CuO и W–CuO
Полукруг может быть отнесен к кинетическому (переносу заряда) контролируемому процессу на границе раздела электрод–электролит, в то время как линия указывает на контролируемый процесс массопереноса на электроде– граница раздела. Оба графика имеют крутую линию в области низкой частоты, указывающая на то, что диффузия электролита происходит довольно быстро внутри этих двух оксидов. Тем не менее, W–CuO обладает меньшим полукругом, чем H–CuO, что позволяет предположить, что W–CuO обладает меньшим сопротивлением переносу заряда, чем H–CuO. Малое сопротивление переносу заряда W–CuO связано с пластинчатыми микроструктурами, которые могут гарантировать большую площадь электроактивной поверхности для значительной диффузии заряда.
Заключение
Иерархические микросферы CuO (W–CuO) могут быть получены простым, безопасным, быстрым и недорогим микроволновым способом при атмосферном давлении. W–CuO структуры демонстрируют относительно узкое распределение по размерам по сравнению с H–CuO, полученным обычным методом химического осаждения. Благодаря ламелеобразным наноразмерным блокам микросферы W-CuO имеет более высокую площадь поверхности и, следовательно, демонстрирует лучшие характеристики переноса заряда в качестве электрода, чем H–CuO. Будущие исследования могут быть сосредоточены на применении W–CuO, а также синтезе других типов оксидов металлов.
Источник
Опубликовано в Micro & Nano Letters, 13 декабря 2018 года.
Автор Цзивэй Ли, Вэй Ли.
Факультет материаловедения, Тайваньский технологический университет, Тайвань.
Micro_&_Nano_Letters_2019_jun_26_vol_14_iss_7_Li,_Jiwei_Li,_Wei
Mathway | Популярные задачи
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | ||
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Всё об оксиде двухвалентной меди, взаимодействие CuO и NaOH, формулы и уравнения реакций
Оксиды — широко распространённый в природе тип соединений, который можно наблюдать даже в повседневной жизни, в быту. Примером могут служить песок, вода, ржавчина, известь, углекислый газ, ряд природных красителей. Руда многих ценных металлов по своей природе является оксидом, вследствие чего представляет большой интерес для научных и производственных исследований.
Примером могут служить песок, вода, ржавчина, известь, углекислый газ, ряд природных красителей. Руда многих ценных металлов по своей природе является оксидом, вследствие чего представляет большой интерес для научных и производственных исследований.
Соединение химических элементов с кислородом называют оксидами. Как правило, образуются они при накаливании каких-либо веществ на воздухе. Различают кислотные и основные оксиды. Металлы образуют основные оксиды, в то время как неметаллы — кислотные. За исключением оксидов хрома и марганца, которые также являются кислотными. В данной статье рассматривается представитель основных оксидов — CuO (II).
Содержание:
- CuO (II)
- Химическая формула: CuO
- Реакция CuO NaOH
- Видео
CuO (II)
Медь, нагреваясь на воздухе при температуре 400–500 °C, постепенно покрывается налётом чёрного цвета, который химики называют оксид двухвалентной меди, или CuO(II). Описанное явление представлено в следующем уравнении:
2 Cu + О 2 → 2 CuO
Термин «двухвалентный» указывает на способность атома вступать в реакцию взаимодействия с другими элементами посредством двух химических связей.
Интересный факт! Медь, находясь в различных соединениях, может быть с разной валентностью и другим цветом. Например: оксиды меди имеют ярко-красную (Cu2O) и коричнево-чёрную (CuO) окраску. А гидроксиды меди приобретают жёлтый (CuOH) и синий (Cu(OH)2) цвета. Классический пример явления, когда количество переходит в качество.
Cu2O ещё иногда называют закись, оксид меди (I), а CuO — окись, оксид меди (II). Существует также оксид меди (III) — Cu2O3.
В геологии оксид двухвалентной (или бивалентной) меди принято называть тенорит, другое его название — мелаконит. Название тенорит произошло от фамилии выдающегося итальянского профессора ботаники Michele Tenore, (1780—1861). Мелаконит считается синонимом названия тенорит и переводится на русский язык, как медная чернь либо чёрная медная руда. В том или ином случае речь идёт о кристаллическом минерале коричнево-чёрного цвета, разлагающемся при прокаливании и плавящемся только при избыточном давлении кислорода, в воде нерастворимом, и не реагирующем с ней.
Акцентируем основные параметры названного минерала.
Химическая формула: CuO
Молекула его состоит из атома Cu с молекулярной массой 64 а. е. м. и атома O, молекулярная масса 16 а. е. м., где а. е. м. — атомная единица массы, она же дальтон, 1 а. е. м. = 1,660 540 2(10) × 10−27 кг = 1,660 540 2(10) × 10–24 г. Соответственно молекулярная масса соединения равняется: 64 + 16 = 80 а. е. м.
Кристаллическая решётка: моноклинная сингония. Что обозначает такой тип осей симметрии кристалла, когда две оси пересекаются под косым углом и имеют различную длину, а третья ось расположена по отношению к ним под углом 90°.
Плотность – 6,51 г/см3. Для сопоставления, плотность чистого золота равна 19,32 г/см³, а плотность поваренной соли составляет 2,16 г /см 3.
Плавится при температуре 1447 °C, под давлением кислорода.
Разлагается при накаливании до 1100 °C и преобразуется в оксид меди (I):
4CuO = 2Cu2O + O 2.
С водой не реагирует и не растворяется в ней.
Зато вступает в реакцию с водным раствором аммиака, с образованием гидроксида тетраамминмеди (II): CuO + 4Nh4 + h3O = [Cu (Nh4)4](OH) 2.
В кислотной среде образует сульфат и воду: CuO + h3SO4 = CuSO4 + h3O.
Реагируя со щёлочью, создаёт купрат: CuO + 2 NaOH → Na2CuO2 + h3O.
Реакция CuO NaOH
Образуется:
- путём прокаливания гидроксида меди (II) при температуре 200 °C: Cu(OH)2 = CuO + h3O;
- при окислении металлической меди на воздухе при температуре 400–500 °C: 2Cu + O2 = 2CuO;
- при высокотемпературной обработке малахита: (CuOH)₂CO₃ —> 2CuO + CO₂ + H₂O.
Восстанавливается до металлической меди —
- в реакции с водородом: CuO + h3 = Cu + h3O;
- с угарным газом (монооксид углерода): CuO + CO = Cu + CO2;
- с активным металлом: CuO + Mg = Cu + MgO.
Токсичен. По степени неблагоприятного воздействия на человеческий организм причисляется к веществам второго класса опасности. Вызывает раздражение слизистых оболочек глаз, кожных покровов, дыхательных путей и желудочно-кишечной системы. При взаимодействии с ним обязательно использование таких средств защиты, как резиновые перчатки, респираторы, защитные очки, спецодежду.
По степени неблагоприятного воздействия на человеческий организм причисляется к веществам второго класса опасности. Вызывает раздражение слизистых оболочек глаз, кожных покровов, дыхательных путей и желудочно-кишечной системы. При взаимодействии с ним обязательно использование таких средств защиты, как резиновые перчатки, респираторы, защитные очки, спецодежду.
Вещество взрывоопасно и легко воспламеняется.
Применяется в промышленности, как минеральная составляющая комбикормов, в пиротехнике, при получении катализаторов химических реакций, как красящий пигмент для стекла, эмалей, керамики.
Окислительные свойства оксида меди (II) наиболее часто применяются в лабораторных исследованиях, когда необходим элементарный анализ, связанный с изучением органических материалов на предмет наличия в них водорода и углерода.
Немаловажно, что CuO (II) достаточно широко распространён в природе, как минерал тенерит, другими словами — это природное соединение руды, из которого можно получить медь.
Латинское наименование Cuprum и соответствующий ему символ Cu происходит от названия острова Кипр. Именно оттуда, через Средиземное море вывозили этот ценный металл древние римляне и греки.
Медь входит в число семи наиболее распространённых в мире металлов и состоит на службе у человека с древних времён. Однако в первозданном, металлическом состоянии встречается довольно редко. Это мягкий, легко поддающийся обработке металл, отличающийся высокой плотностью, очень качественный проводник тока и тепла. По электрической проводимости уступает только серебру, в то время как является более дешёвым материалом. Широко используется в виде проволоки и тонкого листового проката.
Химические соединения меди отличаются повышенной биологической активностью. В животных и растительных организмах они участвуют в процессах синтеза хлорофилла, поэтому считаются очень ценным компонентом в составе минеральных удобрений.
Необходима медь и в рационе человека. Недостаток её в организме может привести к различным заболеваниям крови.
Недостаток её в организме может привести к различным заболеваниям крови.
Видео
Из видео вы узнаете, что такое оксид меди.
.
Мэтуэй | Популярные задачи
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Fe | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Fe | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
Рост in situ нанолистов Cu2O/CuO на углеродных тканях с медным покрытием в качестве бессвязующего электрода для асимметричных суперконденсаторов
Введение
Суперконденсаторы (СК), одни из наиболее перспективных устройств для хранения энергии, привлекли к себе пристальное внимание благодаря их высокой плотности мощности, высокой скорости заряда/разряда, длительному сроку службы и низкой стоимости (Lu et al. , 2014; Xiong et al., 2015; Sami et al., 2017; Dai et al., 2018). По механизму реакции СК можно разделить на конденсаторы с двойным электрическим слоем (EDLC) и псевдоконденсаторы (PC) (Wei et al., 2012). Для EDLC заряды накапливаются электростатически на границе раздела электрод/электролит, при этом обычно в качестве активных материалов используются углеродные материалы (Surendran et al., 2018). Для ПК энергия накапливается внутри электрода посредством окислительно-восстановительной реакции Фарадея, при этом в качестве электродных материалов используются оксиды / гидроксиды переходных металлов и проводящие полимеры, поэтому ПК обеспечивают гораздо более высокую плотность энергии и удельную емкость, чем EDLC. Тем не менее, есть много малопонятных проблем, которые привлекают большое количество исследователей, посвятивших себя решению, таких как неадекватная плотность энергии и емкость, плохая электрохимическая стабильность для практических приложений.
, 2014; Xiong et al., 2015; Sami et al., 2017; Dai et al., 2018). По механизму реакции СК можно разделить на конденсаторы с двойным электрическим слоем (EDLC) и псевдоконденсаторы (PC) (Wei et al., 2012). Для EDLC заряды накапливаются электростатически на границе раздела электрод/электролит, при этом обычно в качестве активных материалов используются углеродные материалы (Surendran et al., 2018). Для ПК энергия накапливается внутри электрода посредством окислительно-восстановительной реакции Фарадея, при этом в качестве электродных материалов используются оксиды / гидроксиды переходных металлов и проводящие полимеры, поэтому ПК обеспечивают гораздо более высокую плотность энергии и удельную емкость, чем EDLC. Тем не менее, есть много малопонятных проблем, которые привлекают большое количество исследователей, посвятивших себя решению, таких как неадекватная плотность энергии и емкость, плохая электрохимическая стабильность для практических приложений.
В последние годы различные оксиды/гидроксиды переходных металлов, такие как RuO 2 (Wang et al. , 2014), NiO (Ouyang et al., 2019), Ni(OH) 2 (Kim et al. , 2017), MnO 2 (Huang et al., 2015), Co 3 O 4 (Liu T. et al., 2018), Co(OH) 2 (Yang et al., 2018). ), V 2 O 5 (Foo et al., 2014), CuO (Bu, Huang, 2017; Li et al., 2017; Liu Y. et al., 2018), Cu 2 O ( Zhang W. et al., 2016; Ji et al., 2017), были применены для достижения превосходных емкостных характеристик для ПК. Среди этих материалов CuO, Cu 2 O или Cu 2 O/CuO наноструктуры с различной конфигурацией, включая наноиглы, наноцветы, нанопроволоки (Dong et al., 2014; Wang et al., 2015; Chen et al., 2016; Xu et al., 2016; Yang et al., 2016), вызывают значительный интерес благодаря своей экологичности, большому резерву, дешевизне, химической стабильности и отличным электрохимическим свойствам [теоретическая емкость CuO до 1800 Ф·г·–1· (Liu Y. et al., 2018) и Cu 2 O до 2,247 F g -1 (Wu et al.
, 2014), NiO (Ouyang et al., 2019), Ni(OH) 2 (Kim et al. , 2017), MnO 2 (Huang et al., 2015), Co 3 O 4 (Liu T. et al., 2018), Co(OH) 2 (Yang et al., 2018). ), V 2 O 5 (Foo et al., 2014), CuO (Bu, Huang, 2017; Li et al., 2017; Liu Y. et al., 2018), Cu 2 O ( Zhang W. et al., 2016; Ji et al., 2017), были применены для достижения превосходных емкостных характеристик для ПК. Среди этих материалов CuO, Cu 2 O или Cu 2 O/CuO наноструктуры с различной конфигурацией, включая наноиглы, наноцветы, нанопроволоки (Dong et al., 2014; Wang et al., 2015; Chen et al., 2016; Xu et al., 2016; Yang et al., 2016), вызывают значительный интерес благодаря своей экологичности, большому резерву, дешевизне, химической стабильности и отличным электрохимическим свойствам [теоретическая емкость CuO до 1800 Ф·г·–1· (Liu Y. et al., 2018) и Cu 2 O до 2,247 F g -1 (Wu et al.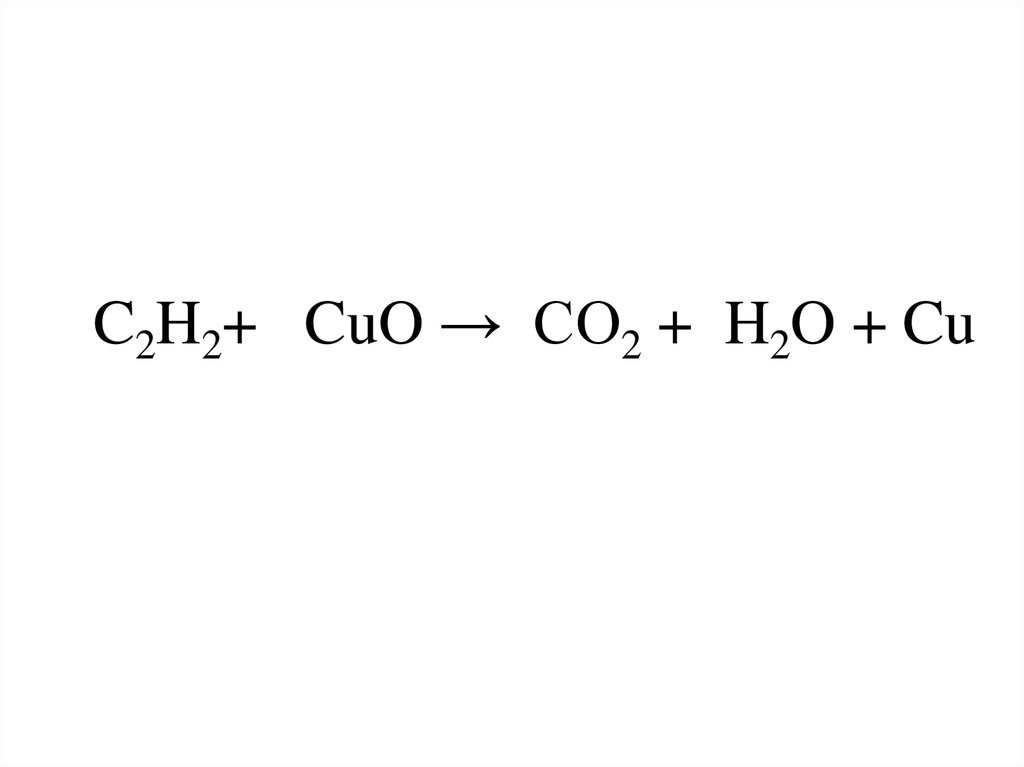 , 2017)]. Однако большинство оксидов/гидроксидов металлов обладают плохой электропроводностью, что затрудняет достижение высокой удельной емкости (Xu et al., 2016). Чтобы решить эту проблему, оксиды/гидроксиды обычно смешивают с вспомогательной сажей или связующим, а затем связывают с токосъемником, что приводит к значительному снижению общей удельной емкости (Yuan et al., 2017). Эффективный подход заключается в том, что наноструктурированные электродные материалы растут непосредственно на токосъемниках, образуя электроды без связующего, что обеспечивает более высокую плотность энергии (Dong et al., 2014).
, 2017)]. Однако большинство оксидов/гидроксидов металлов обладают плохой электропроводностью, что затрудняет достижение высокой удельной емкости (Xu et al., 2016). Чтобы решить эту проблему, оксиды/гидроксиды обычно смешивают с вспомогательной сажей или связующим, а затем связывают с токосъемником, что приводит к значительному снижению общей удельной емкости (Yuan et al., 2017). Эффективный подход заключается в том, что наноструктурированные электродные материалы растут непосредственно на токосъемниках, образуя электроды без связующего, что обеспечивает более высокую плотность энергии (Dong et al., 2014).
Углеродный материал, содержащий углеродные нанотрубки, графен и углеродное волокно, является одним из предпочтительных токосъемников из-за их превосходной электропроводности и электрохимической стабильности (Prasad et al., 2011; Moosavifard et al., 2014; Bu and Huang, 2017). . Среди различных углеродных материалов углеродные ткани (CC) с низкой стоимостью, химической стабильностью и желаемой проводимостью считаются новыми углеродными материалами, которые состоят из множества однородных углеродных волокон с трехмерной (3D) структурой (Guo et al. , 2014; Чжан Ю. и др., 2016). Трехмерная сетчатая структура способствует сокращению пути диффузии ионов и ускорению потока ионов во время электрохимического процесса. Разработаны многочисленные электродные материалы ФК, использующие КС в качестве токосъемников, такие как NiCo-LDH@NiOOH (622 F g -1 при 1 А г -1 ) (Liang et al., 2018), MnNiCoO 4 @MnO 2 (1931 F g -1 при 0,8 А г -1 9093) (Saray) и Hosseini, 2016), массивы нанолистов MnO 2 (2,16 F см -2 , при 5 мА см -2 ) (Guo et al., 2014). В настоящее время оксид меди и его композиционные материалы в основном выращивают на медной пене и медной фольге (Zhang et al., 2015; Singh and Sarkar, 2017), а комбинация CuO или Cu 2 O с УЦ также находится в разработке. ситуация. Например, Сюй и др. (2016) изготовили массивы наноцветков CuO на КС, плотность энергии и удельная мощность 10,05 Втч·кг -1 и 1798,5 Вт·кг -1 соответственно.
, 2014; Чжан Ю. и др., 2016). Трехмерная сетчатая структура способствует сокращению пути диффузии ионов и ускорению потока ионов во время электрохимического процесса. Разработаны многочисленные электродные материалы ФК, использующие КС в качестве токосъемников, такие как NiCo-LDH@NiOOH (622 F g -1 при 1 А г -1 ) (Liang et al., 2018), MnNiCoO 4 @MnO 2 (1931 F g -1 при 0,8 А г -1 9093) (Saray) и Hosseini, 2016), массивы нанолистов MnO 2 (2,16 F см -2 , при 5 мА см -2 ) (Guo et al., 2014). В настоящее время оксид меди и его композиционные материалы в основном выращивают на медной пене и медной фольге (Zhang et al., 2015; Singh and Sarkar, 2017), а комбинация CuO или Cu 2 O с УЦ также находится в разработке. ситуация. Например, Сюй и др. (2016) изготовили массивы наноцветков CuO на КС, плотность энергии и удельная мощность 10,05 Втч·кг -1 и 1798,5 Вт·кг -1 соответственно. Ван и др. (2017) разработали лесоподобный оксид меди / медь с плотностью энергии 24,0 Втч · кг -1 при 0,625 кВт · кг -1 . Тем не менее, по-прежнему сложно разработать коммерчески жизнеспособные оксиды/гидроксиды Cu с высокой плотностью энергии/мощности, удельной емкостью и превосходной стабильностью при циклировании (Dong et al., 2014). Поэтому будет целесообразно провести тщательное исследование электродов CuO или Cu2O, выращенных на СС.
Ван и др. (2017) разработали лесоподобный оксид меди / медь с плотностью энергии 24,0 Втч · кг -1 при 0,625 кВт · кг -1 . Тем не менее, по-прежнему сложно разработать коммерчески жизнеспособные оксиды/гидроксиды Cu с высокой плотностью энергии/мощности, удельной емкостью и превосходной стабильностью при циклировании (Dong et al., 2014). Поэтому будет целесообразно провести тщательное исследование электродов CuO или Cu2O, выращенных на СС.
Для улучшения кинетических и электрохимических характеристик электродов обычно используются два типичных метода. Одним из простых подходов является увеличение удельной площади поверхности электродов, чтобы обеспечить больше активных участков для фарадеевской окислительно-восстановительной реакции (Daoping et al., 2014). Другой метод заключается в улучшении проводимости материала электрода для ускорения электронной проводимости (Lu et al., 2013). Здесь мы впервые синтезировали нанолисты Cu 2 O/CuO, выращенные непосредственно на CC, которые покрыты пленкой Cu, с помощью простой стратегии с химическим меднением, химическим травлением и термической дегидратацией. Однородная медная пленка на ткани из углеродного микроволокна обладает высокой связующей силой. Кроме того, Cu 2 Нанолисты O/CuO in situ , выращенные на CC, обеспечивают достаточные активные центры для электроники заряда/разряда, что важно для накопления энергии суперконденсатора. Наконец, стоит отметить, что после химического травления все еще остаются пленки Cu между CC и нанолистами Cu 2 O/CuO, что важно для обеспечения электронной проводимости.
Однородная медная пленка на ткани из углеродного микроволокна обладает высокой связующей силой. Кроме того, Cu 2 Нанолисты O/CuO in situ , выращенные на CC, обеспечивают достаточные активные центры для электроники заряда/разряда, что важно для накопления энергии суперконденсатора. Наконец, стоит отметить, что после химического травления все еще остаются пленки Cu между CC и нанолистами Cu 2 O/CuO, что важно для обеспечения электронной проводимости.
Экспериментальный
Синтез материалов
CC (WOS1002) были приобретены у CeTech. (НХ 4 ) 2 S 2 O 8 (Tianjin Huachen Company) и все остальные реагенты (от Aladdin) были аналитической чистоты без дополнительной обработки. В типичном процессе химического меднения КК, нарезанные на квадраты (25×25 мм), сначала нагревали до 400°С со скоростью нагрева 10°С мин -1 и выдерживали 30 мин в муфельной печи на воздухе. атмосферу для удаления части примесей. Затем КК погружали в концентрированную азотную кислоту для придания поверхности шероховатости с последующей сенсибилизирующей и активирующей обработкой. Растворы хлорида двухвалентного олова/соляной кислоты и нитрата серебра/гидроксида аммония использовались в качестве сенсибилизатора и активатора соответственно (Yuan et al., 2017). Состав сенсибилизирующего и активирующего раствора показан в дополнительных таблицах 1, 2. Сенсибилизирующая и активирующая обработка адсорбирует слой активных частиц серебра на поверхности углеродной ткани в качестве частиц активного металла, а ионы меди сначала восстанавливаются на активном металлические частицы, так что реакция восстановления меди протекает на поверхности углеродной ткани. Катализированные КЦ с рядом активных центров были получены в NaOH (10%) в течение 3 мин. Затем катализированные КК погружали в гальванические растворы и перемешивали при скорости вращения 200 об/мин -1 в течение 60 мин при 25°C, в течение которых пленки Cu наносили на СС, получая таким образом образцы Cu-CC.
Затем КК погружали в концентрированную азотную кислоту для придания поверхности шероховатости с последующей сенсибилизирующей и активирующей обработкой. Растворы хлорида двухвалентного олова/соляной кислоты и нитрата серебра/гидроксида аммония использовались в качестве сенсибилизатора и активатора соответственно (Yuan et al., 2017). Состав сенсибилизирующего и активирующего раствора показан в дополнительных таблицах 1, 2. Сенсибилизирующая и активирующая обработка адсорбирует слой активных частиц серебра на поверхности углеродной ткани в качестве частиц активного металла, а ионы меди сначала восстанавливаются на активном металлические частицы, так что реакция восстановления меди протекает на поверхности углеродной ткани. Катализированные КЦ с рядом активных центров были получены в NaOH (10%) в течение 3 мин. Затем катализированные КК погружали в гальванические растворы и перемешивали при скорости вращения 200 об/мин -1 в течение 60 мин при 25°C, в течение которых пленки Cu наносили на СС, получая таким образом образцы Cu-CC. Количество оставшейся меди составляет около 0,009 г см -2 на углеродной ткани. Состав раствора для химического меднения показан в дополнительной таблице 3. Формальдегид используется в качестве восстановителя, а основные химические реакции в растворах для химического меднения следующие:
Количество оставшейся меди составляет около 0,009 г см -2 на углеродной ткани. Состав раствора для химического меднения показан в дополнительной таблице 3. Формальдегид используется в качестве восстановителя, а основные химические реакции в растворах для химического меднения следующие:
Cu2++2HCHO+4OH-→Cu+2HCOO -+h3↑+h3O2Cu2++HCHO+5OH-→Cu2O+HCOO-+ 3h3OCu2O+2HCHO+2OH-→2Cu+2HCOO-+h3↑+h3O
В процессе химического травления Cu-CC погружали в 100 мл смешанных растворов с 2,5 моль L -1 NaOH и 0,1 моль L -1 (NH 4 ) 2 S 2 2 8 при 25°C в течение некоторого времени, массивы Cu(OH) 2 были in situ , выращенными на Cu-CC. После промывки массивы Cu(OH) 2 разлагали на массивы Cu 2 O/CuO путем термической дегидратации при 120°C на воздухе в течение 3 ч с получением Cu 2 9Электроды 0916 O/CuO@Cu-CCs.
Характеристика материалов и электрохимические измерения
Фазовый состав продуктов определяли с помощью рентгеноструктурного анализа (XRD, дифрактометр Rigaku-Dmax 2500). Микроструктуру и морфологию наблюдали с помощью сканирующей электронной микроскопии (SEM, HITACHI S4800) и просвечивающей электронной микроскопии высокого разрешения (HRTEM, Tecnai G2 F20 STWIN, FEI, США). Рентгеновскую фотоэлектронную спектроскопию (XPS, Kratos Axis Ultra DLD, Великобритания) проводили с использованием Mg Ka в качестве источника возбуждения.
Микроструктуру и морфологию наблюдали с помощью сканирующей электронной микроскопии (SEM, HITACHI S4800) и просвечивающей электронной микроскопии высокого разрешения (HRTEM, Tecnai G2 F20 STWIN, FEI, США). Рентгеновскую фотоэлектронную спектроскопию (XPS, Kratos Axis Ultra DLD, Великобритания) проводили с использованием Mg Ka в качестве источника возбуждения.
Испытания электродов Cu 2 O/CuO@Cu-CCs методом циклической вольтамперометрии (CV) и гальваностатического заряда-разряда (GCD) были испытаны на электрохимической рабочей станции CHI 660E (Shanghai Chenhua Instrument Company, Китай) в трехэлектродной электрохимическая ячейка с использованием 6 М водного раствора КОН в качестве электролита при комнатной температуре. Электроды Cu 2 O/CuO@Cu-CCs использовались в качестве рабочего электрода, а платиновая проволока и электрод Ag/AgCl в качестве противоэлектрода и электрода сравнения соответственно. Электрохимическую импедансную спектроскопию (ЭИС) проводили в диапазоне частот от 106 до 0,01 Гц. Удельные емкости были рассчитаны из разрядной части кривых НОД с использованием следующего уравнения.
Удельные емкости были рассчитаны из разрядной части кривых НОД с использованием следующего уравнения.
C=(I∫Vdt)/(SV2) (1)
где C представляет собой удельную емкость (Ф см −2 ), I представляет ток разряда (А), Δ t общее время разряда (с), S — площадь образца (см 2 ), Δ V — изменение потенциала (В) за время разряда Δ t .
Изготовление и электрохимические измерения асимметричного суперконденсатора
Активированный уголь, ацетиленовая сажа и политетрафторэтилен (ПТФЭ) в массовом соотношении 80:10:10 смешивали с умеренным количеством этанола. Полученную смесь наносили кистью на углеродную ткань и сушили при 80°С в течение 10 ч в вакуумной печи. Ацетиленовая сажа и ПТФЭ действуют как проводящие агенты и связующие соответственно. Устройство асимметричного суперконденсатора (ASC) было собрано с использованием Cu 2 Электрод O/CuO@Cu-CCs (диаметром 1 см) и электрод из активированного угля в качестве положительного и отрицательного электрода соответственно. В качестве разделителей использовали фильтровальную бумагу, пропитанную 6 М раствором КОН. В качестве асимметричного суперконденсатора с электрохимическими свойствами заряд, хранящийся между двумя электродами, должен поддерживать соотношение баланса (q + = q — ), которое можно рассчитать по уравнению (Liu Y. et al., 2018).
В качестве разделителей использовали фильтровальную бумагу, пропитанную 6 М раствором КОН. В качестве асимметричного суперконденсатора с электрохимическими свойствами заряд, хранящийся между двумя электродами, должен поддерживать соотношение баланса (q + = q — ), которое можно рассчитать по уравнению (Liu Y. et al., 2018).
q=C•m•ΔV (2)
, где C представляет собой удельную емкость (F g -1 ), m представляет собой массу активных материалов на обоих электродах (г), Δ В представляет собой окно потенциала (В). Следовательно, массовое соотношение электроактивного материала между двумя электродами можно рассчитать по уравнению (Li et al., 2019).
m+/m-=C-ΔV-/C+ΔV+ (3)
где C − (F g −1 ) и Δ V − – удельная емкость (acV) и диапазон напряжений сканирующего сегмента электрода переменного тока соответственно. C + (F g −1 ) и Δ V + (В) – удельная емкость и диапазон напряжений сканирующего сегмента Cu 2 O/CuO@Cu-CCs электрода . Удельная емкость, плотность энергии и удельная мощность устройства САУ были рассчитаны с использованием следующих уравнений (Ensafi et al., 2018; Liu Y. et al., 2018).
C + (F g −1 ) и Δ V + (В) – удельная емкость и диапазон напряжений сканирующего сегмента Cu 2 O/CuO@Cu-CCs электрода . Удельная емкость, плотность энергии и удельная мощность устройства САУ были рассчитаны с использованием следующих уравнений (Ensafi et al., 2018; Liu Y. et al., 2018).
Cs=(2I∫Vdt)/(мВ2) (4)
E=1/2CΔV2 (5)
P=E/Δt (6)
, где Cs представляет собой удельную емкость (F g −1 ), I представляет собой ток разряда (А), Δ В представляет собой окно потенциала (В), Δt представляет собой время разряда (с), m представляет собой массу активных материалов на обоих электродах (г), E и P соответствуют плотности энергии (Втч·кг −1 ) и плотности мощности (Вт·кг −1 ) соответственно (Guan et al., 2017). ).
Результаты и обсуждение
Схематическое изображение процесса роста Cu 2 O/CuO@Cu-CC электроды показаны на рисунке 1. Во-первых, медная пленка равномерно покрывается на СС путем химического меднения, образуя образцы Cu-CC. Затем массивы нанолистов Cu(OH) 2 выращены in situ на пленке Cu путем щелочного окислительного окрашивания в NaOH и S 2 O82- прикрепляется к поверхности Cu-CC, и частично CuO окисляется до Cu 2+ (Chen et al., 2016). При реакции Cu 2+ и OH − образуются массивы нанолистов Cu(OH) 2 , которые затем путем термической дегидратации разлагаются на нанолисты Cu 2 O/CuO с получением Cu 2 O /CuO@Cu-CCs электроды
Во-первых, медная пленка равномерно покрывается на СС путем химического меднения, образуя образцы Cu-CC. Затем массивы нанолистов Cu(OH) 2 выращены in situ на пленке Cu путем щелочного окислительного окрашивания в NaOH и S 2 O82- прикрепляется к поверхности Cu-CC, и частично CuO окисляется до Cu 2+ (Chen et al., 2016). При реакции Cu 2+ и OH − образуются массивы нанолистов Cu(OH) 2 , которые затем путем термической дегидратации разлагаются на нанолисты Cu 2 O/CuO с получением Cu 2 O /CuO@Cu-CCs электроды
Рентгенограммы CC, Cu-CC и Cu 2 O/CuO@Cu-CC показаны на рисунке 2a. Как видно из сравнения пиков КК и Cu-КК, пленки Cu на КК приводят к уменьшению характерных пиков углеродного волокна при 2θ = 26,4°. Для образцов Cu-CC имеются два сильных дифракционных пика при 2θ = 43,5 и 50,6°, соответствующих плоскостям (111) и (200) металлической меди (JCPDS № 04-0836) соответственно (Chen et al. , 2016). После термообработки при 120°C образец имеет четыре пика при 2θ 35,6, 36,4, 39.1, 42,3°, в которых 2θ = 35,6 и 39,1° соответствуют плоскостям (-111) и (200) подложек CuO (JCPDS № 48-1548), а два других пика (2θ = 36,4 и 42,3° ) относятся к отражениям (111) и (200) Cu 2 O (JCPDS № 05-0667). Стоит отметить, что пики Cu и CCs все еще наблюдаются, следовательно, подтвержден состав Cu 2 O/CuO@Cu-CCs.
, 2016). После термообработки при 120°C образец имеет четыре пика при 2θ 35,6, 36,4, 39.1, 42,3°, в которых 2θ = 35,6 и 39,1° соответствуют плоскостям (-111) и (200) подложек CuO (JCPDS № 48-1548), а два других пика (2θ = 36,4 и 42,3° ) относятся к отражениям (111) и (200) Cu 2 O (JCPDS № 05-0667). Стоит отметить, что пики Cu и CCs все еще наблюдаются, следовательно, подтвержден состав Cu 2 O/CuO@Cu-CCs.
Рисунок 1 . Схематическое изображение процесса роста Cu 2 нанолистов O/CuO на углеродной ткани с медным покрытием для изготовления электродов Cu 2 O/CuO@Cu-CCs.
Рис. 2. (a) Рентгеновские дифрактограммы образцов «голых» КК, Cu-КК и Cu 2 O/CuO@Cu-КК. СЭМ-изображения образцов (b) CC, (c) Cu-CC и (d) Cu 2 O/CuO@Cu-CCs. (e) ПЭМ-изображение и (f) HRTEM-изображение нанолистов Cu 2 O/CuO.
На рис. 2b показано СЭМ-изображение голых СС, видно, что поверхность углеродных волокон гладкая, а диаметр составляет около 8–10 мкм. На рис. 2с углеродные волокна равномерно покрыты медными пленками. После травления в щелочном растворе морфология Cu 2 Нанолисты O / CuO меняются в зависимости от времени травления (дополнительный рисунок 1). При времени травления 25 минут образец демонстрирует высокопористую сшитую структуру с большим количеством тонких нанолистов Cu 2 O/CuO (рис. 2d). Ламеллярные нанолисты могут эффективно увеличивать количество активных центров, что может способствовать переносу заряда и окислительно-восстановительной реакции (Liu Y. et al., 2018). Как показано на рисунке 2e, пористые нанолисты Cu 2 O/CuO являются ультратонкими, что может увеличить удельную площадь поверхности для ускорения интеркаляции и деинтеркаляции ионов (Chen et al., 2016). Кроме того, изображение HRTEM на рисунке 2f показывает, что измеренное межплоскостное расстояние 0,250 и 0,226 нм для четко определенных полос решетки хорошо согласуется с плоскостью (-111) и (200) CuO (JCPDS № 48-1548). ), и есть часть межплоскостных расстояний, рассчитанная в 0,214 нм, которая может быть направлена как плоскость (200) Cu 2 O (JCPDS № 05-0667)
), и есть часть межплоскостных расстояний, рассчитанная в 0,214 нм, которая может быть направлена как плоскость (200) Cu 2 O (JCPDS № 05-0667)
РФЭС-спектры поверхностного атомного состава и химического состояния образцов Cu 2 O/CuO@Cu-CCs получены путем аппроксимации кривой Гаусса. Как показано на рисунке 3А, полный спектр указывает на присутствие в образце элементов C, Cu и O. Как показано на рисунке 3B, имеются два острых пика, расположенные при 932,43 и 952,5 эВ, которые соответствуют Cu 2p3/2 и Cu 2p1/2 соответственно, что иллюстрирует сосуществование Cu + и Cu 0 видов (Wan et al., 2017). В то же время наличие трех сателлитных пиков с энергиями связи 934,2, 943,1 и 953,9 эВ свидетельствует о наличии в образцах CuO. Следовательно, можно сделать вывод, что медь представлена в основном Cu 2+ , Cu + и Cu 0 (Liu Y. et al., 2018). Существование Cu 0 может быть полезным для улучшения электронной проводимости электродов. Как показано на рисунке 3C, спектр XPS O 1s можно разделить на два пика, один из которых представляет собой пик при 530,3 эВ, который представляет кислород в Cu 2 О решетка. Другим является пик высокой интенсивности при 531,1 эВ, который приписывается CuO. Этот результат еще раз подтверждает сосуществование CuO и Cu 2 O (Singh and Sarkar, 2017). На рисунке 3D спектр C 1s показывает пик высокой интенсивности при 284,5 эВ, демонстрирующий, что интенсивность пика функциональной группы C-C особенно высока, что также свидетельствует о стабильности углеродного волокна в Cu 2 O/CuO@Cu-CC.
Как показано на рисунке 3C, спектр XPS O 1s можно разделить на два пика, один из которых представляет собой пик при 530,3 эВ, который представляет кислород в Cu 2 О решетка. Другим является пик высокой интенсивности при 531,1 эВ, который приписывается CuO. Этот результат еще раз подтверждает сосуществование CuO и Cu 2 O (Singh and Sarkar, 2017). На рисунке 3D спектр C 1s показывает пик высокой интенсивности при 284,5 эВ, демонстрирующий, что интенсивность пика функциональной группы C-C особенно высока, что также свидетельствует о стабильности углеродного волокна в Cu 2 O/CuO@Cu-CC.
Рис. 3. (A) XPS обзорный спектр Cu 9Образцы 0915 2 O/CuO@Cu-CCs и спектры XPS высокого отношения для (B) Cu 2p, (C) O 1s, (D) C 1s.
CV-кривые CC, Cu-CC и Cu 2 O/CuO@Cu-CC при скорости сканирования 30 мВ с -1 показаны на рисунке 4A. Очевидно, что для образцов Cu 2 O/CuO@Cu-CC и Cu-CC отчетливо видна сильная пара анодного и катодного пиков, в основном за счет фарадеевской окислительно-восстановительной реакции (Dong et al. , 2014). Для Cu-CC ионы меди в основном образуются в результате реакции раствора электролита Cu и KOH во время электрохимических измерений. Ярко выраженная псевдоемкостная характеристика Cu 2 O/CuO@Cu-CC в основном относится к пористым сшитым нанолистам Cu 2 O/CuO, в то время как вклад емкости для CC может быть незначительным. На рис. 4В показаны кривые НОД различных электродов при постоянной плотности тока 10 мА·см -2 . Нелинейное поведение кривых GCD также подтверждает, что основные источники накопления заряда происходят из реакций Фарадея. Обсуждаемый выше электрод Cu 2 O/CuO@Cu-CCs представляет собой образец, протравленный в течение 25 мин (кривые CV и GCD других образцов показаны на дополнительных рисунках 2A, B), и этот образец демонстрирует наилучшую псевдоемкостную характеристику с удельная емкость 1,71 Ф см -2 (835,2 F g -1 ) при 10 мА см -2 (3,57 A g -1 ) (рис. 4C), что превосходит ранее опубликованные значения Cu 2 O/CuO электроды на основе (1,674 Ф·см −2 , что эквивалентно 594,27 Ф·г −1 , при 2 мА·см −2 ; 839,9 Фг −1 , при 1 мВ·с −1 Ф·г; 3 093 -1 , при 10 А г -1 ) и более исчерпывающие данные были отображены в дополнительной таблице 4.
, 2014). Для Cu-CC ионы меди в основном образуются в результате реакции раствора электролита Cu и KOH во время электрохимических измерений. Ярко выраженная псевдоемкостная характеристика Cu 2 O/CuO@Cu-CC в основном относится к пористым сшитым нанолистам Cu 2 O/CuO, в то время как вклад емкости для CC может быть незначительным. На рис. 4В показаны кривые НОД различных электродов при постоянной плотности тока 10 мА·см -2 . Нелинейное поведение кривых GCD также подтверждает, что основные источники накопления заряда происходят из реакций Фарадея. Обсуждаемый выше электрод Cu 2 O/CuO@Cu-CCs представляет собой образец, протравленный в течение 25 мин (кривые CV и GCD других образцов показаны на дополнительных рисунках 2A, B), и этот образец демонстрирует наилучшую псевдоемкостную характеристику с удельная емкость 1,71 Ф см -2 (835,2 F g -1 ) при 10 мА см -2 (3,57 A g -1 ) (рис. 4C), что превосходит ранее опубликованные значения Cu 2 O/CuO электроды на основе (1,674 Ф·см −2 , что эквивалентно 594,27 Ф·г −1 , при 2 мА·см −2 ; 839,9 Фг −1 , при 1 мВ·с −1 Ф·г; 3 093 -1 , при 10 А г -1 ) и более исчерпывающие данные были отображены в дополнительной таблице 4.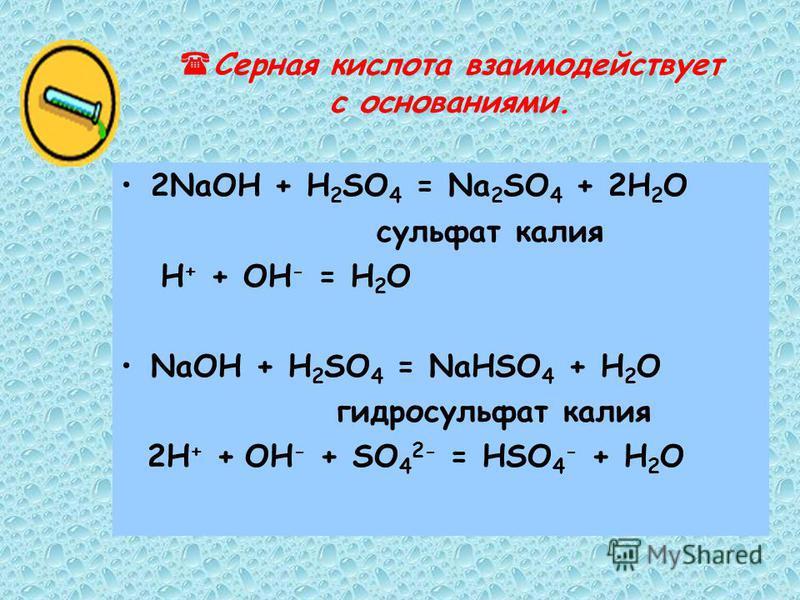 Анализ EIS был изучен для дальнейшего уточнения электрохимического поведения различных электродов. Диаграммы Найквиста показаны на рисунке 4D и состоят из примерного полукруга в высокочастотной области и линии в низкочастотной области. Все точки пересечения с действительной осью составляют примерно 0,5 Ом, что свидетельствует о превосходной электронной проводимости всех образцов благодаря токосъемникам CC и Cu-CC. Вдавленный полукруг в области высоких частот соответствует сопротивлению переноса заряда (Rct), вызванному фарадеевскими реакциями (Ensafi et al., 2018). Медь 2 Электрод O/CuO@Cu-CCs имеет наименьший полукруг, что свидетельствует об улучшенном переносе заряда. Кроме того, прямая линия в области низких частот может быть приписана импедансу Варбурга, связанному с быстрой диффузией заряда в электролите (Ensafi et al., 2018).
Анализ EIS был изучен для дальнейшего уточнения электрохимического поведения различных электродов. Диаграммы Найквиста показаны на рисунке 4D и состоят из примерного полукруга в высокочастотной области и линии в низкочастотной области. Все точки пересечения с действительной осью составляют примерно 0,5 Ом, что свидетельствует о превосходной электронной проводимости всех образцов благодаря токосъемникам CC и Cu-CC. Вдавленный полукруг в области высоких частот соответствует сопротивлению переноса заряда (Rct), вызванному фарадеевскими реакциями (Ensafi et al., 2018). Медь 2 Электрод O/CuO@Cu-CCs имеет наименьший полукруг, что свидетельствует об улучшенном переносе заряда. Кроме того, прямая линия в области низких частот может быть приписана импедансу Варбурга, связанному с быстрой диффузией заряда в электролите (Ensafi et al., 2018).
Рисунок 4 . ЦВА при скорости развертки 30 мВ с -1 (А) , кривые НОД при плотности тока 10 мА см -2 (Б) , сохранение емкости при 10 мА см -2 (C) и график Найквиста (D) электродов CC, Cu-CC и Cu 2 O/CuO@Cu-CCs в трехэлектродной ячейке в 6 М водном растворе КОН.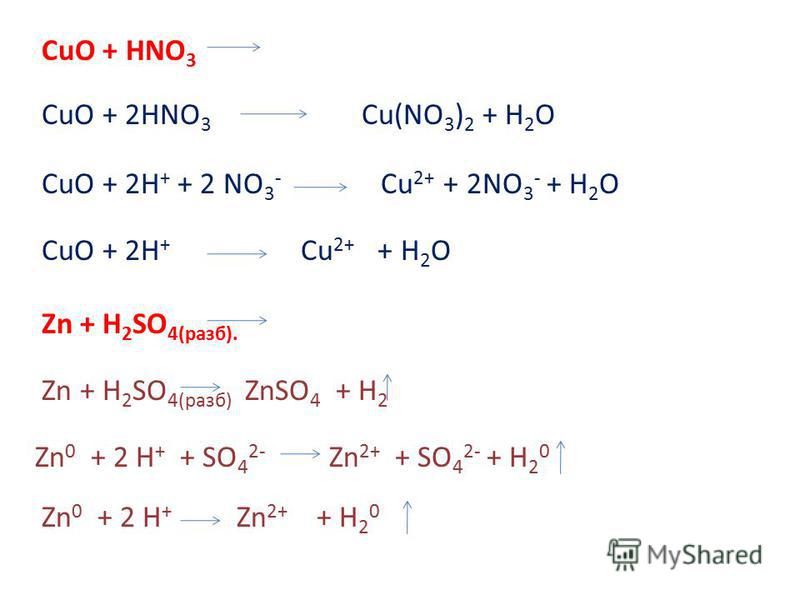 CV-кривые при различных скоростях сканирования 91 169 (E) 91 170, кривые GCD при различных плотностях тока 91 169 (F) 91 170, удельные емкости при различных плотностях тока 91 169 (G) 91 170 и циклические характеристики при плотности тока 5 мА·см 90 937 — 2 (на вставке показаны РЭМ-изображения до и после 5000 циклов) (H) Cu 2 O/CuO@Cu-CCs электрод.
CV-кривые при различных скоростях сканирования 91 169 (E) 91 170, кривые GCD при различных плотностях тока 91 169 (F) 91 170, удельные емкости при различных плотностях тока 91 169 (G) 91 170 и циклические характеристики при плотности тока 5 мА·см 90 937 — 2 (на вставке показаны РЭМ-изображения до и после 5000 циклов) (H) Cu 2 O/CuO@Cu-CCs электрод.
Электрохимические характеристики Cu 2 O/CuO@Cu-CC при различных скоростях сканирования и плотности тока (рис. 4E,F) демонстрируют идеальную обратимость во время процесса заряда-разряда. Ясно, что наклон кривых GCD резко снижается при 0,18–0,25 В в зарядной части и такой же, как в разрядной части, что соответствует псевдоемкостному поведению на CV-сканах, что связано с фарадеевскими окислительно-восстановительными реакциями Cu 2+ /Cu + редокс-пары, относящиеся к OH − в виде мехов (Guan et al., 2017; Sami et al., 2017).
CuO+h3O+2e-↔Cu2O+ 2OH-Cu2O+h3O+2OH-↔2Cu(OH)2+ 2e-CuOH+OH-↔Cu(OH)2+e-CuOH+OH-↔CuO+h3O+e —
Примечательно, что с увеличением плотности тока от 5 до 30 мА см -2 кривые НОД демонстрируют постепенное уменьшение времени разряда, но имеют тенденцию сохранять аналогичную форму (рис. 4F), а электрод сохраняет 68,5% своей емкости ( Рисунок 4G), что свидетельствует о превосходной скорости. Кроме того, Cu 9Электрод 0915 2 O/CuO@Cu-CCs обеспечивает превосходную стабильность при циклировании с потерей удельной емкости всего на 14,4 % после 5000 циклов при 5 мА·см −2 (рис. 4H), что можно объяснить стабильной структурой электродов после езда на велосипеде (вставка на рисунке 4H).
4F), а электрод сохраняет 68,5% своей емкости ( Рисунок 4G), что свидетельствует о превосходной скорости. Кроме того, Cu 9Электрод 0915 2 O/CuO@Cu-CCs обеспечивает превосходную стабильность при циклировании с потерей удельной емкости всего на 14,4 % после 5000 циклов при 5 мА·см −2 (рис. 4H), что можно объяснить стабильной структурой электродов после езда на велосипеде (вставка на рисунке 4H).
Для дальнейшего изучения применения исследуются электрохимические характеристики устройства ASC. Как показано на рисунке 5A, устройство состоит из положительного электрода Cu 2 O/CuO@Cu-CCs, отрицательного электрода из активированного угля и диафрагменного сепаратора, пропитанного 6 М водным раствором КОН. На рис. 5B показан точно дополняющий диапазон потенциальных окон простого AC и Cu 9 .0915 2 Электрод O/CuO@Cu-CCs, который указывает на высокопотенциальное окно устройства ACS. Кроме того, расчетное массовое соотношение электроактивных материалов отрицательного и положительного электродов согласно уравнению (3) составляет примерно 1:20. На рис. 5C, D показаны кривые ЦВА при скорости сканирования 30 мВ с -1 и кривые НОД при плотности тока 1 А г -1 с различными потенциальными окнами соответственно. Очевидно, что формы CV-кривых остаются почти одинаковыми в различных окнах потенциала, а максимальное окно потенциала расширяется до 1,6 В. Идеальная симметрия и почти неизменная форма кривых НОД в различных окнах потенциала также способствуют выдающимся емкостным характеристикам это устройство ASC.
На рис. 5C, D показаны кривые ЦВА при скорости сканирования 30 мВ с -1 и кривые НОД при плотности тока 1 А г -1 с различными потенциальными окнами соответственно. Очевидно, что формы CV-кривых остаются почти одинаковыми в различных окнах потенциала, а максимальное окно потенциала расширяется до 1,6 В. Идеальная симметрия и почти неизменная форма кривых НОД в различных окнах потенциала также способствуют выдающимся емкостным характеристикам это устройство ASC.
Рисунок 5 . Схематическое изображение (A) и сравнительные CV-кривые электродов Cu 2 O/CuO@Cu-CC и электродов переменного тока при скорости сканирования 30 мВ с −1 в трехэлектродной системе (B) , электрохимические характеристики устройства ASC: (C) CV кривые в различных окнах потенциала при 30 мВ с -1 , (D) кривые GCD в различных окнах потенциала при плотности тока 1 A g — 1 , (Е) CV-кривых при различных скоростях сканирования, (F) кривых GCD при увеличении плотности тока, (G) график Рагона и (H) долговременная циклическая стабильность при плотности тока 2 А·г −1 , вставка — последние 5 циклов кривых НОД.
На рисунке 5E показаны CV-кривые устройства ASC при скорости сканирования в диапазоне от 10 до 100 мВ с -1 . По-видимому, отличный синергетический эффект двух электродов приводит к высокому рабочему напряжению 1,6 В, что в три раза больше, чем потенциальное окно Cu 2 Электрод O/CuO@Cu-CCs в трехэлектродной системе. При этом форма кривой остается неизменной при разных скоростях сканирования. Кривые НОД при плотности тока от 0,5 до 10 А г -1 показаны на рисунке 5F. Очевидно, что даже при высоких плотностях тока видны очень низкие перепады напряжения по сравнению с трехэлектродным тестом. А симметричная форма указывает на высокую обратимость устройства. Таким образом, устройство демонстрирует отличные возможности скорости (дополнительный рисунок 3). Кроме того, благодаря широкому потенциальному окну и огромной удельной емкости устройство ASC демонстрирует высокую плотность энергии 60,26 Втч·кг·9.0937 -1 при плотности мощности 299,73 Вт · кг -1 , что выше, чем в некоторых других источниках (рис. 5G). Чтобы исследовать долговременную циклическую стабильность и долговечность устройства, мы выполнили 5000 непрерывных циклов GCD при плотности тока 2 А·г -1 . Устройство ASC демонстрирует превосходную циклическую стабильность, сохраняя удельную емкость на уровне 90,35% после 5000 циклов GCD (рис. 5H). Этот тип электродного материала будет многообещающим электродом для дальнейшего проектирования полностью твердотельных высокопроизводительных суперконденсаторов благодаря его превосходным характеристикам конденсатора и гибкости.
5G). Чтобы исследовать долговременную циклическую стабильность и долговечность устройства, мы выполнили 5000 непрерывных циклов GCD при плотности тока 2 А·г -1 . Устройство ASC демонстрирует превосходную циклическую стабильность, сохраняя удельную емкость на уровне 90,35% после 5000 циклов GCD (рис. 5H). Этот тип электродного материала будет многообещающим электродом для дальнейшего проектирования полностью твердотельных высокопроизводительных суперконденсаторов благодаря его превосходным характеристикам конденсатора и гибкости.
Выводы
Короче говоря, мы сконструировали электроды Cu 2 O/CuO@Cu-CCs с помощью простого процесса с химическим меднением, химическим травлением и термической дегидратацией. Устройство ASC с положительным электродом Cu 2 O/CuO@Cu-CCs и отрицательным электродом переменного тока показало высокую плотность энергии 60,26 Вт·ч·кг·–1· при плотности мощности 299,73 Вт·кг·–1· при использовании 6 М водного раствора КОН. раствор в качестве электролита. Кроме того, устройство ASC демонстрирует превосходную циклическую стабильность, сохраняя 90,35% удельной емкости после 5000 циклов GCD. Кроме того, этот тип электродного материала будет перспективным электродом для дальнейшей разработки полностью твердотельных высокопроизводительных суперконденсаторов.
раствор в качестве электролита. Кроме того, устройство ASC демонстрирует превосходную циклическую стабильность, сохраняя 90,35% удельной емкости после 5000 циклов GCD. Кроме того, этот тип электродного материала будет перспективным электродом для дальнейшей разработки полностью твердотельных высокопроизводительных суперконденсаторов.
Доступность данных
Необработанные данные, подтверждающие выводы этой рукописи, будут предоставлены авторами без неоправданных оговорок любому квалифицированному исследователю.
Вклад авторов
LX синтезировала образцы Cu 2 O/CuO@Cu-CC и проанализировала часть характеристик. JL был руководителем этой исследовательской работы. HS и XG помогли с анализом данных. JX проанализировал измерения XPS. ХЗ организовал часть данных. XZ дополнил часть эксперимента.
Финансирование
Эта работа была поддержана Проектом программы высшего образования в области науки и техники провинции Шаньдун (грант № J18KA002), Национальным фондом естественных наук Китая (грант № 51702189) и Фондом естественных наук провинции Шаньдун (грант № ZR2017BEM033).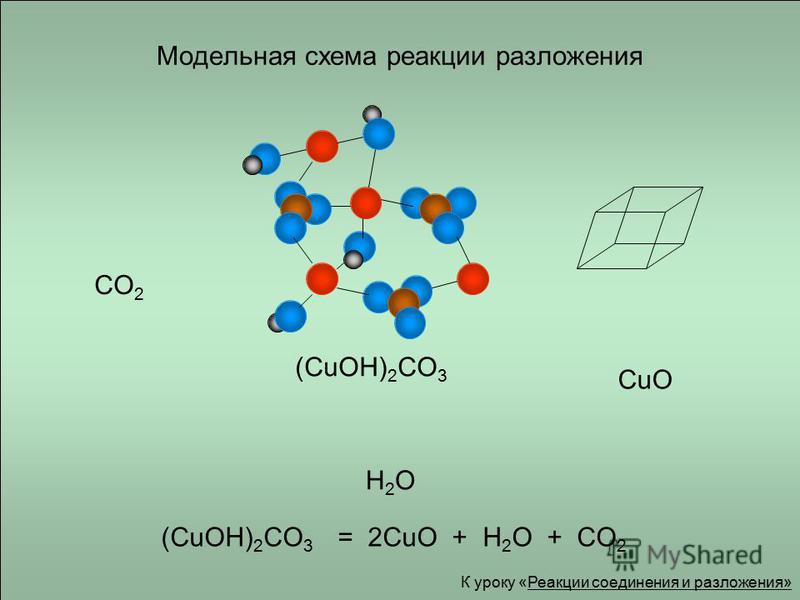
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fchem.2019.00420/full#supplementary-material
Ссылки
Bu, I.Y.Y., и Хуанг, Р. (2017). Изготовление нанолистов восстановленного оксида графена, декорированных CuO, для применения в суперконденсаторах. Керам. Междунар. 43, 45–50. doi: 10.1016/j.ceramint.2016.08.136
CrossRef Full Text | Академия Google
Чен Х., Чжоу М., Ван Т., Ли Ф. и Чжан Ю. Х. (2016). Создание уникальных массивов сердечник-оболочка из оксида меди-диоксида марганца на медной сетке для высокопроизводительных суперконденсаторов. Дж. Матер. хим. А 4, 10786–10793. doi: 10.1039/C6TA04258A
Полный текст CrossRef | Google Scholar
Дай С. , Лю З., Чжао Б., Цзэн Дж., Ху Х., Чжан К. и др. (2018). Высокоэффективный электрод суперконденсатора на основе пористого графена, легированного азотом. Дж. Источники питания 387, 43–48. doi: 10.1016/j.jpowsour.2018.03.055
, Лю З., Чжао Б., Цзэн Дж., Ху Х., Чжан К. и др. (2018). Высокоэффективный электрод суперконденсатора на основе пористого графена, легированного азотом. Дж. Источники питания 387, 43–48. doi: 10.1016/j.jpowsour.2018.03.055
CrossRef Full Text | Google Scholar
Daoping, C., Dandan, W., Bin, L., Lingling, W., Yuan, L., Han, L., et al. (2014). Трехмерные массивы нанопроволок Co3O4@NiMoO4 ядро/оболочка на пене Ni для электрохимического накопления энергии. Приложение ACS Матер. Интерфейсы 6:5050. doi: 10.1021/am500060m
CrossRef Full Text | Google Scholar
Донг К., Ван Ю., Сюй Дж., Ченг Г., Ян В., Коу Т. и др. (2014). Трехмерные массивы наноигл Cu2O@Cu без связующего вещества для высокоэффективных асимметричных суперконденсаторов. Дж. Матер. хим. А 2, 18229–18235. doi: 10.1039/C4TA04329D
Полный текст CrossRef | Google Scholar
Энсафи А. А., Мусавифард С. Э., Резаи Б. и Каверлавани С. К. (2018). Разработка луковичных нанопористых полых сфер CuCo2O4, полученных из биметаллоорганических каркасов, для высокоэффективных асимметричных суперконденсаторов. Дж. Матер. хим. А 6, 10497–10506. doi: 10.1039/C8TA02819B
Дж. Матер. хим. А 6, 10497–10506. doi: 10.1039/C8TA02819B
Полный текст CrossRef | Google Scholar
Фу, С.Ю., Сумбоджа, А., Тан, Д.Дж.Х., Ван, Дж., и Ли, П.С. (2014). Гибкие и масштабируемые электроды V2O5-rGO в органическом электролите для суперконденсаторных устройств. Доп. Энергия Матер. 4:1400236. doi: 10.1002/aenm.201400236
Полный текст CrossRef | Google Scholar
Гуань, Б.Ю., Ю, Л., Ван, X., Сонг, С., и Лу, X.W.D. (2017). Формирование луковичных частиц NiCo2S4 путем последовательного ионного обмена для гибридных суперконденсаторов. Доп. Матер. 29:1605051. doi: 10.1002/adma.201605051
Полный текст CrossRef | Google Scholar
Го, Д., Ю, С., Ши, В., Ло, Ю., Ли, К., и Ван, Т. (2014). Легкий синтез хорошо упорядоченных массивов нанолистов оксида марганца на углеродной ткани для высокопроизводительных суперконденсаторов. Дж. Матер. хим. А 2, 8833–8838. doi: 10.1039/c4ta01238k
Полный текст CrossRef | Google Scholar
Хуан М. , Ли Ф., Донг Ф., Чжан Ю. и Чжан Л. Л. (2015). Наноструктуры на основе MnO2 для высокопроизводительных суперконденсаторов. Дж. Матер. хим. А 3, 21380–21423. doi: 10.1039/C5TA05523G
, Ли Ф., Донг Ф., Чжан Ю. и Чжан Л. Л. (2015). Наноструктуры на основе MnO2 для высокопроизводительных суперконденсаторов. Дж. Матер. хим. А 3, 21380–21423. doi: 10.1039/C5TA05523G
Полный текст CrossRef | Google Scholar
Ji, Y., Liu, J., Liu, X., Yuen, M. M. F., Fu, X. Z., Yang, Y., et al. (2017). Трехмерные пористые пленки Cu@Cu 2 O на подложке с наночастицами Pd для электрокаталитического окисления глюкозы. Электрохим. Acta 248, 299–306. doi: 10.1016/j.electacta.2017.07.100
CrossRef Full Text | Google Scholar
Ким С.В., Ким И.Х., Ким С.И. и Джанг Дж.Х. (2017). Суперконденсатор из гидроксида никеля с теоретической емкостью и высокой пропускной способностью на основе полых дендритных 3D-никелевых токосъемников. Хим. Азиат Дж. 12, 1291–1296. doi: 10.1002/asia.201700454
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Li, J., Liu, Z., Zhang, Q., Cheng, Y., Zhao, B., Dai, S., et al. (2019). Замещение анионов и катионов в нанолистах оксидов переходных металлов для высокоэффективных гибридных суперконденсаторов. Nano Energy 57, 22–33. doi: 10.1016/j.nanoen.2018.12.011
Nano Energy 57, 22–33. doi: 10.1016/j.nanoen.2018.12.011
CrossRef Full Text | Google Scholar
Li, Y., Wang, X., Yang, Q., Javed, M.S., Liu, Q., Xu, W., et al. (2017). Сверхтонкие наночастицы CuO, встроенные в трехмерную сетчатую наноструктуру графена, для высокопроизводительных гибких суперконденсаторов. Электрохим. Acta 234, 63–70. doi: 10.1016/j.electacta.2017.02.167
Полнотекстовая перекрестная ссылка | Google Scholar
Х. Лян, Дж. Линь, Х. Цзя, С. Чен, Дж. Ци, Дж. Цао и др. (2018). Иерархическая гетероструктура ядро-оболочка NiCo-LDH@NiOOH на ткани из углеродного волокна в качестве аккумуляторного электрода для суперконденсатора. Дж. Источники питания 378, 248–254. doi: 10.1016/j.jpowsour.2017.12.046
CrossRef Full Text | Google Scholar
Лю Т., Чжан Л., Ю В. и Ю Дж. (2018). Легированные азотом углеродные полые сферы сердцевина-оболочка/нанолисты Co3O4 в качестве усовершенствованного электрода для высокопроизводительного суперконденсатора. Маленький 14:e1702407. doi: 10.1002/smll.201702407
Маленький 14:e1702407. doi: 10.1002/smll.201702407
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лю Ю., Цао X., Цзян Д., Цзя Д. и Лю Дж. (2018). Иерархические массивы наностержней CuO in situ , созданные на трехмерной пене меди посредством циклического вольтамперометрического окисления для высокопроизводительных суперконденсаторов. Дж. Матер. хим. А 6, 10474–10483. doi: 10.1039/C8TA00945G
Полный текст CrossRef | Google Scholar
Лу К., Чен Ю., Ли В., Чен Дж. Г., Сяо Дж. К. и Цзяо Ф. (2013). Упорядоченная мезопористая никелево-кобальтовая шпинель со сверхвысокой сверхемкостью. Дж. Матер. хим. А 1, 2331–2336. doi: 10.1039/c2ta00921h
CrossRef Full Text | Google Scholar
Лу Х., Цзэн Ю., Ю М., Чжай Т., Лян К., Се С. и др. (2014). Наностержни гематита с дефицитом кислорода в качестве высокоэффективных и новых отрицательных электродов для гибких асимметричных суперконденсаторов. Доп. Матер. 26, 3148–3155. doi: 10.1002/adma.201305851
Матер. 26, 3148–3155. doi: 10.1002/adma.201305851
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мусавифард С.Э., Шамси Дж., Фани С. и Кадходазаде С. (2014). Простой синтез иерархических массивов наностержней CuO на углеродных нановолокнах для высокопроизводительных суперконденсаторов. Керам. Междунар. 40, 15973–15979. doi: 10.1016/j.ceramint.2014.07.126
CrossRef Полный текст | Google Scholar
Оуян Ю., Хуан Р., Ся Х., Е Х., Цзяо Х., Ван Л. и др. (2019). Электроды с иерархической структурой из ультратонких нанолистов NiO, прикрепленных к NiCo2O4 на углеродной ткани, с превосходной циклической стабильностью для асимметричных суперконденсаторов. Хим. англ. Дж. 355, 416–427. doi: 10.1016/j.cej.2018.08.142
CrossRef Full Text | Академия Google
Прасад, К.П., Давале, Д.С., Сивакумар, Т., Алдеяб, С.С., Заиди, Дж.С., Арига, К., и др. (2011). Изготовление и определение текстуры нанопористых углеродных электродов с наночастицами CuO для суперконденсаторов. наук. Технол. Доп. Матер. 12:044602. doi: 10.1088/1468-6996/12/4/044602
наук. Технол. Доп. Матер. 12:044602. doi: 10.1088/1468-6996/12/4/044602
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сами С. К., Сиддики С., Шривастава С., Ли Н. Э. и Чанг С. Х. (2017). Вдохновленная сосновой иголкой структура наностержней оксида цинка, выращенных на электропряденых нановолокнах, для высокопроизводительных гибких суперконденсаторов. Маленький 13:1702142. doi: 10.1002/smll.201702142
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сарай, М. Т., и Хоссейни, Х. (2016). Мезопористые массивы нанопроволок/нанолистов MnNiCoO4@MnO 2 ядро-оболочка на гибкой углеродной ткани для высокопроизводительных суперконденсаторов. Электрохим. Acta 222, 505–517. doi: 10.1016/j.electacta.2016.11.003
CrossRef Полный текст | Google Scholar
Сингх А.К. и Саркар Д. (2017). Гибридные нанопроволоки Co3O4@Au@CuO с интегрированным в подложку ядром и оболочкой в качестве эффективных катодных материалов для высокопроизводительных асимметричных суперконденсаторов с превосходным сроком службы. Дж. Матер. хим. А 5, 21715–21725. doi: 10.1039/C7TA07266J
Дж. Матер. хим. А 5, 21715–21725. doi: 10.1039/C7TA07266J
Полный текст CrossRef | Google Scholar
Сурендран С., Шанмугаприя С., Сиванантам А., Шанмугам С. и Калаи Селван Р. (2018). Электропряденые углеродные нановолокна, инкапсулированные NiCoP: многофункциональный электрод для реакций суперкаптерии и восстановления кислорода, выделения кислорода и выделения водорода. Доп. Энергия Матер. 8:1800555. doi: 10.1002/aenm.201800555
Полный текст CrossRef | Академия Google
Ван, К., Цзяо, Ю., и Ли, Дж. (2017). Иерархическая лесоподобная архитектура массива оксида меди / меди, поддерживаемая целлюлозными волокнами, в качестве гибких и отдельно стоящих электродов для симметричных суперконденсаторов. Дж. Матер. хим. А 5, 17267–17278. doi: 10.1039/C7TA04994C
Полный текст CrossRef | Google Scholar
Ван К., Донг К., Чжао К., Цянь К. и Сюй Ю. (2015). Легкий синтез нанокомпозита Cu 2 O/CuO/RGO и его превосходная циклируемость в суперконденсаторе. Электрохим. Acta 152, 433–442. doi: 10.1016/j.electacta.2014.11.171
Электрохим. Acta 152, 433–442. doi: 10.1016/j.electacta.2014.11.171
CrossRef Полный текст | Google Scholar
Ван В., Го С., Ли И., Ахмед К., Чжун Дж., Фаворс З. и др. (2014). Наночастицы водного оксида рутения, прикрепленные к гибридной пене графена и углеродных нанотрубок для суперконденсаторов. наук. Реп. 4:4452. doi: 10.1038/srep04452
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вей Д., Шерер М. Р., Бауэр К., Эндрю П., Риханен Т. и Штайнер У. (2012). Наноструктурированный электрохромный суперконденсатор. Нано Летт. 12, 1857–1862 гг. doi: 10.1021/nl2042112
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ву, С., Лв, В., Лей, Т., Хань, Ю., Цзянь, X., Дэн, М., и др. (2017). Отличительные сверхемкостные свойства нанокристаллов меди и оксида меди, использующих аналогичный путь коллоидного синтеза. Доп. Энергия Матер. 7:1700105. doi: 10.1002/aenm.201700105
Полный текст CrossRef | Google Scholar
Xiong, X. , Dong, D., Chen, D., Waller, G., Bu, Y., Wang, Z., et al. (2015). Трехмерные ультратонкие нанолисты Ni(OH) 2 , выращенные на пеноникелевой основе, для высокоэффективных суперконденсаторов. Nano Energy 11, 154–161. doi: 10.1016/j.nanoen.2014.10.029
, Dong, D., Chen, D., Waller, G., Bu, Y., Wang, Z., et al. (2015). Трехмерные ультратонкие нанолисты Ni(OH) 2 , выращенные на пеноникелевой основе, для высокоэффективных суперконденсаторов. Nano Energy 11, 154–161. doi: 10.1016/j.nanoen.2014.10.029
CrossRef Full Text | Google Scholar
Сюй В., Дай С., Лю Г., Си Ю., Ху К. и Ван Х. (2016). Наноцветы CuO, растущие на ткани из углеродного волокна, для гибких высокопроизводительных суперконденсаторов. Электрохим. Acta 203, 1–8. doi: 10.1016/j.electacta.2016.03.170
CrossRef Full Text | Google Scholar
Ян В., Цюй Г., Чен М., Ма В., Ли В. и Тан Ю. (2018). Эффективные расслоенные NaBh5 ультратонкие многослойные массивы нанолистов Co(OH)2 и сульфидирование для хранения энергии. Нанотехнологии 29:295403. doi: 10.1088/1361-6528/aac158
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ян Ю., Пей Л., Сюй X., Сюй Дж., Шен Дж. и Е М. (2016). Рост на месте самособирающейся трехмерной пены Cu 2 O@Cu с улучшенными электрохимическими свойствами. Электрохим. Acta 221, 56–61. doi: 10.1016/j.electacta.2016.10.150
Электрохим. Acta 221, 56–61. doi: 10.1016/j.electacta.2016.10.150
CrossRef Full Text | Google Scholar
Юань В., Луо Дж., Пань Б., Цю З., Хуанг С. и Тан Ю. (2017). Иерархические композиты оболочка/сердцевина нанопроволоки CuO/углеродное волокно в качестве анодов без связующего вещества для литий-ионных аккумуляторов. Электрохим. Acta 241, 261–271. doi: 10.1016/j.electacta.2017.04.159
CrossRef Полный текст | Google Scholar
Чжан Л., Дин К., Хуанг Ю., Гу Х., Мяо Ю. Э. и Лю Т. (2015). Гибкие гибридные мембраны с нанопластинками Ni(OH)2, вертикально выращенными на электропряденых углеродных нановолокнах, для высокоэффективных суперконденсаторов. Приложение ACS Матер. Интерфейсы 7:22669. doi: 10.1021/acsami.5b07528
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Чжан В., Инь З., Чун А., Ю Дж., Диао Г., Ким Ю. С. и другие. (2016). Нано-графен Cu 2 O в форме розового камня для высокопроизводительных суперконденсаторов сольвотермическим путем. J. Источники питания 318, 66–75. doi: 10.1016/j.jpowsour.2016.04.006
J. Источники питания 318, 66–75. doi: 10.1016/j.jpowsour.2016.04.006
CrossRef Full Text | Google Scholar
Zhang, Y., Hu, Z., An, Y., Guo, B., An, N., Liang, Y., et al. (2016). Высокоэффективный симметричный суперконденсатор на основе нанолистов оксигидроксида марганца на углеродной ткани в качестве электродов без связующего вещества. J. Источники питания 311, 121–129. doi: 10.1016/j.jpowsour.2016.02.017
Полный текст CrossRef | Google Scholar
Приготовление и теплопроводность наножидкости CuO мокрым химическим методом | Письма об исследованиях в области наноразмеров
- Nano Express
- Открытый доступ
- Опубликовано:
- Хайтао Чжу 1 ,
- Dongxiao Han 1 ,
- Zhaoguo Meng 1 ,
- Daxiong Wu 1 &
- …
- Canying Zhang 1
Письма об исследованиях наноразмеров том 6 , номер статьи: 181 (2011) Процитировать эту статью
15 тыс.
 обращений
обращенийСведения о показателях
Abstract
В этой статье был разработан мокрый химический метод для приготовления стабильных наножидкостей CuO. Исследовано влияние параметров синтеза, таких как вид и количество солей меди, время реакции. Также были исследованы теплопроводности наножидкостей CuO. Результаты показали, что различные соли меди приводят к различной морфологии частиц. Концентрация ацетата меди и время реакции влияли на размер и форму кластеров первичных наночастиц. Наножидкости с различной микроструктурой можно было получить, изменяя параметры синтеза. Теплопроводность наножидкостей CuO увеличивалась с увеличением загрузки частиц.
Введение
Наножидкость — новый класс теплоносителей, содержащий наноразмерные частицы, волокна или трубки, устойчиво взвешенные в жидкости-носителе [1–4]. С тех пор, как была предложена концепция наножидкости [1], все больше и больше исследователей обращаются к ней из-за тепловых свойств и потенциальных применений, связанных с переносом тепла, массопереносом, смачиванием и растеканием [1–7].
С тех пор, как была предложена концепция наножидкости [1], все больше и больше исследователей обращаются к ней из-за тепловых свойств и потенциальных применений, связанных с переносом тепла, массопереносом, смачиванием и растеканием [1–7].
Получение стабильных наножидкостей является первым шагом и ключевым вопросом исследования и применения наножидкостей. В настоящее время некоторые методы, такие как метод дисперсии, метод прямого испарения-конденсации (DECM), система синтеза наночастиц под флюсом (SANSS), метод лазерной абляции, мокрый химический метод и др. [2–4, 8–12], были применены для синтеза наножидкостей. Метод диспергирования представляет собой двухэтапный метод [13–18], при котором коммерческие наночастицы диспергируют в базовой жидкости при ультразвуковом или механическом перемешивании. Преимущество этого метода в том, что он позволяет получать наножидкости в больших масштабах. Однако агрегаты наночастиц трудно разрушить при обработке ультразвуком или перемешивании. Таким образом, стабильность и теплопроводность наножидкостей, приготовленных методом диспергирования, обычно не идеальны. DECM, SANSS и метод лазерной абляции являются одноэтапными физическими методами [19].–22], в котором металлические материалы испаряются с помощью физических технологий и охлаждаются до жидкого состояния для получения наножидкостей. Эти физические методы обеспечивают превосходный контроль размера частиц и позволяют получать стабильные наножидкости. Однако синтезировать наножидкости в больших масштабах сложно. Наша команда разработала мокрый химический метод, с помощью которого было успешно получено несколько видов наножидкостей [23–25]. Он имеет преимущества с точки зрения контроля размера частиц, уменьшения агломерации наночастиц и производства наножидкостей в больших масштабах. Этот метод является перспективным для коммерческого синтеза наножидкостей. Однако исследования влияния параметров синтеза на микроструктуру и свойства наножидкостей немногочисленны, хотя это очень важно для промышленного синтеза наножидкостей.
Таким образом, стабильность и теплопроводность наножидкостей, приготовленных методом диспергирования, обычно не идеальны. DECM, SANSS и метод лазерной абляции являются одноэтапными физическими методами [19].–22], в котором металлические материалы испаряются с помощью физических технологий и охлаждаются до жидкого состояния для получения наножидкостей. Эти физические методы обеспечивают превосходный контроль размера частиц и позволяют получать стабильные наножидкости. Однако синтезировать наножидкости в больших масштабах сложно. Наша команда разработала мокрый химический метод, с помощью которого было успешно получено несколько видов наножидкостей [23–25]. Он имеет преимущества с точки зрения контроля размера частиц, уменьшения агломерации наночастиц и производства наножидкостей в больших масштабах. Этот метод является перспективным для коммерческого синтеза наножидкостей. Однако исследования влияния параметров синтеза на микроструктуру и свойства наножидкостей немногочисленны, хотя это очень важно для промышленного синтеза наножидкостей.
В этом исследовании наножидкость CuO была синтезирована мокрым химическим методом. Влияние параметров синтеза, таких как вид и количество солей меди, время реакции, изучали с помощью рентгеновской дифракции (XRD), просвечивающей электронной микроскопии (TEM) и анализатора размера частиц. Исследована также теплопроводность наножидкостей CuO.
Экспериментальная часть
Все реагенты, использованные в эксперименте, имели аналитическую чистоту. На рис. 1 показан процесс подготовки. Процесс синтеза основан на следующих химических реакциях в растворе:
Cu2++2NaOH=Cu(OH)2+2Na+
(1)
Cu(OH)2≜CuO+h3O
(2)
Увеличенное изображение
При типичной процедуре 600 мл 0,2 М раствора ацетата меди (Cu(CH 3 COO) 2 ·H 2 O) и 2 мл ледяной уксусной кислоты (CH 3 COOH) ) добавляли в круглодонную колбу и нагревали до кипения при магнитном перемешивании. Затем в колбу приливают 30 мл 8 М раствора гидроксида натрия (NaOH). Цвет раствора сразу изменился с синего на черный, и одновременно образовалась черная суспензия. Реакцию проводили при перемешивании и кипячении в течение 2 часов. Смесь охлаждали до комнатной температуры и центрифугировали. Затем получали влажный осадок CuO. Влажный осадок дважды промывали дистиллированной водой для удаления примесных ионов. Наножидкости CuO различной объемной доли получали путем повторного диспергирования влажного осадка в различное количество дистиллированной воды с помощью ультразвуковой вибрации (120 Вт, 40 Гц).
Затем в колбу приливают 30 мл 8 М раствора гидроксида натрия (NaOH). Цвет раствора сразу изменился с синего на черный, и одновременно образовалась черная суспензия. Реакцию проводили при перемешивании и кипячении в течение 2 часов. Смесь охлаждали до комнатной температуры и центрифугировали. Затем получали влажный осадок CuO. Влажный осадок дважды промывали дистиллированной водой для удаления примесных ионов. Наножидкости CuO различной объемной доли получали путем повторного диспергирования влажного осадка в различное количество дистиллированной воды с помощью ультразвуковой вибрации (120 Вт, 40 Гц).
Для изучения влияния параметров синтеза на конечные продукты, виды и количества солей меди, время реакции было изменено, при этом все остальные экспериментальные параметры остались такими же, как и в типичном эксперименте.
Рентгенограмма порошка (полученная сушкой промытого влажного осадка) была записана на дифрактометре Rigaku D/Max r-A. Изображения ПЭМ были получены на приборе JEM-2000EX. Наножидкости разбавляли дистиллированной водой и диспергировали ультразвуком. Затем одну каплю помещали на медную сетку с углеродным покрытием и оставляли сохнуть при комнатной температуре. Распределение размера частиц наночастиц в наножидкостях измеряли с помощью анализатора размера частиц Zetasizer 3000HS (Malvern). Образцы также были приготовлены путем разбавления наножидкостей дистиллированной водой и диспергирования ультразвуком. Теплопроводность измеряли с использованием анализатора термических свойств KD2 Pro (Decagon Inc., Пуллман, Вашингтон, США) на основе метода нестационарной горячей проволоки. Перед измерениями наножидкости обрабатывали ультразвуком в течение примерно 30 мин, чтобы образцы имели одинаковую дисперсность.
Наножидкости разбавляли дистиллированной водой и диспергировали ультразвуком. Затем одну каплю помещали на медную сетку с углеродным покрытием и оставляли сохнуть при комнатной температуре. Распределение размера частиц наночастиц в наножидкостях измеряли с помощью анализатора размера частиц Zetasizer 3000HS (Malvern). Образцы также были приготовлены путем разбавления наножидкостей дистиллированной водой и диспергирования ультразвуком. Теплопроводность измеряли с использованием анализатора термических свойств KD2 Pro (Decagon Inc., Пуллман, Вашингтон, США) на основе метода нестационарной горячей проволоки. Перед измерениями наножидкости обрабатывали ультразвуком в течение примерно 30 мин, чтобы образцы имели одинаковую дисперсность.
Результаты и обсуждение
Характеристика типичного образца
На рис. 2а представлена рентгенограмма типичного образца. Все пики на дифрактограмме могут быть отнесены к пикам моноклинной CuO в соответствии с литературой (JCPDS, FileNo 80-1916).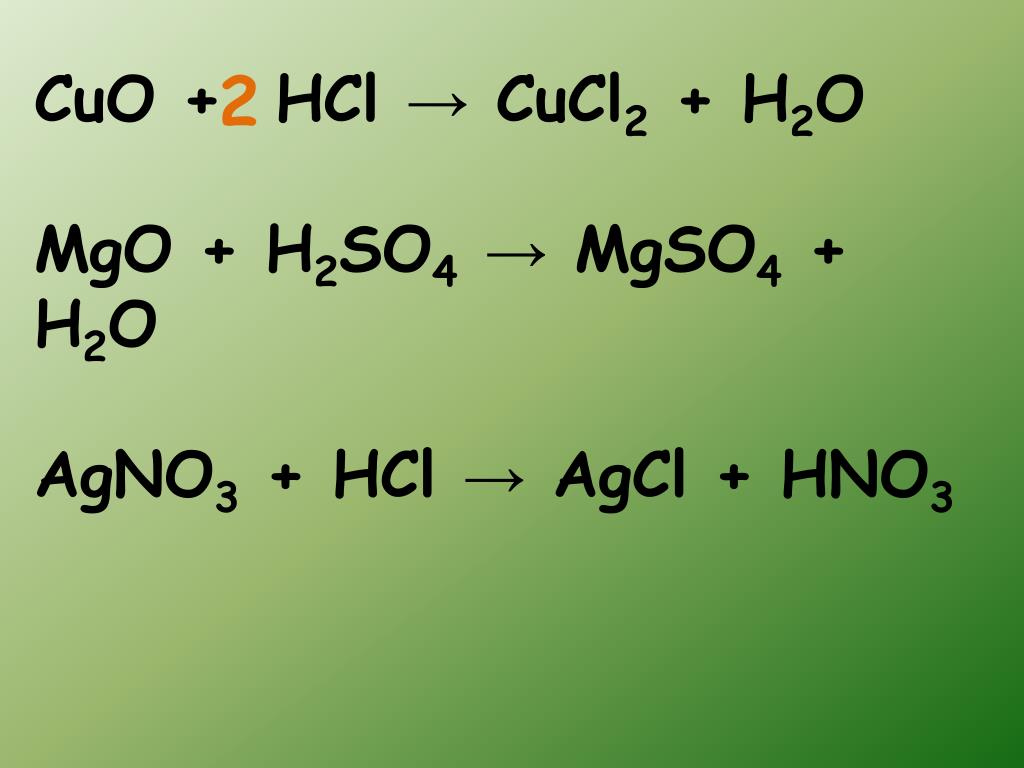 Средний размер кристаллов составляет 10,4 нм, рассчитанный по формуле Дебая-Шеррера. На рис. 2b показано ПЭМ-изображение типичного образца. Размер первичных частиц составляет около 10 нм, что хорошо согласуется с результатами РФА. Первичные частицы собираются в цеповидные кластеры шириной 10 нм и длиной 50-150 нм (5-15 первичных частиц). Рисунок 2c представляет собой распределение размера типичного образца. Размер частиц составляет около 20-80 нм, а распределение по размерам узкое. Больший размер частиц обусловлен короткими кластерами, показанными на ПЭМ-изображении. Рисунок 2d — это реальная фотография продуктов. Полученные наножидкости CuO могли оставаться стабильными в течение 5 месяцев без видимых осадков на дне.
Средний размер кристаллов составляет 10,4 нм, рассчитанный по формуле Дебая-Шеррера. На рис. 2b показано ПЭМ-изображение типичного образца. Размер первичных частиц составляет около 10 нм, что хорошо согласуется с результатами РФА. Первичные частицы собираются в цеповидные кластеры шириной 10 нм и длиной 50-150 нм (5-15 первичных частиц). Рисунок 2c представляет собой распределение размера типичного образца. Размер частиц составляет около 20-80 нм, а распределение по размерам узкое. Больший размер частиц обусловлен короткими кластерами, показанными на ПЭМ-изображении. Рисунок 2d — это реальная фотография продуктов. Полученные наножидкости CuO могли оставаться стабильными в течение 5 месяцев без видимых осадков на дне.
Характеристика типичного образца . (а) рентгенограмма; (б) ПЭМ-изображение; (c) распределение размеров; (d) реальное фото.
Full size image
Influences of copper salts
By replacing Cu(CH 3 COO) 2 ·H 2 O with CuCl 2 ·2H 2 O and Cu(NO 3 ) 3 ·3H 2 O соответственно были приготовлены различные наножидкости CuO при неизменности всех остальных экспериментальных параметров. На рис. 3 представлены ПЭМ-изображения двух указанных выше наножидкостей. При использовании CuCl 2 ·2H 2 O в качестве источника меди (рис. 3а), полученные частицы в наножидкостях представляют собой хлопьевидные частицы шириной 10-80 нм и длиной 100-300 нм. При использовании Cu(NO 3 ) 2 · 3H 2 O (рис. 3b) частицы представляют собой скопления тонких палочек и частиц размером около 15-50 нм. Некоторыми исследователями было подтверждено, что анионы могут влиять на ориентацию и процесс роста наночастиц за счет адсорбции или координационного взаимодействия анионов со специальной кристаллической гранью частиц [26]. Следовательно, меняя источник меди, мы могли получать частицы с другой морфологией.
На рис. 3 представлены ПЭМ-изображения двух указанных выше наножидкостей. При использовании CuCl 2 ·2H 2 O в качестве источника меди (рис. 3а), полученные частицы в наножидкостях представляют собой хлопьевидные частицы шириной 10-80 нм и длиной 100-300 нм. При использовании Cu(NO 3 ) 2 · 3H 2 O (рис. 3b) частицы представляют собой скопления тонких палочек и частиц размером около 15-50 нм. Некоторыми исследователями было подтверждено, что анионы могут влиять на ориентацию и процесс роста наночастиц за счет адсорбции или координационного взаимодействия анионов со специальной кристаллической гранью частиц [26]. Следовательно, меняя источник меди, мы могли получать частицы с другой морфологией.
ПЭМ-изображения наножидкостей CuO, приготовленных с использованием различных солей меди . (а) CuCl 2 ·2H 2 O; (b) Cu(NO 3 ) 2 ·3H 2 O.
Полноразмерное изображение
Влияние концентрации ацетата меди
концентрации ацетата 0,1 и 0,4 моль·л -1 соответственно. По сравнению с типичными наножидкостями (полученными с концентрацией 0,2 моль·л -1 ), видно, что размер первичных наночастиц остается практически одинаковым (около 10 нм), но морфология и размер кластера наночастиц изменяются с увеличением концентрации ацетата меди. При концентрации 0,1 моль·л -1 кластеры также представляют собой цепочечные структуры с длиной в диапазоне 100-200 нм. Он длиннее кластеров в типичных образцах. При концентрации 0,4 моль·л -1 первичные наночастицы агрегируют и образуют неправильные кластеры, состоящие из 2-30 первичных наночастиц. Образование цепочечного кластера может быть связано с механизмом ориентационной адгезии [27]. При низкой концентрации ацетата меди вероятность столкновения первичных наночастиц CuO мала; таким образом, в процессе реакции преобладает ориентационная адгезия. Следовательно, изменяя концентрацию ацетата меди, можно регулировать размер и структуру кластера.
Следовательно, изменяя концентрацию ацетата меди, можно регулировать размер и структуру кластера.
ПЭМ-изображения наножидкостей CuO, приготовленных с различными концентрациями (CH 3 Главный операционный директор 2 Cu·H 2 Раствор О . (а) 0,1 моль·л -1 ; (б) 0,4 моль·л -1 .
Изображение в полный размер
Влияние времени реакции
На рис. 5 представлены ПЭМ-изображения наножидкостей CuO, полученные при различном времени реакции. При времени реакции 12 ч (рис. 5а) средний размер первичных наночастиц CuO составляет около 10 нм. Наночастицы CuO образуют изгибные цепочки, состоящие из 30-50 первичных частиц. Она длиннее, чем цепочка в типичном образце (рис. 2б). При увеличении времени реакции до 25 ч (рис. 5б) размер первичных частиц также составляет около 10 нм, но цепочечных кластеров больше не существует. Вместо этого есть небольшие агрегаты, состоящие из нескольких первичных частиц. Как упоминалось выше, механизм образования цепочечного кластера – ориентационная адгезия. С увеличением времени реакции степень ориентационной адгезии увеличивается; и, таким образом, длина кластера увеличивается. Почему цепочечные кластеры разрушаются, когда время реакции составляет 25 часов? Это требует более детального изучения в будущих исследованиях. Приведенные выше результаты показывают, что различные микроструктуры могут быть получены путем изменения времени реакции.
5б) размер первичных частиц также составляет около 10 нм, но цепочечных кластеров больше не существует. Вместо этого есть небольшие агрегаты, состоящие из нескольких первичных частиц. Как упоминалось выше, механизм образования цепочечного кластера – ориентационная адгезия. С увеличением времени реакции степень ориентационной адгезии увеличивается; и, таким образом, длина кластера увеличивается. Почему цепочечные кластеры разрушаются, когда время реакции составляет 25 часов? Это требует более детального изучения в будущих исследованиях. Приведенные выше результаты показывают, что различные микроструктуры могут быть получены путем изменения времени реакции.
ПЭМ-изображения наножидкостей CuO, синтезированных при различном времени реакции . (а) 12 ч; (б) 25 час.
Полный размер
Теплопроводность наножидкостей CuO
На рис. 6 показано отношение теплопроводности типичного образца, определяемое как k / k 0 , где k 6 и k – теплопроводности наножидкостей и базовых сред (H 2 O) соответственно в зависимости от объемной доли частиц при 25°C.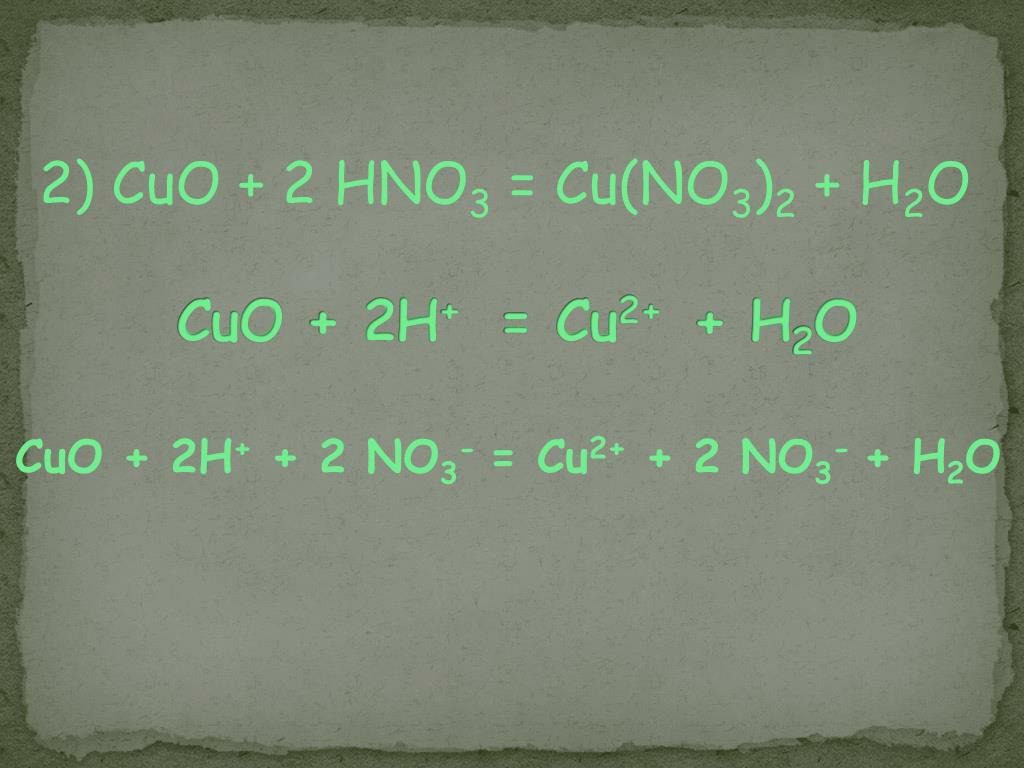 Теплопроводность базовой жидкости (H 2 O) была измерена, и она имела среднее значение 0,580 Вт·м -1 ·K -1 . Видно, что коэффициент теплопроводности увеличивается с увеличением объемной доли частиц. Это хорошо согласуется с некоторыми исследованиями, в которых теплопроводность наножидкостей также увеличивается линейно с увеличением загрузки частиц [28, 29]. При сравнении с некоторыми опубликованными экспериментальными результатами наножидкостей CuO текущие данные оказались близкими к данным Ли и др., данным Даса и др. и данным Лю и др. [30–32], что предполагает потенциальное применение в качестве теплоносителей.
Теплопроводность базовой жидкости (H 2 O) была измерена, и она имела среднее значение 0,580 Вт·м -1 ·K -1 . Видно, что коэффициент теплопроводности увеличивается с увеличением объемной доли частиц. Это хорошо согласуется с некоторыми исследованиями, в которых теплопроводность наножидкостей также увеличивается линейно с увеличением загрузки частиц [28, 29]. При сравнении с некоторыми опубликованными экспериментальными результатами наножидкостей CuO текущие данные оказались близкими к данным Ли и др., данным Даса и др. и данным Лю и др. [30–32], что предполагает потенциальное применение в качестве теплоносителей.
Коэффициент теплопроводности как функция объемной доли CuO при 25°C .
Изображение полного размера
Заключение
Успешно разработан мокрый химический метод синтеза стабильных наножидкостей CuO в больших масштабах. Исследовано влияние параметров синтеза на микроструктуру наножидкостей.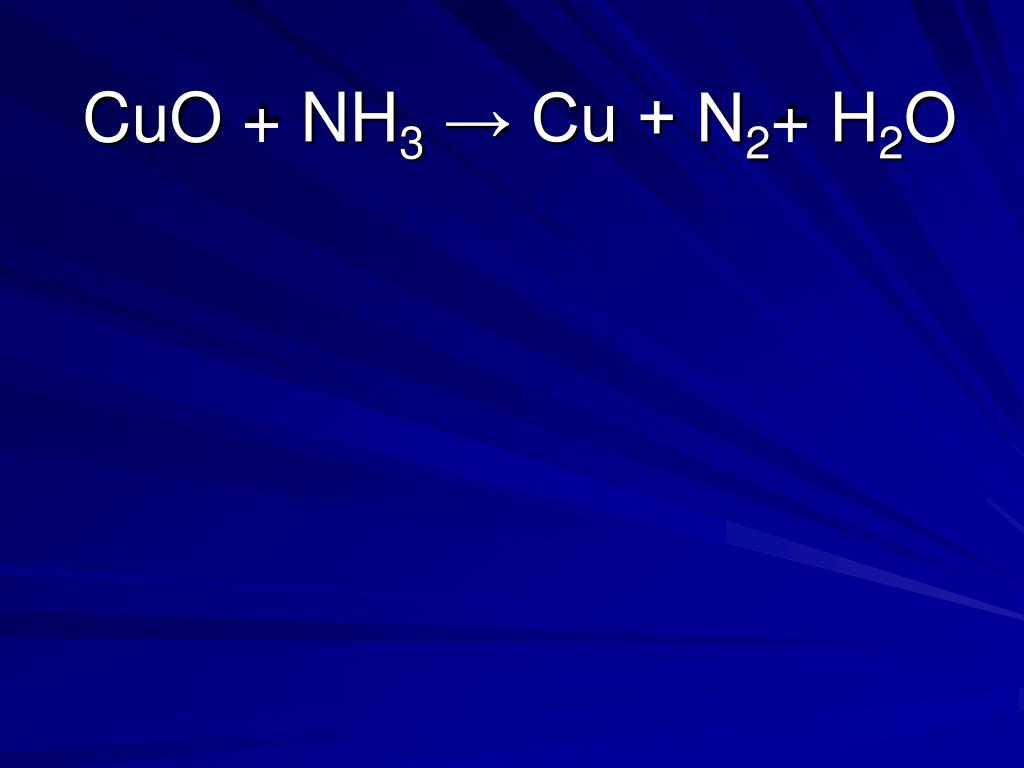 Различные соли меди приводили к различной морфологии частиц. Концентрация ацетата меди и время реакции влияли на размер и форму кластеров первичных наночастиц. Наножидкости с различной микроструктурой могут быть получены путем изменения параметров синтеза. Теплопроводность наножидкостей CuO увеличивалась с увеличением загрузки частиц. Ожидается, что этот метод может быть расширен для синтеза других наножидкостей.
Различные соли меди приводили к различной морфологии частиц. Концентрация ацетата меди и время реакции влияли на размер и форму кластеров первичных наночастиц. Наножидкости с различной микроструктурой могут быть получены путем изменения параметров синтеза. Теплопроводность наножидкостей CuO увеличивалась с увеличением загрузки частиц. Ожидается, что этот метод может быть расширен для синтеза других наножидкостей.
Сокращения
- DECM:
Метод прямого испарения и конденсации
- SANSS:
Система синтеза наночастиц под флюсом
- ТЕМ:
просвечивающая электронная микроскопия
- XRD:
Рентгеноструктурный анализ.
Ссылки
- «>
Choi SUS: Повышение теплопроводности жидкостей с помощью наночастиц. В разработках и приложениях неньютоновских течений . Монтаж: Сингер Д.А., Ван Х.П. Нью-Йорк: Американское общество инженеров-механиков; 1995: 99–105.
Google ученый
Das SK, Choi SUS, Yu W, Pradeep T: Nanofluids: Science and Technology . Нью-Джерси: John Wiley & Sons, Inc.; 2007.
Книга Google ученый
Zhu HT, Liu SQ, Xu L, Zhang CY: Подготовка, характеристика и тепловые свойства наножидкостей. В Передовые разработки в области нанотехнологий . Под редакцией: Сабатини Д.М. Нью-Йорк: Издательство NOVA Science; 2008: 5–38.
Google ученый
Ву Д.С., Чжу Х.Т., Ван Л.К., Лю Л.М.: Критические вопросы подготовки наножидкостей, определения характеристик и теплопроводности.
 Curr Nanosci 2009, 5: 103–112. 10.2174/157341309787314548
Curr Nanosci 2009, 5: 103–112. 10.2174/157341309787314548Артикул Google ученый
Кришнамурти С., Лхаттачарья П., Фелан П.Е., Прашер Р.С.: Улучшенный массоперенос в наножидкостях. Nano Lett 2006, 6: 419–423. 10.1021/nl0522532
Артикул Google ученый
Курси Дж.С., Ким Дж.: Кипение наножидкости: эффект смачиваемости поверхности. Int J Heat Fluid Fl 2008, 29: 1577–1585. 10.1016/j.ijheatfluidflow.2008.07.004
Артикул Google ученый
Васан Д.Т., Николов А.Д. Растекание наножидкостей по твердым телам. Природа 2003, 423: 156–159. 10.1038/nature01591
Артикул Google ученый
Choi SUS: Наножидкости: от видения к реальности через исследования.
 Дж Теплообмен 2009, 131: 0331061–0331069. 10.1115/1.3056479
Дж Теплообмен 2009, 131: 0331061–0331069. 10.1115/1.3056479Артикул Google ученый
Li YJ, Zhou JE, Tung S, Schneider E, Xi SQ: Обзор развития подготовки и характеристики наножидкости. Порошковая технология 2009, 196: 89–101. 10.1016/j.powtec.2009.07.025
Артикул Google ученый
Zhang YX, Jiang W, Wang LQ: Микрожидкостный синтез медных наножидкостей. Microfluid Nanofluid 2010, 9: 727–735. 10.1007/s10404-010-0586-3
Артикул Google ученый
Wei XH, Wang LQ: Микрожидкостный метод синтеза наножидкостей Cu 2 O. J Thermophys Heat Transfer 2010, 24: 445–448. 10.2514/1.48984
Артикул Google ученый
Картикеян Н.
 Р., Филип Дж., Радж Б.: Влияние кластеризации на теплопроводность наножидкостей. Mater Chem Phys 2008, 109: 50–55. 10.1016/j.matchemphys.2007.10.029
Р., Филип Дж., Радж Б.: Влияние кластеризации на теплопроводность наножидкостей. Mater Chem Phys 2008, 109: 50–55. 10.1016/j.matchemphys.2007.10.029Статья Google ученый
Xuan YM, Li Q: Повышение теплопередачи наножидкостей. Int J Heat Fluid Fl 2000, 21: 58–64. 10.1016/S0142-727X(99)00067-3
Артикул Google ученый
Чой С.Ю.С., Чжан З.Г., Ю.В., Локвуд Ф.Е., Грулке Э.А.: Повышение аномальной теплопроводности в суспензиях нанотрубок. Appl Phys Lett 2001, 79: 2252–2254. 10.1063/1.1408272
Артикул Google ученый
Xie HQ, Lee H, Youn W, Choi M: Наножидкости, содержащие многостенные углеродные нанотрубки и их повышенную теплопроводность. J Appl Phys 2003, 94: 4967–4971. 10.1063/1.1613374
Артикул Google ученый
- «>
Хонг Т.К., Ян Х.С., Чой К.Дж.: Исследование повышенной теплопроводности наножидкостей Fe. J Appl Phys 2005, 97: 064311–0643114. 10.1063/1.1861145
Артикул Google ученый
Ko GH, Heo K, Lee K, Kim DS, Kim C, Sohn Y, Choi M: Экспериментальное исследование падения давления наножидкостей, содержащих углеродные нанотрубки, в горизонтальной трубке. Int J Heat Mass Transfer 2007, 50: 4749–4753. 10.1016/ж.ijтепломассообмен.2007.03.029
Статья Google ученый
Wu SY, Zhu SY, Zhang XR, Huang J: Подготовка и характеристики плавления/замораживания наножидкости Cu/Paraffin в качестве материала с фазовым переходом (PCM). Энергетическое топливо 2010, 24: 1894–1898. 10.1021/ef67
Артикул Google ученый
Истман Дж.
 А., Чой С. С., Ли С., Ю. В., Томпсон Л. Дж.: Аномально повышенная эффективная теплопроводность наножидкостей на основе этиленгликоля, содержащих наночастицы меди. Appl Phys Lett 2001, 78: 718–720. 10.1063/1.1341218
А., Чой С. С., Ли С., Ю. В., Томпсон Л. Дж.: Аномально повышенная эффективная теплопроводность наножидкостей на основе этиленгликоля, содержащих наночастицы меди. Appl Phys Lett 2001, 78: 718–720. 10.1063/1.1341218Артикул Google ученый
Lo CH, Tsung TT, Chen LC: Контролируемый формой синтез наножидкости на основе Cu с использованием системы синтеза наночастиц с погруженной дугой (SANSS). J Cryst Growth 2005, 277: 636–642. 10.1016/j.jcrysgro.2005.01.067
Артикул Google ученый
Chang H, Chen H, Jwo CS, Chen SL: Электростатическая и стерическая стабилизация наножидкости CuO, приготовленной с помощью системы синтеза наножидкости с вакуумно-дуговым распылением (ASNSS). Mater Trans 2009, 50: 2098–2103. 10.2320/матертранс.M2009129
Артикул Google ученый
- «>
Phuoc TX, Soong Y, Chyu MK: Синтез наножидкостей Ag-деионизированной воды с использованием многолучевой лазерной абляции в жидкостях. Opt Lasers Eng 2007, 45: 1099–1106. 10.1016/j.optlaseng.2007.06.005
Статья Google ученый
Zhu HT, Lin YS, Yin YS: Новый одностадийный химический метод приготовления медных наножидкостей. J Коллоидный интерфейс Sci 2004, 277: 100–103. 10.1016/j.jcis.2004.04.026
Статья Google ученый
Zhu YS, Zhang CY, Liu SQ, Tang YM, Yin YS: Влияние кластеризации и выравнивания наночастиц на теплопроводность Fe 3 O 4 водных наножидкостей. Appl Phys Lett 2006, 89: 0231231–0231233.
Google ученый
Zhu HT, Zhang CY, Tang YM, Wang JX: Новый синтез и теплопроводность наножидкости CuO.
 J Phys Chem C 2007, 111: 1646–1650. 10.1021/jp065926t
J Phys Chem C 2007, 111: 1646–1650. 10.1021/jp065926tАртикул Google ученый
Чжун В.З., Хуа С.К.: Координационные полиэдры анионов и морфология кристаллов. В Морфология роста кристаллов . Пекин: научное издательство; 1999: 114–126.
Google ученый
Teo JJ, Chang Y, Zeng HC: Изготовление полых нанокубов Cu 2 O и Cu посредством восстановительной самосборки нанокристаллов CuO. Ленгмюр 2006, 22: 7369–7377. 10.1021/la060439q
Артикул Google ученый
Шима П.Д., Филип Дж., Радж Б.: Влияние агрегации на теплопроводность в стабильных и нестабильных наножидкостях. Appl Phys Lett 2010, 97: 1531131–1531133. 10.1063/1.3497280
Артикул Google ученый
- «>
Филип Дж., Шима П.Д., Радж Б.: Доказательства повышенной теплопроводности через перколяционные структуры в наножидкостях. Нанотехнологии 2008, 19: 3057061–3057067. 10.1088/0957-4484/19/30/305706
Артикул Google ученый
Lee S, Choi SUS, Li S, Eastman JA: Измерение теплопроводности жидкостей, содержащих оксидные наночастицы. J Heat Transfer 1999, 121: 280–289. 10.1115/1.2825978
Артикул Google ученый
Дас С.К., Путра Н., Тисен П., Ретцель В.: Температурная зависимость улучшения теплопроводности наножидкостей. Дж Теплопередача 2003, 125: 567–574. 10.1115/1.1571080
Артикул Google ученый
Liu MS, Lin MCC, Huang IT, Wang CC: Повышение теплопроводности CuO для наножидкостей. Chem Eng Technol 2006, 29: 72–77.
 10.1002/ceat.200500184
10.1002/ceat.200500184Артикул Google ученый
СПРАВЕДЕНИЯ СПИСОК ЛИТЕРАТУРЫ
Информация о авторе
Авторы и принадлежность
Колледж материалов и инженерии, Qingdao Университет науки и технологии, Qingdao, 266042, China
. Ву и Каньинг Чжан
Авторы
- Haitao Zhu
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Dongxiao Han
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Zhaoguo Meng
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Daxiong Wu
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Canying Zhang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Хайтао Чжу.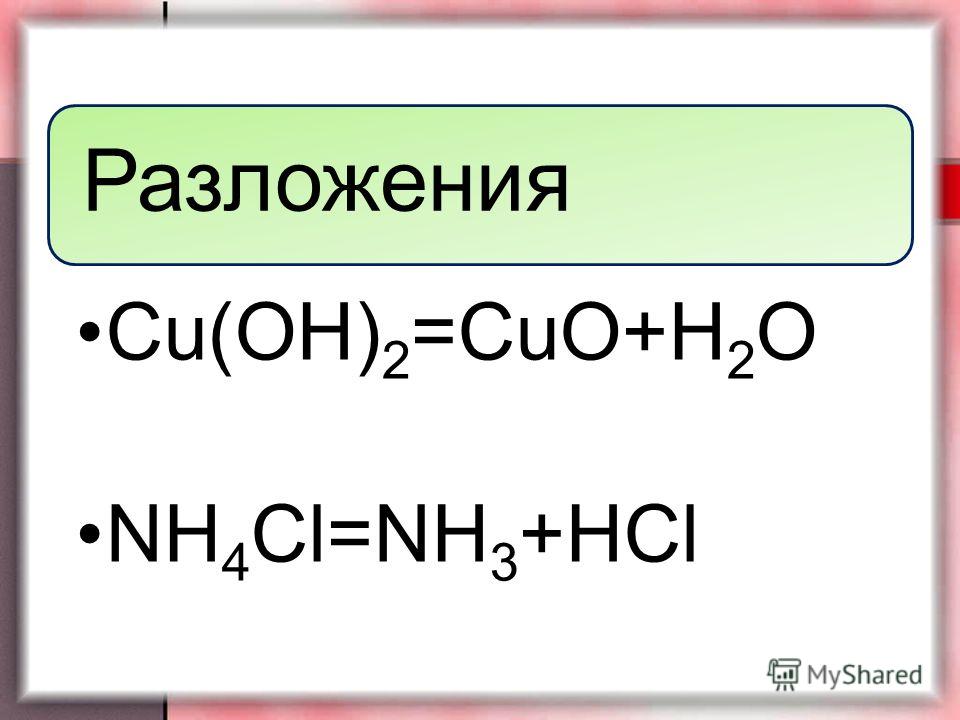
Дополнительная информация
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Вклад авторов
HZ разработал и руководил всеми аспектами работы. DH провел эксперименты и составил рукопись. ZM, DW и CZ участвовали в разработке исследования и редактировали рукопись.
Оригинальные файлы, представленные авторами для изображений
Ниже приведены ссылки на оригинальные файлы, представленные авторами для изображений.
Авторский файл рисунка 1
Authors’ original file for figure 2
Authors’ original file for figure 3
Authors’ original file for figure 4
Authors’ original file for figure 5
Authors’ исходный файл для рисунка 6
Права и разрешения
Открытый доступ Эта статья распространяется на условиях международной лицензии Creative Commons Attribution 2.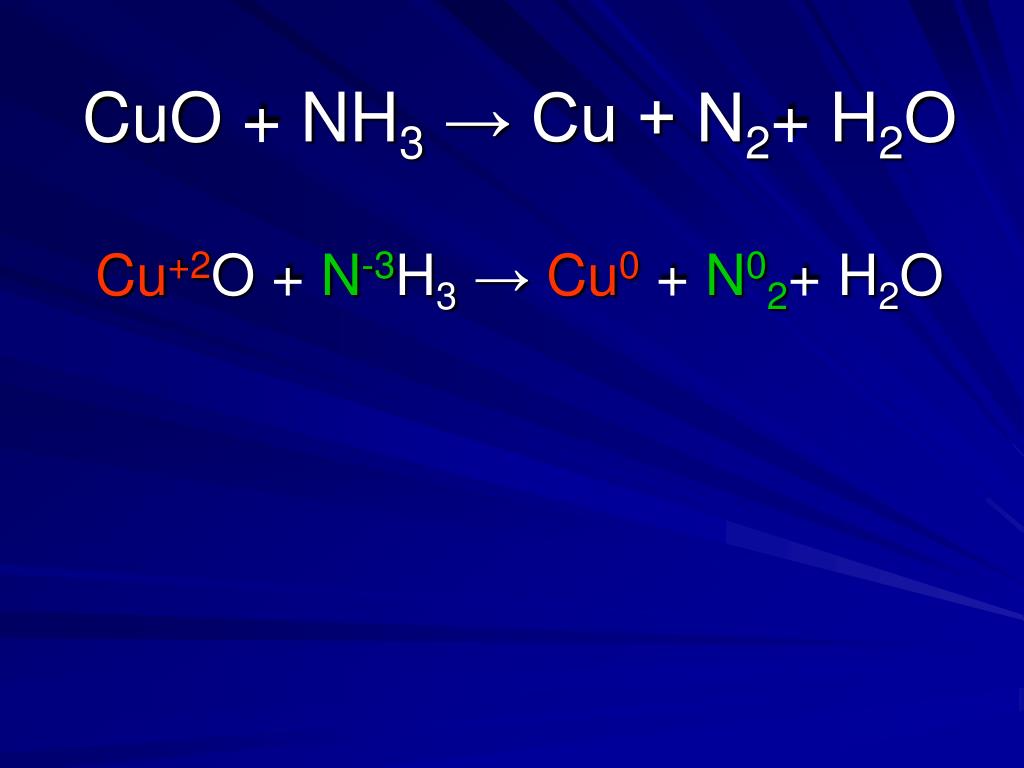

 обращений
обращений Curr Nanosci 2009, 5: 103–112. 10.2174/157341309787314548
Curr Nanosci 2009, 5: 103–112. 10.2174/157341309787314548 Дж Теплообмен 2009, 131: 0331061–0331069. 10.1115/1.3056479
Дж Теплообмен 2009, 131: 0331061–0331069. 10.1115/1.3056479 Р., Филип Дж., Радж Б.: Влияние кластеризации на теплопроводность наножидкостей. Mater Chem Phys 2008, 109: 50–55. 10.1016/j.matchemphys.2007.10.029
Р., Филип Дж., Радж Б.: Влияние кластеризации на теплопроводность наножидкостей. Mater Chem Phys 2008, 109: 50–55. 10.1016/j.matchemphys.2007.10.029 А., Чой С. С., Ли С., Ю. В., Томпсон Л. Дж.: Аномально повышенная эффективная теплопроводность наножидкостей на основе этиленгликоля, содержащих наночастицы меди. Appl Phys Lett 2001, 78: 718–720. 10.1063/1.1341218
А., Чой С. С., Ли С., Ю. В., Томпсон Л. Дж.: Аномально повышенная эффективная теплопроводность наножидкостей на основе этиленгликоля, содержащих наночастицы меди. Appl Phys Lett 2001, 78: 718–720. 10.1063/1.1341218 J Phys Chem C 2007, 111: 1646–1650. 10.1021/jp065926t
J Phys Chem C 2007, 111: 1646–1650. 10.1021/jp065926t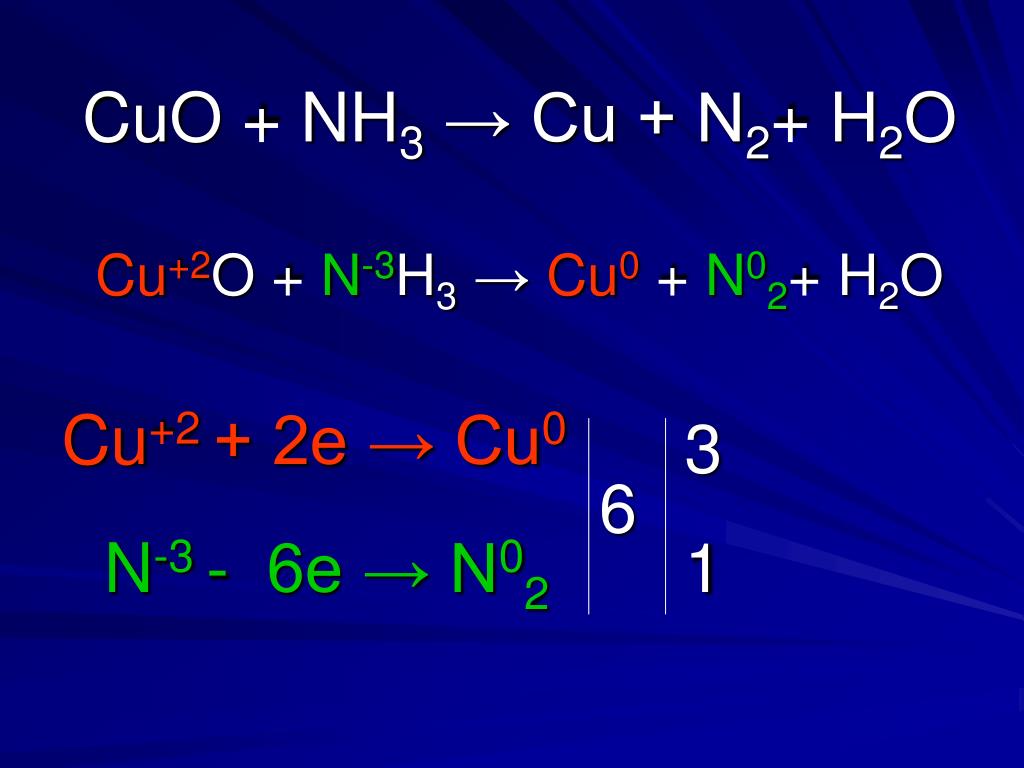 10.1002/ceat.200500184
10.1002/ceat.200500184