| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Количество протонов, нейтронов и электронов химических элементов
Количество протонов, нейтронов и электронов химических элементов.

Поделитесь информацией:
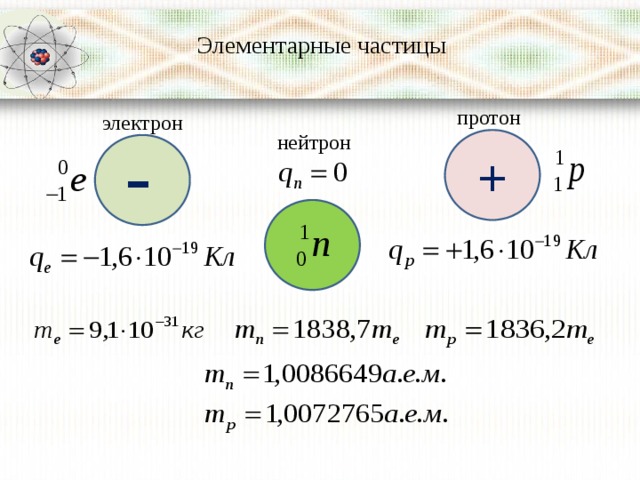
Протон (от др.-греч. πρῶτος – «первый, основной») – элементарная частица, имеющая электрический заряд +1e.
Нейтрон (от лат. neuter – «ни тот, ни другой») – тяжёлая элементарная частица, не имеющая электрического заряда.
Электрон (от др.-греч. ἤλεκτρον – «янтарь») – стабильная отрицательно заряженная элементарная частица. Считается фундаментальной частицей (не имеющей, насколько это известно, составных частей) и является одной из основных структурных единиц вещества.
Количество протонов, нейтронов и электронов химических элементов (1 часть):
| Атомный номер | Химический элемент
| Символ | Количество электронов, протонов и нейтронов |
| 1 | Водород | H | 1 электрон, 1 протон, 0 нейтронов |
| 2 | Гелий | He | 2 электрона, 2 протона, 2 нейтрона |
| 3 | Литий | Li | 3 электрона, 3 протона, 4 нейтрона |
| 4 | Бериллий | Be | 4 электрона, 4 протона, 5 нейтронов |
| 5 | Бор | B | 5 электронов, 5 протонов, 6 нейтронов |
| 6 | Углерод | C | 6 электронов, 6 протонов, 6 нейтронов |
| 7 | Азот | N | 7 электронов, 7 протонов, 7 нейтронов |
| 8 | Кислород | O | 8 электронов, 8 протонов, 8 нейтронов |
| 9 | Фтор | F | 9 электронов, 9 протонов, 10 нейтронов |
| 10 | Неон | Ne | 10 электронов, 10 протонов, 10 нейтронов |
| 11 | Натрий | Na | 11 электронов, 11 протонов, 12 нейтронов |
| 12 | Магний | Mg | 12 электронов, 12 протонов, 12 нейтронов |
| 13 | Алюминий | Al | 13 электронов, 13 протонов, 14 нейтронов |
| 14 | Кремний | Si | 14 электронов, 14 протонов, 14 нейтронов |
| 15 | Фосфор | P | 15 электронов, 15 протонов, 16 нейтронов |
| 16 | Сера | S | 16 электронов, 16 протонов, 16 нейтронов |
| 17 | Хлор | Cl | 17 электронов, 17 протонов, 18 нейтронов |
| 18 | Аргон | Ar | 18 электронов, 18 протонов, 22 нейтронов |
| 19 | Калий | K | 19 электронов, 19 протонов, 20 нейтронов |
| 20 | Кальций | Ca | 20 электронов, 20 протонов, 20 нейтронов |
| 21 | Скандий | Sc | 21 электрон, 21 протон, 24 нейтрона |
| 22 | Титан | Ti | 22 электрона, 22 протона, 26 нейтронов |
| 23 | Ванадий | V | 23 электрона, 23 протона, 28 нейтронов |
| 24 | Хром | Cr | 24 электрона, 24 протона, 28 нейтронов |
| 25 | Марганец | Mn | 25 электронов, 25 протонов, 30 нейтронов |
| 26 | Железо | Fe | 26 электронов, 26 протонов, 30 нейтронов |
| 27 | Кобальт | Co | 27 электронов, 27 протонов, 32 нейтрона |
| 28 | Никель | Ni | 28 электронов, 28 протонов, 31 нейтрон |
| 29 | Медь | Cu | 29 электронов, 29 протонов, 35 нейтронов |
| 30 | Цинк | Zn | 30 электронов, 30 протонов, 35 нейтронов |
| 31 | Галлий | Ga | 31 электрон, 31 протон, 39 нейтронов |
| 32 | Германий | Ge | 32 электрона, 32 протона, 41 нейтрон |
| 33 | Мышьяк | As | 33 электрона, 33 протона, 42 нейтрона |
| 34 | Селен | Se | 34 электрона, 34 протона, 45 нейтронов |
| 35 | Бром | Br | 35 электронов, 35 протонов, 45 нейтронов |
Количество протонов, нейтронов и электронов химических элементов (2 часть):
| 36 | Криптон | Kr | 36 электронов, 36 протонов, 48 нейтронов |
| 37 | Рубидий | Rb | 37 электронов, 37 протонов, 48 нейтронов |
| 38 | Стронций | Sr | 38 электронов, 38 протонов, 50 нейтронов |
| 39 | Иттрий | Y | 39 электронов, 39 протонов, 50 нейтронов |
| 40 | Цирконий | Zr | 40 электронов, 40 протонов, 51 нейтрон |
| 41 | Ниобий | Nb | 41 электрон, 41 протон, 52 нейтрона |
| 42 | Молибден | Mo | 42 электрона, 42 протона, 54 нейтрона |
| 43 | Технеций | Tc | 43 электрона, 43 протона, 55 нейтронов |
| 44 | Рутений | Ru | 44 электрона, 44 протона, 57 нейтронов |
| 45 | Родий | Rh | 45 электронов, 45 протонов, 58 нейтронов |
| 46 | Палладий | Pd | 46 электронов, 46 протонов, 60 нейтронов |
| 47 | Серебро | Ag | 47 электронов, 47 протонов, 61 нейтрон |
| 48 | Кадмий | Cd | 48 электронов, 48 протонов, 64 нейтрон |
| 49 | Индий | In | 49 электронов, 49 протонов, 66 нейтронов |
| 50 | Олово | Sn | 50 электронов, 50 протонов, 69 нейтронов |
| 51 | Сурьма | Sb | 51 электрон, 51 протон, 71 нейтрон |
| 52 | Теллур | Te | 52 электрона, 52 протона, 76 нейтронов |
| 53 | Йод | I | 53 электрона, 53 протона, 74 нейтронов |
| 54 | Ксенон | Xe | 54 электрона, 54 протона, 77 нейтронов |
| 55 | Цезий | Cs | 55 электронов, 55 протонов, 78 нейтронов |
| 56 | Барий | Ba | 56 электронов, 56 протонов, 81 нейтрон |
| 57 | Лантан | La | 57 электронов, 57 протонов, 82 нейтрона |
| 58 | Церий | Ce | 58 электронов, 58 протонов, 82 нейтрона |
| 59 | Празеодим | Pr | 59 электронов, 59 протонов, 82 нейтрона |
| 60 | Неодим | Nd | 60 электронов, 60 протонов, 84 нейтрона |
| 61 | Прометий | Pm | 61 электрон, 61 протон, 84 нейтрона |
| 62 | Самарий | Sm | 62 электрона, 62 протона, 88 нейтронов |
| 63 | Европий | Eu | 63 электрона, 63 протона, 89 нейтронов |
| 64 | Гадолиний | Gd | 64 электрона, 64 протона, 93 нейтрона |
| 65 | Тербий | Tb | 65 электронов, 65 протонов, 94 нейтрона |
| 66 | Диспрозий | Dy | 66 электронов, 66 протонов, 97 нейтронов |
| 67 | Гольмий | Ho | 67 электронов, 67 протонов, 98 нейтронов |
| 68 | Эрбий | Er | 68 электронов, 68 протонов, 99 нейтронов |
| 69 | Тулий | Tm | 69 электронов, 69 протонов, 100 нейтронов |
| 70 | Иттербий | Yb | 70 электронов, 70 протонов, 103 нейтрона |
Количество протонов, нейтронов и электронов химических элементов (3 часть):
| 71 | Лютеций | Lu | 71 электрон, 71 протон, 104 нейтрона |
| 72 | Гафний | Hf | 72 электрона, 72 протона, 106 нейтронов |
| 73 | Тантал | Ta | 73 электрона, 73 протона, 108 нейтронов |
| 74 | Вольфрам | W | 74 электрона, 74 протона, 110 нейтронов |
| 75 | Рений | Re | 75 электронов, 75 протонов, 111 нейтронов |
| 76 | Осмий | Os | 76 электронов, 76 протонов, 114 нейтронов |
| 77 | Иридий | Ir | 77 электронов, 77 протонов, 115 нейтронов |
| 78 | Платина | Pt | 78 электронов, 78 протонов, 117 нейтронов |
| 79 | Золото | Au | 79 электронов, 79 протонов, 118 нейтронов |
| 80 | Ртуть | Hg | 80 электронов, 80 протонов, 121 нейтрон |
| 81 | Таллий | Tl | 81 электрон, 81 протон, 123 нейтрона |
| 82 | Свинец | Pb | 82 электрона, 82 протона, 125 нейтронов |
| 83 | Висмут | Bi | 83 электрона, 83 протона, 126 нейтронов |
| 84 | Полоний | Po | 84 электрона, 84 протона, 125 нейтронов |
| 85 | Астат | At | 85 электронов, 85 протонов, 125 нейтронов |
| 86 | Радон | Rn | 86 электронов, 86 протонов, 136 нейтронов |
| 87 | Франций | Fr | 87 электронов, 87 протонов, 136 нейтронов |
| 88 | Радий | Ra | 88 электронов, 88 протонов, 138 нейтронов |
| 89 | Актиний | Ac | 89 электронов, 89 протонов, 138 нейтронов |
| 90 | Торий | Th | 90 электронов, 90 протонов, 142 нейтрона |
| 91 | Протактиний | Pa | 91 электрон, 91 протон, 140 нейтронов |
| 92 | Уран | U | 92 электрона, 92 протона, 146 нейтронов |
| 93 | Нептуний | Np | 93 электрона, 93 протона, 144 нейтрона |
| 94 | Плутоний | Pu | 94 электрона, 94 протона, 150 нейтрона |
| 95 | Америций | Am | 95 электронов, 95 протонов, 148 нейтронов |
| 96 | Кюрий | Cm | 96 электронов, 96 протонов, 151 нейтрон |
| 97 | Берклий | Bk | 97 электронов, 97 протонов, 150 нейтронов |
| 98 | Калифорний | Cf | 98 электронов, 98 протонов, 153 нейтрона |
| 99 | Эйнштейний | Es | 99 электронов, 99 протонов, 153 нейтрона |
| 100 | Фермий | Fm | 100 электронов, 100 протонов, 157 нейтронов |
| 101 | Менделевий | Md | 101 электрон, 101 протон, 157 нейтронов |
| 102 | Нобелий | No | 102 электрона, 102 протона, 157 нейтронов |
| 103 | Лоуренсий | Lr | 103 электрона, 103 протона, 163 нейтрона |
| 104 | Резерфордий (Курчатовий) | Rf | 104 электрона, 104 протона, 157 нейтронов |
| 105 | Дубний (Нильсборий) | Db | 105 электронов, 105 протонов, 157 нейтронов |
| 106 | Сиборгий | Sg | 106 электронов, 106 протонов, 163 нейтронов |
| 107 | Борий | Bh | 107 электронов, 107 протонов, 160 нейтронов |
| 108 | Хассий | Hs | 108 электронов, 108 протонов, 161 нейтрон |
| 109 | Мейтнерий | Mt | 109 электронов, 109 протонов, 169 нейтронов |
| 110 | Дармштадтий | Ds | 110 электронов, 110 протонов, 171 нейтрон |
Коэффициент востребованности 4 648
Строение атома и электронные конфигурации 1.
 0На этой странице вы узнаете
0На этой странице вы узнаете - Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атомаВеликие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома.  В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:
Характеристика элементарных частицИз таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
| Один водород, но три лучше: что такое изотопы? Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n! |
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
| Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме (№ элемента = p = Z = ē) Число нейтронов = массовое число – порядковый номер (n = Ar — № элемента) |
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями).
 Нумерация слоев начинается с ближайшего к ядру электронного слоя.
Нумерация слоев начинается с ближайшего к ядру электронного слоя. - На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.
На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атомПри заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11
| Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.

У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.

Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Цинк — Протоны — Нейтроны — Электроны
В некоторых отношениях цинк химически подобен магнию: оба элемента имеют только одну нормальную степень окисления (+2), а ионы Zn2+ и Mg2+ имеют одинаковый размер. Коррозионно-стойкое цинкование железа (горячее цинкование) является основным применением цинка. Покрытие стали представляет собой самое широкое применение цинка, но он используется в больших количествах в отливках из цинковых сплавов, в виде цинковой пыли и оксида, а также в кованых изделиях из цинка. Около 70 % цинка в мире поступает из горнодобывающей промышленности, а остальные 30 % — из переработки вторичного цинка.
Коррозионно-стойкое цинкование железа (горячее цинкование) является основным применением цинка. Покрытие стали представляет собой самое широкое применение цинка, но он используется в больших количествах в отливках из цинковых сплавов, в виде цинковой пыли и оксида, а также в кованых изделиях из цинка. Около 70 % цинка в мире поступает из горнодобывающей промышленности, а остальные 30 % — из переработки вторичного цинка.
Протоны и нейтроны в цинке
Цинк — это химический элемент с атомным номером 30 , что означает, что в его ядре 30 протонов. Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулонов .
Общее число нейтронов в ядре атома называется номер нейтрона атома и обозначен символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно используется множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Цинк 64; 66-68; 70.
Основные изотопы цинка
В природе встречаются пять стабильных изотопов цинка, из которых 64 Zn является наиболее распространенным изотопом (49,17% естественного содержания).
Цинк-64 состоит из 30 протонов, 34 нейтронов и 30 электронов.
Цинк-66 состоит из 30 протонов, 36 нейтронов и 30 электронов.
Цинк-67 состоит из 30 протонов, 37 нейтронов и 30 электронов.
Цинк-68 состоит из 30 протонов, 38 нейтронов и 30 электронов.
Цинк-70 состоит из 30 протонов, 40 нейтронов и 30 электронов.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме Цинк равно 30. На каждый электрон влияют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Цинк : [Ar] 3d10 4s2 .
Возможные степени окисления +2 .
Цинк имеет электронную конфигурацию [Ar]3d 10 4s 2 и является членом 12 группы Периодической таблицы. Это умеренно реактивный металл и сильный восстановитель. Поверхность чистого металла быстро тускнеет, со временем образуя защитный пассивирующий слой из основного карбоната цинка, Zn 5 (OH) 6 (CO 3 ) 2 , путем реакции с атмосферным двуокисью углерода.
В химическом составе цинка преобладает степень окисления +2. Когда образуются соединения в этой степени окисления, электроны внешней оболочки s теряются, в результате чего образуется чистый ион цинка с электронной конфигурацией [Ar]3d 10 .
Важнейший сплав цинка
Zamak представляет собой семейство сплавов на основе цинка и легирующих элементов из алюминия, магния и меди. Сплавы цинка с небольшими количествами меди, алюминия и магния используются при литье под давлением, а также при центробежном литье, особенно в автомобильной, электротехнической и метизной промышленности. Цинковые сплавы имеют низкие температуры плавления, требуют относительно небольшого подвода тепла, не требуют флюса или защитной атмосферы. Из-за их высокой текучести цинковые сплавы могут быть отлиты с гораздо более тонкими стенками, чем другие сплавы для литья под давлением, и они могут быть отлиты под давлением с более жесткими допусками на размеры.
Сплавы цинка с небольшими количествами меди, алюминия и магния используются при литье под давлением, а также при центробежном литье, особенно в автомобильной, электротехнической и метизной промышленности. Цинковые сплавы имеют низкие температуры плавления, требуют относительно небольшого подвода тепла, не требуют флюса или защитной атмосферы. Из-за их высокой текучести цинковые сплавы могут быть отлиты с гораздо более тонкими стенками, чем другие сплавы для литья под давлением, и они могут быть отлиты под давлением с более жесткими допусками на размеры.
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной протонов много, и они составляют примерно половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и это спин – ½ фермиона.
раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и это спин – ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонами , связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20-м веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон — это одна из субатомных частиц, составляющих материю. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. У него нет электрического заряда , а масса покоя равна 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой из-за своего положительного заряда. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате с увеличением числа протонов для образования стабильного ядра требуется увеличивающееся соотношение нейтронов и протонов . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распад, бета-распад или захват электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующий выброс гамма-излучения . Чистые альфа- или бета-распады очень редки.
Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующий выброс гамма-излучения . Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически количеством и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип запрета Паули, который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочки. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d представляет собой 10 средних столбцов периодической таблицы, а блок f представляет собой раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d представляет собой 10 средних столбцов периодической таблицы, а блок f представляет собой раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными.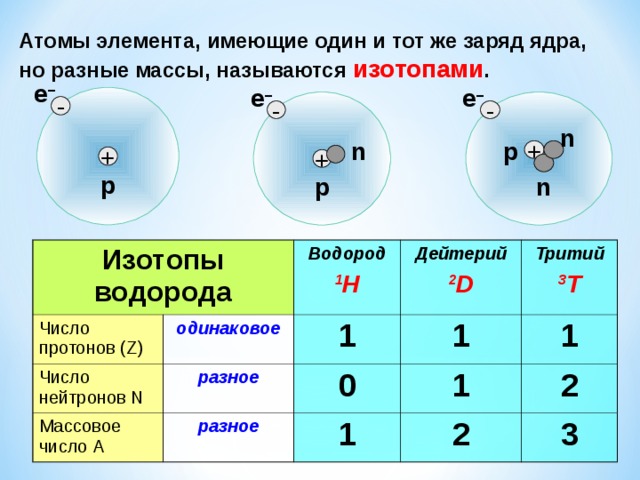 Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.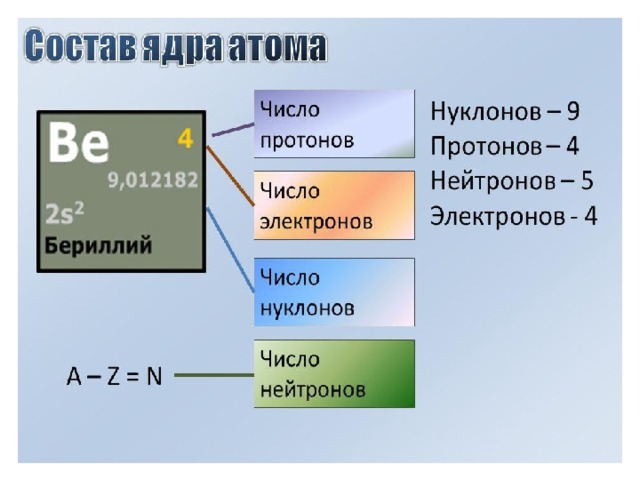
Сводка
| Элемент | Цинк |
| Количество протонов | 30 |
| Количество нейтронов (типичные изотопы) | 64; 66-68; 70 |
| Количество электронов | 30 |
| Электронная конфигурация | [Ар] 3d10 4s2 |
| Степени окисления | +2 |
Источник: www.luciteria.com
Свойства других элементов
Другие свойства цинка
Что такое радиоактивный период полураспада — физический период полураспада
Одним из наиболее полезных терминов для оценки того, насколько быстро распадается нуклид, является период радиоактивного полураспада (t1/2). Период полураспада определяется как количество времени, за которое данный изотоп теряет половину своей радиоактивности. Свойства материала
Период полураспада определяется как количество времени, за которое данный изотоп теряет половину своей радиоактивности. Свойства материала
Одним из наиболее полезных терминов для оценки того, насколько быстро распадается нуклид, является период полураспада ( t 1/2 ). Период полураспада определяется как количество времени, за которое данный изотоп теряет половину своей радиоактивности. Как было написано, радиоактивный распад — это случайный процесс на уровне отдельных атомов, в котором, согласно квантовой теории, невозможно предсказать, когда тот или иной атом распадется. Другими словами, ядро радионуклида не имеет «памяти». Ядро не «стареет» с течением времени. Таким образом, вероятность его разрушения не увеличивается со временем, а остается постоянной независимо от того, как долго существует ядро.
Таким образом, скорость ядерного распада также может быть измерена в терминах периодов полураспада . Каждый радионуклид имеет свой собственный период полураспада, который никогда не меняется, независимо от количества или формы материала (т. е. твердого, жидкого, газообразного, элемента или соединения) или его прошлой истории. Если период полураспада радиоизотопа составляет 14 дней, то половина его атомов распадется в течение 14 дней. Еще через 14 дней половина этой оставшейся половины разложится и так далее.
Каждый радионуклид имеет свой собственный период полураспада, который никогда не меняется, независимо от количества или формы материала (т. е. твердого, жидкого, газообразного, элемента или соединения) или его прошлой истории. Если период полураспада радиоизотопа составляет 14 дней, то половина его атомов распадется в течение 14 дней. Еще через 14 дней половина этой оставшейся половины разложится и так далее.
Период полураспада варьируется от миллионных долей секунды для высокорадиоактивных продуктов деления до миллиардов лет для долгоживущих материалов (таких как встречающийся в природе уран). По истечении пяти периодов полураспада остается только 1/32, или 3,1%, от исходного числа атомов. После семи периодов полураспада остается только 1/128, или 0,78% атомов. Количество атомов, существующих после 5-7 периодов полураспада, обычно можно считать пренебрежимо малым.
Доля исходной активности, оставшаяся после последующих периодов полураспада:
Активность после 1 периода полураспада = ½ исходной
Активность после 2 периодов полураспада = ½ x ½ = ¼ исходной (½) 3 = 1/8 из исходного
Активность после 4 полужига = (½). после 5 периодов полураспада = (½) 5 = 1/32 от исходного
после 5 периодов полураспада = (½) 5 = 1/32 от исходного
Активность после 6 периодов полураспада = (½) 6 = 1/64 от исходного ) 7 = 1/128 исходного
Обратите внимание, что коротких периодов полураспада сопровождаются большими константами распада. Радиоактивный материал с коротким периодом полураспада гораздо более радиоактивен (во время производства), но, очевидно, быстро теряет свою радиоактивность. Независимо от того, насколько долгим или коротким является период полураспада, по прошествии семи периодов полураспада остается менее 1 процента исходной активности.
Закон радиоактивного распада гласит, что вероятность распада ядра в единицу времени является постоянной величиной, не зависящей от времени. Эта константа называется константой распада и обозначается λ, «лямбда». Эта постоянная вероятность может сильно различаться между различными типами ядер, что приводит к множеству различных наблюдаемых скоростей распада. Радиоактивный распад определенного количества атомов (массы) экспоненциален во времени.
Радиоактивный распад определенного количества атомов (массы) экспоненциален во времени.
Закон радиоактивного распада: N = N.e -λt
Скорость ядерного распада также измеряется периодами полураспада . Период полураспада — это время, за которое данный изотоп теряет половину своей радиоактивности. Если период полураспада радиоизотопа составляет 14 дней, то половина его атомов распадется в течение 14 дней. Еще через 14 дней половина этой оставшейся половины разложится и так далее. Период полураспада колеблется от миллионных долей секунды для высокорадиоактивных продуктов деления до миллиардов лет для долгоживущих материалов (например, природный уран). Обратите внимание, что короткие периоды полураспада сопровождаются большими константами распада. Радиоактивный материал с коротким периодом полураспада гораздо более радиоактивен (во время производства), но, очевидно, быстро теряет свою радиоактивность. Независимо от того, насколько долгим или коротким является период полураспада, по прошествии семи периодов полураспада остается менее 1 процента исходной активности.
Независимо от того, насколько долгим или коротким является период полураспада, по прошествии семи периодов полураспада остается менее 1 процента исходной активности.
Закон радиоактивного распада можно вывести также для расчетов активности или массы радиоактивного материала:
(Число ядер) N = N.e -λt (Активность) A = A.e -λt (Масса) частиц в образце, A (общая активность) — число распадов в единицу времени радиоактивного образца, m — масса оставшегося радиоактивного материала.
Период полураспада и постоянная распада
При расчетах радиоактивности один из двух параметров ( постоянная распада или период полураспада ), которые характеризуют скорость распада, должны быть известны. Существует связь между периодом полураспада (t 1/2 ) и постоянной распада λ. Соотношение можно вывести из закона затухания, установив N = ½ N o . Это дает:
, где ln 2 (натуральный логарифм 2) равен 0,693.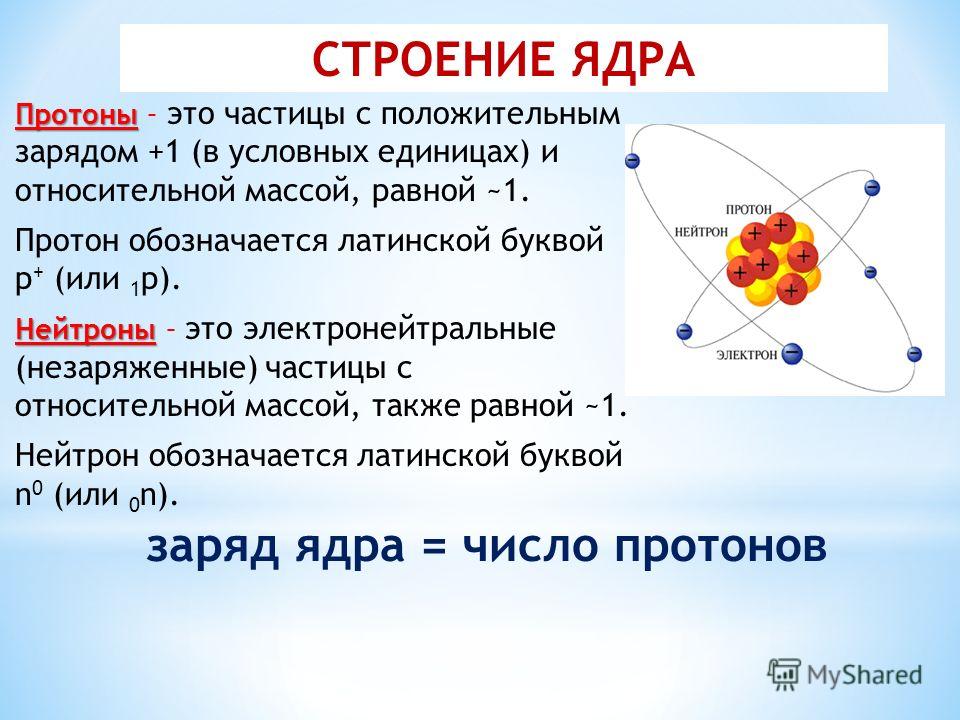 Если задана константа распада (λ), легко рассчитать период полураспада, и наоборот.
Если задана константа распада (λ), легко рассчитать период полураспада, и наоборот.
Период полураспада и радиоактивность
Связь между период полураспада и количество радионуклида, необходимое для придания активности в один кюри, показано на рисунке. Это количество материала можно рассчитать, используя λ , что является константой распада определенного нуклида:
На следующем рисунке показано количество материала, необходимое для 1 1 кюри радиоактивности. Очевидно, что чем больше период полураспада, тем большее количество радионуклида необходимо для получения той же активности. Конечно, более долгоживущее вещество будет оставаться радиоактивным гораздо дольше. Как видно, количество материала, необходимого для 1 кюри радиоактивности, может варьироваться от количества, слишком малого, чтобы его можно было увидеть (0,00088 грамма кобальта-60), через 1 грамм радия-226 и почти до трех тонн урана-238. .
.
Пример – Закон радиоактивного распада
Образец материала содержит 1 микрограмм йода-131. Обратите внимание, что йод-131 играет важную роль в качестве радиоактивного изотопа, присутствующего в продуктах ядерного деления, и является основным источником опасности для здоровья при выбросе в атмосферу во время аварии. Йод-131 имеет период полураспада 8,02 дня.
Вычислить:
- Первоначальное количество атомов йода-131.
- Активность йода-131 в кюри.
- Количество атомов йода-131, которое останется через 50 дней.
- Время, за которое активность достигнет 0,1 мКи.
Решение:
- Количество атомов йода-131 можно определить, используя изотопную массу, как показано ниже.
Н И-131 = м И-131 . N А / М И-131
N I-131 = (1 μg) x (6. 02×10 23 nuclei/mol) / (130.91 g/mol)
02×10 23 nuclei/mol) / (130.91 g/mol)
N I-131 = 4,6 x 10 15 ядер
Период полураспада йода-131 составляет 8,02 дня (692928 сек), поэтому его константа распада составляет:
Используя это значение константы распада, мы можем определить активность образца:
3) и 4) количество атомов йода-131, которое останется через 50 дней (N 50d ) и время, необходимое для того, чтобы активность достигла 0,1 мКи, можно рассчитать по закону распада:
Как видно, через 50 дней количество атомов йода-131 и, следовательно, активность будет примерно в 75 раз ниже. Через 82 дня активность будет примерно в 1200 раз ниже. Следовательно, время десяти периодов полураспада (множитель 2 10 = 1024) широко используется для определения остаточной активности.
Биологический период полураспада
В общем случае период биологического полураспада представляет собой время, необходимое для уменьшения количества конкретного элемента в организме до половины его исходного значения за счет выведения только биологическими процессами, когда скорость удаления примерно экспоненциальна. Биологический период полураспада (t биологический ) можно определить для метаболитов, лекарств и других веществ. Это также очень важно для радиационной защиты, когда речь идет о внутреннем облучении.
Если источник радиации находится внутри нашего тела, мы говорим, что это внутреннее облучение. Поступление радиоактивного материала может происходить различными путями, такими как проглатывание радиоактивного загрязнения с пищей или жидкостями, вдыхание радиоактивных газов, а также через неповрежденную или поврежденную кожу. Большинство радионуклидов дадут вам гораздо большую дозу облучения, если они каким-то образом попадут в ваше тело, чем если бы они оставались снаружи. Биологический период полураспада зависит от скорости, с которой организм обычно использует определенное соединение элемента. Радиоактивные изотопы, которые были проглочены или получены другими путями, будут постепенно удаляться из организма через кишечник, почки, дыхание и пот. Это означает, что радиоактивное вещество может быть выброшено до того, как оно успело распасться.
Биологический период полураспада зависит от скорости, с которой организм обычно использует определенное соединение элемента. Радиоактивные изотопы, которые были проглочены или получены другими путями, будут постепенно удаляться из организма через кишечник, почки, дыхание и пот. Это означает, что радиоактивное вещество может быть выброшено до того, как оно успело распасться.
В результате период биологического полураспада значительно влияет на общую дозу от внутреннего загрязнения. Если радиоактивное соединение с радиоактивным периодом полураспада (t 1/2 ) выводится из организма с биологическим периодом полураспада t b , «эффективный» период полураспада (t e ) определяется выражением выражение:
Как видно, биологические механизмы всегда уменьшают общую дозу от внутреннего загрязнения. Более того, если t 1/2 велик по сравнению с t b , эффективный период полувыведения примерно такой же, как у t b . Например, тритий имеет биологический период полураспада около 10 дней, а радиоактивный период полураспада — около 12 лет.
Например, тритий имеет биологический период полураспада около 10 дней, а радиоактивный период полураспада — около 12 лет.
См. также: Биологический период полураспада
См. также: Эффективный период полураспада
Ссылки:
Радиационная защита:
- Нолл, Гленн Ф., Радиационное обнаружение и измерение, 4-е издание, 2010 . ISBN-13: 978-0470131480.
- Стабин, Майкл Г., Радиационная защита и дозиметрия: введение в физику здоровья, Springer, 10/2010. ISBN-13: 978-1441923912.
- Мартин, Джеймс Э., Физика радиационной защиты, 3-е издание, Wiley-VCH, 4/2013. ISBN-13: 978-3527411764.
- USNRC, КОНЦЕПЦИИ ЯДЕРНОГО РЕАКТОРА
- Министерство энергетики, ядерной физики и теории реакторов США. Справочник по основам Министерства энергетики, том 1 и 2. Январь 1993 г.
Ядерная и реакторная физика:
- Дж. Р. Ламарш, Введение в теорию ядерных реакторов, 2-е изд., Addison-Wesley, Reading, MA (1983).

- Дж. Р. Ламарш, А. Дж. Баратта, Введение в ядерную технику, 3-е изд., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
- WM Stacey, Физика ядерных реакторов, John Wiley & Sons, 2001, ISBN: 0-471-39127-1.
- Гласстоун, Сесонское. Разработка ядерных реакторов: разработка реакторных систем, Springer; 4-е издание, 1994 г., ISBN: 978-0412985317
- W.S.C. Уильямс. Ядерная физика и физика элементарных частиц. Кларендон Пресс; 1 издание, 1991 г., ISBN: 978-0198520467
- Г.Р.Кипин. Физика ядерной кинетики. Паб Эддисон-Уэсли. Ко; 1-е издание, 1965 г.
- Роберт Рид Берн, Введение в работу ядерного реактора, 1988 г.
- Министерство энергетики, ядерной физики и теории реакторов США. Справочник по основам Министерства энергетики, том 1 и 2. Январь 1993 г.
- Пол Ройсс, Нейтронная физика. EDP Sciences, 2008 г. ISBN: 978-2759.800414.
См. также:
Закон распада
Мы надеемся, что эта статья Радиоактивный период полураспада – Физический период полураспада поможет вам. Если это так, дайте нам лайк на боковой панели. Основная цель этого веб-сайта — помочь общественности узнать интересную и важную информацию о материалах и их свойствах.
Если это так, дайте нам лайк на боковой панели. Основная цель этого веб-сайта — помочь общественности узнать интересную и важную информацию о материалах и их свойствах.
Сколько протонов, нейтронов и электронов имеет цинк?
Цинк является классифицированным переходным металлом и имеет обозначение «Zn». Цинк является 30-м элементом периодической таблицы, поэтому его атомный номер равен 30. Атомный номер элемента равен количеству протонов и электронов в этом элементе. Следовательно, атом цинка имеет тридцать протонов и тридцать электронов. Количество нейтронов в атоме можно определить по разнице между массой атома и количеством протонов.
Разница между массовым числом атома цинка и числом протонов составляет тридцать пять. Следовательно, атом цинка имеет тридцать пять нейтронов. Количество нейтронов зависит от изотопа элемента. Атом цинка имеет пять стабильных изотопа.
| Element Name | Zinc |
| Symbol | Zn |
| Atomic number | 30 |
| Atomic weight (average) | 65.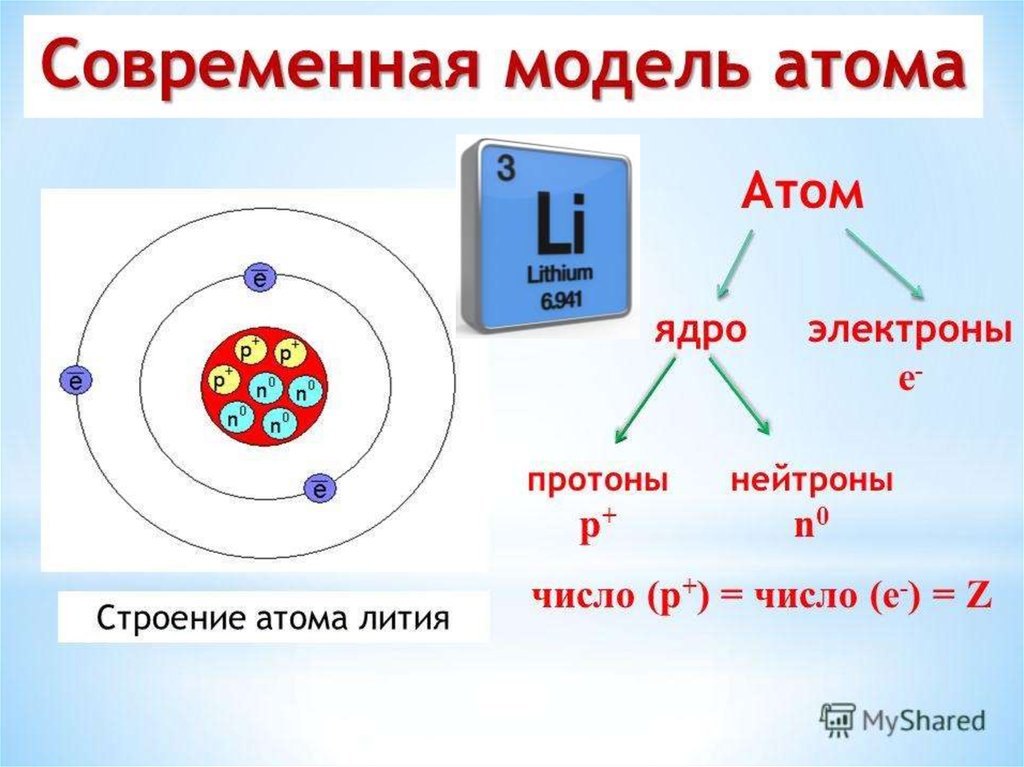 38 38 |
| Protons | 30 |
| Neutrons | 35 |
| Electrons | 30 |
| Group | 12 |
| Period | 4 |
| Block | d-блок |
| Электроны на оболочку | 2, 8, 18, 2 |
| Электронная конфигурация | [Ar] 3d 10 9 4s 2 020225 |
| Степени окисления | +2 |
В этой статье подробно обсуждалось, как легко найти количество протонов, нейтронов и электронов в атоме цинка. Также обсуждаются положение электронов, протонов и нейтронов в атоме, число атомных масс и изотопы цинка. Надеюсь, после прочтения этой статьи вы узнаете подробности по этой теме.
Также обсуждаются положение электронов, протонов и нейтронов в атоме, число атомных масс и изотопы цинка. Надеюсь, после прочтения этой статьи вы узнаете подробности по этой теме.
Содержание
Где в атоме расположены электроны, протоны и нейтроны?
Атом — это мельчайшая частица элемента, которая не существует самостоятельно, но непосредственно участвует в химических реакциях как мельчайшая единица. Атомы настолько малы, что их невозможно увидеть даже под мощным микроскопом. Диаметр атома водорода – 0,1 нм (1,0 нм = 10 — 9 м). Таким образом, если 1000 миллионов атомов водорода расположить рядом друг с другом, его длина составит 1 метр.
Атомная структура атома Однако было возможно обнаружить атомы, увеличив зрение очень мощного электронного микроскопа в два миллиона раз. В атоме существует множество постоянных и временных частиц. Электроны, протоны и нейтроны находятся в атоме как постоянные частицы. Также нейтрино, антинейтрино, позитрон и масон находятся в атоме как временные частицы.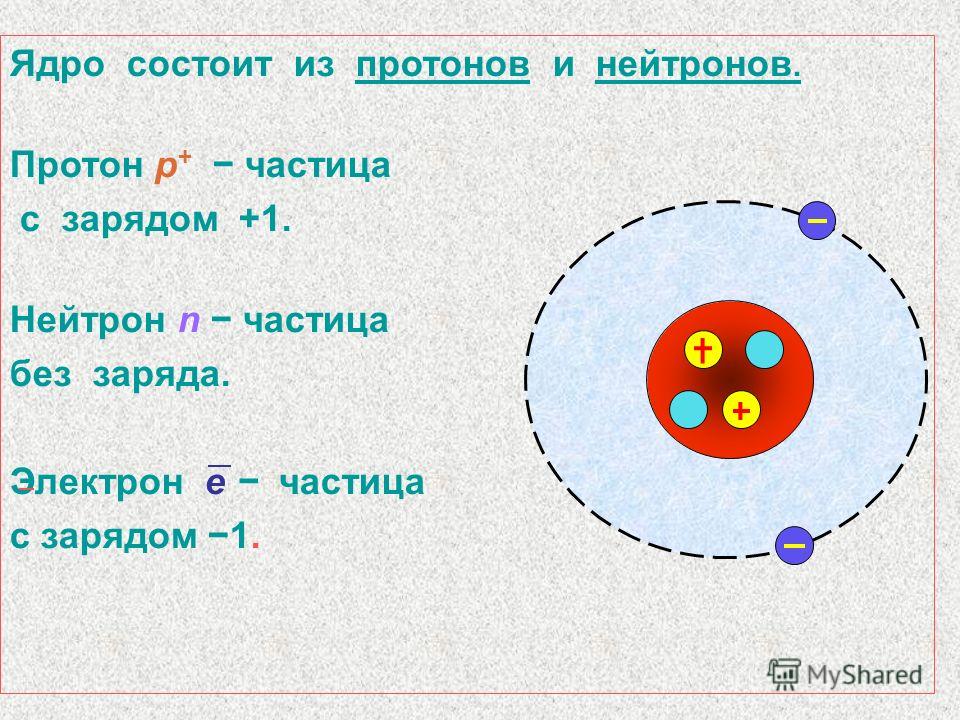
Атомы обычно можно разделить на две части. Один — ядро, а другой — орбита. Эксперименты разных ученых показали, что ядро атома содержит протоны и нейтроны. Единственным исключением является водород, в ядре которого есть только протоны, но нет нейтронов. Электроны вращаются вокруг ядра по определенной орбите.
Как легко найти количество электронов, протонов и нейтронов в атоме цинка?
Ученый Генри Гвинн Джеффрис Мосл исследовал рентгеновский спектр различных элементов в 1913-к 1914. Результаты его экспериментов показывают, что каждый элемент имеет уникальное целое число, равное количеству положительных зарядов в ядре этого элемента. Он назвал это число порядком атомов.
Таким образом, количество положительных зарядов, присутствующих в ядре элемента, называется атомным номером этого элемента. Атомный номер элемента обозначается буквой «Z». Это число равно порядковому номеру таблицы Менделеева. Мы знаем, что протоны находятся в ядре атома в виде положительного заряда.
То есть атомный номер — это общее количество протонов. Атом в целом нейтрален по заряду. Следовательно, количество отрицательно заряженных электронов, обращающихся по своей орбите, равно количеству положительно заряженных протонов в ядре.
Атомный номер (Z) = количество зарядов в ядре (p)
Сколько протонов имеет атом цинка?
Протоны — постоянные частицы ядра атома. Он находится в центре или ядре атома. Когда атом водорода удаляет электрон со своей орбиты, оставшаяся положительно заряженная частица называется протоном. Следовательно, протон выражается как H + . Относительная масса протонов равна 1, что примерно равно массе водорода (1,00757 а.е.м.).
Однако фактическая масса протона составляет 1,6726 × 10 −27 кг. То есть масса протона примерно в 1837 раз больше массы электрона. Протон — положительно заряженная частица. Его фактический заряд составляет +1,602 × 10 −19 кулон. Диаметр протонной частицы составляет около 2,4 × 10 -13 см.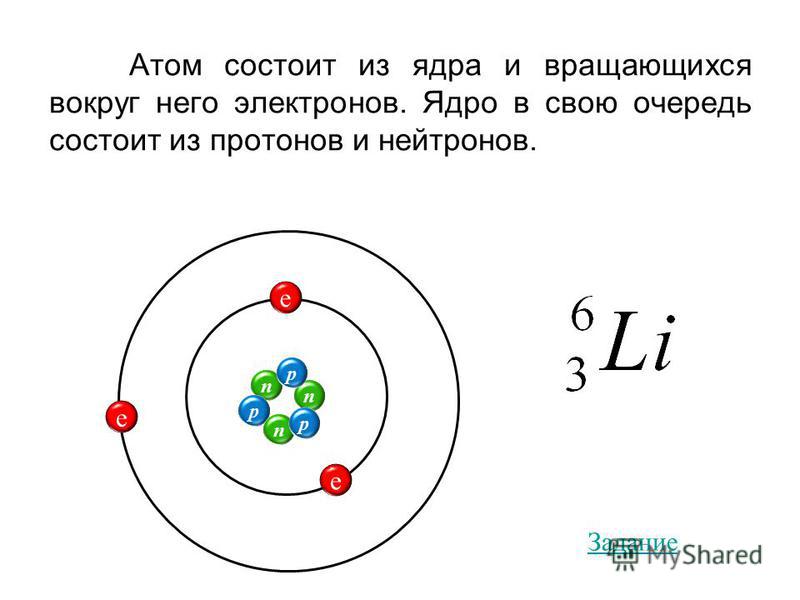
В периодической таблице 118 элементов, 30-й из них — цинк. Элементы в периодической таблице расположены в соответствии с их атомным номером. Поскольку цинк является 30-м элементом периодической таблицы, атомный номер цинка равен 30.
Мы всегда должны помнить, что атомный номер и число протонов элемента равны. Следовательно, атом цинка содержит тридцать протонов.
Сколько электронов у атома цинка?
Электроны — постоянные частицы ядра атома. Он находится на определенной орбите атома и вращается вокруг ядра. Свойства элементов и их соединений зависят от электронной конфигурации. В 1897 году ученый Дж. Дж. Томсон обнаружил существование электронов с помощью электронно-лучевого исследования.
Наименьшая из частиц постоянного ядра атома — электрон. Его масса составляет примерно 1/1836 массы атома водорода. Фактическая масса электрона составляет 9,1085 × 10 −28 г или 9,1093 × 10 −31 кг. Массой электрона часто пренебрегают, потому что эта масса слишком мала. Электроны всегда дают отрицательный заряд.
Электроны всегда дают отрицательный заряд.
Выражается e – . Заряд электронов составляет –1,609 × 10 –19 кулон, а относительный заряд равен –1. То есть заряд электрона равен заряду протона, но наоборот. Мы также должны помнить, что количество протонов и электронов в элементе одинаково. Следовательно, атом цинка содержит на своей орбите тридцать электронов.
Сколько нейтронов у атома цинка?
Ученый Чедвик открыл нейтрон в 1932 году. Он находится в ядре в центре атома. Нейтрон является частицей с нейтральным зарядом и выражается через n. Заряд нейтрона равен нулю, и относительный заряд также равен нулю. Масса нейтрона составляет 1,674 × 10 −27 кг. Количество электронов и протонов в атоме одинаково, но количество нейтронов разное.
Мы уже знаем, что ядро находится в центре атома. В ядре есть два типа частиц. Один из них представляет собой положительно заряженный протон, а другой — нейтрон с нейтральным зарядом.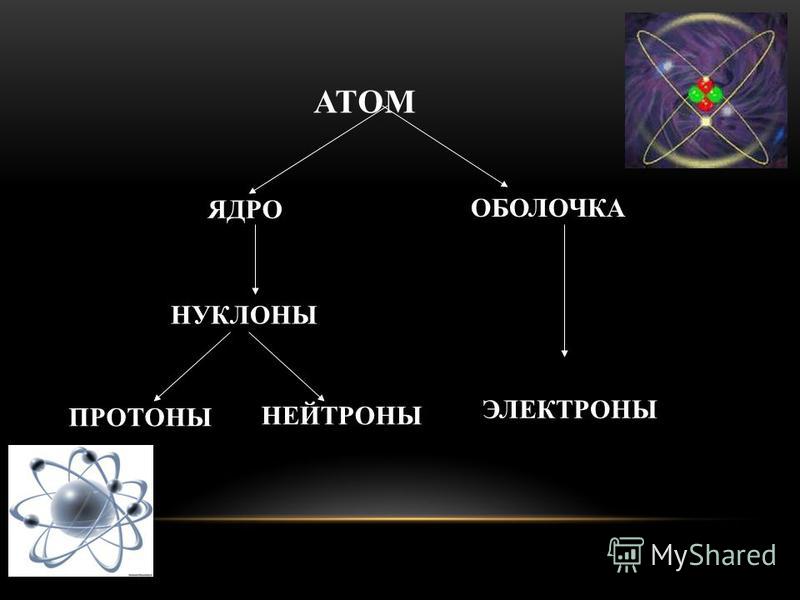 Почти вся масса атома сосредоточена в ядре. Поэтому массу ядра называют атомной массой. Ядро состоит из протонов и нейтронов. Следовательно, атомная масса относится к общей массе протонов и нейтронов.
Почти вся масса атома сосредоточена в ядре. Поэтому массу ядра называют атомной массой. Ядро состоит из протонов и нейтронов. Следовательно, атомная масса относится к общей массе протонов и нейтронов.
Атомная масса (A) = Масса ядра = Суммарная масса протонов и нейтронов (p + n)
Опять же, масса каждого протона и нейтрона составляет около 1 а.е.м. Поэтому общее число протонов и нейтронов называется атомным массовым числом. То есть число атомной массы (А) равно p + n
Таким образом, число нейтронов в элементе получается из разницы между числом атомных масс и числом атомов. То есть число нейтронов (n) = атомное массовое число (A) – атомное число (Z)
| Mass number (A) | Atomic number (Z) | Neutron number = A – Z |
| 65.38 | 30 | 35 |
Мы знаем, что атомный номер цинка равен 30, а среднее атомное массовое число около 65.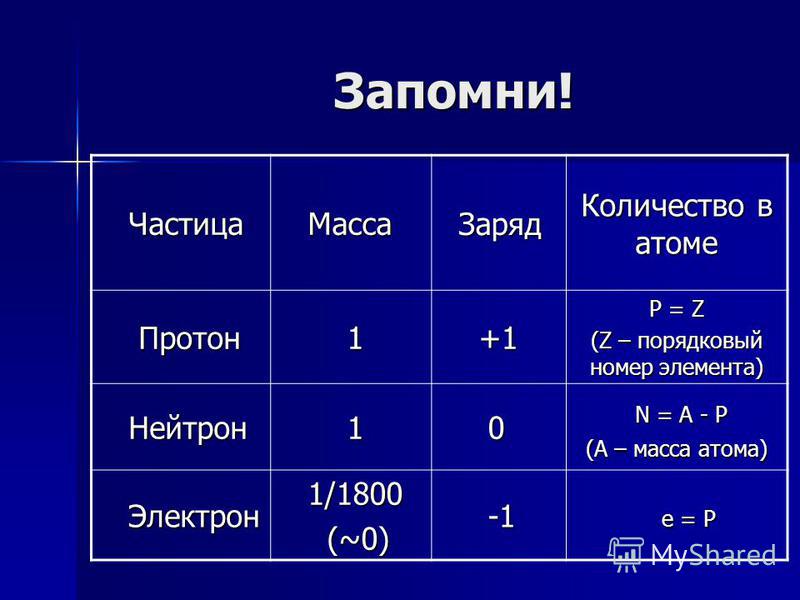 Нейтрон = 65 – 30 = 35. Следовательно, атом цинка имеет тридцать пять нейтронов.
Нейтрон = 65 – 30 = 35. Следовательно, атом цинка имеет тридцать пять нейтронов.
Основываясь на атомном номере, массовом числе и числе нейтронов элемента, можно рассмотреть три вещи. Это изотоп, изобар и изотон. Количество нейтронов зависит от изотопа атома.
Количество протонов, электронов и нейтронов по цинкуКак определить количество нейтронов по изотопам цинка?
Атомы, имеющие одинаковое количество протонов, но разные массовые числа, называются изотопами друг друга. Английский химик Фредерик Соди впервые выдвинул идею изотопов в 1912 году, а ученый Астон в 1919 году определил два атома неона с разными массами ( 20 Ne, 22 Ne). Он назвал атомы одного и того же элемента с разной массой изотопами этого элемента.
Количество протонов в атоме изотопа не меняется, но меняется количество нейтронов. Атом цинка состоит из тридцати изотопов. Such as 54 Zn, 55 Zn, 56 Zn, 57 Zn, 58 Zn, 59 Zn, 60 Zn, 61 Zn, 62 Zn, 63 Zn, 64 Zn, 65 Zn, 66 Zn, 67 Zn, 68 Zn, 69 Zn, 7 9, Zn0021 Zn, 72 Zn, 73 Zn, 74 Zn, 75 Zn, 76 Zn, 77 Zn, 78 Zn, 79 Zn, 80 Zn, 81 Zn, 82 Zn и 83 Zn.
Среди изотопов 64 Zn (стабильный при наблюдениях), 66 Zn, 67 Zn, 68 Zn и 70 Zn (стабильный при наблюдениях) стабильны и образуются естественным путем. Остальные изотопы цинка очень нестабильны, а их периоды полураспада очень короткие.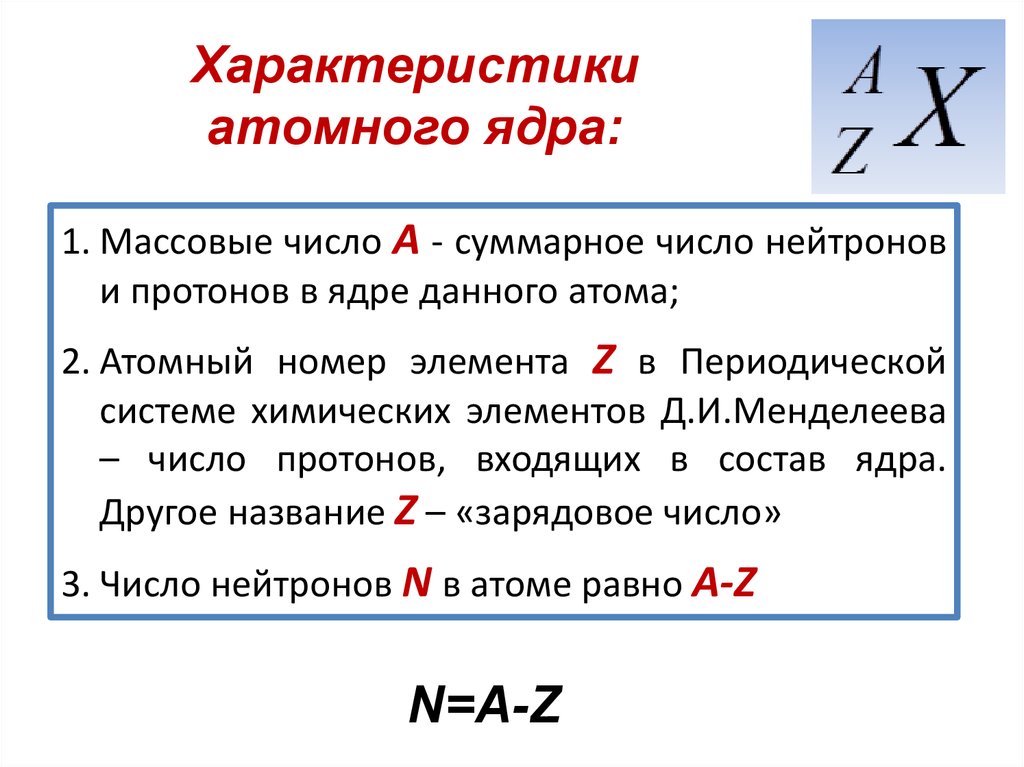
| Isotope | Mass number (A) | Atomic number (Z) | Neutron number = A – Z |
| 54 Zn | 53.99295 | 30 | 24 |
| 55 Zn | 54.98398 | 30 | 25 |
| 56 Zn | 55.97238 | 30 | 26 |
| 57 Zn | 56.96479 | 30 | 27 |
| 58 Zn | 57. 95459 95459 | 30 | 28 |
| 59 Zn | 58.94926 | 30 | 29 |
| 60 Zn | 59.941827 | 30 | 30 |
| 61 Zn | 60.939511 | 30 | 31 |
| 62 Zn | 61.934330 | 30 | 32 |
| 63 Zn | 62.9332116 | 30 | 33 |
| 64 Zn | 63.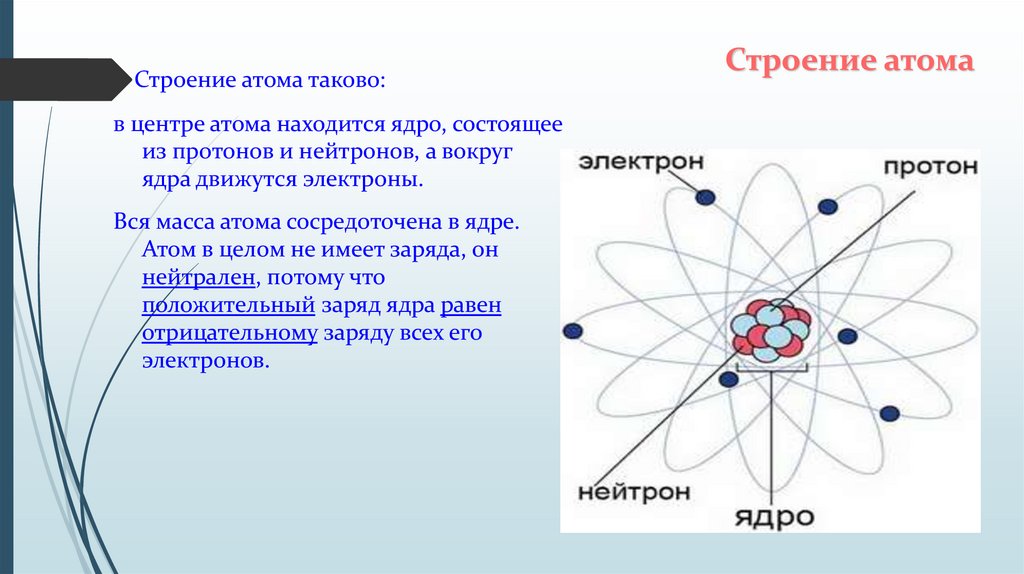 92 92 | 30 | 34 |
| 65 Zn | 64.9292410 | 30 | 35 |
| 66 Zn | 65.9260334 | 30 | 36 |
| 67 Zn | 66.9271273 | 30 | 37 |
| 68 Zn | 67.9248442 | 30 | 38 |
| 69 Zn | 68.9265503 | 30 | 39 |
| 70 Zn | 69. 9253193 9253193 | 30 | 40 |
| 71 Zn | 70.927722 | 30 | 41 |
| 72 Zn | 71.926858 | 30 | 42 |
| 73 Zn | 72.92978 | 30 | 43 |
| 74 Zn | 73.92946 | 30 | 44 |
| 75 Zn | 74.93294 | 30 | 45 |
| 76 Zn | 75.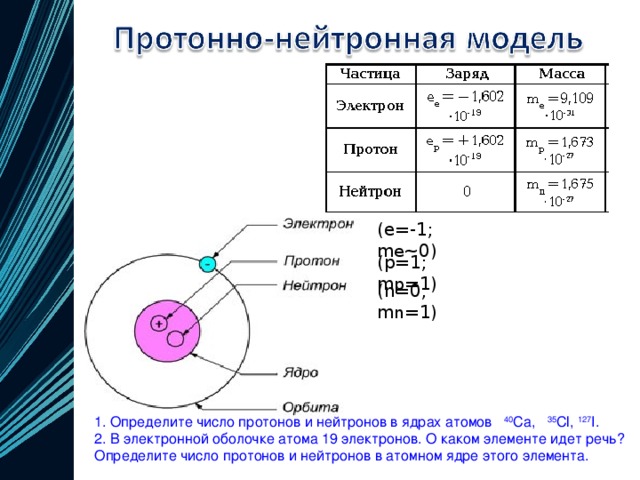 93329 93329 | 30 | 46 |
| 77 Zn | 76.93696 | 30 | 47 |
| 78 Zn | 77.93844 | 30 | 48 |
| 79 Zn | 78.94265 | 30 | 49 |
| 80 Zn | 79.94434 | 30 | 50 |
| 81 Zn | 80.95048 | 30 | 51 |
| 82 Zn | 81.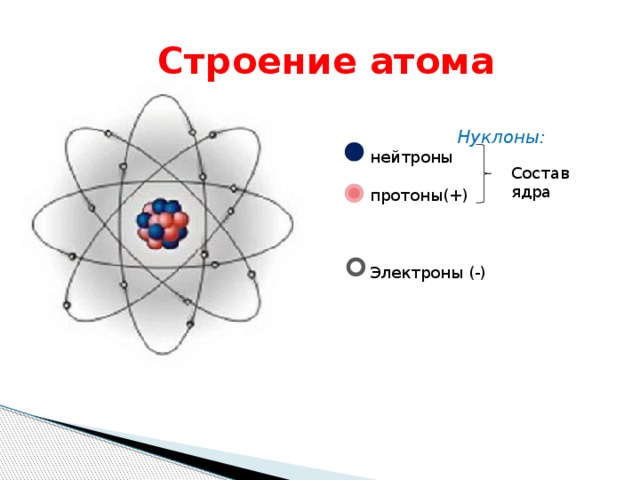 95442 95442 | 30 | 52 |
| 83 Zn | 82.96103 | 30 | 53 |
Of the 30 radioisotopes of цинка, самым долгоживущим радиоизотопом является 65 Zn с периодом полураспада 243,66 дня. Все остальные меньше минуты, большинство меньше секунды. Масса стабильного 64 Zn составляет около 64 (63,92), 66 Zn составляет около 66 (65,9260334), 67 Zn составляет около 67 (66,9271273), 68 Zn составляет около 68 (67,9248442) и 70 Zn составляет около 90,25 (69,25).
Сколько протонов, нейтронов и электронов содержит ион цинка (Zn
2+ )? Когда атом несет отрицательный или положительный заряд, принимая или отталкивая электроны, он называется ионом.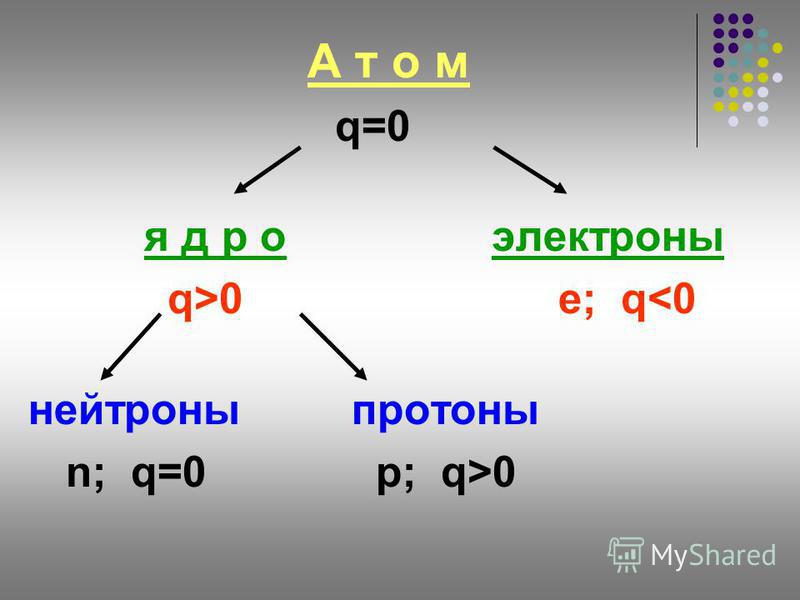 Ионные свойства элементов зависят от обмена электронами. В атомарном ионе изменяется только число электронов, но не изменяется число протонов и нейтронов.
Ионные свойства элементов зависят от обмена электронами. В атомарном ионе изменяется только число электронов, но не изменяется число протонов и нейтронов.
Цинк имеет только два электрона на своей последней орбите. При образовании связи атом цинка отдает два электрона с последней оболочки, образуя ион цинка (Zn 2+ ). В этом случае атом цинка несет положительный заряд.
Zn – 2e – → Zn 2+
Здесь электронная конфигурация иона цинка (Zn 2+ ) равна 1s 2 2s 2 2 20020 2 3p 6 3d 10 . Этот ион цинка (Zn 2+ ) имеет тридцать протонов, тридцать пять нейтронов и двадцать восемь электронов.
| Zinc ion | Protons | Neutrons | Electrons |
| Zn 2+ | 30 | 35 | 28 |
Какими свойствами обладают протоны, нейтроны и электроны?
| Name | Symbol | Relative Mass (amu) | Relative Charge | Actual Mass(kg) | Actual Charge(C) | Location |
| Протон | p | 1.00757 | +1 | 1.672×10 −27 | 1. 602×10 −19 602×10 −19 | Inside the nucleus |
| Neutron | n | 1.0089 | 0 | 1.674× 10 −27 | 0 | Inside the nucleus |
| Electron | e – | 5.488×10 −4 | –1 | 9.109×10 −31 | –1.6 ×10 –19 | Вне ядра |
Почему нам важно знать количество электронов и протонов?
Атомный номер — это число, которое несет в себе свойства элемента. Количество электронов и протонов в элементе определяется атомным номером.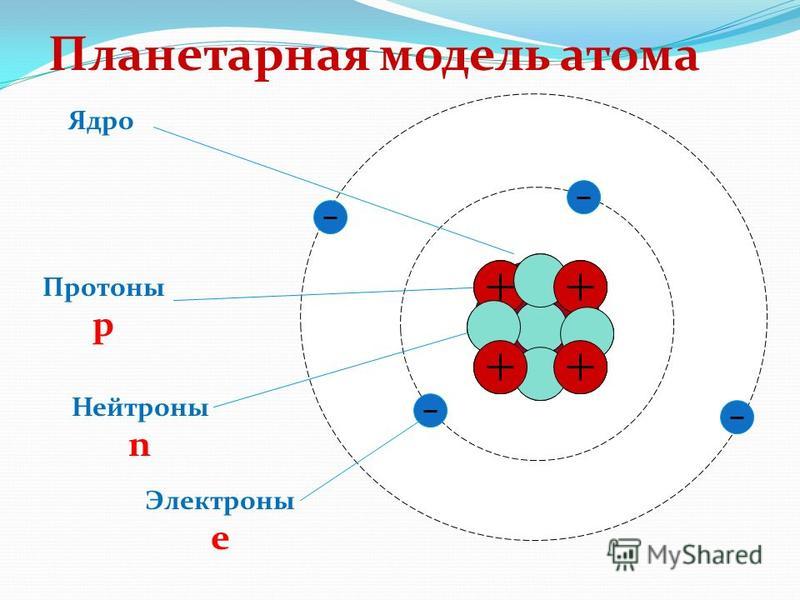 Также определяется точное положение элемента в периодической таблице. Свойства элемента можно определить по электронной конфигурации.
Также определяется точное положение элемента в периодической таблице. Свойства элемента можно определить по электронной конфигурации.
Кроме того, валентность, валентные электроны и ионные свойства элементов определяются электронной конфигурацией. Чтобы определить свойства элемента, необходимо расположить электроны этого элемента. И чтобы расположить электроны, вы должны знать количество электронов в этом элементе.
Чтобы узнать количество электронов, вам нужно знать атомный номер этого элемента. Мы знаем, что в ядре элемента находится равное количество протонов с атомным номером, а электроны, равные протонам, находятся на орбите вне ядра.
Атомный номер (Z) = Количество электронов
Мы уже знаем, что атомный номер цинка равен 30. То есть в атоме элемента цинка тридцать электронов. Итак, по электронной конфигурации можно определить свойства цинка.
Электронная конфигурация цинка показывает, что последняя оболочка цинка имеет два электрона. Следовательно, валентных электронов у цинка два.

 Нумерация слоев начинается с ближайшего к ядру электронного слоя.
Нумерация слоев начинается с ближайшего к ядру электронного слоя.