Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Показать решение »
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg0 -2e— = Mg2+
К: Cu2+ +2e— = Cu
Mg0 + Cu2+ = Mg2+ + Cu
Mg + CuSO4 = MgSO
Вычислим ЭДС гальванического элемента:
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Mg2+/Mg
E0Cu2+/Cu = +0,337 В
E0Mg2+/Mg = -2,37 В
ЭДС =0,337 + 2,37 = 2,71 В
Определим энергию химической реакции:
ΔG0298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Показать решение »
Решение.
E02H+/h3 = 0,00 В
E0Pb2+/
Pb = -0,126 В
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb0 -2e— = Pb2+
К: 2H+ +2e— = H2
Pb0 + 2H+= Pb2+ + H2
Определим электродный потенциал свинца:
E = E° + (0,059/n)lgC
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = E0кат — E0ан = E02H+/h3 — E0Pb2+/Pb
ЭДС = 0 + 0,185 = 0,185 В
Задача 3.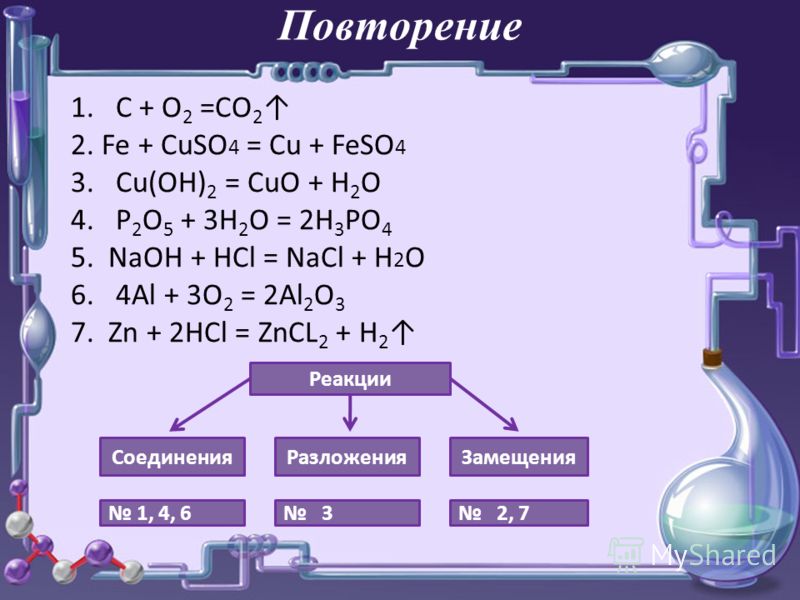 По уравнению токообразующей реакции составьте схему гальванического элемента:
По уравнению токообразующей реакции составьте схему гальванического элемента:
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Ni2+/Ni и E0Cu2+/Cu
E0Ni2+/Ni = -0,250 В
E0Cu2+/Cu = +0,337 В
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni0 -2e— = Ni2+
К: Cu2+ +2e— = Cu0
Ni0 + Cu2+ = Ni2+ + Cu0
Ni0 + CuSO4 = NiSO4 + Cu0
Составим схему гальванического элемента:
(-) Ni0|NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Ni2+/Ni
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg2+] = 0,001 моль/л, [Pb2+] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Mg2+/Mg и E0Pb2+/Pb
E0
E0Pb2+/Pb = -0,126 В
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg0 -2e— = Mg2+
К: Pb2+ +2e— = Pb0
Mg0 + Pb2+ = Mg2+ + Pb0
Составим схему гальванического элемента:
(-) Mg0|Mg2+ || Pb2+|Pb0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
E = E° + (0,059/n)lgC
EMg2+/Mg = -2,37 + (0,059/2)lg0,001 = -2,46 В
EPb2+/Pb = -0,126 + (0,059/2)lg1 = -0,126 В
Рассчитаем стандартную ЭДС
реакцииЭДС = Eкат — Eан = EPb2+/Pb — EMg2+/Mg
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Mg2+/Mg, E0Co2+/Co, E0Fe2+/Fe, E0Ag+/Ag
E0Mg2+/Mg = -2,37 В
E0Fe2+/Fe = -0,440 B
E0Co2+/Co = -0,277 B
E0Ag+/Ag = +0,799 B
Протекание реакции возможно при условии, когда E0восст 0ок.
В нашем случае восстановителем является кобальт и условие E0восст 0ок соблюдается только для пары
Co – Ag.
Co0 + Ag+ = Co2+ + Ag0
Молекулярное уравнение, например:
Co0 + 2AgNO3 = Co(NO3)2 + 2Ag0
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Co) = 1∙59 = 59 г
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Показать решение »
Решение.
По условию задачи материал анода известен – никель.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
E0Ni2+/Ni = -0,250 В
E0Cu2+/Cu = +0,337 В
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni0 -2e— = Ni2+
К: Cu2+ +2e— = Cu0
Ni0 + Cu2+ = Ni2+ + Cu0
Ni0 + CuSO4 = NiSO4 + Cu0
Составим схему гальванического элемента:
(-) Ni0|NiSO4 || CuSO4|Cu0 (+)Рассчитаем стандартную ЭДС реакции
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Ni2+/Ni
ЭДС = 0,337 – (- 0,250) = 0,587 В
Категории ОБЩАЯ ХИМИЯ, Окислительно-восстановительные реакции
Тест: «Реакции в растворах электролитов» 9 класс | Тест по химии (9 класс) на тему:
Тест по теме: «Реакции в растворах электролитов»
Вариант 1.
- Что такое электролитическая диссоциация?
1) процесс распада электролита на отдельные атомы; 2) самораспад вещества на отдельные молекулы; 3) процесс образования ионов; 4) процесс распада электролита на ионы при растворении или расплавлении.
- Какое уравнение диссоциации записано правильно:
- FeCl3 = Fe2+ + 3Cl-;
2) FeCl3 = Fe3+ + 3Cl-;
3) FeCl3 = Fe3+ + 2Cl-;
4) FeCl3 = Fe3+ + Cl3-.
- Процесс диссоциации азотной кислоты можно выразить уравнением:
- HNO3 ↔ H+ + 3NO-;
2) HNO3 ↔ H+ + NO3-;
3) HNO3 ↔ H+1 + NO3-1;
4) HNO3 ↔ 3H+ + 3NO-.
- Как называются электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка:
1) кислоты; 2) основания; 3) соли; 4) оксиды.
- Все общие свойства оснований обусловлены наличием:
1) катионов водорода; 2) катионов металлов; 3) анионов кислотного остатка; 4) гидроксид анионов.
- Что обозначает выражение «степень диссоциации кислоты равна 25%»:
1) 25% всех молекул кислоты не диссоциируют на ионы; 2) 25% всех молекул кислоты диссоциируют на ионы; 3) 25% всех частиц в растворе кислоты – ионы; 4) 25% всех частиц в растворе кислоты – молекулы.
- Электролиты – это:
- оксиды, растворимые в воде; 2) вода; 3) кислоты, соли и основания растворимые в воде;
4) кислоты, соли и основания нерастворимые в воде.
- Кислотная среда раствора определяется:
1) катионом водорода Н+; 2) гидроксид анионом ОН-; 3) наличием обоих ионов одновременно Н+ОН-; 4) другим ионом.
- Индикатор – это вещество, которое при взаимодействии с данным веществом:
1) образует осадок; 2) образует воду; 3) образует газ; 4) изменяет цвет.
- Для определения наличия в растворе сульфат аниона SO42− необходимо добавить раствор содержащий:
1) катион алюминия Al3+; 2) карбонат анион CO32−; 3) катион водорода H+; 4) катион бария Ba2+.
- По таблице растворимости определите, какое из перечисленных веществ относится к неэлектролитам:
1) NaOH; 2) CuSO4; 3) Mg(OH)2; 4) HCl.
- Нейтральная среда раствора определяется:
1) катионом водорода Н+; 2) гидроксид анионом ОН-; 3) наличием обоих ионов одновременно Н+ОН-; 4) другим ионом.
- Фенолфталеин в щелочной среде приобретает окраску:
1) красную; 2) малиновую; 3) синюю; 4) фиолетовую.
- Для определения наличия в растворе карбонат аниона СО32− необходимо добавить раствор содержащий:
1) катион водорода Н+; 2) карбонат анион CO32−; 3) катион серебра Ag+; 4) катион бария Ba2+.
15. Какая из данных кислот является сильным электролитом:
1) серная; 2) кремневая; 3) угольная; 4) фосфорная.
!6. Напишите реакцию ионного обмена для веществ:
FeCl3 + NaOН =
Тест №7 Тема: «Реакции в растворах электролитов»
Вариант 2.
- Какие вещества называются кристаллогидратами:
1) твёрдые вещества, в состав которых входит химически связанная вода; 2) твёрдые вещества растворимые в воде; 3) твёрдые вещества нерастворимые в воде; 4) твёрдые вещества, реагирующие с водой.
- Какое уравнение диссоциации записано правильно:
1) Cu(NO3)2 = Cu2+ + NO6−; 2) Cu(NO3)2 = Cu2+ + 6NO-; 3) Cu(NO3)2 = 2Cu2+ + NO3-;
4) Cu(NO3)2 = Cu2+ + 2NO3-;
- Процесс диссоциации гидроксида кальция можно выразить уравнением:
1) Ca(OH)2 ↔ Ca2+ + OH-; 2) Ca(OH)2 ↔ Ca+2 + OH-; 3) Ca(OH)2 ↔ Ca2+ + 2OH-; 4) Ca(OH)2 ↔ Ca+2 + OH-1.
- Как называются электролиты, которые при диссоциации образуют катионы металла и анионы кислотного остатка:
1) кислоты; 2) основания; 3) соли; 4) оксиды.
- Все общие свойства кислот обусловлены наличием:
1) катионов водорода; 2) катионов металлов; 3) анионов кислотного остатка; 4) гидроксид анионов.
- Что обозначает выражение «степень диссоциации гидроксида натрия равна 40%»:
1) 40% всех молекул гидроксида натрия не диссоциируют на ионы; 2) 40% всех молекул гидроксида натрия диссоциируют на ионы; 3) 40% всех частиц в растворе гидроксида натрия – ионы; 4) 40% всех частиц в растворе гидроксида натрия – молекулы.
- По таблице растворимости определите, какое из перечисленных веществ относится к электролитам:
1) NaCl; 2) Cu(OH)2; 3) CaCO3; 4) h3SiO3.
- Щелочная среда раствора определяется:
1) катионом водорода Н+; 2) гидроксид анионом ОН-; 3) наличием обоих ионов одновременно Н+ОН-; 4) другим ионом.
- Для определения кислотной среды удобно пользоваться индикаторами:
1) фенолфталеином и лакмусом; 2) метилоранжем и фенолфталеином; 3) универсальным, лакмусом и метилоранжем; 4) универсальным и фенолфталеином.
- Для определения наличия в растворе хлорид аниона Cl− необходимо добавить раствор содержащий:
1) катион алюминия Al3+; 2) карбонат анион CO32−; 3) катион серебра Ag+; 4) катион бария Ba2+.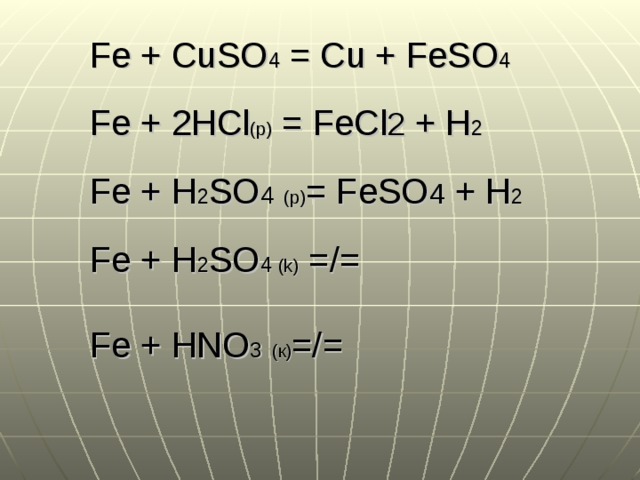
11. Если вещество является электролитом, то в таблице растворимости оно обозначено буквой:
1) М; 2) Н; 3) ?; 4) Р.
12. Сколько сред раствора существует:
1) две; 2) три; 3) четыре; 4) пять.
- Для определения щелочной среды удобно пользоваться индикаторами:
1) лакмусом; 2) метилоранжем; 3) универсальным, лакмусом и метилоранжем; 4) универсальным и фенолфталеином.
- Для определения наличия в растворе катиона серебра Ag+ необходимо добавить раствор содержащий:
1) катион водорода Н+; 2) хлорид анион Cl−; 3) катион серебра Ag+; 4) катион бария Ba2+.
15. Какая из данных кислот является слабым электролитом:
1) серная; 2) соляная; 3) азотная; 4) угольная.
Ответы. Тема: «ТЭД»
1 вариант
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
1) | х | х | х | х | |||||||||||
2) | х | х | х | х | |||||||||||
3) | х | х | х | ||||||||||||
4) | х | х | х | х |
2 вариант
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
1) | х | х | х | ||||||||||||
2) | х | х | х | х | |||||||||||
3) | х | х | х | х | |||||||||||
4) | х | х | х | х |
a Запишите уравнение в ионной форме CuSO4 aq Fe s FeSO4 aq Cu s b Разделите приведенное выше уравнение на .
 ..
..Перейти к
- Упражнение 6А
- Упражнение 6Б
- Упражнение 6С
- Упражнение 6D
- Глава 1. Язык химии
- Глава 2 Химические изменения и реакции
- Глава 3 Вода
- Глава 4.
 Атомная структура и химическая связь
Атомная структура и химическая связь - Глава 5 Периодическая таблица
- Глава 6 Изучение первого элемента водорода
- Глава 7 Изучение газовых законов
- Глава 8. Загрязнение атмосферы
Главная > Селина Солюшнс Класс 9 Химия > Глава 6 — Глава 6 Изучение первого элемента водорода > Упражнение 6D > Вопрос 7
Вопрос 7 Упражнение 6D
(а) Запишите уравнение в ионной форме
CuSO4 (водн. ) + Fe (тв) → FeSO4 (водн.) + Cu (тв)
) + Fe (тв) → FeSO4 (водн.) + Cu (тв)
(б) Разделите приведенное выше уравнение на полуреакции окисления и восстановления
Ответ:
а) Уравнение в ионной форме:
Cu2+ SO4
2- + Fe → Fe2+ SO4
2- + Cu
б) Fe2+ 2 e- —- Окисление
Cu2+ + 2 e → Cu —- Восстановление
Связанные вопросы
**Кратко опишите ионную концепцию окисления и восстановления. Приведите уравнение для иллюстрации**
**Существенно ли, что окисление и восстановление должны происходить параллельно в химической реакции? Объяснить…
** Укажите, аргументируя, были ли вещества, выделенные жирным шрифтом, окислены или восстановлены…
**Укажите, являются ли следующие превращения реакциями окисления или восстановления. ****(a) PbO2 + SO2 —…
****(a) PbO2 + SO2 —…
**В следующей реакции: A+ + B —>A + B. Напишите полуреакции для этой реакции и назовите:****…
**Разделите следующие окислительно-восстановительные реакции на полуреакции окисления и восстановления.****(i) Zn + Pb2+…
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнение 6A
Упражнение 6B
Упражнение 6C
Упражнение 6D
Главы
Глава 1 Язык химии 9
Глава 2. Химические превращения и реакции
Глава 3. Вода
Вода
Глава 4. Атомная структура и химическая связь 8 Атмосферное загрязнение
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
Fe + CuSO4 = Cu + FeSO4
| Поиск |
железо + сульфат меди(ii) = медь + |
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Окислительно-восстановительная реакция Реакция одинарного замещения
| Fe | + | png» substance-weight=»159.6086″> CuSO 4 | → | Cu | + | FeSO 4 | |
| iron | copper(ii) sulfate | copper | |||||
| (rắn) | (dd) | (rắn) | (dd) | ||||
| (trắng xám) | (xanh lam) | (đỏ) | (lục nhạt) | ||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении Fe + CuSO
4 → Cu + FeSO 4В каких условиях Fe (железо) реагирует с CuSO4 (сульфатом меди(ii))?
Не найдено информации для этого химического уравнения
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием Cu (меди) и FeSO4 () ?
Поместите железные гвозди в раствор CuSO4
В полном предложении вы также можете сказать, что Fe (железо) реагирует с CuSO4 (сульфатом меди(ii)) и производит Cu (медь) и FeSO4 ()
Явление после реакции Fe (железа) с CuSO4 (сульфатом меди(ii))
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
Железо действует химически более сильно, чем медь
Категории уравнений
Другие вопросы, связанные с химическими реакциями Fe + CuSO
4 → Cu + FeSO 4Вопросы, связанные с реагентом Fe (железо)
Что такое химический и физические характеристики Fe (железа)? В каких химических реакциях используется Fe (железо) в качестве реагента?
Вопросы, связанные с реагентом CuSO4 (сульфатом меди(ii))
Каковы химические и физические характеристики CuSO4 (сульфата меди(ii))?Каковы химические реакции, в которых CuSO4 (сульфат меди(ii)) используется в качестве реагента ?
Вопросы, связанные с продуктом Cu (медь)
Каковы химические и физические характеристики Cu (сульфата меди(ii))?Каковы химические реакции, в которых Cu (медь) является продуктом?
Вопросы, связанные с продуктом FeSO4 ()
Каковы химические и физические характеристики FeSO4 (сульфата меди(ii))? Каковы химические реакции, в которых FeSO4 () является продуктом?
Essentt — Товары, подобранные вручную
Продукты, подобранные вручную Необходимы для работы из дома!
Уравнения с Fe в качестве реагента
железо
Fe + S → FeS Fe + 2HCl → FeCl 2 + H 2 3Fe + 2O 2 → Fe 3 O 4 Просмотреть все уравнения с Fe в качестве реагента
Уравнения с CuSO4 в качестве реагента
сульфат меди(ii)
2H 2 O + 2K + CUSO 4 → CU (OH) 2 + H 2 + K 2 SO 4 FE + CUSO 4 SO 4 FE + CUSO 4 .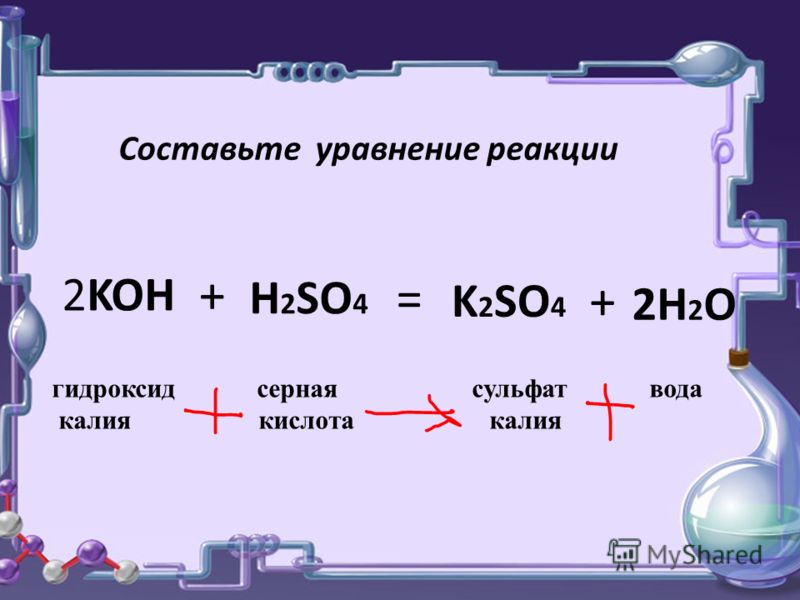 + CuSO 4 → Cu(OH) 2 + Na 2 SO 4 Просмотреть все уравнения с CuSO4 в качестве реагента
+ CuSO 4 → Cu(OH) 2 + Na 2 SO 4 Просмотреть все уравнения с CuSO4 в качестве реагента
Реклама
Уравнения с CuSO4 в качестве продукта
сульфат меди(ii)
CU + 2H 2 SO 4 → 2H 2 O + SO 2 + CUSO 4 3CU + 4H 2 SO 4 3CU + 4H 2 SO 4 + 4H 2 SO 4 + 4H 2 4 3CU + 2 4 3CU + 2 4 3CU + 2 4 3CU + 2 4 + . Na 2 SO 4 + 2NO + 3CuSO 4 CuO + H 2 SO 4 → H 2 O + CuSO 4 Просмотреть все уравнения с CuSO4 в качестве продукта
Уравнения с CuSO4 в качестве продукта
сульфат меди(ii)
Cu + 2H 2 SO 4 → 2H 2 O + SO 2 + CUSO 4 3CU + 4H 2 SO 4 3CU + 4H 2 SO 4 + 4H 2 SO 4 + 4H 2 4 3CU.

 Атомная структура и химическая связь
Атомная структура и химическая связь