Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
отметь в тетради точки О и Д так,как показано на рисунке. проведи красным и зеленым карандашом лучи с началом в точке О так, чтобы точка Д…получилась: а) вне этих лучей ; б) на зеленом луче, но вне
проведи красным и зеленым карандашом лучи с началом в точке О так, чтобы точка Д…получилась: а) вне этих лучей ; б) на зеленом луче, но вне
У Ани было две ленты:зеленая и желтая. Зелёная на 3 дм.длиннее желтой. Аня отрезала от зелёной 6дм.,а от желтой 2дм.Какая лента стала длиннее? На сколько см?
на космическом станции начинается строительство двух обьектов сначала пройди обучение потом выполни оба задание
помогите плиз , решить задачу!!! в первой связке на 56 шаров больше, чем во второй. сколько шаров в каждой связке, если во второй связке в 5 раз меньше шаров, чем в первой?
в детском саду 20 велосипедов-трехколесных…
Пользуйтесь нашим приложением
Окислительно-восстановительные реакции — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕРЕАКЦИИ
2. Межмолекулярные ОВР
А) реакции, в результате которых степень окисления всех элементовостаются без изменения:
HNO3 + NaOH → NaNO3 + h3O
Б) реакции, в результате которых степень окисления некоторых
элементов изменяется:
2KBr + Cl2 → Br2 + 2KCl
ОКИСЛИТЕЛИ
Пример 1:
S0 + 2e → S2Cl20 + 2e → 2ClFe3+ +1e → Fe2+
ВОССТАНОВИТЕЛИ
Пример 2:
Fe2+ — 1e → Fe3+
Al0 — 3e → Al3+
h30 — 2e → 2H+
ОКИСЛИТЕЛИ
1. Неметаллы
с
высокой Cl20 + 2e → 2Cl-
электроотрицательностью.
Присоединяют электроны,
превращаясь в анионы.
2. Катионы. Присоединяют Cu2+ + 2e → Cu0
электроны,
образуя
нейтральные атомы или
молекулы.
ОКИСЛИТЕЛИ
3.Ионы
или
молекулы,
Mn+7 содержится в MnO4-
содержащие элемент с
кислая
высокой
среда
среда
окисления.

+ 5е
+ 3е
Присоединяя электрон
Mn2+
степенью
нейтральная
MnO2
щелочная
среда
+1е
MnO42-
этот элемент понижает S+6 +2e → S+4 – H SO , SO
2
4
3
свою
степень
S+6 1s22s22p6
окисления.
S+4 1s22s22p6 3s2
N+5 – HNO3, NO3Cr+6
щел. ср. → CrO42кисл. ср. → Cr2O72-
ОКИСЛИТЕЛИ
4.
Ионы
содержащие
и
молекулы, Cr+3 → Cr2O3
элемент
с O-1 →H O
2 2
нетипичной промежуточной
В нормальной и щелочной
степенью окисления.
среде:
h3O2-1 + 2e → 2OHВ кислой среде:
h3O2 + 2H+ +2e → 2h3O
ВОССТАНОВИТЕЛИ
1.Металлы.
Отдают
электрон, Ba0 – 2e → Ba2+
превращаясь в катионы.
2.Неметаллы
с
невысокой C0 – 4e → C+4
электроотрицательностью.
H02 — 2e → 2H+
3.Анионы неметаллов (кислотные 2Cl- — 2e → Cl20
остатки
бескислородных S-2 – 2e → S0
кислот).
4.Молекулы и ионы, содержащие S+4 (SO32-)
атом
неметалла
промежуточной
окисления.

в S+4 – 2e → S+6
степени
В кислой среде: O-1 (h3O2)
2О-1 -2е → О2
Алгоритм расстановки коэффициентов в уравнении ОВР,
если известны продукты взаимодействия
1. Записать схему реакции – слева исходные вещества,
справа – продукты реакции.
Каталитическое окисление аммиака:
NH 3 O2 кат
NO H 2O
2. Расставить степени окисления всех элементов во всех
веществах:
N-3h4+1 + O20 → N+2O-2 + h3+1O-2
3. Определить, какой элемент является восстановителем.
4. Записать схему окисления:
N-3 → N+2
Алгоритм расстановки коэффициентов в уравнении ОВР,
если известны продукты взаимодействия
5. Определить число электронов, отданных восстановителем
(на один атом):
(-3) – (+2) = -5
затем умножить на число атомов:
-5*1 = -5
Записать полную схему процесса окисления –
электронное уравнение:
N-3 – 5e = N+2 (восстановитель, окисление).
6. Определить, какой элемент является окислителем.
7. Записать схему процесса восстановления:
O20 → 2O-2
Алгоритм расстановки коэффициентов в уравнении ОВР,
если известны продукты взаимодействия
8.
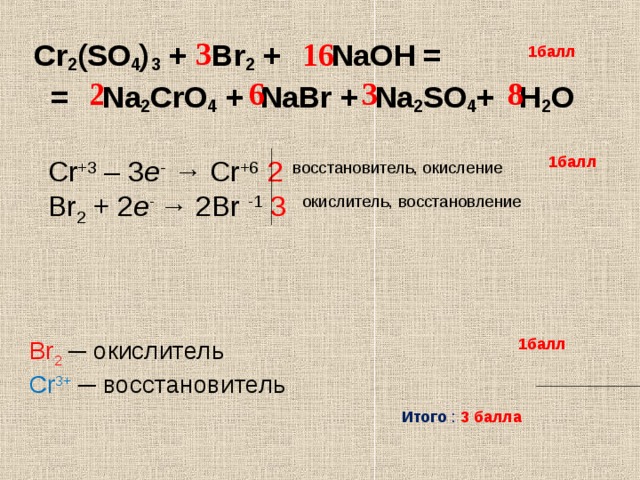 Определить число электронов, полученных окислителем
Определить число электронов, полученных окислителем(на один атом окислителя):
0 – (-2) = +2
затем умножить на число атомов:
+2*2 = +4
Записать полную схему процесса восстановления –
электронное уравнение:
O20 + 4e = 2O-2 (окислитель, восстановление).
9. Найти наименьшее общее кратное для числа отданных и
полученных электронов.
Алгоритм расстановки коэффициентов в уравнении ОВР,
если известны продукты взаимодействия
10. Найти коэффициенты при каждом электронном уравнении:
N-3 – 5e = N+2
4
20:5 = 4
O20 + 4e = 2O-2
5
20:4 = 5
11.Проставить соответствующие коэффициенты (с учетом
количества атомов в молекулах) в исходную схему реакции.
12.Проверить общее количество атомов каждого химического
элемента слева и справа.
слева
справа
N
4
4
O
10
10
H
12
12
Результат:
4 NH 3 5O2 кат
4 NO 6 H 2O
ПРИМЕР:
Fe+2S2-1 + O20 = Fe2+3O3-2 + S+4O2-2
Fe+2 — 1e = Fe+3
S-1 – 5e = S+4
O20 +4e = 2O-2
*2
восстановитель, окисляется
восстановитель, окисляется
окислитель, восстанавливается
Fe+2 — 1e = Fe+3
10е + 1е = 11е *4
2S-1 – 10e = 2S+4
O20 +4e = 2O-2
Ответ:
4е
*11
4FeS2 + 11O2 = 2Fe2O3 +8SO2
восстановители
окислитель
МЕТАЛЛ+ КИСЛОТА
Ме
Li до Mg
Mg до h3
Cu, Ag, Hg
Nh4
N2
NO
Ок-ль
HNO3 р
HNO3
оч.
 разб.
разб.Nh5NO3
HNO3 к
N2O
NO
NO2
h3SO4 к
h3S
S
SO2
h3↑
h3↑
—
HCl
h3SO3
h3SO4 р
h4PO4
14. МЕТАЛЛ+ КИСЛОТА
Пример :Mg + HNO3оч.p → Mg(NO3)2 + Nh5NO3 + h3O
Mg – 2e → Mg+2
4
N+5 + 8e → N-3
4Mg + 10HNO3p → 4Mg(NO3)2 + Nh5NO3 + 3h3O
Внутримолекулярные ОВР
Пример:
2 ,t
2 KClO3 MnO
2 KCl 3O2
Cl+5 +6e → Cl-1 2 — окислитель
2O-2 -4e → O2
3 — восстановитель
Реакции диспропорционирования
Пример:
t
4 KClO3
3KClO4 KCl
Cl+5 + 6e → Cl-1 1 — окислитель
Cl+5 – 2e → Cl+7 3 – восстановитель
Задания для самостоятельной работы
1. Какие из следующих реакций являются окислительновосстановительными:
А) KOH + CuCl2 → KCl + Cu(OH)2
Б) KBr + Cl2 → KCl + Br2
В) Fe(OH)3 → Fe2O3 + h3O
Г) Pb(NO3)2 → PbO + NO2 + O2
2. Закончите уравнения следующих процессов:
А) Al0 – 3e =
Б) S+6 + 8e =
B) N-3 – 5e =
Г) Fe+3 + 1e =
Д) Br2 + 2e =
E) Mn+2 – 5e =
Какие из этих процессов являются процессами восстановления?
3.
 Какие из следующих веществ могут быть:
Какие из следующих веществ могут быть:А) только окислителями
Б) только восстановителями
В) и окислителями и восстановителями:
CrO3, Mg3P2, Na2CrO4, SO2, KI, KNO2, LiClO4, KH, Fe, h3O2,(Nh5)2S?
Укажите тип каждой из следующих
восстановительных реакций:
А) P + KOH + h3O → Ph4 + Kh3PO2
Б) h3SO3 + h3S → S + h3O
В) KClO3 → KCl + KClO4
Г) Nh5NO3 → N2O + h3O
Д) Cu + HNO3 → Cu(NO3)2 + NO + h3O
E) AgNO3 → Ag + NO2 + O2
Ж) Fe + Cl2 → FeCl3
4.
окислительно-
5.
Методом электронного баланса составьте уравнения
окислительно-восстановительных реакций, которые протекают
по схемам:
A) h3S + K2Cr2O7 + h3SO4 → S + Cr2(SO4)3 + K2SO4 + h3O
Б) C + HNO3 → CO2 + NO + h3O
B) MnO2 + NaBiO3 + HNO3 → HMnO4 + BiONO3 + NaNO3 + h3O
Г) NaI + NaIO3 + h3SO4 → I2 + Na2SO4 + h3O
Д) Mg + HNO3 → Mg(NO3)2 + N2O + h3O
E) PbO2 + MnSO4 + HNO3 → PbSO4 + Pb(NO3)2 + HMnO4 + h3O
Ж) KMnO4 + Nh4 → KNO3 + MnO2 + KOH + h3O
З) K2Cr2O7 + HClO4 + HI → Cr(ClO4)3 + KClO4 + I2 + h3O
K) C6h22O6 + KMnO4 + h3SO4 → CO2 + MnSO4 + K2SO4 + h3O
6.
 К какому типу окислительно-восстановительных реакций относится
К какому типу окислительно-восстановительных реакций относитсякаждая из следующих реакций:
A) h3O2 + K2Cr2O7 + HCl → CrCl3 + KCl + O2 + h3O
Б) h3O2 → h3O + O2
B) h3O2 + KNO2 → KNO3 + h3O
Какую роль (окислителя; восстановителя; и окислителя, и
восстановителя) играет пероксид водорода в каждой из этих
реакций? Составьте уравнения реакций методом электронного
баланса.
7. Проанализируйте следующие уравнения реакций:
2 KMnO4 + 5K2SO3 + 3h3SO4 = 2MnSO4 + 6K2SO4 + 3h3O
2 KMnO4 + 3K2SO3 + h3O = 2MnO3 + 3K2SO4 + 2KOH
2 KMnO4 + 3K3SO4 + 2KOH = 2K2MnO4 + K2SO4 + h3O
В каком случае глубина восстановления KMnO4:
А) Наибольшая
Б) Наименьшая?
ТЕСТЫ
Вариант №1
1. Какие из следующих веществ могут являться окислителями?
А) Nh4 Б) Br2 В) KClO3 Г) Fe Д) HNO3
2. Как называется следующий процесс и сколько электронов в нем
участвует: Cl02 → 2Cl+1:
А) восстановление, 1е
Б) окисление, 2е
В) восстановление, 2е
Г) окисление, 1е
3.

 11.16
11.16