Fe2O3 HCl=FeCl3 h3O решение… -reshimne.ru
Новые вопросы
Ответы
Fe2O3+6HCl=2FeCl3+3h3O
Похожие вопросы
В реакцию с раствором гидроксида натрия вступает k2s so3 na2so3 baso4 помогите пожалуйста экзамен…
На 1,3 кг медно-магниевого сплава подействовали избытком разбавленной серной кислоты,при этом образовалось 0,224 м3 газа (ну) .определите % содержание меди в сплаве…
В реакцию с раствором гидроксида натрия вступает k2s so3 na2so3 baso4…
Генетический ряд Fe-FeCL2-Fe(OH)2-Fe(OH)3-Fe(NO3)…
3 грамма соли KNo3 растворили в 35 граммах воды. определите процент массовую долю соли в растворе…
определите процент массовую долю соли в растворе…
К какому классу будет относиться вещество с формулой C5h20O2?…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
МузыкаПраво
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
что, как сбалансировать и часто задаваемые вопросы
Написано Нилой Бхаттачарьяin Химия
In a reaction sequence, one or more products are generally formed. Let us see how the reaction of HCl and Fe2O3 имеет место.
Let us see how the reaction of HCl and Fe2O3 имеет место.
Hydrochloric acid can be found in both liquid and gaseous (hydrogen chloride) forms. Iron(III) Oxide(Fe2O3) is naturally found as гематит ore in rocks and can be prepared from even normal oxidation of Iron. These crystals have various polymorphs and are used in the production of Iron and such alloys.
In this article, we will observe the reaction properties and products of the acid and the metal oxide.
Что является продуктом HCl и Fe2O3?HCl и Fe2O3 react to form Ferric Chloride and water respectively. The reaction equation is:
- Fe2O3 + 6HCl = 2FeCl3 + 3ч2O
The reaction of HCl with Fe2O3 is a neutralisation reaction as the amphoteric Iron oxide reacts with the acid to give salt and water.
Ниже приведены шаги для приравнивания приведенной выше схемы реакции:
- Шаг 1: Put the general chemical equation:
- Fe2O3 + HCl = FeCl3 + Н2O
- Step 2: As both sides should be equal in atoms, keeping in mind the stoichiometry, multiply FeCl3 with 2 to equate the Iron atoms.
- Fe2O3 + HCl = 2FeCl3 + Н2O
- Шаг 3: Equate the Oxygen atoms per unit of the compound.
- Fe2O3 + HCl = 2FeCl3 + 3ч2O
- Шаг 4: Since product side has 6 chlorine atoms per unit, the reaction should be equaled with the same number.
- Fe2O3 + 6HCl = 2FeCl3 + 3H2O
The measurement of Fe2O3 is performed by a method called gravimetric analysis, primarily involving hydrochloric acid solution. Following is the overall procedure required with specific apparatus:
Following is the overall procedure required with specific apparatus:
- Коническая колба
- Стаканы
- Фильтрующая бумага
- Бунзеновская горелка
- The oxide is solvated in the hydrochloric acid medium in a conical flask.
- The conical flask is heated with ammonia and a few drops of dilute nitric acid are added. The solution is stirred for some time.
- The medium is washed to keep away impurities and it is repeated.
- The solution is filtered and washed again.
- A sticky reddish precipitate is obtained which is soluble in dilute acids
- It is heated and dried to measure purity. Any pieces of filter paper are added and the process is repeated.
- The amount of Ferric oxide obtained is measured,
- Weight of Iron is found by mathematical calculations.

The net ionic equation stands as the formation of Iron(III) ions and Chloride ions along with the proton and hydroxyl ions from water.
- 2Fe2+(aq) + 3O2-(вод) + H+(водн.) + Cl–(aq) = 2Fe3+(aq)+ 3Cl–(aq) + H+(aq) + OH–(Водно)
Conjugate acid-base pairs refer to those pairs of compounds where the chemical difference between them is just one proton. For instance,
- Сопряженное основание HCl = Cl–
- Conjugate base of H2O = OH–
HCl shows ionic interactions in an aqueous medium. On comparing electronegativity values, Fe2O3 is found to be polar covalent in nature due to small size of Fe3+ ion. FeCl3 produces electrostatic interactions, with Лондонские дисперсионные силы due to polarization of electron cloud in chlorine.
On comparing electronegativity values, Fe2O3 is found to be polar covalent in nature due to small size of Fe3+ ion. FeCl3 produces electrostatic interactions, with Лондонские дисперсионные силы due to polarization of electron cloud in chlorine.
| Элемент | Electronegativity(approx.) |
|---|---|
| Утюг | 1.8 |
| Кислород | 3.5 |
| водород | 2.1 |
| Хлор | 3.0 |
Reaction Enthalpy of above reaction is -281 kJ/mol.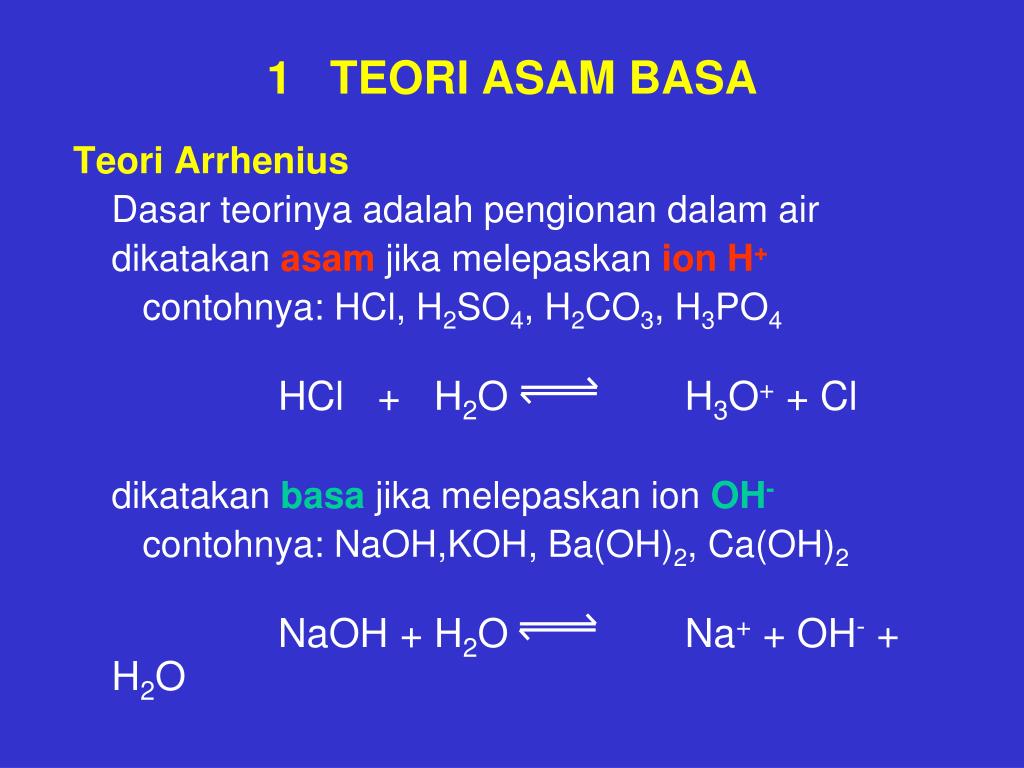 Реакция энтальпия can be found if individual enthalpy of formations are observed. The enthalpy information is as follows:
Реакция энтальпия can be found if individual enthalpy of formations are observed. The enthalpy information is as follows:
- Enthalpy of Formation of Fe2O3 = -822.0 kJ/mol
- Enthalpy of Formation of HCl = -92.3 kJ/mol
- Enthalpy of Formation of FeCl3 = -399.5 kJ/mol
- Enthalpy of Formation of H2O = -285.8 kJ/mol
Эта комбинация не даст сильного буферный раствор as a strong acid like hydrochloric acid is already present.
HCl + Fe2O3 Полная реакция?Реакция завершается, так как в конце образуются полные продукты, как только достигается равновесие.
HCl + Fe2O3 экзотермическая реакция?Результирующая реакция носит экзотермический характер, поскольку энтальпия реакции отрицательна, что приводит к повышению температуры системы.
Реакция HCl и Fe2O3 cannot be termed redox as it does not involve any change In oxidation state of the elements to the product side.
HCl + Fe2O3 реакция осаждения?It is not a precipitation reaction as the product does not precipitate in the system as an insoluble solid.
HCl + Fe2O3 обратимая реакция?Реакция необратима по своей природе, так как образуются полные продукты, которые не могут вернуться, если не произойдет изменение температуры, давления или других условий.
HCl + Fe2O3 реакция смещения?The reaction of Hydrochloric acid with Ferric Oxide is a double displacement reaction.
ЗаключениеReaction of hydrochloric acid with ferric oxide produces an orange-red solution of ferric chloride which is oxidising in nature. The oxidation state of Fe remains unchanged. Ferric chloride is dubbed as “salt” as a result of neutralisation.
The oxidation state of Fe remains unchanged. Ferric chloride is dubbed as “salt” as a result of neutralisation.
Последние посты
ссылка на 11 фактов о Hcl + h3O: реакция с несколькими элементами11 фактов о Hcl + h3O: реакция с несколькими элементами
В этой статье мы собираемся обсудить детали реакции между HCl + h3O, а также то, как сбалансировать реакции с примерами. HCl является одним из компонентов желудочного сока. Хлористый водород…
Продолжить чтение
ссылка на 9 примеров реакции двойной замены: подробное объяснение9 примеров реакции двойной замены: подробное объяснение
В этой статье мы подробно рассмотрим, что такое примеры реакции двойной замены. Реакция гидрокарбоната натрия и уксусной кислотыРеакция плавиковой кислоты и натрия…
Продолжить чтение
What, How to Balance & FAQs – Lambda Geeks
Автор: Нилой Бхаттачарьян Химия
В последовательности реакций обычно образуется один или несколько продуктов. Посмотрим, как протекает реакция HCl и Fe 2 O 3 .
Соляная кислота может быть как в жидком, так и в газообразном (хлороводород) формах. Оксид железа (III) (Fe 2 O 3 ) в природе встречается в виде гематитовой руды в горных породах и может быть получен даже путем нормального окисления железа. Эти кристаллы имеют различные полиморфные модификации и используются в производстве железа и подобных сплавов.
В этой статье мы рассмотрим свойства реакции и продукты реакции кислоты и оксида металла.
Что является продуктом HCl и Fe 2 O 3 ?HCl и Fe 2 O 3 реагируют с образованием хлорида железа и воды соответственно. Уравнение реакции:
- Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O
0012 Какой тип реакции HCl + Fe 2 O 3 ?
Реакция HCl с Fe 2 O 3 представляет собой реакцию нейтрализации, поскольку амфотерный оксид железа реагирует с кислотой с образованием соли и воды.
Ниже приведены шаги для уравнивания приведенной выше схемы реакции:
- Этап 1: Поставьте общее химическое уравнение:
- Fe 2 O 3 + HCl = FECL 3 + H 2 O
- Шаг 2: как обе стороны должны быть равны атомам, с учетом Stoichiometr 3 с 2, чтобы приравнять атомы железа.
- FE 2 O 3 + HCL = 2FECL 3 + H 2 O
- Шаг 3: Приравнивают атомы кислорода на единицу компонента.
- FE 2 O 3 + HCl = 2FECL 3 + 3H 2 O
- Шаг 4: , так как сторона продукта имеет 6 атомов хлора на единицу, реакция должна быть равна по сравнению с с помощью у равной по сравнению с с помощью с помощью у равной по сравнению с по сравнению с с помощью у равной по сравнению с по сравнению с с помощью у равной по сравнению с по сравнению с помощью с помощью у равной по сравнению с по сравнению с реакцией реакция равна с помощью у равной с помощью с такое же количество.

- FE 2 O 3 + 6HCl = 2FECL 3 + 3H 2 O
- Conical flask
- Beakers
- Filter Paper
- Bunsen Burner
- Оксид сольватируют в среде соляной кислоты в конической колбе.
- Коническую колбу нагревают с аммиаком и добавляют несколько капель разбавленной азотной кислоты. Раствор перемешивают некоторое время.
- Среду промывают для удаления примесей и повторяют.

- Раствор фильтруют и снова промывают.
- Образуется липкий красноватый осадок, растворимый в разбавленных кислотах
- Нагревают и сушат для измерения чистоты. Добавляются любые кусочки фильтровальной бумаги, и процесс повторяется.
- Измеряют количество полученного оксида железа,
- Массу железа находят математическим расчетом.
Суммарное ионное уравнение представляет собой образование ионов железа (III) и ионов хлорида воды вместе с протонными и гидроксильными ионами.
- 2FE 2+ (AQ) + 3O 2- (AQ) + H + (AQ) + CL — (AQ) = 2FE 3+ 3+ 3+ 3+ 353333333333 (AQ) = 2FE 3+ 3+ 3+ 3+ 3+ 353333333 (AQ) = 2FE 3+ 3+ 3+ 3+ 3. 3CL — (AQ) + H + (AQ) + OH — (AQ)
ON 3 ПАРЯС к тем парам соединений, где химическая разница между ними составляет всего один протон. Например,
Например,
- Conjugate base of HCl= Cl –
- Conjugate base of H 2 O = OH –
HCl проявляет ионные взаимодействия в водной среде. При сравнении значений электроотрицательности обнаружено, что Fe 2 O 3 имеет полярную ковалентную природу из-за небольшого размера иона Fe 3+ . FeCl 3 производит электростатические взаимодействия с Лондонские дисперсионные силы из-за поляризации электронного облака в хлоре.
| Element | Electronegativity(approx.) |
|---|---|
| Iron | 1. 8 8 |
| Oxygen | 3.5 |
| Hydrogen | 2.1 |
| Chlorine | 3,0 |
Энтальпия реакции приведенной выше реакции составляет -281 кДж/моль . Реакция энтальпия может быть найдена при соблюдении индивидуальных энтальпий пластов. Информация об энтальпии следующая:
- Энтальпия образования Fe 2 O 3 = -822,0 кДж/моль
- Энтальпия образования HCl = -92.3 kJ/mol
- Enthalpy of Formation of FeCl 3 = -399.
 5 kJ/mol
5 kJ/mol - Enthalpy of Formation of H 2 O = -285.8 kJ/mol
Эта комбинация не даст сильного буферного раствора , поскольку уже присутствует сильная кислота, такая как соляная кислота.
Is HCl + Fe 2 O 3 Полная реакция?Реакция завершается, так как в конце образуются полные продукты, как только достигается равновесие.
Является ли HCl + Fe 2 O 3 экзотермической реакцией?Результирующая реакция носит экзотермический характер, поскольку энтальпия реакции отрицательна, что приводит к повышению температуры системы.
Является ли HCl + Fe 2 O 3 окислительно-восстановительной реакцией? Реакция HCl и Fe 2 O 3 не может быть названа окислительно-восстановительной, поскольку она не связана с изменением степени окисления элементов в сторону продукта.
Это не реакция осаждения, так как продукт не осаждается в системе в виде нерастворимого твердого вещества.
Is HCl + Fe 2 O 3 а Обратимая реакция?Реакция необратима по своей природе, так как образуются готовые продукты, которые не могут вернуться в исходное состояние, если не произойдет изменение температуры, давления или других условий.
Является ли HCl + Fe 2 O 3 реакцией замещения?Реакция соляной кислоты с оксидом железа представляет собой реакцию двойного замещения.
Заключение Реакция соляной кислоты с оксидом железа дает оранжево-красный раствор хлорида железа, который по своей природе является окислителем. Степень окисления Fe остается неизменной. Хлорное железо называют «солью» в результате нейтрализации.
Хлорное железо называют «солью» в результате нейтрализации.
Recent Posts
ссылка на 11 фактов о Hcl + h3o: реакция с несколькими элементами11 фактов о Hcl + h3o: реакция с несколькими элементами
также как сбалансировать реакции с примерами. HCl является одним из компонентов желудочного сока. Хлороводород…
Продолжить чтение
ссылка на 9 примеров реакции двойного замещения: подробное объяснение9 примеров реакции двойного замещения: подробное объяснение
В этой статье мы подробно рассмотрим примеры реакции двойного замещения. Реакция гидрокарбоната натрия и уксусной кислотыРеакция плавиковой кислоты и натрия…
Продолжить чтение
[PDF] 2, KMnO4 и т.д. — Скачать PDF бесплатно
Химические реакции и уравнения Важнейшее явление в химии – химическая реакция, т.е. химическое превращение вещества. Способность (или неспособность) вступать в химическую реакцию
— химическое свойство. Примеры: Металл Са быстро окисляется воздухом О2 с образованием оксида кальция, СаО — это хим. свойство кальция. Поэтому Ca не встречается в природе в виде свободного металла, а только в его соединениях. Металлическое золото Au не окисляется O2 и большинством других известных окислителей, но реагирует с крайне агрессивной «царской водкой» — смесью соляной HCl и азотной HNO3 кислот. Это хим. свойства золота.
Примеры: Металл Са быстро окисляется воздухом О2 с образованием оксида кальция, СаО — это хим. свойство кальция. Поэтому Ca не встречается в природе в виде свободного металла, а только в его соединениях. Металлическое золото Au не окисляется O2 и большинством других известных окислителей, но реагирует с крайне агрессивной «царской водкой» — смесью соляной HCl и азотной HNO3 кислот. Это хим. свойства золота.
На языке химии химические реакции обозначаются как
химические уравнения: «Предложения по химии» Состоят из двух частей:
Реагенты 2Ca(s) + O2(g) 2CaO(s)
Продукты
2Au(s)+11HCl(l)+3HNO3 (l)2HAuCl4(aq)+2NOCl(g)+6h3O(l)
Химическое уравнение показывает: — Природа реагентов и продуктов — Молярные отношения между всеми участвующими веществами Они выражаются через СТЕХИОМЕТРИЧЕСКИЕ КОЭФФИЦИЕНТЫ перед формула
— Дополнительная информация о физическом состоянии всех участвующих веществ и условиях реакции (например, повышенная температура, давление и т.
Виды химических реакций Синтез (сочетание): 2 или более веществ соединяются в одно вещество, А+В P 2Cu(т)+O2(г)2CuO(т) SO3(т) + h3O(ж) h3SO4 (м) Разложение: 1 вещество превращается в 2 или более веществ A B+C+… (Nh5)2Cr2O7(т) N2 + Cr2O3(т) + 4h3O(г) Однократное замещение: AX + Y AY + X 2KI( т) + Cl2(г)(т) → 2KCl(т) + I2(г) Ch5(г) + Cl2(г) → Ch4Cl(г) + HCl(г) Zn(т) + HCl(вод) → ZnCl2 (водн.) + h3(г) Двойное замещение: AX + BY AY + BX (никогда AB как продукт!) NaCl(водн.) + AgNO3(водн.) AgCl(т) + NaNO3(водн.) Ch4I + KOH Ch4OH + КИ
Типичные задачи: определить тип, предсказать произведение rxn и завершить химическое уравнение: Mg + O2 синтез MgO 2HgO разложение 2Hg + O2 Fe + 2HCl(водн.) FeCl2 + 2h3 однократное замещение BaCl2(водн.) + Na2SO4(водн.) BaSO4(тв.) + 2NaCl(водн.) AgNO3(водн.) + NaBr(водн.) AgBr(тв.) + NaNO3(водн.)
Синтез, разложение и однократное замещение свободными элементами может быть окислением- восстановление rxn, т.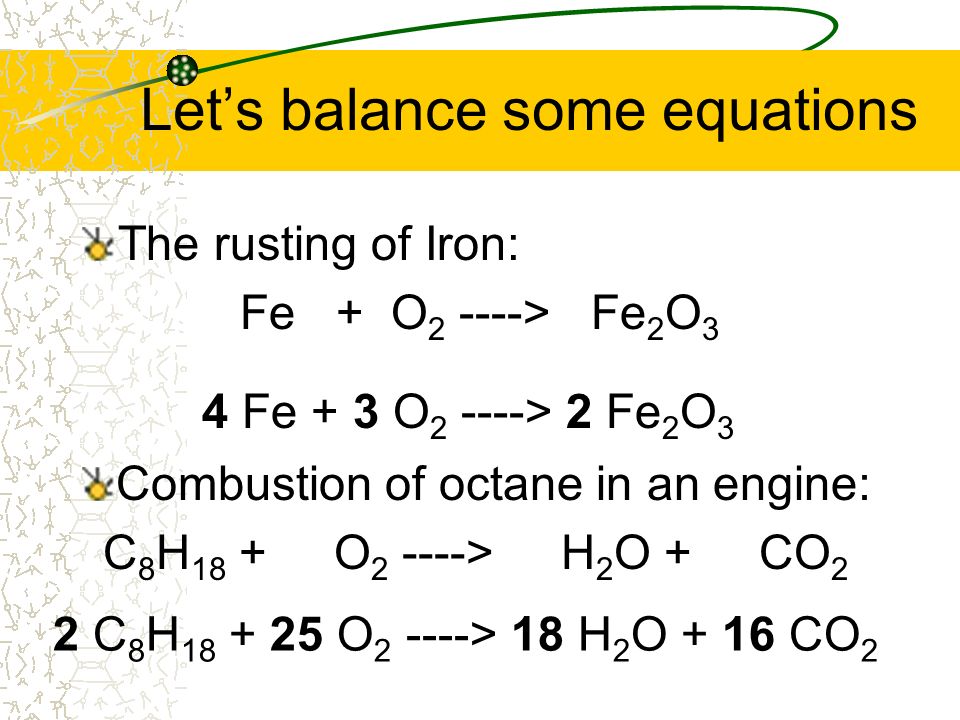
Существует много неокислительно-восстановительных синтеза и разложения соединений, а не элементов: SO3 + h3O h3SO4 является синтезом rxn, но не окислительно-восстановительным rxn (ни один элемент не меняет свою степень окисления) CaCO3 CaO + CO2 Образование молекул путем сочетание атомов также является синтезом rxn, но не окислительно-восстановительным: 2I I2 или 2O3 3O2
Одиночное Замещение: 2KBr(т) + Cl2(г) 2KCl(т) + Br2(ж) Степени окисления элементов : ЛЕВАЯ СТОРОНА:
K(+1) Br(-1) Cl(0)
ПРАВАЯ СТОРОНА:
K(+1) Cl(-1) Br(0)
В процессе rxn:
2Br(-1) -2e- Br2 (0) Cl2 (0) +2e- 2Cl( -1)
окисление бромид-иона, Br-
восстановление хлора, Cl2 Более активный неметалл вытесняет менее активный неметалл из его соединений Наиболее активные неметаллы находятся в верхней правой части таблицы; Cl2 более активен, чем Br2 или I2, поэтому вытесняет их, как и в приведенном выше рхн.
2HCl(водн.) + Zn(т) ZnCl2(водн.) + h3(г) 2H(+1) + 2e- h3(0) Zn(0) — 2e- Zn(+2)
гидратированный ион H+ восстановился, металлический цинк окислился
Cl(-1) не изменился их соединения
Cu(+2) Cu(0) Zn(0) Zn(+2)
Li>K>Ba>Ca>Na>Mg>Al>Mn>Zn>Fe>Cd>Co> Ni>Sn>Pb>h3>Cu>Ag>Pt>Au
РЯД МЕТАЛЛОВ ПО АКТИВНОСТИ содержит металлы, расположенные по убывающей активности. Те, кто слева, вытесняют тех, кто справа от их соединений:
Металлы слева от водорода вытесняют h3 из кислот, т.е. водных растворов соединений ГК, выделяя в раствор ионы Н+, а металлы справа от h3 этого сделать не могут. M + HA MA + h3↑ (т.е. газообразный водород) Наиболее активны
вытесняют h3 из жидкой воды: Ca + h3O Ca(OH) 2 + h3
вытесняют h3 из кислот: Zn + HCl ZnCl2 + h3 & из горячего пара: Mg + h3O MgO + h3
вытесняют h3 из кислот: Sn + HCl SnCl2 + h3
не вытесняют водород Наименее активны
Типичная задача:
Определить, что может или не может произойти некоторое одиночное смещение rxn, и если оно может, предсказать его продукты (завершить уравнение): Cu + AgNO3 Cu(NO3)2 + Ag↓ Cu + HCl(водн.
Наиболее активные металлы (группа IA, а также Ca, Ba) вытесняют водород не только из кислот, но и из жидкой воды с образованием газа h3 и гидроксида металла (щелочи): 2Na +2h3O 2NaOH + h3 Ca+2h3O Ca (OH) 2+ h3 При высокой температуре многие другие металлы вытесняют водород из водяного пара (пара): Mg + h3O(г) MgO(т) + h3 Fe + h3O(г) FeO(т) + h3
Другие восстановители: При нагревании h3 и C вытесняют большинство металлов из их соединений, особенно из оксидов – наиболее распространенной формы металлических руд. символ нагрева C(т) + Fe2O3(т) Fe(т) + CO(г)
h3(г) + Fe2O3(т) Fe + h3O(г) окислительно-восстановительные рхнс. Одиночное замещение не обязательно является окислительно-восстановительным: SiO2 + CaCO3 CaSiO3 + CO2 степени окисления не меняются. A + BX AX + B ГОРЕНИЕ является частным случаем окислительно-восстановительного процесса с участием O2 в качестве окислителя и приводит к сильному выделению тепла: Бензин: C8h28(g) + O2(g) CO2(g) + h3O(g) Кислород восстанавливается, углерод окисляется.
БАЛАНСИРОВКА ХИМИЧЕСКИХ УРАВНЕНИЙ Поскольку атомы не исчезают в химических реакциях, правильное химическое уравнение должно быть сбалансировано для каждого участвующего элемента.
3C + Fe2O3 → 3CO + 2Fe
C8h28 + O2 → CO2 + h3O
Никогда не начинайте со свободного элемента. Сначала игнорируйте. Слева 8C – справа нужно 8CO2:
C8h28 + O2 8CO2 + h3O Теперь посчитаем H: слева 18H, справа положим 9h3O: C8h28 + O2 8CO2 + 9h3O Теперь посчитаем кислород справа: есть 16+9=25 атомов кислорода. Слева 2 атома кислорода – считайте сначала, что это не дикислород, а O: C8h28 + 25 O 8CO2 + 9h3O Так как это должен быть O2, берите все дважды:
2C8h28 + 25O216CO2+18h3O 2Al + 3FeO → Al2O3 + 3Fe FeS2 + O2 → Fe2O3 + SO2
Проверьте балансировку для каждого элемента.
остаток Fe первый:
2FeS2 + O2 Fe2O3 + SO2 следующий остаток S 2FeS2 + O2 Fe2O3+ 4SO2 считать кислород справа: 11 O, взять 11 O слева, игнорировать O2 2FeS2 + 11O2 Fe2O3 + 4SO2 взять все дважды:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
проверьте баланс каждого элемента.
Реакции ионов в водных растворах Ионные соединения растворяются в воде путем диссоциации на гидратированные ионы:
Растворение NaCl: h3O
NaCl(s) Na+(водн.) + Cl-(водн.) Растворение AgNO3: h3O
AgNO3(s) Ag+(aq) + NO3-(aq)
Вещества, образующие ионы при растворении, являются ЭЛЕКТРОЛИТАМИ. Их растворы проводят электрический ток. Ионы в растворе перемещаются и реагируют независимо друг от друга.
Если комбинация ионов в растворе образует нерастворимое соединение, это соединение выпадает в осадок, что означает, что реакция происходит и может завершиться. + При смешивании растворов NaCl и AgNO3 Ag и Cl образуют нерастворимую соль AgCl
Na+(вод) + Cl-(вод)+Ag+(вод) + NO3-(вод) AgCl + Na+(вод) + NO3-(водн.)
Только ионы Ag+ и Cl- участвуют в rxn, образуя твердое вещество, а Na+ и NO3- остаются в растворе. Они ЗРИТЕЛИ.
ЧИСТОЕ ИОННОЕ УРАВНЕНИЕ игнорирует ионы-спектаторы: Ag+(водн.) + Cl-(водн.) AgCl(тв)
Ионы-спектаторы могут быть заменены другими ионами без изменения общего ионного уравнения. KCl(aq)+AgC2h4O2(aq)AgCl(s)+KC2h4O2(aq)
KCl(aq)+AgC2h4O2(aq)AgCl(s)+KC2h4O2(aq)
Классы неорганических соединений Катионы металлов (&Nh5+) Неметаллические и многоатомные анионы Na+, Mg2+, Al3+, Pb4+ и т.д.
Cl-, O2-, S2-, N3-, C4-, OH-, SO42-, CO32-, MnO4- и т. д.
Их комбинации: Катион металла и оксид: Оксид металла Cu2O, MgO, Fe2O3, PbO2 и т. д. Катион металла и OH- гидроксид: гидроксид металла NaOH, Mg(OH)2, Al(OH)3 и т. д. Катион металла и любой другой анион: СОЛИ NaCl, CoS, Ca(NO3)2, KMnO4 и т. д.
Кислоты: соединения, выделяющие H+ в растворе: HCl(водн.) → H+(водн.) + Cl-(водн.), основные кислоты: HCl
соляная кислота, (соли: хлориды)
HNO3 азотная кислота (соли нитраты ) h3SO4 серная кислота (сульфаты) HClO4 хлорная кислота (перхлораты)
HNO2 азотистая кислота (нитриты)
Ch4COO- + H+ (ацетаты)
Основания: соединения, принимающие H+ в растворе, в частности содержащие OH-, такие как гидроксиды металлов: Ca(OH)2 Ca2+ +2OHЭти OH- соединяются с H+ с образованием воды, H-O-H Это НЕЙТРАЛИЗАЦИЯ rxn:
+
—
H + OH h3O напр. NaOH + HCl NaCl + h3O Результат двойного смещения rxn между ионными соединениями можно предсказать, исходя из правил растворимости.
NaOH + HCl NaCl + h3O Результат двойного смещения rxn между ионными соединениями можно предсказать, исходя из правил растворимости.
Общее правило растворимости, известное алхимикам: подобное растворяется в подобном. Неполярные органические вещества не растворяются в воде, но растворяются в неполярных органических жидкостях, напр. бензин (октан, С8х28) в воде не растворяется, а неполярные органические вещества растворяются в октане. Ионные соединения могут растворяться в воде, в некоторой степени – в других полярных растворителях, таких как этанол, C2H5OH, но не в октане. Водные растворы наиболее важны для ионных соединений.
Чтобы определить, будет ли образовываться осадок при ионном двойном замещении rxn, используйте
ПРАВИЛА РАСТВОРИМОСТИ 1. Все соли Na+, K+ (группа IA) и аммония, Nh5+, и все нитраты (NO3-) и ацетаты (C2h4O2- ) растворимы (не исключение). [например. K3PO4, (Nh5)2CO3, Pb(NO3)2, Mg(C2h4O2)2] 2. Большинство хлоридов (Cl-) и сульфатов (SO42-) растворимы, за исключением: AgCl, BaSO4, PbSO4, которые нерастворимы. [FeCl2, MgSO4]
[FeCl2, MgSO4]
3. Большинство карбонатов (CO32-), фосфатов (PO43-), сульфидов (S2-) и гидроксидов (OH-) нерастворимы (кроме перечисленных выше). например [MgCO3, FePO4, CuS, Pb(OH)2] 4. Все соли, содержащие H в анионе (кислые соли), растворимы: нерастворимы растворимы CaCO3 Ca(HCO3)2 Ca3(PO4)2 CaHPO4 Ca(h3PO4)2 Типичная задача :
Предсказать, произойдет ли rxn при смешивании двух заданных решений. Составьте уравнения растворения реагентов, а затем полные ионные и суммарные ионные уравнения, где это необходимо: (т) 2Na+(водн.) + SO42-(водн.)
Ba2+(водн.)+2NO3-(водн.)+2Na+(водн.)+ SO42-(водн.) BaSO4 + 2Na+(водн.) + 2NO3-(водн. )
Суммарное ионное уравнение:
Ba2+(водн.)+SO42-(водн.)BaSO4 Растворы KOH и FeCl3 KOH(s) K+(водн.) + OH-(водн.) FeCl3(тв.) Fe3+(водн. ) + 3Cl-(водн.) 3K+(водн.) + 3OH-(водн.) + Fe3+(водн.) + 3Cl-(водн.) Fe(OH)3 + 3K+(водн.) + 3Cl-(водн.) Fe3+(водн.) + 3OH-(водн.) Fe(OH)3
Растворы (Nh5)2CO3 и CaCl2 Завершите независимо.
Две другие причины, помимо осаждения, по которым реакция может произойти и завершиться: Образование газа (наблюдаются пузырьки, один из продуктов выделяется в виде газа): Пример 1.
Растворы Na2CO3 и HCl, смешанные: Na2CO3 (s) 2Na+(водн.) + CO32-(водн.) HCl H+(водн.) + Cl-(водн.)
2Na+(водн.) + CO32-(водн.)+ 2H+(водн.) + 2Cl-(водн.) 2Na+(водн.) + 2Cl-(водн.) + h3O + CO2
Na+ и Cl- ионы-спектаторы Суммарное ионное уравнение: CO32-(водн.)+ 2H+(водн.) h3O + CO2
Пример 2.
KOH + Nh5Cl Nh4 + KCl + h3O
Дополнить самостоятельно. _____________________________________________________________________________________________________________
Образование молекулярного неионизированного соединения, такого как вода: KOH + HCl h3O + KCl K+ + OH- + H+ + Cl- h3O + K+ + ClNet ионное уравнение
+
—
H + OH h3O Нейтрализация rxn (высокая экзотермическая реакция!)
Образование воды является мощной движущей силой для возникновения rxn.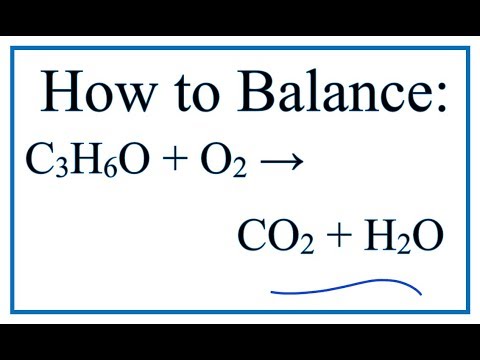 Даже нерастворимые в воде гидроксиды металлов, такие как Cu(OH)2, или оксиды металлов, такие как Fe2O3, реагируют с кислотами с образованием воды: Cu(OH)2(s) + HCl(aq) → CuCl2(aq) + h3O Чистая ионная : Cu(OH)2(т) + 2H+(водн.) Cu2+(водн.) + 2h3O Fe2O3(тв) + HCl(водн.) FeCl3(водн.) + h3O Чистый ионный: Fe2O3(т) + 6H+(водн.) 2FeCl3(aq) + 3h3O Это тоже нейтрализация rxn (поскольку исчезает кислота). Оксиды неметаллов реагируют с основаниями: SO2(т) + Ca(OH)2(р) → CaSO3(т) + 2h3O Оксиды металлов и неметаллов реагируют между собой: CaO(т) + CO2(г) → CaCO3( с)
Даже нерастворимые в воде гидроксиды металлов, такие как Cu(OH)2, или оксиды металлов, такие как Fe2O3, реагируют с кислотами с образованием воды: Cu(OH)2(s) + HCl(aq) → CuCl2(aq) + h3O Чистая ионная : Cu(OH)2(т) + 2H+(водн.) Cu2+(водн.) + 2h3O Fe2O3(тв) + HCl(водн.) FeCl3(водн.) + h3O Чистый ионный: Fe2O3(т) + 6H+(водн.) 2FeCl3(aq) + 3h3O Это тоже нейтрализация rxn (поскольку исчезает кислота). Оксиды неметаллов реагируют с основаниями: SO2(т) + Ca(OH)2(р) → CaSO3(т) + 2h3O Оксиды металлов и неметаллов реагируют между собой: CaO(т) + CO2(г) → CaCO3( с)
Окислительно-восстановительный процесс в водном растворе можно также рассматривать с точки зрения участвующих ионов Cu(s)+2AgNO3(aq) Cu(NO3)2(aq) +2Ag(s)
Cu(s)+2Ag+( водн.) +2NO3-(водн.)Cu2+(водн.) + 2NO3-(водн.)+2Ag(тв)
Суммарное ионное уравнение:
Cu(тв)+2Ag+(водн) → Cu2+(водн) + 2Ag(тв) ) Полуреакции переноса электрона:
Окисление Cu(s) Cu2+(водн.) + 2eВосстановление 2Ag+(водн.)+2e- 2Ag(s)
Поскольку e- в химии не разрушаются, окисление всегда сопряжено с восстановлением , & количество электронов, отпущенных одним элементом, должно быть равно количеству электронов, принятых другим элементом.




 5 kJ/mol
5 kJ/mol