Задания на установление продуктов взаимодействия неорганических веществ.
Задание №1
Установите соответствие между исходными веществами и продуктами их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) NaOH + CO2 (изб.) → Б) NaOH (изб.) + CO2 → В) Na + H2O → Г) NaOH + HCl → | 1) NaOH + H2 2) Na2CO3 + H2O 3) NaHCO3 4) NaCl + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №2
Установите соответствие между исходными веществами и продуктами реакции.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) Fe + Cl2 Б) Fe + HCl В) FeO + HCl Г) Fe2O3 + HCl | 1) FeCl2 2) FeCl3 3) FeCl2 + H2 4) FeCl3 + H2 5) FeCl2 + H2O 6) FeCl3 + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №3
Установите соответствие между исходными веществами и продуктами их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) Fe + Cl2 Б) Fe + HCl В) Fe + H2SO4 (разбавл.) Г) Fe + H2SO4 (конц.) | 1) FeSO4 + H2 2) Fe2(SO4)3 + H2 3) Fe2(SO4)3 + SO2 + H2O 4) FeCl2 + H2 5) FeCl3 + H2 6) FeCl3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №4
Установите соответствие между реагирующими веществами и продуктами реакций.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) KHCO3 + KOH Б) KHCO3 + HCl В) K2CO3 + HNO3 Г) K2CO3 + ВаCl2 | 1) KNO3 + CO2 + H2O 2) KCl + Na2CO3 3) K2CO3 + H2O 4) KCl + H2O + CO2 5) ВаСO3+KCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №5
Установите соответствие между реагирующими веществами и продуктами реакции, содержащими кремний.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) Si + Mg Б) Si + NaOH(р-р) В) Ca2Si + H2O Г) SiO2 (изб.) + Mg | 1) SiH4 2) H2SiO3 3) Na2SiO3 4) Mg2Si 5) CaSiO3 6) Si |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №6
Установите соответствие между реагирующими веществами и продуктами реакции.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) Na2CO3 + HCl Б) Na2CO3 + CO2 + H2O В) Na2CO3 + H2O Г) Na2CO3 + СаСl2 | 1) NaCl + CaCO3 2) NaHCO3 3) NaHCO3 + HCl 4) NaOH + CO2 + H2O 5) NaOH + NaHCO3 6) NaCl + CO2 + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №7
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) MgO + SO2 → Б) MgO + SO3 → В) MgO + H2SО3 → Г) MgO + H2SО4 → | 1) MgSO3 2) MgSO3 + Н2 3) MgSO3 + Н2O 4) MgSO4 5) MgSO4 + H2 6) MgSO4 + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №8
Установите соответствие между реагирующими веществами и продуктами реакции.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) FeO + HCl Б) Fe2O3 + HCl В) Fe3O4 + HCl Г) Fe2O3 + NaOH | 1) FeCl2 + FeCl3+ H2O 2) FeCl3+ H2O 3) FeCl2+ H2O 4) Na3[Fe(OH)6] 5) NaFeO2 + H2O 6) Fe(OH)3 + NaCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №9
Установите соответствие между формулами реагирующих веществ и продуктами реакций.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) CaC2 + HCl → Б) Ca + H2O → В) CaO + H2O → Г) CaCO3 + H2O + CO2 → | 1) CaCl2 + H2O 2) Ca(OH)2 3) Ca(OH)2 + H2 4) CaCl2 + C2H2 5) Ca(HCO3)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №10
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) Ca(HCO3)2 + Ca(OH)2 Б) Ca(HCO3)2 + H2SO4 В) Ca(HCO3)2 Г) CaCO3 + CO2 + H2O | 1) CaCO3 + H2O 2) CaCO3 + CO2 + H2O 3) CaSO4 + H2O 4) CaSO4 + CO2 + H2O 5) CaCO3 + CO2 + Н2 6) Ca(HCO3)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №11
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А)Mg и H2SO4(конц.) Б) MgO и H2SO4 В) S и H2SO4(конц.) Г) H2S и O2(изб.) | 1) MgSO4 и H2O 2) MgO, SO2 и H2O 3) H2S и H2O 4) SO2 и H2O 5) MgSO4, H2S и H2O 6) SО3 и H2О |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №12
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
1) Zn(NO3)2 + H2 2) Zn(NO3)2 + H2O 3) K2ZnO2+ H2O 4) K2[Zn(OH)4] 5) ZnO + H2 6) ZnO + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №13
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
1) BeSO3 + H2 2) BeSO3 + H2O 3) Na2[Be(OH)4] 4) BeSO4 + H2O 5) Na2BeO2+ H2 6) Na2BeO2+ H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №14
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) S + H2SO4(конц.) Б) Cu + Н2SO4(конц.) → В)H2S + O2(изб. Г) SO2 + Br2 + Н2O → | 1) CuSO4 + SO2 + Н2O 2) Н2SO4 + HBr 3) SO2 + Н2O 4) SO3 + Н2O 5) S + Н2O 6) CuSO4 + H2 |
Задание №15
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) HCl + KHSO3 → Б) HCl + K2SO3 → В) HCl + KHS → Г) HCl + K2S → | 1) KCl + H2S 2) KCl + H2S + H2O 3) KCl + SO2 + H2O 4) KCl + H2SO4 5) KCl + H2SO4 + H2O 6) KCl + SO3 + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №16
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) Cu и HNO3(разб.) Б) CuS и O2 В) Cu и HNO3(конц.) Г) Cu и H2SO4(конц.) | 1) сульфат меди(II), оксид серы(IV) и вода 2) нитрат меди(II), оксид азота(II) и вода 3) сульфит меди(II), оксид серы(VI) и вода 4) оксид меди(II) и оксид серы(IV) 5) нитрат меди(II), оксид азота(IV) и вода 6) оксид меди(II) и оксид серы(VI) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №17
Установите соответствие между реагирующими веществами и продуктами реакции.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) CaCO3 + H2O + CO2 Б) Ca(HCO3)2 В) Ca(HCO3)2 + HNO3 Г) Ca + HNO3(разб. | 1) Ca(NO3)2 + H2O + CO2 2) Ca(OH)2 + NO2 + CO2 3) Ca(HCO3)2 4) Ca(NO3)2 + H2O + NO2 5) CaCO3 + H2O + CO2 6) Ca(NO3)2 + H2O + NH4NO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №18
Установите соответствие между реагирующими веществами и продуктами реакции.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) ВаO + SO2 → Б) ВаO + H2SO3 → В) ВаO + SO3 → Г) ВаO + H2SO4 → | 1) Ba(OH)2 + S 2) BaSO3 3) BaSO3 + H2 4) BaSO3 + H2O 5) BaSO4 6) BaSO4 + H2О |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №19
Установите соответствие между реагирующими веществами и продуктами реакции.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) Al и KOH(р-р) Б) Al и H2SO4(разб.) В) Al2S3 и H2O Г) Al и H2O | 1) гидроксид алюминия и сера 2) гидроксид алюминия и сероводород 3) тетрагидроксоалюминат калия и водород 4) сульфат алюминия и водород 5) алюминат калия и оксид алюминия 6) гидроксид алюминия и водород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеСкорость химической реакции
Дидактический материал
Скорость химической реакции и ее зависимость от различных факторов
1. При обычных условиях с наименьшей скоростью происходит взаимодействие между
1) железом и кислородом
2) магнием и 10%-ным раствором соляной кислоты
3) медью и кислородом
4) цинком и 10%-ным раствором
2. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
2СО+O2=2CO + Q необходимо
1) увеличить концентрацию оксида углерода (II)
2) уменьшить концентрацию кислорода
3) понизить давление
4) понизить температуру
3. При комнатной температуре с наибольшей скоростью протекает реакция между
1) Zn и HCl (1 % р-р)
2) Zn и HCl (30 % р-р)
3) Zn и HCl (10 % р-р)
4) ZnCl2 (р-р) и AgNO3 (р-р)
4. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния
1) концентрация кислоты
2) измельчение железа
3) температура реакции
4) увеличение давления
5. Для увеличения скорости химической реакции
FeO(тв) + CO(г) → Fe(тв) + СO2 (г) + 17 кДж
необходимо
1) увеличить концентрацию СО2
2) уменьшить концентрацию СО2
3) уменьшить температуру
4) увеличить степень измельчения FeO
6. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
2CuS(тв) + 3О2(г) = 2CuO(тв) + 2SO2 (г) + 2920 кДж
необходимо
1) увеличить концентрацию SО2
2) уменьшить концентрацию SО 2
3) уменьшить температуру
4) увеличить степень измельчения CuS
7. Для увеличения скорости химической реакции
Zn(тв) + 2Н+ → Zn2+ + H2 (г) + 154 кДж
необходимо
1) уменьшить концентрацию ионов цинка
2) увеличить концентрацию ионов водорода
3) уменьшить температуру
4) увеличить концентрацию ионов цинка
8. Для увеличения скорости химической реакции
Mg(тв) + 2Н+ → Mg2+ + H2(г) + 462 кДж
необходимо
1) уменьшить концентрацию ионов водорода
2) увеличить концентрацию ионов водорода
3) понизить температуру
4) повысить давление
9. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
Zn(тв) + 2НСl(г) = ZnCl2(тв) + H2(г) + 231 кДж
необходимо
1) увеличить концентрацию водорода
2) увеличить количество цинка
3) уменьшить температуру
4) увеличить концентрацию хлороводорода
10. Для увеличения скорости взаимодействия железа с хлороводородной кислотой следует
1) добавить ингибитор
2) понизить температуру
3) повысить давление
4) увеличить концентрацию соляной кислоты HCl
11. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно
1) разбавить кислоту
2) измельчить мрамор
3) добавить индикатор
4) проводить реакцию в атмосфере инертного газа
12. С наибольшей скоростью при обычных условиях взаимодействуют
1) азот и водород
2) магний и вода3) раствор гидроксида натрия и соляная кислота
4) сера и железо
13. С наибольшей скоростью при обычных условиях взаимодействуют
С наибольшей скоростью при обычных условиях взаимодействуют
1) цинк и соляная кислота
2) натрий и вода
3) магний и вода
4) свинец и соляная кислота
14. Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а скорость других — уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты столкновений частиц.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. C наибольшей скоростью реагирует с водородом
1) Сl2
2) F2
3) S
4) C
16. Оцените правильность утверждений.
А. Катализатор — это вещество, которое увеличивает скорость химической реакции, но при этом не расходуется.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Для увеличения скорости реакции водорода с азотом
1) охлаждают азотоводородную смесь
2) снижают давление в системе
3) используют катализатор
4) используют циркуляцию азотоводородной смеси
18. При повышении давления увеличивается скорость реакции
1) кислорода с сернистым газом
2) цинка с серной кислотой
3) серы с железом
4) гидроксида натрия с хлоридом меди (II)
19. Катализатор требуется для проведения реакции
1) хлорирования алканов
2) нейтрализации фосфорной кислоты
3) пиролиза метана
4) этерификации уксусной кислоты
20. С наибольшей скоростью при обычных условиях взаимодействуют
1) аммиак и хлороводород
2) азот и водород
3) азот и кислород
4) сернистый газ и кислород
21. Оцените правильность утверждений.
Оцените правильность утверждений.
А. При нагревании скорость многих реакций уменьшается.
Б. Катализатор — это вещество, которое увеличивает скорость химической реакции, но само в ней не расходуется
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
22. Давление влияет на скорость реакции между
1) гидроксидом цинка и азотной кислотой
2) цинком и серной кислотой
3) аммиаком и кислородом
4) серой и алюминием
23. Реакцию, уравнение которой
FeO + 2H+ = Fe2+ + H2O + Q,
можно ускорить, если
1) повысить давление
2) понизить давление
3) повысить температуру
4) понизить температуру
24. Скорость реакции
Zn + H2SO4 = ZnSO4 + H2 + Q
понизится при
1) повышении температуры
2) понижении давления
3) повышении давления
4) разбавлении раствора кислоты
25. Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
1) | Na, Ca, Zn, Cr, Cu |
2) | Mg, Na, Ni, Zn, Cu |
3) | Na, Ba, Fe, Cu, Zn |
4) | Ba, Na, Zn, Cu, Fe |
26. Оцените справедливость суждений.
А. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия..
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. Скорость реакции
Скорость реакции
N2 + 3H2 = 2NH3 + Q
увеличится при
1) понижении температуры
2) понижении концентрации NH3
3) разбавление смеси аргоном
4) использовании катализатора
28. Какой металл реагирует с серной кислотой быстрее других?
29. Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, — это
1) нейтрализация серной кислоты раствором гидроксида натрия
2) горение водорода в кислороде
3) взаимодействие растворов хлорида меди и гидроксида калия
4) горение алюминия в кислороде
Ответ: 1-3, 2-1, 3-4, 4-4, 5-4, 6-4, 7-2, 8-2, 9-4, 10-4, 11-2, 12-3, 14-2, 14-2, 15-2, 16-3, 17-3, 18-1, 19-4, 20-1, 21-2, 22-3, 23-3, 25-44, 25-1, 26-3, 27-4, 28-2, 29-4.
Взаимосвязь неорганических веществ. Часть 1
Чтобы поделиться, нажимайте
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию).
Задание 10
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) KCl
2) Cl
23) AlCl
34) C
2H5Cl5) HCl
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) H
22) H
2O23) H
2O4) ZnS
5) Na
2SO4Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.

1) Cu(NO
3)22) CuS
3) CuO
4) Cu
2S5) Cu
3(PO4)3Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Fe
2O32) Fe
3O43) FeCl
24) FeCl
35) FeS
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) KCl
2) HCl
3) SO
24) PbSO
45) H
2SO4Запишите в таблицу номера выбранных веществ под соответствующими буквами.

Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Fe
2O32) FeCl
23) FeCl
34) FeO
5) Fe(OH)
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) CH
42) CO
23) Ba(HCO
3)24) CO
5) BaC
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Cl
22) HCl
3) Al
4) AlCl
35) H
2O2Запишите в таблицу номера выбранных веществ под соответствующими буквами.

Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) KCl
2) KOH
3) H
24) HNO
35) K
2SЗапишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NaCl
2) HCl
3) H
2O4) NaOH
5) Cl
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Ba(NO
3)22) Ba(OH)
23) HNO
3 (конц. )
)4) BaCl
25) HCl
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Cl
22) HCl (p-p)
3) Fe
4) Ag
5) NaOH (p-p)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) твердый гидроксид калия (при нагревании)
2) водный раствор сульфата калия
3) гидроксид железа(III)
4) водный раствор аммиака
5) избыток водного раствора гидроксида калия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.

1) AgNO
32) Na
2CO33) CaCO
34) NaNO
35) CO
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NaOH
2) KOH
3) NaCl
4) HBr
5) Cl
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) KNO
32) Cl
23) KCl
4) HCl
5) AgNO
3Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.

1) KCl (p-p)
2) KOH (p-p)
3) H
24) HCl (избыток)
5) CO
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) ортофосфорная кислота
2) фосфористая кислота
3) фосфат кальция
4) гидрофосфат кальция
5) дигидрофосфат кальция
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) соляная кислота
2) хлор
3) раствор хлорида натрия
4) гидроксид железа(II)
5) нитрат железа(II)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.

Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) CaCl
22) Cl
23) O
24) Si
5) SiO
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) сульфат магния
2) сульфит магния
3) сульфид магния
4) оксид магния
5) карбид магния
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) O
2 (избыток)2) CO
23) Ca(NO
3)24) Ca(OH)
25) HNO
3 (конц.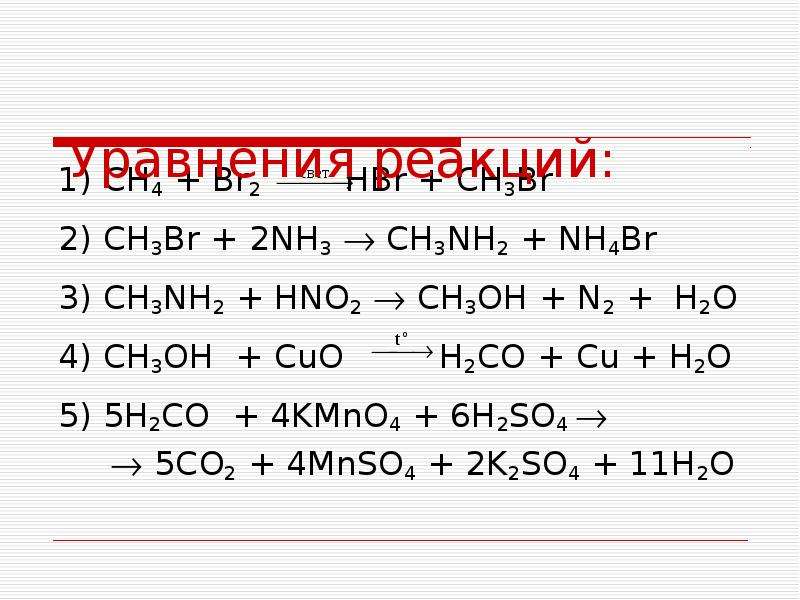 )
)Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) HCl
2) H
23) Cu(NO
3)24) CuCl
25) NaOH
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NO
2) NO
23) Mg(NO
3)24) NH
4Cl5) N
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.

1) H
2O2) Cl
2 (p-p)3) SO
24) K
2O5) KCl
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NaHCO
32) BaCO
33) CO
4) HClO
45) BaCl
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NaCl
2) NaOH
3) NaClO
44) H
2O5) HCl
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.

1) HCl
2) H
2O3) O
24) HNO
3 (разб.)5) H
2Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) KOH (изб.)
2) H
2O3) O
24) KOH (нед.)
5) KH
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) HCl
2) H
2O3) Zn(OH)
24) Cl
2 (при нагревании)5) Cl
2 (при охлаждении)Запишите в таблицу номера выбранных веществ под соответствующими буквами.

Ответы:
- 52
- 34
- 13
- 34
- 25
- 13
- 32
- 32
- 24
- 24
- 25
- 13
- 41
- 12
- 14
- 45
- 42
- 13
- 14
- 25
- 41
- 14
- 23
- 12
- 25
- 15
- 25
- 35
- 34
- 24
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Типы химических реакций
- Реакции соединения — реакции, при которых из двух или более исходных веществ образуется одно сложное вещество (А + В = АВ)
- Реакции разложения — реакции, при которых из одного сложного вещества образуется два или более новых вещества (АВС = АВ + С)
- Реакции замещения — реакции, при которых атомы простого вещества замещают атомы одного из элементов в молекуле сложного вещества (А + ВС = В + АС)
- Реакции обмена — реакции, при которых два сложных вещества обмениваются своими составными частями (АВ + СД = СВ + АД)
- Реакция нейтрализации — реакция обмена между кислотой и щелочью, при которой образуются соль и вода (HCl + NaOH = NaCl + H2O)
- Экзотермическая реакция — реакция, протекающая с выделением тепла +Q (все реакции горения)
- Эндотермическая реакция — реакция, протекающая с поглощением тепла -Q (реакции термического разложения)
- Окислительно-восстановительные реакции — реакции, в результате которых происходит изменение степени окисления атомов химических элементов.

Давайте порассуждаем вместе
1. Какое уравнение относится к реакции соединения?
1) 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl
2) Mg + 2HCl = MgCl2 + H2
3) CaCO3 = CaO + CO2
4) K2O + H2O = 2KOH
Ответ: реакция 4 — соединения, т.к. из двух веществ образуется одно новое.
2. Взаимодействие серной кислоты и гидроксида алюминия относится к реакции
1) обмена
2) замещения
3) разложения
4) соединения
Ответ: 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O — это реакция обмена, т.
к. два сложных вещества обмениваются своими составными частями
3. Взаимодействие кальция с водой относится к реакциям
1) соединения
2) замещения
3) обмена
4) разложения
Ответ: Ca +2H2O = Ca(OH)2 + H2 — это реакция замещения, т.к. атомы простого вещества кальция замещают атомы водорода в молекуле воды.
4. Гидроксид калия вступает в реакцию нейтрализации с
1) оксидом серы (VI)
2) сульфатом меди
3) азотной кислотой
4) хлоридом магния
Ответ: реакция нейтрализации — это реакция кислоты со щелочью, т.е. реакция гидроксида калия с азотной кислотой.
5. К окислительно-восстановительным реакциям относится реакция
1) Ca(OH)2 + SO3 = CaSO4 + H2O
2) 2H2S +3O2 = 2H2O + 2SO2
3) Cu(OH)2 = CuO + H2O
4) 2NaOH + CuCl2 = Cu(OH)2 + 2 NaCl
Ответ: 2 реакция относится к окислительно-восстановительным, т.
к. сера меняет степень окисления с -2 на +4, а кислород с 0 на -2
6. К реакциям разложения относится реакция
1) FeO + 2HCl = FeCl2 + H2O
2) Fe + H2SO4 = FeSO4 + H2
3) 3Fe + 2O2 = Fe3O4
4) FeCO3 = FeO + CO2
Ответ: 4 реакция относится к реакциям разложения, т.к. из одного сложного вещества образуется два новых.
7. Какая из экзотермических реакций является окислительно-восстановительной?
1) HCl + NaOH = NaCl + H2O + Q
2) CaCO3 = CaO + CO2 — Q
3) 2 Mg + O2 = 2MgO + Q
4) N2 + O2 = 2NO — Q
Обратимые и необратимые химические реакции
Реакции, идущие до конца и не изменяющие своего направления при изменении температуры и давления, называются необратимыми.
Химические реакции принято считать необратимыми, если:
Один из продуктов реакции выводится из сферы реакции в виде:
А) газа BaCO3 =t= BaO +CO2↑
Б) осадка Pb(NO3)2 + 2NaCl = PbCl2 ↓+ 2NaNO3
В) малодиссоциированного соединения – воды, слабой кислоты или основания, комплексной соли.
KOH +HCl = KCl + H2O
CH3COONa + HNO3 = NaNO3 + CH3COOH
Al(OH)3 NaOH = Na ⌈Al(OH)4⌉
Г) выделяется большое количество тепла, например, реакция горения:
C +О2 = CO2 ΔH = + 393,5 кДж
Однако, большинство химических реакций являются обратимыми: при одних условиях (P, t, kat) они идут в одном направлении, при других – в обратном, а при некоторых промежуточных – протекают одновременно в двух взаимно противоположных направлениях.
Примером обратимых реакций служат реакции термического разложения гидроксида кальция, синтез аммиака:
Ca(OH) ↔ CaO + H2O – Q
N2+3H2 ↔ 2NH3 + Q
Реакцию, идущую слева направо называют прямой, а справа налево – обратной.
Если прямая реакция экзотермическая, то обратная – эндотермическая. Причем, по закону сохранения энергии, количество теплоты, выделившееся в результате прямой реакции, равно количеству теплоты, поглощенному при обратном процессе, а наоборот.
Понятия «обратимая реакция» и «необратимая реакция» относительны: любая обратимая реакция может стать необратимой, если:
- одно из веществ выводить из сферы реакции;
- изменить условия протекания реакции;
С другой стороны, многие реакции, протекающие необратимо, можно сделать обратимыми, изменив условия их протекания.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Хлороводород — это… Что такое Хлороводород?
Хло́роводоро́д[1], хло́ристый водоро́д[2] (HCl) — бесцветный, термически устойчивый газ (при нормальных условиях) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты. При −85,1 °C конденсируется в бесцветную, подвижную жидкость. При −114,22 °C HCl переходит в твёрдое состояние. В твёрдом состоянии хлороводород существует в виде двух кристаллических модификаций: ромбической, устойчивой ниже −174,75 °C, и кубической.
Свойства
Водный раствор хлористого водорода называется соляной кислотой. При растворении в воде протекают следующие процессы:
- HClг + H2Oж⇌ H3O+ж + Cl−ж
Процесс растворения сильно экзотермичен. С водой HCl образует азеотропную смесь, содержащую 20,24 % HCl.
С водой HCl образует азеотропную смесь, содержащую 20,24 % HCl.
Соляная кислота является сильной одноосновной кислотой, она энергично взаимодействует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами, основаниями и солями, образуя соли — хлориды:
- Mg + 2 HCl → MgCl2 + H2↑
- FeO + 2 HCl → FeCl2 + H2O
Хлориды чрезвычайно распространены и имеют широчайшее применение (галит, сильвин). Большинство из них хорошо растворяется в воде и полностью диссоциирует на ионы. Слаборастворимыми являются хлорид свинца (PbCl2), хлорид серебра (AgCl), хлорид ртути(I) (Hg2Cl2, каломель) и хлорид меди(I) (CuCl).
При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:
- MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 H2O
При нагревании хлороводород окисляется кислородом (катализатор — хлорид меди(II) CuCl2):
- 4 HCl + O2 → 2 H2O +2 Cl2↑
Однако, концентрированная соляная кислота реагирует с медью, при этом образуется комплекс одновалентной меди:
- 2 Cu + 4 HCl → 2 H[CuCl2] + H2↑
Смесь 3 объемных частей концентрированной соляной и 1 объемной доли концентрированной азотной кислот называется «царской водкой».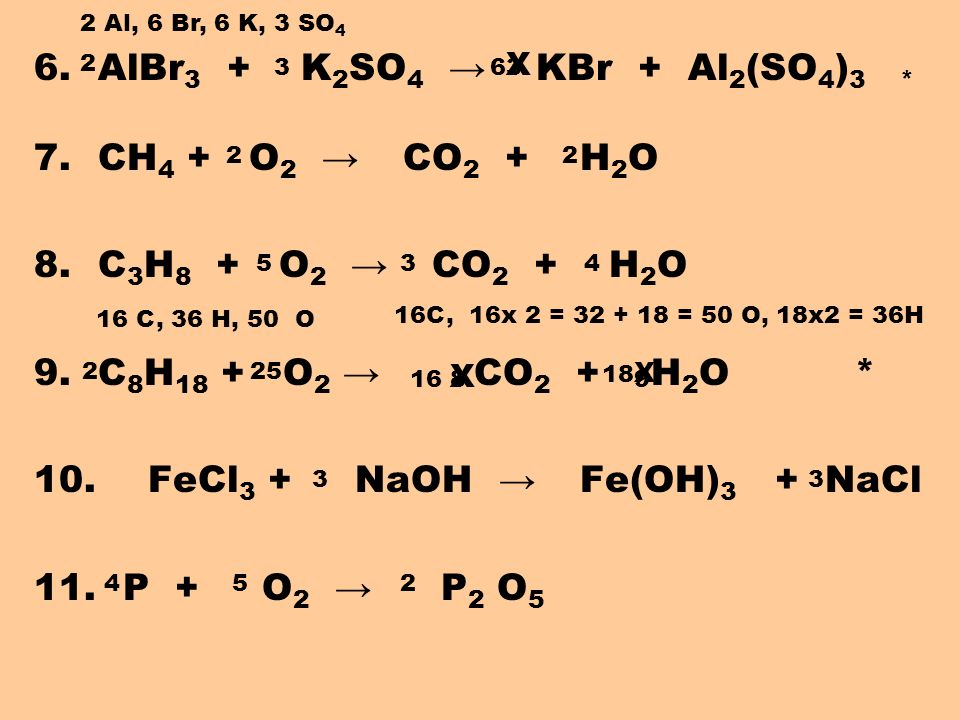 Царская водка способна растворять даже золото и платину. Высокая окислительная активность царской водки обусловлена присутствием в ней хлористого нитрозила и хлора, находящихся в равновесии с исходными веществами:
Царская водка способна растворять даже золото и платину. Высокая окислительная активность царской водки обусловлена присутствием в ней хлористого нитрозила и хлора, находящихся в равновесии с исходными веществами:
- 4 H3O+ + 3 Cl− + NO3−⇌ NOCl + Cl2 + 6 H2O
Благодаря высокой концентрации хлорид-ионов в растворе металл связывается в хлоридный комплекс, что способствует его растворению:
- 3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ + 8 H2O[3]
Для хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):
- R-CH=CH2 + HCl → R-CHCl-CH3
- R-C≡CH + 2 HCl → R-CCl2-CH3
Присоединяется к серному ангидриду, образуя хлорсульфоновую кислоту HSO3Cl:
- SO3 + HCl → HSO3Cl
Получение
В лабораторных условиях хлороводород получают, воздействуя концентрированной серной кислотой на хлорид натрия (поваренную соль) при слабом нагревании:
- NaCl(тверд.
 ) + H2SO4(конц.) = NaHSO4 + HCl↑
) + H2SO4(конц.) = NaHSO4 + HCl↑
HCl↑ также можно получить гидролизом ковалентных галогенидов, таких, как хлористый фосфорил, тионилхлорид (SOCl2), и гидролизом хлорангидридов карбоновых кислот:
- PCl5 + H2O → POCl3 + 2HCl↑
- R-COCl + H-OH → R-COOH + HCl↑
- H2O + O=SCl2 → SO2 + 2HCl↑
В промышленности хлороводород ранее получали в основном сульфатным методом (методом Леблана), основанном на взаимодействии хлорида натрия с концентрированной серной кислотой. В настоящее время для получения хлороводорода обычно используют прямой синтез из простых веществ:
- H2 + Cl2⇌ 2HCl↑
В производственных условиях синтез осуществляется в специальных установках, в которых водород непрерывно сгорает ровным пламенем в токе хлора, смешиваясь с ним непосредственно в факеле горелке. Тем самым достигается спокойное (без взрыва) протекание реакции. Водород подается в избытке (5 — 10 %), что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту.
Водород подается в избытке (5 — 10 %), что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту.
Соляную кислоту получают растворением газообразного хлороводорода в воде.
Применение
Водный раствор широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамината натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Безопасность
Вдыхание хлороводорода может привести к кашлю, удушью, воспалению носа, горла и верхних дыхательных путей, а в тяжёлых случаях, отёк легких, нарушение работы кровеносной системы, и даже смерть. Контактируя с кожей может вызывать покраснение, боль и серьёзные ожоги. Хлористый водород может вызвать серьёзные ожоги глаз и их необратимое повреждение.
Использовался как отравляющее средство во время войн.[источник не указан 186 дней]
Примечания
Литература
- Левинский М.
 И, Мазанко А. Ф., Новиков И. Н. «Хлористый водород и соляная кислота» М.:Химия 1985
И, Мазанко А. Ф., Новиков И. Н. «Хлористый водород и соляная кислота» М.:Химия 1985
Ссылки
Исследование коррозии карбида железа (Fe3C) в воде и кислотном растворе с использованием молекулярной динамики ReaxFF
Основные моменты
- •
Для описания тенденции коррозии Fe 3 C применялась молекулярная динамика ReaxFF.
- •
Исследовано влияние температуры и кислотного раствора на коррозию Fe 3 C.
- •
Была исследована двумерная функция радиального распределения в пассивном слое.
- •
FeO 4 H 8 является основным продуктом коррозии Fe 3 C в присутствии воды при 500 К.
- •
FeO 5 H 9 является более стабильным продуктом коррозии Fe 3 C в кислотном растворе при 298 K.
Abstract
Коррозия карбида железа исследовалась в воде при 298 K и 500 K как слабый электролит и раствор соляной кислоты при 298 K с использованием молекулярной динамики реактивного силового поля. Были исследованы толщина пассивной пленки, образующиеся частицы и двумерная функция радиального распределения. Виды FeO 5 H 10 , FeO 4 H 8 и FeO 3 H 6 были признаны продуктами реакции коррозии в воде при 500 K и FeO 5 H . 10 , FeO 4 H 8 и FeO 5 H 9 в кислом растворе при 298 K. Квантово-механические расчеты показали, что более стабильными продуктами в воде и кислотном растворе являются FeO 4 H 8 и FeO 5 H 9 соответственно.
Были исследованы толщина пассивной пленки, образующиеся частицы и двумерная функция радиального распределения. Виды FeO 5 H 10 , FeO 4 H 8 и FeO 3 H 6 были признаны продуктами реакции коррозии в воде при 500 K и FeO 5 H . 10 , FeO 4 H 8 и FeO 5 H 9 в кислом растворе при 298 K. Квантово-механические расчеты показали, что более стабильными продуктами в воде и кислотном растворе являются FeO 4 H 8 и FeO 5 H 9 соответственно.
- Предыдущая статья в номере
- Следующая статья в номере
Ключевые слова
Поле реактивных сил
Коррозия карбида железа
Пассивная пленка
Функция радиального распределения
Рекомендуемые статьи Цитирующие статьи (0)
Просмотр полный текст © 2020 Elsevier BV Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Артикул Метрики
Гидролиз хлорида железа в растворе (Технический отчет)
Лассие, Дж., И Бекстед, Л. Гидролиз хлорида железа в растворе . США: Н. П., 1996.
Интернет. DOI: 10,2172 / 426965.
Лассие, Дж. И Бекстед, Л. Гидролиз хлорида железа в растворе . Соединенные Штаты. https://doi.org/10.2172/426965
Лассие, Дж., И Бекстед, Л.Пт.
«Гидролиз хлорного железа в растворе». Соединенные Штаты. https://doi.org/10.2172/426965. https://www.osti.gov/servlets/purl/426965.
@article {osti_426965,
title = {Гидролиз хлорида железа в растворе},
author = {Lussiez, G and Beckstead, L},
abstractNote = {В процессе Detox {товарный знак} используется концентрированный хлорид железа и небольшие количества катализаторов для окисления органических соединений. Рассматривается возможность окисления трансурановых органических отходов. Хотя раствор широко используется повторно, в какой-то момент он достигнет приемлемого предела радиоактивности или максимальной растворимости радиоизотопов. Этот раствор можно было бы зацементировать, но объем значительно увеличился бы из-за плохой совместимости хлоридов и цемента. Был разработан процесс, который восстанавливает ионы хлорида в виде HCl и либо сводит к минимуму объем радиоактивных отходов, либо позволяет рециркулировать радиоактивные хлориды.Процесс включает двухстадийный гидролиз при атмосферном давлении или, предпочтительно, в небольшом вакууме и относительно низкой температуре, около 200 ° C. На первом этапе процесса гидролиз происходит в соответствии с реакцией, приведенной ниже: FeCl {sub 3 жидкость} + H {sub 2} O {r_arrow} FeOCl {sub solid} + 2 HCl {sub gas}. На втором этапе горячий твердый оксихлорид железа распыляют водой или помещают в контакт с паром, и гидролиз происходит до оксида железа в соответствии со следующей реакцией: 2 FeOCl {субтвердое вещество} + H {sub 2} O {r_arrow} Fe {sub 2 } O {суб-3 твердое вещество} + 2 HCl {суб-газ}.
Рассматривается возможность окисления трансурановых органических отходов. Хотя раствор широко используется повторно, в какой-то момент он достигнет приемлемого предела радиоактивности или максимальной растворимости радиоизотопов. Этот раствор можно было бы зацементировать, но объем значительно увеличился бы из-за плохой совместимости хлоридов и цемента. Был разработан процесс, который восстанавливает ионы хлорида в виде HCl и либо сводит к минимуму объем радиоактивных отходов, либо позволяет рециркулировать радиоактивные хлориды.Процесс включает двухстадийный гидролиз при атмосферном давлении или, предпочтительно, в небольшом вакууме и относительно низкой температуре, около 200 ° C. На первом этапе процесса гидролиз происходит в соответствии с реакцией, приведенной ниже: FeCl {sub 3 жидкость} + H {sub 2} O {r_arrow} FeOCl {sub solid} + 2 HCl {sub gas}. На втором этапе горячий твердый оксихлорид железа распыляют водой или помещают в контакт с паром, и гидролиз происходит до оксида железа в соответствии со следующей реакцией: 2 FeOCl {субтвердое вещество} + H {sub 2} O {r_arrow} Fe {sub 2 } O {суб-3 твердое вещество} + 2 HCl {суб-газ}. Оксид железа, содержащий радиоизотопы, затем можно утилизировать путем цементации или инкапсуляции. В качестве альтернативы, эти хлориды можно смыть с твердых частиц и затем либо переработать, либо утилизировать другим способом.},
Оксид железа, содержащий радиоизотопы, затем можно утилизировать путем цементации или инкапсуляции. В качестве альтернативы, эти хлориды можно смыть с твердых частиц и затем либо переработать, либо утилизировать другим способом.},
doi = {10.2172 / 426965},
url = {https://www.osti.gov/biblio/426965},
journal = {},
number =,
объем =,
place = {United States},
год = {1996},
месяц = {11}
}
У вас есть следующие химические вещества в вашей (Lab-3): FeCl 2 NaOH H 2 SO 4 HCl FeO Mg Fe Fe 2 (SO 4) 3 FeCl 3 6 FeSO 4 Fe (OH) 3 Fe 3 O 4 Fe.
Презентация на тему: «В вашей (Лаборатории-3) имеются следующие химические вещества: 12 10 345 89 FeCl 2 NaOH H 2 SO 4 HCl FeO Mg Fe Fe 2 (SO 4) 3 FeCl 3 6 FeSO 4 Fe (OH). 3 Fe 3 O 4 Fe. «- стенограмма презентации:
ins [data-ad-slot = «4502451947»] {display: none! important;}} @media (max-width: 800px) {# place_14> ins: not ([data-ad-slot = «4502451947»]) {display: none! important;}} @media (max-width: 800px) {# place_14 {width: 250px;}} @media (max-width: 500 пикселей) {# place_14 {width: 120px;}} ]]>1
2 У вас в (Лаборатории-3) есть следующие химические вещества: 12 10 345 89 FeCl 2 NaOH H 2 SO 4 HCl FeO Mg Fe Fe 2 (SO 4) 3 FeCl 3 6 FeSO 4 Fe (OH) 3 Fe 3 O 4 Fe 2 O 3 7 131112 Ответьте на следующие вопросы (1 15)
3
Q1) Используйте следующие треугольные диаграммы, чтобы построить химические связи по часовой стрелке между химическими веществами (Лаборатория-3).
4 FeSO 4 Fe 2 (SO 4) 3 Fe HNO 3 разбавленный H 2 SO 4 Mg FeCl 3 Fe FeCl 2 Mg сухой газообразный HCl оксид. тепло / воздух FeCl 3 Fe 2 (SO 4) 3 Fe конц. H 2 SO 4 Cl 2 / Mg при сильном нагревании FeSO 4 Fe 2 O 3 Fe H 2 SO 4 (разбавленный) (CO) 700 — 900 C A1)
5 Q2) Используйте следующие четырехугольные диаграммы, чтобы построить химические связи по часовой стрелке между химическими веществами (Лаборатория-3).Газ HCl / конц. H 2 SO 4 FeCl 3 FeCl 2 Fe 2 (SO 4) 3 Fe Mg оксид. тепло / воздух разбав. H 2 SO 4 Fe 2 O 3 FeSO 4 FeO Fe Сильный нагрев CO / 700 — 900 C CO / 400 — 700 C A2)
6
Q3) Используйте следующие пятиугольные диаграммы, чтобы построить химические связи по часовой стрелке между (Lab-3) химическими веществами HNO 3 оксид. H 2 O (пар) раскаленный FeSO 4 Fe 3 O 4 FeO Fe 2 (SO 4) 3 Fe Mg разбавленный H 2 SO 4 красный. CO / 300 C оксид.тепло / воздух тепло FeCl 2 Fe 2 O 3 Fe FeCl 3 Fe (OH) 3 NaOH сухой газ HCl красный. CO / 700-900 C A3)
CO / 300 C оксид.тепло / воздух тепло FeCl 2 Fe 2 O 3 Fe FeCl 3 Fe (OH) 3 NaOH сухой газ HCl красный. CO / 700-900 C A3)
7 Q4) Используйте следующие гексагональные диаграммы, чтобы построить химические связи по часовой стрелке между химическими веществами (Лаборатория — 3). ……
8 Fe 2 O 3 Fe 2 (SO 4) 3 FeO FeSO 4 Fe (OH) 3 Fe HNO 3 оксид. красный. H 2/300 C разбав.H 2 SO 4 NaOH нагревается до красного цвета. CO / 700-900 C Fe 2 O 3 FeCl 3 FeO FeCl 2 Fe (OH) 3 Fe окс. тепло / воздух красный. H 2/300 C сухой газообразный HCl NaOH нагревается до красного цвета. CO / 700-900 C A42-)
9
Q5) Используйте следующие треугольные диаграммы, чтобы построить химические связи против часовой стрелки между некоторыми из (Лаборатория — 3) химикатов. оксид воздуха. FeCl 3 FeCl 2 Fe сухой HCl газ Mg разбав. H 2 SO 4 FeSO 4 FeO Fe 2 O 3 сильный нагрев красный. H 2/300 C A5)
FeCl 3 FeCl 2 Fe сухой HCl газ Mg разбав. H 2 SO 4 FeSO 4 FeO Fe 2 O 3 сильный нагрев красный. H 2/300 C A5)
10 Q6) Используйте следующие треугольные диаграммы, чтобы построить возможные реверси LAB-3-6.DOC — 2ble химические отношения между вашими (Lab — 3) химическими веществами H 2/300 C O 2 (оксид) Fe 2 O 3 FeO FeSO 4 разл. H 2 SO 4 сильный нагрев сухой HCl (газ) Fe FeCl 3 H 2 / красный. Cl 2 / Mg FeCl 2 нагревают окисл. Воздух. A6)
11 Q7) Изобразите максимальные химические отношения между (Lab — 3) химическими веществами на четырехугольных диаграммах, а затем представьте эти отношения в виде списка сухой HCl (газ) конц. H 2 SO 4 FeCl 3 FeCl 2 Fe 2 (SO 4) 3 Fe окс./ нагреть воздух Cl 2 / Mg Fe FeCl 2 FeCl 3 Fe FeCl 3 Fe 2 (SO 4) 3 Fe FeCl 2 FeCl 3 Fe 2 (SO 4) 3
12
A7-2) дил. H 2 SO 4 Fe 2 O 3 FeSO 4 FeO Fe CO / красный. 700 — 900 C CO / красный. 500 — 900 C сильный нагрев CO 400 — 700 C разбав. H 2 SO 4 Fe FeSO 4 Fe 2 O 3 FeO Fe FeSO 4 Fe 2 O 3 FeO FeSO 4 Fe 2 O 3 FeO Fe FeSO 4 Fe2O 3 FeO Fe
H 2 SO 4 Fe 2 O 3 FeSO 4 FeO Fe CO / красный. 700 — 900 C CO / красный. 500 — 900 C сильный нагрев CO 400 — 700 C разбав. H 2 SO 4 Fe FeSO 4 Fe 2 O 3 FeO Fe FeSO 4 Fe 2 O 3 FeO FeSO 4 Fe 2 O 3 FeO Fe FeSO 4 Fe2O 3 FeO Fe
13 В8) Используйте следующую четырехугольную диаграмму, чтобы построить возможные обратимые химические отношения между вашими (Лаборатория — 3) химическими веществами.Mg горячий воздух / (оксид.) H 2 / красный. FeCl 2 Fe FeCl 3 Fe 2 (SO 4) 3 сухой HCl (газ) конц. H 2 SO 4 A8)
14 Q9) Изобразите максимальные химические отношения между вашими (Лаборатория — 3) химическими веществами на пятиугольных диаграммах, затем приведите эти отношения в список. красный. CO / 700-900 C разбав. H 2 SO 4 Mg HNO 3 (оксид.) H 2 O (пар.) Красный. горячее железо FeSO 4 Fe 3 O 4 FeO Fe 2 (SO 4) 3 Fe разбав. H 2 SO 4 красный. H 2/300 C FeO FeSO 4 Fe 2 (SO 4) 3 Fe Fe 3 O 4 FeO FeSO 4 Fe 2 (SO 4) 3 Fe Fe Fe 3 O 4 FeO FeSO 4 Fe Fe 3 O 4 FeO Fe FeSO 4 Fe 2 (SO 4) 3 Fe FeSO 4 FeO
15 сильное нагревание оксид NaOH.HNO 3 нагреть FeSO 4 Fe 2 O 3 Fe Fe 2 (SO 4) 3 Fe (OH) 3 разбав. H 2 SO 4 красный. / CO 700-900 C A-9-2) Fe FeSO 4 Fe 2 (SO 4) 3 Fe (OH) 3 Fe 2 O 3 FeSO 4 Fe 2 (SO 4) 3 Fe (OH) 3 Fe 2 O 3 Fe FeSO 4 Fe 2 O 3
16 Q10) Изобразите максимальные химические отношения между вашими (Лаборатория — 3) химическими веществами на гексагональных диаграммах, затем приведите эти отношения в список. Fe FeSO 4 Fe 2 (SO 4) 3 Fe (OH) 3 Fe 2 O 3 FeO FeSO 4 Fe 2 (SO 4) 3 Fe (OH) 3 Fe 2 O 3 FeO FeO Fe FeSO 4 Fe 2 O 3 FeO Fe dil H 2 SO 4 красный.H 2/700 C NaOH нагреть HNO 3 оксид. красный. H 2/300 C FeSO 4 FeO Fe Fe (OH) 3 Fe 2 (SO 4) 3 Fe 2 O 3 разбав. H 2 SO 4 красный. CO / 700-900 C A10-1
17 HCl NaOH нагревают воздух / нагревают оксид. красный. H 2/300 C FeCl 2 FeO Fe Fe (OH) 3 FeCl 3 Fe 2 O 3 сухой газообразный HCl красный. CO / 700-900 C красный. H 2/700 C A10-2 Fe FeCl 2 FeCl 3 Fe (OH) 3 Fe 2 O 3 FeO Fe FeCl 2 FeCl 3 Fe (OH) 3 Fe 2 O 3 FeO Fe FeCl 2 Fe 2 O 3 FeO Fe FeCl 2 FeCl 3 Fe (OH) 3 Fe 2 O 3 FeO
18 Q11) Из (Лаборатории — 3) химикатов: заполните следующие треугольные диаграммы химических отношений.конц. H 2 SO 4 FeCl 3 …… Mg CL 2 / ……… …… ……… HNO 3 окс. FeSO 4 Fe 2 (SO 4) 3 Fe H 2 SO 4 (разбавленный) Mg конц. H 2 SO 4 FeCl 3 Fe 2 (SO 4) 3 Fe Cl 2 / Mg A11
19 Q12) Из (Лаборатории — 3) химикатов: заполните следующую четырехугольную диаграмму химических отношений. ……… Fe 2 O 3 …… Fe ……… дил. H 2 SO 4 Fe 2 O 3 FeSO 4 FeO Fe Сильный нагрев CO / 700 — 900 C CO / 400 — 700 C Q13) Максимизируйте химические связи на приведенной выше четырехугольной диаграмме дил.H 2 SO 4 Fe 2 O 3 FeSO 4 FeO Fe Сильный нагрев разбав. H 2 SO 4 H 2/700 C CO / 700 — 900 C CO / 400 — 700 C
20 Q14) Из (Лаборатории — 3) химикатов: Заполните следующую пятиугольную диаграмму химических отношений. ……… …… FeO …… Fe ……… HNO 3 окс. H 2 O (пар) раскаленное железо FeSO 4 Fe 3 O 4 FeO Fe 2 (SO 4) 3 Fe Mg разбавленный H 2 SO 4 H 2/300 C A14)
21 год Q15) Из (Лаборатории — 3) химикатов: заполните следующую гексагональную диаграмму химического отношения.…… Fe Fe 2 O 3 Fe 2 (SO 4) 3 FeO FeSO 4 Fe (OH) 3 Fe HNO 3 оксид. красный. H 2/300 C тепл. H 2 SO 4 NaOH красный. CO / 700-900 C
Оксид железа (II) | FeO | ChemSpider
Прогнозируемые данные генерируются с использованием EPISuite ™ Агентства по охране окружающей среды США.
Логарифмический коэффициент разделения октанол-вода (SRC):
Log Kow (оценка KOWWIN v1.67) = 1,23
Boiling Pt, Melting Pt, оценки давления пара (MPBPWIN v1.42):
Температура кипения (° C): 564,42 (адаптированный метод Штейна и Брауна)
Температура плавления (град. C): 242,69 (среднее или взвешенное MP)
VP (мм рт. Ст., 25 ° C): 1.01E-011 (метод модифицированного зерна)
Переохлажденная жидкость VP: 2,3E-009 мм рт. Ст. (25 ° C, метод Mod-Grain)
Оценка растворимости в воде из Log Kow (WSKOW v1.41):
Растворимость в воде при 25 ° C (мг / л): 1.202e + 004
log Kow: 1,23 (оценка)
Используемое уравнение неплавления pt
Оценка водных солей по фрагментам:
Wat Sol (v1.01 est) = 1.2753e + 005 мг / л
Программа класса ECOSAR (ECOSAR v0.99h):
Найдены классы:
Нейтральная органика
Константа закона Генри (25 ° C) [HENRYWIN v3.10]:
Метод облигации: неполный
Групповой метод: неполный
Henrys LC [оценка VP / WSol с использованием значений EPI]: 7,943E-017 атм-м3 / моль
Логарифмический коэффициент разделения октанол-воздух (25 ° C) [KOAWIN v1.10]:
Не могу оценить (не могу рассчитать HenryLC)
Вероятность быстрого биоразложения (BIOWIN v4.10):
Biowin1 (линейная модель): 0,7133
Biowin2 (нелинейная модель): 0.8796
Результаты экспертного исследования по биоразложению:
Biowin3 (Ultimate Survey Model): 3,0404 (недели)
Biowin4 (модель первичного обследования): 3,7441 (дни-недели)
Вероятность биодеградации MITI:
Biowin5 (линейная модель MITI): 0,4984
Biowin6 (нелинейная модель MITI): 0,6110
Вероятность анаэробного биоразложения:
Biowin7 (анаэробная линейная модель): 0,8361
Готовый прогноз биоразлагаемости: НЕТ
Биодеградация углеводородов (BioHCwin v1.01):
Структура несовместима с текущим методом оценки!
Сорбция аэрозолями (25 дек C) [AEROWIN v1.00]:
Давление пара (жидкость / переохлажденный): 3,07E-007 Па (2,3E-009 мм рт. Ст.)
Log Koa (): недоступно
Kp (коэффициент распределения частицы / газа (м3 / мкг)):
Модель Маккея: 9,78
Модель октанол / воздух (Koa): недоступно
Фракция, сорбированная взвешенными в воздухе твердыми частицами (фи):
Модель Юнге-Панкова: 0,997
Модель Mackay: 0,999
Модель октанол / воздух (Koa): недоступно
Атмосферное окисление (25 ° C) [AopWin v1.92]:
Реакция гидроксильных радикалов:
ОБЩАЯ константа скорости OH = 0.0000 E-12 см3 / молекула-сек
Half-Life = -------
Озоновая реакция:
Оценка отсутствия озона
Фракция, сорбированная взвешенными в воздухе твердыми частицами (phi): 0,998 (Junge, Mackay)
Примечание: сорбированная фракция может быть стойкой к атмосферному окислению.
Коэффициент адсорбции почвы (PCKOCWIN v1.66):
Koc: 14,3
Лог Коч: 1,155
Водное основание / кислотно-катализируемый гидролиз (25 ° C) [HYDROWIN v1.67]:
Константы скорости НЕ могут быть оценены для этой структуры!
Оценки биоаккумуляции по Log Kow (BCFWIN v2.17):
Логарифм BCF из регрессионного метода = 0,246 (BCF = 1,763)
log Kow: 1,23 (оценка)
Улетучивание из воды:
Генри LC: 7,94E-017 атм-м3 / моль (рассчитано из VP / WS)
Период полураспада из Model River: 6.248E + 012 часов (2.603E + 011 дней)
Период полураспада из Модельного озера: 6,816E + 013 часов (2,84E + 012 дней)
Удаление при очистке сточных вод:
Общее удаление: 1,91 процента
Общее биоразложение: 0,09 процента
Общая адсорбция осадка: 1,82 процента
Всего в воздух: 0.00 процентов
(с использованием 10000 часов Bio P, A, S)
Модель летучести уровня III:
Массовое количество выбросов с периодом полураспада
(процент) (час) (кг / час)
Воздух 1.09e-006 1e + 005 1000
Вода 32,4 360 1000
Почва 67,6 720 1000
Осадок 0,0688 3,24e + 003 0
Время стойкости: 626 часов
Критический обзор JSTOR
AbstractРассмотрена взаимосвязь между различными хлорид-ионными соединениями, связанными с коррозией железа в морской среде, и их роль в усилении коррозии оценена как основа для выбора методов консервации с высокой вероятностью успеха./// On pas en revue le rôle des ion chlorure dans la corrective du fer dans un climat marin. Леур роль в темпах, способствующих коррозии, учитывается как мой выбор методов реставрации, а также предотвращает лучшие шансы на успех. /// Die Beziehung zwischen den Verschiedenen Chloridion enthaltenen Verbindungen, die mit der Korrosion von Eisen in Einer Seeumgebung in Verbindung gebracht werden, wird überprüft, und deren Rolle in der Korrosionsförderlängenderecht.
Journal InformationStudies in Conservation стремится стать ведущим международным рецензируемым журналом по сохранению исторических и художественных произведений. Предполагаемая читательская аудитория включает практикующих реставраторов всех типов объектов, учителей консервации, менеджеров по коллекциям или консервации, а также ученых-реставраторов или музейных ученых. В издании «Исследования в области консервации» публикуются оригинальные работы по ряду тем, включая достижения в области консервации, новые методы лечения, превентивную консервацию, вопросы ухода за коллекциями, историю и этику консервации, методы исследования произведений искусства, новые исследования в области анализа художественных материалов. или механизмы порчи, и проблемы сохранения при демонстрации и хранении.Научное содержание не обязательно, и редакторы поощряют представление практических статей, чтобы помочь сохранить традиционный баланс журнала. Каким бы ни был предмет изучения, отчеты о рутинных процедурах не принимаются, за исключением случаев, когда они приводят к результатам, которые являются достаточно новыми и / или значительными, чтобы представлять общий интерес.
Информация об издателеОсновываясь на двухвековом опыте, Taylor & Francis за последние два десятилетия быстро выросла и стала ведущим международным академическим издателем.Группа издает более 800 журналов и более 1800 новых книг каждый год, охватывающих широкий спектр предметных областей и включая журнальные оттиски Routledge, Carfax, Spon Press, Psychology Press, Martin Dunitz и Taylor & Francis. Тейлор и Фрэнсис полностью привержены делу. на публикацию и распространение научной информации высочайшего качества, и сегодня это остается первоочередной задачей.
Термодинамика оксидов железа: Часть III. Энтальпии образования и стабильность ферригидрита (∼Fe (OH) 3), швертманнита (∼FeO (OH) 3/4 (SO 4) 1/8) и ∊-Fe 2O 3
Аннотация
Энтальпии образования ферригидрита и швертманнита измеряли калориметрическим методом в растворе кислоты в 5 н. HCl при 298 К.Были оценены опубликованные термодинамические данные для этих двух фаз и ∊-Fe 2 O 3 , и были отобраны лучшие термодинамические данные для исследуемых соединений. Ферригидрит метастабилен по энтальпии по отношению к 1/2 α-Fe 2 O 3 и жидкой воде от 11,5 до 14,7 кДж ∙ моль -1 при 298,15 К. Менее положительная энтальпия соответствует 6-линейному ферригидриту, и более высокий, указывающий на меньшую стабильность, к 2-линейному ферригидриту. Другими словами, образцы ферригидрита становятся более стабильными с увеличением кристалличности.Наилучший набор термодинамических данных для ферригидрита состава Fe (OH) 3 был выбран с использованием измеренных энтальпий и (1) требования, чтобы ферригидрит был метастабильным по отношению к мелкозернистому лепидокрокиту; (2) требование, чтобы ферригидрит имел энтропию выше, чем энтропия гипотетического, хорошо кристаллического Fe (OH) 3 ; и (3) рассмотрение опубликованных оценок продуктов растворимости ферригидрита. ∆G ° f для двухстрочного ферригидрита лучше всего описывается диапазоном -708.От 5 ± 2,0 до -705,2 ± 2,0 кДж ∙ моль -1 и ∆G ° f для 6-линейного ферригидрита от -711,0 ± 2,0 до -708,5 ± 2,0 кДж ∙ моль -1 . Опубликованные результаты измерения энтальпии методом кислотной калориметрии ∊-Fe 2 O 3 были пересмотрены и получили ∆H ° f (∊-Fe 2 O 3 ) = -798,0 ± 6,6 кДж ∙ моль -1 . Стандартная энтропия (S °) ∊-Fe 2 O 3 считалась равной S ° (γ-Fe 2 O 3 ) (93.0 ± 0,2 Дж ∙ K -1 ∙ моль -1 ), что дает ∆G ° f (∊-Fe 2 O 3 ) = -717,8 ± 6,6 кДж ∙ моль -1 . ∊-Fe 2 O 3 , таким образом, кажется, не имеет поля стабильности и является метастабильным по отношению к большинству фаз в системе Fe 2 O 3 -H 2 O, что, вероятно, является причиной того, что эта фаза в природе встречается редко. Энтальпии образования двух образцов швертманнита: ∆H ° f (FeO (OH) 0.686 (SO 4 ) 0,157 ∙ 0,972H 2 O) = -884,0 ± 1,3 кДж ∙ моль -1 , ∆H ° f (FeO (OH) 0,664 (SO 4 ) 0,168 ∙ 1,226H 2 O) = -960,7 ± 1,2 кДж ∙ моль -1 . В сочетании с оценкой энтропии эти данные дают значения свободных энергий Гиббса образования -761,3 ± 1,3 и -823,3 ± 1,2 кДж ∙ моль -1 для двух образцов, соответственно. Эти значения ∆G f ° означают, что швертманнит термодинамически предпочтительнее ферригидрита в широком диапазоне pH (2-8), когда система содержит даже небольшую концентрацию сульфата.Отношения устойчивости двух исследованных образцов могут быть воспроизведены швертманнитом «идеального» состава FeO (OH) 3/4 (SO 4 ) 1/8 с ∆G ° f = -518,0 ± 2,0 кДж ∙ моль -1 .
Стандартные теплоты и свободные энергии образования и абсолютные энтропии элементов и неорганических соединений
| Название | Δ H f ° (кДж / моль) | Δ G f ° ° кДж / моль) | S ° (Дж / моль K) |
|---|---|---|---|
| h3 (г) | 0 | 0 | 130.5 |
| H (г) | 218 | 203,3 | 114,6 |
| Ли (ли) | 0 | 0 | 28 |
| Li (г) | 155,2 | 122,2 | 138,5 |
| Li2O (т) | -595,8 | -560,7 | 37,9 |
| Li2O2 (т) | -634.7 | -564,8 | 56,5 |
| LiH (s) | -90,4 | -69,9 | 24,7 |
| LiCl (s) | -408,8 | -383,7 | 55,2 |
| LiF (s) | -612,1 | -584,1 | 36 |
| Младший | -271,1 | -270,3 | 86.8 |
| Na (с) | 0 | 0 | 51 |
| Na (г) | 108,8 | 78,2 | 153,6 |
| NaH (s) | -57,3 | -33,5 | 40 |
| NaF (тв) | -569 | -541 | 58,6 |
| NaCl (тв) | -410.9 | -384,1 | 72,4 |
| NaBr (ов) | -359,8 | -347,7 | 86,8 |
| Нал (ов) | -287,9 | -286,1 | 98,5 |
| Na2SO4 (т) | -1384,5 | -1266,9 | 149,4 |
| NaNO3 (т) | -466,5 | -365,7 | 116.3 |
| NaNO2 (т) | -359,4 | -284,6 | 103,8 |
| Na2CO3 (т) | -1130,9 | -1047,7 | 136 |
| Na2O (ов) | -415,9 | -376,6 | 72,8 |
| Na2O2 (т) | -504,6 | -430,1 | 95 |
| NaO2 (т) | -260.7 | — 218,8 | 115,9 |
| NaC2h4O2 (т) | -710,4 | -607,3 | 123 |
| NaOH (тв) | -430,5 | -377 | 52,3 |
| тыс. | 0 | 0 | 63,6 |
| К (г) | 90 | 61,1 | 160,2 |
| КФ (ов) | -562.7 | -533 | 66,5 |
| KCl (тв) | -436 | -408,4 | 83 |
| KClO3 (т) | -391,2 | –290 | 143,1 |
| K2O (s) | -361,5 | -318,8 | 94,1 |
| K2O2 (ов) | -493,7 | -418,4 | 102.1 |
| КО2 (т) | -282,8 | -248,5 | 116,7 |
| КОН (ы) | -425,9 | -374,5 | 79 |
| KNO3 (ов) | -492,9 | -393,3 | 133 |
| KClO4 (т) | -433,5 | -304,2 | 151 |
| руб | 0 | 0 | 69.5 |
| Rb (г) | 85,8 | 56,5 | 169,9 |
| руб. | -549,4 | 75,3 | |
| RbCl (ов) | -430,5 | -407,8 | 95,9 |
| Rb2O (т) | -330,1 | -292,9 | |
| Rb2O2 (т) | -425.5 | -351,5 | |
| RbO2 (т) | -263,6 | ||
| CS | 0 | 0 | 82,8 |
| Cs (г) | 78,7 | 51 | 175,3 |
| CsF (ы) | -530,9 | -525,5 | 92,8 |
| CsCl (тв) | -433 | -414.5 | 101,2 |
| CSL | -336,8 | -333,5 | 123 |
| Cs2O (ов) | -317,6 | -326,4 | 146,8 |
| Cs2O2 (тв) | -402,5 | -359,8 | |
| CsO2O (ов) | -259,4 | ||
| Be (s) | 0 | 0 | 9.6 |
| Be (г) | 320,5 | 282,8 | 136 |
| BeCl2 (тв) | -511,7 | -449,5 | 75,8 |
| мг | 0 | 0 | 32,6 |
| мг (г) | 150,2 | 115,5 | 148,5 |
| MgF2 (тв) | -1102.5 | 1049,3 | 57,3 |
| MgCl2 (тв) | -641,8 | -592,5 | 89,5 |
| MgO (ов) | -601,7 | -559,4 | 26,8 |
| MgSO4 (тв) | -1278,2 | -1173,6 | 91,6 |
| Mg (NO3) 2 (т) | -789,5 | -588.3 | 164 |
| Ca (ы) | 0 | 0 | 41,6 |
| Ca (г) | 192,5 | 167,4 | 154,8 |
| Cah3 (s) | -188,7 | -149,8 | 41,8 |
| СаО | -635,5 | -604,2 | 39,7 |
| Ca (OH) 2 (тв) | -986.6 | -896,6 | 76,1 |
| CaF2 (тв) | -1214,6 | -1161,9 | 69 |
| CaCl2 (тв) | -795 | -750,2 | 113,8 |
| CaCO3 (т) | -1207,1 | -1128,8 | 92,9 |
| Sr (ов) | 0 | 0 | 54.4 |
| Sr (г) | 164 | 110 | 164,4 |
| SrCl2 (т) | -828,4 | -781,2 | 117,2 |
| Ba (s) | 0 | 0 | 66,9 |
| Ba (г) | 175,7 | 144,8 | 170,3 |
| BaCl2 (т) | -860.2 | -810,9 | 125,5 |
| BaCl2.2h3O (т) | -1461,9 | -1295,8 | 202,9 |
| BaCO3 (т) | -1218,8 | -1138,9 | 112,1 |
| Б (и) | 0 | 0 | 6,7 |
| B2O3 (ы) | -1263,6 | -1184,1 | 54 |
| BF3 (г) | -1136.8 | -1120,5 | 254 |
| BCl3 (г) | -402,9 | -387,9 | 290 |
| B2H6 (г) | 31,4 | 82,8 | 233 |
| Al (и) | 0 | 0 | 28,5 |
| Al2O3 (тв) | -1669,8 | -1576,5 | 51 |
| Al2 (SO4) 3 (т) | -3440.9 | -3506,6 | 239,3 |
| C (т, графит) | 0 | 0 | 5,9 |
| C (s, ромб) | 2,1 | 2,9 | 2,5 |
| C (г) | 718,4 | 672,8 | 158,2 |
| CF4 (г) | -933 | -888,3 | 261.5 |
| CCl4 (г) | -100,4 | -58,2 | 310 |
| CCl4 (л) | -132,6 | -62,8 | 216,3 |
| Cl2CO (г) | -220,9 | -206,7 | 283,7 |
| CO (г) | -110,5 | -137,2 | 197,9 |
| CO2 (г) | -393.3 | -394,6 | 213,8 |
| OCS (г) | -138,5 | -165,7 | 231,4 |
| CS2 (г) | 117,2 | 66,9 | 237,7 |
| HCN (г) | 130,5 | 120,1 | 201,7 |
| Si (s) | 0 | 0 | 19 |
| Название | Δ H f ° (кДж / моль) | Δ G f ° (кДж / моль) | ° S (кДж / моль) | ° S 9033 J моль К) |
|---|---|---|---|---|
| SiO2 (т) | -859.4 | -856,7 | 41,8 | |
| Sih5 (г) | 34,3 | 57 | 203,8 | |
| SiCl4 (г) | -609,6 | -569,9 | 331,4 | |
| SiCl4 (л) | -640,2 | -572,8 | 239,3 | |
| Ge | 0 | 0 | 42.2 | |
| GeCl4 (л) | -543,9 | -462,8 | 245,6 | |
| Sn | 0 | 0 | 51,5 | |
| SnO (ы) | -286,2 | -257,3 | 56,5 | |
| SnO2 (т) | -580,7 | -520,5 | 52,3 | |
| SnCl2 (т) | -349.8 | 0 | 129,7 | |
| SnCl4 (л) | -545,2 | -440,1 | 258,6 | |
| N2 (г) | 0 | 0 | 191,6 | |
| Nh4 (г) | -45,6 | -16,3 | 192,5 | |
| N2h5 (г) | 95 | 159 | 238,5 | |
| НЕТ (г) | 90.4 | 86,6 | 210,5 | |
| NO2 (г) | 33,9 | 51,9 | 239,7 | |
| N2O (г) | 81,6 | 103,8 | 220,1 | |
| N2O4 (г) | 9,6 | 98,3 | 304,2 | |
| Nh5Cl (тв) | -315,5 | -203,8 | 94.6 | |
| Nh5NO3 (т) | -365,3 | -184 | 151,1 | |
| Nh5NO2 (т) | –264 | |||
| HNO3 (л) | -173,2 | -79,9 | 155,6 | |
| P4 (s, белый) | 0 | 0 | 44,4 | |
| P4 (s, красный) | -18.4 | 13,8 | 29,3 | |
| P4 (s, черный) | -43,1 | |||
| P4O10 (s) | -3012,5 | -2697,8 | 228,9 | |
| Ph4 (г) | 9,2 | 18,4 | 210 | |
| PCl3 (г) | -278,7 | -258,6 | 311.7 | |
| PCl5 (г) | -371,1 | -296,6 | 352,7 | |
| Как | 0 | 0 | 35,1 | |
| Ясень4 (г) | 66,4 | 68,9 | 222,7 | |
| Сб (с) | 0 | 0 | 45,6 | |
| SbCl3 (т) | -382 | -323.8 | 184,1 | |
| SbCl5 (л) | -440,2 | -350,2 | 301,2 | |
| O2 (г) | 0 | 0 | 205 | |
| O3 (г) | 142,3 | 163,6 | 237,7 | |
| h3O (г) | -241,8 | -228,4 | 188,7 | |
| h3O (л) | -285.8 | -237,2 | 69,9 | |
| h3O2 (л) | -187,4 | -120,4 | 109,6 | |
| OCl2 (г) | 76,1 | 93,7 | 266,5 | |
| S8 (s, ромбический) | 0 | 0 | 31,8 | |
| h3S (г) | -20,1 | -33,1 | 205.9 | |
| SF6 (г) | -1096,2 | -991,6 | 290,8 | |
| SO2 (г) | -296,2 | -300,4 | 248,5 | |
| SO3 (г) | -395,4 | -370,3 | 256,1 | |
| h3SO4 (л) | -811,3 | -690,1 | 156,9 | |
| Se (s) | 0 | 0 | 42.3 | |
| SnCl2 (т) | -349,8 | 0 | 129,7 | |
| h3Se (г) | 85,8 | 71,1 | 221,3 | |
| SeO2 (ов) | -236 | |||
| Te (и) | 49,8 | |||
| h3Te (г) | 154.4 | 138,5 | 243,2 | |
| F2 (г) | 0 | 0 | 203,3 | |
| HF (г) | — 268,6 | -270,7 | 173,6 | |
| Cl2 (г) | 0 | 0 | 223 | |
| HCl (г) | -92,5 | -95,4 | 186,6 | |
| Br2 (л) | 0 | 0 | 152.3 | |
| Br2 (г) | 30,5 | 3,3 | 245,2 | |
| HBr (г) | -36,4 | -53,1 | 198,3 | |
| BrF (г) | -46 | -61,5 | 229,3 | |
| BrF3 (г) | -313,8 | -288,7 | 292,5 | |
| I2 (s) | 0 | 0 | 116.7 | |
| I2 (г) | 62,3 | 19,2 | 260,7 | |
| HI (г) | 25,9 | 1,3 | 206,3 | |
| IF5 (г) | -816,3 | -746 | 329,3 | |
| ICl3 (ы) | -88,3 | -22,6 | 172 | |
| Co (s) | 0 | 0 | 30.1 | |
| CoCl2 (т) | -312,5 | -269,9 | 109,2 | |
| Cr (s) | 0 | 0 | 23,8 | |
| Cr2O3 (тв) | -1139,7 | -1058,1 | 81,2 | |
| CrCl2 (тв) | -395,4 | -356,1 | 115,5 | |
| CrCl3 (тв) | -556.5 | -486,2 | 123 | |
| Fe (тв) | 0 | 0 | 27,2 | |
| FeO (тв) | –266,5 | -244,3 | 54 | |
| Fe2O3 (т) | -822,2 | -741 | 90 | |
| Ni (ы) | 0 | 0 | 30,1 | |
| NiCl2.6х3О (с) | -2103,3 | -1713,3 | 344,3 | |
| Ti (тв) | 0 | 0 | 30,5 | |
| TiCl4 (л) | -802,1 | -737,2 | 252,3 | |
| TiO2 (тв) | -944,7 | -889,1 | 50,2 | |
| Cu (s) | 0 | 0 | 33.5 | |
| CuO (тв) | -157,3 | -129,7 | 42,7 | |
| CuCl2.2h3O (т) | -821,3 | -656,1 | 167,4 | |
| CuSO4 (т) | -769,9 | -661,9 | 113,4 | |
| Zn (тв) | 0 | 0 | 41,4 | |
| ZnO (тв) | -348.1 | -318,4 | 43,5 | |
| ZnCl2 (тв) | -415,5 | -369,4 | 111,7 | |
| Кд (ы) | 0 | 0 | 51,9 | |
| CdS (ы) | -161,9 | -156,5 | 64,9 | |
| Hg (л) | 0 | 0 | 77,4 | |
| HgCl2 (тв) | -230. |

 ) →
) → )
)
 к. два сложных вещества обмениваются своими составными частями
к. два сложных вещества обмениваются своими составными частями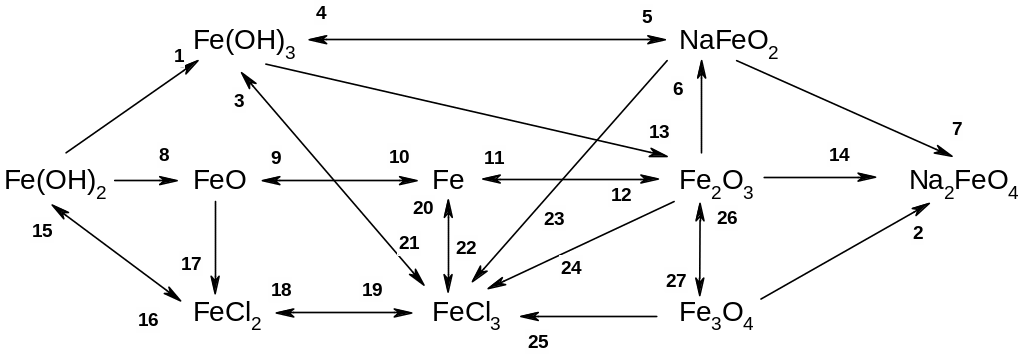 к. сера меняет степень окисления с -2 на +4, а кислород с 0 на -2
к. сера меняет степень окисления с -2 на +4, а кислород с 0 на -2 ) + H2SO4(конц.) = NaHSO4 + HCl↑
) + H2SO4(конц.) = NaHSO4 + HCl↑ И, Мазанко А. Ф., Новиков И. Н. «Хлористый водород и соляная кислота» М.:Химия 1985
И, Мазанко А. Ф., Новиков И. Н. «Хлористый водород и соляная кислота» М.:Химия 1985