Галогены — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. ГАЛОГЕНЫ
2. Историческая справка
Слово «галогены» (“halogen”) ввел шведский химик Й.Я.Берцелиусгалогены (греч. hals – соль, gen – рождаю)
1886 – открыт фтор
(Анри Муассан, фр. химик,
Нобелевская премия)
Фтор (греч. phtoros – разрушение)
1774 – открыт хлор (Карл Шееле,
шведский химик)
1826 – открыт бром
(Антуан Балар, фр. химик)
1811 – открыт йод (Бернар Куртуа,
фр. химик)
Бром (греч. bromos – зловонный)
Иод (греч.
 iodes – фиолетовый)
iodes – фиолетовый)1940 – открыт астат (Д. Корсон,
К. Р. Маккензи, Э. Сегре, калифорнийский
университет в Беркли)
2009—2010 – открыт элемент №117
(унунсептий) (Объединённый институт
ядерных исследований в Дубне, Россия)
Астат (греч. astatos – неустойчивый)
Унунсептий (лат. – сто семнадцатый)
Хлор (греч. khloros –
бледно-зеленый)
3. Распространенность в природе
флюорит CaF2галит NaCl
сильвин KCl
сильвинит KCl•NaCl
4. Строение атома
35Количество валентных электронов
Количество энергетических уровней
Радиус атома
Восстановительные свойства
Металлические свойства
Электроотрицательность
5. Строение молекулы
F2Cl2
Br2
I2
F-F
Cl-Cl
Br-Br
I-I
Связь ковалентная неполярная,
одинарная, кристаллическая
решетка молекулярная.
6. Физические свойства
,способно к
возгонке
7. Химические свойства
1) Взаимодействие с металлами:Cu + Cl2 =
Fe + Cl2 =
2) Взаимодействие с неметаллами (галогены не
взаимодействует с кислородом и азотом):
h3 + F2 = 2HF (со взрывом)
h3 + Cl2 = 2HCl (на свету)
h3 + Br2 = 2HBr (при нагревании)
h3 + I2 = 2HI (при нагревании, обратимая реакция)
8.
 Химические свойства3) Взаимодействие с водой:
Химические свойства3) Взаимодействие с водой:2F2 + 2h3O = 4HF + O2
h3O + Cl2 HCl + HClO (хлорная вода)
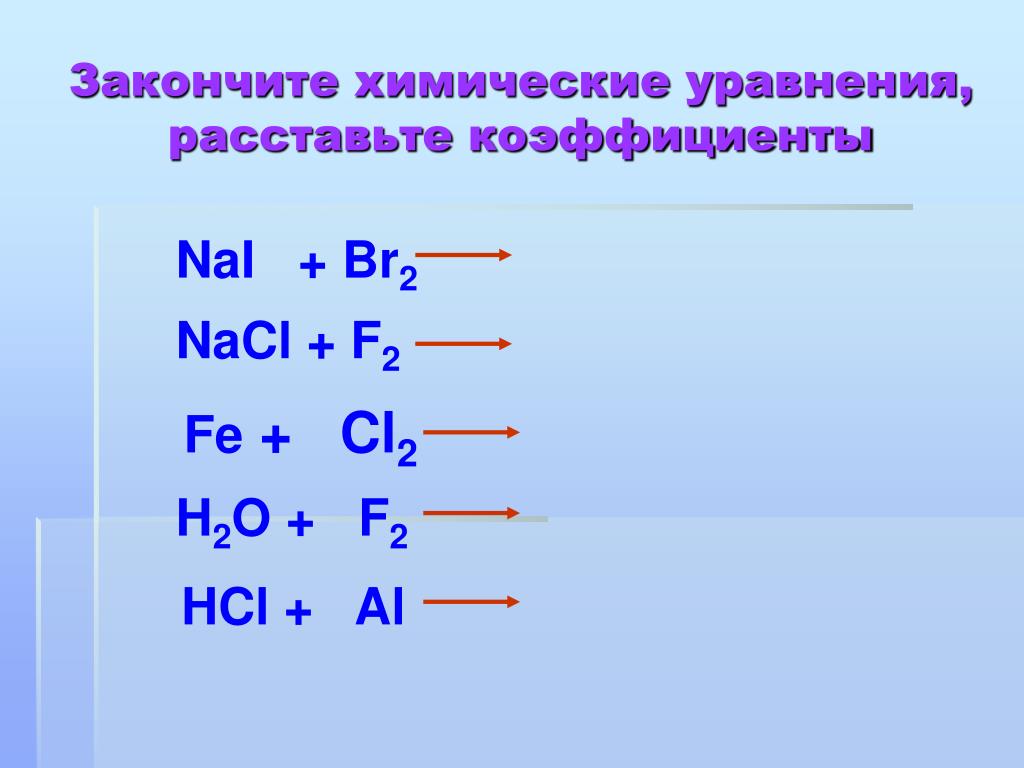
4) Вытеснение менее активных галогенов из
галогенидов : Cl2>Br2>I2
Cl2 + NaI =
I2 + NaCl =
9. Химические свойства
5) Взаимодействие со щелочамина холоду:
2NaOH + Cl2 = NaCl + гипохлорит
NaClO + h3O
натрия
при нагревании:
t
6NaOH + 3Cl2 = 5NaCl + NaClO
+ 3h3O
хлорат 3
натрия
Составить электронный баланс
10. Получение
F2 и Cl2 в промышленности получаютэлектролизом расплавов или растворов их
солей:
эл.ток
2Na + Cl
2NaCl
2
расплав
ток
H
2NaCl + 2h3O эл.
2 + Cl2+ h3O
Cl2 в лаборатории получают:
MnO2 + 4HCl = MnCl2 + Cl2 + h3O
В периодической системе галогены находятся в:
А) главной подгруппе VIII группы;
Б) побочной подгруппе VII группы;
В) главной подгруппе VII группы;
Г) главной подгруппе VI группы.
Для галогенов характерна степень окисления:
А) -2;
Б) -1 и -2;
В) -2 и -3;
Г) -1.

Галогены могут проявлять положительную
степень окисления в соединениях с:
А) водородом;
Б) кислородом;
В) с металлами;
Г) ни с одним из этих веществ.
Как меняется химическая активность галогенов в
ряду: F, Cl, Br, I?
А) увеличивается;
Б) меняется беспорядочно;
В) уменьшается;
Г) не меняется.
При обычных условиях бром — это:
А) газ;
Б) жидкость;
В) кристаллическое в-во;
Г) жидкость или кристаллическое в-во.
Свободных орбиталей нет у:
А) хлора;
Б) брома;
В) йода;
Г) фтора.
Галогены в твердом состоянии имеют:
А) атомную кристаллическую решетку;
Б) молекулярную кристаллическую решетку;
В) А и Б;
Г) имеют особое строение.
18. Домашнее задание
§23, 241.
1.Составить электронный баланс для реакций
хлора со щелочами (для сдающих).
2.
2. Для несдающих сообщение «Соединение
галогенов»
English Русский Правила
Подготовка к ЕГЭ: составление уравнений реакций методом электронного баланса.

Задания С1
Используя метод электронного баланса, составьте уравнения реакций, укажите окислитель и восстановитель:
1.Cr2(SO4)3 +… + NaOH → Na2CrO4 + NaBr + … + h3O
2.Si + HNO3 + HF → h3SiF6 + NO + …
3.P + HNO3 + … → NO + …
4.K2Cr2O7 + … + h3SO4 → I2 + Cr2(SO4)3 + … + h3O
5.P + HNO3 + … → NO2 + …
6.K2Cr2O7 + HCl → Cl2 + KCl + … + …
7.B + HNO3 + HF → HBF4 + NO2 + …
8.KMnO4 + h3S + h3SO4 → MnSO4 + S + …+ …
9.KMnO4 + … → Cl2 + MnCl2 + … + …
10. h3S + HMnO4 → S + MnO2 + …
11. KMnO4 + KBr + h3SO4 → MnSO4 + Br2 + … + …
12. KClO + … → I2 + KCl + …
13. KNO2 + … + h3SO4 → NO + I2 + … + …
14. NaNO2 + … + h3SO4 → NO + I2 + … + …
15. HCOH + KMnO4 → CO2 + K2SO4 + … + …
16. Ph4 + HMnO4 → MnO2 + … + …
Ph4 + HMnO4 → MnO2 + … + …
17. P2O3 + HNO3 + … → NO + …
18. Ph4 + HClO3 → HCl + …
19. Zn + KMnO4 + … → … + MnSO4 + K2SO4 + …
20.FeCl2 + HNO3 (конц.) → Fe(NO3)3 + HCl + … + …
Задания C1
(решения и ответы)
1.Cr2(SO4)3 + 3Br2 + 16NaOH = 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8h3O
2 Cr+3 — 3ē → Cr+6
3 Br20 + 2ē → 2Br-1
Cr2(SO4)3 (Cr+3) – восстановитель, Br2 – окислитель
2.3Si + 4HNO3 + 18HF = 3h3SiF6 + 4NO + 8h3OSi0 — 4ē → Si+4
N+5 + 3ē → N+2 3
4
Si – восстановитель, HNO3(N+5) – окислитель
3.3P + 5HNO3 + 2h3O = 3h4PO4 + 5NOP0 — 5ē → P+5
N+5 + 3ē → N+2 3
5
P – восстановитель, HNO3 (N+5) – окислитель
4. K2Cr2O7 + 6KI + 7h3SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7h3Cr+6 + 3ē → Cr+3
K2Cr2O7 + 6KI + 7h3SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7h3Cr+6 + 3ē → Cr+3
2I- — 2ē → I2 2
3
KI (I-) – восстановитель, K2Cr2O7 (Cr+6) – окислитель
5.P + 5HNO3 = h4PO4 + 5NO2 + h3OP0 — 5ē → P+5
N+5 + 1ē → N+4 1
5
P – восстановитель, HNO3 (N+5) – окислитель
6.K2Cr2O7 + 14HCl = 3Cl2 + 2KCl + 2CrCl3 + 7h3Cr+6 + 3ē → Cr+3
2Cl- — 2ē → Cl2 2
3
K2Cr2O7 (Cr+6) – окислитель, HCl (Cl-) – восстановитель
7.B + 3HNO3 + 4HF = HBF4 + 3NO2 + 3h3OB0 — 3ē → B+3
N+5 + 1ē → N+4 1
3
B – восстановитель, HNO3 (N+5) – окислитель
8.2KMnO4 + 5h3S + 3h3SO4 = 2MnSO4 + 5S + K2SO4 + 8h3OMn+7 + 5ē → Mn+2
S-2 — 2ē → S 2
5
h3S (S-2) – восстановитель, KMnO4 (Mn+7) – окислитель
9. 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8h3OMn+7 + 5ē → Mn+2
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8h3OMn+7 + 5ē → Mn+2
2Cl- — 2ē → Cl2 2
5
KMnO4 (Mn+7) – окислитель, HCl (Cl-) – восстановитель
10.3h3S + 2HMnO4 = 3S + 2MnO2 + 4h3OS-2 — 2ē → S
Mn+7 + 3ē → Mn+4 3
2
h3S (S-2) – восстановитель, HMnO4 (Mn+7) – окислитель
11.2KMnO4 + 10KBr + 8h3S04 = 2MnSO4 + 5Br2 + 6K2SO4 + 8h3O2Br- — 2ē → Br2
Mn+7 + 5ē → Mn+2 5
2
KMnO4 (Mn+7) – окислитель, KBr (Br-) – восстановитель
12.KClO + 2HI = I2 + KCl + h3OCl+1 + 2ē → Cl-1
2I- — 2ē → I2 1
1
KClO (Cl+1) – окислитель, HI (I-) – восстановитель
13.KNO2 + 2HI + h3SO4 = 2NO + I2 + K2SO4 + 2h3ON+3+1ē → N+2
2I- — 2ē → I2 2
1
KNO2 (N+3) – окислитель, HI (I-) – восстановитель
14. 2NO + 3KClO + 2KOH = 2KNO3 + 3KCl + h3ON+2 — 3ē → N+5
2NO + 3KClO + 2KOH = 2KNO3 + 3KCl + h3ON+2 — 3ē → N+5
Cl+1+2ē → Cl-1 2
3
NO (N+2) – восстановитель, KClO (Cl+1) – окислитель
15.5HCOH + 4KMnO4 + 6h3SO4 = 5CO2 + 2K2SO4 + 4MnSO4 + 11h3OMn+7 + 5ē → Mn+2
C0 — 4ē → C+4 4
5
HCOH – восстановитель, KMnO4 (Mn+7) – окислитель
16.3Ph4 + 8HMnO4 = 3h4PO4 + 8MnO2 + 4h3OP-3 — 8ē → P+5
Mn+7 + 3ē → Mn+4 3
8
KMnO4 (Mn+7) – окислитель, Ph4 (P-3) – восстановитель
17.3P2O3 + 4HNO3 + 7h3O = 4NO + 6h4PO4N+5+ 3ē → N+2
2P+3 — 4ē → 2P+5 4
3
P2O3 (P+3) – восстановитель, HNO3 (N+5) – окислитель
18.3Ph4+ 4HClO3 = 4HCl + 3h4PO4P-3 — 8ē → P+5
Cl+5 + 6ē → Cl-1 3
4
Ph4 (P-3) – восстановитель, HClO3 (Cl+5) – окислитель
19. 5Zn + 2KMnO4 + 8h3SO4 = 5ZnSO4 + 2MnSO4 + K2SO4 + 8h3OMn+7 + 5ē → Mn+2
5Zn + 2KMnO4 + 8h3SO4 = 5ZnSO4 + 2MnSO4 + K2SO4 + 8h3OMn+7 + 5ē → Mn+2
Zn0 — 2ē → Zn+2 2
5
Zn0 — восстановитель, KMnO4 (Mn+7) — окислитель
20.FeCl2 + 4HNO3 = Fe(NO3)3 + 2HCl + NO2 + h3OFe+2 — 1ē → Fe+3
N+5 + 1ē → N+4 1
1
FeCl2 (Fe+2) – восстановитель, HNO3(N+5) — окислитель
Задания С2
Даны вещества: магний аммиак, азот, азотная кислота (разб.). Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: кальций, фосфор, азотная кислота. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: сульфит натрия, вода, гидроксид калия, перманганат калия, фосфорная кислота. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: медь, азотная кислота, сульфид меди (II), оксид азота (II).

Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.). Напишите уравнения четырех возможных реакций между этими веществами.
Даны водные растворы: хлорида железа (III), иодида натрия, бихромата натрия, серной кислоты и гидроксида цезия. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: алюминий, хлор, йодид калия, серная кислота (конц.).
Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: углерод, водород, серная кислота (конц.), дихромат калия. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: кремний, соляная кислота, едкий натр, гидрокарбонат натрия. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: алюминий, вода, разбавленная азотная кислота, концентрированный раствор гидроксида натрия.
 Напишите уравнения четырех возможных реакций.
Напишите уравнения четырех возможных реакций.Даны водные растворы: сульфида натрия, сероводорода, хлорида алюминия, хлора. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: оксид натрия, оксид железа (III), иодоводород, углекислый газ. Напишите уравнения четырех возможных реакций между этими веществами.
Даны водные растворы: гексагидроксоалюмината калия, хлорида алюминия, сероводорода, гидроксида рубидия. Напишите уравнения четырех возможных реакций между этими веществами
Даны вещества: карбонат калия (раствор), гидрокарбонат калия (раствор), углекислый газ, хлорид магния, магний. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: нитрат натрия, фосфор, бром, гидроксид калия (раствор). Напишите уравнения четырех возможных реакций между этими веществами.
Задания С2 (решения и ответы)
1. 3Mg + N2 =Mg3N2
3Mg + 2Nh4= Mg3N2 + 3h3
4Mg + 10HN03 = 4Mg(NO3)2 + N2O + 5h3O
Nh4 + HNO3= Nh5NO3
2. 4Ca + 10HNO3(конц) = 4Сa(NO3)2 + N2O + 5h3O
4Ca + 10HNO3(конц) = 4Сa(NO3)2 + N2O + 5h3O
4Ca + 10HNO3(разб)= 4Сa(NO3)2 + Nh5NO3 + 3h3O
P + 5HNO3 = h4PO4 + 5NO2 + h3O
3Ca + 2P = Ca3P2
3. Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + h3O
3Na2SO3 + 2KMnO4 + h3O = 3Na2SO4 + 2MnO2 + 2KOH
Na2SO3 + h4PO4 = Nah3PO4 + NaHSO3
3KOH + h4PO4= K3PO4 + 3h3O
4. Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2h3O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4h3O
CuS + 8HNO3(конц) = CuSO4+ 8NO2 + 4h3O
2Cu + 2NO = 2CuO + N2
5. S + 6HNO3(конц) = h3SO4 + 6NO2 + 2h3O
S + 2h3SO4(конц) = 3SO2 + 2h3O
h3S + 2HNO3(конц) = S + 2NO2 + 2h3O
h3S + 3h3SO4(конц) = 4SO2 + 4h3O
6. 2FeCl3 + 2NaI = 2NaCl + 2FeCl2 + I2
FeCl3 + 3CsOH = Fe(OH)3↓ + 3CsCl
h3SO4 + 2CsOH = Cs2SO4 + 2h3O
Na2Cr2O7 + 2CsOH = Na2CrO4 + Cs2CrO4 + h3O
Na2Cr2O7 + 6NaI + 7h3SO4 = Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7h3O
7. 2Al + 3Cl2 = 2AlCl3
2KI + Cl2 = I2 + 2KCl
2KI + 2h3SO4(конц) = I2 + K2SO4 + SO2 + 2h3O
t
2Al + 6h3SO4(конц) = Al2(SO4)3 + 3SO2 + 6h3O
8. C + 2h3SO4(конц)= CO2 + 2SO2 + 2h3O
C + 2h3SO4(конц)= CO2 + 2SO2 + 2h3O
3C + 8h3SO4 + 2K2Cr2O7 = 3CO2 + 2Cr2(SO4)3 + 2K2SO4 + 8h3O
C + 2h3 = Ch5
K2Cr2O7 + 2h3SO4 = 2KHSO4 + 2CrO3 + h3O
9. NaOH + HCl = NaCl + h3O
NaHCO3 + HCl = NaCl + CO2 + h3O
NaHCO3 + NaOH = Na2CO3 + h3O
Si + 4NaOH = Na4SiO4 + 2h3↑
10. 2Al(безокс.пя) + 6h3O = 2Al(OH)3 + 3h3↑
NaOH + HNO3 = NaNO3 + h3O
8Al + 30HNO3 = 8Al(NO3)3 + 3Nh5NO3 + 9h3O
2Al + 2NaOH + 6h3O = 2Na[Al(OH)4] + 3h3↑
(Допустимо Na3[Al(OH)6])
11. Na2S + h3S = 2NaHS
3Na2S + 2AlCl3 +6h3O = 3h3S + 2Al(OH)3 +6NaCl
Na2S + Cl2 = 2NaCl + S
h3S + Cl2 = 2HCl + S
12. Na2O +Fe2O3 = 2NaFeO2
2HI + Na2O = 2NaI + h3O
Na2O + CO2 = Na2CO3
Fe2O3 + 6HI = 2FeI2 + I2 + 3h3O
13. K3[Al(OH)6] + AlCl3 = 2Al(OH)3 + 3KCl
K3[Al(OH)6] + 3h3S = Al(OH)3 + 3KHS + 3h3O
h3S + 2RbOH = Rb2S + 2h3O
AlCl3 + 3RbOH = Al(OH)3 + 3RbCl
14. K2CO3 + CO2 + h3O = 2KHCO3
2K2CO3 + h3O + MgCl2 = (MgOH)2CO3 + CO2 + 4KCl
2KHCO3 + MgCl2 = MgCO3 + 2KCl + CO2 + h3O
CO2 + 2Mg = C + 2MgO
15. 5NaNO3 + 2P = 5NaNO2 + P2O5
5NaNO3 + 2P = 5NaNO2 + P2O5
5Br2 + 2P = 2PBr5
4P + 3KOH + 3h3O = 3Kh3PO4 + Ph4
Br2 + 2KOH(хол) = KBrO + KBr + h3O
3Br2 + 6KOH(гор) = 5KBr + KBrO3 + 3h3O
Задания С3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
t, Сакт. Ch4Cl, AlCl3 Сl2, УФ КОН водн.,t
1. Этин → Х1 → толуол → Х2 → Х3 → С6Н5-СН2-ООСН
h3SO4 разб. h3SO4 конц. t Br2 KOH, h3O, t
2. Калий → этилат калия → Х1 → СН2 = СН2 → Х2 → Х3
Н2О 1200 t, кат. СН3Cl, AlCl3Cl2,УФ
3. Карбид алюминия → Х1 → Х2 → бензол → Х3 → Х4
KMnO4, H+CaCO3 t
4. CaC2 → этин → этаналь → Х1 → Х2 → Х3
СН3Cl, AlCl3 СН3ОН, Н+
5. Метан → Х1 → бензол → Х2 → бензойная кислота → Х3
Br2, свет КОН(спирт.) HBrNa
6. СН3-СН2-СН(СН3)-СН3 → Х1 → Х2 → Х1 → Х3 → СО2
NaMnO4, NaOH электролиз Cl2, светKOH, h3Oh3SO4, t
7. СН3СНО → Х1 → С2Н6 → Х2 → Х3 → (С2Н5)2О
h3O, Hg2+ KMnO4, H+ NaOH Ch4I h3O, H+
8. С2Н2 → Х1 → СН3СООН → Х2 → Х3 → уксусная кислота
С2Н2 → Х1 → СН3СООН → Х2 → Х3 → уксусная кислота
Н2, кат. Na HCl KMnO4, h3SO4
9. СН4 → НСНО→ Х1 → Х2 → Х1 → Х3
С, t Br2 ,hνKOH(спирт.)KMnO4, h3O
10. С2Н2 → Х1 → С6Н5С2Н5 → Х2 → Х3 → Х4
[Ag(Nh4)2]OHCl2,hνNaOH(спирт.) СН3ОН, Н+ полимеризация
11. СН3-СН2-СНО → Х1 → Х2 → Х3 → Х4 → Х5
h3SO4, 200Cкат., t[Ag(Nh4)2]OH HCl KMnO4, h3O
12. Этанол → Х1 → Х2 → Ag2C2→ Х2 → Х3
Cакт., tCl2, FeCl3,tKMnO4
13. С2Н2 → Х1 → Х2 → С6Н5СН3 → СН3-С6Н4-NO2 → Х3
электролиз Cl2, hνNaOH, h3Oh3SO4 (конц), t ‹ 140
14. СН3СООН→ Х1 → С2Н6 → Х2 → Х3 → Х4
Н2, Ni, t HBr [Ag(Nh4)2]OH
15. СН3СНО → Х1 → Х2 → этилен → СН3СНО → Х3
Задания С3
(решения и ответы)1. Cакт., t
1) 3C2h3→ C6H6
AlCl3
2) C6H6 + Ch4Cl → C6H5Ch4 + HCl
hν
3) C6H5Ch4 + Cl2 → C6H5Ch3Cl + HCl
h3O
4) C6H5Ch3Cl + KOH → C6H5Ch3OH + KCl
h3SO4, t
5) C6H5Ch3OH + HCOOH → C6H5Ch3OOCH + h3O
2. 1) 2K + 2C2H5OH → 2C2H5OK + h3
1) 2K + 2C2H5OH → 2C2H5OK + h3
2) C2H5OK + h3SO4 → C2H5OH + K2SO4
h3SO4, t
3) C2H5OH → C2h5 + h3O
4) Ch3=Ch3 + Br2 → Ch3Br-Ch3Br
h3O
5) Ch3Br-Ch3Br + 2KOH → Ch3OH-Ch3OH + 2KBr
3. 1) Al4C3 + 12h3O → 3Ch5 + 4Al(OH)3
t
2) 2Ch5 → C2h3 + 3h3
Cакт., t
3) 3C2h3 → C6H6
AlCl3
4) C6H6 + Ch4Cl → C6H5Ch4 + HCl
hν
5) C6H5Ch4 + Cl2 → C6H5Ch3Cl + HCl
4. 1) CaC2 + 2h3O → Ca(OH)2 + C2h3
Hg2+
2) C2h3 + h3O → Ch4CHO
3) 5Ch4CHO+ 2KMnO4 + 3h3SO4 → 5Ch4COOH + K2SO4 + 2MnSO4 + 3h3O
4) 2Ch4COOH + CaCO3 → (Ch4COO)2Ca + h3O + CO2
t
5) (Ch4COO)2Ca → CaCO3 + Ch4-CO-Ch4
5. t
1) 2Ch5 → C2h3 + 3h3
Cакт., t
2) 3C2h3 → C6H6
AlCl3
3) C6H6 + Ch4Cl → C6H5Ch4 + HCl
4) 5C6H5Ch4 + 6KMnO4 + 9h3SO4 →
5Ch4COOH + 3K2SO4 + 6MnSO4 + 14h3O
h3SO4, t
5) Ch4COOH + Ch4OH → Ch4COOCh4 + h3O
6. 1) Ch4-Ch3-CH(Ch4)-Ch4 + Br2 → Ch4-Ch3-CBr(Ch4)-Ch4 + HBr
2) Ch4-Ch3-CBr(Ch4)-Ch4 + KOH(спирт. ) → Ch4-CH=C(Ch4)-Ch4 + h3O + KBr
) → Ch4-CH=C(Ch4)-Ch4 + h3O + KBr
3) Ch4-CH=C(Ch4)-Ch4 + HBr →Ch4-Ch3-CBr(Ch4)-Ch4
t
4) 2Ch4-Ch3-CBr(Ch4)-Ch4 + 2Na → Ch4-Ch3-C(Ch4)2-C(Ch4)2-Ch3-Ch4 + 2NaBr
t
5) 2C10h32+ 31O2 → 20CO2↑ + 22h3O
7. 1) Ch4CHO + 2NaMnO4 + 3NaOH → Ch4COONa + 2Na2MnO4 + 2h3O
эл.ток
2) 2Ch4COONa → C2H6 + 2NaHCO3 + h3↑
hν
3) C2H6 + Cl2 → C2H5Cl + HCl
h3O
4) C2H5Cl + KOH → C2H5OH + NaCl
h3SO4, t
5) 2C2H5OH → C2H5-O-C2H5 + h3O
8. Hg2+
1) C2h3 + h3O → Ch4COH
2) 5Ch4CHO + 2KMnO4 + 3h3SO4 → 5Ch4COOH + K2SO4 + 2MnSO4 + 3h3O
3) Ch4COOH + NaOH → Ch4COONa + h3O
4) Ch4COONa + Ch4I → Ch4COOCh4 + NaI
H+
5) Ch4COOCh4 + h3O → Ch4COOH + Ch4OH
9. t, кат.
1) Ch5 + O2 →HCHO + h3O
t, кат.
2) HCHO + h3 → Ch4OH
3) 2Ch4OH + 2Na → 2Ch4ONa + h3↑
4) Ch4ONa + HCl → 2Ch4OH + NaCl
5) 5Ch4OH + 6KMnO4 + 9h3SO4 → 5CO2↑ + 6MnSO4 + 3K2SO4 + 19h3O
10. 1) 3C2h3 → C6H6
AlCl3
2) C6H6 + C2H5Cl → C6H5C2H5 + HCl
hν
3) C6H5C2H5 + Br2 → C6H5-CHBr-Ch4 + HBr
4) C6H5-CHBr-Ch4 + KOH(спирт. ) → C6H5-CH=Ch3+KBr + h3O
) → C6H5-CH=Ch3+KBr + h3O
5) 3C6H5-CH=Ch3 + 2KMnO4 + 4h3O → 3C6H5-CH(OH)-Ch3OH + 2MnO2 + 2KOH
11. t
1) Ch4-Ch3-CHO + 2[Ag(Nh4)2]OH → Ch4-Ch3-CHOOH + 2Ag + 4Nh4 + h3O
hν
2) Ch4-Ch3-CHOOH + Cl2 → Ch4-CHCl-COOH + HCl
3) Ch4-CHCl-COOH + NaOH(спирт.) → Ch3=CH-COOH + NaCl + h3O
h3SO4, t
4) Ch3=CH-COOH + Ch4OH → Ch3=CH-COOCh4 + h3O
t,кат.
5) nCh3=CH-COOCh4 → (-Ch3-CH-)n
|
COOCh4
12. h3SO4, 200C
1) C2H5OH → Ch3=Ch3 + h3O
t, Pt
2) Ch3=Ch3 → C2h3 + h3
3) C2h3 + 2[Ag(Nh4)2]OH → C2Ag2↓+ 4Nh4 + 2h3O
4) C2Ag2 + 2HCl → C2h3 + 2AgCl
5) 3C2h3 + 8KMnO4 → 3K2C2O4 + 2KOH + 8MnO2 + 2h3O
13. Cакт., t
1) 3C2h3→ C6H6
FeCl3, t
2) C6H6 + Cl2 →C6H5Cl + HCl
t
3) C6H5Cl + Ch4Cl + 2Na → C6H5-Ch4 + 2NaCl
h3SO4, t
4) C6H5-Ch4 + HO-NO2 → Ch4-C6h5-NO2 + h3O
5) 5Ch4-C6h5-NO2 + 6KMnO4 + 9h3SO4 →
5HOOC-C6h5-NO2 + 6MnSO4 + 3K2SO4 + 14h3O
14. 1) Ch4СОOH + NaOH → Ch4СОONa + h3O
1) Ch4СОOH + NaOH → Ch4СОONa + h3O
эл. ток
2) 2Ch4СОONa + 2h3O → C2H6 + 2NaHCO3+ h3↑
hν
3) C2H6 + Cl2 → C2H5Cl + HCl
h3O
4) C2H5Cl + NaOH → C2H5OH + NaCl
h3SO4, t
5) 2C2H5OH → C2H5-O-C2H5 + h3O
15. t, кат.
1) Ch4CHO + h3 → C2H5OH
h3SO4
2) C2H5OH + HBr → C2H5Br + h3O
3) C2H5Br + KOH(спирт.) → C2h5 + KBr + h3О
t, Pd2+
4) 2C2h5 + O2 → 2Ch4CHO
t
5) Ch4CHO + 2[Ag(Nh4)2]OH → Ch4COOH + 2Ag↓ + 4Nh4 + h3O
Задания С5
Масса неизвестного объема воздуха равна 0,123 г, а масса такого же объема газообразного алкана 0,246 г (при одинаковых условиях). Определите молекулярную формулу алкана.
Органическое вещество массой 1,875 г занимает объем 1 л (н.у.). При сжигании 4,2 г этого вещества образуется 13,2 г СО2 и 5,4 г воды. Определите молекулярную формулу вещества.
Установите молекулярную формулу предельного третичного амина, содержащего 23,73% азота по массе.

Предельную одноосновную карбоновую кислоту массой 11 г растворили в воде. Для нейтрализации полученного раствора потребовалось 25 мл раствора гидроксида натрия, молярная концентрация которого 5 моль/л. Определите формулу кислоты.
Установите молекулярную формулу дибромалкана, содержащего 85,11% брома.
Установите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного или 101 г дибромпроизводного.
При сгорании 9 г предельного вторичного амина выделилось 2,24 л азота и 8,96 л (н.у.) углекислого газа. Определите молекулярную формулу амина.
При взаимодействии 0,672 л алкена (н.у.) с хлором образуется 3,39 г его дихлорпроизводного. Определите молекулярную формулу алкена, запишите его структурную формулу и название.
При полном сжигании вещества, не содержащего кислорода, образуется азот и вода.
 Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения.
Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения.При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при нагревании образовался осадок массой 28,8 г. Выведите молекулярную формулу альдегида.
Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название одного изомера исходного алкена.
При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется, соответственно, 7,85 г хлорпроизводного или 12,3 г бромпроизводного. Определите молекулярную формулу алкена.
При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана.
При сгорании 9 г первичного амина выделилось 2,24 л азота (н.
 у.). Определите молекулярную формулу амина, приведите его название.
у.). Определите молекулярную формулу амина, приведите его название.На полное сгорание 0,2 моль алкена израсходовано 26,88 л кислорода (н.у.). Установите название, молекулярную и структурную формулы алкена.
При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Массовая доля кислорода в предельной одноосновной кислоте составляет 43,24 %. Определите молекулярную формулу этой кислоты.
Задания С5
(решения и ответы)
1. n(возд.) = n(Cnh3n+2)
M(Cnh3n+2) = 14n+2
0,123 / 29 = 0,246 / (14n+2)
n = 4, C4h20
2. M = 1,875 г/л . 22,4 л/моль= 42 г/моль
n(CO2) = 13,2 г / 44 г/моль= 0,3 моль
n(C) = 0,3 моль
m(C) = 0,3 моль . 12 г/моль = 3,6г
n(h3O) = 5,4 г / 18 г/моль = 0,3 моль
n(H) = 0,6 моль
m(H) = 0,6 моль . 1 г/моль = 0,6 г
4,2 г – (3,6г + 0,6г) = 0, кислорода нет.
n(C) : n(H) = 0,3 : 0,6 = 1 :2
Ch3 – простейшая формула
42 / 14 = 3, С3Н6
3. R1 – N – R3
|
R2
Mr(амина) = Ar(N) / ω(N) = 14 / 0,2373 = 59
59 – 14 = 45 (R1, R2, R3)
45 / 3 = 15 Ch4 – все радикалы.
(СН3)3N — триметиламин
4. Сnh3n+1COOH + NaOH = Cnh3n+1COONa + h3O
n(NaOH) = 5 моль/л . 0,025 л = 0,125 моль
n(кислоты) = 0,125 моль
М(кислоты) = 11г / 0,125 моль = 88 г/моль
М(Cnh3n+1COOH) = 12n + 2n + 1 + 45 = 14n +46
14n + 46 = 88
n = 3, C3H7COOH
5. Cnh3пBr2
Mr(Cnh3Br2) = 160 / 0,8511 = 188
12n + 2n + 160 = 188
n = 2, C2h5Br2 — дибромэтан
6. Cnh3n + Cl2 → Cnh3nCl2
Cnh3n + Br2 → Cnh3nBr2
n(Cnh3nCl2) = n(Cnh3nBr2)
M(Cnh3nCl2) = 14n + 71
M(Cnh3nBr2) = 14n + 160
56,5 / (14n+71) = 101 / (14n+160)
n = 3, C3H6
7. R1 – NH – R2
n(N2) = 2,24 л / 22,4л/моль = 0,1 моль
n(N2) = 0,2моль
n(CO2) = 8,96л / 22,4л/моль = 0,4 моль
n(C) = 0,4 моль
n(N) : n(C) = 0,2 : 0,4 = 1 : 2
Следовательно, атомов С – 2
Ch4 – NH – Ch4 — диметиламин
8. Cnh3n + Cl2 = Cnh3nCl2
Cnh3n + Cl2 = Cnh3nCl2
n(Cnh3n) = 0,672 л / 22,4л/моль = 0,03 моль
n(Cnh3nCl2) = 0,03моль
М(Сnh3nCl2) = 3,39 г / 0,03 моль = 113 г/моль
12n + 2n + 71 = 113
n = 3, C3H6, Ch4 – CH = Ch3 — пропен
9. NxHy + 0,5xO2 → 0,5xN2 + 0,5yh3O
0,5x . 2 = 0,5y x : y = 1 : 2 Nh3 – простейшая формула
М(NxHy) = 16 . 2 г/моль = 32г/моль
32 / 16 = 2, N2h5 – гидразин
2 способ:
М(NxHy) = 16 . 2г/моль = 32 г/моль,
т.к. вещество содержит только N и H, то атомов N – 2
(14 . 2 = 28), а атомов H – 4 (32 – 28 = 4), N2h5
10. Cnh3n+1CHO + 2Cu(OH)2 → Cnh3n+1COOH + Cu2O↓ + 2h3O
n(Cu2O) = 28,8 г / 144г/моль = 0,2 моль
n(альдегида) = 0,2 моль
М(альдегида) = 11,6 г / 0,2 моль = 58 г/моль
12n + 2n + 1 + 12 + 1 + 16 = 58
14n + 30 = 58
n=2, Ch4 – Ch3 – CHO — пропионовый альдегид
11. Cnh3n + HBr → Cnh3n+1Br
М(Cnh3n+2) + Br2 → Cnh3n+1Br + HBr
M = 29 г/моль . 4,24 = 123г/моль
14n + 81 = 123
n = 3, C3H7Br – бромпропан, C3H6 – пропен
Изомер – циклопропан
12. Сnh3n+ HCl → Cnh3n+1Cl
Сnh3n+ HCl → Cnh3n+1Cl
Cnh3n + HBr → Cnh3n+1Br
n(Cnh3n+1Cl) = n(Cnh3n+1Br)
7,85 / (14n+36,5) = 12,3 / (14n+81)
n = 3, C3H6 — пропен
13. Сnh3n+2 + Br2 → Cnh3n+1Br + HBr
n(Cnh3n+2) = n(Cnh3n+1Br)
1,74 / (14n+2) = 4,11 / (14n+81)
n = 4, C4h20
14. R – Nh3 + O2 → CO2 + h3O + N2
2R – Nh3 → N2
n(N2) = 2,24 л / 22,4 л/моль = 0,1 моль
n(R – Nh3) = 0,2 моль
М(R – Nh3) = 9г / 0,2 моль = 45г/моль
45 – (14+2) = 29 R – C2H5 C2H5Nh3 – этиламин
15.Сxh3x + 1,5xO2 → xCO2 + xh3O
n(O2) = 26,88 л / 22,4 л/моль = 1,2 моль
0,2 моль Cxh3x – 1,2 моль О2
1 моль Сxh3x – 1,5х моль О2
х = 4, C4H8
16.Cnh3n+1COOH + NaHCO3 → Сnh3n+1COONa + h3O + CO2
n(CO2) = 5,6л / 22,4л/моль = 0,25 моль
n(Cnh3n+1COOH) = 0,25 моль
М(Cnh3n+1COOH) = 25,5 г / 0,25моль = 102 г/моль
12n + 2n + 1 + 45 = 102
n = 4, C4H9COOH
17. Cnh3n+1COOH
Mr = 16 . 2 / 0,4324 = 74
12n + 2n + 1 + 45 = 74
14n = 28, n = 2, Ch4 – Ch3 – COOH — пропионовая кислота
Реакция соединения h3 cl2.
 Влияние давления на скорость химической реакции
Влияние давления на скорость химической реакцииХлористый водород получают в промышленности либо путем прямого синтеза из хлора и водорода, либо из побочных продуктов при хлорировании алканов (метана). Мы рассмотрим прямой синтез из элементов.
HCl — бесцветный газ с резким характерным запахом.
t° пл = -114,8°С, t° тр = -84°С, t° христ = +57°С, т.е. Хлороводород можно получить при комнатной температуре в жидком виде повышением давления до 50 — 60 атм . В газовой и жидкой фазе находится в виде отдельных молекул (отсутствие водородных связей). Прочная связь Е св = 420 кДж/моль. Начинает разлагаться на элементы при t>
2HCl Cl 2 + H 2
Эффективный радиус HCl = 1,28, дипольный — 1,22.
R Cl — = 1,81, т.е. протон внедряется в электронное облако иона хлора на треть эффективного радиуса, и при этом само соединение упрочняется за счет увеличения положительного заряда вблизи ядра иона хлора и уравновешивая отталкивающее действие электронов. Все галогеноводороды образуются сходным образом и являются сильными соединениями.
Все галогеноводороды образуются сходным образом и являются сильными соединениями.
Хлористый водород хорошо растворим в воде в любом соотношении (в одном объеме H 2 O растворяется до 450 объемов HCl), образует с водой несколько гидратов и дает азеотропную смесь — 20,2% HCl и t°кип.=108,6°С
Образование хлороводорода из элементов:
Cl 2 + H 2 = 2HCl
Смесь водорода и хлора взрывается при освещении, что свидетельствует о цепной реакции.
В начале века Баденштейн предложил следующий механизм реакции:
Инициирование: Cl 2 + hν → ē + Cl 2 +
Цепь: Cl 2 + + H 2 → HCl + H + Cl +
H + Cl 2 → HCl + Cl
Обрыв цепи: Cl + + ē → Cl
Cl + Cl → Cl2
Но ē не было найдено в сосуде.
В 1918 г. Нернст предложил другой механизм:
Инициирование: Cl 2 + hν → Cl + Cl
Цепь: Cl + H 2 → HCl + H
H + Cl 2 → HCl + Cl
Окончание цепи: H + Cl → HCl
В дальнейшем этот механизм получил дальнейшее развитие и дополнение.
Стадия 1 — инициирование
реакция Cl 2 + hν → Cl + Cl
Инициируется фотохимическим путем, т.е. путем поглощения кванта света hν. Согласно принцип эквивалентности Эйнштейн, каждый квант света может вызвать преобразование только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:
— число прореагировавших молекул на 1 квант света.
γ в обычных фотохимических реакциях ≤1. Однако в случае цепных реакций γ>>1. Например, в случае синтеза HCl γ=10 5 , при распаде H 2 O 2 γ=4.
Если молекула Cl 2 поглотила квант света, то она находится в возбужденном состоянии
10 -8 -10 -3 сек и если энергии, полученной с квантом света, хватило для превращения, то происходит реакция, если нет, то молекула снова перейдет в основное состояние, либо с испусканием квант света (флуоресценция или фосфоресценция), или электронное возбуждение преобразуется в колебательную или вращательную энергию.
Посмотрим, что получится в нашем случае:
E дис H 2 = 426,4 кДж/моль
E дис Cl 2 = 239,67 кДж/моль
E обр HCl = 432,82 кДж/моль — без облучения реакция не идет.
Квант света имеет энергию Е кв = 41,1*10 -20 Дж. Энергия, необходимая для начала реакции (энергия активации), равна энергии, затрачиваемой на диссоциацию молекулы Cl 2 :
т.е. Е Cl2
В отличие от катализа, при котором потенциальный барьер снижается, в случае фотохимических реакций он просто преодолевается энергией кванта света.
Другой возможностью инициирования реакции является добавление паров Na к смеси H 2 +Cl 2 . Реакция протекает при 100°С в темноте:
Na + Cl 2 → NaCl + Cl
Cl + H 2 → HCl + H ………
и образуется до 1000 HCl на 1 атом Na.
Стадия 2 — продолжение цепи
Реакции распространения цепи при получении HCl бывают следующих типов:
1. Cl + H 2 → HCl + H E a = 2,0 кДж/моль
2. H + Cl 2 → HCl + Cl E a = 0,8 кДж/моль
Это звенья цепи.
Скорость этих реакций можно представить следующим образом:
W 1 = K 1 [H 2 ]
W 2 = K 2 [Cl 2 ]
Поскольку энергии активации этих реакций невелики, их скорости высоки. Цепи в этом случае неразветвленные, и согласно теории неразветвленных цепей:
W развитие цепи = W инициируется фотохимически, т.е. путем поглощения кванта света из разрыва,
Cl + Cl + M → Cl 2 + M,
тогда W обр = K 2
Скорость образования HCl зависит от реакций 1 и 2
в данном случае W 1 = W 2 , т.к. цепи довольно длинные (из теории цепных реакций)
Это кинетическое уравнение справедливо при отсутствии примесей в смеси H 2 + Cl 2 . Если в систему попадет воздух, то кинетическое уравнение будет другим. В частности
W обр = К, т.е. неквадратичное прекращение и протекание процесса обратное.
Потому что есть вещества, которые являются ингибиторами цепных реакций. Ингибитором реакции образования HCl является кислород:
O 2 + H → O 2 H
Этот радикал неактивен и может реагировать только с таким же радикалом, регенерируя кислород.
O 2 H + O 2 H = O 2 + H 2 O 2
Расчеты показывают, что в присутствии 1% O 2 реакция замедляется в 1000 раз. Присутствие NCl 3 замедляет скорость процесса еще сильнее, что замедляет реакцию в 10 5 раз больше, чем кислород. Т.к. хлористый азот может присутствовать в хлоре при его промышленном производстве, то перед синтезом HCl необходима тщательная очистка исходного хлора.
Вещества даны: водные растворы тетрагидроксоалюмината калия K[Al(OH)4], хлорид алюминия, карбонат калия, хлор. Напишите уравнения четырех возможных реакций между этими веществами
(*ответ*) 3K2CO3 + 2AlCl3 + 3h3O = 2Al(OH)3 + 3CO2 + 6KCl
( *ответ*) K + CO2 = KHCO3 + Al(OH)3
(*ответ*) 3K2CO3 + 3Cl2 = 5KCl + KClO3 + 3CO2
2AlCl3 + 2CO2 + 3h3O = Al(OH)3 + 2h3CO3 + 2HCl
Вещества даны : водные растворы тетрагидроксоцинката калия К2, пероксид натрия, уголь, углекислый газ. Напишем уравнения четырех возможных реакций между этими веществами
(*ответ*) K2 + CO2 = K2CO3 + Zn(OH)2 + h3O
(*ответ*) 2Na2O2 + 2CO2 = 2Na2CO3 + O2
(*ответ*) CO2 + C 2CO
(*ответ*) 2Na2O2 + C Na2CO3 + Na2O
2Na2O2 + 2CO = 2Na2CO3 + 2CO2
Вещества даны: водный раствор гексагидроксохромата калия K3[Cr(OH)6], твердый гипохлорит калия, оксид марганца(IV), концентрированная соляная кислота.
 Напишем уравнения четырех возможных реакций между этими веществами: _
Напишем уравнения четырех возможных реакций между этими веществами: _ (*ответ*) 2K3 + 3KClO = 2K2CrO4 + 3KCl + 2KOH + 5h3O
(*ответ*) K3 + 6HCl = 3KCl + CrCl3 + 6h3O
(*ответ*) 4HCl + MnO2 = Cl2 + MnCl2 + 2h3O
(*ответ*) 2HCl + KClO = Cl2 + KCl + h3O
MnO2 + KClO = MnCl4 + KO
Даваемые вещества: карбонат натрия, концентрированный раствор гидроксида натрия, оксид алюминия, фторид фосфора(V), вода. Напишем уравнения четырех возможных реакций между этими веществами:
(*ответ*) PF5 + 4h3O = h4PO4 + 5HF
(*ответ*) PF5 + 8NaOH = Na3PO4 + 5NaF + 4h3O
(*ответ*) Na2CO3 + Al2O3 2NaAlO2 + СО2
(*ответ*) Al2O3 + 2NaOH + 3h3O = 2Na
PF5 + 2Na2CO3 = Na3PO4 + 2CO2 + NaF
Вещества даны: концентрированная азотная кислота, фосфор, диоксид серы, концентрированный раствор сульфита аммония. Напишем уравнения четырех возможных реакций между этими веществами. В результате получаем: _
(*ответ*) P + 5HNO3 = h4PO4 + 5NO2 + h3O
(*ответ*) (Nh5)2SO3 + SO2 + h3O = 2Nh5HSO3
(*ответ*) 2HNO3 + (Nh5)2SO3 = (Nh5)2SO4 + 2NO2 + h3O
P + SO2 = PS + O2
Данные вещества: концентрированная серная кислота, сера, серебро, хлорид натрия.
 Напишем уравнения четырех возможных реакций между этими веществами. В результате получаем: _
Напишем уравнения четырех возможных реакций между этими веществами. В результате получаем: _ (*ответ*) 2h3SO4 + S = 3SO2 + 2h3O
(*ответ*) h3SO4 + 2NaCl = Na2SO4 + 2HCl (или NaHSO4 + HCl)
(*ответ*) 2Ag + 2h3SO4 = Ag2SO4 + SO2 + 2h3O
(*ответ*) 2Ag+S = Ag2S
3h3SO4 + 2NaCl = 2Na + 2HCl + 3SO2 + 2h3O+ O2
Вещества даны: хлористоводородная кислота концентрированная, растворы хлорида хрома(III), гидроксид натрия. Напишем уравнения четырех возможных реакций между этими веществами. В итоге получаем: _
(*ответ*) HClO3 + 2CrCl3 + 4h3O = h3Cr2O7 + 7HCl
(*ответ*) HClO3 + NaOH = NaClO3 + h3O
(*ответ*) CrCl3 + 3NaOH = Cr(OH)3 + 3NaCl
(*ответ*) ) CrCl3 + 6NaOH = Na3 + 3NaCl
CrCl3 + 8NaOH = Na4 + 4NaCl
Приведены вещества: хлор, концентрированная азотная кислота, растворы хлорида железа(II), сульфид натрия. Напишем уравнения четырех возможных реакций между этими веществами. В результате получаем: _
(*ответ*) 2FeCl2 + Cl2 = 2FeCl3
(*ответ*) Na2S + FeCl2 = FeS + 2NaCl
(*ответ*) Na2S + 4HNO3 = S + 2NO2 + 2NaNO3 + 2h3O
(*ответ*) FeCl2 + 4HNO3 = Fe(NO3)3 + NO2 + 2HCl + h3O
2HNO3 + Cl2 = 2HCl + 2NO2 + h3O
Вещества даются: хлорид фосфора(III), концентрированный раствор едкого натра, хлор.
 Напишем уравнения четырех возможных реакций между этими веществами. В результате получаем: _
Напишем уравнения четырех возможных реакций между этими веществами. В результате получаем: _ (*ответ*) PCl3 + 5NaOH = Na2PHO3 + 3NaCl + 2h3O
(*ответ*) PCl3 + Cl2 = PCl5
(*ответ*) 2NaOH + Cl2 = NaCl + NaClO + h3O
4NaOH + 2Cl2 = 4NaCl + h3O + O3
Методом электронного баланса составим уравнение реакции: Cl2 + NaI + h3O ® NaIO3 + … и определить окислитель и восстановитель. В результате получаем: _
(*ответ*) уравнение реакции 3Cl2 + NaI + 3h3O = NaIO3 + 6HCl
(*ответ*) окислитель — хлор
(*ответ*) восстановитель — йод
уравнение реакции 2Cl2 + NaI + 2h3O = NaIO3 + 4HCl
восстановитель — хлор
окислитель — йод
При составлении уравнений окислительно-восстановительных реакций данным методом рекомендуется придерживаться следующего порядка:
1. Запишите схему реакции с указанием исходного и полученного веществ, определите элементы, изменяющие степень окисления в результате реакции, находят окислитель и восстановитель.
2. Составьте электронные уравнения, исходя из того, что окислитель принимает электроны, а восстановитель их отдает.
3. Множители (базовые коэффициенты) для электронных уравнений подобрать таким образом, чтобы количество электронов, отданных при окислении, было равно количеству электронов, полученных при восстановлении.
4. Расставьте коэффициенты в уравнении реакции.
ПРИМЕР 3: Напишите уравнение восстановления оксида железа (III) углеродом. Реакция протекает по схеме:
Fe 2 O 3 + C → Fe + CO
Решение: Железо восстанавливают понижением степени окисления с +3 до 0; углерод окисляется, его степень окисления повышается от 0 до +2.
Составим схемы этих процессов.
восстановитель 1| 2Fe +3 + 6e = 2Fe 0, процесс окисления
окислитель 3| C 0 -2e = C +2, процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Найдя наименьшее общее кратное между числами 2 и 6, определяем, что молекул восстановителя должно быть три, а молекулы окислителя две, т. е. находим соответствующие коэффициенты в уравнении реакции перед восстановителем, окислителем и окислением и продукты восстановления.
е. находим соответствующие коэффициенты в уравнении реакции перед восстановителем, окислителем и окислением и продукты восстановления.
Уравнение будет иметь вид:
Fe 2 O 3 + 3C = 2Fe + 3CO
Метод электронно-ионных уравнений (полуреакций).При составлении электронно-ионных уравнений учитывается форма существования веществ в растворе (простой или сложный ион, атом или молекула вещества, нерастворимого или трудно диссоциирующего в воде).
Для составления уравнений окислительно-восстановительных реакций данным методом рекомендуется придерживаться следующего порядка:
1. Составьте схему реакции с указанием исходных веществ и продуктов реакции, отметьте ионы, изменяющие степень окисления в результате реакции, определите окислитель и восстановитель.
2. Составьте схемы полуреакций окисления и восстановления с указанием исходных и образующихся ионов или молекул в условиях реакции.
3. Уравнять количество атомов каждого элемента в левой и правой частях полуреакций; следует помнить, что в водных растворах в реакциях могут участвовать молекулы воды, ионы Н+ или ОН-.
Следует помнить, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходят по-разному, в зависимости от рН среды. В кислых растворах избыток кислорода связывается с ионами водорода с образованием молекул воды, а в нейтральных и щелочных растворах — с молекулами воды с образованием гидроксид-ионов. Например,
MnO 4 — + 8H + + 5e = Mn 2+ + 4H 2 O (кислая среда)
NO 3 — + 6H 2 O + 8e = NH 3 + 9OH — (нейтральная или щелочная среда).
Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде — за счет гидроксид-ионов с образованием молекул воды. Например,
I 2 + 6H 2 O — 10e = 2IO 3 — + 12H + (кислая или нейтральная среда)
CrO 2 — + 4OH — — 3e = CrO 4 2- + 2H 2 O (щелочная)
4. Уравнять общее количество зарядов в обеих частях каждой полуреакции; для этого нужно добавить необходимое количество электронов в левую и правую части полуреакции.
5. Множители (основные коэффициенты) для полуреакций подобрать таким образом, чтобы количество электронов, отдаваемых при окислении, было равно количеству электронов, полученных при восстановлении.
6. Сложить уравнения полуреакций с учетом найденных главных коэффициентов.
7. Расставьте коэффициенты в уравнении реакции.
ПРИМЕР 4: Напишите уравнение окисления сероводорода хлорной водой.
Реакция протекает по схеме:
H 2 S + Cl 2 + H 2 O → H 2 SO 4 + HCl
Раствор. Восстановлению хлора соответствует следующее уравнение полуреакции: Cl 2 + 2e = 2Cl — .
При составлении уравнения полуреакции окисления серы исходим из схемы: H 2 S → SO 4 2-. В ходе этого процесса атом серы связывается с четырьмя атомами кислорода, источником которых являются молекулы воды. При этом образуется восемь ионов Н+; кроме того, из молекулы H 2 S высвобождается два иона Н+.
Всего образуется 10 ионов водорода:
В левой части диаграммы находятся только незаряженные частицы, а суммарный заряд ионов в правой части диаграммы равен +8. Следовательно, в результате окисления выделяется восемь электронов:
Следовательно, в результате окисления выделяется восемь электронов:
H 2 S + 4H 2 O → SO 4 2- + 10 H +
Так как отношение числа электронов, принятых при восстановлении хлора и отданных при окислении серы составляет 8×2 или 4×1, то, сложив уравнения полуреакций восстановления и окисления, первое из них надо умножить на 4, а второе на 1.
Получаем:
Cl 2 + 2e = 2Cl — | четыре
H 2 S + 4H 2 O = SO 4 2- + 10H + + 8e — | один
4Cl 2 + H 2 S + 4H 2 O = 8Cl — + SO 4 2- + 10H +
В молекулярном виде полученное уравнение имеет следующий вид:
4Cl 2 + H 2 S + 4H 2 O = 8HCl + H 2 SO 4
Одно и то же вещество в разных условиях может окисляться или восстанавливаться до разных степеней окисления соответствующего элемента, поэтому величина эквивалента окислителя и восстановителя также может иметь разную ценности.
Эквивалентная масса окислителя равна его молярной массе, деленной на число электронов n, которое присоединяет одна молекула окислителя в этой реакции.


 Напишите уравнения четырех возможных реакций.
Напишите уравнения четырех возможных реакций.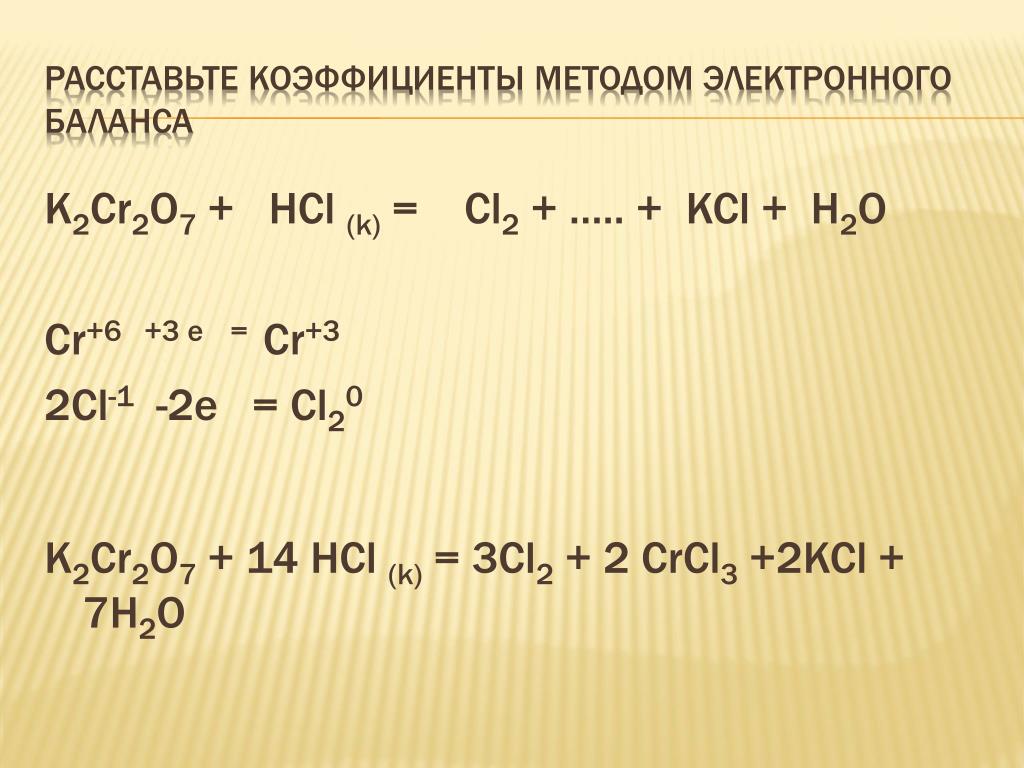
 Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения.
Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения. у.). Определите молекулярную формулу амина, приведите его название.
у.). Определите молекулярную формулу амина, приведите его название.