Список уравнений реакций (Страница 45)
Список уравнений реакций (Страница 45) — Химические Уравнения Онлайн! Обратно к введению уравнения- Al2(SO4)3 + NaOH = Na2SO4 + Al(OH)3 + Na[Al(OH)4]
- Cr2O7 + SO2 + h4O:+ = Cr:3+ + SO3 + h3O
- SnCl2 + SO2 + HCl = SnS2 + SnCl4 + h3O
- PbO2 + HCl = Pb + HClO
- Ag + CrO4 = Ag2CrO4
- I2 + NaOH = NaOI + NaI + h3O
- S + HNO3 = NO2 + SO2 + h3O
- Fe + HNO3 = Fe(NO3)2 + (Nh5)(NO3) + h3O
- Cu + KCN + h3O = K[Cu(CN)2] + KOH + h3
- As + S = As2S3
- C10H8 + O2 = CO2 + h3O
- KHF2 + SO3 + h3SO4 = HSO3F + K2SO4
- [Cr(Nh3)2(CO)6]4[Cr(CN)6]3 + KMnO4 + h3SO4 = K2Cr2O7 + KNO3 + CO2 + h3O + MnSO4 + K2SO4
- (Nh5)SO4 + NaOH = NaSO4 + h3O + Nh4
- Ch5 + O2 = CO2 + h3O + C2
- Ca(OH)2 + h3CO3 = CaCO3 + h3O
- Ba + h3SO4 = BaSO4 + H
- h3SO4 + Cu = CuS + CuSO4 + h3O
- MnO2 + h3O2 + h4O:+ = O2 + Mn:2+ + h3O
- HCl + SO3 = HSO3Cl
- AgNO3 + h3O = Ag2O + HNO3
- HCOOH + h3O = COOH + h4O
- CuSO4 + h3 = h3SO4 + Cu
- Na2S + KMnO2 + h3SO4 = MnSO4 + S + K2SO4 + Na2SO4 + h3O
- C8H8 + KMnO4 = C7H5O2K + K2CO3 + MnO2 + KOH + h3O
- FeSO4 + h3O2 = Fe2(SO4)3 + Fe2O3 + O2 + h3O
- AgNO3 + Ph4 + h3O = h4PO4 + Ag + HNO3
- h3SO3 + OH:- = HSO3:- + h3O
- Al + Nh5ClO4 = Al2O3 + AlCl3 + NO + h3O
- MnCl2 + KOH + h3O2 = MnO2 + KCl + h3O + Cl2
- MnCl2 + KOH + h3O2 = MnO2 + KCl + h3O
- Ch3O + KMnO4 = K2CO3 + Mn + h3O + CO2
- Ni(OH)2 + Br2 + KOH = Ni(OH)3 + KBr
- MgCl2 = Mg + Cl2
- C3H5N3O9 = CO2 + h3O + N2 + O2
- Ba(OH)2 + h3SO4 = BaSO4 + h3O
- Zn + HNO3 = ZnNO3 + Nh5NO3 + h3O
- MgCO3 + HCl = MgCl2 + h3O + CO2
- Nh4 + O2 = HNO3 + h3O
- HCl + KMnO4 = MnCl2 + KCl + h3O + Cl
- KMnO4 + h3C2O4 = h3O + CO2 + MnO2 + K2CO3
- K3AsS3 + HNO3 = K3AsO4 + h3SO4 + NO + h3O
- ReCl5 + h3O = HReO4 + ReO2 + HCl
- Ch5 + O2 = CO + h3
- Cl2 + Ch5 = CCl4 + HCl
- FeS + O2 + N2 = FeO + SO2 + NO
- P + Cl2 = PCl3
- CuCl2 + KOH = Cu(OH)2 + KCl
- Fe + h3O = FeO + h3
- Na3CrO3 + PbO2 + NaOH = Na2CrO4 + Na2PbO2 + h3O
h4O — Фактические вопросы — Доска объявлений Straight Dope
Доска объявлений Straight DopeThe_Ryan
#1
Каков период полураспада перекиси водорода (при условии STP и непрозрачного контейнера)?
Плутон
#2
Это h302, Райан .
Я думаю, что он довольно стабилен в разбавленных концентрациях, которые вы покупаете в аптеке. В любом случае, это должно длиться год или больше.
Высококонцентрированное вещество (например, ракетное топливо) трудно держать под рукой. Дело не в том, что оно самопроизвольно разлагается, это больше похоже на спусковой крючок для волос. Он очень реакционноспособен и экзотермичен, поэтому, как только он запускается, все более или менее проходит.
«Я скажу ему, но не думаю, что он будет очень заинтересован. Видите ли, у него уже есть один!»
Видите ли, у него уже есть один!»
Хлоя
#3
На самом деле моя подруга-медсестра сообщила мне, что после вскрытия перекись действует всего несколько коротких месяцев. В нераскрытом виде может храниться более года.
Ботаник
#4
Хм, я верю, что ракетное топливо — это h3 и O2 отдельно. Сильно экзотермическая реакция 2ч3 + О2 -> 2ч30.
Значит, перекись тут ни при чем. Конечно IANARS, так что могу ошибаться.
экран4
#5
Гм, я действительно считаю, что ракетное топливо — это h3 и O2 отдельно. Сильно экзотермическая реакция 2ч3 + О2 ->
2ч30.
Это правда, но h3O2 также является сильным окислителем. Реакция 2h3O2 -> O2 + 2h3O требует очень мало энергии и производит кислород, который соединяется с любым топливом, которое вы ей подбрасываете. Кроме того, с ним гораздо проще обращаться, чем с чистым кислородом, потому что h3O2 является относительно стабильной жидкостью при комнатной температуре и атмосферном давлении. Чистый O2 трудно носить с собой в полезных количествах — его нужно либо сжимать в очень прочном резервуаре, либо сжижать и хранить при криогенных температурах.
Beal Aerospace разрабатывает ракету на керосине и перекиси водорода.
Несколько месяцев назад в Японии произошла авария, когда кто-то перевозил перекись водорода высокой концентрации в автоцистерне, а затем пытался перевезти что-то еще (масло?), не очень хорошо помыв бак.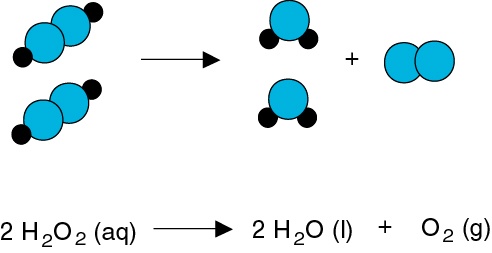
ябоб
#6
Перекись водорода использовалась в ракетах на жидком топливе еще до Второй мировой войны, а также в других целях, например, в торпедах. Немецкий V2 работал на перекиси водорода.
Немного информации:
http://www.ee.surrey.ac.uk/SSC/h3O2CONF/PStokes.htm
Когда-то была штука под названием V2
Которая для пилотирования вам не нужна была
Вы просто нажали на кнопку
и она оставила бы орехи
но окоченевшие и большие дыры и обломки тоже
«Радуга гравитации» Пинчона. На самом деле я проявляю сдержанность, не цитируя последующие лимерики…
Энди#7
Я не согласен с Плутоном. Я использую 90% раствор перекиси водорода, который я открыл больше года назад. Он не утратил своей активности. Перекись водорода разлагается, но очень медленно при комнатной температуре, и я не думаю, что концентрация так важна (она не является автокаталитической), как присутствие примесей металлов в следовых количествах, которые, безусловно, катализируют это разложение.
Туман
#8
Первоначально отправлено yabob:
…Немецкий V2 питался перекисью…
Не поэтому ли бутылочные блондины иногда называют «бомбой»?
Извините, я ухожу.
Rich_G7subs
#9
Пытаюсь вспомнить свой химический состав… Думаю, h40 — это дейтерий или «тяжелая вода».
Рич «G7SUBS»
Энди
#10
h4O на самом деле довольно бессмысленно.
Перекись водорода – это h3O2.
Дейтерированная перекись водорода будет D2O2 или HDO2.
плутон
#11
Я не согласен с теми, кто исправил мой первоначальный ответ (за одним исключением, указанным ниже).
Мои воспоминания о перекиси водорода в качестве ракетного топлива были основаны на давнем прочтении книги Вилли Лея « Rockets», ??? и космическое путешествие . (Понимаете, это было так давно, что я даже не могу вспомнить название. Я думаю, второе слово могло быть «Мужчины»). В какой-то момент разработки V2 им понадобился высококонцентрированный h3O2, и они были встревожены, обнаружив, что он недоступен. Фармацевтический материал очень разбавлен, и промышленные концентрации по-прежнему составляли всего 10% (или около того) растворов.
Я смутно припоминаю, что перекись не использовалась непосредственно в качестве топлива или окислителя (V2 использовала LOX, IIRC), а использовалась для производства пара, приводящего в действие насосы топлива и окислителя. Дальнейшее проникновение в глубины моей памяти возвращает к мысли, что подобная система или, по крайней мере, паровой генератор, работающий на H3O2, использовалась в X-15.
Жидкие h3 и O2 использовались в качестве топлива и окислителя на «Сатурн-5».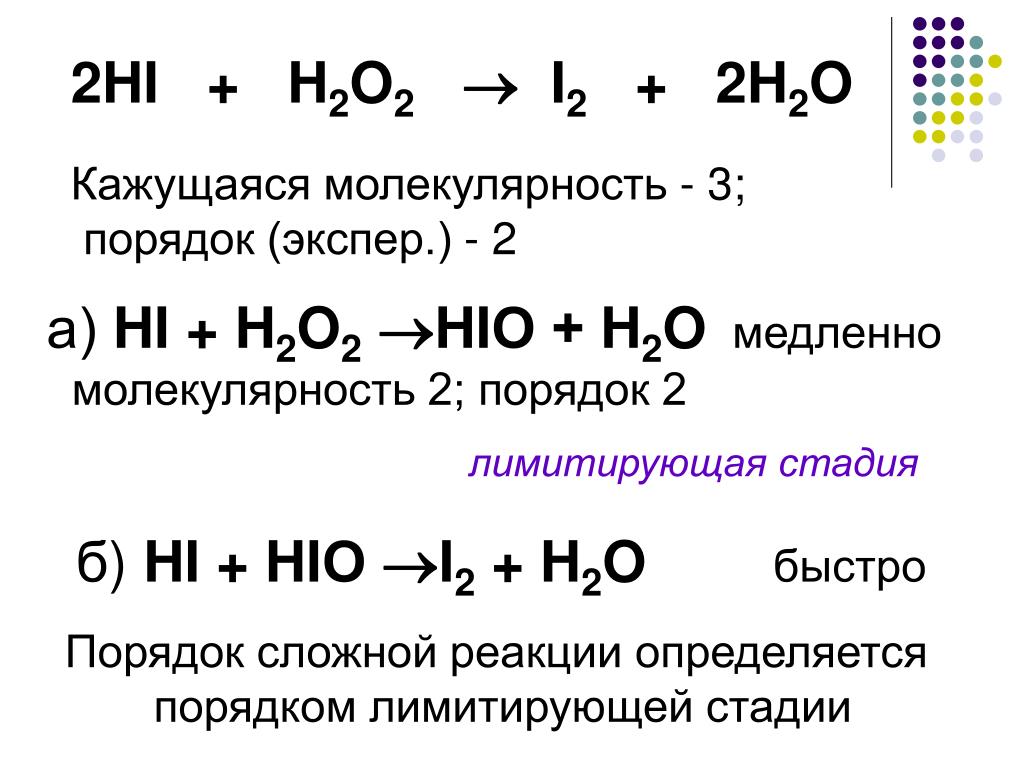 Я полагаю, что это первая ступень, но я хочу, чтобы меня поправили на этот счет.
Я полагаю, что это первая ступень, но я хочу, чтобы меня поправили на этот счет.
андроид , ты исключение. Мне трудно представить себе какое-либо применение 90%-ного решения, если только вы не говорите о каком-то техническом процессе. У вас действительно есть такое сильное решение? Дайте мне знать, если я ошибаюсь. Вы, безусловно, правы насчет использования металлов для катализа реакции.
морская звезда
#12
Перекись водорода высокой чистоты [концентрация] использовалась в качестве топлива для ракетной ленты. [летал в кино и на Олимпийских играх, но на самом деле время полета составляло всего около 30 секунд] В этом приложении перекись пропускалась через катализатор для производства пара, который приводил в действие ракетный пояс.
система
№13
h40+ обычно называют кислотой
В основном это ионы h30 и H+. Вы спрашиваете о h302. На самом деле это обычная перекись водорода. У Wish на самом деле нет периода полураспада. Он не подвергается альфа-, бета- или гамма-деградации.
16 только что провел такие лучшие дни, дни, когда я все еще чувствовал себя живым, я не мог дождаться, чтобы выйти на улицу. Мир наблюдал.
Рональд Барнхардт
№14
H3O2 в моей аптечке всего 3%. Я верю, что он разрушается светом. Вот почему он поставляется в светонепроницаемой бутылке.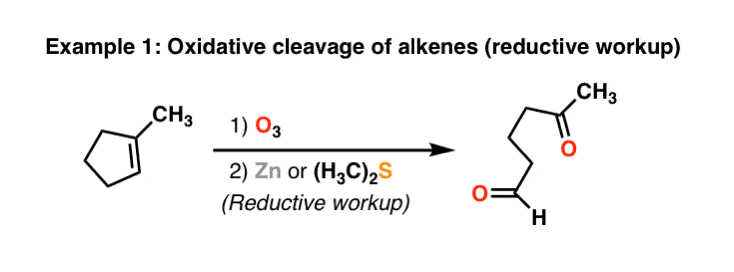 Все, что сильнее, было бы токсичным.
Все, что сильнее, было бы токсичным.
Если мне не изменяет память (давно не было химии), h3O2 считается кислородным радикалом, как O3 и синглетный кислород, и очень токсичен для растительных и животных клеток, из-за присутствия разрушающих клеточную мембрану и ДНК синглетные атомы кислорода.
Немного не по теме: кто-нибудь может сказать мне химическое название h3O, кроме воды? Я говорю, что это оксид водорода, но моя жена говорит, что это неправильно, но она не может придумать правильное химическое название, если оно действительно существует.
КуртК
№15
Рич G7subs написал:
Пытаюсь вспомнить свою химию… Я думаю, что h40 — это дейтерий или «тяжелая вода».
Не совсем. Дейтерий — это атом водорода с дополнительным нейтроном в ядре (нормальный атом водорода имеет только протон, поэтому дейтерий в два раза тяжелее обычного водорода).
Если сделать воду из дейтерия, она называется «тяжелая вода». Обычный h3O имеет вес 18 (16 для O плюс 2 для водорода), но тяжелая вода будет иметь вес 19, потому что один из атомов водорода будет иметь лишний нейтрон.
Кстати, атом водорода с еще одним нейтроном, который имеет атомный вес 3, называется тритием. Спрос на этот материал превышает предложение, поэтому он чрезвычайно дорог.
ИнутилисВисЭст
№16
Как вы можете видеть здесь, перекись водорода (h3O2) использовалась и использовалась в качестве окислителя ракетного топлива.
Конечно, h3 и O2 используются в качестве ракетного топлива, особенно в главных двигателях космических челноков.
Вы могли бы сжигать дейтерий (D2) или тритий в химической ракете, но это было бы чертовски дорого.
Перекись водорода в высоких (90%) концентрациях используется, в том числе, в производстве зеркал.
h4O+ называется ионом гидроксония и присутствует в кислых растворах.
Воду можно назвать по-разному, в зависимости от того, в какой области химии вы находитесь. Гидроксид водорода (HOH) — это то, что предпочитают химики-органики, IIRC.
Вещи имеют период полураспада, даже если они не радиоактивны. Например, период полувыведения лекарства может составлять 2 часа, поэтому вы примете больше за 4 часа, если концентрация будет составлять 1/4 той, с которой вы начали.
Я веду скучную относительно незначительную жизнь. Действительно.
Энди
# 17
Период полураспада, связанный с радиоактивным распадом, и период полураспада, означающий химическую стабильность, не следует путать.
В лабораторных масштабах очень высококонцентрированная и даже почти чистая перекись водорода производится перегонкой с водяным паром (примерно до 90%) и низкотемпературной кристаллизацией (примерно до 98%) для проведения некоторых специфических процессов окисления, таких как получение оксазиридины, хотя и не используются в данном случае, но вы можете посмотреть структуру, если она вас интересует. Это также позволяет получать почти безводную перекись водорода, хотя обычно аддукт мочевина-перекись водорода используется, когда требуется безводная перекись.
Энди
# 18
Первоначально написано CurtC:
Если вы делаете воду из дейтерия, она называется «тяжелой водой». Обычный h3O имеет вес 18 (16 для O плюс 2 для водорода), но тяжелая вода будет иметь вес 19, потому что один из атомов водорода будет иметь лишний нейтрон.
**
Я не уверен, есть ли в продаже моно-дейтеро-вода. Единственная «более тяжелая» вода, продаваемая большинством поставщиков, — это D20 с молекулярной массой (приблизительно) 20. А если вы хотите настоящий дорогой, попробуйте купить D2(18)O, молекулярная масса 40 ;).
Энди
# 19
К сожалению, MW = 22. Я думал о D2(18)O2, mw= 40… теперь , что будет дорого.
Трелл
#20
V-2 работал на водке и жидком O2. спирт производился путем брожения картофеля и дистилляции. h3O2 — очень хороший окислитель, но, как уже говорилось ранее, немцы не смогли найти его в больших количествах.
h3O2 — очень хороший окислитель, но, как уже говорилось ранее, немцы не смогли найти его в больших количествах.
следующая страница →
pH перекиси водорода – кислотная или щелочная?
Перекись водорода или h3O2 представляет собой химическое соединение, состоящее из двух атомов кислорода и двух атомов водорода.
В чистом виде представляет собой бледно-голубую слегка вязкую жидкость. Это простейший пероксид, имеющий одинарную связь кислород-кислород. Медленно разлагается в присутствии света, из-за чего хранится в темных бутылях.
Является ли перекись водорода кислотой? Да. Перекись водорода является кислотой, так как имеет рН 6,2. Однако значение pH зависит как от концентрации, так и от температуры раствора. При температуре около 25°С, в зависимости от концентрации перекиси водорода в растворе, значение рН колеблется от 4,2 до 7,9.0018
Растворы перекиси водорода, изготовленные для коммерческих целей, содержат стабилизаторы, которые также являются кислыми, благодаря чему рН раствора дополнительно снижается до 2,5-3,5.
Почему h3O2 является слабой кислотой?
Слабые кислоты имеют низкое значение константы кислотной диссоциации (Ka). В случае пероксида водорода значение Ка составляет около 1,55·10-12 при 298 К, что указывает на то, что это слабая кислота.
Кроме того, сила кислоты оценивается по ее тенденции терять протон, т.е. ионы H+.
Чистая перекись водорода не образует ионов водорода и имеет значение pH 7, что является нейтральным, а значение pH 0,1 М водного раствора перекиси водорода составляет 6,4.
Следовательно, перекись водорода является слабой кислотой.
В водном растворе уравнение диссоциации пероксида водорода имеет вид: =====> h4O+ + (O2) 2- (Пероксид-ион)
Двойная стрелка в реакции указывает на обратимую реакцию, указывая на то, что ионы, образующиеся после диссоциации перекиси водорода, имеют тенденцию к преобразованию исходных молекул, таким образом, подтверждая, что h3O2 является слабой кислотой.
Как рассчитать pH перекиси водорода?
pH – это количественная мера кислотности или щелочности раствора. Значение по шкале pH колеблется от 1 до 14, среди которых 7 — это значение для нейтрального раствора.
Растворы со значением pH ниже 7 являются кислыми, тогда как растворы со значением pH выше 7 являются щелочными.
рН впервые использовал датский биохимик С.П.Л. Серенсена, который определил ее как концентрацию ионов водорода в растворе, которая колеблется от 1 до 10-14. Определяется по формуле
pH = – log [H+]
В случае h3O2 расчет pH для 0,1 М раствора h3O2:
Концентрация ионов водорода рассчитывается как:
[H+] = √Ka X M 9-7
Значение pH для 0,1 М раствора теперь можно рассчитать как:
pH = – log [H+]
= – log [ 3,93 X 10-7 ]
= – log [ 3,93 – 7 log 10]
= 6,41
Поскольку значение pH меньше 7, становится ясно, что h3O2 имеет кислую природу.
Константа кислотной диссоциации (Ka) и логарифмическая константа (pKa):
В предыдущем разделе мы использовали значение Ka для расчета pH раствора h3O2.
Вот вы спросите, что это за Ка и как оно связано с кислотностью раствора? Продолжайте читать, чтобы понять это.
Значение константы диссоциации кислоты (Ka) используется для оценки степени ионизации кислоты. Именно константа равновесия помогает измерить силу кислого раствора.
Значение константы кислотной диссоциации указано в моль/л. Для сильных кислот значение Ka выше, а для слабых кислот значение Ka ниже.
Также иногда выражается как логарифмическая константа pKa. Значение pKa для сильных кислот ниже -2, в то время как для слабых кислот значение pKa находится между -2 и 12.
Расчет значений Ka и pKa для кислот:
Значение Ka и pKa дает нам меру силы любой кислоты.
Как мы уже говорили ранее, сильные кислоты почти полностью ионизируются в растворе, а слабые кислоты полностью не диссоциируют, поэтому их значения Ka можно рассчитать, используя концентрацию их ионов в растворе. 9-pH
9-pH
pH раствора можно рассчитать, если известна молярная концентрация кислоты в растворе, и, в свою очередь, значение pH можно использовать для расчета значения Ka этого раствора.
Дополнительный процент диссоциации можно также рассчитать как:
% диссоциации = ([A- (водн.)] / [ГК (водн.)]) X 100
| Тип кислоты | Значение Ка | Значение рКа |
| Очень прочный | >0,1 | < 1 |
| Сильный | 10-3 – 0,1 | 1 – 3 |
| Слабый | 10-5 – 10-3 | 3 – 5 |
| Очень слабый | 10-15 – 10-5 | 5 – 15 |
| Чрезвычайно слабый | < 10-15 | >15 |
Типы кислот
Кислоты представляют собой вещества, диссоциирующие в водном растворе. Легкость, с которой молекулы кислоты высвобождают ионы Н+, определяет силу кислоты.
Кроме того, вещество может быть классифицировано как кислота, если оно обладает следующими характеристиками:
• Оно превращает синий лакмус в красный.
• Имеет pH менее 7.
• Образует соль со своим комплементарным основанием.
В химии было предложено несколько теорий для идентификации вещества как кислоты или основания. Ниже приведены три теории:
Теория Бренстеда-Лоури : Согласно этой теории, если молекула легко отдает протон в растворе, это кислота.
Теория Льюиса : Молекула, которая занимает неподеленную пару электронов, отдаваемых другой молекулой.
Теория Аррениуса : Молекула, которая не образует ион гидроксида (OH-) в растворе.
h3O2 образует в растворе ионы водорода, легко принимает неподеленную пару электронов, а также не образует в растворе ионов гидроксида.
Кроме того, значение pH для h3O2 меньше 7. Следовательно, h3O2 является кислотой.
Следовательно, h3O2 является кислотой.
После того как вещество было идентифицировано как кислота или основание, оно далее классифицируется как сильная или слабая кислота и сильное или слабое основание.
Кислоты, которые легко диссоциируют в водном растворе и высвобождают ионы водорода, называются сильными кислотами, например, h3SO4, HCl и т. д., а кислоты, которые не диссоциируют легко или быстро, реагируя со своим сопряженным основанием с образованием исходной молекулы, называются сильными. называемые слабыми кислотами, например, HCN, Ch4COOH, h3O2 и т. д.
Посмотрите видео с лакмусовой бумажкой на перекись водорода.
Является ли h3O2 кислотой или основанием Льюиса?
Согласно теории Льюиса, кислота — это вещество, которое принимает электронные пары, а основания — это вещества, которые отдают электронные пары.
При объединении они приводят к образованию продукта, известного как аддукт Льюиса, путем образования ковалентной ковалентной связи между ними.
Реакция представлена следующим уравнением:
На самом деле кислоты Льюиса имеют пустые орбитали, благодаря чему они способны принимать электроны.
Ионы водорода (H+) и ионы гидроксония (h4O+) считаются кислотами Льюиса.
В случае перекиси водорода Уравнение диссоциации записывается как:
H3O2+H3O ——-> H4O++HO2- (гидропероксид ион)
HO2-+H3O—> H4O++(O2). 2- (пероксид-ион)
Эти уравнения отображают высвобождение ионов гидроксония в уравнении диссоциации. Следовательно, перекись водорода является кислотой.
h3O2 Свойства
Перекись водорода имеет химическую формулу h3O2. Некоторые из его важных свойств перечислены ниже:
• Молярная масса h3O2 составляет 34,0147 г/моль
• Смешивается с водой
• Имеет плотность 1,11 г/см3 20 °C
• Плавление и температуры кипения h3O2 составляют -0,43 °С и 150,2 °С соответственно.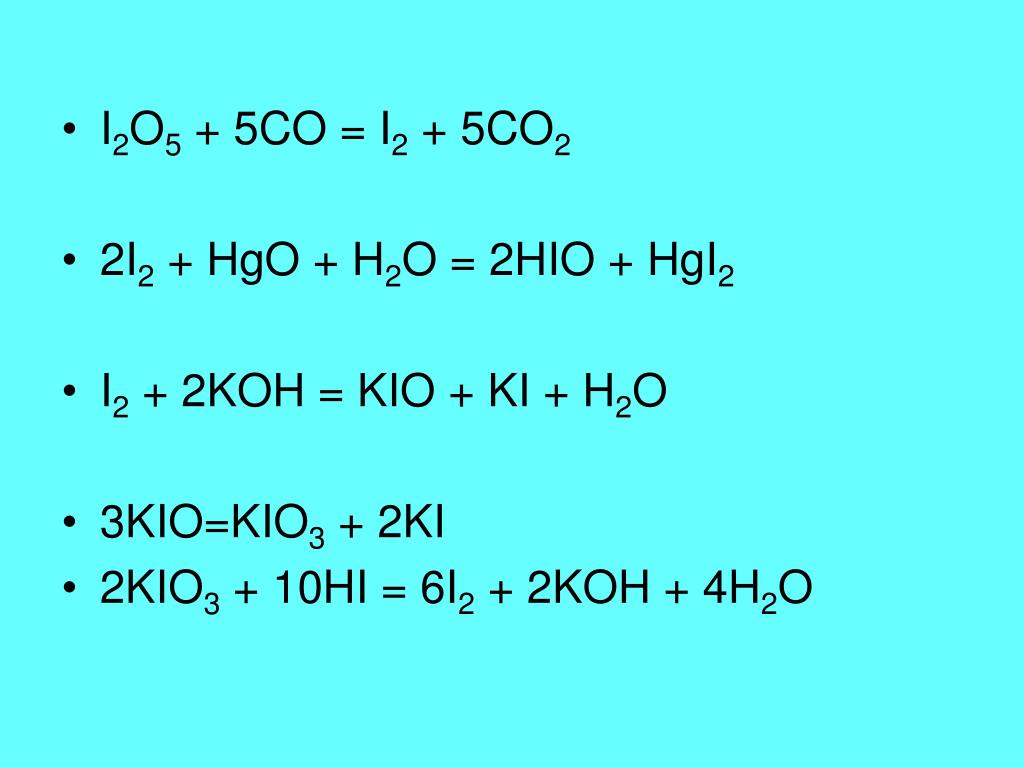
• Давление паров 5 мм рт. ст.
• Имеет неплоскую структуру с симметрией С2. Однако валентный угол и длина связи различаются для газовой и твердой фаз.
• Значение pKa равно 11,75
• Значение показателя преломления равно 1,4061.
• Вязкость 1,245 сП
• Дипольный момент 2,26 D.
h3O2 Применение
• Перекись водорода используется для различных целей:
• Используется, в частности, в качестве отбеливателя отбеливание бумаги.
• Он также используется в производстве перкарбоната натрия и пербората натрия, которые используются в качестве отбеливателей в стиральных порошках.
• Наряду с дибензоилпероксидом используется для производства органических пероксидов.
• Используется для лечения акне и как антисептик.
• Также используется в процессе полимеризации.
• Раствор 3-6 % по массе предназначен для потребительских целей, таких как очистка и дезинфекция.
• Высококонцентрированная перекись водорода, также известная как высококонцентрированная перекись, используется в ракетном топливе, поскольку она разлагается со взрывом.

