9) Направленность ковалентной связи. Строение молекул h3, Cl2, hCl, h3o, h3s, nh4, ch5, bCl3, BeCl2. Гибридизация электронных облаков, s и p связь. Строение молекул этилена, ацетилена.
В случае ковалентной связи взаимное перекрытие электронных облаков в пространстве определяет форму молекулы.
1)AA, BB.Этот тип молекул характерен для Н2 (s-связь), галогенов, и соединений Н с галогенами. (см.рис).Молекулы водорода имеют линейную структуру. Химическая связь действует по кратчайшему расстоянию, связывая атомыs-связью(см.рис).
2)А2В.Этот тип характерен для соединений, образованных элементами главной подгруппы 6-ой группы: Н2О, Н2S.(см.рис) ( Н2О – угол –1050, Н2S – 92035’) Максимальная плотность возникает при темп.=4 градуса цельсия.
3)А3В.Элементы главной подгруппы 3
группы(N,P,As,Sb). NH3 (см.рис).
NH3 (см.рис).
4)А4В Главная подгруппа 4 группа(Si,C,Ge,Sn). СН
5)АВ3 – характерно для соединений гл. подгруппы 3-ей группы.(B,Al,Ga,In,Tl) BCl3. s2p®sp2®q3(см.рис).
6)АВ2–для некоторых соединений, образованными
элементами главной подгруппы 2 группы.
ВеCl2(линейная структура, угол –
1800). sp®spàq2d2sp3®q6 (см.рис)Сигма и p — связь.Если в молекуле имеется кратная
связь между атомами (двойная и тройная),
то только одна связь является прочной
-s-связь.
Предположим, что
мы имеем соединение АB, при этом
взаимодействуют атомы A B с большим
значением энергии сродства к электрону.
ЭОa>Эоb -> общая электронная пара в
молекуле AB смещена от атома B к атому А.
Электронейтральность нарушается, в
молекуле появляются положительный и
отрицательный полюса.(см.рис5) Такая
структура молекулы носит название
полярная структура.
 Наличие полярных структур
молекул приводит к тому, что могут
возникать ассоциаты-агрегаты состояний
из нескольких молекул. Возн. ассоциат
есть рез-т проявления водородных
связей.(Н2О)x (НF)y (см.рис11) Общая эл. пара
смещена к атому О. Атом Н практически
лишен электронной оболочки. Несимметричная
структура воды приводит к поляризации
связи => наличие водородных связей =>аномальные свойства воды. 1)
dmax(максимальная плотность) при +4?C –
(Н2О)2 2) Вода обладает максимальной
теплоемкостью среди всех жидкостей.
При нагревании воды энергия идет на
разрыв водородных связей (энергия
затрачивается не только на движение
молекул воды) 3) lo-н=0,96А? lо…н=1,76А?
Е(водородной связи)=20ч40кДж/моль. Водородная
связь(?)
Наличие полярных структур
молекул приводит к тому, что могут
возникать ассоциаты-агрегаты состояний
из нескольких молекул. Возн. ассоциат
есть рез-т проявления водородных
связей.(Н2О)x (НF)y (см.рис11) Общая эл. пара
смещена к атому О. Атом Н практически
лишен электронной оболочки. Несимметричная
структура воды приводит к поляризации
связи => наличие водородных связей =>аномальные свойства воды. 1)
dmax(максимальная плотность) при +4?C –
(Н2О)2 2) Вода обладает максимальной
теплоемкостью среди всех жидкостей.
При нагревании воды энергия идет на
разрыв водородных связей (энергия
затрачивается не только на движение
молекул воды) 3) lo-н=0,96А? lо…н=1,76А?
Е(водородной связи)=20ч40кДж/моль. Водородная
связь(?)Понятие о методе электронных орбиталей.
Метод валентных
связей в целом ряде случаев не может
объяснить механизм возникновения ряда
соединений и свойств образованных
молекул. Согласно методу валентных
связей хим. связь образуется с помощью
общих электронных пар. 1) Н2-энергия
разрыва связи=259кДж/моль 2) так возникает
молекула О2. В молекуле кислорода нет
не спаренных электронов.(см.рис12) Изучение
магн. св-ва молекулы кислорода показывает,
что есть не спаренные электроны. Если
вещество не имеет не спаренных электронов,
то оно не имеет магнитного ноля –
диамагнетическое вещество. Если вещество
имеет не спаренные электроны оно обладает
магнитным полем, оно втягивается внутрь
магнитного поля – парамагнитное
вещество. С т.з. валентных св-в трудно
объяснить, что ряд веществ теряя электроны
становится более прочным. О2-498кДж/моль,
О2-664кДж/моль. Электроны в атомах
располагаются на атомных электронных
орбиталях, При возникновении химических
связей электроны переходят на молекулярные
электронные орбитали. Различают два
вида молекулярных орбитали.1) связывающие
молекулярные орбитали, 2) разрыхляющие
молекулярные орбитали. При возникновении
первой электронной орбитали волновые
функции электрона складываются т.
Согласно методу валентных
связей хим. связь образуется с помощью
общих электронных пар. 1) Н2-энергия
разрыва связи=259кДж/моль 2) так возникает
молекула О2. В молекуле кислорода нет
не спаренных электронов.(см.рис12) Изучение
магн. св-ва молекулы кислорода показывает,
что есть не спаренные электроны. Если
вещество не имеет не спаренных электронов,
то оно не имеет магнитного ноля –
диамагнетическое вещество. Если вещество
имеет не спаренные электроны оно обладает
магнитным полем, оно втягивается внутрь
магнитного поля – парамагнитное
вещество. С т.з. валентных св-в трудно
объяснить, что ряд веществ теряя электроны
становится более прочным. О2-498кДж/моль,
О2-664кДж/моль. Электроны в атомах
располагаются на атомных электронных
орбиталях, При возникновении химических
связей электроны переходят на молекулярные
электронные орбитали. Различают два
вида молекулярных орбитали.1) связывающие
молекулярные орбитали, 2) разрыхляющие
молекулярные орбитали. При возникновении
первой электронной орбитали волновые
функции электрона складываются т.
12.1) Донорно-акцепторная
связь. Комплексные соединения. Является
разновидностью ковалентной связи.
Соединения первого порядка или валентно
насыщенные соединения. h3O, AgCl, Nh4, HCl, KJ,
HgJ2, CuSO4, FeCl3 и т.д. Они могут давать
соединения высшего порядка или комплексные
соединения. 1)Nh4+ HClà[Nh5]Cl, 2)AgCl+2Nh4=[Ag(Nh4)2]Cl, 3)CuSO4+4Nh4= [Cu(Nh4)4]SO4,
4)2KJ+HgJ2= K2[HgJ4], 5)FeCl3+6h3Oà[Fe(h3O)6]Cl3. Комплексные соединения-
соединения, которые образуются без
возникновения новых электронных пар,
а за счет проявления дон.-акц. связи.(см.рис)
BF3+Nh4àBF3Nh4,
B-акцептор, N-донор. Общие св-ва ков.
и дон.-акцепторных связей. Возникают
за счет общих электрон- ных пар. В случае
ковалентной связи все участники
равноправны (каждый участник дает по
1 электрону) , д-а (каждый участник дает
электронную пару).[Cu(Nh4)4]SO4.
Cu-комплексообразователь,
4-координационное число. ( )- внутренняя
сфера, [ ]-внешняя сфера, Nh4-лиганды. Заряд
внутри сферы представляет собой сумму
зарядов центрального иона и заряда
лиганд. В целом заряд нейтрален.
1)Nh4+ HClà[Nh5]Cl, 2)AgCl+2Nh4=[Ag(Nh4)2]Cl, 3)CuSO4+4Nh4= [Cu(Nh4)4]SO4,
4)2KJ+HgJ2= K2[HgJ4], 5)FeCl3+6h3Oà[Fe(h3O)6]Cl3. Комплексные соединения-
соединения, которые образуются без
возникновения новых электронных пар,
а за счет проявления дон.-акц. связи.(см.рис)
BF3+Nh4àBF3Nh4,
B-акцептор, N-донор. Общие св-ва ков.
и дон.-акцепторных связей. Возникают
за счет общих электрон- ных пар. В случае
ковалентной связи все участники
равноправны (каждый участник дает по
1 электрону) , д-а (каждый участник дает
электронную пару).[Cu(Nh4)4]SO4.
Cu-комплексообразователь,
4-координационное число. ( )- внутренняя
сфера, [ ]-внешняя сфера, Nh4-лиганды. Заряд
внутри сферы представляет собой сумму
зарядов центрального иона и заряда
лиганд. В целом заряд нейтрален.
Константа нестойкости. Двойные соли.
К4[Fe(CN)6]4=желтая гравитая соль = 4K++ [Fe(CN)6]4-
Комплексный ион может распадаться на простые соли, например, [Fe(CN)6]4-=Fe2++ 6CN—
Kn-
константа нестойкости молекулярного
иона. (-4) (для )
(-4) (для )
Наряду с комплексными соединениями существуют так называемые двойные соли.
K2Al2(SO4)4*24H2O , etc… В отличие от комплексных соединений, у которых очень прочная внутренняя сфера, двойные соли при диссоциации сразу распадаются на простые ионы:K[MgCl3] =K++Mg2++ 3Cl—.
Газоанализаторы хлора (Cl2) — Обзор, характеристики, цены
ГРИФ-2
ПОРТАТИВНЫЙ ЭКСПРЕСС-ОБНАРУЖИТЕЛЬ
Макс. кол-во каналов: 16
Сенсор: Термокаталитический, электрохимический, оптико-абсорбционный
Цифровая индикация: Да
Измерение: SO2, h3S, CL2, NO, NO2, Nh4, HCL, HF
Взрывозащита: Да
Подробнее
СИГМА-03М
Газоанализатор универсальный
Макс. кол-во каналов: 16
Сенсор: Термокаталитический, электрохимический, оптико-абсорбционный
Цифровая индикация: Да
Измерение: h3, CO, SO2, h3S, CL2, NO, NO2, Nh4, O3
Взрывозащита: Да
Подробнее
Макс. кол-во каналов: 4
кол-во каналов: 4
Тип прибора: Переносной
Сенсор: Электрохимический Термохимический
Цифровая индикация: Да
Измерение: O2, CO, SO2, h3S, CL2, NO2, Nh4, HCL
Взрывозащита: Да
Подробнее
Газоанализаторы Сенсон
Каталог
Макс. кол-во каналов: 6
Сенсор: Электрохимический Термохимический Оптический
Цифровая индикация: Да
Измерение: O2, CO, SO2, h3S, CL2, NO2, Nh4, HCL
Взрывозащита: Да
Модификации: 5
Подробнее
СИГМА-ЕХ
МНОГОКОМПОНЕНТНЫЙ ПОРТАТИВНЫЙ ГАЗОАНАЛИЗАТОР
Макс. кол-во каналов: 5
Сенсор: Оптический, электрохимический
Цифровая индикация: Да
Измерение: h3, CO, CO2, SO2, h3S, CL2, NO2, Nh4, Ch5, C3H8
Взрывозащита: Да
Подробнее
СГА-ЕХ
СТЕНД ГАЗОАНАЛИТИЧЕСКИЙ С АВТОМАТИЧЕСКОЙ СИСТЕМОЙ ПРОБООТБОРА
Макс. кол-во каналов: 4
Сенсор: Оптический, электрохимический
Цифровая индикация: Да
Измерение: O2, h3, CO, SO2, CL2, NO2, Nh4, Ch5
Взрывозащита: Да
Подробнее
БПС-21М
Блок питания и сигнализации
Макс.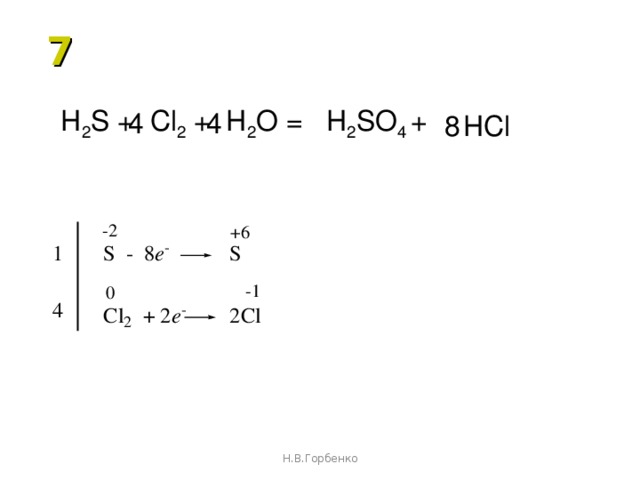 кол-во каналов: 12
кол-во каналов: 12
Тип прибора: Стационарный
Цифровая индикация: Да
Измерение: O2, h3, CO, CO2, SO2, h3S, CL2, NO2, Nh4, HCL, EX, Ch5, C3H8, C2h3, D2O, SumCH
Взрывозащита: Да
Модификации: 28
Подробнее
ДАХ-М
Датчик-газоанализатор
Макс. кол-во каналов: 1
Тип прибора: Стационарный
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: O2, CO, SO2, h3S, CL2, NO2, Nh4, HCL
Взрывозащита: Да
Модификации: 178
Подробнее
АНКАТ-7664Микро
Газоанализатор
Макс. кол-во каналов: 4
Тип прибора: Переносной
Сенсор: Электрохимический, Термокаталитический, Оптический, Фотоионизационный
Цифровая индикация: Да
Измерение: O2, CO, CO2, SO2, h3S, CL2, NO2, Nh4, HCL, EX, Ch5, C3H8, SumCH
Взрывозащита: Да
Модификации: 42
Подробнее
СТГ-3
Сигнализатор горючих и токсичных газов
Макс. кол-во каналов: 30
Тип прибора: Стационарный
Сенсор: Электрохимический, Термокаталитический
Цифровая индикация: Нет
Измерение: O2, CO, h3S, CL2, NO2, Nh4, HCL, EX
Взрывозащита: Нет
Модификации: 20
Подробнее
СКАПО
Система контроля атмосферы
Макс. кол-во каналов: 512
кол-во каналов: 512
Тип прибора: Стационарный
Цифровая индикация: Да
Измерение: O2, h3, CO, CO2, SO2, h3S, CL2, NO2, Nh4, HCL, EX, Ch5, C3H8, C2h3
Взрывозащита: Да
Подробнее
АНКАТ-410
Многокомпонентный газоанализатор промышленных выбросов
Макс. кол-во каналов: 5
Тип прибора: Стационарный
Сенсор: Электрохимический, Оптический
Цифровая индикация: Да
Измерение: O2, CO, CO2, SO2, h3S, CL2, NO, NO2, Nh4, HCL
Взрывозащита: Нет
Подробнее
СИГМА-03
Газоанализатор универсальный
Макс. кол-во каналов: 14
Тип прибора: Стационарный
Сенсор: Электрохимический, Полупроводниковый, Оптический
Цифровая индикация: Да
Измерение: O2, CO, CO2, SO2, h3S, CL2, NO, NO2, Nh4, HCL, Ch5, C3H8, C2H5OH, C6h24, O3, SF6
Взрывозащита: Да
Подробнее
ОМЕГА
Газоанализатор
Макс. кол-во каналов: 32
Тип прибора: Стационарный
Сенсор: Электрохимический, Термокаталитический, Полупроводниковый, Оптический
Цифровая индикация: Да
Измерение: O2, CO, CO2, SO2, h3S, CL2, NO, NO2, Nh4, HCL, EX, Ch5, C3H8, C6h24, O3
Взрывозащита: Да
Подробнее
СИГНАЛ-4
Газоанализатор взрывоопасных паров переносной
Макс. кол-во каналов: 1
кол-во каналов: 1
Тип прибора: Переносной
Сенсор: Электрохимический, Термокаталитический, Полупроводниковый
Цифровая индикация: Да
Измерение: O2, CO, CO2, SO2, h3S, CL2, NO, NO2, Nh4, HCL, EX, Ch5, C3H8, C6h24, O3
Взрывозащита: Нет
Подробнее
АЛЬФА
Мультигазоанализатор
Макс. кол-во каналов: 6
Тип прибора: Переносной
Цифровая индикация: Да
Измерение: O2, CO, CO2, SO2, h3S, CL2, NO, NO2, Nh4, HCL, EX, Ch5, C3H8, C6h24, O3
Взрывозащита: Нет
Подробнее
КОЛИОН-701
Газоанализатор переносной
Макс. кол-во каналов: 1
Тип прибора: Переносной
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: CL2
Взрывозащита: Нет
Подробнее
ЭССА-CL2 (БС)
Газоанализатор стационарный
Макс. кол-во каналов: 16
Тип прибора: Стационарный
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: CL2
Взрывозащита: Нет
Подробнее
ЭССА с радиоканалом
Газоанализатор
Макс. кол-во каналов: 16
кол-во каналов: 16
Тип прибора: Стационарный
Сенсор: Электрохимический, Термокаталитический
Цифровая индикация: Да
Измерение: O2, CO, SO2, h3S, CL2, NO, NO2, Nh4, O3
Взрывозащита: Нет
Подробнее
СЕАН
Газоанализатор индивидуальный
Макс. кол-во каналов: 1
Тип прибора: Переносной
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: O2, CO, SO2, h3S, CL2, NO2, Nh4
Взрывозащита: Нет
Подробнее
ХОББИТ-Т-CL2
Газоанализатор хлора
Макс. кол-во каналов: 16
Тип прибора: Стационарный
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: CL2
Взрывозащита: Да
Подробнее
ОКА-92МТ
Газоанализатор кислорода, токсичных и горючих газов
Макс. кол-во каналов: 16
Тип прибора: Стац. или переносной
Сенсор: Электрохимический, Термокаталитический
Цифровая индикация: Да
Измерение: O2, h3, CO, CO2, SO2, h3S, CL2, NO2, Nh4, HCL, Ch5, C3H8, C6h24, HF
Взрывозащита: Да
Подробнее
ОКА-92Т
Газоанализатор кислорода и токсичных газов
Макс. кол-во каналов: 16
кол-во каналов: 16
Тип прибора: Стац. или переносной
Сенсор: Электрохимический, Термокаталитический
Цифровая индикация: Да
Измерение: O2, CO, CO2, SO2, h3S, CL2, NO2, Nh4, HCL, HF
Взрывозащита: Да
Подробнее
ОКА-МТ
Газоанализатор токсичных и горючих газов
Макс. кол-во каналов: 16
Тип прибора: Стац. или переносной
Сенсор: Электрохимический, Термокаталитический
Цифровая индикация: Да
Измерение: h3, CO, CO2, SO2, h3S, CL2, NO2, Nh4, HCL, Ch5, C3H8, C6h24, HF
Взрывозащита: Да
Подробнее
ОКА-Т
Газоанализатор токсичных газов
Макс. кол-во каналов: 16
Тип прибора: Стац. или переносной
Сенсор: Термокаталитический
Цифровая индикация: Да
Измерение: CO, CO2, SO2, h3S, CL2, NO2, Nh4, HCL, HF
Взрывозащита: Да
Подробнее
БД CL2 для ФСТ-03В
Блок датчика на хлор
Макс. кол-во каналов: 1
Тип прибора: Стационарный
Сенсор: Электрохимический
Цифровая индикация: Нет
Измерение: CL2
Взрывозащита: Да
Подробнее
ИГС-98 Хмель-В
Портативный газоанализатор хлора
Макс. кол-во каналов: 1
кол-во каналов: 1
Тип прибора: Переносной
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: CL2
Взрывозащита: Да
Подробнее
ИГС-98 Хмель-СВ исп. 011
Стационарный газоанализатор хлора
Макс. кол-во каналов: 1
Тип прибора: Стационарный
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: CL2
Взрывозащита: Да
Подробнее
КОМЕТА-М
Переносной многокомпонентный газоанализатор
Макс. кол-во каналов: 5
Тип прибора: Переносной
Сенсор: Электрохимический, Термокаталитический, Оптический, Фотоионизационный
Цифровая индикация: Да
Измерение: O2, h3, CO, CO2, SO2, h3S, CL2, NO2, Nh4, HCL, Ch5, C3H8, C2H5OH, Ch4OH
Взрывозащита: Да
Подробнее
Gasbadge Pro
Газоанализатор
Макс. кол-во каналов: 1
Тип прибора: Переносной
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: O2, CO, SO2, h3S, CL2, NO2, Nh4, Ph4
Взрывозащита: Нет
Подробнее
Идентифицируйте соединение, окисляющееся в следующей реакции: h3S g +
Если вы видите это сообщение, это означает, что JavaScript отключен в вашем браузере , включите JS , чтобы это приложение заработало.
Получение изображения.
а. h3S(г) + Cl_2(г) дает 2HCl(г) + S(т)
More Related Question & Answers
3.0k LIKES
3.0k VIEWS
1.5k SHARES
3.0k LIKES
3.0k VIEWS
1.5k SHARES
3.0k LIKES
3.0k VIEWS
1.5 K Акции
3,0K Like
3,0K Просмотр
1,5K Акции
3.0K Like
3,0K Просмотр
1,5K Акции
3,0K IMPLAY
3,01K Виды
3,0K. k НРАВИТСЯ
3,0K Просмотр
1,5K Акции
3,0K, как
3,0K Просмотр
1,5K Акции
3,0K нравятся
3,0K.
1.5K Шарес
1,5K Акции
3,0K Like
3,0K просмотр
1,5K Акции
3,0K Like
3,0K Piews
1,5K Shares
3,0K Like
1,5K Shares
3,0K Like
9001K 3,000 3 900K.3.0k НРАВИТСЯ
3,0K Просмотр
1,5K Акции
3,0K нравятся
3,0K Просмотр
1,5K Акции
3,0K LIKE
3.0K VIEW
1,5K Акции
3,0K Like
3,0K Просмотры
1,5K Акции
3,0K любят
3,0K View
1,5K. , Doubtnut не владеет и не контролирует характер и содержание этих вопросов. Doubtnut не несет ответственности за какие-либо расхождения относительно дублирования контента по этим вопросам.
, Doubtnut не владеет и не контролирует характер и содержание этих вопросов. Doubtnut не несет ответственности за какие-либо расхождения относительно дублирования контента по этим вопросам.
h3S⋯Cl2 охарактеризован в предреакционной газовой смеси сероводорода и хлора методом ротационной спектроскопии: характер взаимодействия
H
2 S⋯Cl 2 охарактеризован в предреакционной газовой смеси сероводорода и хлора методом вращательной спектроскопии: природа взаимодействияЗДРАВСТВУЙ. Блуминк, С.Дж. Доллинг, К. Хиндс а также А. К. Легон
Аннотация
Вращательные спектры пяти изотопомеров (H 2 S⋯ 35 Cl 2 , H 2 S⋯ 35 Cl 37 Cl, H 2 S⋯ 37 Cl 35 Cl, HDS⋯ 35 Cl 2 and D 2 S⋯ 35 Cl 2 ) of a complex formed by сероводород и хлор наблюдались с помощью микроволнового спектрометра с преобразованием Фурье с импульсным соплом. Реакция H 2 S и Cl 2 было предотвращено за счет использования сопла быстрого смешивания. The rotational constant ½( B
Реакция H 2 S и Cl 2 было предотвращено за счет использования сопла быстрого смешивания. The rotational constant ½( B 
