Сероводород и оксид серы — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Сероводород.
Лавандой, ландышем, фиалкойИли простой еловой палкой
Пусть будет пахнуть – нам не жалко.
Но никогда не будет моды
На запах сероводорода!
«… Тогда услышал я (о, диво!) запах скверный,
Как будто тухлое разбилося яйцо»…
А. С. Пушкин
Состав. Строение сероводорода
h3S
+
+δ
─δ
H S
+δ
H
ковалентная полярная
молекулярная
Кристаллическая решетка:
Химическая связь:
3.
 Нахождение в природеСероводород входит в состав вулканических газов, а
Нахождение в природеСероводород входит в состав вулканических газов, атакже содержится в воде некоторых минеральных
источников. Сероводород образуется при гниении
серосодержащих остатков растительного и животного
происхождения.
4. Получение сероводорода
В промышленности сероводород получают как побочныйпродукт при очистке нефти, природного и коксового газов.
В лаборатории его получают взаимодействием соляной
или разбавленной серной кислот с сульфидами цинка или
железа.
Составьте уравнение реакции взаимодействия сульфида
цинка и соляной кислоты:
ZnS + 2HCl = ZnCl2 + h3S
ZnS + 2H+ + 2Cl¯ = Zn2+ + 2Cl¯ + h3S
ZnS + 2H+ = Zn2+ + h3S
Проверка:
H 2S
HS¯
H+ + HS¯
H+ + S2─
h3S + CuSO4 = CuS + h3SO4
Химические свойства
Какую степень окисления проявляет сера в сероводороде?
-2
Какие свойства характерны для соединений, в которых элемент
проявляет низшую степень окисления?
Сероводород – это сильный восстановитель.

Составьте уравнение реакции сгорания сероводорода в кислороде:
2h3S + 3O2 = 2SO2 + 2h3O (избыток кислорода)
2h3S + O2 = 2S + 2h3O
(недостаток кислорода)
опыт
Сероводород легко окисляется галогенами
, оксидом серы (IV),
хлоридом железа (III):
На воздухе сероводород окисляет
серебро, что и объясняет почернение
2h3S + SO2 = 2h3O + 3S
серебряных изделий, которое
h3S + 2FeCl3 + S + 2HCl
наблюдается со временем.
2h3S + 4Ag + O2 = 2Ag2S + 2h3O
Сульфиды металлов
Как двухосновная, сероводородная средние (сульфиды)
кислота образует два ряда солей – кислые (гидросульфиды)
Нерастворимые сульфиды
металлов окрашены в
различные цвета.
2KOH + h3S = K2S + 2h3O
KOH + h3S = KHS + h3O
Ag+
Zn2+
Pb2+
Mn2+ Bi
3+
Cu2+
Sn2+
Hg2+ Cd2+
S2- Ag2S
ZnS
PbS
MnS
Bi2S3
CuS
SnS
HgS
CdS
Как и сероводород и сульфиды являются сильными восстановителями
Составьте уравнения реакций горения сульфида меди (II), рассмотрите
с т.
 зр. ОВР.
зр. ОВР.2CuS-2 + 3O20 = 2CuO-2 + 2S+4O2
S-2 ─ 6e → S+4 6 2 CuS (за счет S-2)─восстановитель, пр. окисления
O20 +4e →2O-2 4 3 О2 – окислитель, пр.восстановления
Состав. строение оксида серы (IV)
δ+
S
SO2 O O
δ−
δ−
Степень окисления серы
+4
Валентность
IV
Химическая связь
Кристаллическая решетка
ковалентная полярная
молекулярная
Физические свойства
Это бесцветный газ с резким запахом,
вызывающим приступы удушья; t плавления = −75°С,
t кипения=−10°С; в 100 г воды при н.у. растворяется
7,89 л сернистого газа. Водный раствор SO2 –
сернистая кислота
Сернистый газ и экологические проблемы
облако водяного пара
Ооксид серы
(IV) SO
2
Часть SO2 реагирует с
SO2 выбрасывается
в атмосферу ТЭЦ и
промышленными
предприятиями
кислородом и влагой в
атмосфере образуя
серную кислоту
Серная
кислота
оказывает
агрессивное
Сера содержащаяся
воздействие на кирпичные и бетонные
в угле и нефти сгорает
строения; повреждаются растения; вода
с образованием SO2
открытых водоемов закисляется, рыба гибнет;
повышается кислотность почвы.

Экология нас учит: если кислый дождь из тучи, то природная
среда вся в опасности тогда.
Получение оксида серы (IV)
Какое вещество используется для получения оксида серы (IV)?
Как обнаружить продукт?
Имеет ли значение: кислород или воздух пропускают через трубку?
На что это влияет?
Укажите уравнение химической реакции.
S + O2 = SO2
Оксид серы (IV) или сернистый газ получают при горении
сероводорода, а также при обжиге сульфидов.
Составьте уравнения реакций данных способов получения
сернистого газа.
2h3S + 3O2 = 2SO2 + 2h3O
2CuS + 3O2 = 2SO2 + 2h3O
В лаборатории SO2 получают реакцией обмена
между сульфитом и раствором серной кислоты.
Составьте уравнения реакций данного способа получения
сернистого газа.
Na2SO3 + h3SO4 = SO2 + h3O + Na2SO4
Можно получить SO2 также взаимодействием
концентрированной серной кислоты с медью при
нагревании.
Составьте уравнения реакций данного способа получения
сернистого газа.

Cu + 2h3SO4 = SO2 + 2h3O + CuSO4
К какому типу оксидов относится оксид серы (IV)
Оксид серы (IV) солеобразующий кислотный оксид.
Перечислите свойства кислотных оксидов
Взаимодействие с водой (кроме SiO2), основными оксидами,
растворимыми основаниями
Составьте уравнения реакций оксида серы (IV) с водой, оксидом натрия,
гидроксидом калия.
SO2 + h3O ↔ h3SO3
SO2 + Na2O = Na2SO3
SO2 + KOH = K2SO3 + h3O
SO2 + KOH = KHSO3
Окислительно-восстановительные свойства оксида серы (IV)
Определите степень окисления серы
S
SO2
h3S
h3SO3
h3SO4
K2SO3
Na2SO4
0
+4
−2
+4
+6
+4
+6
Расположите полученные значения степени окисления серы
в порядке возрастания:
−2
низшая с.о.
0
+4
промежуточная с.о.
+6
высшая с.о.
Сравните полученные значения с номером группы,
в которой находится сера и друг с другом
Только восстановительные свойства проявляют элементы,
находящиеся в низшей степени окисления
Только окислительные свойства проявляют элементы,
находящиеся в высшей степени окисления
Элементы, находящиеся в промежуточной степени
окисления, могут проявлять как окислительные, так и
восстановительные свойства, т.
 к способны как к отдаче
к способны как к отдачеэлектронов, так и к приему электронов
Оксид серы (IV) может быть как окислителем, так и
восстановителем. Определите в каких реакциях SO2
является окислителем, а каких восстановителем?
SO2 + O2 → SO3
SO2 + h3O + Br2 → HBr + h3SO4
SO2 + HNO3 → h3SO4 + NO2
SO2 + C → S + CO2
SO2 + h3S → S + h3O
проверка
English Русский Правила
1. В химической реакции, протекающей по уравнению:
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г)
Тепловой эффект реакции (∆Нх.р.), исходя из следствия закона Гесса, равен сумме теплот образования ∆Нобр. продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
∆Нх.р.= ∑Нобр.прод. — ∑Нобр.исх.
∆Нх.р.= (2 ∆Н°Fe(к) +3∆Н°Н2О (г)) – (∆Н° Fe2O3(к) + 3 ∆Н°Н2г)
— теплоты образования простых веществ условно приняты равными нулю;
— теплота образования Н2О
(г) равна -241. 83 (по табл. №5)
83 (по табл. №5)
— теплота образования Fe2O3(к) равна -822.10 (см.табл.№5)
Исходя из указанных данных:
∆Нх.р.= 3(-241.83) – (-822.10) = -725.49 – (-822.10) = 96.61 кДж
Ответ: ∆Нх.р.= 96.61 кДж
Примечание: в условии задачи №113 (стр. 51 методических указаний) в праой части уравнения перед молекулой воды проставлен коэффициент 2, считаю, что коэффициент должен быть 3.
2. Изменение энтропии продуктов химической реакции, протекающей по уравнению
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г),
Рассчитывается по формуле:
∆Sх.р.= ∑Sпрод. — ∑Sисх.
∆Sх.р.= (2 ∆S°Fe(к) +3∆S°Н2О (г)) – (∆S° Fe2O3(к) + 3 ∆S°Н2г), где:
∆S°Fe(к)= 27.2 Дж/(моль*К)
∆S°Н2О (г))= 188.72 Дж/(моль*К)
∆S° Fe2O3(к) = 89.96 Дж/(моль*К)
∆S° O/h3(г)
= 130. 59 Дж/(моль*К)
59 Дж/(моль*К)
(данные из табл.7)
С учетом этих данных:
∆Sх.р.= (2*27.2 +3*188.72) – (89.96+3*130.59) = 620.56-481.73 = 138.83 Дж/(моль*К)
Ответ: ∆Sх.р.= 138.83 Дж/(моль*К)
3. Мерой химического сродства (∆G°) является убыль энергии Гиббса (изменение изобарно- термического потенциала или энергии Гиббса).
Убыль энергии Гиббса ∆G°х.р. в химической реакции
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г)
вычисляем по формуле:
∆G°х.р = ∆Н° — Т*∆S°
∆G°х.р = 96.61 – 298*0.13883 = 96.61-41.37 = +55.24кДж
Ответ: ∆G°х.р = +55.24кДж
Т.к. ∆G°х.р. > 0, то реакция при стандартных условиях невозможна; при этих условиях пойдет обратная реакция — окисление железа (коррозия).
Определяем температуру, при которой
∆G°х.р. =
0
=
0
∆Н = Т*∆S, отсюда Т = ∆Н/∆S = 96.61/0.13883 = 695.9°К,
отсюда находим убыль энергии при 500°К :
∆G500 =96.61-500*0.13883 кДж = +27.19 кДж
Таким образом, ∆G при температуре 500°К составляет +27.19 кДж,
т.е. ∆G > 0 и реакция невозможна.
При температуре 2000°К находим ∆G2000 аналогично:
∆G2000 = 96.61 – 2000*0.13883 = 96.61 -277.66 = — 181.кДж
∆G2000 = — 181.кДж
∆G2000 <0, значит при температуре 2000°К реакция возможна.
Примечание:
Поскольку изначальная температура, при которой начинается реакция по уравнению
Fe2O3(к)+3Н2(г) = 2Fe(к) + 3Н2О (г),
из вышеприведенных расчетов равна
695.9°К, то путем сравнения температур
можно сразу определить, что при температуре
500°К реакция не пойдет, а при температуре
выше 695.
Химическая кинетика и равновесие
Задача №139.
Почему при изменении давления смещается равновесие системы
N2 +3 H2 ↔2 NH3 и не смещается равновесие системы
N2 + O2↔ 2NO?
Ответ мотивируйте на основании расчета скорости прямой и братной скорости реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение.
Имеются два уравнения реакции
1). N2 +3 h3 ↔2 Nh4
2). N2
+ O2↔
2NO?
N2
+ O2↔
2NO?
В уравнении (1) обозначим концентрации реагирующих веществ:
[N2] = a; [h3] = b; [Nh4] = с
Согласно закону действующих масс, скорость прямой и обратной реакций до изменения давления равны
Vпр = Ка*b³ Vобр = К1*с²
Предположим, что давление гомогенной системы увеличилось в два раза, тогда концентрация каждого из реагирующих веществ увеличится в два раза:
[N2] = 2a; [h3] = 2b; [Nh4] = 2с
при новых концентрациях скорости прямой и обратной реакций равны:
V´пр = К(2а)*(2b)³ = 16Кab³ V´обр = К1*(2с)² = 4К1*с²
Отсюда:
V´пр/ Vпр = 16К*a*b³/ К*а*b³ = 16;
V´обр /Vобр = 4К1*с²/ К1*с² = 4.
Следовательно, скорость прямой реакции
увеличилась в 16 раз, а обратной только
в 4 раза.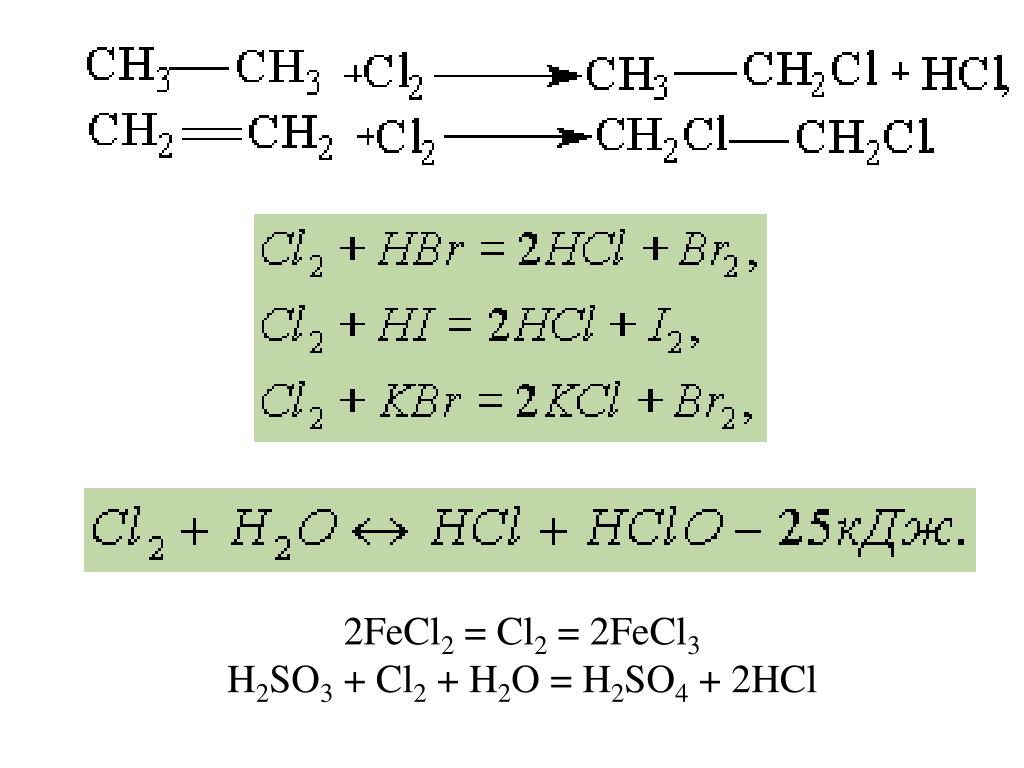 Равновесие системы сместилось
в сторону образования Nh4.
Равновесие системы сместилось
в сторону образования Nh4.
Теперь рассмотрим уравнение (2).
Обозначим концентрации реагирующих веществ:
[N2] = a; [О2] = b; [NО] = с
Тогда скорости прямой и обратной реакций будут равны
Vпр = Ка*b Vобр = К1*с²
При увеличении давления в два раза концентрации будут равны:
[N2] = 2a; [О2] = 2b; [NО] = 2с
а скорости прямой и обратной реакций:
V´пр = К(2а)*(2b) = 4Кab; V´обр = К1*(2с)² = 4К1с²
Отсюда:
V´пр/ Vпр = 4Кab/ Ка*b = 4
V´обр/ Vобр = 4К1с²/ К1*с² = 4.
Скорости прямой и обратной реакций изменились одинаково, т.е. в 4 раза. Равновесие системы не изменилось и реакция не идет.
При равновесии скорости прямой и обратной
реакции равны, а отношение констант
этих скоростей постоянно и называется
константой равновесия данной системы.
Для реакции по уравнению
N2(г) +3 h3(г) ↔2 Nh4(г)
Vпр = К[N2] [h3]³ Vобр = К1 [Nh4]²
Кравн = К/К1 = [Nh4]²/ [N2] [h3]³
Для реакции по уравнению:
N2(г) + O2(г)↔ 2NO(г)
Vпр = К[N2] [O2] Vобр = К1 [NO]²
Кравн = К/К1 =[NO]² /[N2] [O2].
Тема Концентрации
Задача №146
Сколько и какого вещества останется в избытке, если к 75см3 0.3н раствора серной кислоты прибавить 125см3 0.2н раствора KOH?
2KOH + h3 SO4= K2 SO4+ 2h3O
Вещества вступают во взаимодействие в количествах, обратно пропорциональных их концентрациям, при этом для этого уравнения будет действительно равенство:
Vк*Ск = Vщ*Cщ
Определим, какое количество 0,2н раствора
KOH израсходуется на
нейтрализацию 75см3 0. 3н раствора серной
кислоты.
3н раствора серной
кислоты.
Vк*Ск = Vщ*Cщ
Vщ= Vк*Ск / Cщ=75*0,3/0,2=112.5см3
Избыток KOH составляет
125 — 112.5 = 12.5см3 0,2н раствора KOH
Эквивалент KOH равна молярной массе, деленной на валентность металла.
Э = М/1 = 56г
Количество KOH в 12.5см3 0,2н раствора составляет
0.2*56/1000*12.5=0,14г KOH
Ответ: 0,14г KOH
Тема: Ионно-молекулярные (ионные) реакции обмена
Задача № 189
Какие из веществ KHCO3, CH3COOH, NiSO4, Na2S взаимодействуют с раствором H2 SO4?
Напишите молекулярные и ионно-молекулярные
уравнения этих реакций.
2KHCO3+ h3 SO4= K2 SO4+ h3O +CO2
2K+ 2HCO3¯ +2H+ + SO4¯² = 2K+ SO4¯²+h3O + CO2
2HCO3¯= h3O + CO2
Na2S + h3 SO4= Na2S O4 + h3S
2Na+ + S¯² +2H+ SO4¯² = 2Na + SO4¯²+ h3S
S¯² +2H= h3S
Ch4COOH+ h3 SO4= Ch4COO¯+H+ + 2H+ + SO4¯²
NiSO4+ h3 SO4= Ni+² + SO4¯²+2H+ + SO4¯²
Реакция с кислоты с кислотой и кислоты с солью, образованной от этой же кислоты не идет до конца, образуется равновесная система или смесь растворов.
Тема Свойства растворов
№167
Вычислите температуру кипения 5%ного раствора нафталина С10H8 в бензоле. Температура кипения бензола 80.2ºС. Эбулиоскопическая константа его 2.57ºС.
По закону Рауля повышение температуры кипения раствора по сравнению с температуры кипения растворителя выражается уравнением:
,где
∆Т – изменение температуры кипения раствора, ºС
К — эбулиоскопическая константа,ºС;
m — масса растворенного вещества, г;
m1- масса растворителя,г;
М — молярная масса растворенного вещества, г
М С10H8 = 12*10+ 1*8 = 128г
=
2. 57
=1.05ºС
57
=1.05ºС
Ткип = 80,2+1.05=81.25ºС.
Ответ: Температура кипения 5%ного раствора нафталина С10H8 в бензоле 81.25ºС.
Тема: Гидролиз солей.
Задача №209.
Какое значение PH (7 < pH<7) имеют растворы солей:
Na3PO4, K2S, CuSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Гидролиз – это химическое
взаимодействие ионов растворенной соли
с водой, приводящее к образованию
слабодиссоциирующих продуктов (молекул
слабых кислот или оснований, анионов
кислых или катионов основных солей) и
сопровождающееся изменением pH среды.
1.Na3PO4 это соль сильного основания (щелочи) NaOH и средней кислоты (фосфорной) h4PO4. Гидролиз соли идет по анионному типу, т.к. катион Na+, связываясь с гидроксил-анионом OH¯, образует сильный электролит NaOH, который диссоциирует на ионы.
Фосфорная трехосновная кислота образует три вида солей:
Nah3PO4 –первичный фосфат Na, хорошо растворимый
Na2HPO4 – вторичный фосфат Na, практически нерастворимый
Na3PO4- третичный фосфат Na, практически нерастворимый.
Из этого ясно, что при гидролизе Na3PO4, т.е. реакции, идущей до образования слабодиссоциирующей (плохорастворимой) соли, будет образовываться вторичный фосфат натрия Na2HPO4.
1 ступень
Ионно-молекулярное уравнение
PO4¯³ + h3O ↔ HPO4¯² + OH¯
Молекулярное уравнение:
Na3PO4 + h3O ↔ Na2HPO4 + NaOH
2 ступень
Ионно-молекулярное уравнение
Na2HPO4 + h3O↔ h3PO4¯² +OH¯
Молекулярное уравнение
Na2HPO4 + h3O↔ Nah3PO4 + NaOH
3 ступень
Ионно-молекулярное уравнение
h3PO4¯+ h3O = h4PO4 + OH¯
Молекулярное уравнение
Nah3PO4 + h3O = h4PO4 + NaOH
Обычно реакция идет по первой ступени,
далее накапливаются гидроксильные ионы
OH¯
и не дают реакции идти до конца.
Так как образуется кислая соль и сильное основание (щелочь), реакция раствора будет щелочная, т.е. pH>7.
2.Соль K2S, сульфид калия – это соль сильного основания и слабой фтористоводородной кислоты h3S. Гидролиз соли будет идти в две ступени, т.к. сероводородная кислота двухосновна, по анионному типу. Соль K2S при растворении в воде диссоциирует на катион К+ и сульфид-анион S¯². Катион К+ не может связать гидроксильный анион, т.к. при этом образуется сильный электролит KOH, который тут же диссоциирует на ионы, а сульфид-анион S¯² слабой кислоты связывается с гидроксильной группой в малодиссоциирующее соединение.
1 ступень
Ионно-молекулярное уравнение
S¯² + h3O = HS¯ + OH¯
Молекулярное уравнение
K2S + h3O = KHS + KOH
2 ступень
Ионно-молекулярное уравнение
HS¯ + h3O = h3S + OH¯
Молекулярное уравнение
KHS + h3O = h3S + KOH
Гидролиз протекает по первой ступени
с образованием сильнощелочной реакции,
pH>7.
3. CuSO4, сульфат меди – соль сильной кислоты и слабого многокислотного основания . Cu(OH)2 . Гидролиз соли будет идти с образованием катионов основной соли CuOH+.
1 ступень
Ионно-молекулярное уравнение
Cu+² + h3O↔ CuOH+ + H+
Молекулярное уравнение
CuSO4+ h3O ↔ (CuOH)2SO4 + h3SO4
По 2 ступени реакция не пойдет из-за образующегося избытка ионов водорода сильной серной кислоты. Среда имеет кислую реакцию, pH<7.
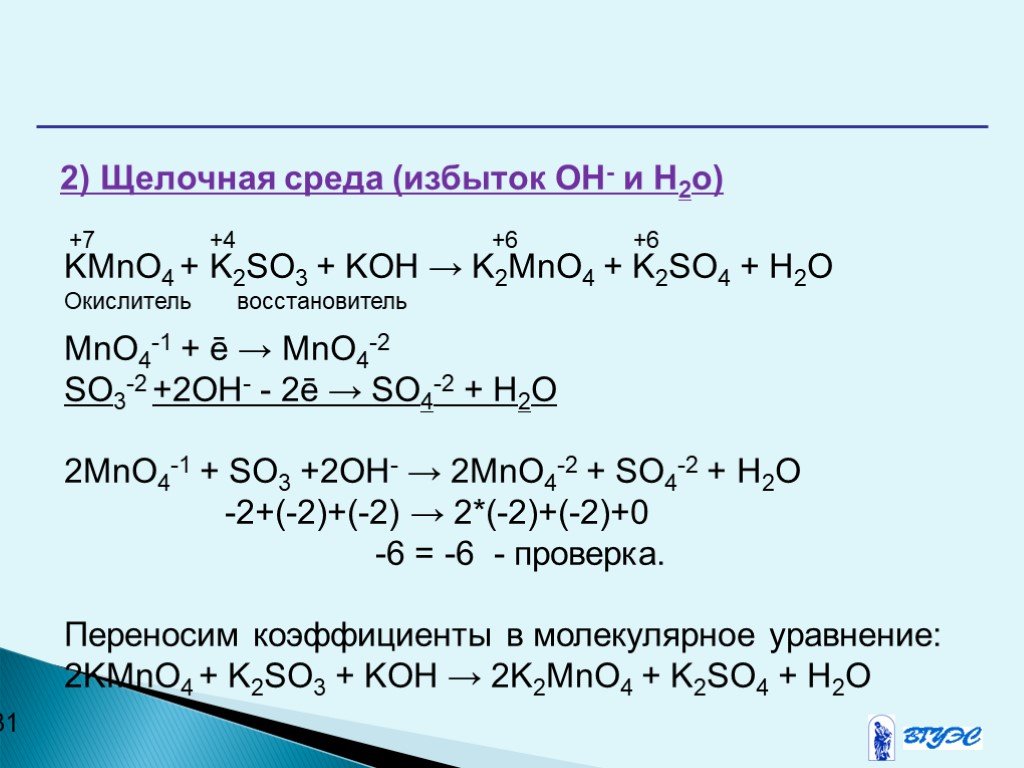
Тема: Окислительно-восстановительные реакции.
Задача №229.
Реакции выражаются схемами
H2S + Cl2 + H2O → H2SO4 + HCl
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4+ H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях
реакций. Для каждой реакции укажите,
какое вещество является окислителем,
какое – восстановителем; какое вещество
окисляется, какое – восстанавливается.
Расставьте коэффициенты в уравнениях
реакций. Для каждой реакции укажите,
какое вещество является окислителем,
какое – восстановителем; какое вещество
окисляется, какое – восстанавливается.
Реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. При этом одно вещество окисляется, другое восстанавливается, это процесс взаимосвязанный.
Под степенью окисления понимают условный заряд атома, который вычисляют, исходя из предположения, что молекула состоит только из ионов.
Степень окисления – это условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное количество электронов.
Окисление – процесс отдачи электронов атомом, молекулой или ионом.
Восстановление – процесс присоединения электронов атомом, молекулой или ионом.
Отдающий электрон – восстановитель, сам при этом окисляется,
Принимающий электрон- окислитель, сам
при этом восстанавливается.
Химия тиолов
Тиолы могут быть получены реакцией алкилгалогенида с КОН и избытком сероводорода.
ХИМИЯ ТИОЛОВ
Ключ Примечания ПодготовкаТиолы можно получить реакцией алкилгалогенида с KOH и избытком сульфид водорода. Образуется сероводородный анион, который претерпевает S N 2 реакция с алкилгалогенидом. Сероводород должен быть в избытке, чтобы чтобы ограничить дальнейшую реакцию на тиоэфир. Альтернативно, алкилгалогенид может обрабатывать тиомочевиной с образованием S -алкилизотиуроний соль, которую затем гидролизуют водным основанием с получением тиола. Дисульфиды могут быть восстановлены до тиолов цинком и кислотой.
СвойстваВодород связь слабая, что приводит к температурам кипения ниже, чем у сопоставимых спирты и аналогичные тиоэфирам.
Реакционная способность Тиолы
(RSH) содержат большой поляризуемый атом серы. Связь S–H слабее по сравнению с
спирты, что делает тиолы склонными к окислению. Ионы тиолата чрезвычайно хороши
нуклеофилы, будучи слабыми основаниями. Тиолы более сильные кислоты, чем спирты.
Связь S–H слабее по сравнению с
спирты, что делает тиолы склонными к окислению. Ионы тиолата чрезвычайно хороши
нуклеофилы, будучи слабыми основаниями. Тиолы более сильные кислоты, чем спирты.
Тиолы окисляются бромом или йодом с образованием дисульфидов. Лечение тиола с основание приводит к образованию тиолат-иона.
Подготовка
Тиолы могут быть получены обработкой алкилгалогениды с избытком КОН и сероводородом ( рис. 1а ). Препарат представляет собой реакцию S N 2 с участием образование аниона сероводорода (HS — ) как нуклеофил. А Проблема с этой реакцией заключается в возможности ионизации продукта и взаимодействие со второй молекулой алкилгалогенида с образованием тиоэфира (RSR) как побочный продукт. Чтобы избежать этого, обычно используют избыток сероводорода. проблема.
Проблема образования тиоэфира также может быть
можно избежать, используя альтернативную процедуру с использованием тиомочевины (, рис. 1b, ). Тиомочевина действует как
нуклеофил в S N 2 реакция с получением соли S -алкилизотиурония, которую затем гидролизуют водным раствором
основание для получения тиола.
1b, ). Тиомочевина действует как
нуклеофил в S N 2 реакция с получением соли S -алкилизотиурония, которую затем гидролизуют водным раствором
основание для получения тиола.
Тиолы также могут образовываться при восстановлении дисульфидов с цинком в присутствии кислоты ( рис. 1с ).
СвойстваТиолы образуют чрезвычайно слабые водородные связи – намного слабее, чем спирты, поэтому температуры кипения тиолов аналогичны к сопоставимым простым тиоэфирам и которые ниже, чем сопоставимые спирты. За например, этантиол кипит при 37°C тогда как этанол кипит при 78°C.
Низкомолекулярные тиолы печально известны наличие неприятных запахов.
Реакционная способность Тиолы являются сернистым эквивалентом спиртов
(РСХ). Атом серы больше и более поляризуем, чем кислород, что означает
что соединения серы в целом являются более мощными нуклеофилами, чем
соответствующие соединения кислорода. Ионы тиолата
(например, CH 3 CH 2 S — ) находятся
более сильные нуклеофилы и
более слабые основания, чем соответствующие алкоксиды (CH 3 СН 2 О — ). И наоборот, тиолы являются более сильными кислотами, чем соответствующие спирты.
И наоборот, тиолы являются более сильными кислотами, чем соответствующие спирты.
Относительная разница в размерах между серой и кислород также означает, что связывающие орбитали серы более размыты, чем орбитали кислорода. связывающие орбитали. Это приводит к худшему связывающему взаимодействию между серой и водородом, чем между кислородом и водородом. В результате связь S–H тиолов слабее, чем связь O–H спиртов (80 ккал моль -1 против. 100 ккал моль -1 ). Это, в свою очередь, означает, что связь S–H тиолов более склонны к окислению, чем связь O–H спиртов.
ДействияТиолы легко окисляются мягким окислением агенты, такие как бром или йод, для получения дисульфидов ( рис. 2 ).
Тиолы реагируют с основанием с образованием тиолат-ионов которые могут действовать как мощные нуклеофилы.
- Предыдущая страница
- Следующая страница
Учебный материал, Лекционные заметки, Задание, Справочник, Вики описание объяснение, краткое описание
Органическая химия: Спирты, фенолы и тиолы : Химия тиолов |
Сбалансируйте уравнение $KOH + {H_2}S{O_4} \\to {K_2}S{O_4} + {H_2}O$
Ответ
Проверено
137,1 тыс. + просмотров
+ просмотров
Подсказка: Химикат Уравнение — это символ химической реакции, в которой реагенты и продукты представлены их химическими формулами. Часть химического уравнения слева от знака «$ \to $» — это сторона реагента, а часть справа от символа стрелки — сторона продукта.
Полный ответ:
Данное химическое уравнение:
$KOH + {H_2}S{O_4} \to {K_2}S{O_4} + {H_2}O$
Сбалансированное уравнение:
$2KOH + {H_2 }S{O_4} \to {K_2}S{O_4} + 2{H_2}O$
В приведенной выше реакции гидроксид калия реагирует с серной кислотой с образованием сульфата калия и воды.
Реагентами являются гидроксид калия и серная кислота, а продуктами являются сульфат калия и вода.
Это реакция двойного смещения.
Реакции двойного замещения определяются как реакции, в которых два соединения реагируют путем обмена ионами с образованием двух новых молекул. Положительные ионы обмениваются партнерами с отрицательными ионами во время процессов двойного замещения. Между ионными химическими веществами, растворенными в воде, происходит множество процессов двойного вытеснения. Общее уравнение можно использовать для моделирования реакции двойного замещения.
Между ионными химическими веществами, растворенными в воде, происходит множество процессов двойного вытеснения. Общее уравнение можно использовать для моделирования реакции двойного замещения.
$AB + CD \to AD + BC$
Дополнительная информация:
Реакции нейтрализации и осаждения представляют собой два типа реакций двойного замещения. Применение реакций двойного замещения: 1) Кислотное расстройство желудка 2) Извлечение металла 3) Пламенная фотометрия. Когда два водных ионогенных соединения реагируют с образованием нового ионогенного соединения, не растворимого в воде, это называется реакцией осаждения. Между кислотой и основанием реакции нейтрализации представляют собой тип реакции двойного замещения.
Примечание:
Реагенты и продукты реакции двойного замещения обычно представляют собой ионные соединения, но они также могут быть кислотами или основаниями. Растворителем для реакции двойного замещения обычно является вода, а реагентами и продуктами обычно являются ионные соединения, но они также могут быть кислотами или основаниями.
