7 фактов о Naoh + h3so4: реакция нескольких элементов
Эта статья о naoh + h3so4 (реакционная смесь) и объясняет, как происходит реакция, образование продукта, уравновешивание и как проводить титрование данных смесей.
Гидроксид натрия реагирует с серной кислотой и имеет химическую формулу Наох+h3so4 получение продукта (NaSO4+h3O) сульфата натрия и воды. Это кислотно-щелочная реакция, и полученный продукт находится в форме соли и воды. Сульфат натрия – это соль (продукт реакции нейтрализации). Таким образом, когда кислота вступает в реакцию с основанием, происходит реакция нейтрализации, в результате которой высвобождаются молекулы соли и воды.
2NaOH + H2SO4 → На2SO4 + 2H2O
Что происходит при взаимодействии NaOH с h3so4?Когда NaOH реагирует с H2SO4происходит их образование солей, а также в качестве побочного продукта выделяются молекулы воды. Реакция выглядит следующим образом:
Реакция выглядит следующим образом:
NaOH + H2SO4 → На2SO4 + Н2O
Натриевая серно-натриевая вода
Сульфат гидроксида кислоты
Реагент представляет собой гидроксид натрия и серную кислоту с химической формулой NaOH и H2SO4. Это кислотно-щелочная реакция, которая называется реакция нейтрализации и происходит образование соли как продукта.
В ходе реакции нейтрализации основание нейтрализует кислоту с выделением тепла, поэтому реакция называется Экзотермическая реакция и происходит образование новой связи.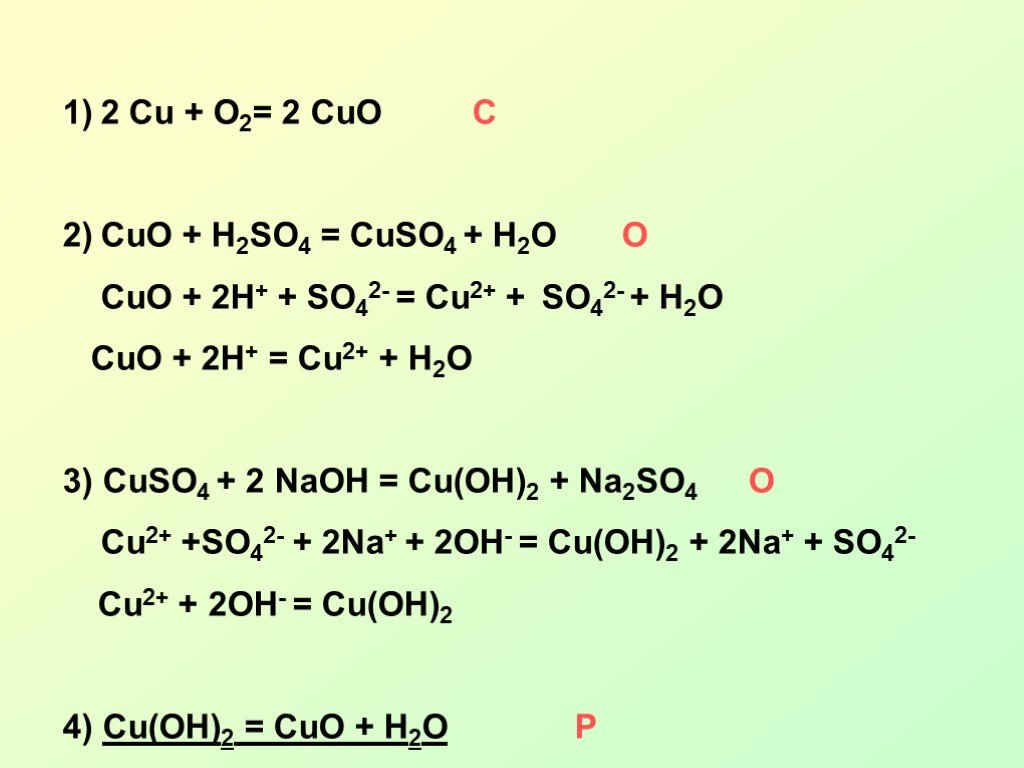
Рассмотрим реакцию между сильным основанием и сильной кислотой. Серная кислота — сильная кислота, гидроксид натрия — сильное основание.
Кислота + Основание→ Соль + вода (реакция нейтрализации), когда сильная кислота (H2SO 4) реагирует с сильным основанием (NaOH) наблюдается реакция нейтрализации.
H2SO4 + 2НаОН → На2SO4 + 2H2O
Это очень спонтанно и всегда их формирование из соли и воды. Как сильная кислота, H2SO4 производит ионы H+, которые атакуются OH- из NaOH, что приводит к образованию воды. Ионы Na+ образуют ионные связи с ионами сульфата с образованием Na2SO4 (соль).
Ионы Na+ образуют ионные связи с ионами сульфата с образованием Na2SO4 (соль).
Это также показывает реакции двойного смещения, это происходит, когда два соединения реагируют вместе, обмениваясь ионами, что приводит к образованию двух новых соединений. Положительные ионы обмениваются на отрицательные ионы в этих реакциях.
Как сбалансировать NaOH + h3so4?Процесс уравновешивания химических уравнений включает в себя согласование количества атомов в реагенте и продукте. Реагентами в этой реакции являются серная кислота, одна из самых сильных кислот, и гидроксид натрия, одно из самых сильных оснований.
Конечными продуктами являются соль и вода. Эта реакция известна как реакция нейтрализации.
Ниже приводится уравнение реакции:
NaOH + H2SO4→ На2SO4 + H2O
Составьте таблицу для сравнения номеров. реагента и продукта в обеих частях уравнения.
реагента и продукта в обеих частях уравнения.
| Атомы присутствуют в молекулах, которые участвуют в реакциях. | В Реагенте | В продукте |
|---|---|---|
| Na | 1 | 2 |
| O | 5 | 5 |
| H | 3 | 2 |
| S | 1 | 1 |
Чтобы уравнять Na и H, мы начнем с Na и используем 2 в качестве коэффициента для NaOH.
H2SO4 + 2NaOH → На2SO4 + H2O
Теперь, когда на стороне реагента 4 атома H, используйте 2 в качестве значения коэффициента для H. 2ОЙ2SO4 + 2NaOH → Na2SO4 + 2H2O.
2ОЙ2SO4 + 2NaOH → Na2SO4 + 2H2O.
Уравнение теперь является сбалансированным химическим уравнением.
2NaOH + H2SO4→ На2SO4 + 2H2O
Является ли Naoh + h3so4 полной реакцией?Да, это полная реакция, NaOH + H2SO4→ На2SO4 + Hб>2. Реагенты: серная кислота, одна из сильнейших кислот, гидроксид натрия, одно из сильнейших оснований, и сульфат натрия растворимая соль.
Naoh+h3so4=na2so4+h3oЭто кислотно-щелочная реакция, и ниже приведены меры этой реакции.
A. Какой тип реакции вступает в реакцию naoh+h3so4?Naoh+h3so4 является кислотно-щелочной реакцией нейтрализации, она также показывает реакцию двойного замещения.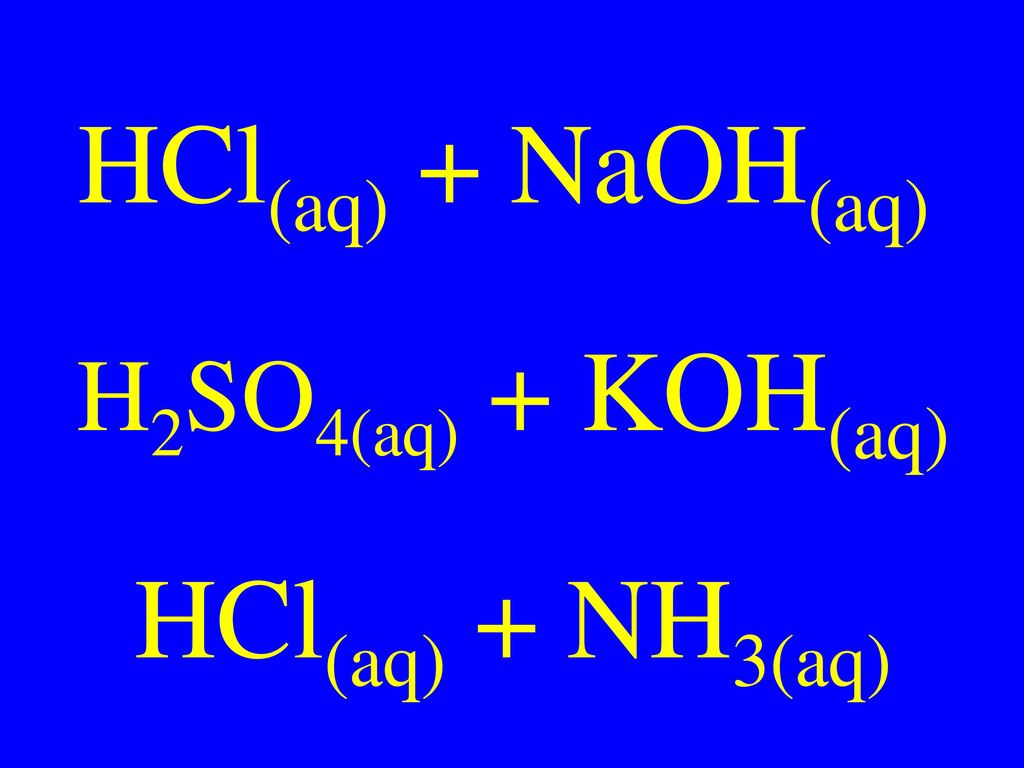
NaOH реагирует с h3so4 и дает продукт сульфат натрия и молекулы воды.
NaOH + H2SO4→ На2SO4 + H2O
C. Шаги по балансировке химического уравнения- Вот как написать несбалансированное уравнение. Химические формулы реагентов указаны слева. Пример: NaOH + H.2SO4→ На2SO4 + H2О, NaOH + H2SO4(реагент).
- Справа есть список продуктов. На2SO4 + H2О (Продукты)
- Используя закон сохранения массы, мы можем создать одинаковые атомы в обеих частях химического уравнения и сбалансировать элемент, присутствующий в одном реагенте и продукте.
Атомы присутствуют в молекулах, которые участвуют в реакциях. | В Реагенте | В продукте |
| Na | 1 | 2 |
| O | 5 | 5 |
| H | 3 | 2 |
| S | 1 | 1 |
- Продолжайте, пока все элементы не будут сбалансированы после того, как один из них будет сбалансирован. В результате мы начнем с Na, а затем используем 2 в качестве коэффициента NaOH, чтобы сбалансировать Na и H.

- H2SO4 + 2NaOH → Na2SO4 + H2O
- Теперь, когда на стороне реагента 4 атома H, используйте 2 в качестве значения коэффициента для H.2O.
- H2SO4 + 2NaOH → Na2SO4 + 2H2O (сбалансированное химическое уравнение).
Используя ионное уравнение, мы можем найти зрительские ионы путем расщепления каждой молекулы реагента и продукта.
Ниже приведены шаги для написания ионного уравнения Net:
1. Запишите молекулярное уравнение в сбалансированной форме.H2SO4 + 2NaOH → Na2SO4 + 2H2O.
2. Назначьте состояние (твердое (твердое), жидкое (ж), газообразное (г) и водное (водное) состояние) для каждого вещества.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
(водн.) (водн.) (водн.) (л)
3. Разделить каждый ион в его ионной форме.H2SO4 → 2ч+ + (SO4)2-
NaOH → Na+ + (ОН)–
Na2SO4 → 2На+ + (SO4)2-
2H+ + (SO4)2- + 2На+ + 2(ОН)– → 2На+ +(SO4)2-+ 2Н2О
4. Теперь найдены ионы-зрителиТеперь нашли ионы-наблюдатели и удалили их. Мы видим, что Na+ и(SO4)2-появляются в обеих частях уравнения, и их можно удалить.
5. Напишите суммарное ионное уравнение.2H+ + 2 (ОН)– → 2ч2O
Поскольку чистое ионное уравнение 2H+ + 2(ОН)– → 2ч2O.
NaOH (гидроксид натрия) + H2SO4(Серная кислота) = NaHSO4(гидросульфат натрия) +H2O (Вода) представляет собой кислотно-щелочную реакцию, которая называется реакцией нейтрализации. Это ионная реакция.
A. Какой тип реакции Naoh+h3so4?Это реакция нейтрализации и также показывает ионное уравнение. Мы можем рассчитать ионную реакцию следующим образом:
Na+ + (ОН)– + 2H+ + (SO4)2-→ Na+ + HSO4– + H2O
Чистое ионное уравнение
(ОЙ)– + 2H+ + (SO4)2- = HSO4– + H2O
Ионы зрителей: Na+.
Б. Что является продуктом этой реакции?NaOH + h3SO4 = NaHSO4 + H2O
Гидросульфат натрия – продукт, получаемый при взаимодействии гидроксида натрия с серной кислотой.
Это тоже кислотно-щелочная реакция, или мы назвали ее реакцией нейтрализации и реакцией двойного замещения.
C. Список шагов для балансировки химического уравнения- Вот как написать несбалансированное уравнение. Слева указаны химические формулы реагентов. Пример: NaOH + H2SO4→ NaHSO4 + H2О, NaOH + H2SO4(реагент).
- Справа есть список продуктов. NaHSO4 + H2О (Продукты).
- Используя закон сохранения массы, мы можем создать одинаковые атомы в обеих частях химического уравнения и сбалансировать элемент, присутствующий в одном реагенте и продукте.
| Атомы присутствуют в молекулах, которые участвуют в реакциях. | В Реагенте | В продукте |
| Na | 1 | 1 |
| O | 5 | 5 |
| H | 3 | 3 |
| S | 1 | 1 |
- Продолжайте, пока все элементы не будут сбалансированы.
 Таким образом, все элементы сбалансированы должным образом.
Таким образом, все элементы сбалансированы должным образом.
Метод кислотно-щелочного титрования используется для определения концентрации (молярность неизвестна) кислоты или основания путем нейтрализации их основанием или кислотой с известной концентрацией (молярность).
Возьмем пример NaOH + H2SO4 титрование для определения концентрации NaOH или H2SO4.
Таким образом, общая сбалансированная химическая нейтрализованная реакция имеет вид: H2SO4+ 2NaOH → Na2SO4 + 2H2O
Этапы, используемые при титровании:
Индикатор титрования NaOH + h3so4Во время NaOH + H2SO4 титрования, мы должны использовать фенолфталеин в качестве индикатора для кислотно-щелочного титрования.
Расчеты титрования NaOH + h3so4Давайте рассчитаем молярность или концентрацию H2SO4 решение. Общее уравнение для расчета молярности данного раствора:
Общее уравнение для расчета молярности данного раствора:
М1В1 = М2В2
- где M1 (молярность H2SO4 знак равно
- M2 (молярность NaOH) = xмоль/л
- V1 ( объем H2SO4) = у мл
- V2 (объем NaOH) = z мл
М1=М2В2/В1,
Во-первых, мы вычисляем количество молей NaOH = M × L = xmol / L × y мл. =Nмоль NaOH.
N моль NaOH×1 моль H2SO4/ 2 моль NaOH = Y моль H2SO4, М1=УМ
M1 = YM ( молярность H2SO4).
Эксперимент по титрованию NaOH + h3so4Используемый аппарат: Резиновая трубка присоединена к шприцу-пипетке-бюретке, мензурке вместимостью 1–250 мл, мензуркам 3–100 мл, зажиму бюретки и подставке для консистентной смазки. Каждый стакан должен быть абсолютно сухим и чистым.
Один стакан на 100 мл должен быть помечен для кислоты, один для основания и один для промывки.
- Внесите в колбу на 250 мл аликвоту раствора серной кислоты.
- Разбавьте примерно до 100 мл дистиллированной водой.
- Добавьте в смесь пару капель раствора фенолфталеина.
- Титруйте раствором NaOH до тех пор, пока цвет не изменится в первый раз.
- Повторите эксперимент 3-4 раза для получения показания.
S-образная кривая получается при титровании сильной кислоты сильным основанием. Кривая асимметрична, поскольку раствор становится более разбавленным по мере того, как объем раствора постоянно увеличивается во время титрования.
Таким образом, Naoh+ h3so4 имеет S-образную кривую.
Кривая титрования NaOH + h3so4Цвет титрования NaOH + h3so4Цвет титрования NaOH + h3so4 – розовый раствор после конечной точки.
Количество добавленного титранта как раз достаточно для полной нейтрализации раствора анализируемого вещества на данном этапе титрования.. При кислотно-основном титровании количество молей основания равно количеству молей кислоты, и в точке эквивалентности раствор содержит только соль и воду.
Таким образом моль NaOH = моль H2SO4, а точка эквивалентности получается при pH = 7.
ЗаключениеСогласно уравнению реакции, H2SO4 + 2NaOH → Na2SO4 + 2H2O
Соотношение серной кислоты и гидроксида натрия составляет 1:2. Это означает, что количество используемых молей серной кислоты вдвое меньше, чем у гидроксида натрия.
Узнайте больше фактов о h3SO4:
| h3SO4 + KClO3 h3SO4 + NaH h3SO4 + NaOCl h3SO4 + K2S h3SO4 + MnO2 h3SO4 + HCOOH h3SO4 + Mn2O7 h3SO4 + Мг h3SO4 + Na2CO3 h3SO4 + Sr(NO3)2 h3SO4 + MnS h3SO4 + NaHSO3 h3SO4 + CaCO3 h3SO4 + Ch4COONa h3SO4 + Sn h3SO4 + Al2O3 h3SO4 + SO3 Н2SO4 + Н2О h3SO4 + Fe2S3 | h3SO4 + КОН h3SO4 + Ch4Ch3OH h3SO4 + Li2O h3SO4 + K2Cr2O7 h3SO4 + NaOH h3SO4+ Ag h3SO4 + Mn3O4 h3SO4 + Nah3PO4 h3SO4 + Sr h3SO4 + цинк h3SO4-HG2(NO3)2 h3SO4 + Pb(NO3)2 h3SO4 + Na h3SO4 + Ag2S h3SO4 + BaCO3 h3SO4 + PbCO3 h3SO4 + Sr(OH)2 h3SO4+Mg3N2 h3SO4 + LiOH | h3SO4 + Fe(OH)3 h3SO4 + Al(OH)3 h3SO4 + NaI h3SO4 + K2CO3 h3SO4 + NaNO3 h3SO4 + CuO h3SO4 + Fe2O3 h3SO4 + AgNO3 h3SO4 + Al h3SO4 + K2SO4 h3SO4-HGO h3SO4 + Ва h3SO4 + MnCO3 h3SO4 + K2SO3 h3SO4 + PbCl2 h3SO4 + P4O10 h3SO4 + NaHCO3 h3SO4 + О3 h3SO4 + Ca(OH)2 | h3SO4 + KMnO4 h3SO4 + Ch4Nh3 h3SO4 + Ch4COOH h3SO4 + Pb h3SO4 + Ch4OH h3SO4 + Fe2(CO3)3 h3SO4 + Li2CO3 h3SO4 + MgO h3SO4 + Na2O h3SO4 + F2 h3SO4 + Zn(NO3)2 h3SO4 + Са Н2SO4 + К2О h3SO4 + Mg(OH)2 h3SO4 + Sb2S3 h3SO4 + Nh5NO3 h3SO4 + AlBr3 h3SO4 + CsOH h3SO4 + CuS | h3SO4 + Fe h3SO4 + HCOONa h3SO4 + Cu h3SO4 + PbS h3SO4 + P2O5 h3SO4 + CuCO3 h3SO4 + литий h3SO4 + K2CrO4 h3SO4 + NaCl h3SO4 + Ag2O h3SO4+Mg2Si h3SO4 + Mn(OH)2 h3SO4+ НАКЛО2 h3SO4 + К h3SO4 + Li2S h3SO4 + SrCO3 h3SO4 + h3O2 h3SO4 + Nh5OH |
Закончите реакции.
 1.naoh+h3so4=2.fe(oh)2+h3so4=3.ca+hcl=4.fe2o3+h3so4=5ba(oh)2+h4po4= — Школьные Знания.net
1.naoh+h3so4=2.fe(oh)2+h3so4=3.ca+hcl=4.fe2o3+h3so4=5ba(oh)2+h4po4= — Школьные Знания.netВсе предметы
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Информатика
Українська література
Қазақ тiлi
Экономика
Музыка
Беларуская мова
Французский язык
Немецкий язык
Психология
Оʻzbek tili
Кыргыз тили
Астрономия
Физкультура и спорт
1. NaOH+h3SO4=
NaOH+h3SO4=
2.Fe(OH)2+h3SO4=
3.Ca+HCl=
4.Fe2O3+h3SO4=
5Ba(OH)2+h4PO4=
Ответ дан
svetka1574
Ответ:
Объяснение:
1)2NaOH + h3SO4 = Na2SO4 + 2h3O
Fe(OH)2 + h3SO4 = FeSO4 + 2h3O
Ca + 2HCl = CaCl2 + h3
Fe2O3 + 3h3SO4 = Fe2(SO4)3 + 3h3O
3Ba(OH)2 + 2h4PO4 = Ba3(PO4)2 + 6h3O
80 г Х г
2) 2NaOH + h3SO4 = Na2SO4 + 2h3O
n=2 моль n=1 моль
М=40 г/моль М = 142 г/моль
m= 80 г m=142 г
80 г NaOH — Х г Na2SO4
80 г NaOH — 142 г Na2SO4
m(Na2SO4) = 80 * 142 / 80 = 142 г
Ответ дан
rodionvlasov2lolop
Ответ:
1) 2NaOH + H₂SO₄ = Na₂SO₄ + 2H₂O
2) Fe(OH)₂ + H₂SO₄ = FeSO₄ + 2H₂O
3) Ca + 2HCl = CaCl₂ + H₂
4) Fe₂O₃ + 3H₂SO₄= Fe₂(SO₄)₃ + 3H₂O
5) 3Ba(OH)₂+ 2H₃PO₄ = Ba₃(PO₄)₂ + 6H₂O
В реакции $2NaOH + {H_2}S{O_4} \to 2{H_2}O + N{a_2}S{O_4}$ сколько граммов сульфата натрия образуется, если начать с 200,0 граммов гидроксида натрия а у вас избыток серной кислоты?
Ответить
Проверено
212,1 тыс. + просмотров
+ просмотров
Подсказка: Чтобы определить массу сульфата натрия, сначала найдите молярное соотношение. В этом вопросе два моля гидроксида натрия образуют один моль сульфата натрия. Моли можно рассчитать, разделив массу на молекулярную массу.
Полный пошаговый ответ:
В вопросе указано, что 200,0 г едкого натра реагирует с избытком серной кислоты.
Данная реакция показана ниже.
$2NaOH + {H_2}S{O_4} \to 2{H_2}O + N{a_2}S{O_4}$
В этой реакции два моля гидроксида натрия реагируют с одним молем серной кислоты с образованием двух молей воды и один моль сульфата натрия.
Чтобы определить массу сульфата натрия, сначала рассчитайте количество молей гидроксида натрия, так как указано значение массы.
Молекулярная масса NaOH составляет 40 г/моль.
Формула показана ниже.
$n = \dfrac{m}{M}$
Где
n — количество молей
m — масса
M — молекулярная масса
Чтобы рассчитать количество молей, подставьте значения в приведенное выше уравнение.
$ \Rightarrow n = \dfrac{{200.0}}{{40г/моль}}$
$ \Rightarrow n = 5$
В уравнении указано, что 2 моля гидроксида натрия дают 1 моль сульфата натрия.
Итак, для определения фактического моля сульфата натрия разделите расчетное количество молей NaOH на 2.
$ \Rightarrow \dfrac{5}{2}$
$ \Rightarrow 2,5$моль
Итак, из 5 моль NaOH образуется 2,5 моль сульфата натрия.
Молекулярная масса сульфата натрия составляет 142,1 г/моль.
Для расчета массы сульфата натрия подставьте значения в формулу.
$ \Rightarrow 2,5 = \dfrac{m}{{142,1 г/моль}}$
$ \Rightarrow m = 2,5 \times 142,1$
$ \Rightarrow m = 355,25$
Следовательно, масса сульфата натрия образовалась, когда мы начните с 200,0 граммов гидроксида натрия, и у вас избыток серной кислоты составит 355,25 грамм.
Примечание:
В этом вопросе серная кислота является избыточным реагентом, а гидроксид натрия является лимитирующим реагентом. Избыточными реагентами являются те реагенты, которые полностью расходуются в ходе реакции, а лимитирующими реагентами являются те реагенты, которые полностью расходуются в ходе химической реакции.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды Кальций класса 12 химии JEE_Main
В Индии по случаю бракосочетания фейерверк класса 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды A Кальций класса 12, химия JEE_Main
Тенденции сомнений
Уравнение дано h3SO4+2NaOH —> Na2SO4+2h3O; какой объем 3,00 М серной кислоты потребуется для нейтрализации и растворения 2,5 кг твердого натрия.
 .. Цитата страницы
Начать эссе
значок-вопрос
Спросите репетитора
.. Цитата страницы
Начать эссе
значок-вопрос
Спросите репетитораНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой ДелитьсяСсылайтесь на эту страницу следующим образом:
«Данное уравнение h3SO4+2NaOH —> Na2SO4+2h3O; какой объем 3,00 М серной кислоты потребуется для нейтрализации и растворения 2,5 кг твердого гидроксида натрия? » eNotes Editorial , 19 апреля 2012 г., https://www.enotes.com/homework-help/equation-given-h3so4-2naoh-gt-na2so4-2h3o-what-331637. По состоянию на 25 декабря 2022 г.
Первое, что нужно сделать, это убедиться, что у нас есть сбалансированное химическое уравнение, которое было дано в задаче. Это кислотно-щелочная реакция, но это все еще просто проблема стехиометрии, поскольку нам нужно беспокоиться о молях каждого вещества.
Поскольку нам известна масса NaOH, мы можем найти количество молей NaOH. Как только мы узнаем количество молей, мы можем использовать молярное отношение из сбалансированного химического уравнения, чтобы увидеть, что на каждый 1 моль h3SO4 нам потребуется 2 моля NaOH.
Мы можем настроить наш расчет, обращая особое внимание на единицы измерения, чтобы убедиться, что они сокращаются, и мы получаем объем. Помните, что молярность (М) — это количество молей растворенного вещества на литр раствора. Переписав как моль/л, мы увидим, как нам нужно использовать его в уравнении.
2,5 кг NaOH(1000 г/1 кг)(1 моль NaOH/40 г)(1 моль h3SO4/2 моль NaOH)(1 л/3,00 моль h3SO4) объем и что проблема просит.
Ответ: 10,4 л h3SO4
Утверждено редакцией eNotes
Химия
Последний ответ опубликован 12 октября 2015 г.


 Таким образом, все элементы сбалансированы должным образом.
Таким образом, все элементы сбалансированы должным образом.