Соли. CaSO4 — Сульфат кальция
Нажмите для полного просмотра!
Вы можете ознакомиться и скачать презентацию на тему Соли. CaSO4 — Сульфат кальция. Доклад-сообщение содержит 7 слайдов. Презентации для любого класса можно скачать бесплатно. Если материал и наш сайт презентаций Mypresentation Вам понравились – поделитесь им с друзьями с помощью социальных кнопок и добавьте в закладки в своем браузере.
Слайды и текст этой презентации
Слайд 1
Описание слайда:
Сообщение на тему – Соли «CaSO4-Сульфат кальция» Яковлева Анастасия 9П-11
Слайд 2
История:
Природные соединения кальция (мел, мрамор, известняк, гипс) и продукты их простейшей переработки (известь) были известны людям с древних времен. В 1808 г. английский химик Хэмфри Дэви подверг электролизу влажную гашеную известь (гидроксид кальция) с ртутным катодом и получил амальгаму кальция (сплав кальция с ртутью). Из этого сплава, отогнав ртуть Дэви получил чистый кальций.
Он же предложил название нового химического элемента, от латинского «сalx» обозначавшего название известняка, мела и других мягких камней.
В 1808 г. английский химик Хэмфри Дэви подверг электролизу влажную гашеную известь (гидроксид кальция) с ртутным катодом и получил амальгаму кальция (сплав кальция с ртутью). Из этого сплава, отогнав ртуть Дэви получил чистый кальций.
Он же предложил название нового химического элемента, от латинского «сalx» обозначавшего название известняка, мела и других мягких камней.
Слайд 3
Описание слайда:
Физические свойства:
Сульфат кальция, известный как пищевая добавка под номером Е516, представляет собой ромбовидные кристаллы, не обладающие цветом. Это кальциевая соль серной кислоты. Чаще всего в природных условиях находится в виде дигидрата. Однако под воздействием высоких температур существует в виде кубических стабильных модификаций. В безводном состоянии представлен минералом ингридритом, который образуется в толщах осадка в результате обезвоживания отложений гипса естественным путем.
Слайд 4
Описание слайда:
Химические свойства: При плавлении разлагается (tпл = 1450˚С). Растворимость CaSO4 повышается в присутствии MgCl2, NaCl, HNO3, HCl. Реагирует с концентрированной серной кислотой, восстанавливается углеродом при спекании. 2CaSO4 = 2CaO + 2SO2 + h3O t > 1450˚С CaSO4 + h3SO4 (конц) = Ca(HSO4)2 CaSO4 +3C = CaS + 2CO + CO2 t = 900˚С CaSO4 +4CO = CaS + 4CO2 t = 600-800˚С CaSO4 + Na2CO3 = CaCO3 ↓+Na2SO4 CaSO4 2h3O = CaSO4 0,5h3O + 1,5h3O t = 150-170˚С CaSO4 0,5h3O = CaSO4 + 0,5h3O t = 225±5˚С
Слайд 5
Описание слайда:
Получение: 1) CaO + h3SO4 = CaSO4 + h3O 2) Ca + h3SO4 = CaSO4 + h3 3) Ca(OH)2 + h3SO4 = CaSO4 + 2h3O 4) CaCl2 + Na2SO4 = CaSO4 + 2NaCl 5) CaO + SO3 = CaSO4
Слайд 6
Описание слайда:
Применение:
Минерал, состоящий из дигидрата сульфата кальция (гипса) имеет длительную историю своего применения: первые упоминания относительно использования вещества датируются 1961 годом в области клинического применения.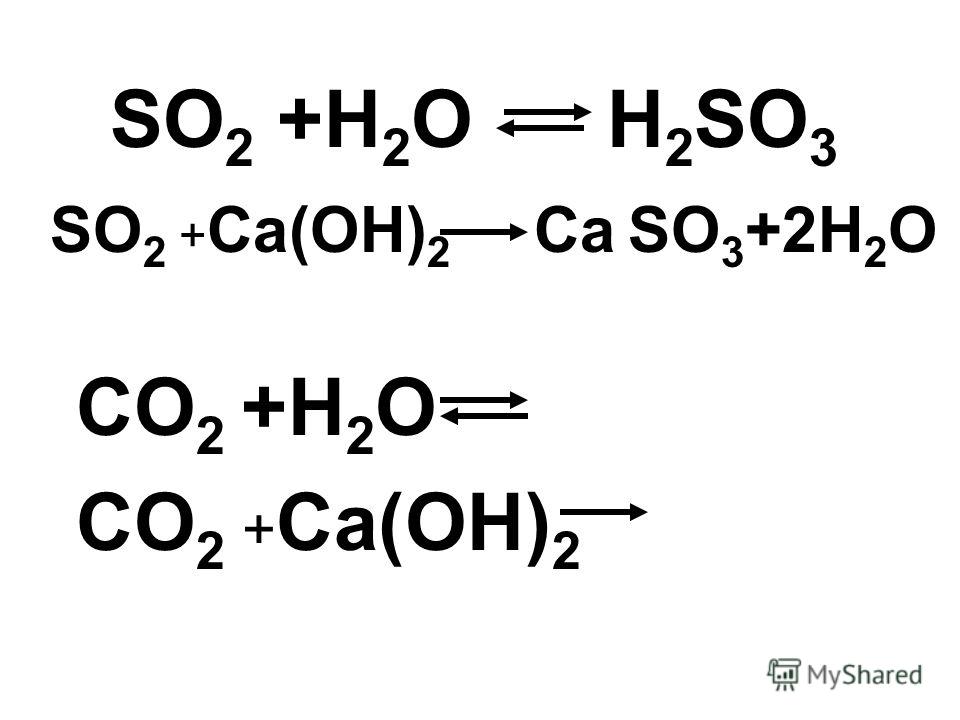
Слайд 7
Описание слайда:
Спасибо за просмотр
Теги Соли. CaSO4 — Сульфат кальция
Похожие презентации
Презентация успешно отправлена!
Ошибка! Введите корректный Email!
ДАЮ 35+35+ Реакция ✅ обмена CaO + h3SO4 = CaSO4 + h3O CaCO3 = CaO + CO2 Ca + S = CaS CaO + CO2 = CaCO3 Выберите два исходных вещества, взаимодействию которых
Выбери предметМатематикаЛитератураАлгебраРусский языкГеометрияАнглийский языкХимияФизикаБиологияДругие предметыИсторияОбществознаниеОкружающий мирГеографияУкраїнська моваИнформатикаУкраїнська літератураҚазақ тiлiЭкономикаМузыкаПравоБеларуская моваФранцузский языкНемецкий языкМХКОБЖПсихология
Химия, 14. 05.2021 21:52, Gggmim
05.2021 21:52, Gggmim
CaO + h3SO4 = CaSO4 + h3O
CaCO3 = CaO + CO2
Ca + S = CaS
CaO + CO2 = CaCO3
Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Ca2+ + SO32- = CaSO3 ↓
CaCl2
K2SO3
h3SO3
Ca
CaO
Сокращённое ионное уравнение
Nh5+ + OH- = Nh4 + h3O
соответствует взаимодействию
аммиака с водой
сульфата аммония с гидроксидом калия
хлорида аммония с гидроксидом цинка
нитрата аммония с гидроксидом натрия
нитрата аммония с водой
Осадок не образуется при взаимодействии водных растворов
CuSO4 и KOH
HCl и NaOH
MgSO4 и Ba(NO3)2
h3SO4 и KOH
Na2CO3 и CaCl2
Вода образуется в реакции ионного обмена при взаимодействии
HCl и Ca(OH)2
h3SO4 и Ba(OH)2
K2CO3 и CaCl2
Na2CO3 и Ba(OH)2
CuSO4 и Ba(OH)2
Для растворения гидроксида железа (II) можно использовать растворы
NaOH
BaCl2
NaNO3
HCl
h3SO4
Для реакции
CaCl2 + h3SiO3 = CaSiO3 +2HCl
подходит сокращённое ионное уравнение:
Ca+2 + h3SiO3 = CaSiO3 + 2H+
2H+ + SiO3-2 = h3SiO3
Ca+2 + 2Cl- + SiO3 = CaSiO3 + 2Cl-
Ca+2 + SiO3-2 = CaSiO3
Сумма коэффициентов в полном ионном и сокращённом ионном уравнении между гидроксидом бария и йодоводородной кислотой равны соответственно:
6
10
12
3
2
Установите соответствия между веществами и призн
Всего ответов: 3
Открыть ответы
Похожие вопросы
Химия, 11. 03.2019 07:20, ХАМЕЧОКЕ2036
03.2019 07:20, ХАМЕЧОКЕ2036
Краствору, содержащему 12,6 г соляной кислоты, добавим раствор, содержащий 7,2 г гидроксида калия. сколько гидроксида калия по массе потребуется для полной нетрализации.
Ответов: 3
Посмотреть ответ
Химия, 12.03.2019 09:50, Ульяна2732
Найдите n и v серной кислоты,если известно что для ее получения использовали 30 л воды
Ответов: 2
Посмотреть ответ
Химия, 13.03.2019 08:10, Майнур1234567890
Составьте уравнение реакции по ее схеме. ca(oh)2 + hno3 -> ca(no3)2 + h3o
Ответов: 2
Посмотреть ответ
Химия, 13.03.2019 20:11, osmyhinaozd6ev
Есть рассол натрия хлористого 20процентного.добавили кальция хлористого содержание кальция иона 200 .также добавили соляной кислоты до рн 5.выпал белый осадок.вопрос почему?
Ответов: 3
Посмотреть ответ
Химия, 14.03.2019 08:56, могистер3271
Определите простейшую формулу соединения, содержащего, по данным анализа, 54,5% углерода, 9,1% кислорода и имеет относительную плотность по воздуху, равную 1,51.
Ответов: 2
Посмотреть ответ
Химия, 14.03.2019 11:57, Kseniya05
Распознавание растворов уксуснрй кислоты и глицерола
Ответов: 3
Посмотреть ответ
Химия, 14.03.2019 19:45, idknotforlong
Розрахувати який об’єм газу утвориться при взаємодії 2 моль na з h3so4
Ответов: 2
Посмотреть ответ
Химия, 14.03.2019 19:30, FullDown
Найдите объем воздуха, необходимого для обжига цинковой обманки массой 500 кг, содержащей 36% примеси
Ответов: 3
Посмотреть ответ
CaO + h3SO4 = h3O + CaSO4
| Поиск |
+ серная кислота = вода + сульфат кальция |
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Реакция двойной замены
| png» substance-weight=»56.0774″> CaO | + | 021858000000-chemical-structure-cas-7778-18-9.jpg-650.jpg» substance-weight=»136.1406″> CaSO 4 | |||||
| sulfuric acid | Water | Сульфат кальция | |||||
| 00005 | |||||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên — Phân tử Кхой (г/моль) | |||||||
| Со моль | |||||||
| 0 | Кхой лунг (г) |
Дополнительная информация об уравнении CaO + H
2 SO 4 → H 2 O + CaSO 4Каковы условия реакции CaO () реагирует с h3SO4 (серной кислотой) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3O (вода) и CaSO4 (сульфат кальция)?
В полном предложении вы также можете сказать, что CaO () реагирует с h3SO4 (серной кислотой) и производит h3O (воду) и CaSO4 (сульфат кальция)
Явление после того, как CaO () реагирует с h3SO4 (серная кислота)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Другие вопросы, связанные с химическими реакциями CaO + H
2 SO 4 → H 2 O + CaSO 4Вопросы, связанные с химическим веществом 90 CaO1 ()
9 и физические характеристики CaO ()? В каких химических реакциях используется CaO () в качестве реагента?
Вопросы, связанные с реагентом h3SO4 (серная кислота)
Каковы химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (серная кислота)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Вопросы, связанные с продуктом CaSO4 (сульфат кальция)
Каковы химические и физические характеристики CaSO4 (серная кислота)? В каких химических реакциях образуется CaSO4 (сульфат кальция)?
Essentt — Подобранные товары
Подобранные товары Необходимы для работы из дома!
Уравнения с CaO в качестве реагента
CaO + H 2 O → Ca(OH) 2 C + CaO → CaC 2 + CO CaO + 2NH 4 Cl → H 2 O + 2NH 3 900 Просмотреть все уравнения с CaO в качестве реагента
Уравнения с h3SO4 в качестве реагента
серная кислота
10FeO + 18H 2 SO 4 + 2KMnO 4 → 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MNSO 4 + K 2 SO 4 H 2 SO 4 + NA 2 SO 3 → H 2 O + 2 O + 2 OS + 2 O + 2 O + 2 O + 2 O + 2 O + 2 O + 2 O + 2 nA + 2 .
Реклама
Уравнения с h3SO4 в качестве продукта
серная кислота
2H 2 O + 2KMNO 4 + 5SO 2 → 2H 2 SO 4 + 2MNSO 4 + K 2 SO 4 4 + K 2 SO 4 . Cu (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE (№ 3 ) 3 2H 2 9 2 2 2 2 2 2 2 2 )
→ 2H 2 SO 4 + O 2 + 2Zn Просмотреть все уравнения с h3SO4 в качестве продуктаУравнения с h3SO4 в качестве продукта
серная кислота
2H 2 O + 2KMNO 4 + 5SO 2 → 2H 2 SO 4 + 2MNSO 4 + K 2 SO 4 4 + K 2 SO 4 . CU (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE (№ 3 ) 3 FE 2 9 400388 4. 40038 3 FE 2 8 4. 8 400388 40038 3 FE 2 8 8 3 FE 2 9) 3 . ) 3 + 3H 2 O → 2Fe + 3H 2 SO 4 + 3/2O 2 Просмотреть все уравнения с h3SO4 в качестве продукта
CU (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE (№ 3 ) 3 FE 2 9 400388 4. 40038 3 FE 2 8 4. 8 400388 40038 3 FE 2 8 8 3 FE 2 9) 3 . ) 3 + 3H 2 O → 2Fe + 3H 2 SO 4 + 3/2O 2 Просмотреть все уравнения с h3SO4 в качестве продукта
CaO + h3SO4 → CaSO4 ↓ + h3O | CaO ра CaSO4
- Тайское приложение VietJack. Xem lời giải nhanh hơn!
Trang trước
Trang sau
Phản ứng CaO + H 2 SO 4 hay CaO ra CaSO 4 hay CaO ra CaSO 4 9003 2 SO 4 ra CaSO 4 thuộc loại phản ứng trao đổi đã được can bằng chính xác và chi tiết nhất. Bên cạnh đ nhou một số bài tập có liên quan về cao có lời giải, mời các bạn đoun xem:
Bên cạnh đ nhou một số bài tập có liên quan về cao có lời giải, mời các bạn đoun xem:
Cao + H 2 SO 4 → CASO 4 2 . ing wry wry wry ing ings wry wry ings .
Куанг Као
Điều kiện phản ứng
— Khong có.
Cách thực hiện phản ứng
— Cho CaO tác dụng với dung dịch axit H 2 СО 4 .
Hiện tượng nhận biết phản ứng
— Cao phản ứng với H 2 SO 4 TạO THANH CHấT RắN Màu TRắNG CASO 4 .
bạn có biết
tương tự cao hầu hết các oxit bazơ tác dụng với axit h 2 So 4 Tạo thành muối sunfat và nước.
Ви до минь хоаВи до 1: Чронг ту нхьен, канси сунфат тун тэй дун дуй дунг мун0038 4 .2H 2 O) được gọi là:
A. Thạch cao sống. Б. Тхоч цао хан.
C. Thạch cao nung. Д. Да вой.
đAP án A
HướNG Dẫn Giải:
THạCH CAO SốNG Là CASO 4 .2H 2 O.
9003. THạAN.Thạch cao nung la CaSO4.h3O / CaSO4.0,5h3O.
Quảng cáo
Ví dụ 2: Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xưng?
A. Thạch Cao Nung Nóng (CASO 4 .H 2 O)
B. THạCH CAO SốNG (CASO 4 .
D. Vôi SốNG CAO
đAP án A
Hướng dẫn giải:
Thạch Cao NUNG (Caso 4 .h 2 ượ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đ đn giải. Тинь Ви Донг Транг Три Ной Тхат, Лам Фан Вьет Банг, Бо Бот Кхи Гай Ксунг
Ví dụ 3: Để điều chế Ca từ CaCO 3 cần thực hiện it nhất mấy phản ong ?
A. 2 B. 3 C. 4 D. 5
đAP án B
Hướng dẫn giải:
Phản ứng (1): CACO 3 + 2Hcl → Cacl 2 2 2 2 2 2 2 2 2 2 2 2 2 . 2 + H 2 O
2 + H 2 O
Phản ứng (2): CaCl 2 → Ca + Cl 2 ↑
Ngân hàng trắc nghiệm miễn phí ôn thi THPT Quốc Gia tại
khoahoc.vietjack.com- Hơn 75.000 cau trắc nghiem Toán có đáp án
- Hơn 50.000 cau trắc nghiệm Hóa có đáp án chi tiet
- Gần 40.000 cau trắc nghiệm Vật lý có đáp án
- Hơn 50.000 cau trắc nghiệm Tiếng Anh có đáp án
- Кхо Трук Нгхим Как Мон Кхак
>CHỈ TỪ 250K 1 BỘ TÀI LIỆU GIÁO ÁN, ĐỀ THI, KHÓA HỌC BẤT KÌ, VIETJACK HỖ TRỢ DỊCH COVID
Bộ giáo án, đề thi, bài giảng powerpoint, khóa học dành cho các thầy cô và học sinh lớp 12, đẩy đủ cac bộ sách cánh diều, kết nối tri thức, chân trời sáng tạo tại https://tailieugiaovien.com.vn/ . Hỗ trợ zalo VietJack Official
Giáo án, bài giung powerpoint Ван, Тоан, Ли, Хоа….
4,5 (243)
799 000
199 000 донгов
1000 Đề thi bản word THPT quốc gia cá trường 2023 Toán, Lí, Hóa.

