что, как сбалансировать и часто задаваемые вопросы —
By Томлешкумар Дешмукх
H2SO4 (Серная кислота) является сильной кислотой, а KBr (бромид калия) представляет собой белый кристаллический порошок. Сообщите нам некоторые факты о H2SO4 + КБр.
Серная кислота также известна как купоросное масло. Это бесцветная вязкая жидкость без запаха. Бромид калия состоит из элементов калия и брома. Это ионная соль, также служат ионы бромида.
В этой статье мы обсудим реакцию между серной кислотой и бромидом калия, уравновешивание уравнения, тип реакции и результирующее ионное уравнение реакции.
Что является произведением H2SO4 и KBrБисульфат калия (KHSO4), бром (Br2), диоксид серы (SO2) и вода (H2O) образуются в результате реакции между серной кислотой и бромидом калия.
3H2SO4 + 2KBr = 2ХСО4 + Br2 + ТАК2 + 2H2O
Какой тип реакции Н2SO4 + КВгH2SO4 + KBr представляет собой окислительно-восстановительная реакция.
Реакция уравновешивается с помощью следующих шагов:
H2SO4 + КВг = КХСО4 + Бр.2 + ТАК2 + H2O
- Подсчитывается количество атомов, присутствующих с обеих сторон, которое должно быть одинаковым..
| Сторона реагента | Сторона продукта |
|---|---|
| 2-атом водорода | 3-атом водорода |
| 4-атом кислорода | 7-атом кислорода |
| 1-атом серы | 2-атом серы |
| 1-атом брома | 2-атом брома |
| 1-атом калия | 1-атом калия |
- Количество атомов кислорода обеих сторон реакции уравновешивается добавлением коэффициента 3 к молекуле серной кислоты на стороне реагента.

- 3H2SO4 + КВг = КХСО4 + Бр.2 + ТАК2 + H2O
- Количество атомов водорода обеих сторон реакции уравновешивается добавлением коэффициента 2 к молекуле воды на стороне продукта.
- 3H2SO4 + КВг = КХСО4 + Бр.2 + ТАК2 + 2H2O
- Количество атомов серы обеих сторон реакции уравновешивается добавлением коэффициента 2 к молекуле бисульфата калия на стороне продукта.
- 3H2SO4 + КВг = 2ХСО4 + Бр.2 + ТАК2 + 2H2O
- Количество атомов брома обеих сторон реакции уравновешивается добавлением коэффициента 2 к молекуле бромида калия на стороне реагента.
- 3H2SO4 + 2KBr = 2ХСО4 + Бр.2 + ТАК2 + 2H2O
- Таким образом, сбалансированная химическая реакция:
- 3H2SO4 + 2KBr = 2ХСО4 + Бр.
 2 + ТАК2 + 2H2O
2 + ТАК2 + 2H2O
H2SO4 + KBr не титруют, т.к. Точка эквивалентности.
H2SO4 + результирующее ионное уравнение KBrСуммарное ионное уравнение реакции H2SO4 + КВг
6H+ + ТАК42- = 2Н+ + ТАК2 + 2H2O
Чистое ионное уравнение выводится с использованием шагов, упомянутых ниже.
- Сбалансированное уравнение с фазами для H2SO4 + Fe3O4
- 3H2SO4(водн.) + 2KBr(водн.) = 2KHSO4(водн.) + Br2(водн.) + SO2(г) + 2Н2О (л)
- Тогда уравнение, записанное в расщеплении соединений
- 6H++3SO42- + 2К+ + 2Бр– = 2К+ + 2H+ + 2СО42- + 2Бр– + ТАК2 + 2H2O
- Чистое ионное уравнение выглядит следующим образом, удаляя ионы-наблюдатели (ионы, которые одинаковы на стороне реагента и продукта)
- 6H+ + ТАК42- = 2Н+ + ТАК2 + 2H2O
Компания сопряженный пары Н2SO4 + KBr:
- Сопряженное основание H2SO4 ТАК42-
- Сопряженным основанием KBr является Br.
 –
–
Межмолекулярные силы присутствует в H2SO4 + KBr:
- Водородная связь, диполь-дипольное взаимодействие и дисперсия Ван-дер-Ваальса являются межмолекулярными силами в H2SO4.
- Бромид калия ионно связан друг с другом..
Энтальпия реакции H2SO4 + KBr составляет -362.07 кДж/моль.
| Соединение | Моли | Энтальпия образования, ΔH0f (кДж/моль) |
|---|---|---|
| H2SO4 | 3 | -814 |
| KBr | 2 | -180.08 |
| ХСО4 | 2 | -1163.3 |
| Br2 | 1 | 30. 91 91 |
| SO2 | 1 | -296.9 |
| H2O | 2 | -285.82 |
- Стандартную энтальпию реакции рассчитывают по формуле:
- & delta; H0ф (реакция) = Σ∆H0ф (продукт) – Σ∆Н0f (реагенты)
- Таким образом, изменение энтальпии = [2*(-1163.3) + 1*(30.91) + 1*(-296.9) + 2*(-285.82)] – [3*(-814.0) + 2*(-180.08)] = [(-3164.23) – (2802.16)]
- = -362.07 кДж/моль
H2SO4 + KBr реакция не приведет к буферный раствор потому что серная кислота является сильной кислотой и в буферном растворе может присутствовать только слабая кислота или основание.
Is H2SO4 + KBr полная реакцияH2SO4 + KBr является полной реакцией, и после завершения реакции образуются такие продукты, как гидросульфат калия, бром, диоксид серы и вода.
H2SO4 + КВг есть экзотермическая реакция потому что он показывает отрицательную энтальпию -362.07 кДж/моль.
Is H2SO4 + KBr окислительно-восстановительная реакцияH2SO4 + KBr представляет собой окислительно-восстановительный потенциал реакция за счет изменения степени окисления ионов серы и брома на стороне реагента и продукта как показано ниже.
3H2S6+O4 + 2КБр1- = 2ХСО4 + Br20 + S4+O2 + 2H2O
Н2SO4 + KBr реакция осажденияH2SO4 + KBr реакция не является реакцией осаждения, так как во время реакции не образуется осадок.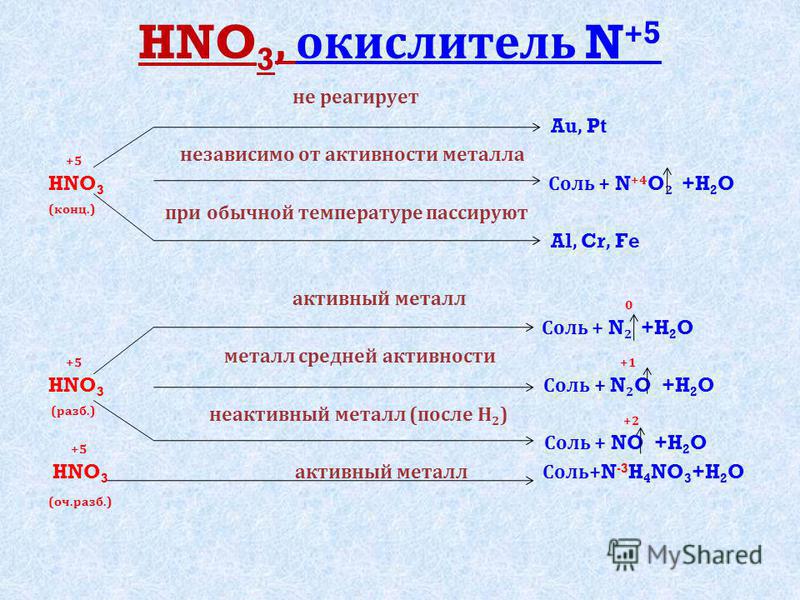
H2SO4 + KBr является необратимой реакцией, так как образуются продукты гидросульфат калия, бром, диоксид серы и вода, которые при тех же условиях не реагируют с возвратом реагентов.
Н2SO4 + KBr реакция замещенияH2SO4 + KBr представляет собой одинарное перемещение реакция, в которой сульфат-ион вытесняется из H2SO4 молекула с образованием гидросульфата калия.
3H2SO4 + 2KBr = 2ХСО4 + Бр.2 + ТАК2 + 2H2O
Как сбалансировать KBrO3 + КВг +Н2SO4 = К2SO4 + Br2 + H2OРеакцию уравновешивают, используя следующие стадии.
KBrO3 + КВг + Н2SO4 = К2SO4 + Бр. 2 + H2O
2 + H2O
- Подсчитывается количество атомов, присутствующих с обеих сторон, которое должно быть одинаковым..
| Сторона реагента | Сторона продукта |
|---|---|
| 2-атом водорода | 2-атом водорода |
| 7-атом кислорода | 5-атом кислорода |
| 1-атом серы | 1-атом серы |
| 2-атом брома | 2-атом брома |
| 2-атом калия | 2-атом калия |
- Количество атомов кислорода обеих сторон реакции уравновешивается добавлением коэффициента 3 к молекуле серной кислоты на стороне реагента и сульфату калия на стороне продукта..
- KBrO3 + КВг + 3Н2SO4 = 3К2SO4 + Бр.
 2 + H2O
2 + H2O - Количество атомов водорода с обеих сторон баланса реакции путем добавления коэффициента 3 к молекуле воды на стороне продукта.
- KBrO3 + КВг + 3Н2SO4 = 3К2SO4 + Бр.2 + 3H2O
- Количество атомов брома с обеих сторон баланса реакции путем добавления коэффициента 5 к молекуле бромида калия со стороны реагента и 3 к молекуле бромида со стороны продукта.
- KBrO3 + 5KBr + 3H2SO4 = 3К2SO4 + 3Бр2 + 3H2O
- Таким образом, сбалансированная химическая реакция:
- KBrO3 + 5KBr + 3H2SO4 = 3К2SO4 + 3Бр2 + 3H2O
Когда серная кислота реагировала с бромидом калия, она давала бисульфат калия, бром, диоксид серы и воду. Это единственная реакция замещения, также окислительно-восстановительная реакция. Он обнаруживает отрицательную энтальпию реакции, следовательно, это экзотермическая реакция.
Это единственная реакция замещения, также окислительно-восстановительная реакция. Он обнаруживает отрицательную энтальпию реакции, следовательно, это экзотермическая реакция.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
Пользуйтесь нашим приложением
What, How to Balance & FAQs —
By Tomleshkumar Deshmukh
H 2 SO 4 (серная кислота) — сильная кислота, а KBr (бромид калия) — белый кристаллический порошок. Сообщите нам некоторые факты о H 2 SO 4 + KBr.
Серная кислота также известна как купорос. Это бесцветная вязкая жидкость без запаха. Бромид калия состоит из элементов калия и брома. Это ионная соль, также служат ионы бромида.
Это бесцветная вязкая жидкость без запаха. Бромид калия состоит из элементов калия и брома. Это ионная соль, также служат ионы бромида.
В этой статье мы обсудим реакцию между серной кислотой и бромидом калия, уравновешивание уравнения, тип реакции и результирующее ионное уравнение реакции.
Каков продукт H 2 SO 4 и KBRБисульфат калия (KHSO 4 ), Бром (BR 2 ), диоксид серы (So 2 ) и вода (Br 2 ), диоксид серы (So 2 ) и вода (Br 2 ), диоксид серы (So 2 (Br 2 ), диоксид серы (So 2 (Br 2 H 2 O) образуются в результате реакции между серной кислотой и бромидом калия.
3H 2 SO 4 + 2KBR = 2KHSO 4 + BR 2 + SO 2 + 2H 2 O
Что тип реакции. 4 + KBr H 2 SO 4 + KBr представляет собой окислительно-восстановительную реакцию .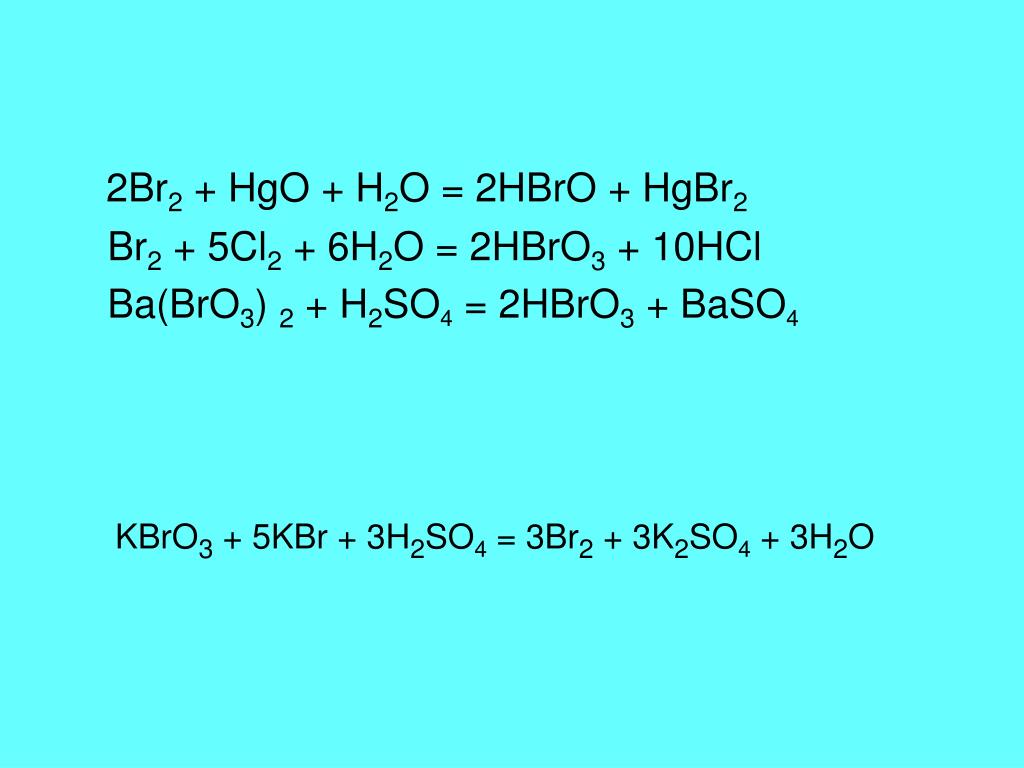
Реакцию уравновешивают, используя следующие шаги :
H 2 SO 4 + KBR = KHSO 4 + BR 2 + SO 2 + H 2 O
- Количество, присутствующие на обеих сторонах, необходимо, что должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, что должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, которое должно быть, что должно быть тем же .
| Reactant Side | Product Side |
|---|---|
| 2-Hydrogen atom | 3-Hydrogen atom |
| 4-Oxygen atom | 7-Oxygen atom |
| 1-Sulphur atom | 2-Sulphur atom |
| 1-Bromine atom | 2-Bromine atom |
| 1-Pottasium atom | 1-Pottasium atom |
- Количество атомов кислорода обеих сторон реакции уравновешивается добавлением коэффициента 3 к молекуле серной кислоты на стороне реагента.

- 3H 2 SO 4 + KBR = KHSO 4 + BR 2 + SO 2 + H 2 O
- . уравновешивается добавлением коэффициента 2 к молекуле воды на стороне продукта.
- 3H 2 SO 4 + KBR = KHSO 4 + BR 2 + SO 2 + 2H 2 O
- Количество SUPHUR ATOMS Atom реакция уравновешивается добавлением коэффициента 2 к молекуле бисульфата калия на стороне продукта.
- 3H 2 SO 4 + KBR = 2KHSO 4 + BR 2 + SO 2 + 2H 2 O
- . реакция уравновешивается добавлением коэффициента 2 к молекуле бромида калия на стороне реагента.
- 3H 2 SO 4 + 2KBR = 2KHSO 4 + BR 2 + SO 2 + 2H 2 O
- + 2H 2 O
- .
 0015 So the balanced chemical reaction is :
0015 So the balanced chemical reaction is : - 3H 2 SO 4 + 2KBr = 2KHSO 4 + Br 2 + SO 2 + 2H 2 O
H 2 SO 4 + KBr титрование не проводят, т.к. нет точки эквивалентности.
H 2 SO 4 + KBr результирующее ионное уравнениеЧистое ионное уравнение реакции H 2 SO 4 + KBR IS
6H + + SO 4 2- = 2H + + SO 9000 29 29 2963H63H63H6 29 296H63H6 29 293H6. 2 O
Чистое ионное уравнение получено с использованием шагов, упомянутых ниже
- Сбалансированное уравнение с фазами для H 2 SO 4 + Fe 3 O 4 991041101010104111159 3 o 4 1610411010411111101049111111111010104959 3 O.

- 3H 2 SO 4 (водн.) + 2KBr (водн.) = 2KHSO 4 (водн.) + Br 2 (водн.) + SO 2 (г) + 05H 2 90 )
- Then the equation written in splitting of compounds
- 6H + +3SO 4 2- + 2K + + 2Br – = 2K + + 2H + + 2SO 4 2- + 2Br – + SO 2 + 2H 2 O
- Итоговое ионное уравнение выглядит следующим образом, если исключить ионы-спектаторы (ионы, одинаковые со стороны реагента и продукта) + + SO 2 + 2H 2 O
СОЗДАНИ следующим образом:
- The conjugate base of H 2 SO 4 is SO 4 2-
- The conjugate base of KBr is Br –
Межмолекулярные силы, присутствующие в H 2 SO 4 + KBr, следующие: в Н 2 СО 4 .

- Бромид калия связаны друг с другом ионной связью .
Энтальпия реакции H 2 SO 4 + KBr is -K0.
| Соединение | Моль | Энтальпия образования, ΔH 0 90J6 f6 f 00112 |
|---|---|---|
| H 2 SO 4 | 3 | -814 |
| KBr | 2 | -180.08 |
| KHSO 4 | 2 | -1163.3 |
| Br 2 | 1 | 30.91 |
| SO 2 | 1 | -296.9 |
| H 2 O | 2 | -285.82 |
- Стандартная энтальпия реакции рассчитывается с использованием формулы:
- ΔH 0 F (реакция) 9006 = σδh 0 99593.
 99969... .. . 0 f (реагенты)
99969... .. . 0 f (реагенты) - Таким образом, изменение энтальпии = [2*(-1163,3) + 1*(30,91) + 1*(-296,9) + 2*(-285,82)] – [3* (-814,0) + 2*(-180,08)] = [(-3164,23) – (2802,16)]
- = -362,07 кДж/моль
H 2 SO 4 + KBr reaction will not form a buffer solution because Sulphuric acid is a strong acid and в буферном растворе может присутствовать только слабая кислота или основание.
IS H 2 SO 4 + KBR Полная реакцияH 2 SO 4 + KBR — полная реакция, а продукты, такие и вода образуются после завершения реакции.
IS H 2 SO 4 + KBR A -экзотермическая или эндотермическая реакция H 2 SO 4 + KBR — это экзатерматическая реакция, потому что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что это показывает, что с ответом. 362,07 кДж/моль.
362,07 кДж/моль.
H 2 SO 4 + KBR — окислительно -восстановительная реакция из -за изменения в состоянии окисления сульфур и бром. сторона реагента и продукта , как показано ниже.
3H 2 S 6+ O 4 + 2KBR 1- = 2KHSO 4 + BR 2 0 + S 45939393939393939393939393939393939393939393939393939393939393939393939393 9000 2 9000 2 2 9000 2 9000 2 2 2 2 2 2 2 2 0 + S 40005 2 . O
Is H 2 SO 4 + KBr реакция осажденияH 2 SO 4 + KBr осадок в ходе реакции реакция не образуется т.к.
Is H 2 SO 4 + KBr обратимая или необратимая реакция H 2 SO 4 образуются, которые не реагируют с отдачей реагентов при тех же условиях.
H 2 SO 4 + KBr представляет собой единственную реакцию замещения, в которой ион сульфата вытесняется из молекулы H 2 SO 4 с образованием гидросульфата калия.
3H 2 SO 4 + 2KBr = 2KHSO 4 + Br 2 + SO 2 + 2H 2 O
How to balance KBrO 3 + KBr +H 2 SO 4 = K 2 SO 4 + Br 2 + H 2 OРеакция уравновешивается с помощью следующих шагов.
KBRO 3 + KBR + H 2 SO 4 = K 2 SO 4 + BR 2 + H 2 O
- . обе стороны подсчитываются, что должно быть одинаковым .

| Сторона реагента | Сторона продукта |
|---|---|
| 2-Hydrogen atom | 2-Hydrogen atom |
| 7-Oxygen atom | 5-Oxygen atom |
| 1-Sulphur atom | 1-Sulphur atom |
| 2-Bromine atom | 2-атом брома |
| 2-атом калия | 2-атом калия |

When Sulphuric acid reacted with Potassium bromide it produced Potassium bisulfate, bromine, sulfur dioxide и вода. Это единственная реакция замещения, также окислительно-восстановительная реакция. Он обнаруживает отрицательную энтальпию реакции, следовательно, это экзотермическая реакция.
Производство серной кислоты | КБР
Обращение с кислотой требует самых современных процессов. Наши специально разработанные установки для концентрирования и очистки серной кислоты отвечают особым требованиям, сочетая самые современные технологии с проверенными материалами.
 Технологии производства серной кислоты
Технологии производства серной кислотыKBR могут использоваться для концентрирования и очистки загрязненной и отработанной серной кислоты из самых разных областей применения и источников. KBR предлагает полностью устойчивый к коррозии теплообменник SAVACO ® -HT с высокой концентрацией серной кислоты, TO-HeX, пропускающий до 98 мас.% H3SO4 с подтвержденным сроком службы более 30 лет, что является уникальным предложением на рынке. и самое передовое техническое решение, доступное для этого приложения.
«У нас есть опыт и рекомендации по нашим передовым технологиям производства серной кислоты для всех процессов, требующих обращения с отработанными кислотами».
KBR имеет опыт и рекомендации по всем типичным источникам и процессам, требующим обращения с отработанными кислотами, включая:
- Процессы нитрования, такие как производство 2-ЭГН, МНТ, ДНТ, ТНТ, НБ, НХБ, ДНХБ, ШФЛУ/НГ, ДЭГН, ЭГДН, НЦ, пикриновой кислоты и т.
 д.
д. - Химические применения, такие как производство МЭК и сульфирование
- Производство некоторых красителей и пигментов
- Сушка хлором
- Очистка газа
- Органический синтез, например производство эфира
- Применение в металлургии, например, обработка лития
KBR уже поставляет установки для широкого спектра применений и поэтому может разработать индивидуальные решения, соответствующие современному технологическому процессу, для применения в любой точке мира. Мы также разрабатываем новые приложения нашей технологии и управляем лабораторией с экспериментальными установками, которые позволяют нам очень надежно и эффективно разрабатывать и масштабировать такие новые приложения для наших клиентов.
Основываясь на более чем 70-летнем опыте работы в области кислотной обработки, KBR предлагает индивидуальные решения для нужд клиентов. Мы проектируем как небольшие установки, на которых извлекается всего несколько сотен килограммов кислоты в час, так и установки мирового масштаба.
Предварительное концентрирование
Предварительное концентрирование используется, когда поток серной кислоты достаточно разбавлен (20–60 мас.%), чтобы довести концентрацию до 70–75 мас.%. Предварительное концентрирование проводят либо при атмосферном давлении, либо в условиях вакуума. Можно использовать различные типы испарителей. Для большей производительности по испарению воды в целях энергосбережения часто используются многоступенчатые испарительные системы. Пары одного этапа используются в качестве теплоносителя для другого этапа процесса.
Средняя концентрация
Этот процесс используется для концентрирования серной кислоты от 70% до 85% по массе. Серная кислота средней концентрации в основном работает при вакууме около 80–150 мбар. В этих условиях для нагрева может использоваться пар среднего давления, а для конденсации – обычная охлаждающая вода. В тех случаях, когда требуются более высокие температуры — например, при разложении некоторых органических загрязнителей — испарение из атмосферы при рабочей температуре до 250°C возможно с помощью нашего уникального SAVACO 9. Теплообменник 0292 ® -HT TO-HeX.
Теплообменник 0292 ® -HT TO-HeX.
Высокая концентрация SAVACO®-HT
Процесс PLINKE SAVACO ® используется для производства высококонцентрированной серной кислоты до 98% масс. Компания PLINKE разработала специальный теплообменник, работающий на термальном масле в качестве теплоносителя при температуре до 250°C, не подверженный коррозии и имеющий подтвержденный срок службы более 30 лет. В этих условиях процесс протекает очень экономично при приемлемом уровне вакуума и производится очень чистая серная кислота. Если такие высокие температуры или концентрации не требуются, доступны другие вакуумные процессы с теплообменниками с паровым нагревом.
Очистка
Отработанные кислоты из различных процессов часто содержат органические и неорганические примеси. Эти загрязняющие вещества должны быть удалены или их концентрация должна быть сведена к минимуму, чтобы можно было повторно использовать серную кислоту. KBR предлагает различные процессы химической и термической обработки для очистки отработанных кислот, которые можно комбинировать со стадиями концентрирования.

 2 + ТАК2 + 2H2O
2 + ТАК2 + 2H2O –
– 2 + H2O
2 + H2O



 0015 So the balanced chemical reaction is :
0015 So the balanced chemical reaction is :
 99969... .. . 0 f (реагенты)
99969... .. . 0 f (реагенты) 
 д.
д.