СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
14.02.2023
«Науки юношей питают…» (М. Ломоносов)
В СУНЦ УрФУ в День российской науки состоялись тематические мероприятия.
12.02.2023
Lecture on the world economy Pupils 10Z and 11Z, или Приглашение на кейс-чемпионат
Математико-экономические классы СУНЦ встретились с представителями УрФУ.
10.02.2023
Урал… Уралу… Об Урале!
В общежитии состоялся поэтический вечер, посвященный Уралу.
09.02.2023
День Российской науки: астрономия с автором учебника
Лицеисты встретились с Владимиром Георгиевичем Сурдиным, автором учебника астрономии.
09.02.2023
Юрий Казарин о Тютчеве, интерфизике и «чуваках»
В СУНЦ прошла встреча с уральским поэтом, организованная кафедрой филологии.
06.02.2023
В СУНЦ УрФУ состоялся форум выпускников
Выпускники СУНЦ разных лет встретились с нынешними лицеистами.
Больше новостей
Видеогалерея:
Новогодние поздравления (декабрь 2022)
СУНЦ.АРТ (ноябрь 2022)
«Горнозаводской Урал» (октябрь 2022)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.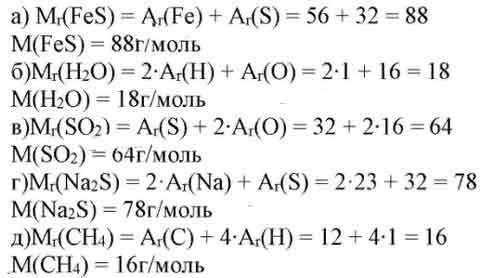
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9, 10 и 11 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул., 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 19, 32 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
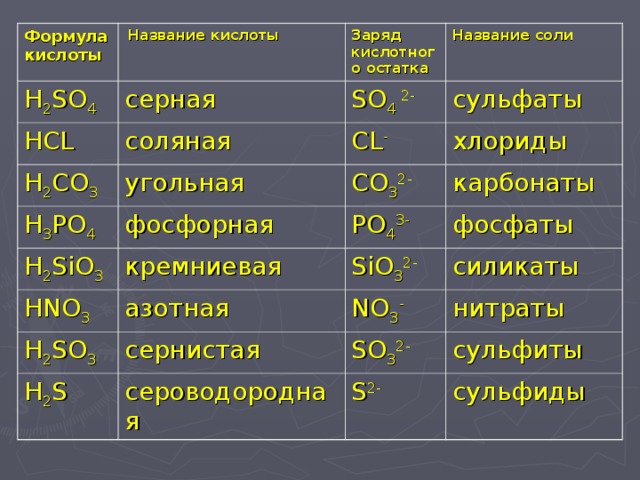
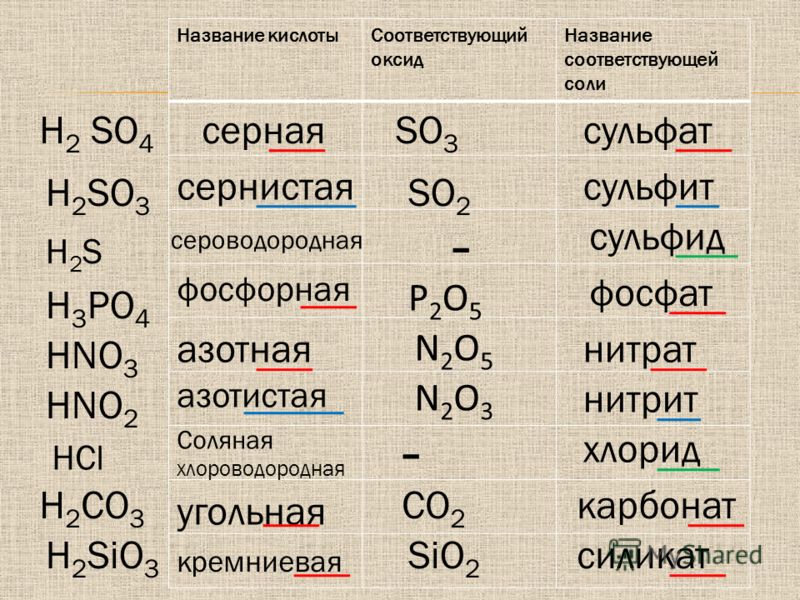
Серная кислота (h3SO4) – структура, формула, молекулярная масса и применение
Серная кислота или серная кислота представляет собой минеральную кислоту, состоящую из одного атома серы, четырех атомов кислорода и двух атомов водорода. Химическая или молекулярная формула серной кислоты: H 2 SO 4 . Серная кислота является одним из наиболее важных химических веществ, используемых в коммерческих целях. Он также известен как маттлинговая кислота, сульфат водорода или купорос. Серная кислота является очень сильной кислотой и вязкой жидкостью. Это бесцветная, маслянистая жидкость без запаха, едкая по своей природе. Серная кислота является компонентом кислотных дождей, поскольку она растворима в воде.
Химическая или молекулярная формула серной кислоты: H 2 SO 4 . Серная кислота является одним из наиболее важных химических веществ, используемых в коммерческих целях. Он также известен как маттлинговая кислота, сульфат водорода или купорос. Серная кислота является очень сильной кислотой и вязкой жидкостью. Это бесцветная, маслянистая жидкость без запаха, едкая по своей природе. Серная кислота является компонентом кислотных дождей, поскольку она растворима в воде.
Серная кислота представляет собой сильнокислотную жидкость. В результате он используется для очистки металлов, извлечения примесей из нефти, производства химических веществ, таких как азотная кислота и соляная кислота, а также производства красителей, лекарств, моющих средств и взрывчатых веществ, среди других процессов. Молярная масса серной кислоты составляет 98,079 г/моль. Плотность Серной кислоты 1,83 г/см 3 . Молекула H 2 SO 4 ковалентна, имеет тетраэдрическую структуру и моноклинную кристаллическую структуру.
Что такое серная кислота?
Серная кислота является высокореактивным химическим веществом. Серная кислота используется во многих отраслях промышленности, таких как автомобильные аккумуляторы на основе свинца, производство различных химикатов, клея и взрывчатых веществ, очистка нефти, отверждение металлов и т. д. Следовательно, из-за такого широкого применения ее называют « Король химикатов ». Химическая формула серной или серной кислоты: H 2 SO 4 .
Как показано ниже, серная кислота (H 2 SO 4 ) представляет собой ковалентное соединение, состоящее из атома серы, присоединенного к двум атомам кислорода и двум молекулам гидроксила (-ОН).
Свойства серной кислоты (H
2 SO 4 )Физические свойства серной кислоты
- H 2 SO 4 — вязкий, толстый, безрезультатный и йайл. кислота имеет плотность 1,84 г/мл, температуру кипения 337 °С и температуру плавления 10 °С.

- Концентрированная серная кислота на 98% состоит из воды и является наиболее стабильной формой. Многие другие концентрации с разными названиями доступны для различных целей, например, аккумуляторная кислота с концентрацией 29–32 %, камерная кислота с концентрацией 62–70 % и башенная кислота с концентрацией 78–80 %.
- Имеет удельный вес 1,84 при 298 K.
- Лакмус окрашивается в синий цвет, а значения pH серной кислоты в ммоль/л указаны в таблице ниже,
| Значения pH | 1 mM | 10 mM | 100 mM |
| Sulphuric acid (in mmol/l) | 2.75 | 1.87 | 1.01 |
- It is сильно разъедает, что делает его опасным для прикосновения.
Химические свойства серной кислоты
- H 2 SO 4 представляет собой сильную кислоту, которая полностью диссоциирует на ионы в своем водном растворе, как,
H 2 SO 4 ⇢ H 2 + + SO 4 -2
- Sulfuric Acdos является хорошим окислителем, как это, так как это, как это, пожертвование, пожертвование.
 Другие ветвы. его атомы кислорода в химической реакции. Как показано ниже, он окисляет углерод и серу.
Другие ветвы. его атомы кислорода в химической реакции. Как показано ниже, он окисляет углерод и серу.
2H 2 SO 4 + C ⇢ 2H 2 O + 2SO 2 + CO 2
10020 2H 2 SO 4 + S ⇢ 2H 2 O + 3SO 2
- Серная кислота является двухосновной кислотой и выделяет два иона водорода на молекулу.
- Серная кислота обладает гигроскопическими свойствами, что означает, что H 2 SO 4 может впитывать и контролировать влажность окружающей среды. Этот эффект делает его хорошим обезвоживающим средством.
- Менее летучий. Вот почему он способствует получению более летучих кислот из их комплементарных солей.
Структура серной кислоты
Два атома кислорода образуют двойные связи с атомом серы, а две гидроксильные группы (ОН) образуют одинарные связи с атомом серы. Из-за своей способности высвобождать два протона это дипротонная кислота. Как показано ниже, молекула имеет тетраэдрическую структуру и является ковалентной.
Из-за своей способности высвобождать два протона это дипротонная кислота. Как показано ниже, молекула имеет тетраэдрическую структуру и является ковалентной.
Получение серной кислоты
Серная кислота обычно готовится и производится следующими двумя широко используемыми методами.
- Контактный процесс
- Свинцовый камерный процесс
Контактный процесс производства серной кислоты
Контактный процесс включает три этапа производства серной кислоты:
- Получение диоксида серы или сернистых соединений воздух.
С(с) + О 2 (g) → SO 2 (g)
SO 4 (олеум) → H 2 S 2 O 7
- Реакция диоксида серы с кислородом в присутствии V 2 O 5 катализатор с образованием триоксида серы (SO 3 50 909004 ) как, 000004 , 2SO 2 (G) + O 2 (G) → 2SO 3 (G)
- Преобразование триоксида серы в серную кислоту,
SO 3 + H 49
SO 3 + H 9000 3 49
H 2 S 2 O 7 (L) + H 2 O (L) → 2H 2 SO 4 (кислота SULFURIARIC).

Серная кислота, полученная контактным способом, имеет чистоту 96–98%.
Процесс со свинцовой камерой
Одним из самых популярных производственных процессов является метод со свинцовой камерой. Он производит от 50 до 60 кислот класса B. В этой процедуре используется влажный SO 2 в присутствии оксидов азота (динамический импульс). В результате он подвергается окислению кислородом воздуха с образованием триоксида серы. Эта реакция выражается как
2SO 2 + O 2 → 2SO 3
Затем проводят взаимодействие воды и триоксида серы, в результате чего образуется H 2
4 SO 4
. Эта реакция указана какSO 3 + H 2 O → H 2 SO 4
Молекулярная масса серной кислоты
серная кислота имеет химическую форму H 2 SO SO. 4 . Согласно этой формуле одна молекула серной кислоты (H 2 SO 4 ) содержит 2 моля водорода, 1 моль серы и 4 моля атомов кислорода. В результате молекулярная масса H 2 SO 4 будет равна сумме масс двух молей водорода, одного моля серы и четырех молей кислорода. Поскольку атомная масса водорода равна 1 u, атомная масса серы равна 32 u, а атомная масса кислорода равна 16 u, молекулярная масса серной кислоты может быть рассчитана следующим образом:
Согласно этой формуле одна молекула серной кислоты (H 2 SO 4 ) содержит 2 моля водорода, 1 моль серы и 4 моля атомов кислорода. В результате молекулярная масса H 2 SO 4 будет равна сумме масс двух молей водорода, одного моля серы и четырех молей кислорода. Поскольку атомная масса водорода равна 1 u, атомная масса серы равна 32 u, а атомная масса кислорода равна 16 u, молекулярная масса серной кислоты может быть рассчитана следующим образом:
Молекулярная масса H 2 SO 4 = Масса 2 молей атомов водорода + Масса 1 моля серы + Масса 4 молей атомов кислорода
= 2 × 1 + 32 + 4 × 16
= 2 + 32 + 64
= 98 ед.
Таким образом, молекулярная масса серной кислоты равна 98 ед., а молекулярная масса серной кислоты равна 98 г/моль.
Реакции серной кислоты
- Диссоциация- При варке чистой безводной серной кислоты образуются триоксид серы и вода.
H 2 SO 4 → SO 3 + H 2 O
- Кислотный характер серной кислоты- Это обычная дибазиновая кислота, которая становится синими литмическими. Делится на две группы солей.
NaOH + H 2 SO 4 → Nahso 4 + H 2 O
2NAOH + H 2 SO 4 → NA 2 SO 4 0004 + 2H 2 O
- Сульфирующее действие серной кислоты- Концентрированная серная кислота соединяется с различными органическими молекулами, такими как бензол, толуол и другие, с образованием, например, сульфокислоты.
C 6 H 6 + H 2 SO 4 → C 6 H 5 SO 3 H + H 2 O
- . Кислота- Образует нерастворимые сульфаты, которые осаждаются, например, при взаимодействии с водными растворами бария, свинца и других солей.
H 2 SO 4 + BACL 2 → BASO 4 ↓ + 2HCl
- Реакция с триоксидом Sulfur- , обычно известный, как и коричневая атисфур. триоксид серы.
H 2 SO 4 + SO 3 → H 2 S 2 O 7
Использование серной кислоты
Серная кислота известна как один из наиболее важных реагентов и имеет несколько промышленных применений. Вот несколько примеров:
- Таким способом производятся такие удобрения, как сульфат аммония, суперфосфат извести и другие.
- В производстве красок, взрывчатых веществ и фармацевтических препаратов.
- H 2 SO 4 используется в производстве кислот, таких как HCl и HNO 3 .
- Например, в производстве пигментов, красок и полимеров.
- Например, в бумажной и текстильной промышленности.

- Нитроцеллюлоза используется в производстве товаров.
- Применение в металлургии (пример: очистка металлов перед эмалированием, гальванопокрытием и цинкованием).
- В кожевенном бизнесе.
- В отсеках для хранения.
- В нефтегазовом секторе.
- В бизнесе моющих средств.
- Работает как осушитель.
- В качестве реагента в лаборатории.
Часто задаваемые вопросы о серной кислоте
Вопрос 1: Каково применение серной кислоты?
Ответ:
Удобрения, красители, взрывчатые вещества и фармацевтические препараты производятся с использованием серной кислоты. Он также используется для получения таких кислот, как HCl и HNO3. Он часто используется в металлургической промышленности (пример: очистка металлов перед эмалированием, гальванопокрытием и цинкованием).
Вопрос 2: Почему серную кислоту называют королем химических веществ?
Ответ:
Серная кислота, которую иногда называют «королем химических веществ», является одним из наиболее важных веществ.
Оно также известно как купоросное масло, так как когда-то его делали из зеленого купороса. Он очень агрессивен и более реактивен, чем другие кислоты. В результате он имеет широкий спектр применения, включая использование в лабораториях, батареях, моющих средствах и производстве многочисленных лекарств.
Вопрос 3: Что произойдет при взаимодействии серной кислоты с водными растворами солей бария?
Ответ:
Образует нерастворимые сульфаты, которые осаждаются при взаимодействии с водными растворами солей бария.
H 2 SO 4 + BaCl 2 → BaSO 4 ↓ + 2HCl
при реакции трисульфида с серой Вопрос 4: Что произойдет?
Ответ:
Серная кислота растворяет триоксид серы с образованием олеума, часто известного как дымящаяся серная кислота.
H 2 SO 4 + SO 3 → H 2 S 2 O 7
Вопрос 5: Какова структура серная кислота?
Ответ:
В серной кислоте два атома водорода прочно связаны с двумя атомами кислорода, в результате чего образуются две группы ОН.
Молекула ковалентна и имеет тетраэдрическую структуру.
Вопрос 6: Какая кислота самая сильная в мире?
Ответ:
Фторсурьмяная кислота представляет собой суперкислотную смесь пятифтористой сурьмы и плавиковой кислоты, которая является самой сильной в мире. Кислоты, основания и соли
Last updated date: 15th Feb 2023
•
Total views: 274.5k
•
Views today: 7.64k
Answer
Verified
274.5k+ views
Hint: Molecular mass is the sum of отдельные атомы в молекуле. Начните вопрос с написания химической формулы серной кислоты, а затем добавьте молярную массу отдельных атомов.
Полный пошаговый ответ:
Серная кислота состоит из серы, кислорода и водорода.
Химическая формула серной кислоты дается как – \[{{H}_{2}}S{{O}_{4}}\].
Как видно из приведенной выше химической формулы, серная кислота имеет 2 атома водорода, 1 атом серы и 4 атома кислорода.
Следовательно, для расчета молекулярной массы нам нужно сложить отдельные массы, т. е.
Молекулярная масса серной кислоты = (2 х Молярная масса водорода) + (1 х Молярная масса серы) + (4 х Молярная масса кислорода)
Из периодической таблицы можно найти, что –
Молярная масса водорода = 1,01 г/моль
Молярная масса серы = 32,06 г/моль
Молярная масса кислорода = 16 г/моль
Молярная масса любого элемента или соединения выражается в г/моль.
Следовательно, молекулярная масса
\[=\left( 2\times1.01 \right)+\left( 1\times32.06 \right)+\left( 4\times16 \right)\text{г/моль }\]
\[=\text{ }2,02+32,06+64\text{ }г/моль\]
\[=\text{ }98,08\text{ }г/моль\]
Следовательно, ответ равен 98,08 г/моль.Дополнительная информация: Серная кислота также известна как купоросное масло.
Примечание: Серная кислота — очень сильная кислота. Он дипротонный, то есть может высвобождать два протона в водном растворе. Это очень сильный окислитель, который реагирует с металлами при высокой температуре.


 Другие ветвы. его атомы кислорода в химической реакции. Как показано ниже, он окисляет углерод и серу.
Другие ветвы. его атомы кислорода в химической реакции. Как показано ниже, он окисляет углерод и серу.


 Оно также известно как купоросное масло, так как когда-то его делали из зеленого купороса. Он очень агрессивен и более реактивен, чем другие кислоты. В результате он имеет широкий спектр применения, включая использование в лабораториях, батареях, моющих средствах и производстве многочисленных лекарств.
Оно также известно как купоросное масло, так как когда-то его делали из зеленого купороса. Он очень агрессивен и более реактивен, чем другие кислоты. В результате он имеет широкий спектр применения, включая использование в лабораториях, батареях, моющих средствах и производстве многочисленных лекарств. Молекула ковалентна и имеет тетраэдрическую структуру.
Молекула ковалентна и имеет тетраэдрическую структуру.