что, как сбалансировать и часто задаваемые вопросы —
By Вишнуприя Тадури
Оксид натрия и серная кислота являются неорганическими соединениями. На2O существует в твердой форме, а H2SO4 представляет собой сиропообразную жидкость. Дайте нам знать больше о H2SO4 и Na2О реакция.
Na2О — сильный основной оксид белого цвета, растворимый в воде. Он имеет кристаллическая структура антифлюорита. Н2SO4 isбесцветная сильная кислота, действует как хороший обезвоживающий агент. Когда Н2SO4 добавляется к Na2О, происходит реакция сильная кислота-сильное основание.
В этой статье мы обсудим некоторые факты о кислотно-щелочной реакции H2SO4 + На2О, вроде, образовался продукт,тип реакции, способ уравновешивания, сила межмолекулярного притяжения и др.
Что является произведением H
2SO4 и Na2O?Сульфат натрия и вода получаются, когда Na2O добавляется к H2SO4.
Na2О + Н2SO4 ———> Na2SO4 + Н2O
Какой тип реакции Н
2SO4 + На2O?Na2O+ H2SO4 есть кислотно-щелочная реакция, так как в качестве продуктов получаются соль и вода.
Как сбалансировать H
2SO4 + На2O?Уравнение уравновешивается с помощью следующих шагов.
Na2О+ Н2SO4 = На2SO4 + H2O
- Обратите внимание на количество каждого элемента, участвующего в реакции, как в реагенте, так и в продукте.
| Элемент | Сторона реагента | Сторона продукта |
|---|---|---|
| Na | 2 | 2 |
| S | 1 | 1 |
| O | 5 | 5 |
| H | 2 | 2 |
- Количество каждого элемента в реагенте и продукте оказывается равным.
 Следовательно, реакция является самоуравновешенной.
Следовательно, реакция является самоуравновешенной. - Na2О+ Н2SO4 = На2SO4 + H2O
H
2SO4 + На2О титрованиеH2SO4 и Na2O следует титрованию сильной кислоты сильным основанием. Сила На2О определяют с помощью следующей процедуры.
АппаратыБюретка, подставка для бюретки, коническая колба, мерный стакан, пипетка на 20 мл и химический стакан.
Индикаторныефенолфталеин используется в качестве индикатора.
Процедура- Стандартизированный Н2SO4 берется в бюретку, а Na2О отбирают в коническую колбу.
- Титрование начинают с медленного добавления капель H2SO4, а индикатор фенолфталеин добавляют в середине титрования.

- Титрование продолжают до тех пор, пока бесцветный раствор не станет розовым. Говорят, что это точка эквивалентности.
- Используя формулу V1S1=V2S2, оцените неизвестную силу Na2O.
H
2SO4 + На2O чистое ионное уравнениеСуммарное ионное уравнение реакции H2SO4 + Na2O is –
2H+(Водно) + О2- (Водно) = Н2O (L)
Чтобы получить результирующее ионное уравнение, выполняются следующие шаги:
- Напишите ионную форму каждого из веществ вместе с их состояниями. Полное ионное уравнение H2SO4 + На2О есть —
- 2H+ (водн.
 ) + SO42- (водн.) + 2Na+ (водн.) + О2- (водн.) = 2Na+ (водн.) + SO42- (водн.) +H2O (L)
) + SO42- (водн.) + 2Na+ (водн.) + О2- (водн.) = 2Na+ (водн.) + SO42- (водн.) +H2O (L) - Отмените ионы спектатора (SO42-На+), которые появляются в обеих частях уравнения, чтобы прийти к чистому ионному уравнению.
- Таким образом, результирующее ионное уравнение имеет вид
- 2H+(Водно) + О2- (Водно) = Н2O (L)
H
2SO4 + На2О сопряженные пары- Сопряженное основание H2SO4 это HSO4–
- Нет сопряженные пары в На2О, будучи основанием, производит воду, которая также является основанием.
H
2SO4 + На2О межмолекулярные силы- Водородная связь, ионные, диполь-дипольные и ван-дер-ваальсовы дисперсионные силы межмолекулярные силы в H2SO4.

- В Na существует сильная электростатическая сила притяжения.2O между противоположно заряженными ионами натрия и ионами оксида.
H
2SO4 + На2О энтальпия реакцииH2SO4 + На2О энтальпия реакции -2629.3 кДж/моль, а отрицательный знак указывает на то, что в ходе этой реакции выделяется тепло.
Н
2SO4 + На2О буферный раствор?H2SO4 + На2О не является буферный раствор поскольку реакционная смесь содержит H2SO4, сильная кислота и Na2О, сильный основной оксид.
Н
2SO4 + На2О полной реакции?H2SO4 + На2O является полной реакцией, так как все реагенты полностью расходуются при равновесии реакции.
Н
2SO4 + На2О экзотермическая реакция?H2SO4 + На2О является экзотермическая реакция, так как реакция завершается с энергией, выделяющейся в ходе реакции.
Н
2SO4 + На2О окислительно-восстановительная реакция?H2SO4 + На2О не является окислительно-восстановительный потенциал реакции, так как степени окисления всех участвующих элементов остаются одинаковыми.
Н
2SO4 + На2О реакция осаждения?Реакция Н2SO4 + Na2O не является реакцией осаждения, так как образующаяся соль сульфата натрия растворима в воде. и сразу же диссоциирует на составляющие его ионы.
Н
2SO4 + На2О необратимая реакция?H2SO4 + На2О является необратимый реакция, потому что в равновесии реагенты полностью превращаются в Na2SO4; следовательно, обратной реакции не наблюдается.
Н
2SO4 + На2О реакции смещения?Реакция между H2SO4 + На2О является примером реакция двойного вытеснения, поскольку ионы сульфата и оксида заменяются ионами натрия и водорода соответственно.
Двойная реакция смещения ЗаключениеNa2O — оксид металла, используемый в стекольной и керамической промышленности, а H2SO4это сильная кислота, широко используемая в производстве удобрений и химической промышленности.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
Пользуйтесь нашим приложением
What, How to Balance & FAQs —
Вишнуприя Тадури
Оксид натрия и серная кислота являются неорганическими соединениями. Na 2 O существует в твердой форме, тогда как H 2 SO 4 представляет собой сиропообразную жидкость. Дайте нам знать больше о реакции H 2 SO 4 и Na 2 O .
Na 2 O существует в твердой форме, тогда как H 2 SO 4 представляет собой сиропообразную жидкость. Дайте нам знать больше о реакции H 2 SO 4 и Na 2 O .
Na 2 O — сильный основной оксид белого цвета, растворимый в воде. Он имеет антифлюоритовую кристаллическую структуру. Н 2 SO 4 представляет собой бесцветную сильную кислоту и действует как хороший обезвоживающий агент. При добавлении H 2 SO 4 к Na 2 O происходит реакция сильной кислоты и сильного основания.
В этой статье мы обсудим некоторые факты о кислотно-щелочной реакции, H 2 SO 4 + Na 2 O, например, образующийся продукт, тип реакции, метод уравновешивания, межмолекулярный сила притяжения и т. д.
Что является продуктом H
2 SO 4 и Na 2 O? Сульфат натрия и вода получаются при добавлении Na 2 O к H 2 SO 4 .
NA 2 O + H 2 SO 4 — -> NA 2 SO 4 + H 2 O
Что тип реакции является H
2 6. SO 4 + Na 2 O?На 2 O + H 2 SO 4 является кислотно-щелочной реакцией, так как в качестве продуктов образуются соль и вода.
Как сбалансировать H
2 SO 4 + Na 2 O?Уравнение балансируется с помощью следующих шагов.
NA 2 O+ H 2 SO 4 = NA 2 SO 4 + H 2 O
- Примечание. Каждый и каждый элемент, вовлеченный в реакцию, реакция, Реакция, Реакция, Реакция, Реакция, Реакция, Реакция. как со стороны реагента, так и со стороны продукта.
| Element | Reactant side | Product side |
|---|---|---|
| Na | 2 | 2 |
| S | 1 | 1 |
| O | 5 | 5 |
| H | 2 | 2 |
- Число элементов каждой стороны реакции должно быть одинаковым и равным.
 Следовательно, реакция является самоуравновешенной.
Следовательно, реакция является самоуравновешенной. - Na 2 O+ H 2 SO 4 = Na 2 SO 4 + H 2 O
H
2 SO 4 + Na 2 O титрованиеH 2 SO 4 и Na 2 O следует за титрованием сильной кислоты сильным основанием. Прочность Na 2 O определяется с помощью следующей процедуры.
АппаратураБюретка, подставка для бюреток, коническая колба, мерный стакан, пипетка 20 мл и химический стакан.
ИндикаторВ качестве индикатора используется фенолфталеин.
Процедура- Стандартизированный H 2 SO 4 берут в бюретку, а в коническую колбу Na
6 O 90.

- Титрование начинают с медленного добавления капель H 2 SO 4 , а индикатор фенолфталеин добавляют в середине титрования.
- Титрование продолжают до тех пор, пока бесцветный раствор не станет розовым. Говорят, что это точка эквивалентности.
- с использованием формулы V 1 S 1 = V 2 S 2 , оцените неизвестную прочность NA 2 O.
H
2 SO 9000 4 4 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9 000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 9000 + 5. 2 О чистое ионное уравнениеЧистое ионное уравнение для реакции H 2 SO 4 + NA 2 O IS —
2H + (AQ) 9 9 9 9 9 9 9 9 9 9 9 9 9
9 + . — (водный) = H 2 O (л)
— (водный) = H 2 O (л) со своими состояниями. Полное ионное уравнение H 2 SO 4 + NA 2 o IS-
 99199999999999999999919919919919919919999999999999999999991900 2 2 (AQ) + 2 )
99199999999999999999919919919919919919999999999999999999991900 2 2 (AQ) + 2 )H
2 SO 4 + NA 2 O Конъюгатные пары- Конъюгатное основание H 2 SO 4 IS HSO 4 — 5913 9001 9003 9001. . 9001. 9032. 9032. 9001. —
H
2 SO 4 + Na 2 O межмолекулярные силы- Силы водородной связи, ионные, диполь-дипольные и Ван-дер-Ваальсовы дисперсионные силы — межмолекулярные силы 5 2 0 905 H 4

H
2 SO 4 + Na 2 Энтальпия реакции OH 2 SO 4 + Na 2 Энтальпия реакции O равна -2629,3 кДж/моль, отрицательный знак указывает на то, что в ходе этой реакции выделяется тепло.
Является ли H
2 SO 4 + Na 2 O буферным раствором?H 2 SO 4 + Na 2 O не является буферным раствором потому что реакционная смесь содержит H 2 SO 4 , сильная кислота, и Na 2 O, сильный основной оксид.
Является ли H
2 SO 4 + Na 2 O полной реакцией?H 2 SO 4 + Na 2 O является полной реакцией, так как все реагенты полностью расходуются при равновесии реакции.
Является ли H
2 SO 4 + Na 2 O экзотермической реакцией? Н 2 SO 4 + Na 2 O является экзотермической реакцией, так как реакция завершается с выделением энергии во время реакции.
Является ли H
2 SO 4 + Na 2 O окислительно-восстановительной реакцией?H 2 SO 4 + Na 2 O не является окислительно-восстановительной реакцией, поскольку степени окисления всех участвующих элементов остаются одинаковыми.
Является ли H
2 SO 4 + Na 2 O реакцией осаждения?Реакция H 2 SO 4 + Na 2 O не является реакцией осаждения, так как образующийся сульфат натрия растворим в воде и сразу же диссоциирует на составляющие его ионы.
Is H
2 SO 4 + Na 2 O необратимая реакция? H 2 SO 4 + Na 2 O является необратимой реакцией, поскольку при равновесии реагенты полностью превращаются в Na 2 СО 4 ; следовательно, обратной реакции не наблюдается.
Является ли H
2 SO 4 + Na 2 O реакцией замещения?Реакция между H 2 SO 4 + Na 2 O является примером реакции двойного замещения, поскольку ионы сульфата и оксида заменяются ионами натрия и водорода соответственно.
Реакция двойного смещения ВыводNa 2 O представляет собой оксид металла, используемый в стекольной и керамической промышленности, а H 2 SO 4 представляет собой сильную кислоту, широко используемую в производстве удобрений и химической промышленности.
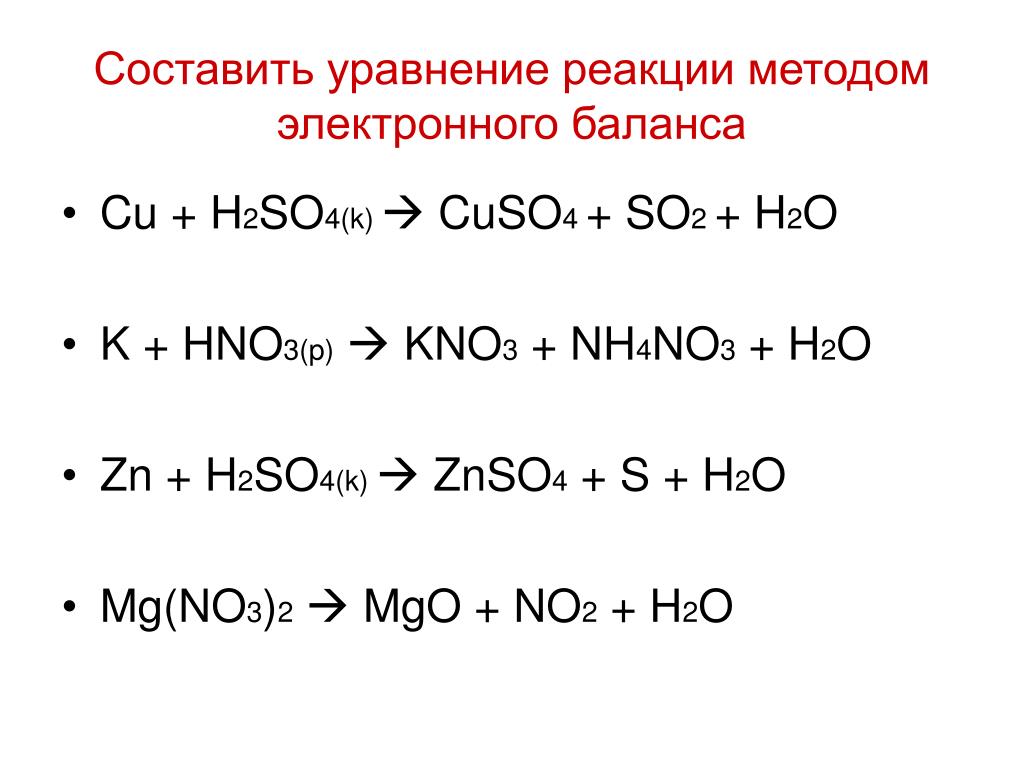
Кислотно-щелочное поведение оксидов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3665
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждаются реакции оксидов элементов периода 3 (натрия в хлор) с водой и, где это уместно, с кислотами или основаниями (как и прежде, аргон опущен, поскольку он не образует оксид).
Краткий обзор тенденции
Оксиды: Оксиды, представляющие интерес, приведены ниже:
| Нет 2 О | MgO | Алюминий 2 О 3 | SiO 2 | Р 4 О 10 | SO 3 | Класс 2 О 7 |
| С 4 О 6 | SO 2 | Класс 2 О |
Тенденцию кислотно-щелочного поведения можно резюмировать следующим образом:
Кислотность возрастает слева направо, от сильно основных оксидов слева до сильнокислых справа, с амфотерным оксидом (оксидом алюминия) в середине.
Амфотерный оксид — это тот, который проявляет как кислотные, так и основные свойства.
Эта тенденция относится только к высшим оксидам отдельных элементов (см. верхнюю строку таблицы) в самых высоких степенях окисления этих элементов. Для других оксидов картина менее ясна. Кислотность оксида неметалла определяется с точки зрения кислых растворов, образующихся в реакциях с водой, например, триоксид серы реагирует с водой с образованием серной кислоты. Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия, как подробно описано ниже.
Оксид натрия
Оксид натрия представляет собой простой сильноосновный оксид. Он является основным, поскольку содержит ион оксида O 2-, который является очень сильным основанием с высокой склонностью к соединению с ионами водорода.
Реакция с водой : Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. Концентрированный раствор оксида натрия в воде будет иметь pH 14.
Концентрированный раствор оксида натрия в воде будет иметь pH 14.
\[ Na_2O + H_2O \rightarrow 2NaOH\]
Реакция с кислотами: Будучи сильным основанием, оксид натрия также реагирует с кислотами. Например, он реагирует с разбавленной соляной кислотой с образованием раствора хлорида натрия.
\[Na_2O + 2HCl \rightarrow 2NaCl + H_2O\]
Оксид магния
Оксид магния — еще один простой основной оксид, который также содержит оксидные ионы. Однако он не такой сильно основной, как оксид натрия, потому что ионы оксида не так слабо связаны. В оксиде натрия твердое тело удерживается вместе за счет притяжения между ионами 1+ и 2-. В оксиде магния притяжение находится между 2+ и 2- ионами. Из-за более высокого заряда металла требуется больше энергии, чтобы разорвать эту ассоциацию. Даже принимая во внимание другие факторы (такие как энергия, высвобождаемая при ионно-дипольных взаимодействиях между катионами и водой), чистый эффект заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции с оксидом натрия.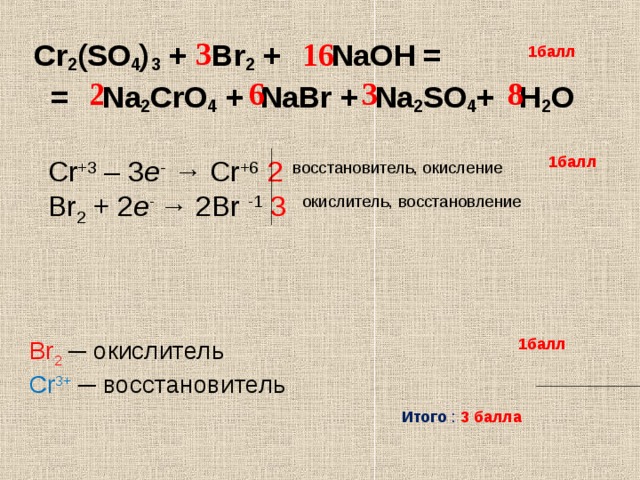
Реакция с водой: На первый взгляд, порошок оксида магния не реагирует с водой. Однако рН полученного раствора составляет около 9, что указывает на образование ионов гидроксида. На самом деле в реакции образуется некоторое количество гидроксида магния, но, поскольку эти соединения почти нерастворимы, на самом деле растворяется небольшое количество гидроксид-ионов. Реакция показана ниже:
\[MgO + H_2O \rightarrow Mg(OH)_2\]
Реакция с кислотами: Оксид магния реагирует с кислотами, как предсказано для простого оксида металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
\[MgO + 2HCl \rightarrow MgCl_2+H_2O\]
Оксид алюминия
Описание свойств оксида алюминия может привести к путанице, поскольку он существует в различных формах. Одна из этих форм очень нереактивна (химически известна как альфа-Al 2 O 3 ) и образуется при высоких температурах. Следующие реакции относятся к более реакционноспособным формам молекулы. Оксид алюминия амфотерен. Он вступает в реакцию как с основанием, так и с кислотой.
Следующие реакции относятся к более реакционноспособным формам молекулы. Оксид алюминия амфотерен. Он вступает в реакцию как с основанием, так и с кислотой.
Реакция с водой: Оксид алюминия нерастворим в воде и не вступает в реакцию, как оксид натрия и оксид магния. Оксидные ионы слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой.
Реакция с кислотами: Оксид алюминия содержит оксид-ионы и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Оксид алюминия реагирует с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия.
\[Al_2O_3 + 6HCl \rightarrow 2AlCl_3 + 3H_2O\]
Эта и другие реакции демонстрируют амфотерную природу оксида алюминия.
Реакция с основаниями: Оксид алюминия также проявляет кислотные свойства, что проявляется в его реакциях с основаниями, такими как гидроксид натрия. Существуют различные алюминаты (соединения, в которых алюминий является компонентом отрицательного иона), что возможно, поскольку алюминий может образовывать ковалентные связи с кислородом. Это возможно потому, что разница электроотрицательностей между алюминием и кислородом мала, в отличие, например, от разницы между натрием и кислородом (электроотрицательность увеличивается по периоду)
Это возможно потому, что разница электроотрицательностей между алюминием и кислородом мала, в отличие, например, от разницы между натрием и кислородом (электроотрицательность увеличивается по периоду)
Оксид алюминия вступает в реакцию с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора тетрагидроксоалюмината натрия:
\[Al_2O_3 + 2NaOH +3H_2O \rightarrow 2NaAl(OH)_4\]
Диоксид кремния (оксид кремния(IV))
Кремний слишком похож по электроотрицательности на кислород, чтобы образовывать ионные связи. Следовательно, поскольку диоксид кремния не содержит ионов оксида, он не обладает основными свойствами. На самом деле он очень слабокислотный, реагирующий с сильными основаниями.
Реакция с водой: Диоксид кремния не вступает в реакцию с водой из-за термодинамической трудности разрушения его сетчатой ковалентной структуры.
Реакция с основаниями : Диоксид кремния реагирует с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора силиката натрия:
\[SiO_2 + 2NaOH \rightarrow Na_2SiO_3 + h3O\]
В другом примере кислого диоксида кремния Реагируя с основанием, извлечение железа из доменной печи, оксид кальция из известняка реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция:
\[SiO_2 + CaO \rightarrow CaSiO_3\]
Оксиды фосфора
Два оксида фосфора, оксид фосфора(III), P 4 O 6 , и оксид фосфора(V), P
6 O 4 10
, учитываются здесь.
Оксид фосфора(III): Оксид фосфора(III) реагирует с холодной водой с образованием раствора слабой кислоты, H 3 PO 3 — известный как фосфористая кислота, ортофосфорная кислота или фосфоновая кислота:
\[P_4O_6 + 6H_2O \стрелка вправо 4H_3PO_3\]
Структура полностью протонированной кислоты показана ниже:
Протоны остаются связанными до тех пор, пока не будет добавлена вода; даже в этом случае, поскольку фосфористая кислота является слабой кислотой, несколько молекул кислоты депротонируются. Фосфористая кислота имеет pK a 2,00, что является более кислым, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76).
Оксид фосфора(III) вряд ли будет реагировать непосредственно с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислыми, а третий атом водорода — нет. Следовательно, есть две возможные реакции с основанием, таким как гидроксид натрия, в зависимости от количества добавленного основания:
\[ NaOH + H_3PO_3 \rightarrow NaH_2PO_3 + H_2O\]
\[ 2NaOH + H_3PO_3 \rightarrow Na_2HPO_3 + 2H_2O\]
В первой реакции только один из протонов реагирует с гидроксид-ионами основания. Во втором случае (при использовании вдвое большего количества гидроксида натрия) реагируют оба протона.
Во втором случае (при использовании вдвое большего количества гидроксида натрия) реагируют оба протона.
Если вместо оксида фосфора(III) непосредственно реагировать с раствором гидроксида натрия, возможны те же соли:
\[4NaOH + P_4O_6 + 2H_2O \rightarrow 4NaH_2PO_3\]
\[9NaOH + P_4O_6 \rightarrow 4Na_2HPO_3 + 2H_2O\]
Оксид фосфора(V): Оксид фосфора(V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которых зависит от условия реакции. Обычно рассматривается только одна кислота, фосфорная (V) кислота, H 3 PO 4 (также известная как фосфорная кислота или ортофосфорная кислота).
\[P_4O_{10} + 6H_2O \rightarrow 4H_3PO_4\]
На этот раз полностью протонированная кислота имеет следующую структуру:
Фосфорная(V) кислота – еще одна слабая кислота с pK a 2,15, что немного слабее фосфористой кислоты. Растворы каждой из этих кислот с концентрацией около 1 моль дм -3 имеют рН около 1.
Оксид фосфора (V) также вряд ли будет непосредственно реагировать с основанием, но рассматриваются гипотетические реакции. В кислотной форме молекула имеет три кислотные группы -OH, которые могут вызвать трехстадийную реакцию с гидроксидом натрия:
\[ NaOH + H_3PO_4 \rightarrow NaH_2PO_4 + H_2O\]
\[ 2NaOH + H_3PO_4 \rightarrow Na_2HPO_4 + 2H_2O\]
\[ 3NaOH + H_3PO_4 \rightarrow Na_3PO_4 + 3H_2O03] Аналогично фосфору оксид, при непосредственном взаимодействии оксида фосфора(V) с раствором гидроксида натрия образуется та же возможная соль, что и на третьей стадии (и только эта соль):
\[12NaOH + P_4O_{10} \rightarrow 4Na_3PO_4 + 6H_2O\]
Оксиды серы
Рассматриваются два оксида: диоксид серы, SO 2 и триоксид серы, SO 3 .
Двуокись серы: Двуокись серы хорошо растворяется в воде, реагируя с образованием раствора сернистой кислоты (также известной как серная (IV) кислота), H 2 SO 3 , как показано в приведенной ниже реакции. Этот вид существует только в растворе, и любая попытка выделить его выделяет диоксид серы.
Этот вид существует только в растворе, и любая попытка выделить его выделяет диоксид серы.
\[ SO_2 + H_2O \rightarrow H_2SO_3\]
Протонированная кислота имеет следующую структуру:
Сернистая кислота также является относительно слабой кислотой с pK и около 1,8, но немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты имеет рН около 1.
Диоксид серы также непосредственно реагирует с основаниями, такими как раствор гидроксида натрия. При барботировании диоксида серы через раствор гидроксида натрия сначала образуется раствор сульфита натрия, а затем раствор гидросульфита натрия, если диоксида серы в избытке.
\[ SO_2 + 2NaOH \rightarrow Na_2SO_3 + H_2O\]
\[Na_2SO_3 + H_2O \rightarrow 2NaHSO_3\]
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (также известного как сульфат кальция). (IV)). Это один из важных методов удаления диоксида серы из дымовых газов на электростанциях.
\[CaO + SO_2 \rightarrow CaSO_3\]
Триоксид серы: Триоксид серы бурно реагирует с водой с образованием тумана из капель концентрированной серной кислоты. 9{2-} (водн.)\]
Это полезно, если вы понимаете, почему серная кислота является более сильной кислотой, чем сернистая кислота. Вы можете применить те же рассуждения и к другим кислотам, которые вы найдете на этой странице.
Серная кислота сильнее серной кислоты, потому что, когда ион водорода теряется из одной из групп -ОН серной кислоты, отрицательный заряд, остающийся на кислороде, распределяется (делокализуется) по иону за счет взаимодействия с двойной связью атомы кислорода. Из этого следует, что большее количество атомов кислорода с двойными связями в ионе делает возможной большую делокализацию; большая делокализация приводит к большей стабильности, что снижает вероятность рекомбинации иона с ионом водорода и превращения в неионизированную кислоту.
Сернистая кислота имеет только одну двойную связь кислорода, тогда как серная кислота имеет две; дополнительная двойная связь обеспечивает гораздо более эффективную делокализацию, гораздо более стабильный ион и более сильную кислоту. Серная кислота проявляет все реакции, характерные для сильной кислоты. Например, при реакции с гидроксидом натрия образуется сульфат натрия; в этой реакции оба кислых протона реагируют с гидроксид-ионами, как показано:
Серная кислота проявляет все реакции, характерные для сильной кислоты. Например, при реакции с гидроксидом натрия образуется сульфат натрия; в этой реакции оба кислых протона реагируют с гидроксид-ионами, как показано:
\[2NaOH +H_2SO_4 \rightarrow Na_2SO_4 + 2H_2O\]
В принципе гидросульфат натрия можно получить, используя вдвое меньше гидроксида натрия; при этом удаляется только один из кислых атомов водорода.
Сам триоксид серы также непосредственно реагирует с такими основаниями, как оксид кальция, с образованием сульфата кальция:
\[ CaO + SO_3 \rightarrow CaSO_4\]
Эта реакция аналогична реакции с диоксидом серы, рассмотренной выше.
Оксиды хлора
Хлор образует несколько оксидов, но только два из них (оксид хлора(VII), Cl 2 O 7 , и оксид хлора(I), Cl 2 O) рассматриваются здесь. Оксид хлора (VII) также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора.
Оксид хлора(VII): Оксид хлора(VII) является высшим оксидом хлора — атом хлора находится в максимальной степени окисления +7. Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой с образованием очень сильной кислоты, хлорной (VII) кислоты, также известной как хлорная кислота.
Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой с образованием очень сильной кислоты, хлорной (VII) кислоты, также известной как хлорная кислота.
\[ Cl_2O_7 + H_2O \rightarrow 2HClO_4\]
Как и в серной кислоте, рН типичных растворов хлорной кислоты около 0. Нейтральная хлорная(VII) кислота имеет следующую структуру:
Когда ион хлората(VII) (перхлорат-ион) образуется в результате потери протона (например, в реакции с водой), заряд делокализуется по каждому атому кислорода в ионе. Это делает ион очень стабильным, что делает хлорную (VII) кислоту очень сильной.
Хлорная(VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия(VII):
\[ NaOH + HClO_4 \rightarrow NaClO_4 + h3O\]
Сам оксид хлора(VII) также непосредственно реагирует с натрием раствор гидроксида с получением того же продукта: 9-\), также известный как хлорноватистая кислота.

 Следовательно, реакция является самоуравновешенной.
Следовательно, реакция является самоуравновешенной.
 ) + SO42- (водн.) + 2Na+ (водн.) + О2- (водн.) = 2Na+ (водн.) + SO42- (водн.) +H2O (L)
) + SO42- (водн.) + 2Na+ (водн.) + О2- (водн.) = 2Na+ (водн.) + SO42- (водн.) +H2O (L)
 04.16
04.16 Следовательно, реакция является самоуравновешенной.
Следовательно, реакция является самоуравновешенной. 
 Амфотерный оксид — это тот, который проявляет как кислотные, так и основные свойства.
Амфотерный оксид — это тот, который проявляет как кислотные, так и основные свойства.