Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Окислительные свойства серной кислоты | Дистанционные уроки
29-Дек-2014 | комментариев 5 | Лолита Окольнова
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
Разбавленная серная ведет себя, как и остальные кислоты, окислительные свои возможности прячет:
Zn + h3SO4 → ZnSO4 + h3↑
Автор статьи — Саид Лутфуллин
И еще, что надо помнить про разбавленную серную кислоту: она не реагирует со свинцом. Кусок свинца, брошенный в разбавленную h3SO4 покрывается слоем нерастворимого (см. таблицу растворимости) сульфата свинца и реакция моментально прекращается.
таблицу растворимости) сульфата свинца и реакция моментально прекращается.
Pb + h3SO4 ≠
Концентрированная серная кислота – тяжелая маслянистая жидкость, не летучая, не имеет вкуса и запаха
За счет серы в степени окисления +6(высшей) серная кислота приобретает сильные окислительные свойства.
Правило для задания 24 (по-старому А24) при приготовлении растворов серной кислоты никогда нельзя в нее лить воду. Концентрированую серную кислоту нужно тонкой струйкой вливать в воду, постоянно помешивая.
Взаимодействие концентрированной серной кислоты с металлами
Эти реакции строго стандартизированны и идут по схеме:
h3SO4(конц.) + металл → сульфат металла + h3O + продукт восстановленной серы.
Есть два нюанса:
1) Алюминий, железо и хром с h3SO4 (конц) в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
Нужно нагреть.
2) С платиной и золотом h3SO4 (конц) не реагирует вообще.
Сера в концентрированной серной кислоте
– окислитель
- значит, сама будет восстанавливаться;
- то, до какой степени окисления будет восстанавливаться сера, зависит от металла.
Рассмотрим диаграмму степеней окисления серы:
- До -2 серу могут восстановить только очень активные металлы — в ряду напряжений до алюминия включительно.
Реакции будут идти вот так:
8Li + 5H2SO4(конц.) → 4Li2SO4 + 4H2O + H2S↑
4Mg + 5H2SO4(конц.) → 4MgSO4 + 4H2O + H2S↑
8Al + 15H2SO4(конц. ) (t)→ 4Al2(SO4)3 + 12H2O + 3H 2S↑
) (t)→ 4Al2(SO4)3 + 12H2O + 3H 2S↑
- при взаимодействии h3SO4 (конц) с металлами в ряду напряжений после алюминия, но до железа, то есть с металлами со средней активностью сера восстанавливается до 0:
3Mn + 4H2SO4(конц.) → 3MnSO4 + 4H2O + S↓
2Cr + 4H2SO4(конц.) (t)→ Cr2(SO4)3 + 4H2O + S↓
3Zn + 4H2SO4(конц.) → 3ZnSO4 + 4H2O + S↓
- все остальные металлы, начиная с железа в ряду напряжений (включая те, что после водорода, кроме золота и платины, конечно), могут восстановить серу только до +4. Так как это малоактивные металлы:
2Fe + 6H2SO4(конц.) (t)→ Fe2(SO4)3 + 6H2O + 3SO
(обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем)
Cu + 2H2SO4(конц. ) → CuSO4 + 2H2O + SO2↑
) → CuSO4 + 2H2O + SO2↑
2Ag + 2H2SO4(конц.) → Ag2SO4 + 2H2O + SO2↑
Конечно, все относительно. Глубина восстановления будет зависеть от многих факторов: концентрации кислоты (90%, 80%, 60%), температуры и т.д. Поэтому совсем уж точно предсказать продукты нельзя. Приведенная выше таблица тоже имеет свой процент приблизительности, но пользоваться ей можно. Еще необходимо помнить, что в ЕГЭ, когда продукт восстановленной серы не указан, и металл не отличается особой активностью, то, скорее всего, составители имеют в виду SO 2. Нужно смотреть по ситуации и искать зацепки в условиях.
SO2 – это вообще частый продукт ОВР с участием конц. серной кислоты.
h3SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO2:
Сера при этом тоже восстанавливается до SO2:
C + 2H2SO4(конц.) → CO2↑ + 2H2O + 2SO2↑
2P + 5H2SO4(конц.) → P2O5 + 5H2O + 5SO2↑
Свежеобразованный оксид фосфора (V) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу:
2P + 5H2SO4(конц) → 2H3PO4 + 2H2O + 5SO2↑
То же самое с бором, он превращается в ортоборную кислоту:
2B + 3H2SO4(конц) → 2H3BO3 + 3SO2↑
Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). В рамках ЕГЭ рассматривается взаимодействиеh3SO4 (конц) с серой (простым веществом) и сероводородом.
Начнем с взаимодействия серы (простого вещества) с концентрированной серной кислотой. В простом веществе степень окисления 0, в кислоте +6. В этой ОВР сера +6 будет окислять серу 0. Посмотрим на диаграмму степеней окисления серы:
Сера 0 будет окисляться, а сера +6 будет восстанавливаться, то есть понижать степень окисления. Будет выделяться сернистый газ:
2H2SO4(конц.) + S → 3SO2↑ + 2H2O
Но в случае с сероводородом:
Образуется и сера (простое вещество), и сернистый газ:
H2SO4(конц.) + H2S → S↓ + SO2↑ + 2H2O
Этот принцип часто может помочь в определении продукта ОВР, где окислитель и восстановитель – один и тот же элемент, в разных степенях окисления. Окислитель и восстановитель «идут навстречу друг другу» по диаграмме степеней окисления.
h3SO4 (конц) , так или иначе, взаимодействует с галогенидами. Только вот тут надо понимать, что фтор и хлор – «сами с усами» и с фторидами и хлоридами ОВР не протекает, проходит обычный ионно-обменный процесс, в ходе которого образуется газообразный галогеноводород:
CaCl2 + H2SO4(конц.) → CaSO4 + 2HCl↑
CaF2 + H2SO4(конц.) → CaSO4 + 2HF↑
А вот галогены в составе бромидов и иодидов (как и в составе соответствующих галогеноводородов) окисляются ей до свободных галогенов. Только вот сера восстанавливается по-разному: иодид является более cильным восстановителем, чем бромид. Поэтому иодид восстанавливает серу до сероводорода, а бромид до сернистого газа:
2H2SO4(конц.) + 2NaBr → Na2SO4 + 2H2O + SO2↑ + Br2
H2SO4(конц. ) + 2HBr → 2H2O + SO2↑ + Br2
) + 2HBr → 2H2O + SO2↑ + Br2
5H2SO4(конц.) + 8NaI → 4Na2SO4 + 4H2O + H2S↑ + 4I2↓
H2SO4(конц.) + 8HI → 4H2O + H2S↑ + 4I2↓
Хлороводород и фтороводород (как и их соли) устойчивы к окисляющему действию h3SO4 (конц).
И наконец, последнее: для концентрированной серной кислоты это уникально, больше никто так не может. Она обладает водоотнимающим свойством.
Это позволяет использовать концентрированную серную кислоту самым разным образом:
Во-первых, осушение веществ. Концентрированная серная кислота забирает воду от вещества и оно «становится сухим».
Во-вторых, катализатор в реакциях, в которых отщепляется вода (например, дегидратация и этерификация):
H3C–COOH + HO–CH3 (H2SO4(конц. ))→ H3C–C(O)–O–CH3 + H2O
))→ H3C–C(O)–O–CH3 + H2O
H3C–CH2–OH (H2SO4(конц.))→ H2C=CH2 + H2O
- Подписка на рассылку
(Правила комментирования)
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
FeSO4+KClO3+h3SO4=Fe2(SO4)3+KCl+h3O
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
какую массу карбоната кальция следует добавить к 300 граммам раствора азотной кислоты с массовой долей 60%, чтобы массовая доля кислоты уменьшилась до 20 %?
Решено
ИЗ С2h3 ПОЛУЧИТЬ C6H6 Из. ..
..
Смесь углекислого газа и газа Х имеет относительную плотность по гелию равную 11,2. При пропускании исходной смеси через склянку с раствором перекиси
Пользуйтесь нашим приложением
Проверочная работа «Сера и её соединения»
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 1
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Для серы характерна степень окисления:
1. -2 2. -3 3. -4 4. +7
Сера – более сильный окислитель, чем
1. Фтор 2. Хлор 3. Фосфор 4. Кислород
Степени окисления серы изменяются в последовательности +6, -2, 0 в группе веществ
1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
Схема превращения S+6 → S+4 соответствует уравнению реакции
1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3
SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3
2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O
Раствор серной кислоты может взаимодействовать со всеми веществами группы
1. MgO, CO2, NaCl, Fe(OH)3 3. NaOH, ZnO, Cu, Na2CO3
2. CuO, Fe, HNO3, NaOH Mg(OH)2, 4. BaCl2, FeO, Zn, KOH
И сернистый газ, и оксид серы (VI) будут реагировать со следующей парой веществ
1. Н2О и СО2 2. NaOH и CaO 3. h3O и Cl2 4. h3S и О2
Для осуществления превращения H2S→SO2→SO3→ K2SO4 нужно последовательно использовать
1. Воду, кислород, оксид калия 3. Кислород, воду, калий
2. Кислород, кислород, гидроксид калия 4. Воду, кислород, карбонат калия
Качественную реакцию на сульфат-анион можно представить сокращённым ионным уравнением
1. 2H+ + SO42- → h3SO4 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. S2- + 2H+ → h3S
2H+ + SO42- → h3SO4 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. S2- + 2H+ → h3S
Газ с запахом тухлых яиц, образующий при растворении в воде слабую кислоту, называется
1. Сернистый 2. Угарный 3. Сероводород 4. Хлор
Верны ли следующие утверждения о свойствах серы и её соединений?
А. Самой устойчивой аллотропной модификацией серы является ромбическая.
Б. Чтобы приготовить раствор серной кислоты, нужно в концентрированную кислоту вливать воду.
1. Верно А 2. Верно Б 3. Оба суждения верны 4. Оба суждения неверны
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду S – Se – Te
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции |
1 | h3S + O2 (избыток) → | 1 | не взаимодействует |
2 | Ag + h3SO4 (разб) → | 2 | h3O + S |
3 | SO2 + NaOН(избыток) → | 3 | NaHSO3 |
4 | Fe + S → | 4 | Na2SO3 + h3O |
| 5 | Ag2SO4 + h3↑ | |
6 | Fe2S3 | ||
7 | h3O + SO2↑ | ||
8 | FeS | ||
Часть С Задания со свободным ответом (10 баллов)
(4 балла) Через 240 г 10% раствора гидроксида натрия пропускают сернистый газ объёмом 5,6 л. Определить массу полученной соли. (Ответ: 31,5 г.)
Определить массу полученной соли. (Ответ: 31,5 г.)
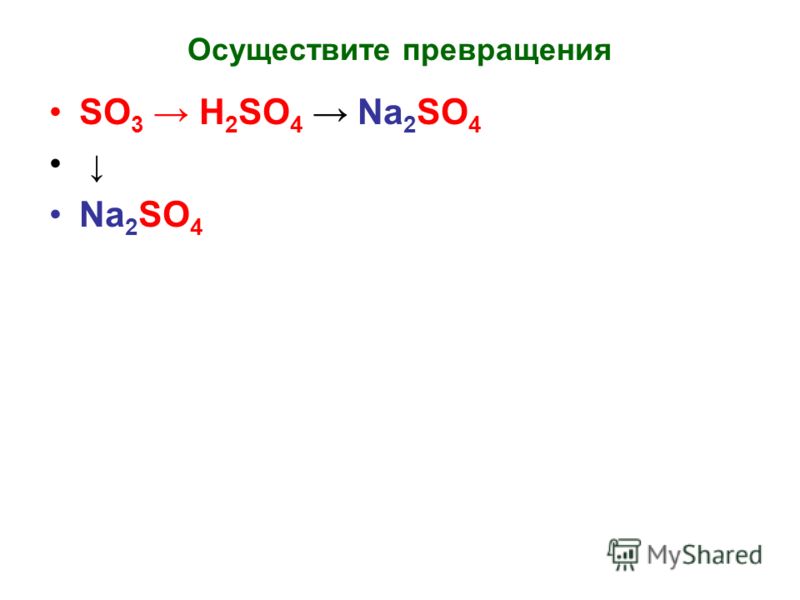
( 5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
S → h3S → Na2S → PbS Для последней реакции составьте уравнение в сокращённой ионной форме, укажите цвет образовавшегося осадка.
(3 балла) Для реакции h3SO4(конц.) + Zn → …. + h3S + h3O определить коэффициенты методом
электронного баланса, указать окислитель и восстановитель.
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 2
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Для серы нехарактерна степень окисления:
1. -2 2. -4 3. +4 4. +6
Сера является восстановителем в реакции с:
1. Фтором 2. Железом 3. Натрием 4. Водородом
Степени окисления серы изменяются в последовательности +6, +4, -2 в группе веществ
1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S
Схема превращения S+6 → S-2 соответствует уравнению реакции
1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3S + h3O
2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O
Раствор серной кислоты может взаимодействовать со всеми веществами группы
1. MgO, SO2, NaCl, Fe(OH)3 3. Fe(OH)3, CaO, Zn, K2SO3
2. CuO, Ag, HNO2, NaOH 4. Ba(OH)2, NaCl, FeO, Zn
И сернистый газ, и серная кислота будут реагировать со следующей парой веществ
1. Н2О и СО2 2. КOH и MgO 3. h3O и SO3 4. Na2S и О2
Для осуществления превращения S→SO2→SO3→ BaSO4 нужно последовательно использовать
1. Воду, кислород, оксид бария 3. Кислород, кислород, гидроксид бария
2. Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария
Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария
Качественную реакцию на сульфит-анион можно представить сокращённым ионным уравнением
1. Pb2+ + S2-→PbS 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. 2H+ + SO32- → SO2 + h3O
Газ с запахом горящих спичек, образующий при растворении в воде слабую кислоту, называется
1. Сернистый 2. Угарный 3. Сероводород 4. Фтор
Верны ли следующие утверждения о свойствах серы и её соединений?
А. Пластическую серу можно получить при нагревании и последующем охлаждении ромбической серы.
Б. Раствор сернистого газа в концентрированной серной кислоте называется «олеум».
1. Верно А 2. Верно Б 3. Оба суждения верны 4. Оба суждения неверны
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду Р – S – Cl
В ряду Р – S – Cl
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции |
1 | h3S + O2 (недостаток) → | 1 | не взаимодействует |
2 | Au + h3SO4 (разб) → | 2 | h3O + S |
3 | SO3 + NaOН(избыток) → | 3 | NaHSO4 |
4 | Fe + h3SO4 (разб) → | 4 | Na2SO4 + h3O |
| 5 | Au2SO4 + h3↑ | |
6 | Fe2(SO4)3 + h3↑ | ||
7 | h3O + SO2↑ | ||
8 | FeSO4 + h3↑ | ||
Часть С Задания со свободным ответом (10 баллов)
13. (4 балла) Через 1120 г 5% раствора гидроксида калия пропускают серный ангидрид объёмом 4,48 л. Определить массу полученной соли. (Ответ: 34,8 г.)
(4 балла) Через 1120 г 5% раствора гидроксида калия пропускают серный ангидрид объёмом 4,48 л. Определить массу полученной соли. (Ответ: 34,8 г.)
14. (5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
SО2 → SО3 → h3SО4 → ВаSО4 Для последней реакции составьте уравнение в сокращённой ионной форме, укажите цвет образовавшегося осадка.
15. (3 балла) Для реакции Mg + h3SO4 → …. + S + h3O определить коэффициенты методом электронного баланса, указать окислитель и восстановитель.
Ответы к проверочной работе по теме «Сера и её соединения» 9 класс
№ п/п | Вариант 1 | Балл | № п/п | Вариант 2 | Балл |
1 | 1 | 1 | 1 | 2 | 1 |
2 | 3 | 1 | 2 | 1 | 1 |
3 | 3 | 1 | 3 | 2 | 1 |
4 | 4 | 1 | 4 | 3 | 1 |
5 | 4 | 1 | 5 | 3 | 1 |
6 | 2 | 1 | 6 | 2 | 1 |
7 | 2 | 1 | 7 | 3 | 1 |
8 | 3 | 1 | 8 | 4 | 1 |
9 | 3 | 1 | 9 | 1 | 1 |
10 | 1 | 1 | 10 | 1 | 1 |
11 | 23 | 2 | 11 | 14 | 2 |
12 | 7148 | 2 | 12 | 2148 | 2 |
13 |
| 4 | 13 |
| 4 |
14 |
| 5 | 14 |
| 5 |
15 |
| 3 | 15 |
| 3 |
Критерий: 0-9 = 2, 10-16 =3, 17-23 = 4, 24-26 = 5
Проверочная работа по теме «Сера и её соединения» 9 класс
Вариант 3
Часть А. Задания с выбором одного правильного ответа (10 баллов)
Задания с выбором одного правильного ответа (10 баллов)
1. Распределение электронов по энергетическим уровням в атоме серы:
1) 2, 6 2) 2, 8, 8 3) 2, 8, 6 4) 2, 8, 8, 6
2. Сера — более сильный окислитель, чем:
1) фтор 2)хлор 3) фосфор 4) кислород
3. Степени окисления серы изменяются с +6 до 0 в группе веществ:
1)S, SO2, SO3 2) h3SO4, SO2, h3S 3) Na2SO4, K2S, S 4) SO2, K2SO3, S
4. Раствор серной кислоты может взаимодействовать со всеми веществами из группы:
1) MgO, CO2, NaCl, Fe(OH)3 3) NaOH, ZnO, Cu, Na2CO3
2) CuO, Fe, HNO3, NaOH 4) Mg(OH)2, BaCl2, FeO, Zn
5. Схеме превращения S+6 → S+4 соответствует уравнению реакции:
1) SO3 + h3O = h3SO4 3) h3SO4 + Zn = ZnSO4 + h3
2) 2SO2 + O2 = 2SO3 4) Cu +2h3SO4 = CuSO4 + SO2 + 2h3O
6. И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ:
И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ:
1) h3O , CO2 2) NaOH, CaO 3) h3O, Cl2 4) h3S, O2
7. Для осуществления превращения H2S → SO2 → SO3→ K2SO4 нужно последовательно использовать:
1) воду, кислород, оксид калия 3) кислород, воду, калий
2) кислород, кислород. гидроксид калия 4) воду, кислород, карбонат калия
8. В реакции, уравнение которой H2SO3 + Br2 + H2O= H2SO4 + HBr , сера
1) является восстановителем 3) является окислителем
2) понижает степень окисления 4) не изменяет степень окисления
9. Разбавленная серная кислота не будет взаимодействовать с каждым веществом из следующей пары веществ:
Разбавленная серная кислота не будет взаимодействовать с каждым веществом из следующей пары веществ:
1) CuO, HCl 2) Cu, NaCl 3) Zn, NaOH 4) CuSO4, MgO
10. Верны ли следующие утверждения о свойствах серы и её соединений?
А. Чтобы приготовить раствор серной кислоты, нужно в концентрированную кислоту вливать воду.
Б. Раствор серного ангидрида в концентрированной серной кислоте называется «олеум».
Часть В. Задания на соотнесение и с выбором нескольких вариантов ответа (4 балла)
Выберите два верных суждения. Ответ запишите в виде последовательности цифр без пробелов и запятых (2 балла)
11. В ряду S – Se – Te
1. Уменьшается радиус атома.
2. Усиливаются восстановительные свойства.
3. Уменьшаются кислотные свойства высших оксидов.
4. Увеличивается число электронов на внешнем энергетическом уровне.
5. Уменьшается число энергетических уровней в атоме.
12. Установите соответствие между левой и правой частями уравнения. Ответ представьте в виде последовательности четырёх цифр без пробелов и запятых (2 балла) (цифры могут повторяться!)
№ п/п | Исходные вещества | № п/п | Продукты реакции | ||
1 | h3S + O2 (избыток) → | 1 | не взаимодействует | ||
2 | Ag + h3SO4 (разб) → | 2 | h3O + S | ||
3 | SO2 + NaOН(избыток) → | 3 | NaHSO3 | ||
4 | Fe + S → | 4 | Na2SO3 + h3O | ||
| 5 | Ag2SO4 + h3↑ | |||
6 | Fe2S3 | ||||
7 | h3O + SO2↑ | ||||
8 | FeS | ||||
Часть С Задания со свободным ответом (10 баллов)
(4 балла) Через 120 г 20% раствора гидроксида натрия пропускают сернистый газ объёмом 2,24 л. Определить массу полученной соли.
Определить массу полученной соли.
( 5 баллов) Составьте уравнения реакций, соответствующих схеме превращений:
S → h3S → Na2S → PbS Для последней реакции составьте уравнение в полной и сокращённой ионной форме, укажите цвет образовавшегося осадка.
(3 балла) Для реакции h3SO4 + Zn …. + h3S + h3O определить коэффициенты методом
электронного баланса, указать окислитель и восстановитель.
Ответы к диагностике по сере
3 вариант
1 | 3 | 1 |
2 | 3 | 1 |
3 | 3 | 1 |
4 | 4 | 1 |
5 | 4 | 1 |
6 | 2 | 1 |
7 | 2 | 1 |
8 | 1 | 1 |
9 | 3 | 1 |
10 | Б | 1 |
11 | 23 | 2 |
12 | 7148 | 2 |
13 |
| 4 |
14 |
| 5 |
15 |
| 3 |
Окислительно-восстановительные реакции (ОВР) | Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Характерной особенностью окислительно-восстановительных реакций является изменение степени окисления, по меньшей мере двух атомов: окисление одного (потеря электронов) и восстановление другого (присоединение электронов).
Окисление и восстановление — два полупроцесса, самостоятельное существование каждого из которых невозможно, но их одновременное протекание обеспечивает прохождение окислительно-восстановительного процесса.
Вещества, содержащие атомы, которые понижают свою степень окисления и присоединяют электроны, называются окислителями, а вещества, содержащие атомы, которые повышают степень окисления и отдают электроны — восстановителями.
Еще есть такое шутливое правило:
окислитель — грабитель,
восстановитель — потерпевший.
Если в роли окислителей и восстановителей выступают простые вещества, названия реагентов совпадают с названиями атомов, изменяющих свои степени окисления. Так, в реакции
2Na + Cl2 = 2NaCl
окислителем является простое вещество — хлор, поскольку оно содержит атомы хлора, присоединяющие электроны, а восстановителем — металлический натрий, содержащий атомы натрия, которые отдают электроны.
В реакции
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2 (SО4) 3 + 4K2SO4 + 4H2O
окислителем является дихромат калия, в который входят атомы хрома, присоединяющие электроны, а восстановителем — сульфит калия, в который входят атомы серы, отдающие электроны.
Существуют несколько типов окислительно-восстановительных реакций.
- Межмолекулярные окислительно-восстановительные реакции — атомы, изменяющие свои степени окисления, находятся в разных по своей химической природе атомных или молекулярных частицах. Межмолекулярные процессы составляют наибольшую часть окислительно-восстановительных реакций.
- Внутримолекулярные окислительно-восстановительные реакции — атомы, изменяющие свои степени окисления, находятся в одной и той же молекулярной частице:
2KNO3 = 2KNO2 + О2
В этом случае атомы азота, изменяющие степень окисления от +5 до +3, принимают электроны, а атомы кислорода, степень окисления которых меняется от -2 до 0, их отдают.
Среди внутримолекулярных окислительно-восстановительных реакций выделяют реакции диспропорционирования (самоокисления-самовосстановления). Они сопровождаются одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, первоначально находящихся в одном определенном состоянии. Например, атомы хлора из степени окисления 0 переходят как в степень окисления –1 (KCl), так и в состояние +5 (KClO3):
Например, атомы хлора из степени окисления 0 переходят как в степень окисления –1 (KCl), так и в состояние +5 (KClO3):
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
В реакциях усреднения происходит изменение степени окисления одного и того же элемента с образованием одной и той же молекулы:
2H2S + H2SO3 = 3S + 3H2O
Составление окислительно-восстановительных реакций сводится к подбору коэффициентов при окислителе и восстановителе. Главная закономерность — в окислительно-восстановительных процессах общее число электронов, присоединяемых окислителем, равно общему числу электронов, отдаваемых восстановителем. Следует пользоваться примерно таким алгоритмом подбора коэффициентов (метод электронного баланса).
- Написать схему уравнения без коэффициентов, то есть указать исходные вещества и продукты реакций.
- Найти элементы, изменяющие степень окисления, и цифрами над символами этих элементов указать степень окисления.

- Указать процессы окисления и восстановления с учетом количества атомов элементов, участвующих в этих процессах
- Определить основные коэффициенты при окислителе и восстановителе. Вводят дополнительные множители, устанавливающие электронный баланс. Их подбирают по правилу нахождения наименьшего общего кратного и получают стехиометрические коэффициенты при окислителе и восстановителе.
- Расставляют коэффициенты перед прочими реагентами.
- Проверяют число атомов водорода и кислорода в левой и правой частях уравнения и определяют число участвующих в реакции молекул воды.
Например:
+2 +5 +3 +6 +4
FeS2 + HNO3 = Fe(NO3) 3 + H2SO4 + NO2 + H2O
Записываем полуреакции окисления и восстановления:
+2 +3 -1 +6
Fe – e = Fe , 2S – 14e = 2S, и далее:
+3 +6 +5 +4
FeS2 – 15e = Fe + 2S, N + e = N
Общее кратное 15, ставим его перед NO2 в левой части уравнения, подбираем прочие коэффициенты:
FeS2 + 18HNO3 = Fe(NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
И несколько примеров расстановки коэффициентов методом электронного баланса из заданий ЕГЭ и ЦТ:
Расстановка коэффициентов методом электронного баланса» src=»https://www.youtube.com/embed/-o3Qla1rG7Q?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Сера — химические и физические свойства
Химия
12. 11.21
11.21
8 мин.
Сера – важнейший элемент в современной промышленности.
Оглавление:
- Что такое сера и как она выглядит
- Характеристика серы
- Области применения
- Нахождение серы в природе
- Биологическая роль серы
Особые свойства серы (антисептические и антипаразитарные) делают её незаменимым компонентном многих лекарственных препаратов.
Что такое сера и как она выглядит
Сера – химический элемент, находящийся по 16 номером в таблице Д. И. Менделеева и обозначающийся буквой S (по первой букве латинского названия Sulphur).
Молярная масса серы равна 32, 065 г/моль, атомная масса — 32,066 а. е. м. Это вещество может быть как ярко-желтого, так и коричневого цвета.
Различают порошкообразную (молотую) и жидкую серу.
Характеристика серы
Сера – вещество с переменной степенью окисления. На внешней электронной орбитали серы находятся шесть валентных электронов, для заполнения не хватает ещё двух, поэтому в соединениях с металлами и водородом она проявляет валентность -2.
На внешней электронной орбитали серы находятся шесть валентных электронов, для заполнения не хватает ещё двух, поэтому в соединениях с металлами и водородом она проявляет валентность -2.
При взаимодействии с кислородом и галогенами, т. е. с элементами с большей электроотрицательностью, сера может проявлять положительную валентность, например, +4 и +6.
Физические свойства
Как простое вещество, сера образует несколько аллотропных модификаций:
- Ромбическая – то, что мы привыкли называть обычной серой. Она устойчива при обычных условиях, встречается чаще всего недалеко от действующих или потухших вулканов.
- Пластическая – представляет собой замкнутые или открытые цепочки соединяющейся между собой серы, получаемые обычно при её сжигании. Имеет самую большую молекулярную массу среди всех разновидностей серы.
- Моноклинная (S8) – соединение серы, которое в молекулярном виде представляет собой восьмиугольник с атомами серы в вершинах.
 Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.
Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.
Приблизительная молярная масса одной молекулы моноклинной серы – 256 г/моль. В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
Сера – легкоплавкое вещество, температура плавления около 120 градусов. Нерастворима в воде и не намокает про соприкосновении с ней.
Не обладает электролитическими свойствами и теплопроводностью. Плотность серы — 2,070 г/см³.
Химические свойства
В соединениях с водородом образует серную (химическая формула h3SO4) со степенью окисления серы +6 и сернистую (h3SO3) со степенью окисления +4 кислоты, которые дают соответственно сульфаты и сульфиты.
В нормальных условиях реагируют с активными металлами и ртутью, образуя сульфиды:
Hg + S = HgS
Na + S = Na2S
Также образует сульфиды при нагревании с большинством неактивных металлов, кроме платины и золота:
Fe + S (t) = Fe2S3
Проявляет восстановительные свойства в реакции с кислородом при нагревании, образуя кислотный оксид:
S + O2 = SO2
В реакциях с водородом образует сернистый газ, летучее бесцветное вещество с неприятным запахом тухлых яиц:
h3 + S = h3S
Области применения
Широко применяется в медицине, обладает антисептическими и антипаразитарными свойствами, используется для дезинфекции помещений и избавления от паразитов.
В низких концентрациях способствует формированию новых клеток эпидермиса, из-за чего её часто используют для лечения воспалений. Помимо этого сера имеет слабительное действие, а при приеме внутрь оказывает отхаркивающий эффект.
Благодаря легковоспламеняемости и горючим свойствам, сера хорошо горит. Например, самое простое, где можно взять серу, это открыть полный спичечный коробок — сера входит в состав спичечной головки.
При трении головка касается шероховатой поверхности (например, наждачной бумаги), и спичка легко загорается.
Серная кислота (h3SO4) – важнейший продукт химической промышленности, используется в качестве электролита в свинцовых аккумуляторах, применяется для получения соляной, азотной, борной и других кислот.
Серная кислота является необходимым сульфирующим средством при получении многих лекарственных веществ и красок.
Сероводород (h3S) используется для выделения чистой серы, сульфитов и серной кислоты из растворов.
Оксиды серы (SO2 и SO3) находят применения в производстве серной и азотной кислот, а также используются в бытовой химии: входят в состав отбеливателей, дезинфицирующих средств.
Нахождение серы в природе
Чаще всего в природе находится самородная сера (S), однако встречаются и её соединения с другими элементами: FeS2 (сульфат железа (II), пирит), ZnS (сульфат цинка, цинковая обманка), CaSO4*2h3O (гипс), PbS (сульфат свинца, свинцовый блеск) и другие.
Биологическая роль серы
Сера содержится в живых организмах, особенно много её в белках ногтей, волос, копыт. Общая масса серы в человеческом организме составляет около 130 грамм. Также это вещество встречается в составе некоторых витаминов и гормонов.
Сера обладает уникальными химическими и физическими свойствами, благодаря чему является важнейшим компонентом промышленности и незаменима при создании лекарственных препаратов.
com/embed/fkzmef2_RxY» frameborder=»0″ allowfullscreen=»allowfullscreen»>Окислительно-восстановительные реакции между ионами галогенидов и концентрированной серной кислотой На этой странице описаны и объяснены окислительно-восстановительные реакции с участием ионов галогенидов и концентрированной серной кислоты. Эти реакции используются для обсуждения тенденции снижения способности ионов при переходе от фторида к хлориду, бромиду и йодиду. Факты Существует два разных типа реакции, которые могут протекать, когда концентрированную серную кислоту добавляют к твердому ионному галогениду, такому как фторид, хлорид, бромид или йодид натрия. Концентрированная серная кислота может действовать и как кислота, и как окислитель. Концентрированная серная кислота, действующая как кислота Концентрированная серная кислота отдает ион водорода иону галогенида с образованием галогенида водорода. Например, концентрированная серная кислота реагирует с твердым хлоридом натрия на холоде с образованием хлороводорода и гидросульфата натрия.
Все галогенид-ионы (фторид, хлорид, бромид и йодид) ведут себя одинаково. | |||||||||||||||||||||||||
Примечание: Эти реакции образования галогеноводородов рассматриваются на отдельной странице. Если вы хотите прочитать о них немного больше, перейдите по этой ссылке и используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||||||
Концентрированная серная кислота, действующая как окислитель С ионами фтора или хлорида Концентрированная серная кислота не является достаточно сильным окислителем для окисления ионов фтора или хлорида. Можно посмотреть на это иначе — с точки зрения галоид-ионов. Ионы фтора и хлорида недостаточно сильные восстановители для восстановления серной кислоты. Как ни посмотри, все, что у тебя есть, это галогеноводород! Однако это не так в отношении бромидов и йодидов. С ионами брома Ионы брома являются достаточно сильными восстановителями для восстановления концентрированной серной кислоты. При этом ионы брома окисляются до брома.
Ионы брома восстанавливают серную кислоту до газообразного диоксида серы. Это уменьшение степени окисления серы с +6 в серной кислоте до +4 в диоксиде серы.
Вы можете объединить эти два полууравнения, чтобы получить общее ионное уравнение реакции: H 2 SO 4 + 2H + + 2Br — Br 2 + SO 2 + 2H 0 3 2 O 8 9003 | |||||||||||||||||||||||||
Примечание: Если вы не уверены в окислительно-восстановительных реакциях, уравнениях электронной половины и степенях окисления, вам действительно следует пройти по этой ссылке, прежде чем двигаться дальше.  | |||||||||||||||||||||||||
То, что вы видите в этой реакции, представляет собой пары паров бромистого водорода, загрязненные коричневыми парами брома. Диоксид серы — бесцветный газ, поэтому вы не можете наблюдать его присутствие напрямую. С ионами йодида Иодид-ионы являются более сильными восстановителями, чем бромид-ионы. Они окисляются до йода концентрированной серной кислотой.
Восстановление серной кислоты сложнее, чем раньше. Иодид-ионы являются достаточно сильными восстановителями, чтобы восстановить его .
Наиболее важным из этой смеси продуктов восстановления, вероятно, является сероводород.
Объединение этих двух последних полууравнений дает: H 2 SO 4 + 8H + + 8I — 4I 2 + H 2 S + 9003 O 90 0 4H 2 90 | |||||||||||||||||||||||||
Важно! Не пытайтесь запомнить это уравнение — шансы, что оно вам когда-нибудь понадобится на экзамене, ничтожно малы. Научитесь составлять уравнения полуэлектронов и комбинировать их, чтобы составить общее уравнение. Немного времени на приобретение этого навыка сэкономит вам много бессмысленного обучения. | |||||||||||||||||||||||||
На этот раз вы видите следы паров йодистого водорода, но в основном много йода. Реакция является экзотермической, поэтому образуются фиолетовые пары йода и, вероятно, темно-серое твердое вещество йода, конденсирующееся вокруг верхней части пробирки. Красный цвет обусловлен ионом I 3 — , образованным в результате реакции между I 2 молекул и I — ионов. Вы не увидите бесцветный сероводородный газ, но можете уловить его запах «тухлых яиц», если вы достаточно глупы, чтобы почувствовать запах выделяющихся сильно ядовитых газов! Краткое изложение тенденции снижения способности
Объяснение тенденции Слишком упрощенное объяснение Это работает (да и то не очень хорошо!) только в том случае, если вы игнорируете ионы фтора. Когда ион галогена действует как восстановитель, он отдает электроны чему-то другому. Это означает, что сам галогенид-ион должен терять электроны. Чем больше ион галогенида, тем дальше внешние электроны от ядра и тем больше они экранируются от него внутренними электронами. Следовательно, ионам галогенидов становится легче терять электроны по мере продвижения вниз по Группе, потому что между внешними электронами и ядром меньше притяжения. Звучит убедительно, но это только часть истории. Нам нужно более подробно рассмотреть энергетику изменений. | |||||||||||||||||||||||||
Важно! Вам действительно нужно выяснить, какое объяснение (если таковое имеется) ожидают от вас экзаменаторы. Если их схемы выставления оценок (или то, как они формулируют свои вопросы) предполагают, что им нужно это упрощенное объяснение, то вам придется дать им именно его. Остальная часть этой страницы будет довольно сложной. Было бы целесообразно выяснить, нужно ли вам знать об этом. Великобритания Учащимся уровня A’ следует искать свои программы, прошлые экзаменационные работы, схемы оценок и любые другие вспомогательные материалы, доступные в их экзаменационной комиссии. Если у вас ничего из этого нет, вы можете найти веб-адрес своей экзаменационной комиссии, перейдя по этой ссылке. Студенты в других местах должны найти эквивалентную информацию из своих собственных источников. | |||||||||||||||||||||||||
Более подробное объяснение Глядя на изменение энтальпии от галогена к галогену Нам нужно сравнить количество тепла, выделяющегося или поглощаемого при превращении твердого галогенида (например, хлорида натрия) в молекулы галогена. Возьмем, к примеру, хлорид натрия:
Посмотрите внимательно на схему, чтобы увидеть, как все это сочетается друг с другом: | |||||||||||||||||||||||||
Примечание: Используемый здесь термин «энтальпия решетки» более точно следует описывать как «энтальпия диссоциации решетки».  Если вы не уверены в энергетических циклах и логике, лежащей в их основе (закон Гесса), вы можете изучить раздел энергетики Chemguide или мою книгу по химическим расчетам. | |||||||||||||||||||||||||
Что нам нужно сделать, так это рассчитать изменение энтальпии, показанное зеленой стрелкой на диаграмме для каждого из галогенов, чтобы мы могли провести сравнение. Диаграмма показывает, что общее изменение с участием ионов галогенидов является эндотермическим — зеленая стрелка указывает вверх в сторону более высокой энергии. Это не является полным изменением энтальпии всей реакции. Тепло будет выделяться, когда происходят изменения с участием серной кислоты. Это будет то же самое, независимо от того, о каком галогене вы говорите. Полное изменение энтальпии будет суммой изменений энтальпии для полуреакции галогенид-иона и полуреакции серной кислоты. В таблице показаны изменения энергии, которые варьируются от галогена к галогену.
| |||||||||||||||||||||||||
Примечание: В этих цифрах может быть ошибка.  Они поступают из разных источников — одни более надежны, чем другие! Они поступают из разных источников — одни более надежны, чем другие! | |||||||||||||||||||||||||
Общее изменение энтальпии галогенидной полуреакции: Посмотрите на последнюю колонку цифр. Обратите внимание, что сумма этих изменений энтальпии становится менее эндотермической по мере продвижения вниз по группе. Это означает, что общее изменение (включая серную кислоту) будет становиться легче по мере того, как вы спускаетесь по Группе. Количество тепла, выделяемое полуреакцией с участием серной кислоты, должно быть достаточно большим, чтобы сделать возможными реакции с бромидом или йодидом, но недостаточным, чтобы компенсировать более положительные значения, получаемые полуреакциями фторида и хлорида. . Я не знаю, каково реальное значение полуреакции серной кислоты с образованием диоксида серы, но оно должно быть примерно -980 кДж моль -1 . Попробуйте эффект объединения этого значения с общими значениями в таблице, чтобы увидеть, что происходит с полным изменением энтальпии реакции для каждого галогена. Изучение изменений в различных терминах энергии Какие отдельные значения энергии в таблице являются наиболее важными для того, чтобы сделать полуреакцию галогена менее эндотермической по мере продвижения вниз по Группе? Преобразование хлора в йод Рассматривая галогены от хлора до йода, больше всего упала энтальпия решетки. Она падает на 87 кДж моль -1 . Напротив, теплота, необходимая для удаления электрона, уменьшилась только на 54 кДж·моль 9 .0086 -1 . Оба эти условия имеют значение, но более важным является падение энтальпии решетки. Это падает, потому что ионы становятся больше. Это означает, что они не так близки друг к другу, и поэтому притяжение между положительными и отрицательными ионами в твердой решетке становится меньше. Упрощенное объяснение, о котором мы упоминали ранее, концентрируется на менее важном уменьшении количества энергии, необходимой для отрыва электрона от иона. Фтор Ионы фтора очень трудно окисляются до фтора. Таблица показывает, что это не имеет ничего общего с количеством энергии, необходимой для отрыва электрона от иона фтора. На самом деле легче удалить электрон у фторид-иона, чем у хлорид-иона. В этом случае делать обобщение о том, что электрон становится легче удалить по мере того, как ион становится больше, просто неправильно! Ионы фтора настолько малы, что электроны испытывают ненормальное отталкивание друг от друга. Это перевешивает эффект их близости к ядру и облегчает их удаление, чем можно было бы ожидать. Есть две важные причины, по которым ионы фтора так трудно окисляются. Во-первых, это сравнительно очень высокая энтальпия кристаллической решетки твердого фторида. Это связано с небольшим размером иона фтора, а это означает, что положительные и отрицательные ионы расположены очень близко друг к другу и сильно притягиваются друг к другу. Другим фактором является небольшое количество тепла, которое выделяется, когда атомы фтора объединяются в молекулы фтора. Это происходит из-за низкой энтальпии связи F-F. Причина такой низкой энтальпии связи обсуждается на отдельной странице. | |||||||||||||||||||||||||
Примечание: Если вы не читали об этом недавно, вы найдете его на странице об атомных и физических свойствах галогенов | |||||||||||||||||||||||||
Что, если ионы галогенидов были бы в растворе, а не в твердом состоянии? Мы сосредоточились на энергетике процесса, начиная с твердых ионов галогенидов, потому что это то, что вы используете, если пытаетесь окислить их с помощью концентрированной серной кислоты. А если окислить их в растворе каким-нибудь другим окислителем? Тенденция точно такая же. Ионы фтора трудно окислить, и это становится легче, когда вы спускаетесь по группе к ионам йода. С другой стороны, ионы фтора не являются хорошими восстановителями, а ионы йода — хорошими восстановителями. На этот раз объяснение должно начинаться с гидратированных ионов в растворе, а не с твердых ионов. В некотором смысле это уже было сделано на другой странице. Фтор является очень сильным окислителем, потому что он очень легко образует свой отрицательный ион в растворе. Это означает, что повернуть процесс вспять будет энергетически сложно. Напротив, по энергетическим причинам, которые вы обсудите, йод относительно неохотно образует свой отрицательный ион в растворе. Это означает, что будет относительно легко убедить его снова вернуться к молекулам йода. | |||||||||||||||||||||||||
Примечание: Вы найдете подробное объяснение окислительной способности галогенов, перейдя по этой ссылке. Поскольку теперь вы будете думать об обратном процессах, описанных на этой странице, вам придется поменять знак всех исследованных энергетических изменений. Если бы я был на вашем месте, я бы не стал заниматься этим, если для этого нет какой-то неопровержимой причины! | |||||||||||||||||||||||||
В меню группы 7 . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2002 г. (последнее изменение: март 2022 г.) | |||||||||||||||||||||||||
Олово: степени окисления и реакции с ним
Похоже, вы зашли на наш сайт из Германия . Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Химические свойства олова
[Депозитные фотографии] Олово — легкий металл, расположенный в 14-й группе таблицы Менделеева, с атомным номером 50. Этот элемент известен человечеству с древних времен и считался одним из самых редких и ценных металлов, поэтому предметы, изготовленные из олова могли себе позволить только самые богатые жители Римской империи и Древней Греции. Из олова делали специальную бронзу, которая использовалась еще в 3-м тысячелетии до нашей эры. Бронза стала самым прочным и популярным сплавом, а олово использовалось в качестве одного из ее компонентов и использовалось более 2000 лет.
Этот элемент известен человечеству с древних времен и считался одним из самых редких и ценных металлов, поэтому предметы, изготовленные из олова могли себе позволить только самые богатые жители Римской империи и Древней Греции. Из олова делали специальную бронзу, которая использовалась еще в 3-м тысячелетии до нашей эры. Бронза стала самым прочным и популярным сплавом, а олово использовалось в качестве одного из ее компонентов и использовалось более 2000 лет.
На латыни этот металл назывался «stannum», что означает прочность и выносливость, но ранее это название давали сплаву свинца и серебра. Только в IV веке это слово было присвоено самому олову .
Этот металл редко встречается в природе, он является лишь 47-м наиболее распространенным элементом в земной коре и добывается из касситерита, так называемого оловянного камня, в котором содержится около 80 % этого металла.
Касситерит [Депозитные фотографии]Использование в промышленности
Поскольку олово является нетоксичным и очень прочным металлом, оно используется в сплавах с другими металлами, но в основном используется для производства жести, которая используется для изготовления банок, припоев в электронике и производства бронзы. .
.
Физические свойства олова
Белый металл с серебристым блеском
Слева: белая жесть; справа: серая жесть [Викимедиа]Если олово нагревается, оно трескается из-за трения кристаллов друг о друга. Этот характерный треск слышен, если кусок жести просто согнуть.
Олово очень ковкое и пластичное. В классических условиях этот элемент существует в виде «белого олова», которое может видоизменяться в зависимости от температуры, например, если белое олово находится на морозе, оно превращается в серое олово, имеющее структуру, подобную алмазу. Между прочим, серое олово очень хрупкое и превращается в порошок прямо на глазах. По этой причине в истории существует термин «оловянная чума».
via GIPHY
Люди не знали об этом свойстве олова, поэтому из него делали пуговицы и кружки для солдат, а также другие полезные предметы, которые после пребывания на морозе превращались в порошок. Это ставило армии в невыгодное положение. Например, некоторые историки считают, что это свойство олова снижало боеспособность армии Наполеона.
Это ставило армии в невыгодное положение. Например, некоторые историки считают, что это свойство олова снижало боеспособность армии Наполеона.
Получение олова
Основным методом получения олова является восстановление металла из руды, содержащей оксид олова(IV), углем, алюминием или цинком.
SnO₂ + C = Sn + CO₂.
Олово особо чистое получают электрохимическим рафинированием или методом зонной плавки.
Химические свойства олова
При комнатной температуре олово достаточно устойчиво к воздействию воздуха или воды, так как на поверхности металла образуется тонкая оксидная пленка. На воздухе олово начинает окисляться при температуре выше 150°С:
Sn + O₂ → SnO₂.
Волокна SnO₂ (оптический микроскоп) [Викимедиа] Если олово нагреть, элемент будет реагировать с большинством неметаллов, образуя соединения со степенью окисления +4, что более характерно для этого элемента.
Sn + 2Cl₂ → SnCl₄
Взаимодействие олова и концентрированной соляной кислоты происходит достаточно медленно:
Sn + 4HCl → H₂[SnCl₄] + H₂
С концентрированной серной кислотой олово реагирует очень медленно, при этом не вообще не вступают в реакцию с разбавленной серной кислотой.
Очень интересна реакция олова с азотной кислотой, которая зависит от концентрации раствора. Реакция протекает с образованием оловянной кислоты H₂SnO₃, которая представляет собой белый аморфный порошок.
3Sn + 4HNO₃ + nH₂O = 3H₂SnO₃·nH₂O + 4NO
Если олово смешать с разбавленной азотной кислотой, элемент проявит металлические свойства с образованием нитрата олова.
4Sn + 10HNO₃ = 4Sn(NO3)₂ + NH4NO₃ + 3H₂O
Если олово нагреть, оно может реагировать со щелочами с выделением водорода.
Sn + 2KOH + 4H₂O = K₂[Sn(OH)₆] + 2H₂
Здесь вы найдете удивительные и безопасные эксперименты с оловом
нуль.
Sn также может иметь степень окисления +2: оксид олова (II) SnO, хлорид олова (II) SnCl₂, гидроксид олова (II) Sn(OH)₂.
Степень окисления +4 наиболее характерна для этого элемента в оксиде олова(IV) SnO₂ и галогенидах(IV), например SnCl4, сульфиде олова(IV) SnS₂ и нитриде олова(IV) Sn₃N₄.
У нас есть для вас еще статьи по химии:
- Эксперимент «Адсорбция». Как очистить воздух с помощью активированного угля
- Эксперимент «Фиолетовая дымка». Как сделать фиолетовый дым с алюминием и йодом
Вы можете провести десятки химических опытов дома!
Оловянный дендрит
Учить больше
Попытайся
Difference Between Sulfuric Acid and Sulfurous Acid
Key Difference – Sulfuric Acid vs. Sulfurous Acid Sulfuric acid (H 2 SO 4 ) and sulfurous acid (H 2 SO 3 ) — две неорганические кислоты, содержащие в качестве элементов серу, водород и кислород. ключевое различие между серной кислотой и серной кислотой заключается в степени окисления серы . Более того, когда мы сравниваем две кислоты по кислотности, серная кислота более кислая, чем сернистая кислота . Другими словами, серная кислота — очень сильная кислота, а сернистая кислота — относительно слабая.
ключевое различие между серной кислотой и серной кислотой заключается в степени окисления серы . Более того, когда мы сравниваем две кислоты по кислотности, серная кислота более кислая, чем сернистая кислота . Другими словами, серная кислота — очень сильная кислота, а сернистая кислота — относительно слабая.
Серная кислота представляет собой очень сильную дипротонную минеральную кислоту , которая полностью смешивается с водой в любой пропорции. Растворение серной кислоты в воде является экзотермической реакцией. Это едкая и вредная жидкость, вызывающая множество травм, таких как кислотные ожоги кожи или глаз. Это включает как краткосрочные, так и долгосрочные эффекты в зависимости от концентрации кислоты и времени контакта. Серная кислота обладает высокой коррозионной активностью из-за нескольких факторов; кислотность, окисляющая способность, дегидратация, вызванная концентрированными растворами, и теплота, выделяющаяся при экзотермической реакции.
Сернистая кислота имеет химическую формулу H 2 SO 3 , где степень окисления серы равна +4. Это прозрачная, бесцветная, слабая и нестабильная кислота. Имеет резкий запах горелой серы. Он образуется при растворении диоксида серы в воде, а чистая безводная форма сернистой кислоты никогда не была выделена или обнаружена. Сернистая кислота быстро разлагается и распадается на химические составляющие; так как он термодинамически нестабилен. Реакция разложения
H 2 SO 3(aq) → H 2 O (l) + SO 2 (g)
9063Структура и химическая формула:
Серная кислота: Химическая формула серной кислоты: H 2 SO 4 , где степень окисления серы равна +6. Геометрическая структура этой молекулы тетраэдрическая.
Сернистая кислота: Химическая формула серной кислоты H 2 SO 3 , где степень окисления серы равна +4. Геометрическая структура этой молекулы тригонально-пирамидальная.
Геометрическая структура этой молекулы тригонально-пирамидальная.
Кислотность:
Серная кислота: Серная кислота является одной из самых сильных кислот и является двухосновной кислотой. Константы кислотной диссоциации серной кислоты равны; K 1 = 2,4×10 6 (сильная кислота) и K 2 = 1,0×10 −2 .
Сернистая кислота: Кислотность сернистой кислоты по шкале рН равна 1,5. Это не считается очень сильной кислотой, но и не слишком слабой кислотой.
Свойства:
Серная кислота: Серная кислота обладает как окислительными, так и восстановительными свойствами в дополнение к своим кислотным свойствам. Поэтому он реагирует как с металлами, так и с неметаллами; он реагирует с металлами, как и другие кислоты, с образованием газообразного водорода и соответствующей соли металла.
Реакции с металлами:
Fe (тв) + H 2 SO 4 (водн. ) → H 2 (г) + FeSO 4 (водн.)
) → H 2 (г) + FeSO 4 (водн.)
Cu + 2 H1 3 SO 4 2 + 2 H 2 O + SO 4 2– + CU 2+
Реакции с неметалами:
C + 2 H 2 SO 4 9008 it 2 + 2 SO 2 + 2 H 2 O
S + 2 H 2 SO 4 → 3 SO 2 + 2 H 2 O
Сернистая кислота: Сернистая кислота не существует в виде раствора в безводной форме, подобной серной кислоте. Однако есть данные, что молекулы серы существуют в газовой фазе. В отличие от H 2 SO 4, сернистая кислота вступает в очень ограниченное число химических реакций.
CaCO 3 ( s ) + H 2 SO 3 ( водный раствор ) → CO 2 ( г 2 0 9 O 9 90 690 ) + H 30694 l ) + CaSO 3 ( aq )
Применение:
Серная кислота: Серная кислота широко используется во всем мире в самых разных отраслях промышленности. Например, он используется для производства удобрений, взрывчатых веществ, бумаги, моющих средств, красителей и красящих материалов. Кроме того, это очень важно в химическом синтезе, обработке поверхностей, нефтяной и текстильной промышленности.
Например, он используется для производства удобрений, взрывчатых веществ, бумаги, моющих средств, красителей и красящих материалов. Кроме того, это очень важно в химическом синтезе, обработке поверхностей, нефтяной и текстильной промышленности.
Сернистая кислота: Сернистая кислота используется в качестве очень сильного восстановителя. Он обладает некоторыми отбеливающими свойствами и используется в качестве отбеливающего агента.
Изображение предоставлено:
1. Химическая структура серной кислоты Автор DMacks (собственная работа) [общественное достояние], через Wikimedia Commons
2. Сернистая кислота-2D Автор Benjah-bmm27 (собственная работа) [общественное достояние] , через Wikimedia Commons
Разница между серной кислотой и сернистой кислотой
Основное отличие — серная кислота против сернистой кислоты
Сера — это химический элемент, имеющий химический символ «S» и атомный номер 16. Электронная конфигурация серы [Ne ] 3с²3п⁴. Следовательно, он имеет 6 электронов на самой внешней электронной оболочке, которые могут участвовать в химической связи. Сера может образовывать максимум 6 ковалентных связей. Он образует самые разнообразные химические соединения. Серная кислота и серная кислота являются двумя такими соединениями, которые являются кислотами. Основное различие между серной кислотой и сернистой кислотой заключается в том, что серная кислота имеет химическую формулу H 2 , поэтому 4 и является хорошим окислителем, тогда как серная кислота имеет химическую формулу H 2 SO 3 и является хорошим восстановителем.
Следовательно, он имеет 6 электронов на самой внешней электронной оболочке, которые могут участвовать в химической связи. Сера может образовывать максимум 6 ковалентных связей. Он образует самые разнообразные химические соединения. Серная кислота и серная кислота являются двумя такими соединениями, которые являются кислотами. Основное различие между серной кислотой и сернистой кислотой заключается в том, что серная кислота имеет химическую формулу H 2 , поэтому 4 и является хорошим окислителем, тогда как серная кислота имеет химическую формулу H 2 SO 3 и является хорошим восстановителем.
Ключевые области, охватываемые
1. Что представляет собой серная кислота
— Определение, химические свойства, реакции
2. Что является серной кислотой
— Определение, определение.8 3. В чем разница между серной кислотой и серной кислотой
– Сравнение ключевых различий
Ключевые термины: Атомный номер, ковалентные связи, степень окисления, восстановитель, серная кислота, серная кислота Тетраэдрическая, тригональная пирамидальная
Что такое серная кислота
Серная кислота представляет собой кислоту, имеющую химическую формулу H 2 SO 4 . При комнатной температуре это бесцветная сиропообразная жидкость без запаха. Молярная масса серной кислоты равна 9.8,079 г/моль. Это сильная кислота, вызывающая коррозию. Поэтому при обращении с этой кислотой следует соблюдать осторожность.
При комнатной температуре это бесцветная сиропообразная жидкость без запаха. Молярная масса серной кислоты равна 9.8,079 г/моль. Это сильная кислота, вызывающая коррозию. Поэтому при обращении с этой кислотой следует соблюдать осторожность.
Температура плавления серной кислоты 10 o С, температура кипения 337 °С. При рассмотрении химической структуры серной кислоты атом серы находится в середине молекулы. Две группы –OH связаны с атомом серы одинарными ковалентными связями. Два атома кислорода связаны с атомами серы двойными связями. Молекула имеет тетраэдрическую структуру.
Рисунок 1: Химическая структура серной кислоты
Молекула серной кислоты имеет две связи –OH, которые очень полярны. Из-за этой полярности атомы H могут быть легко потеряны. Ионизация серной кислоты происходит в два этапа.
H 2 SO 4(aq) + H 2 O (l) → HSO 4 – (aq) + H 3 O + (aq)
ХСО 4 — (aq) +H 2 O (L) → SO 4 -2 (AQ) +H 3 O + (A 3 O +
(A 3 O + (AQ) (AQ) (AQ) (AQ) (AQ) + 3 O + (AQ) (AQ) (AQ) Серная кислота является сильным окислителем в концентрированных условиях. Но когда он разбавлен, окислительная сила снижается. Например, при более высоких температурах концентрированная серная кислота может окислять Br– до Br 2 .
Но когда он разбавлен, окислительная сила снижается. Например, при более высоких температурах концентрированная серная кислота может окислять Br– до Br 2 .2HBr (водный) + H 2 SO 4(aq) → Br 2(aq) + SO 2(aq) + 2 H 2 O (l)
The oxidation state of атом серы в серной кислоте +6. Это максимальная степень окисления, которую может удерживать атом серы. Следовательно, серную кислоту можно восстановить до более низких степеней окисления, но она не может действовать как восстановитель.
Что такое сернистая кислота
Сернистая кислота представляет собой кислоту, имеющую химическую формулу H 2 СО 3 . Это ковалентное соединение, содержащее только ковалентные химические связи. Молярная масса сернистой кислоты 82,07 г/моль. Сернистая кислота является слабой кислотой и неустойчива. Он образуется при растворении диоксида серы (SO 2 ) в воде.
Он образуется при растворении диоксида серы (SO 2 ) в воде.
Рис. 2: Химическая структура сернистой кислоты
Химическая геометрия сернистой кислоты тригонально-пирамидальная. Хотя электронная геометрия молекулы является тетраэдрической, молекулярная геометрия является тригонально-пирамидальной из-за наличия неподеленной электронной пары.
Сернистую кислоту нельзя выделить в чистом виде, поскольку она образуется только в водном растворе. Сернистая кислота (водный раствор) является восстановителем. Это связано с тем, что атом серы в этом соединении находится в степени окисления +4 и может быть дополнительно окислен до высшей степени окисления серы; +6. Сернистая кислота также действует как отбеливатель.
Разница между серной кислотой и серной кислотой
Определение
Серная кислота: Серная кислота представляет собой кислоту, имеющую химическую формулу H 2 SO 4 .
Сернистая кислота: Сернистая кислота представляет собой кислоту, имеющую химическую формулу H 2 SO 3 .
Молярная масса
Серная кислота: Молярная масса серной кислоты составляет 98,079 г/моль.
Сернистая кислота: Молярная масса сернистой кислоты составляет 82,07 г/моль.
Степень окисления серы
Серная кислота: Степень окисления атома серы в серной кислоте равна +6.
Сернистая кислота: Степень окисления атома серы в сернистой кислоте +4.
Геометрия
Серная кислота: Молекула серной кислоты имеет тетраэдрическую структуру.
Сернистая кислота: Молекула сернистой кислоты имеет тригонально-пирамидальную структуру.
Nature
Серная кислота: Серная кислота является хорошим окислителем.
Сернистая кислота: Сернистая кислота является хорошим восстановителем.
Заключение
Серная кислота и сернистая кислота представляют собой кислые ковалентные соединения, содержащие атомы S, H и O. Основное различие между серной кислотой и сернистой кислотой заключается в том, что серная кислота имеет химическую формулу h 2 , поэтому 4 , тогда как серная кислота имеет химическую формулу 2 , поэтому 3 .
Основное различие между серной кислотой и сернистой кислотой заключается в том, что серная кислота имеет химическую формулу h 2 , поэтому 4 , тогда как серная кислота имеет химическую формулу 2 , поэтому 3 .
Ссылки:
1. «Формула серной кислоты – использование, свойства, структура и формула серной кислоты». Математика, доступна здесь.
2. «Сернистая кислота». Изучающий химию, доступно здесь.
3. «Сернистая кислота». Википедия, Фонд Викимедиа, 17 декабря 2017 г., доступно здесь.
Изображение предоставлено:
1. «Химическая структура серной кислоты» Автор DMacks (разговор) — собственная работа (общественное достояние) через Commons Wikimedia
2. «Серная кислота-2D-пирамида» Автор Benjah-bmm27 — собственная работа ( Public Domain) через Commons Wikimedia
Номер окисления — MCAT Physical
Все физические ресурсы MCAT
8 Диагностические тесты 303 практических теста Вопрос дня Карточки Learn by Concept
← Предыдущая 1 2 Следующая →
Физическая помощь MCAT » Общая химия » Снижение окисления » Число окисления
Какова степень окисления серы в H 2 SO 4 ?
Возможные ответы:
-5
+4
+6
0
-2
Правильный ответ:
+6
Объяснение:
Поскольку в соединении нет общего заряда, степени окисления должны компенсироваться. Хотя степень окисления гидридов равна +1, в соединении необходимо учитывать две степени. То же верно и для кислорода; хотя степень окисления кислорода равна -2, присутствует четыре кислорода, что в сумме составляет -8. Вклад в состояние +2 от гидридов и -8 от атомов кислорода приводит к заряду -6. Степень окисления серы должна быть +6, чтобы молекула была нейтральной.
Хотя степень окисления гидридов равна +1, в соединении необходимо учитывать две степени. То же верно и для кислорода; хотя степень окисления кислорода равна -2, присутствует четыре кислорода, что в сумме составляет -8. Вклад в состояние +2 от гидридов и -8 от атомов кислорода приводит к заряду -6. Степень окисления серы должна быть +6, чтобы молекула была нейтральной.
Сообщить об ошибке
Какова степень окисления хрома в бихромате кальция (CaCr 2 O 7 )?
Возможные ответы:
+7
-2
0
+2
+6
Правильный ответ:
+6
8 Пояснение:
Поскольку ион кальция имеет заряд +2, анион дихромата должен иметь заряд -2. Кислород всегда имеет степень окисления -2, поэтому семь атомов кислорода в молекуле имеют общее число -14. Остается заряд +12, который должны уравновесить два хрома (-2 — (-14) = 12). Следовательно, каждый хром должен иметь степень окисления +6.
Следовательно, каждый хром должен иметь степень окисления +6.
Сообщить об ошибке
Какова степень окисления азота в HNO 3 ?
Возможные ответы:
Правильный ответ:
Объяснение:
При применении степеней окисления необходимо соблюдать определенные иерархические правила.
1. Сумма степеней окисления всех элементов в молекуле должна составлять общий заряд.
2. Элементы группы 1 и группы 2 имеют степени окисления +1 и +2 соответственно.
3. Фтор имеет степень окисления –1.
4. Водород имеет степень окисления +1 (кроме гидридов металлов).
5. Кислород имеет степень окисления –2.
6. Элементы одной группы (за исключением переходных металлов) обычно имеют одинаковую степень окисления.
При применении степени окисления к HNO 3 водород имеет степень окисления +1, а каждая из молекул кислорода имеет степень окисления -2. Поскольку существует только одна молекула водорода и три молекулы кислорода, степень окисления азота должна уравновешивать заряд молекулы водорода и объединенных молекул кислорода.
Поскольку существует только одна молекула водорода и три молекулы кислорода, степень окисления азота должна уравновешивать заряд молекулы водорода и объединенных молекул кислорода.
Азот должен иметь степень окисления +5.
Сообщить об ошибке
Какова степень окисления водорода в NaH?
Возможные ответы:
Правильный ответ:
Объяснение:
При применении степеней окисления необходимо соблюдать определенные иерархические правила.
1. Сумма степеней окисления всех элементов в молекуле должна составлять общий заряд.
2. Элементы группы 1 и группы 2 имеют степени окисления +1 и +2 соответственно.
3. Фтор имеет степень окисления –1.
4. Водород имеет степень окисления +1 (кроме гидридов металлов).
5. Кислород имеет степень окисления –2.
6. Элементы одной группы (за исключением переходных металлов) обычно имеют одинаковую степень окисления.
В соответствии с правилами окисления элементы группы 1 должны иметь степень окисления +1.
Чтобы сбалансировать общий нулевой заряд, водород в этом соединении должен иметь степень окисления –1. Обратите внимание, что NaH представляет собой гидрид металла; следовательно, степень окисления водорода не обязательно +1.
Сообщить об ошибке
Какова правильная степень окисления цинка в соединении ?
Возможные ответы:
+2
-1
+1
-2
0
Правильный ответ:
+2
Пояснение:
Сумма степеней окисления каждого элемента в этом соединении должна прибавляться к общему заряду -2. Водород всегда имеет степень окисления +1, а кислород всегда имеет степень окисления -2.
Итак, в сумме для кислорода имеем (4) * (-2) = -8, а для водорода имеем (4) * (+1) = +4.
Объединяя кислород и водород, (+4) + (-8) = -4, поэтому нам нужно дополнительно +2, чтобы получить общий заряд -2. Zn должен обеспечивать этот уравновешивающий заряд и иметь степень окисления +2.
Сообщить об ошибке
Какое из следующих утверждений между HClO 4 и HClO 3 верно?
Возможные ответы:
Степень окисления хлора в HClO 4 уменьшилась в HClO 3
Степени окисления всех атомов одинаковы в обеих молекулах
Степень окисления хлора в HClO 4 увеличилась в HClO 3
Степень окисления кислорода в HClO 4 уменьшилась в HClO 3
Правильный ответ:
Степень окисления хлора в HClO 4 уменьшилась в HClO 3
99 Пояснение:Число окисления — это понятие, с которым вы также столкнетесь на лекциях по электрохимии.
Он используется для отслеживания электронов в окислительно-восстановительной реакции. В целом сумма степеней окисления всех атомов в молекуле должна равняться общему заряду молекулы. Важно помнить некоторые из общепринятых степеней окисления атомов, чтобы можно было предсказать степени окисления других атомов. Вот некоторые ключевые степени окисления, которые полезно знать для MCAT:
1. Атомы в элементарной форме имеют степень окисления 0.
2. Галогены обычно имеют степень окисления –1.
3. Водород и щелочные металлы обычно имеют степень окисления +1.
4. Кислороду обычно присваивается степень окисления –2.
Помня об этих правилах, мы можем предположить, что атомы водорода и кислорода в двух соединениях сохраняют одинаковую степень окисления. Хлор, однако, связан с кислородом меньше в HClO 3 . В результате степень окисления Cl уменьшилась с +7 до +5 при сравнении HClO 4 с HClO 3 .
Сообщить об ошибке
Какой элемент в данных соединениях имеет самую высокую степень окисления?
Возможные ответы:
Углерод в
Алюминий в
Сера в
Серная0699
Объяснение:
Мы можем вычислить степень окисления в каждом ответе, чтобы найти наибольшее значение.
В кислород будет иметь значение и молекула нейтральна. Сера должна иметь степень окисления, чтобы сбалансировать три кислорода.
В кислород будет иметь значение и молекула нейтральна. Углерод должен иметь степень окисления, чтобы сбалансировать два кислорода.
В хлор будет иметь значение и молекула нейтральна. Алюминий должен иметь степень окисления, чтобы сбалансировать три хлора.
В кальций будет иметь значение и молекула нейтральна. Сера должна иметь степень окисления, чтобы сбалансировать кальций.
— молекула, состоящая из одного элемента; каждый атом будет иметь степень окисления .
Сообщить об ошибке
Какова степень окисления хлора в перхлорат-ионе?
Возможные ответы:
Правильный ответ:
Объяснение:
Чтобы найти степень окисления, сначала помните, что общий заряд должен сохраниться.
Суммарный заряд перхлорат-иона равен .
Каждый кислород будет иметь степень окисления . Окисление хлора необходимо использовать, чтобы сбалансировать этот отрицательный заряд.
Сообщить об ошибке
Какая молекула содержит атом со степенью окисления ?
Возможные ответы:
Правильный ответ:
Объяснение:
Правила для степени окисления отмечают, что некоторые атомы будут иметь постоянные степени окисления, в то время как другие, скорее всего, изменятся. Кислород, например, всегда будет иметь степень окисления , щелочные металлы всегда будут иметь степень окисления , а водород (почти) всегда будет иметь степень окисления .
Все указанные соединения являются нейтральными, а это означает, что их степени окисления должны суммироваться до нуля.
Используя наши перечисленные правила для просмотра этих молекул, мы можем попытаться найти любые недостающие значения.
Хром в бихромате калия является единственным атомом в этом наборе, имеющим степень окисления .
Сообщить об ошибке
Какая разница в степени окисления марганца в и ?
Возможные ответы:
Правильный ответ:
Пояснение:
Сумма степеней окисления каждого атома в молекуле должна равняться суммарному заряду молекулы.
Кислород всегда будет иметь степень окисления . В мы можем найти степень окисления марганца с помощью следующего уравнения:
Решая это, мы видим, что заряд марганца должен быть .
В ионах марганца имеется только один атом, а суммарный заряд равен . Окисление этого атома марганца должно уравновесить ионный заряд.
Разница между этими степенями окисления:
Сообщить об ошибке
← Предыдущая 1 2 Следующая →
Уведомление об авторских правах
Все физические ресурсы MCAT
8 Диагностические тесты 303 практических теста Вопрос дня Карточки Learn by Concept
Гидроксиапатит, полученный из биоотходов, встроенный в двумерные нанолисты g-C3N4 для разложения опасного красителя и фармакологического препарата посредством переноса заряда по Z-схеме
%PDF-1.6 % 1 0 объект > эндообъект 2 0 объект >поток 2022-07-07T19:03:17+05:30Springer2022-07-07T22:04:04+02:002022-07-07T22:04:04+02:00application/pdfhttps://doi.org/10.1038/s41598-022-15799-y
 Шкир
Шкир adobe.com/pdfx/1.3/pdfxAdobe Document Info Схема расширения PDF
adobe.com/pdfx/1.3/pdfxAdobe Document Info Схема расширения PDF org/crossmark/1.0/crossmarkCrossmark Схема
org/crossmark/1.0/crossmarkCrossmark Схема Вместо использования #other обратитесь к группе PRISM по адресу [email protected], чтобы запросить добавление вашего термина в словарь, контролируемый платформой.urlURI
Вместо использования #other обратитесь к группе PRISM по адресу [email protected], чтобы запросить добавление вашего термина в словарь, контролируемый платформой.urlURI Если используется, prism:eIssn ДОЛЖЕН содержать ISSN электронной версии.issnText
Если используется, prism:eIssn ДОЛЖЕН содержать ISSN электронной версии.issnText агрегатионтипетекст
агрегатионтипетекст adobe.com/xap/1.0/mm/xmpMMXMP Схема управления мультимедиа
adobe.com/xap/1.0/mm/xmpMMXMP Схема управления мультимедиа Это может быть позиция, в которой документ был изменен с момента самой последней истории событий (stEvt:changed). Для ресурса в списке xmpMM:Ingredients ResourceRef использует этот тип, чтобы идентифицировать как часть содержащего документа, которая ссылается на ресурс, так и часть ссылочного ресурса, на который ссылаются.http://ns.adobe.com /xap/1.0/sType/Part#stPartPart
Это может быть позиция, в которой документ был изменен с момента самой последней истории событий (stEvt:changed). Для ресурса в списке xmpMM:Ingredients ResourceRef использует этот тип, чтобы идентифицировать как часть содержащего документа, которая ссылается на ресурс, так и часть ссылочного ресурса, на который ссылаются.http://ns.adobe.com /xap/1.0/sType/Part#stPartPart


 01.18
01.18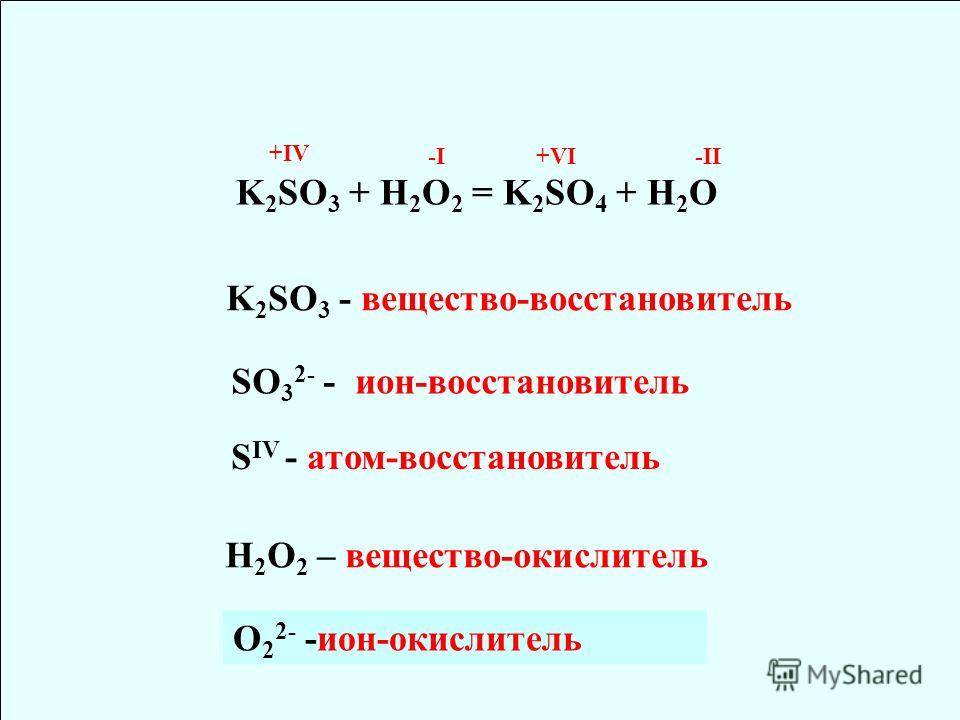
 Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.
Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую. Поскольку это газ, он немедленно выходит из системы. Если галогеноводород подвергается воздействию влажного воздуха, вы видите его в виде паров.
Поскольку это газ, он немедленно выходит из системы. Если галогеноводород подвергается воздействию влажного воздуха, вы видите его в виде паров. В этих случаях все, что вы получаете, — это паровые пары галогеноводорода — фтороводорода или хлороводорода.
В этих случаях все, что вы получаете, — это паровые пары галогеноводорода — фтороводорода или хлороводорода. Полууравнение для его образования:
Полууравнение для его образования: Там также будут красные цвета, где йод вступает в контакт с твердым йодидом.
Там также будут красные цвета, где йод вступает в контакт с твердым йодидом. Аргумент звучит так:
Аргумент звучит так: (Хотя чем ближе вы можете подобраться к истине, тем больше удовольствия!)
(Хотя чем ближе вы можете подобраться к истине, тем больше удовольствия!)
 Мы предполагаем, что вы начинаете с твердого галогенида натрия . Значения энтальпий решетки для других твердых галогенидов будут другими, но картина останется той же.
Мы предполагаем, что вы начинаете с твердого галогенида натрия . Значения энтальпий решетки для других твердых галогенидов будут другими, но картина останется той же.
 Это заблуждение!
Это заблуждение! (Прокрутите назад и снова посмотрите на таблицу.)
(Прокрутите назад и снова посмотрите на таблицу.)
 Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.
Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже. Он используется для отслеживания электронов в окислительно-восстановительной реакции. В целом сумма степеней окисления всех атомов в молекуле должна равняться общему заряду молекулы. Важно помнить некоторые из общепринятых степеней окисления атомов, чтобы можно было предсказать степени окисления других атомов. Вот некоторые ключевые степени окисления, которые полезно знать для MCAT:
Он используется для отслеживания электронов в окислительно-восстановительной реакции. В целом сумма степеней окисления всех атомов в молекуле должна равняться общему заряду молекулы. Важно помнить некоторые из общепринятых степеней окисления атомов, чтобы можно было предсказать степени окисления других атомов. Вот некоторые ключевые степени окисления, которые полезно знать для MCAT: