Метафосфорная кислота
Формула простейшей метафосфорной кислоты имеет вид: HPO3 — это стекловидное твердое вещество, обладает всеми свойствами кислот.
Триметафосфорная кислота (HPO3)3 построена из трех остатков метафосфорной кислоты, которые составляют замкнутый цикл.
Соответственно, тетраметафосфорная кислота (HPO3)4 построена из 4 остатков метафосфорной кислоты, и получается воздействием фосфорного ангидрида P2O5(V) на воду при низких температурах: P4O10+2h3O = (HPO3)4
Ортофосфорная кислота h4po4
Ортофосфорная (фосфорная) кислота является трехосновной кислотой средней силы (ее соли — фосфаты или ортофосфаты) бесцветные прозрачные кристаллы; температура плавления 42°C;
неограниченно растворяется в воде, с образованием водородных связей, как между собой (высокая вязкость раствора), так и с молекулами воды (высокая растворимость).
h4PO4 диссоциирует в три ступени:
h4PO4 ↔ H++h3PO4- (Kдис=7,5·10-3)
h3PO4- ↔ H++HPO42- (Kдис=6,2·10-8)
HPO42- ↔ H++PO43-(Kдис=5,0·10-13)
В водном р-ре фосфорной
кислоты преобладают ионы H+ и h3PO4-,
поскольку константы второй и третьей
ступени диссоциации намного меньше,
чем константа первой ступени.
Несмотря на тот факт, что фосфорная к-та обладает всеми свойствами общих кислот, она намного слабее, например, азотной или серной кислоты, и не обладает, в отличие от сильных кислот, сколь-нибудь значительными окислительными свойствами, что объясняется устойчивой степенью окисления фосфора (+5).
Как трехосновная кислота h4PO4 образует средние соли и два вида кислых солей, например:
фосфат натрия — Na3PO4
гидрофосфат натрия — Na2HPO4
дигидрофосфат натрия — Nah3PO4
В промышленности ортофосфорную кислоту получают воздействием серной кислоты на фосфориты и апатиты (экстракционный метод): Ca3(PO4)2+3h3SO4 = 2h4PO4+3CaSO4
Более чистая кислота получается сжиганием фосфора с последующим растворением в воде образующегося оксида P2O5.
Фосфорную кислоту применяют в производстве:
удобрений;
химических реактивов;
органических веществ;
катализаторов;
защитных покрытий на металлах;
в фармацевтической промышленности.

Полифосфорная кислота
Эти кислоты состоят из открытых цепей, в состав которых входят 2..10 атомов фосфора.
Все фосфорные кислоты получаются реакцией фосфорного ангидрида P2O5 с водой — чем больше концентрация оксида фосфора (V), тем больше образуется полифосфорной кислоты, и меньше — ортофосфорной. Фосфорноватистая кислота h4PO2 Бесцветные кристаллы, хорошо растворимые в воде.
Водный раствор фосфорноватистой кислоты является сильной одноосновной кислотой:
Фосфорноватистая кислота и ее соли (гипофосфиты) являются сильными восстановителями: h4PO2+2I2+2h3O = h4PO4+4HI
Фосфористая кислота h4po3
Твердое бесцветное вещество, обладающее гигроскопическими свойствами, хорошо растворимо в воде.
Водный раствор фосфористой кислоты является двухосновной кислотой средней силы: Соли фосфористой кислоты, называемые фосфитами, плохо растворимы в воде за исключением фосфитов щелочных металлов.
Фосфористая кислота и ее соли являются сильными восстановителями, восстанавливая неактивные металлы из их соединений: 2AgNO3+h4PO3+h3O = h4PO4+2Ag↓+2HNO3
Получение фосфористой кислоты: реакция оксида фосфора (III) с водой: P2O3+h3O = 2h4PO3; гидролиз тригалогенида фосфора: PCl3+3h3O = h4PO3+3HCl
Фосфор.
 Биологическое значение соединений фосфора. Соединения фосфора
Биологическое значение соединений фосфора. Соединения фосфораПохожие презентации:
Фосфор и его соединения
Фосфор и его соединения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Фосфор и его соединения
Фосфор и его соединения. 11 класс
Фосфор
Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы
Химический элемент фосфор. Фосфор в составе ДНК и РНК
Фосфор. Характеристика элемента
Основные классы неорганических соединений
2. Фосфор
3. Важное биологическое значение соединений фосфора
100 кг зерна содержит около 1 кгфосфора
Почва обедняется по содержанию
фосфора
На 100 кг почвы надо вносить
0.1 — 0.2 кг h4PO4
Фосфор содержится в белках и
нуклеиновых кислотах,
в мозговой ткани, в скелете человека и
животных, в мускулах
4. Важное биологическое значение соединений фосфора
Природные минералы :Фосфориты – Ca3(PO4)2
Апатиты – Ca3(PO4)2 CaX2 ( X = F, CI )
Фосфор открыт Гамбургским
купцом Брандтом :
2Ca3(PO4)2 + 10 С + 6SiO2
5е
2е
= Р4 +
нагрев.
 =
=CaSiO3 + 10 CO
5. Аллотропные формы фосфора
Фосфор белый – 4 –х атомная молекула Р4 суглами связи = 600. Структура напряженная,
что обусловливает высокую реакционную
способность этой формы
Р
Р
Р
Р
6. Аллотропные формы фосфора
АллотропныеР4
формы
хорошо растворим в
фосфора
CS2 , C6H6
и др. неполярных растворителях
Белый фосфор хранят под водой, но даже под
водой его можно заставить гореть :
5KCIO3 + 1.5 P4 + 9h3O = 6 h4PO4 + 5KCI
6е
20е
Белый фосфор очень ядовит ! ! !
7. Аллотропные формы фосфора
Красный фосфор является болееполимеризованной аллотропной
модификацией и менее активен
8. Степени окисления фосфора
Степени-3
окисления
+1
+3
фосфорноватистая
Ph4
фосфин
h4PO2
фосфора
+5
ортофосфорная
h4PO3
фосфористая
кислоты
h4PO4
9. Соединения фосфора с водородом
Фосфин – РН3P4 + 3KOH + 3h3O нагрев.

1е
+
3е
=
Ph4
3Kh3PO2
В этой реакции Р4 диспропорционирует
на Р3- и Р1+
Nh4 – хорошо растворим в воде
( 700 л в 1л Н2О ,
+
200С )
Отличие : РН3 – малорастворим,
т.к. не образует водородных связей с Н2О
10. Изменение основных свойств соединений ЭН3
Nh4–более сильное основание ( Kb = 10-5 ) ,
чем
РН3
( Kb = 10-26 )
Основные свойства убывают в ряду :
Nh4 >> Ph4 > Ash4 > Sbh4 > Bih4
Восстановительные свойства в этом ряду
увеличиваются ! ! !
11. Фосфорноватистая кислота h4PO2
OP
Н
H
O
Н
h4PO2 — к — та
одноосновная ( Ka = 10-1 )
Соли – гипофосфиты Nah3PO2 используются
в качестве сильных, но медленно действующих
восстановителей
12. Ангидрид фосфористой кислоты P4O6
Ангидрид фосфористой кислотыP
O
O
O
P
P
O
O
O
P
Следует обратить внимание на то,
что все связи в
Р4О6
являются
одинарными ! ! !
P4O6
13.
 Фосфористая кислота h4PO3Ангидрид фосфористой кислоты Р4О6
Фосфористая кислота h4PO3Ангидрид фосфористой кислоты Р4О6получают путем окисления фосфора
при недостатке кислорода :
Р4 + 3О2 = Р4О6
12е
Р4О6 +
Н3РО3
4е
6Н2О
= 4Н3РО3
кислота 2 – х основная :
K1 = 10-2
K2 = 10-7
14. Фосфористая кислота h4PO3
Н3РО3 кислота 2–х основная : K1 = 10-2, K2 = 10-7O
H
P
O
H
O
H
Н3РО3 и её соли Na2НPO3
являются восстановителями
15. Ангидрид фосфорной кислоты Р4О10
Строение:О
P
O
O
O
О
P
P
O
O
O
P
О
О
16. Получение высшего оксида P4O10
Путем сжигания фосфорав избытке кислорода :
P4 + 5O2 = P4O10
20е
4е
Окисление фосфора азотной кислотой :
3P + 5HNO3 + 2h3O = 3h4PO4 + 5NO
5е
3е
17. Свойства высшего оксида P4O10
Р4О10 обладает сильнейшимводоотнимающим свойством :
4HNO3 + P4O10 = 2N2O5 + 4HPO3
Процессы взаимодействия
Р4О10 с водой
очень сложные ! ! !
Рассмотрим их более подробно.

При медленном добавлении Р4О10
к ледяной воде образуется полимерная
тетраметафосфорная кислота ( НРО3 ) 4 :
Р4О10 + 2Н2О = ( НРО3 ) 4
( НРО3 )4 – циклический тетрамер
Н
О
О
Р
Р
О
Н
О
О
О
О
Р
Р
О
О
О
Н
Н
О
О
19. Процессы гидратации тетрамера ( НРО3 )4
( НРО3 )4 + Н2О = Н6Р4О13Н6Р4О13 – тетраполифосфорная кислота –
— линейный полимер
О
О
О
О
Р
Р
Р
Р
НО
О
ОН
О
ОН
О
ОН
ОН
ОН
20. Процессы гидратации тетрамера ( НРО3 )4
Дальнейший процесс гидратации протекаетс отщеплением молекул НРО3 :
Н6Р4О13 = НРО3 + Н5Р3О10 ( трифосфорная )
Н5Р3О10 = НРО3 + Н4Р2О7 ( дифосфорная )
Н4Р2О7 + Н2О = 2Н3РО4 ( ортофосфорная )
21. Процессы гидратации тетрамера ( НРО3 )4
Конечным продуктом гидратацииоксида фосфора ( V ) является
ортофосфорная кислота Н3РО4
22. Процессы гидратации Р4О10
Очень важно отметить тот факт,что процессы гидратации Р4О10
протекают очень
медленно ! ! !
23.
 Свойства фосфорных кислот( НРО3 )4 –тетрамер довольно сильная
Свойства фосфорных кислот( НРО3 )4 –тетрамер довольно сильнаякислота
( Ka = 10-2 )
Н3РО4 – ортофосфорная кислота :
K1 = 10-2
K2 = 10-8
K3 = 10-12
24. Ортофосфорная кислота Н3РО4 рК1 = 2.12 рК2 = 7.21 рК3 = 12.36
1α0
α1
α2
Н3РО4
Н2РО41-
НРО42-
α3
0
рН
РО43-
25. Свойства фосфорных кислот
Н4Р2О7—
дифосфорная кислота
более сильная, чем Н3РО4 :
K1 = 10-1
K2 = 10-2
K3 = 10-6
K4 = 10-9
26. Дифосфорная кислота Н4Р2О7 рК1 = 1.52 рК2 = 2.36 рК3= 6.60 рК4 = 9.25
Дифосфорная кислота Н4Р2О7рК1 = 1.52
1
рК2 = 2.36
рК3= 6.60
рК4 = 9.25
Н4Р2О7
α0
α1
α2
α3
α4
Н2Р2О72-
НР2О73-
Н3Р2О71-
0
рН
Р2О74-
27. Свойства солей фосфорных кислот
Найти рН 0.1 М р – ра K4P2O7Н4Р2О7
K1 = 10-1
K4P2O7
P2O74-aq
основание
+
H 2O
K2 = 10-2
4 K+aq
K3 = 10-6
+
K4 = 10-9
P2O74-aq
HP2O73-aq
+
сопряж.
 кислота
кислотаOh2-aq
28. Свойства солей фосфорных кислот ( К4Р2О7 )
P2O74-aqоснование
+ H 2O
HP2O73-aq
+ Oh2-aq
сопряж. кислота
Kb = Kw / K4 = 10-14 / 10-9 = 10-5
[ Oh2- ]
= ( 10-5 10-1 )0.5 = 10-3 м/л
рОН = 3
рН = 11
Степень превращения Р2О74- = 1%
29. Свойства солей фосфорных кислот ( К3НР2О7 )
Найти рН 0.1 М р – ра K3НP2O7Н4Р2О7
K1 = 10-1
HP2O73-
K2 = 10-2
кислота ( K4 = 10-9 )
HP2O73-aq
основание
+ h3O
K3 = 10-6
K4 = 10-9
H+ + P2O74-
h3P2O72-aq + ОН1-aq
сопр. к — та ( К3 = 10-6 )
30. Свойства солей фосфорных кислот ( К3НР2О7 )
HP2O73-aqоснование
h3P2O72-aq
+ h3 O
+ Oh2-aq
сопр. к — та ( К3 = 10-6 )
Kb = 10-14 / 10-6 = 10-8
Kb ( 10-8 ) > Ka4( 10-9 )
Cледовательно, у иона HP2O73-
преобладают основные свойства
[ H+ ] = ( К3 К4 )0.5 = ( 10-6 10-9 )0.5 = 10-7.5 м/л
рН = 7.5
31. Свойства солей фосфорных кислот ( К2Н2Р2О7 )
Найти рН 0. 1 М р – ра K2Н2P2O7
1 М р – ра K2Н2P2O7Н4Р2О7
K1 = 10-1
h3P2O72-
K2 = 10-2
кислота ( K3 = 10-6 )
h3P2O72-aq + h3O
основание
K3 = 10-6
K4 = 10-9
H+ + HP2O73-
h4P2O71-aq
+
ОН1-aq
сопр. к — та ( К2 = 10-2 )
32. Свойства солей фосфорных кислот ( К2Н2 Р2О7 )
h3P2O72-aq + h3Oоснование
h4P2O71-aq + ОН1-aq
сопр. к — та ( К2 = 10-2 )
Kb = 10-14 / 10-2 = 10-12
Kb ( 10-12 ) < Ka2 ( 10-2 )
Cледовательно, у иона h3P2O72преобладают кислотные свойства
[ H+ ] = ( К2 К3 )0.5 = ( 10-2 10-6 )0.5 = 10-4 м/л
рН = 4
33. Свойства солей фосфорных кислот ( Kh4P2O7 )
Найти рН 0.1 М р–ра K Н3P2O7Н4Р2О7
K1 = 10-1
h4P2O71-
K2 = 10-2
кислота ( K2 = 10-2 )
h4P2O71-aq + h3O
основание
K3 = 10-6
K4 = 10-9
H+ + h3P2O72-
h5 P2O7aq
+
сопр. к-та ( К1 = 10-1 )
ОН1-aq
34. Свойства солей фосфорных кислот ( Kh4P2O7 )
Свойства солей фосфорных кислот (h4P2O71-aq + h3O
основание
Kh4P2O7 )
h5P2O7aq + ОН1-aq
сопр.
 к — та ( К1 = 10-1 )
к — та ( К1 = 10-1 )Kb = 10-14 / 10-1 = 10-12
Kb ( 10-12 ) < Ka2 ( 10-2 )
Cледовательно, у иона h4P2O71преобладают кислотные свойства
[ H+ ] = ( К1 К2 )0.5 = ( 10-1 10-2 )0.5 = 10-1.5 м/л
рН = 1.5
35. Изополикислоты
Н4Р2О7+ НРО3 = Н5Р3О10
— три-
Н5Р3О10 + НРО3 = Н6Р4О13
— тетра-
Н6Р4О13 + НРО3 = Н7Р5О16
— пента
— фосфорные кислоты
36. Изополикислоты
Н3РО4 + 2Н2О = Н7РО6такой кислоты не существует,
назовем её гипотетической
Есть производные этой кислоты.
37. Гетерополикислоты
Н3РО4+ 12(Nh5)2MoO4 + 21HNO3 нагрев. =
+ 21Nh5NO3 + 10h3O +
(Nh5)3 h5 [ P(Mo2O7)6 ]
желтый осадок
Осадок – соль фосфорномолибденовой
гетерокислоты
38. Определение фосфат — ионов
Другая аналитическая реакция :MgCI2 + Nah3PO4 + ( Nh4 + Nh5CI, pH = 9 ) =
= MgNh5PO4
Характерные кристаллы
рассматривают в микроскоп ! ! !
39. Фосфорсодержащие удобрения
Ca3(PO4)2( апатиты, фосфориты — природное
сырье ) мало растворимы и плохо усваиваются
растениями
Ca3(PO4)2 + 2h3SO4 = Ca(h3PO4)2 + CaSO4
простой суперфосфат
содержит
14 — 20% Р4О10
40.
 Фосфорсодержащие удобренияCa3(PO4)2 + 3h3SO4 = 2h4PO4 + 3CaSO4
Фосфорсодержащие удобренияCa3(PO4)2 + 3h3SO4 = 2h4PO4 + 3CaSO44h4PO4 + Ca3(PO4)2 = 3Ca(h3PO4)2 –
двойной суперфосфат
содержит 40 — 50% Р4О10
41. Фосфорсодержащие удобрения
Ca(OH)2 + h4PO4 = CaHPO4 + 2h3O –преципитат ( 30 — 35% Р4О10 )
h4PO4 + 2Nh4 = (Nh5)2HPO4 – аммофос
(Nh5)KHPO4 – аммофоска содержит
три биологически активных
элемента ( K , N , P )
42. Соединения фосфора с галогенами
PJPF3
PCI3
PBr3
PF5
PCI5
Эти соединения – типичные
галогенангидриды,
практически полностью гидролизуются :
PCI5 +
4h3O = h4PO4 + 5HCI
43. Соединения фосфора с галогенами
Оксигалогениды фосфора :2PCI3 + O2 = 2 POCI3
P4O10 + 6PCI5 = 10 POCI3
POCI3 + h3O = h4PO4 + 3HCI
44. Соединения фосфора – аккумуляторы энергии в живых организмах
Источник энергии — окисление глюкозы :С6Н12О6 + 6О2 = 6СО2 + 6Н2О
ΔН = — 2800 кДж/м ! ! !
Выделившаяся энергия идет на
превращение аденозиндифосфата (
АДФ )
в аденозинтрифосфат ( АТФ )
45.
 Соединения фосфора – аккумуляторы энергии в живых организмах АТФ используется как источник энергии
Соединения фосфора – аккумуляторы энергии в живых организмах АТФ используется как источник энергиипо мере необходимости :
( АТФ ) [ Н4Р3О10аденозин ] + Н2О
Н3РО4 + ( АДФ ) [ h4P2O7 аденозин ] +
+ 33 кДж/м
English Русский Правила
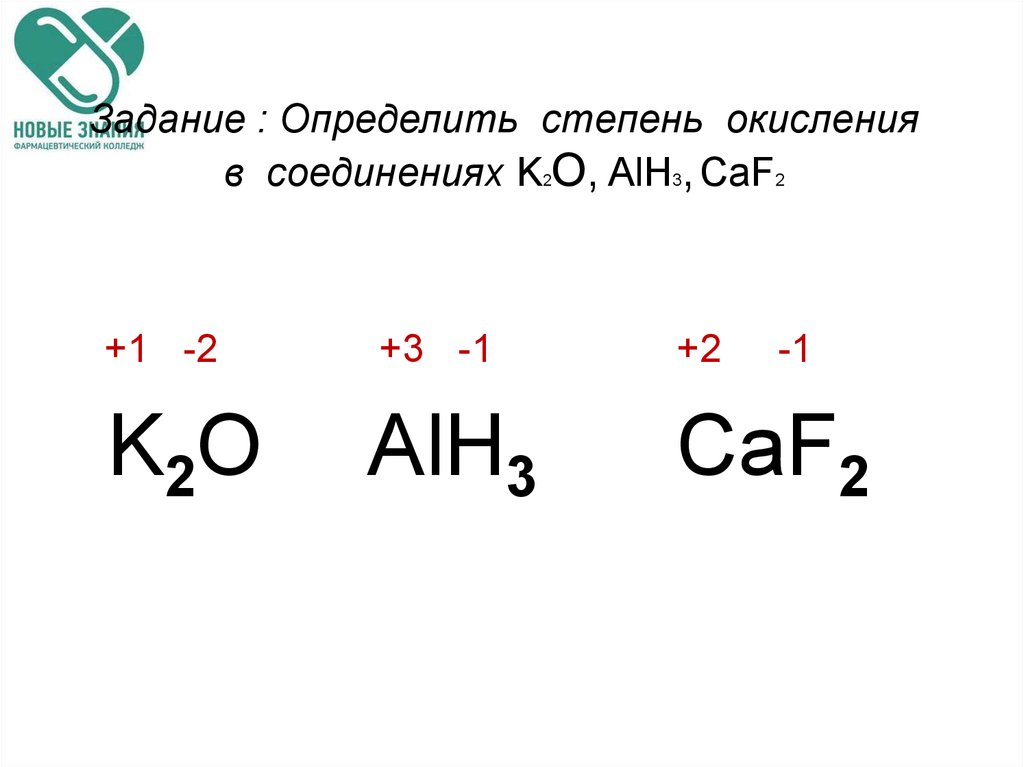
Фосфор имеет степень окисления +3 в: (A) Ортофосфорная кислота (B) Фосфористая кислота (C) Метафосфорная кислота (D) Пирофосфорная кислота
Дата последнего обновления: 07 марта 2023 г.
•
Всего просмотров: 266,1 k
•
Просмотров сегодня: 7.48k
Ответ
Проверено
266.1k+ просмотров
Подсказка: ковалентное соединение известно как степень окисления атома. Степень окисления описывает степень окисления, то есть потерю электронов атомом в химическом соединении.
Полное пошаговое решение:
— Первым элементом, открытие которого можно отнести к одному человеку, был фосфор. Элементарный фосфор существует в двух основных формах: белый фосфор и красный фосфор.
Элементарный фосфор существует в двух основных формах: белый фосфор и красный фосфор.
— Фосфор, являющийся высокореактивным, энергично реагирует с воздухом в его элементарной форме и воспламеняется.
— Фосфор часто образует соединения с одинаковыми степенями окисления, но с разными формулами.
-Для расчета степени окисления соединения необходимо помнить следующие правила-
(i) Степень окисления свободного элемента всегда равна нулю.
(ii) Степень окисления в случае одноатомного иона равна заряду иона.
(iii) Степень окисления водорода обычно равна +1, но когда он соединяется с менее электроотрицательными элементами, он проявляет степень окисления -1.
(iv) Степень окисления кислорода в соединениях обычно равна -2. В случае пероксидов степень окисления кислорода равна -1.
(v) Для элементов группы 1 степень окисления в соединении равна +1.
(vi) Для элементов группы 2 степень окисления равна +2.
(vii) Для окисления элементов группы 17 в бинарном соединении id -1.
(viii) Сумма степеней окисления всех атомов и ионов в нейтральном соединении равна нулю.
(ix) Сумма степеней окисления многоатомного иона равна заряду иона.
-Следуя вышеизложенным правилам, давайте теперь рассчитаем степени окисления соединений, указанных в опциях.
— Ортофосфорная кислота имеет химическую формулу ${{H}_{3}}P{{O}_{4}}$. Примем степень окисления Р в этом комплексе за х.
Согласно правилу (iii), водород будет иметь степень окисления +1.
Согласно правилу (iv), кислород будет иметь степень окисления -2.
Общий заряд комплекса нейтрален, то есть равен нулю.
Следовательно, степень окисления фосфора в ${{H}_{3}}P{{O}_{4}}=$ 3(1) + x + 4(-2) = 0
$\Rightarrow x =+5$
-Для фосфористой кислоты химическая формула ${{H}_{3}}P{{O}_{3}}$. Примем степень окисления Р в этом комплексе за х.
Согласно правилу (iii), водород будет иметь степень окисления +1.
Согласно правилу (iv), кислород будет иметь степень окисления -2.
Общий заряд комплекса нейтрален, то есть равен нулю.
Следовательно, степень окисления фосфора в ${{H}_{3}}P{{O}_{3}}=$3(1) + x + 3(-2)=0
$\Rightarrow x= +3$
— Метафосфорная кислота имеет химическую формулу $HP{{O}_{3}}$. Примем степень окисления Р в этом комплексе за х.
Согласно правилу (iii), водород будет иметь степень окисления +1.
Согласно правилу (iv), кислород будет иметь степень окисления -2.
Общий заряд комплекса нейтрален, то есть равен нулю.
Следовательно, степень окисления фосфора в $HP{{O}_{3}}=$ 1 + x + 3(-2) = 0
$\Rightarrow x=+5$
-Для пирофосфорной кислоты химическое формула ${{H}_{4}}{{P}_{2}}{{O}_{7}}$. Примем степень окисления Р в этом комплексе за х.
Согласно правилу (iii), водород будет иметь степень окисления +1.
Согласно правилу (iv), кислород будет иметь степень окисления -2.
Общий заряд комплекса нейтрален, то есть равен нулю.
Следовательно, степень окисления фосфора в ${{H}_{4}}{{P}_{2}}{{O}_{7}}=$ 4(1) + 2x + 7(-2 ) = 0
$\Rightarrow x=+5$ .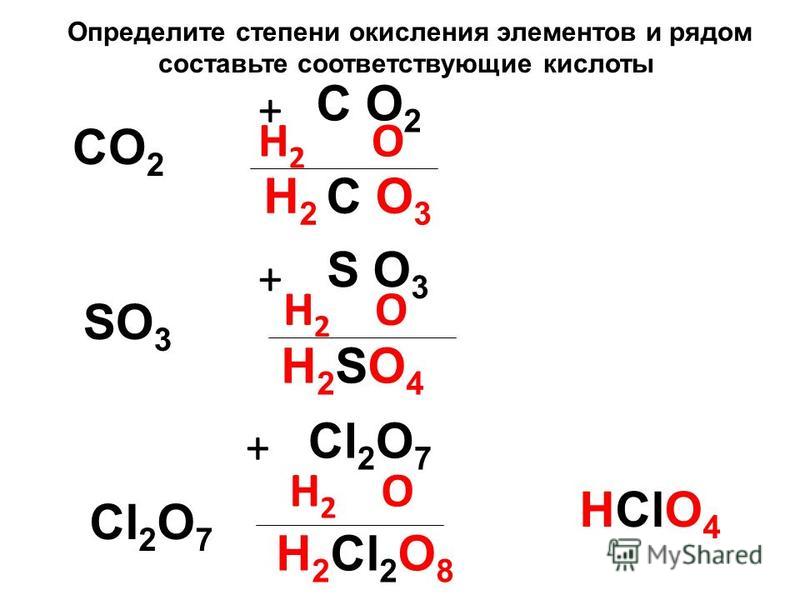
Итак, правильный ответ — только варианты B.
Примечание: Фосфор, будучи элементом третьего ряда, имеет пять пустых 2d-орбиталей, которые можно использовать для создания связи p-d способом, аналогичным связи pi, поэтому фосфор может расширить свою валентную оболочку на два электрона. Фосфорорганические соединения имеют фосфор в степенях окисления от -3 до +5.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий класс электродного потенциала 12 химия JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 химия JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 химия JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Кальций класс 12 химический JEE_Main
Тенденции сомнения
1.
 h4PO3 2. h4PO4 3. h4PO2 4. Прошлые годы (QYP2O7 NEET), вопросы, вопросы, годы Вопросы NCERT, банк вопросов, вопросы для классов 11 и 12 и решение в формате PDF с ответами
h4PO3 2. h4PO4 3. h4PO2 4. Прошлые годы (QYP2O7 NEET), вопросы, вопросы, годы Вопросы NCERT, банк вопросов, вопросы для классов 11 и 12 и решение в формате PDF с ответамиВыберите тему:
Ботаника Химия3220108 Зоология
Состояние окисления +1 для фосфора обнаружено в:
1. H 3 PO 3
2. H 3 PO 40135
. H 3 PO 4 40003 . 2 3 PO 40135
4. H 4 P 2 O 7
Q58:
87
% From NCERT
(1)
( 2)
(3)
(4)
Подтема: Окислители и восстановители |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep 9
NEET MCQ Books for XI th & XII th Physics, Chemistry & Biology
Какая из следующих реакций не представляет собой окислительно-восстановительное изменение?
1. CACO 3 → CAO + CO 2
2. 2H 2 + O 2 → 2H 2 O
3. Na + H 2 ON
3. Na + H 2 1/10003
3. Na + H 2 ON
3. Na + H 2 ON
3. Na + H 2 O
3, 2 H 2
4. MnCl 3 → MnCl 2 + 1/2 Cl 2
Q59:
70
% From NCERT
(1)
(2)
(3)
(4)
Подтема: Введение в окислительно-восстановительный потенциал и число окисления |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите NeetPrep’s Уникальные MCQ Books с онлайн Audio/Video/Text Solutions с помощью Telegram Bot
NEET MCQ Books для XI TH & XII TH Physics, Chemistry & Biology
, если H 2 S IS 2 S IS IS 2 S IS 2 S IS 2 . пропущен через подкисленный раствор K 2 Cr 2 O 7 , цвет раствора:
а. останется без изменений
б. изменится на темно-красный
c. изменится на темно-зеленый
d. will change to dark brown
Q60:
60
%
(1)
(2)
(3)
(4)
Подтема: Введение в окислительно-восстановительный потенциал и число окисления |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Physics, Chemistry & Biology
5 Число окисления серы и ковалентность в молекуле серы (S
1. 0 и 2
2. +6 и 8
3. 0 и 8
4. +6 и 2
Q61:
53
%от Ncert
( 1)
(2)
(3)
(4)
Подтема: Окислители и восстановители |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получить NeetPrep’s Уникальные MCQ Books с онлайн Audio/Video/Text Solutions с помощью Telegram Bot
NEET MCQ Books для XI TH & XII TH Physics, Chemistry & Biology
H 2 S Arder Is Arass Is Arass Is Arass Is Aray Shareshistry
H 2 через подкисленный раствор медного купороса и образуется черный осадок. Это связано с:
1. Окисление Cu 2+
2. Снижение CU 2+
3. Двойное разложение
4. Русбережение и окисление
Q62:
от NCERT
- 9919 (1)
(2)
(3)
(4)
Подтема: Окислители и восстановители |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги
Книги NEET MCQ для XI th & XII th Physics, Chemistry & Biology наиболее распространенное состояние окисления
5 элемент -2. Количество электронов, присутствующих в его внешней оболочке:
1,2
2,4
3,6
4. 8
Q63:
77
% From NCERT
(1)
(2)
(3)
(4)
Подтема: Окислители и восстановители |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Get NEETprep’s Unique MCQ Books with Online Audio/Video/Text Solutions via Telegram Bot
NEET MCQ Books for XI th & XII th Physics, Chemistry & Biology
4P + 3KOH + 3H 2 O → 3KH 2 PO 2 + PH 3 :
Правильное утверждение относительно приведенной выше реакции —
1. P окисляется только
2. P снижается только
3. P окисляется, а также снижается
4. Ни один из вышеуказанных
Q64:
86
%от NCERT 9003
%от NCERT 9003
%.
(1)
(2)
(3)
(4)
(4)
|
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th & XII th Physics, Chemistry & Biology
In which SO 2 acts as oxidant, while reacting with:
1. acidified KMnO 4
2. acidified K 2 Cr 2 O 7
3. H 2 S
H 2 S
4. H 2 0 2
Q65:
61
%
(1)
(2)
(3)
(4)
Подтема: Окислители и восстановители |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th & XII th Physics, Chemistry & Biology
В реакции;
3Br 2 + 6CO32- + 3H 2 O →5Br — + BrO3- + 6HCO3-
какое утверждение верно?
1. BR 2 — окислен
BR 2 — окислен
2. BR 2 снижается
3. BR 2 — ни окислен, ни уменьшен
4. Br 2 не окисляется, а также, а также
Q666 66666666666666666666666666666666 2 2 . :
83
% От NCERT
(1)
(2)
(3)
(4)
Подтема: Введение в окислительно-восстановительный потенциал |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Физика, химия и биология Когда Na растворяется в воде
5 ион натрия превращается в:
1.

