что, как сбалансировать и часто задаваемые вопросы —
By Айон Маджумдер
Бромистоводородная кислота (HBr) представляет собой сжатый сжиженный газ и диоксид серы (SO2) представляет собой бесцветный сжиженный газ с резким запахом. Давайте обсудим реакцию между ними.
HBr является одной из самых сильнодействующих кислот и восстановителем. ТАК2 является кислотным оксидом и также обладает окислительным свойством. Таким образом, реакция между восстановителем и окислителем даст нам некоторые новые представления о том, как протекает химическая реакция. продолжается.
В этой статье мы обсудим продукты, как сбалансировать реакцию, обратимость, тип и многие другие факты о реакции между HBr и SO.2 более подробно.
Что является продуктом HBr и SO2?Полученные продукты представляют собой твердую серу (S), красновато-коричневый газообразный бром (Br2) и вода ( H2O) в результате реакции между бромистым водородом (HBr) и диоксидом серы (SO2).
Реакция:-
HBr(водн.) +SO2(водный) ➝ H2O(ж)+ S(тв)+ Br2(Водно)
Какой тип реакции HBr + SO2?Реакция между HBr и SO2 это тип Окислительно-восстановительная реакция, Необратимая реакция, Эндотермическая реакция, и Реакция на осаждение.
Как сбалансировать HBr + SO2?Чтобы сбалансировать реакцию HBr + SO2, указанные шаги должны быть выполнены в Число окисления метод: —
- Сначала найдите степени окисления каждого атома, чтобы определить, какие атомы окисляются, а какие восстанавливаются.
- HBr(водн.) +SO2(водный) ➝ H2O(ж)+ S(тв)+ Br2(водн.) — из этой реакции степени окисления, генерируемые каждым атомом, показаны в таблице ниже.
| атомы | ВКЛ на стороне реагента | ВКЛ на стороне продукта |
|---|---|---|
| Br | -1 | 0 |
| S | +4 | 0 |
| O | -2 | -2 |
- Судя по счету ON, Br здесь окисляется (от -1 до 0), а S восстанавливается (от +4 до 0).

- Увеличение НА Br =0 – (-1)=1 ед.
- Снижение ВКЛ S =(+4)-(0)= 4 ед.
- Чтобы сбалансировать это уравнение, S и Br должны находиться в соотношении 1:4.
- Баланс Н2O путем проверки атомов кислорода с обеих сторон.
- Следовательно, окончательное сбалансированное уравнение:
S(IV)O2 (водн.) + 4HBr(-1)(водн.) = S(0)(с) +2Br2(0) + 2H2O
Титрование между HBr и SO2 нельзя сделать напрямую, так как HBr является сильной кислотой и SO2 также является кислотным оксидом и SO2 находится в газообразном состоянии.
HBr + SO2 чистое ионное уравнениеСуммарное ионное уравнение HBr + SO2 является:-
S(IV)O2 (водн. ) + 4H+(водн.) + 4Br –(водн.)= S(0)(с) +2Br2(0) + 2H+(водн.) +2 ОН–(Водно)
) + 4H+(водн.) + 4Br –(водн.)= S(0)(с) +2Br2(0) + 2H+(водн.) +2 ОН–(Водно)
- Поскольку на стороне реагента HBr является сильной кислотой, поэтому в водном растворе он ионизируется до H+ и Br– но
- Как ТАК2 является кислотным оксидом, поэтому он не разлагается на ионы.
- В продукте, боковая сера осаждается в виде твердого вещества, а Br2 представляет собой нейтральное ковалентное соединение, поэтому эти два не распадаются на ионы.
- H2O (вода) разлагается до H+ и ОН– немного.
- Таким образом, чистое ионное уравнение становится:
S(IV)O2 (водн.) + 4H+(водн.) + 4Br –(водн.)= S(0)(с) +2Br2(0) + 2H+(водн. ) +2 ОН–(Водно)
) +2 ОН–(Водно)
Сопряженные пары HBr + SO2 реакция –
- Поскольку HBr является сильной кислотой, поэтому в водном растворе HBr отдает протон, так что Br– является сопряженным основанием HBr.
- Как ТАК2 является кислотным оксидом, поэтому у него нет сопряженной пары.
In HBr + SO2 реакции, в молекулах реагентов действуют следующие межмолекулярные силы:
- HBr представляет собой полярную ковалентную сильную кислоту. Обладает межмолекулярным Н-склеивание взаимодействие (сильное) с другими молекулами HBr и ионные диполь-дипольные взаимодействия (кулоновская сила притяжения) присутствуют между H+ и Br – для формирования HBr.

- Как ТАК2 представляет собой полярную ковалентную молекулу, поэтому она обладает диполь-дипольные взаимодействия.
- Твердая сера (S) обладает силой притяжения Ван-дер-Волла, так как является неполярным твердым соединением.
- В бр.2 только лондонско-дисперсионная сила притяжения присутствует, поскольку это неполярная ковалентная молекула.
- В воде (H2O) присутствует межмолекулярная Н-связь.
Чистая энтальпия реакции HBr + SO2 реакция +66.5 кДж/моль .
Наблюдения и советы этой статьи мы подготовили на основании опыта команды стандартные энтальпии пласта реагентов и продуктов:
| Молекулы | Энтальпия образования (кДж/моль) |
|---|---|
| HBr | -36. 2 2 |
| SO2 | -296.9 |
| H2O | -187.6 |
| Br2 | 0 |
| S | 0 |
Энтальпия реакции ΔHf = Стандартная энтальпия продуктов – Стандартная энтальпия реагентов
Таким образом, ΔHf =[0+0+2(-187.6)]-[(-296.9)+4(-36.2)]
=+66.5 кДж/моль
HBr+ SO2 буферный раствор?HBr+SO2 не буферный раствор поскольку HBr — сильная кислота, а SO2 является оксидом, поэтому он не может образовывать буферный раствор. Чтобы приготовить буферный раствор, нам нужна слабая кислота и соль этой кислоты, поддерживающая рH решения а тут нельзя.
HBr+ SO2 реакция является полной реакцией, поскольку после нее не происходит никакой дальнейшей реакции, и не происходит обратной реакции, поскольку сера осаждается.
HBr + SO2 экзотермическая или эндотермическая реакция?HBr+ SO2 реакция носит эндотермический характер, так как реакция положительная энтальпийное значение, +66.5 кДж/моль указывает на то, что реакция требует энергии для осуществления реакции в прямом направлении в виде тепла.
HBr + SO2 окислительно-восстановительная реакция?HBr+ SO2 реакция представляет собой окислительно-восстановительную реакцию, в которой одновременно происходит окисление Br (от -1 до 0) и восстановление серы (от +4 до 0). Здесь HBr – восстановитель, а SO2 является окислителем.Возникновение окисления и восстановления одновременно
HBr + SO2 реакция осаждения?HBr+ SO2 реакция является реакцией осаждения, потому что желтая твердая сера [S(0)] осаждается как продукт, который трудно растворяется в воде или кислоте.
HBr+ SO2 реакция является необратимой реакцией, однонаправленный, так как все реагенты реагируют с образованием продуктов, и сера выпадает в осадок, который не может вернуться обратно в SO2 в этом реакционном состоянии.
HBr + SO2 реакция смещения?HBr+ SO2 реакция не является реакцией замещения, так как атомы не замещаются друг другом с образованием продуктов.
Заключение
Из приведенного выше обсуждения следует, что реакция между сильной кислотой (HBr) и кислым оксидом (SO2) с образованием серы, что очень важно для промышленного использования. Это окислительно-восстановительная реакция, которую можно проводить и при комнатной температуре. Так что это энергия, а также рентабельность.
ГДЗ Хімія 8 клас Григорович §40 2021 / §42 2016 ГЕНЕТИЧНІ ЗВ’ЯЗКИ МІЖ КЛАСАМИ НЕОРГАНІЧНИХ СПОЛУК відповіді » Допомога учням
Інші завдання дивись тут. ..
..
Завдання для засвоєння матеріалу
Вправа 1
Складіть формули таких речовин: кальцій оксид CaO, калій оксид K2O, фосфор (III) оксид P2O3, барій оксид BaO, цинк оксид ZnO, сульфідна кислота H2S, карбонатна кислота H2CO3, магній гідроксид Mg(OH)2, ферум (II) гідроксид Fe(OH)2, силікатна кислота H2SiO3, купрум (II) гідроксид Cu(OH)2, літій гідроксид LiOH, калій гідроксид KOH, нікол (II) сульфат NiSO4, алюміній гідроксид Al(OH)3, натрій ортофосфат Na3PO4, хлоридна кислота HCl, ортофосфатна кислота H3PO4.
Вправа 2
Із наведених формул речовин випишіть окремо формули та назви оксидів, кислот, основ і солей: NaOH, HCl, H2SO4, Ca(OH)2, HBr, Cu(OH)2, H3PO4, H2SiО3, H2S, NaOH, Fe(OH)2, K2SO4, CaBr2, CuCO3, CO2, Mg(OH)2, AlPO4, SO3, HI, CuSO4, Zn(OH)2, Ba(NO3)2, FeCl3, Na2S, Al(NO3)3, Ba3(PO4)2.
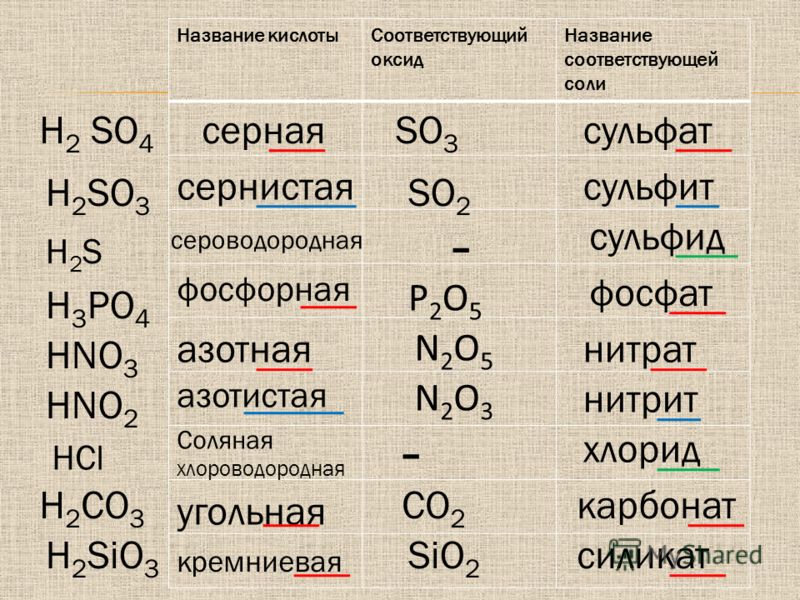
Оксиди: CO2 карбон (IV) оксид, SO3 сульфур (VI) оксид.
Кислоти: HCl хлоридна кислота, H2SO4 сульфатна кислота, HBr бромідна кислота, H3PO4 ортофосфатна кислота, H2SiО3 силікатна кислота, H2S сульфідна кислота, HI йодидна кислота.
Основи: NaOH натрій гідроксид, Ca(OH)2 кальцій гідроксид, Cu(OH)2 купрум (ІІ) гідроксид, Fe(OH)2 ферум (ІІ) гідроксид, Mg(OH)2 магній гідроксид, Zn(OH)2 цинк гідроксид.
Солі: K2SO4 калій сульфат, CaBr2 кальцій бромід, CuCO3 купрум (ІІ) карбонат, AlPO4 алюміній ортофосфат, CuSO4 купрум (ІІ) сульфат, Ba(NO3)2 барій нітрат, FeCl3 ферум (ІІІ) хлорид, Na2S натрій сульфід, Al(NO3)3 алюміній нітрат, Ba3(PO4)2 барій ортофосфат.
Оксиди — це бінарні сполуки елементів з Оксигеном, і яких Оксиген виявляє ступінь окиснення -2.
Кислоти — це складні речовини, що складаються з йонів Гідрогену та кислотного залишку.
Основи — це сполуки, що складаються з йонів металічного елемента й одного або декількох гідроксид-іонів OH–.
Солі — це сполуки, що складаються з йонів металічних елементів та кислотних залишків.
Вправа 3
Невідомий оксид розчиняється у воді з утворенням розчину, що забарвлює лакмус у червоний колір. Який висновок можна зробити щодо характеру властивостей цього оксиду? Це кислотний оксид. Чи буде він взаємодіяти з хлоридною кислотою, натрій гідроксидом, натрій хлоридом, кальцій оксидом? Відповідь обґрунтуйте. Кислотні оксиди взаємодіють з лугами і основними оксидами, тому кислотний оксид, наприклад, СО2 буде реагувати з натрій гідроксидом і кальцій оксидом.
СО2 + 2NaOH = Na2CO3 + H2O
CO2 + CaO = CaCO3
Вправа 4
Проілюструйте генетичний зв’язок між класами неорганічних речовин на прикладі магнію й сірки.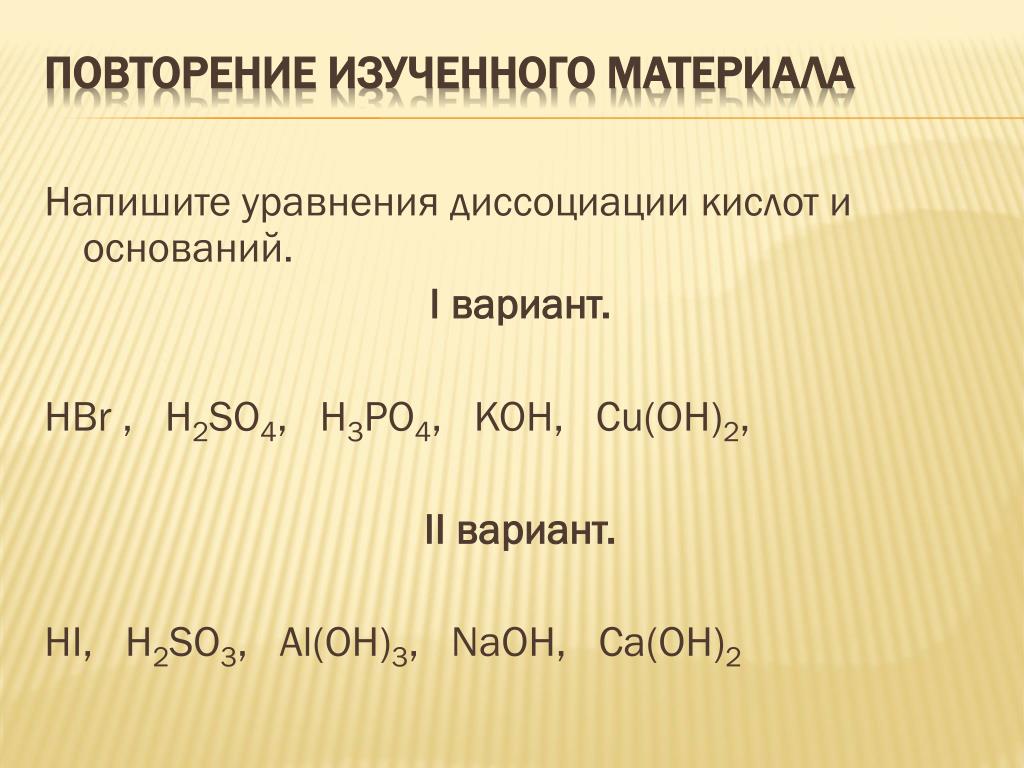 Складіть відповідні рівняння реакцій.
Складіть відповідні рівняння реакцій.
Mg → MgO → MgSO4
2Mg + O2 = 2MgO
MgO + H2SO4 = MgSO4 + H2O
При згорянні магнію утворюється основний оксид MgO. З водою магній оксид не взаємодіє, бо не утворює лугу (не є оксидом лужного і лужноземельного елемента). При взаємодії основного оксиду і кислоти утворюється сіль.
S → SO2 → H2SO3
S + O2 = SO2
SO2 + H2O = H2SO3
При згорянні сірки утворюється кислотний оксид SO2, що реагує з водою з утворенням сульфітної кислоти H2SO3.
Вправа 5
Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
а) Mg → MgО → MgCl2 → MgCO3 → Mg(NO3)2;
2Mg + O2 = 2MgO
MgO + 2HCl = MgCl2 + H2O
MgCl2 + Na2CO3 = 2NaCl + MgCO3
MgCO3 + 2HNO3 = Mg(NO3)2 + H2O + CO2↑
б) S → SO2 → Na2SO3 → BaSO3 → SO2;
S + O2 = SO2
SO2 + Na2O = Na2SO3
Na2SO3 + BaCl2 = BaSO3↓+ 2NaCl
BaSO3 = BaO + SO2↑
в) Na → NaOH → Na2SO4 → NaCl → NaNO3.
2Na + 2H2O = 2NaOH + H2↑
2NaOH + SO3 = Na2SO4 + H2O
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
NaCl + AgNO3 = NaNO3 + AgCl↓
Вправа 6
Наведіть рівняння реакцій, що ілюструють чотири різні способи добування кальцій карбонату.
СaO + CO2 = CaCO3
Ca(OH)2 + CO2 = CaCO3 + H2O
Ca(OH)2 + Na2CO3 = CaCO3 + 2NaOH
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Вправа 7
Розташуйте запропоновані речовини за порядком, що характеризує генетичний
зв’язок класів речовин, та складіть відповідні рівняння реакцій:
а) фосфор (V) оксид, калій ортофосфат, фосфор, ортофосфатна кислота;
Р -> P2O5 -> H3PO4 -> K3PO4
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
б) барій гідроксид, барій оксид, барій карбонат, барій;
Ba -> BaO -> Ba(OH)2 -> BaCO3
2Ba + O2 = 2BaO
BaO + H2O = Ba(OH)2↓
Ba(OH)2 + H2CO3 = BaCO3 + 2H2O
в) купрум (II) оксид, купрум (II) гідроксид, мідь, купрум (II) сульфат.
Cu -> CuO -> CuSO4 -> Cu(OH)2
2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
Вправа 8
Як добути кальцій хлорид з кальцій нітрату, використовуючи калій карбонат і хлоридну кислоту? Складіть рівняння реакцій.
Ca(NO3)2 + K2CO3 = CaCO3↓ + 2KNO3
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Вправа 9
Визначте відсутні ланки ланцюгів перетворень, що характеризують генетичний зв’язок речовин. Складіть рівняння реакцій, що характеризують ці перетворення.
а) S → ? → H2SO3 → CaSO3;
S → SO2→ H2SO3 → CaSO3;
S + O2 = SO2
SO2 + H2O = H2SO3
H2SO3 + Ca(OH)2 = CaSO3 + 2H2O
б) Fe → Fe2O3 → ? → Fe(OH)3.
Fe → Fe2O3 → FeCl3 → Fe(OH)3.
4Fe + 3O2 = 2Fe2O3
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
Вправа 10
Складіть рівняння реакцій для здійснення таких перетворень:
а) Ca → CaO → Ca(ОН)2 → CaСl2;
2Ca + O2 = 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
б) S → SО2 → Н2SО3 → Nа2SО3;
S + O2 = SO2
SO2 + H2O = H2SO3
H2SO3 + 2NaOH = Na2SO3 + 2H2O
в) Ba → BaО → Ba(ОН)2 → BaSО4;
2Ba + O2 = 2BaO
BaO + H2O = Ba(OH)2
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
г) С → CO2 → CaCO3 → CaСl2 → Ca(ОН)2;
C + O2 = CO2↑
CO2 + CaO = CaCO3
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CaCl2 + 2NaOH = Ca(OH)2 + 2NaCl
д) NаОН → Nа2CO3 → CO2 → MgCO3;
2NaOH + H2CO3 = Na2CO3 + 2H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CO2 + MgO = MgCO3
е) Аl → Аl2О3 → Аl2(SО4)3 → Аl(ОН)3 → Аl2О3;
4Al + 3O2 = 2Al2O3
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Al2(SO4)3 + 6NaOH = 2Al(OH)3↓+ 3Na2SO4
2Al(OH)3↓ = Al2O3 + 3H2O
є) Fe → Fe2O3 → Fe(NO3)3 → Fe(OH)3 → Fe2O3 → Fe → FeCl2.
4Fe + 3O2 = 2Fe2O3
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3↓+ 3NaNO3
2Fe(OH)3↓ = Fe2O3 + 3H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
Fe+ 2HCl = FeCl2 + H2↑
Вправа 11
Визначте відсутні ланки ланцюгів, що характеризують генетичний зв’язок речовин:
а) Ca → ? → ? → Ca(NO3)2;
Ca -> CaO -> Ca(OH)2 -> Ca(NO3)2
2Ca + O2 = 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
б) SO3 -> ? -> ? -> ?
SO3 -> H2SO4 -> MgSO4 -> Mg(OH)2
SO3 + H2O = H2SO4
H2SO4 + Mg = MgSO4 + H2↑
MgSO4 + 2NaOH = Na2SO4 + Mg(OH)2
в) Mg(OH)2 -> ? -> ? -> ? -> ?
Mg(OH)2 -> MgO -> MgCl2 -> Mg(OH)2 -> MgSO4
Mg(OH)2↓= MgO + H2O
MgO + 2HCl = MgCl2 + H2O
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Вправа 12
До розчину блакитного кольору додали розчин лугу, при цьому випав блакитний осад.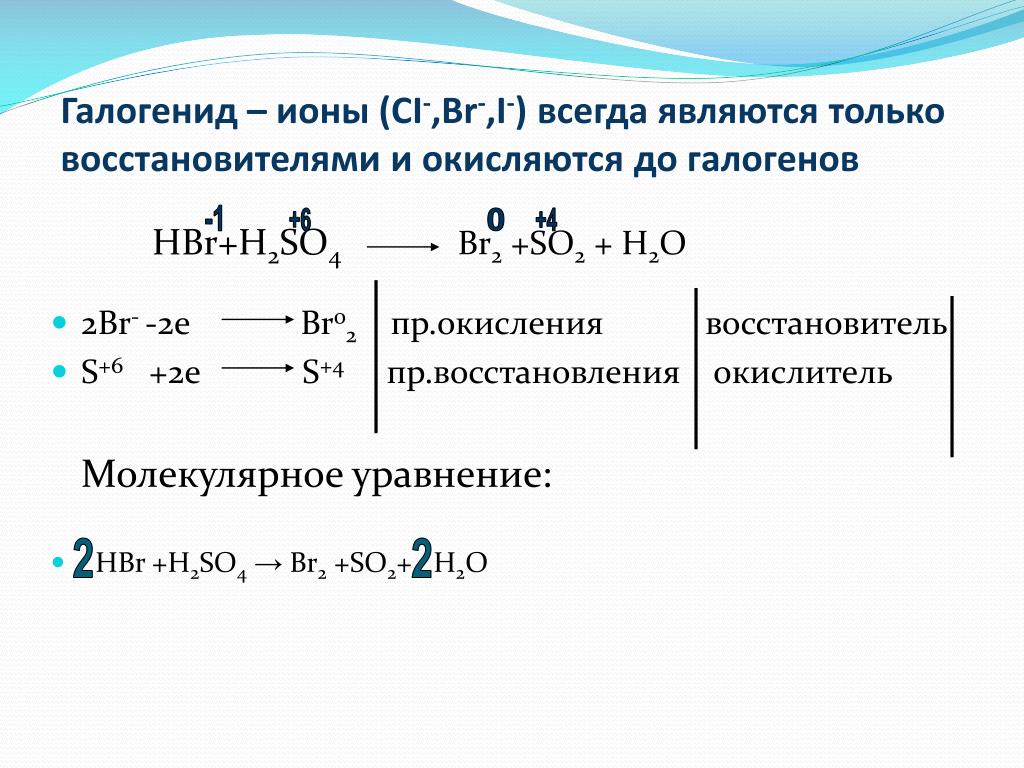 Осад відфільтрували і прожарили. У результаті одержали чорний порошок, що потім обробили воднем під час нагрівання.
Осад відфільтрували і прожарили. У результаті одержали чорний порошок, що потім обробили воднем під час нагрівання.
Утворився метал червоного кольору. Визначте описані речовини, складіть рівняння реакцій.
Речовини: розчин мідного купоросу CuSO4 має блакитний колір, розчин натрій гідроксиду NaOH, купрум (ІІ) гідроксид Cu(OH)2, купрум оксид CuO, метал купрум Cu.
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ — осад блакитного кольору
Cu(OH)2↓ = Н2О + CuO — оксид чорного кольору
CuO + H2 = Н2О + Cu — метал червоного кольору
Вправа 13
Порівняйте об’єм сульфур (IV) оксиду (за н.у.), що можна добути із сірки масою 480 г та натрій сульфіту масою 630 г.
Відомо: m(S)=480 г, m(Na2SO3)=630 г
Порівняти V1(SO2) і V2(SO2)
Розв’язування
І спосіб
1. Обчислюємо кількості речовини сірки масою 480 г і натрій сульфіту масою 630 г за формулою n=m/M, де M=Mr г/моль.
Обчислюємо кількості речовини сірки масою 480 г і натрій сульфіту масою 630 г за формулою n=m/M, де M=Mr г/моль.
Mr(S)=Ar(S)=32, M(S)=32 г/моль,
Mr(Na2SO3)=2•Ar(Na)+Ar(S)+3•Ar(О)=2•23+32+3•16=126, M(Na2SО3)=126 г/моль
n(S)=m(S)/M(S)=480 г : 32 г/моль=15 моль
n(Na2SО3)=m(Na2SО3)/M(Na2SО3)=630 г : 126 г/моль=5 моль
2. Записуємо два рівняння реакції:
S + O2 = SO2↑ (1)
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑ (2)
За рівнянням реакції (1) n(S):n1(SО2)=1:1, кількість речовини однакова, тому
n1(SO2)=n(S)=15 моль
За рівнянням реакції (2) n(Na2SO3):n2(SО2)=1:1, кількість речовини однакова, тому
n2(SO2)=n(Na2SO3)=5 моль
3, Обчислюємо об’єми SO2 кількість речовини 15 моль і 5 моль за формулою V=n•VM
V1(SO2)=n1(SO2)•VM=15 моль•22,4 л/моль=336 л
V2(SO2)=n2(SO2)•VM=5 моль•22,4 л/моль=112 л
V1(SO2)>V2(SO2)
ІІ спосіб
Записуємо два рівняння реакції:
S + O2 = SO2↑ (1)
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑ (2)
За рівнянням реакції (1) n(S)/1=n1(SO2)/1
У ццьому співвідношенні замінюємо кількість речовини сульфур (IV) оксиду на співвідношення об’ємів, а кількість речовини сірки — на співвідношення мас.
V1(SO2)/VM=m(S)/M(S)
Звідси виражаємо об’єм газу сульфур (IV) оксиду:
V1(SO2)•М(S)=m(S)•VM, тому
V1(SO2)=m(S)•VM:M(S)
Обчислюємо молярну масу сірки і підставляємо значення у формулу.
Mr(S)=Ar(S)=32, M(S)=32 г/моль
V1(SO2)=480 г • 22,4 л/моль : 32 г/моль=336 л
За рівнянням реакції (2) n(Na2SO3)/1=n1(SO2)/1
У цьому співвідношені замінюємо кількість речовини сульфур (IV) оксиду на співвідношення об’ємів, а кількість речовини натрій сульфіту — на співвідношення мас.
V2(SO2)/VM=m(Na2SO3)/M(Na2SO3)
Звідси виражаємо об’єм газу сульфур (IV) оксиду:
V2(SO2)•М(Na2SO3)=m(Na2SO3)•VM, тому
V2(SO2)=m(Na2SO3)•VM:M(Na2SO3)
Обчислюємо молярну масу Na2SO3 і підставляємо значення у формулу.
Mr(Na2SO3)=2•Ar(Na)+Ar(S)+3•Ar(О)=2•23+32+3•16=126, тому M(Na2SО3)=126 г/моль
V2(SO2)=630 г•22,4 л/моль:126 г/моль=112 л
V1(SO2)>V2(SO2)
Відповідь: більший об’єм SO2 можна добути з порції cірки
Вправа 14
Обчисліть масу фосфору, що необхідно ввести в низку перетворень для добування кальцій ортофосфату масою 15,5 г.
Відомо: m(Са3(PО4)2)=15,5 г
Знайти m(P)-?
Розв’язування
1. Обчислюємо кількість речовини Са3(PО4)2 масою 15,5 г за формулою n=m/M, де
M=Mr г/моль
Mr(Са3(PО4)2)=3•Ar(Ca)+2•Ar(P)+8•Ar(O)=3•40+2•31+8•16=310, М(Ca3(PO4)2)=310 г/моль
n(Ca3(PO4)2)=m(Ca3(PO4)2)/M(Ca3(PO4)2)=15,5 г : 310 г/моль=0,05 моль
2. Записуємо рівняння реакції: 2P2O5+ 6CaО = 2Ca3(PO4)2
Записуємо рівняння реакції: 2P2O5+ 6CaО = 2Ca3(PO4)2
За рівнянням реакції n(P2O5):n(Ca3(PO4)2)=2:2=1:1, кількості речовини однакові,
n(P2O5)=n(Са3(PO4)2=0,05 моль
3. Записуємо рівняння реакції: 4Р + 5О2=2Р2О5
За рівнянням реакції n(P):n(P2O5)=4:2, звідси
n(P)•2=n(P2O5)•4, тому
n(P)=4•n(P2O5):2=4•0,05:2=0,1 моль
4. Обчислюємо масу фосфору кількістю речовини 0,1 моль за формулою m=n•M
Mr(P)=Ar(P)=31, тому М(P)=31 г/моль
m(P)=n(P)•M(P)=0,1•31=3,1 г
Відповідь: 3,1 г
Інші завдання дивись тут…
What, How to Balance & FAQs —
By Ayon Majumder
Бромистоводородная кислота (HBr) представляет собой сжатый сжиженный газ, а диоксид серы (SO 2 ) представляет собой бесцветный сжиженный газ с резким запахом. Давайте обсудим реакцию между ними.
Давайте обсудим реакцию между ними.
HBr — одна из самых сильнодействующих кислот и восстановитель. SO 2 представляет собой кислотный оксид и также обладает окисляющими свойствами. Таким образом, реакция между восстановителем и окислителем даст нам несколько новых идей о том, как протекает химическая реакция 9.0010 продолжается.
В этой статье мы более подробно обсудим продукты, как сбалансировать реакцию, обратимость, тип и многие другие факты о реакции между HBr и SO 2 .
Что является продуктом HBr и SO 2 ?Полученные продукты представляют собой твердую серу (S), красновато-коричневый газообразный бром (Br 2 ) и воду (H 2 O) в результате реакции между бромистым водородом (HBr) и диоксидом серы (SO). 2 ).
Реакция:-
HBr(водн.) + SO 2 (водн. ) ➝ H 2 O(ж)+ S (т)+ Br 2 900 06 (водный)
) ➝ H 2 O(ж)+ S (т)+ Br 2 900 06 (водный)
Реакция между HBr и SO 2 относится к типу Окислительно-восстановительная реакция , Необратимая реакция , Эндотермическая реакция , и реакция осаждения .
Как сбалансировать HBr + SO 2 ?Чтобы сбалансировать реакцию HBr + SO 2 , в методе степени окисления необходимо выполнить следующие шаги: —
- Сначала найдите степени окисления каждого атома, чтобы определить, какие атомы окисляются. и уменьшено.
- HBr(водн.) +SO 2 (водн.) ➝ H 2 O(л)+ S (тв.)+ Br 2 (водн.) показаны в таблице ниже.
| Атомы | О. Н. на стороне реагента Н. на стороне реагента | О.Н. со стороны изделия |
|---|---|---|
| Br | -1 | 0 |
| S | +4 | 0 |
| О | -2 | -2 |
- Из О.Н. подсчет, Br окисляется (от -1 до 0), а S восстанавливается (от +4 до 0).
- Увеличение О.Н. Br =0 – (-1) =1 ед.
- Снижение О.Н. of S =(+4)- (0)= 4 единицы
- Чтобы сбалансировать это уравнение, S и Br должны находиться в соотношении 1:4.
- Баланс H 2 O путем проверки атомов кислорода с обеих сторон.
- Следовательно, окончательное сбалансированное уравнение:-
S (IV) O 2 (водн. ) + 4HBr (-1) (водн.) = S (0) (s) +2Br 2 (0) +2H 2 O
) + 4HBr (-1) (водн.) = S (0) (s) +2Br 2 (0) +2H 2 O
Титрование между HBr и SO 2 нельзя проводить напрямую, т.к. HBr является сильной кислотой и SO 2 также кислотным оксидом и SO 2 находится в газообразном состоянии .
HBr + SO 2 результирующее ионное уравнениерезультирующее ионное уравнение HBr + SO 2 is:-
S (IV) O 2 (водн.) + 4H + (водн.) + 4Br – (водн.)= S 90 172 (0) (с) + 2Br 2 (0) +2H + (водн.) +2 OH – (водн.)
- Поскольку со стороны реагента HBr является сильной кислотой, в водном растворе она ионизируется до H + и Br – , но
- Поскольку SO 2 является кислым оксидом, он не распадается на ионы.

- В продукте боковая сера осаждается в виде твердого вещества, а Br 2 представляет собой нейтральное ковалентное соединение, поэтому эти два вещества не распадаются на ионы .
- H 2 O (вода) слегка разлагается на H + и OH – .
- Таким образом, результирующее ионное уравнение принимает вид:-
S (IV) O 2 (водн.) + 4H + (водн.) + 4Br – (водн.)= S ( 0) (т) +2Br 2 (0) +2H + (водн.) +2 OH – (водн.)
HBr + SO 2 9000 6 сопряженных парСопряженные пары реакции HBr + SO 2 –
- Так как HBr является сильной кислотой, то в водном растворе HBr отдает протон так что Br – является сопряженное основание HBr.

- Поскольку SO 2 является кислотным оксидом, у него нет сопряженной пары.
In HBr + SO 2 реакция, в молекулах реагентов присутствуют следующие межмолекулярные силы:
- HBr представляет собой полярную ковалентную сильную кислоту. Он обладает межмолекулярным H-связывающим взаимодействием (сильным) с другими молекулами HBr, а ионное диполь-дипольное взаимодействие (кулоновская сила притяжения) присутствует между H + и Br – для образования HBr.
- Поскольку SO 2 представляет собой полярную ковалентную молекулу, она обладает диполь-дипольными взаимодействиями.
- Твердая сера (S) обладает силой притяжения Ван-дер-Волла, так как является неполярным твердым соединением.

- В Br 2 присутствует только лондонско-дисперсионная сила притяжения, так как это неполярная ковалентная молекула.
- В воде ( H 2 O ) присутствует межмолекулярная Н-связь.
Чистая энтальпия реакции HBr + SO 2 реакция равна +66,5 кДж/моль .
Стандартные энтальпии образования реагентов и продуктов:
| Молекулы | Энтальпия образования (кДж/моль) | -187,6 |
|---|---|
| Бр 2 | 0 |
| С | 0 |
Энтальпия реакции ΔH f = Стандартная энтальпия продуктов – Стандартная энтальпия реагентов
Таким образом, ΔH f =[0+0+2(-187,6)]-[(-296,9)+4(-36,2)]
=+66,5 кДж/моль
Is HBr+ SO 9 0005 2 буферный раствор? HBr+SO 2 не является буферным раствором, поскольку HBr является сильной кислотой, а SO 2 является оксидом, поэтому он не может образовывать буферный раствор. Для получения буферного раствора нам нужна мягкая кислота и соль этой кислоты, которая поддерживает p H раствора , но здесь это невозможно.
Для получения буферного раствора нам нужна мягкая кислота и соль этой кислоты, которая поддерживает p H раствора , но здесь это невозможно.
Реакция HBr+ SO 2 является полной реакцией, поскольку после нее не происходит никакой дальнейшей реакции, и не происходит обратной реакции, поскольку сера осаждается.
Является ли реакция HBr + SO 2 экзотермической или эндотермической?Реакция HBr+ SO 2 носит эндотермический характер, так как из реакции Положительное значение энтальпии , +66,5 кДж/моль указывает, что для реакции в прямом направлении требуется энергия в виде тепла.
Является ли HBr + SO 2 окислительно-восстановительной реакцией? Реакция HBr+ SO 2 представляет собой окислительно-восстановительную реакцию, при которой одновременно происходит окисление Br(-1 до 0) и восстановление серы (+4 до 0). Здесь HBr — восстановитель, а SO 2 — окислитель. Одновременное протекание окисления и восстановления
Здесь HBr — восстановитель, а SO 2 — окислитель. Одновременное протекание окисления и восстановления
Реакция HBr+ SO 2 является реакцией осаждения, поскольку желтая твердая сера [S(0)] осаждается как продукт, который трудно растворяется в воде или кислоте.
Является ли HBr + SO 2 обратимой или необратимой реакцией?Реакция HBr+ SO 2 является необратимой реакцией, однонаправленной, так как все реагенты реагируют с образованием продуктов, и сера выпадает в осадок, который не может вернуться обратно к SO 2 в этих условиях реакции.
Является ли HBr + SO 2 реакцией замещения? Реакция HBr+ SO 2 не является реакцией замещения, поскольку атомы не замещаются друг другом с образованием продуктов.
Заключение
Из вышеизложенного следует, что реакция между сильной кислотой (HBr) и кислым оксидом (SO 2 ) образует серу, что очень важно для промышленного использования. Это окислительно-восстановительная реакция, которую можно проводить и при комнатной температуре. Так что это энергоэффективно, а также экономично .
Изменчивость газового состава вулканического шлейфа Попокатепетль
NASA/ADS
Изменчивость газового состава вулканического плюма Попокатепетль.
- Таке, Ноэми ;
- Стремме, Вольфганг ;
- Груттер, Мишель ;
- Байлон, Хорхе ;
- Безанилья, Алехандро ;
- Скьяво, Бенедетто ;
- Ривера, Клаудия ;
- Кэмпион, Робин ;
- Булестейкс, Томас ;
- Эспинаса-Перенья, Рамон ;
- Блюменшток, Томас ;
- Хасе, Франк
Аннотация
Долгосрочные временные ряды состава вулканических плюмов представляют собой ценные индикаторы эволюции магматических и вулканических систем. Мы представляем здесь 4-летний временной ряд молекулярных отношений HF/HCl, HCl/SO2, SiF4/SO2, HF/SiF4, измеренный в вулканическом плюме Попокат-Эпетль с помощью наземной солнечной абсорбционной FTIR-спектроскопии. Прибор, базирующийся на станции NDACC (Сеть для обнаружения изменений состава атмосферы) на площадке Альдзомони, обращенной к вулкану Попокатепетль, обеспечивает непревзойденную точность. Расчетное среднее значение и стандартное отклонение отношений HF/HCl и HCl/SO2 за этот период составили 0,24±0,03 и 0,11±0,03 соответственно. SiF4 был обнаружен в трех случаях, а соотношение SiF4/SO2 колебалось в пределах (1,9±0,5) х 10е-3 и (9,9±0,4) х 10е-3. Отношения HBr/HCl и HBr/SO2 оставались ниже их предела обнаружения (1,25 x 10e-4 и 1,25 x 10e-5 соответственно), учитывая, что часть HBr уже превратилась в другие соединения брома (например, BrO, Br2) в нескольких километрах по ветру от кратера. Объединяя наши временные ряды со спутниковыми потоками SO2 и сейсмическими данными, мы объясняем значительные долгосрочные колебания HCl/SO2 изменениями проницаемости каналов и построек, влияющими на процессы глубокой и мелкой дегазации.
Мы представляем здесь 4-летний временной ряд молекулярных отношений HF/HCl, HCl/SO2, SiF4/SO2, HF/SiF4, измеренный в вулканическом плюме Попокат-Эпетль с помощью наземной солнечной абсорбционной FTIR-спектроскопии. Прибор, базирующийся на станции NDACC (Сеть для обнаружения изменений состава атмосферы) на площадке Альдзомони, обращенной к вулкану Попокатепетль, обеспечивает непревзойденную точность. Расчетное среднее значение и стандартное отклонение отношений HF/HCl и HCl/SO2 за этот период составили 0,24±0,03 и 0,11±0,03 соответственно. SiF4 был обнаружен в трех случаях, а соотношение SiF4/SO2 колебалось в пределах (1,9±0,5) х 10е-3 и (9,9±0,4) х 10е-3. Отношения HBr/HCl и HBr/SO2 оставались ниже их предела обнаружения (1,25 x 10e-4 и 1,25 x 10e-5 соответственно), учитывая, что часть HBr уже превратилась в другие соединения брома (например, BrO, Br2) в нескольких километрах по ветру от кратера. Объединяя наши временные ряды со спутниковыми потоками SO2 и сейсмическими данными, мы объясняем значительные долгосрочные колебания HCl/SO2 изменениями проницаемости каналов и построек, влияющими на процессы глубокой и мелкой дегазации.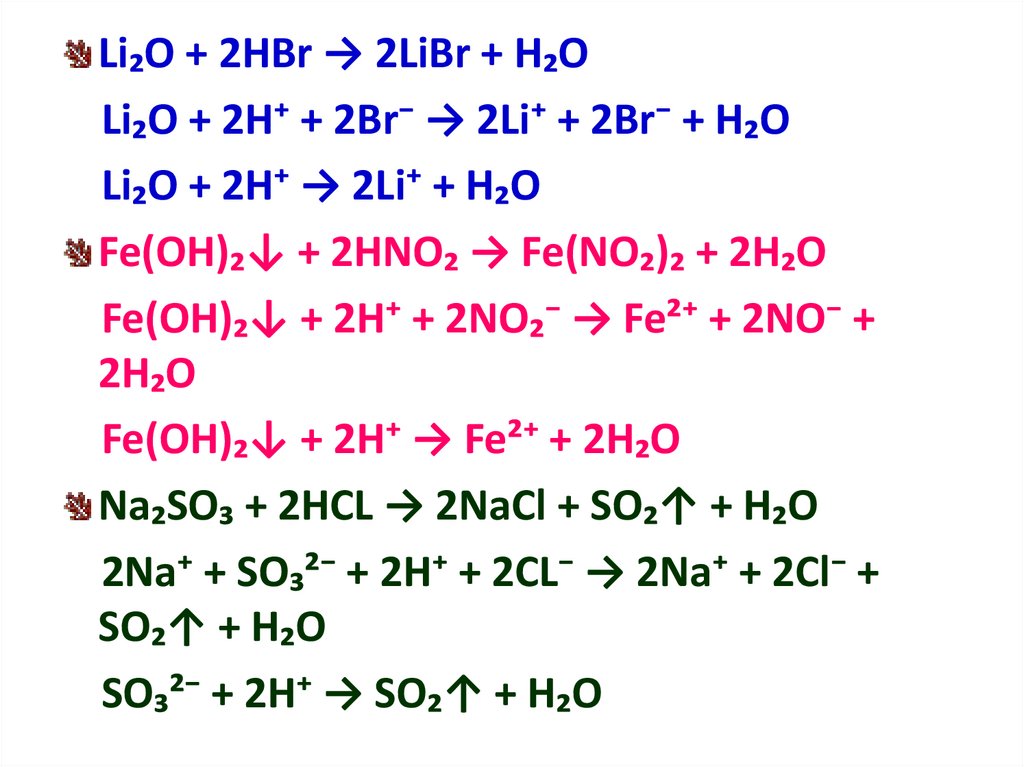
- Публикация:
Границы наук о Земле
- Дата публикации:
- июнь 2019 г.
- DOI:
- 10.3389/страх.2019.00114
- Бибкод:
- 2019FREAS.



 ) + 4HBr (-1) (водн.) = S (0) (s) +2Br 2 (0) +2H 2 O
) + 4HBr (-1) (водн.) = S (0) (s) +2Br 2 (0) +2H 2 O 


