CaCO3→CO2→CaCO3→CaCl2 Пожалуйста помогите!… -reshimne.ru
Новые вопросы
Ответы
CaCO3=(t) CaO+CO2
2 CaO + 3 Co2 = 2 CaCo3 + O2
CaCO3 + HCl = CaCl2 + CO2 + h3O.
Похожие вопросы
Помогитееее 4 решите прошу надо очень…
Осуществите следующие превращения….
Вычислите объем воздуха (н.у.), в котором содержится: 8.а)* 0,25 моль кислорода; 23 8.б) 1,2 х 10 молекул азота….
Реагирует ли СЕРНАЯ КИСЛОТА (разбавленная) :ОКСИД УГЛЕРОД 4; АЗОТНАЯ КИСЛОТА;ЛАКМУС?
Составьте уравнения ещё пожалуйста…
При помощи фенолфталеина можно различить растворы солей. ..
..
K2SO4 и KNO3
K2SO3 и K2SO4
NaCl и ZnCl2
CuBr2 и FeCl2…
Установите соответствие
1)ZnS+O2=SO2+ZnO
2)FeO+Al=Fe+Al2O3
3)N2O5+h3O=HN03
4)Cu+HNO3=Cu(No3)2+NO2+h3O
5)h3SO4+NaOH=NaSO4+h3O
6)NaHCO3=Na2CO3+h3O+CO2
A)разложения
Б)обмена
В)замещения
Г)соединения…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
ЭкономикаМузыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
: Написание суммарного ионного уравнения реакции твердого карбоната кальция с раствором соляной кислоты
В экспериментах по определению скорости реакции часто используется реакция между карбонатом кальция и соляной кислотой, как показано: CaCO₃ (т) + 2 HCl (водн. ) ⟶ CaCl₂ (водн.) + CO₂ (г) + H₂O (л). Каково суммарное ионное уравнение этой реакции?
) ⟶ CaCl₂ (водн.) + CO₂ (г) + H₂O (л). Каково суммарное ионное уравнение этой реакции?
Стенограмма видео
Эксперименты со скоростью реакции часто используйте реакцию между карбонатом кальция и соляной кислотой, как показано: CaCO3 твердое вещество плюс два водных раствора HCl реагируют с образованием водного CaCl2 плюс газообразный CO2 плюс h3O жидкость. Что такое чистое ионное уравнение для эта реакция?
Для начала мы можем идентифицировать данный
сбалансированное химическое уравнение как молекулярное уравнение. Молекулярное уравнение – это химическое
уравнение, в котором все реагенты и продукты имеют химические формулы недиссоциированных
соединения. Другими словами, даже если соединение
известно, что в водном растворе они диссоциируют на ионы, в молекулярном уравнении эти
ионы не показаны как разделенные.
Другой тип химического уравнения химики используют ионное уравнение, которое разделяет ионные соединения и кислоты которые растворяются в водных растворах на отдельные ионы.
Наконец, результирующее ионное уравнение представляет собой упрощенное ионное уравнение, которое показывает только частицы, участвующие в химическом реакция.
Чтобы ответить на этот вопрос, мы
сначала нужно преобразовать наше молекулярное уравнение в ионное уравнение, а затем преобразовать
ионное уравнение в чистое ионное уравнение. Чтобы написать ионное уравнение, мы
должны изменить химические формулы соляной кислоты и хлорида кальция
растворы так, чтобы они отображали растворенные ионы как отдельные частицы. Два эквивалента водного
соляная кислота должна быть записана как два иона водорода и два иона хлора,
в то время как один эквивалент водного хлорида кальция следует записывать как один кальций
ион и два хлорид-иона.
Теперь, когда у нас есть ионное уравнение, нам нужно определить, какие виды участвуют в химической реакции. В ходе реакции твердый кальций карбонат растворяется в соляной кислоте и реагирует с ионами водорода. Ионы кальция остаются растворенными в раствор, а также газообразный диоксид углерода и жидкая вода. Ионы хлора из соляная кислота не участвует в химической реакции и известна как ионы зрителя.
Мы знаем, что результирующее ионное уравнение должны содержать только вещества, участвующие в химической реакции. Поэтому мы не должны включать ионы хлорида в нашем чистом ионном уравнении. В заключение, чистая ионная уравнение реакции между карбонатом кальция и соляной кислотой: CaCO3 твердое вещество плюс два H+ водный реагирует с образованием Ca2+ водный плюс газообразный CO2 плюс h3O жидкость.
Кислоты соляные | Wyzant Спросите эксперта
Chemistry Ap Chemistry Chemistry Lab Chemistry,ap Chemistry Chemistry, Homework Chemistry Science Chemistry Helpneeded
Тринити К.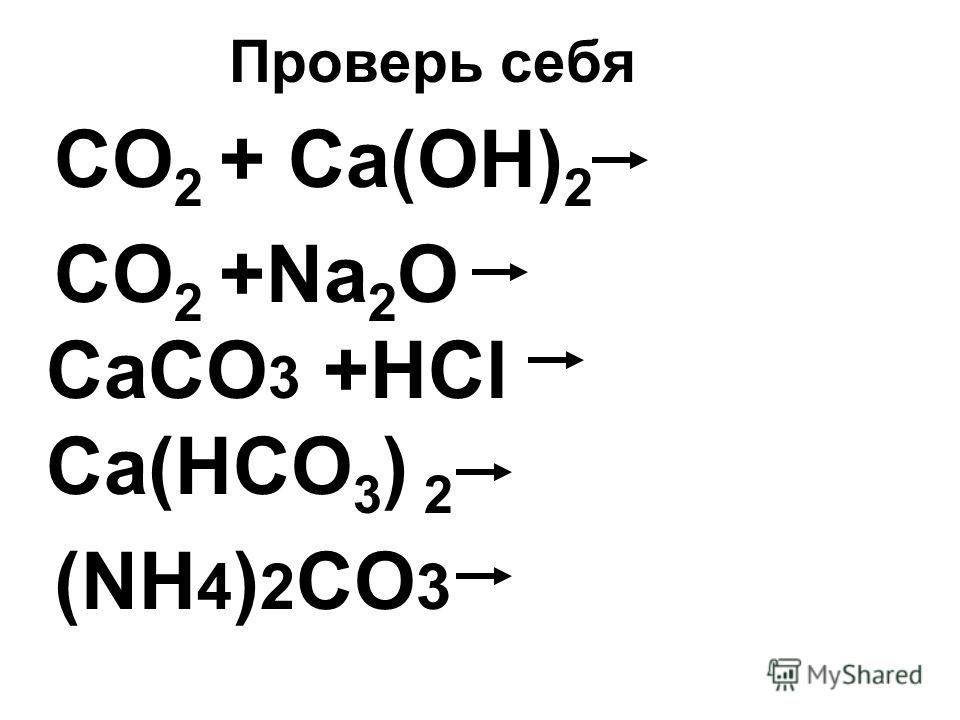
При добавлении карбоната кальция к соляной кислоте образуются хлорид кальция, диоксид углерода и вода.
CaCO3 + 2HCl = CaCl2 (водн.) + h3O + CO2
A.) Сколько граммов хлорида кальция получится, если 32,0 г карбоната кальция смешать с 14,0 г соляной кислоты?
B.) Какой реагент находится в избытке и сколько граммов этого реагента останется после завершения реакции?
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Дж. Р. С. ответил 09/08/18
Репетитор
5,0 (139)
к.т.н. Профессор университета со стажем репетиторства более 10 лет
Об этом репетиторе ›
Об этом репетиторе ›
Для таких вопросов смотрите СБАЛАНСИРОВАННОЕ УРАВНЕНИЕ. Он сообщает вам молярное соотношение всех реакций и продуктов.
Он сообщает вам молярное соотношение всех реакций и продуктов.
CaCO 3 (т) + 2HCl (водн.) ==> CaCl 2 (водн.) + H 2 O(ж) + CO 2 (g)
1 моль CaCO 3 реагирует с 2 молями HCl с образованием 1 моль CaCl 2 , 1 моль H 2 O и 1 моль CO 2 .
(A) Ограничивающий реагент: Какой реагент закончится первым?
моль CaCO 3 использовано = 32,0 г x 1 моль/100 г = 0,320 моль
моль использовано HCl = 14,0 г x 1 моль/36,45 г = 0,384 моль. НО, поскольку на каждый 1 моль CaCO 3 требуется 2 моля HCl, HCl ограничивает. Он иссякнет первым. Таким образом, количество молей HCl будет определять, сколько молей CaCl2 можно получить.
моль CaCl 2 произведено = 0,384 моль HCl x 1 моль CaCl 2 /2 моль HCl = 0,192 моль
грамм произведено CaCl2 = 0,192 моль x 110,98 г/моль = 21,313 г цифры)
(B) Ограничивающим реагентом является HCl, как описано выше, что приводит к избытку CaCO3. Определить, сколько осталось, можно следующим образом. Найдите количество молей, израсходованных в реакции, и вычтите его из числа молей в начале реакции. Это дает нам оставшиеся родинки. Преобразуйте это в граммы, используя молярную массу.
Определить, сколько осталось, можно следующим образом. Найдите количество молей, израсходованных в реакции, и вычтите его из числа молей в начале реакции. Это дает нам оставшиеся родинки. Преобразуйте это в граммы, используя молярную массу.
moles CaCO 3 used = 0.384 moles HCl x 1 mole CaCO 3 /2 moles HCl = 0.192 moles used
moles CaCO 3 left = 0.320 moles — 0.192 moles = 0.128 moles
grams CaCO 3 Осталось = 0,128 моль x 100 г/моль = осталось 12,8 грамма.
Голосовать за 1 Понизить
Подробнее
Отчет
Все еще ищете помощь? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
