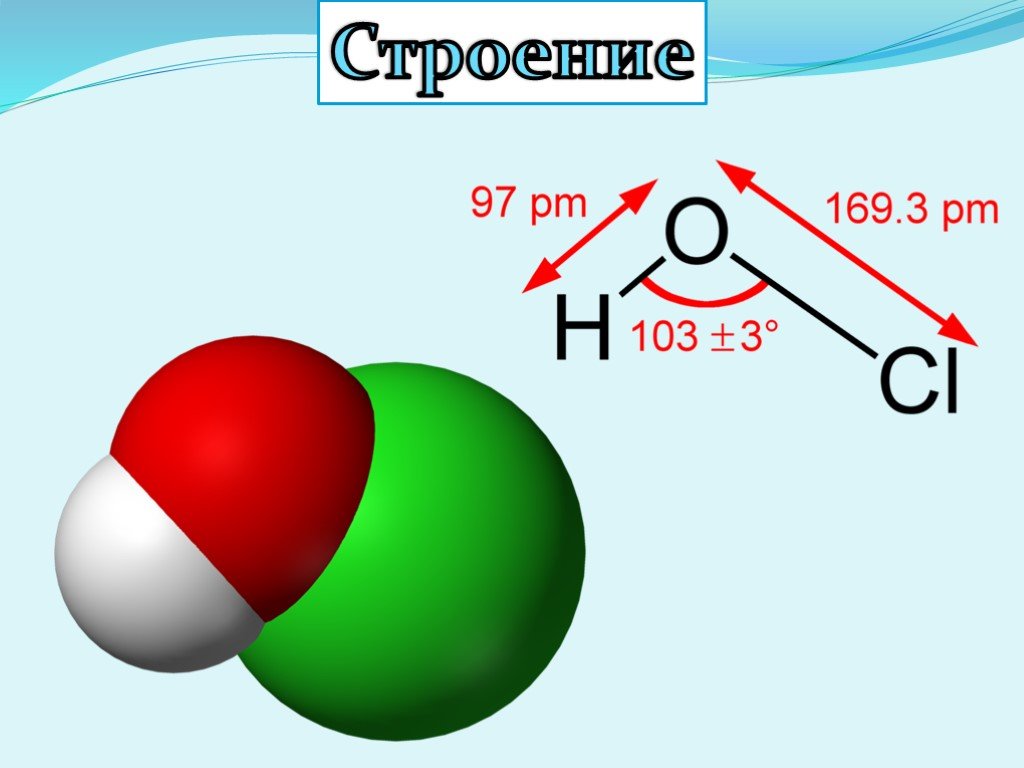
What, How To Balance & FAQs – Lambda Geeks
Hydrochloric acid and Hypochlorous acid are both inorganic acids. Let us inspect some interesting facts about the reaction between HCl and HClO.
Hydrochloric acid is a stronger acid than Hypochlorous acid. Hypochlorous acid serves as a base in the reaction medium. Concentrated hydrochloric acid is needed in this reaction. This reaction readily proceeds on cold water-ice and nitric acid trihydrate (NAT) поверхностей.
Let us thrive into the mechanism of the reaction between HCl and HClO with some FAQs with proper explanation in the following article.
1. What is the product of HCl and HClO?Water is produced along with the evolution of chlorine gas when hydrochloric acid and hypochlorous acid react.
HCl (aq) + HClO (aq) -> H2O (l) + Cl2(Г)
2. What type of reaction is HCl + HClO?The reaction between hydrochloric acid and hypochlorous acid is an example of a double displacement reaction. It also falls under the category of redox and gas evolution reactions. In hydrochloric acid, chlorine gets oxidized; in hypochlorous acid, chlorine is reduced to give diatomic chlorine gas.
It also falls under the category of redox and gas evolution reactions. In hydrochloric acid, chlorine gets oxidized; in hypochlorous acid, chlorine is reduced to give diatomic chlorine gas.
To balance the equation between HCl and HClO, we have to check if an equal number of individual atoms (H, Cl, O) are present on both the reactant and product sides.
- Step 1- We first label each molecule as A, B, C, and D, as four elements are present.
- The reaction looks like this,
- A HCl + B HClO = C H2O + D Cl2
- Step 2- Now we calculate the number of coefficients labelled as alphabets in reactants and products using suitable numbers.
- H = A = B= 2C, Cl = A = B = 2D, O= B = C
- Step 3- We calculate the coefficient and variables required to balance the equation using Gaussian elimination process.
 Now we get,
Now we get, - А = 1, В = 1, С = 1 и D = 1
- The reaction was already balanced.
- So, overall balanced equation for the above reaction is,
- HCl + HClO = H2О + Cl2
The titration of HCl with HClO will not yield a significant change of color as it is hard to detect the end-point/equivalence point.
5. HCl + HClO net ionic equationHydrochloric acid will be dissociated as proton and chloride ions. Hypochlorous acid will dissipate as hydroxide ion and chlorine (+1) cation.
H+ + Кл– + OH–+ Кл+ = ОН– + H+ + Кл– + Кл+
6. HCl + HClO conjugate pairsThe conjugate pairs of the reaction between hydrochloric acid and hypochlorous acid are the conjugate base of the hydrochloric acid and the respective conjugate acid of the hypochlorous acid, which is shown below,
HCl(-1) + HCl(+ 1)O = H+OH–+ Кл(+ 1)Cl(-1)
7. HCl and HClO intermolecular forces
HCl and HClO intermolecular forcesOn the reactant side, in HCl, there is an ionic force of attraction between the proton and chlorine atom. In HClO, there is диполь-дипольное взаимодействие. On the product side, H2O molecule projects hydrogen bonds, dipole-dipole forces, and London dispersion forces. The intermolecular force that exists in Cl2 is the London dispersion force.
| молекула | Межмолекулярные силы |
| HCl | Electrostatic, Van der waals |
| HCLO. | Dipole dipole |
| H2O | Electrostatic, H-bonding, covalent |
| Cl2 | London dispersion, covalent |
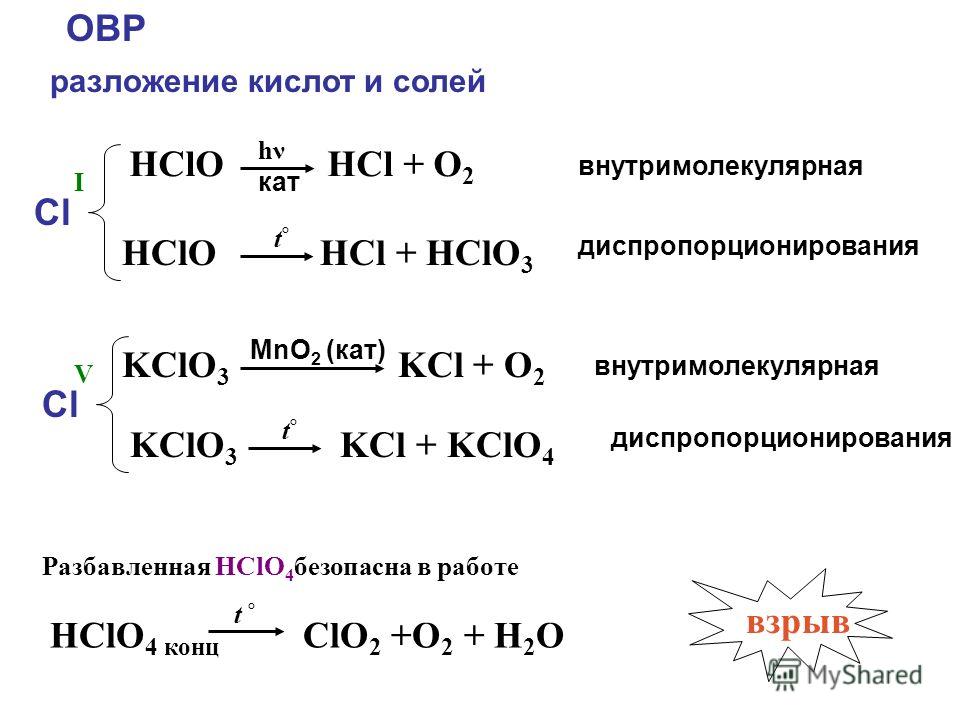 HCl + HClO reaction enthalpy
HCl + HClO reaction enthalpyThe total enthalpy change is -285,835= -285,820 – (92-77)) KJ/mol, which is negative. Energy will be released in this reaction. Mathematically, ΔH = Hпродуктов-Hреактивы .
| молекула | Enthalpy (of formation) (кДж/моль) |
| HCl | 92 |
| HCLO. | -77 |
| H2O | -285,820 |
| Cl2 | 0 |
The solution of HCl and HClO is a buffer of the weak acid HClO and the conjugate base ClO–. When HCl and HClO are mixed, ClO– will consume H+.
10. Is HCl + HClO a complete reaction?The reaction between hydrochloric acid and hypochlorous acid is not a complete reaction, as the concentration of reactants never reaches zero. Rather the reaction achieves equilibrium after some time.
Rather the reaction achieves equilibrium after some time.
The reaction can be inferred as an exothermic reaction as we get a negative enthalpy change for the reaction. Here it is shown in the diagram,
Energy Profile Diagram of the Reaction12. Is HCl + HClO a redox reaction?The reaction between hydrochloric acid and hypochlorous acid is a redox reaction. This redox is a comproportionation reaction type. HClO and HCl act as oxidizing and reducing agents, respectively.
Redox reaction of HCl and HClO13. Is HCl + HClO a precipitation reaction?The above reaction is not a реакция осаждения, as we will not get any precipitation as a product.
14. Is HCl + HClO reversible or irreversible reaction?The above reaction between hydrochloric acid and hypochlorous acid is a обратимый reaction. Chlorine reacts reversibly with water, giving the reactants. This property is used for water sterilization.
Chlorine reacts reversibly with water, giving the reactants. This property is used for water sterilization.
The above reaction is an example double displacement reaction. The chlorine atom gets double displaced with each reactant, and diatomic chlorine gas is released.
ЗаключениеIn conclusion Hydrochloric acid and hypochlorous acid form water and chlorine by following a simple inorganic mechanism. This reaction leads to chlorine activation providing atmosphere. Cl2 is a very good oxidizing agent. Thus the reaction has some industrial value.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
В каком году была сформулирована теория — предшественница кислородной теории горения.
Решено
Составьте уравнения реакций фенола с литием, калий гидроксидом, разбавленной азотной кислотой и назовите соединения, которые образуются.
Решено
Mg + HNO3(разб.) = ? Написать ОВР :
Решено
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO 3 , и стандартного водородного электрода. Написать уравнения…
Решено
Решение задач 8 класс. Массовая доля растворенного вещества в раствореПользуйтесь нашим приложением
What, How to Balance & FAQs – Lambda Geeks
Соляная кислота и хлорноватистая кислота являются неорганическими кислотами. Давайте рассмотрим некоторые интересные факты о реакции между HCl и HClO.
Соляная кислота является более сильной кислотой, чем хлорноватистая кислота. Хлорноватистая кислота служит основанием в реакционной среде. В этой реакции необходима концентрированная соляная кислота. Эта реакция легко протекает на холодных поверхностях вода-лед и тригидрата азотной кислоты (NAT) .
Давайте углубимся в механизм реакции между HCl и HClO с некоторыми часто задаваемыми вопросами с надлежащим объяснением в следующей статье.
1. Что является продуктом HCl и HClO?Вода образуется вместе с выделением газообразного хлора при реакции соляной и хлорноватистой кислот.
HCl (водн.) + HClO (водн.) -> H 2 O (ж) + Cl 2 (г)
2. Какой тип реакции представляет собой HCl + HClO?Реакция между соляной кислотой и хлорноватистой кислотой является примером реакции двойного замещения. Он также подпадает под категорию окислительно-восстановительных реакций и реакций газовыделения. В соляной кислоте хлор окисляется; в хлорноватистой кислоте хлор восстанавливается с образованием двухатомного газообразного хлора.
3. Как сбалансировать HCl + HClO? Чтобы сбалансировать уравнение между HCl и HClO, мы должны проверить, присутствует ли одинаковое количество отдельных атомов (H, Cl, O) как на стороне реагента, так и на стороне продукта.
- Шаг 1. Сначала мы помечаем каждую молекулу как A, B, C и D, поскольку присутствуют четыре элемента.
- Реакция выглядит так и продукты, используя подходящие номера.
- H = A = B= 2C, Cl = A = B = 2D, O= B = C
- Шаг 3. Мы вычисляем коэффициент и переменные, необходимые для балансировки уравнения, используя процесс исключения Гаусса. Теперь мы получаем ,
- A = 1, B = 1, C = 1 и D = 1
- Реакция уже уравновешивается.
- Итак, общее сбалансированное уравнение для приведенной выше реакции:0006
Титрование HCl с помощью HClO не приведет к значительному изменению цвета, поскольку трудно определить конечную точку/точку эквивалентности.
5. Ионное уравнение HCl + HClOСоляная кислота диссоциирует на протон и хлорид-ионы.
 Хлорноватистая кислота будет рассеиваться в виде иона гидроксида и катиона хлора (+1).
Хлорноватистая кислота будет рассеиваться в виде иона гидроксида и катиона хлора (+1). H + + Cl – + OH – + Cl + = OH – + H + + CL — + CL +
6. HCl + HCLO -конъюгированные парыКонъюгатные пары гидрохловой кислоты и гипопроизводительной кислоты являются конъюгатскими основаниями гидрохлорной кислоты и гипоклеристой кислоты. кислоты и соответствующей сопряженной кислоты хлорноватистой кислоты, которая показана ниже,
HCl (-1) + HCl (+1) O = H + OH – + Cl (+ 1) Класс (-1)
7. Межмолекулярные силы HCl и HClOСо стороны реагента в HCl существует ионная сила притяжения между протоном и атомом хлора. В HClO существует диполь-дипольных взаимодействий .
 Со стороны продукта молекула H 2 O создает водородные связи, диполь-дипольные силы и лондоновские дисперсионные силы. Межмолекулярная сила, существующая в Cl 2 , представляет собой лондоновскую дисперсионную силу.
Со стороны продукта молекула H 2 O создает водородные связи, диполь-дипольные силы и лондоновские дисперсионные силы. Межмолекулярная сила, существующая в Cl 2 , представляет собой лондоновскую дисперсионную силу.
Межмолекулярные силы реагентов и продуктов0006Molecule Intermolecular forces HCl Electrostatic, Van der waals HClO Dipole dipole H 2 O Electrostatic, H-bonding, covalent Cl 2 Лондонская дисперсия ковалентная Общее изменение энтальпии составляет -285,835= -285,820 – (92-77)) кДж/моль, что отрицательно.
 В этой реакции будет выделяться энергия. Математически ΔH = H продукты -H реактаны .
В этой реакции будет выделяться энергия. Математически ΔH = H продукты -H реактаны .
Entlpy of Reactants и продукты Entlpy of Reactants и продукты 9012 9012 9012.Molecule Enthalpy (of formation)
(KJ/mol)HCl 92 HClO -77 H 2 O -285,820 CL 2 0 Раствор HCl и HClO представляет собой буфер слабой кислоты HClO и сопряженного основания ClO – . При смешивании HCl и HClO ClO – потребляет H + .
10. Является ли HCl + HClO полной реакцией?Реакция между соляной кислотой и хлорноватистой кислотой не является полной реакцией, так как концентрация реагентов никогда не достигает нуля.
11. Является ли реакция HCl + HClO экзотермической или эндотермической? Скорее реакция достигает равновесия через некоторое время.
Скорее реакция достигает равновесия через некоторое время. Реакцию HCl + HClO можно рассматривать как экзотермическую реакцию, поскольку мы получаем отрицательное изменение энтальпии реакции. Вот это показано на схеме ,
Диаграмма энергетического профиля реакции 12. Является ли HCl + HClO окислительно-восстановительной реакцией?Реакция между соляной кислотой и хлорноватистой кислотой является окислительно-восстановительной реакцией. Этот окислительно-восстановительный процесс представляет собой реакцию сопропорционирования типа . HClO и HCl действуют как окислители и восстановители соответственно.
Окислительно-восстановительная реакция HCl и HClO 13. Является ли HCl + HClO реакцией осаждения?Вышеуказанная реакция не является0006 реакция осаждения , так как в качестве продукта мы не получим никаких осадков.
14. Является ли реакция HCl + HClO обратимой или необратимой?
Вышеупомянутая реакция между соляной кислотой и хлорноватистой кислотой является обратимой реакцией. Хлор обратимо реагирует с водой, давая реагенты. Это свойство используется для обеззараживания воды.
15. Реакция замещения HCl + HClO?HCl + HClO представляет собой реакцию двойного замещения, поскольку H + в HCl вытесняет Cl – из HClO, а затем OH – в HClO вытесняет Cl – из HCl и образует H 2 9002 О и Cl 2 .
Реакция двойного замещения ЗаключениеЗаключение Соляная кислота и хлорноватистая кислота образуют воду и хлор по простому неорганическому механизму. Эта реакция приводит к активации хлора с созданием атмосферы. кл 2 — очень хороший окислитель.
 Таким образом, реакция имеет некоторое промышленное значение.
Таким образом, реакция имеет некоторое промышленное значение.Подробнее о HCl:
Разница между хлорноватистой кислотой и соляной кислотой
Основное различие между хлорноватистой кислотой и соляной кислотой заключается в том, что хлорноватистая кислота является слабой кислотой, а соляная кислота — сильной кислотой.
И хлорноватистая кислота, и соляная кислота являются кислыми веществами с различной кислотностью. Хлорноватистая кислота представляет собой кислое вещество, имеющее химическую формулу HClO, а соляная кислота представляет собой водный раствор хлористого водорода, имеющий химическую формулу HCl.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое хлорноватистая кислота
3. Что такое соляная кислота
4. Хлорноватистая кислота и соляная кислота в табличной форме
Хлорноватистая кислота?Хлорноватистая кислота представляет собой кислое вещество, имеющее химическую формулу HClO.
 Это слабая кислота, которая образуется при растворении хлора в воде, при этом происходит частичная диссоциация с образованием гипохлорита (ClO-). Молярная масса хлорноватистой кислоты 52,46 г/моль. Это водорастворимое вещество.
Это слабая кислота, которая образуется при растворении хлора в воде, при этом происходит частичная диссоциация с образованием гипохлорита (ClO-). Молярная масса хлорноватистой кислоты 52,46 г/моль. Это водорастворимое вещество.Существует несколько различных применений хлорноватистой кислоты, в том числе применения в органическом синтезе, где нам нужна эта кислота в качестве промежуточного продукта, в косметической промышленности в качестве ингредиента, в пищевой промышленности и в процессах распределения воды в качестве дезинфицирующего средства. Это кислое вещество также естественным образом содержится в наших нейтрофилах, где оно помогает уничтожать бактерии.
Рисунок 01: Химическая структура хлорноватистой кислоты
Когда мы добавляем газообразный хлор в воду, получается как соляная, так и хлорноватистая кислота. Если мы добавим некоторые кислоты к водным солям хлорноватистой кислоты, это вызовет образование газообразного хлора, сдвигая равновесную реакцию между водой, хлором, хлорноватистой кислотой и соляной кислотой влево.
 Более того, мы можем приготовить это вещество, растворив монооксид дихлора в воде.
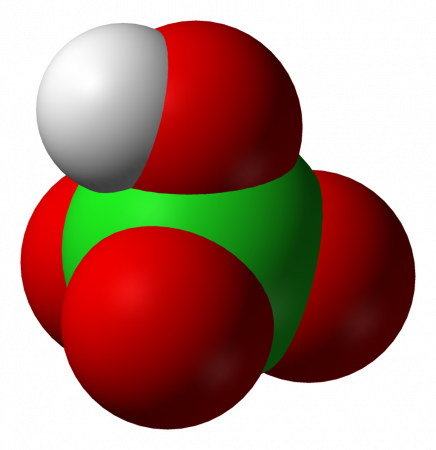
Более того, мы можем приготовить это вещество, растворив монооксид дихлора в воде.Что такое соляная кислота?
Соляная кислота представляет собой водный раствор хлороводорода. Это сильная кислота. Его химическая формула – HCl, а молярная масса – 36,5 г/моль. Эта кислота имеет резкий запах. Кроме того, он важен как исходное соединение для многих неорганических химических веществ, таких как винилхлорид. Рисунок 02: Химическая структура соляной кислоты кислотная система в водном растворе. Кроме того, эта сильная кислота может воздействовать на нашу кожу в широком диапазоне составов и вызывать ожоги кожи.
Естественно, это кислое вещество присутствует в желудочной кислоте в пищеварительной системе большинства животных, включая человека. Кроме того, он коммерчески доступен в качестве промышленного химиката для производства поливинилхлорида для пластика. Кроме того, соляная кислота используется как средство для удаления накипи в бытовых нуждах, как пищевая добавка в пищевой промышленности, при обработке кожи и т.
 д.
д.Соляная кислота встречается в виде соли иона гидроксония и иона хлора. Мы можем приготовить его, обработав HCl водой. Кислота HCl обычно используется в химическом анализе для подготовки или переваривания образцов для анализа. Это связано с тем, что концентрированная кислота HCl может растворять многие металлы и может образовывать окисленные хлориды металлов с газообразным водородом.
В чем разница между хлорноватистой кислотой и соляной кислотой?
Хлорноватистая кислота и соляная кислота представляют собой кислые вещества, состоящие из атомов водорода и хлора; хлорноватистая кислота также содержит атомы кислорода в дополнение к атомам водорода и хлора. Основное различие между хлорноватистой кислотой и соляной кислотой заключается в том, что хлорноватистая кислота является слабой кислотой, а соляная кислота — сильной кислотой.
На приведенной ниже инфографике перечислены различия между хлорноватистой кислотой и соляной кислотой в табличной форме для параллельного сравнения.


 Now we get,
Now we get, 01.19
01.19

 Хлорноватистая кислота будет рассеиваться в виде иона гидроксида и катиона хлора (+1).
Хлорноватистая кислота будет рассеиваться в виде иона гидроксида и катиона хлора (+1).  Со стороны продукта молекула H 2 O создает водородные связи, диполь-дипольные силы и лондоновские дисперсионные силы. Межмолекулярная сила, существующая в Cl 2 , представляет собой лондоновскую дисперсионную силу.
Со стороны продукта молекула H 2 O создает водородные связи, диполь-дипольные силы и лондоновские дисперсионные силы. Межмолекулярная сила, существующая в Cl 2 , представляет собой лондоновскую дисперсионную силу.  В этой реакции будет выделяться энергия. Математически ΔH = H продукты -H реактаны .
В этой реакции будет выделяться энергия. Математически ΔH = H продукты -H реактаны .  Скорее реакция достигает равновесия через некоторое время.
Скорее реакция достигает равновесия через некоторое время. 
 Таким образом, реакция имеет некоторое промышленное значение.
Таким образом, реакция имеет некоторое промышленное значение. Это слабая кислота, которая образуется при растворении хлора в воде, при этом происходит частичная диссоциация с образованием гипохлорита (ClO-). Молярная масса хлорноватистой кислоты 52,46 г/моль. Это водорастворимое вещество.
Это слабая кислота, которая образуется при растворении хлора в воде, при этом происходит частичная диссоциация с образованием гипохлорита (ClO-). Молярная масса хлорноватистой кислоты 52,46 г/моль. Это водорастворимое вещество. Более того, мы можем приготовить это вещество, растворив монооксид дихлора в воде.
Более того, мы можем приготовить это вещество, растворив монооксид дихлора в воде. д.
д.