что, как сбалансировать и часто задаваемые вопросы —
By Сахил Сингх
Процесс превращения реагентов в два или более различных продукта называется химической реакцией. Давайте подробно рассмотрим, как HCl реагирует с NaHCO.3 .
Хлористый водород классифицируется как сильная кислота, которая при реакции с бикарбонатом натрия, который на самом деле является слабым основанием, будет выделять соль и воду. Бикарбонат натрия (NaHCO3) представляет собой кристаллическое твердое вещество с моноклинная кристаллическая структура, но он, естественно, выходит в виде порошка.
Мы подробно обсудим важные механизмы реакции, такие как окислительно-восстановительный потенциал, осаждение, тип реакции, межмолекулярные силы, уравновешивание химического уравнения и т. д.
Что является продуктом HCl и NaHCO3HCl и NaHCO3 реагировать с образованием хлорида натрия (NaCl), двуокиси углерода (CO2) и вода (H2О) освобождается. Химическое уравнение реакции выглядит следующим образом;
Химическое уравнение реакции выглядит следующим образом;
HCl + NaHCO3 = NaCl + H2О + СО2.
Какой тип реакции HCl и NaHCO?3HCl + NaHCO3 — это реакция нейтрализации, где кислота (HCl) и основание (NaHCO3) реагируют с образованием соли и воды.
HCl (водн.) + NaHCO3 (водн.) = NaCl (водн.) + H2О (л) + СО2 (Г)
Как сбалансировать HCl и NaHCO3Ниже приведены шаги, необходимые для балансировки химического уравнения:
- Шаг 1: Напишите общее химическое уравнение:
- HCl + NaHCO3 = NaCl + H2О + СО2.
- Шаг 2: Теперь, как мы видим, атомы на стороне реагента такие же, как и на стороне продукта.
- Поэтому нет необходимости уравновешивать данное химическое уравнение, поскольку оно уже уравновешено.

NaHCO3 титруется против HCl, чтобы определить неизвестную концентрацию NaHCO3 в заданном решении. Следующие этапы участвуют в титровании HCl и NaHCO.3.
Используемый аппарат:Нам нужно,
- бюретка
- Держатель бюретки
- Мензурка
- Коническая колба
- Мерная колба
Лучшим индикатором рассматриваемого титрования является Метил Апельсин.
Процедура:- Промойте, ополосните и заполните бюретку раствором NaHCO.3 раствора и отметьте начальное показание бюретки.
- Пипеткой отбирают 10 мл раствора HCl и переносят в промытую колбу для титрования.

- В колбу для титрования добавляют 2-3 капли индикатора метилового оранжевого.
- Теперь начните добавлять раствор бикарбоната натрия в колбу для титрования по каплям, пока окраска не станет светло-розовой.
- Запишите окончательные показания бюретки и найдите объем раствора бикарбоната натрия, использованного для нейтрализации раствора HCl.
- Повторите эксперимент, чтобы получить больше показаний.
- Неизвестную концентрацию можно найти по формуле S1V1 = С2V2.
Чистое ионное уравнение:
HCO3– (водн.) + Н+ (водн.) = CO2 (г) + Н2О (л)
HCl и NaHCO3 сопряженная параВ этой реакции
HCl (водн. ) + NaHCO3 (водн.) = NaCl (водн.) + H2О (л) + СО2 (Г)
) + NaHCO3 (водн.) = NaCl (водн.) + H2О (л) + СО2 (Г)
- Сопряженная пара HCl = Cl–
- Сопряженная пара H2О = ОН–
- Сопряженная пара NaHCO3 = ХСО3–
- Для NaCl нет сопряженной пары.
Межмолекулярные силы в данной реакции перечислены следующим образом:
HCl (водн.) + NaHCO3 (водн.) = NaCl (водн.) + H2О (л) + СО2 (Г)
| Реактивы | Межмолекулярные силы | Каталог | Межмолекулярные силы |
|---|---|---|---|
| HCl | 1. Диполь-дипольное взаимодействие Диполь-дипольное взаимодействие2. Лондонские дисперсионные силы | NaCl | 1. Лондонско-дипольная сила 2. Диполь-индуцированное дипольное взаимодействие |
NaHCO3 | 3. Ионная связь | H2O | 1. Водородная связь 2. Лондонские дисперсионные силы |
HCl + NaHCO3энтальпия реакции составляет +28.5 кДж/моль. Информация об энтальпии для участвующих реагентов и продуктов следующая:
- Энтальпия образования реагента HCl: -393.509 кДж / моль
- Энтальпия образования реагента NaHCO3: -950.
 8 кДж / моль
8 кДж / моль - Энтальпия образования продукта NaCl: -411.15 кДж / моль
- Энтальпия образования продукта H2О: -285.8 кДж / моль
- Энтальпия образования продукта CO2: -167.16 кДж / моль
Таким образом, ∆fH (Энтальпия реакции) = Сумма стандартных энтальпий образования продуктов – сумма стандартных энтальпий образования реагентов.
ΔfH = +28.5 кДж/моль.
Is HCl и NaHCO3 буферный растворHCl + NaHCO3 не является буферным раствором, потому что соли не могут рассматриваться как буфер, так как они легко диссоциируют на ионы, что делает их неспособными поддерживать рН раствора.
Is HCl и NaHCO3 полная реакцияHCl + NaHCO3 представляет собой полную реакцию, в которой HCl и NaHCO3 полностью реагировать с образованием таких продуктов, как CO2, H2О и NaCl без дальнейшего процесса.
HCl и NaHCO3 реакция является эндотермической реакцией, так как энтальпия реакции положительна, а это означает, что повышение температуры сместит равновесие в правую сторону.
Is HCl и NaHCO3 окислительно-восстановительная реакцияHCl и NaHCO3 реакцию нельзя назвать окислительно-восстановительная реакция потому что нет изменения степени окисления на стороне реагента и продукта.
Is HCl и NaHCO3 реакция осажденияHCl + NaHCO3 не является реакцией осаждения, поскольку после завершения реакции не образуется нерастворимый продукт.
Is HCl и NaHCO3 обратимая или необратимая реакцияHCl + NaHCO3 реакция необратима реакция поскольку реагенты полностью расходуются, и указанную выше реакцию нельзя обратить вспять, если не будут применены некоторые особые условия.
HCl + NaHCO3 реакция является реакцией двойного замещения.
- Атом натрия вытесняет водород из хлороводорода с образованием H2CO3.
- HCl + NaHCO3 = NaCl + H2CO3.
Заключение
Реакция HCl и NaHCO3 нейтрализуют друг друга, образуя соль и воду с углекислым газом в качестве побочного продукта. Степени окисления реагентов и продуктов остаются неизменными. Это двухстадийная реакция, в которой H2CO3, первоначально образовавшийся, разлагается на воду и углекислый газ.
What, How to Balance & FAQs —
By Sahil Singh
Процесс превращения реагентов в два или более различных продукта называется химической реакцией. Давайте подробно рассмотрим, как HCl реагирует с NaHCO 3 .
Хлористый водород классифицируется как сильная кислота, которая при реакции с гидрокарбонатом натрия, который на самом деле является слабым основанием, будет выделять соль и воду. Бикарбонат натрия ( NaHCO 3 ) представляет собой кристаллическое твердое вещество с моноклинной кристаллической структурой, но естественным образом выходит в виде порошка.
Мы подробно обсудим важные механизмы реакции, такие как окислительно-восстановительный потенциал, осаждение, тип реакции, межмолекулярные силы, уравновешивание химического уравнения и т. д.
Что является продуктом HCl и NaHCO 3HCl и NaHCO 3 реагируют с образованием хлорида натрия (NaCl), двуокиси углерода (CO 2 ) и выделяется вода (H 2 O). Химическое уравнение реакции выглядит следующим образом;
HCl + NaHCO 3 = NaCl + H 2 O + CO 2 .
HCl + NaHCO 3 реакция нейтрализации, где кислота (HCl) и соль реагируют с образованием 0000 6 90 вода .
HCl (водн.) + NaHCO 3 (водн.) = NaCl (водн.) + H 2 O (л) + CO 2 (г)
Как сбалансировать HCl и NaHCO 3 90 Шаги, необходимые для балансировки химического уравнения:- Шаг 1: Напишите общее химическое уравнение:
- HCl + NaHCO 3 = NaCl + H 2 O + CO 2
6.
- Шаг 2: Теперь, как мы видим, атомы на стороне реагента такие же, как и на стороне продукта.
- Поэтому нет необходимости балансировать данное химическое уравнение, так как оно уже сбалансировано.
NAHCO 3 титров против HCL, чтобы определить неизвестную концентрацию NAHCO 3 в данном решении. Следующие этапы включают титрование HCl и NaHCO 3 .
Следующие этапы включают титрование HCl и NaHCO 3 .
We need,
- Burette
- Burette holder
- Beaker
- Conical flask
- Volumetric flask
The best indicator рассматриваемого титрования – метиловый оранжевый.
Процедура:- Промойте, ополосните и заполните бюретку раствором NaHCO 3 и запишите начальное показание бюретки.
- Пипеткой отберите 10 мл раствора HCl и перенесите его в промытую колбу для титрования.
- Добавьте 2-3 капли индикатора метилового оранжевого в колбу для титрования.
- Теперь начните добавлять по каплям раствор бикарбоната натрия в колбу для титрования, пока цвет не изменится на светло-розовый.

- Запишите окончательные показания бюретки и найдите объем раствора бикарбоната натрия, использованного для нейтрализации раствора HCl.
- Повторите эксперимент, чтобы получить больше показаний.
- Неизвестную концентрацию можно найти по формуле S 1 V 1 = S 2 V 2 .
Ионное уравнение —
HCO 3 — (AQ) + H 6 + — (AQ.) + H 9026 + — (AQ.) + H + — (AQ). CO 2 (г) + H 2 O (л)
В этой реакции
HCl (aq.) + Nahco 3 (aq. 2 O (l) + CO 2 (g)
- Conjugate pair of HCl = Cl –
- Conjugate pair of H 2 O = OH –
- Сопряженная пара NaHCO 3 = HCO 3 —
- Не существует конъюгатной пары для NaCl
 следующим образом:
следующим образом: HCl (водн.) + NaHCO 3 (водн.) = NaCl (водн.) + H 2 O (л) + CO 2 (г) 1
92. London Dispersion forces
2. Dipole-induced -дипольное взаимодействие
NaHCO 3
HCl + NaHCO 3 reaction enthalpy is + 28,5 кДж/моль. Информация об энтальпии реагентов и продуктов представлена ниже:
Информация об энтальпии реагентов и продуктов представлена ниже:
- Энтальпия образования реагента HCl: -393,509 kJ/mol
- Enthalpy of formation for reactant NaHCO 3 : -950.8 kJ/mol
- Enthalpy of formation for product NaCl: -411.15 kJ/mol
- Enthalpy of formation for Продукт H 2 O: -285,8 кДж/моль
- Энтальпия формирования для продукта CO 2 : -167,16 кДж/моль
Таким реакция) = Сумма стандартных энтальпий образования продуктов – сумма стандартных энтальпий образования реагентов.
Δ f H = +28,5 кДж/моль .
IS HCl и NAHCO 3 A Buffer Solution HCL + NAHCO 3 не является буферным раствором, потому что соли не могут рассматриваться как буфер, так как они . ионов, что делает их неспособными поддерживать рН раствора.
ионов, что делает их неспособными поддерживать рН раствора.
HCl + NaHCO 3 полная реакция, в которой HCl и NaHCO 3 полностью реагируют с образованием таких продуктов, как CO 2 , H 2 O и NaCl 1 без дальнейшего процесса .
IS HCl и NAHCO 3 Экзотермическая или эндотермическая реакцияHCl, а Nahco 3 — эндотермическая реакция, как ароматическая реакция, что означает, что означает, что означает, что означает температура сместит равновесие в правую сторону. 9окислительно-восстановительная реакция .
IS HCL и NAHCO 3 A Реакция осадков HCL + NAHCO 3 не является реакцией осаждения, потому что не является инсолютной продуктом после завершения повторной реакции.
HCl + Nahco 3 Реакция. вышеуказанная реакция не может быть обращена вспять, если не применяются некоторые особые условия.
Is HCl и NaHCO 3 реакция замещенияHCl + NaHCO 3 реакция представляет собой реакцию двойного замещения.
- Атом натрия вытесняет водород из хлороводорода с образованием H 2 CO 3 .
- HCl + NaHCO 3 = NaCl + H 2 CO 3 .
Заключение
Реакция HCl и NaHCO 3 нейтрализует друг друга с образованием соли и воды с двуокисью углерода в качестве побочного продукта. Степени окисления реагентов и продуктов остаются неизменными. Это двухстадийная реакция, в которой H 2 CO 3 , первоначально образовавшийся, разлагается на воду и углекислый газ.
Степени окисления реагентов и продуктов остаются неизменными. Это двухстадийная реакция, в которой H 2 CO 3 , первоначально образовавшийся, разлагается на воду и углекислый газ.
Stoichiometry 6.1-Лектура Демонстрационные демонстрации уступая химии-универсальности Massachusetts Amherst
DISTICHIOMETRY ›6,1
Стоихиометрия
6.1 STOICHIOMETRY
-lemitemetry
6.1. твердого бикарбоната натрия добавляют в колбы, содержащие 1М HCl. Воздушные шары, прикрепленные к колбе, будут собирать CO 2 выделился газ. Скорость надувания и объем надувания определяются начальным количеством использованных материалов.
Материалы:
- 3 надувных шарика
- 2,94 г бикарбоната натрия – разделить на части по 1,68 г, 0,84 г и 0,42 г ‡
- 3 колбы по 250 мл
- 300 мл 0,1 М HCl‡
- Градуированный цилиндр 100 мл
- Шпатель
- 3 Зажимы для колб
- 3 подставки для колец*
- Универсальный индикатор ‡
- Пластиковая воронка
- Лодки для взвешивания (рядом с весами)
*Общие элементы.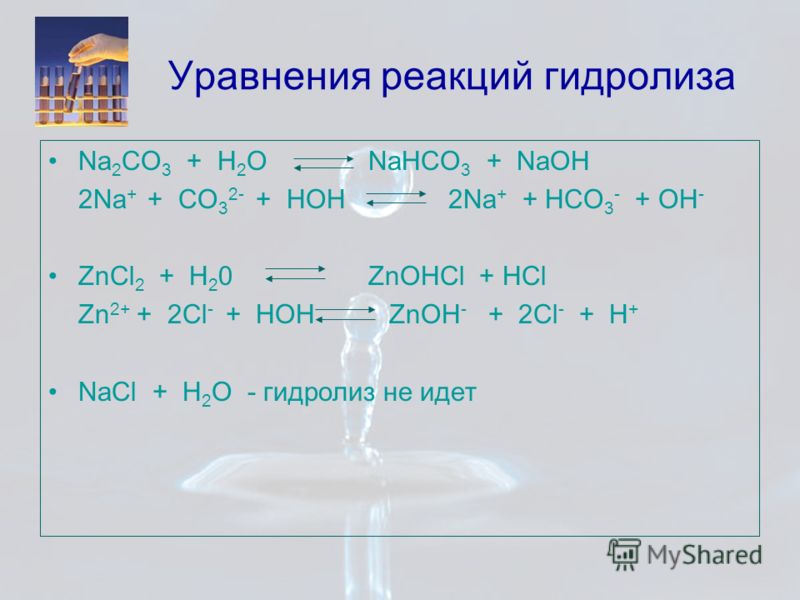
‡Соляная кислота находится в шкафу под капотом. Универсальный индикатор находится в шкафу с горючими материалами. Гидрокарбонат натрия находится на общей полке хранения химикатов.
Предварительная подготовка:
Примечание. Может оказаться полезным зафиксировать колбы с помощью зажимов и кольцевых подставок, чтобы предотвратить их опрокидывание.
- Предварительно растяните шарики и наклейте этикетки весом 1,68 г, 0,84 г и 0,42 г.
- Взвесьте бикарбонат натрия и поместите его в каждый баллон с помощью воронки.
- Добавьте в каждую колбу по 100 мл 0,1 М HCl. Добавьте несколько капель универсального индикатора.
- Натяните горлышки воздушных шаров на колбы. Будьте осторожны, чтобы твердое вещество не попало в колбы, пока оно не будет готово.
Процедура:
1. Встряхните бикарбонат натрия из баллонов одновременно с кислотами.
2. Наблюдать за темпом и объемом инфляции.
Обсуждение:
Ниже приведена реакция между кислотой и бикарбонатом натрия:
HCl(водн.) + NaHCO 3 (водн.) → CO 2 (г) + H 2 O(л) + NaCl(водн.)
Суммарное ионное уравнение:
2H+(водн.) + CO 3 2- (водн.) → CO 2 (г) + H 2 O(л)
Количество молей в 100 мл 0,1 М HCl определяется по формуле: 0,1 л HCl * 0,1 моль/л = 0,01 моль HCl бикарбонат натрия реагирует с 0,01 моль HCl.
0,01 моль бикарбоната натрия * 84,01 г/моль = 0,84 грамма бикарбоната натрия.
Баллон с 1,68 г бикарбоната натрия содержит вдвое больше стехиометрического количества и является избытком. HCl является ограничивающим реагентом и будет израсходован. Некоторое количество бикарбоната натрия останется, и индикатор покажет, что раствор является слабощелочным.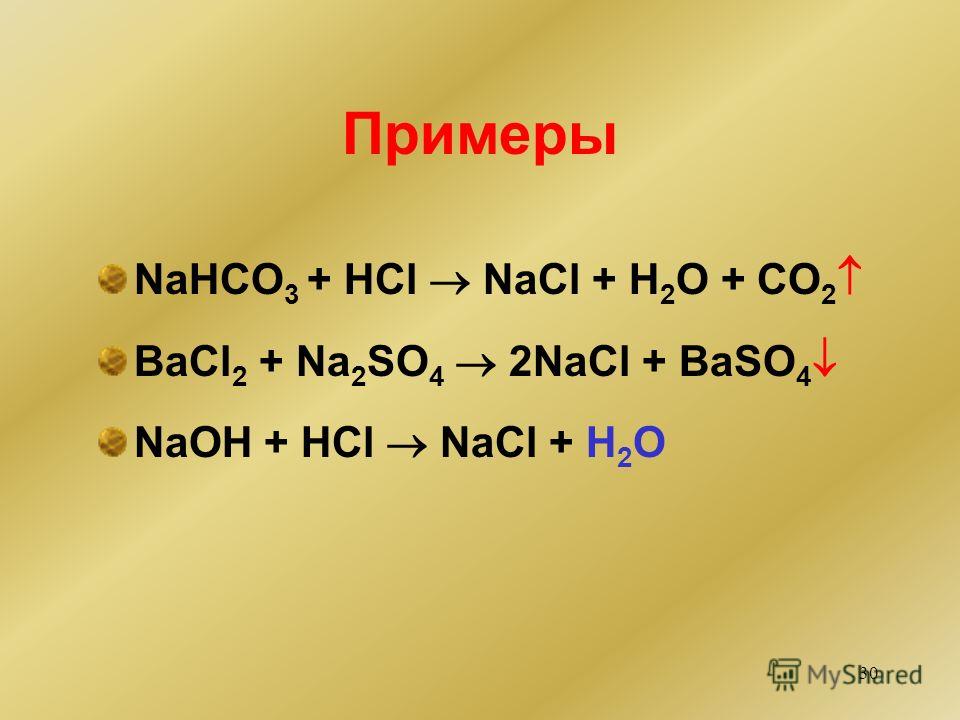
Баллон с 0,84 г бикарбоната натрия стехиометрически эквивалентен HCl, поэтому и бикарбонат натрия, и HCl израсходованы. Когда реакция подходит к концу, реакция замедляется, и может потребоваться больше времени, чтобы достичь того же объема, что и у первого баллона.
Баллон с 0,42 г бикарбоната натрия содержит половину стехиометрического эквивалента и не будет надуваться в той же степени, что и два других баллона. Раствор останется кислым из-за остатков кислоты, а индикатор останется красным.
Безопасность: Соблюдайте осторожность при работе с соляной кислотой. Используйте перчатки и защитные очки при подготовке и выполнении этого эксперимента.
Утилизация: Растворы можно смыть водой в канализацию. Воздушные шары можно выбросить в мусор или использовать повторно.
Ссылки:
1. Л. Саммерлин, К. Боргфорд, Дж. Или. Химические демонстрации: справочник для учителей; Том 2; 1987 год; п. 141-142
2. Университет штата Орегон, химический факультет, веб-сайт ChemDemos: http://chemdemos.


 8 кДж / моль
8 кДж / моль