Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
В каком году была сформулирована теория — предшественница кислородной теории горения.
Структурная формула всех изомеров С7Н16
рассчитайте массу кристаллогидрата и объем…
Решено
2-метилбутен — 1 Написать уравнения реакций данного алкена с хлором, хлороводородом, водой, кислородом, реакцию Вагнера
Решено
Напишите структуру тетрапептида состоящего из полярной незаряженной, гидрофобной, положительно заряженной и отрицательно заряженной аминокислот….
Пользуйтесь нашим приложением
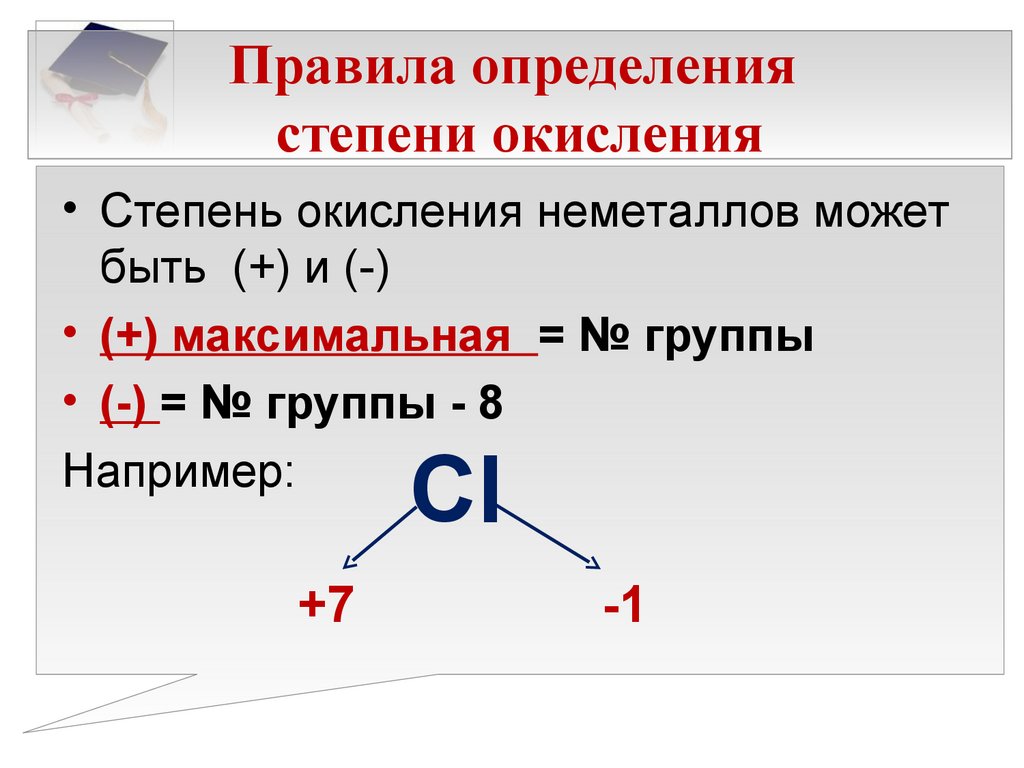
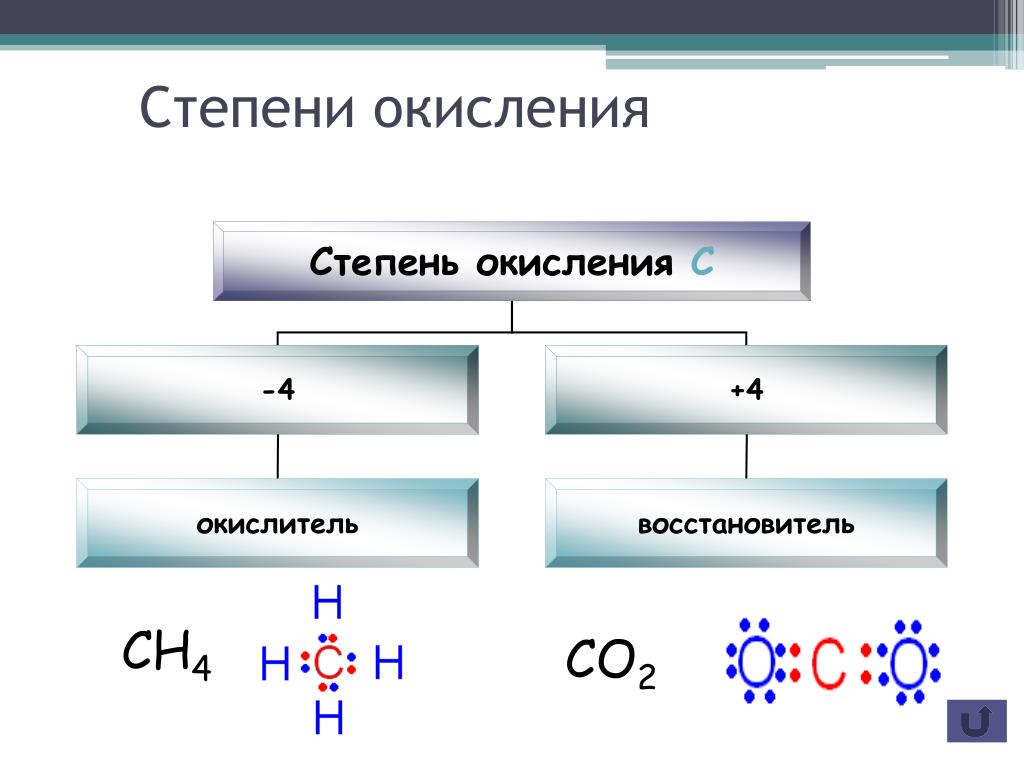
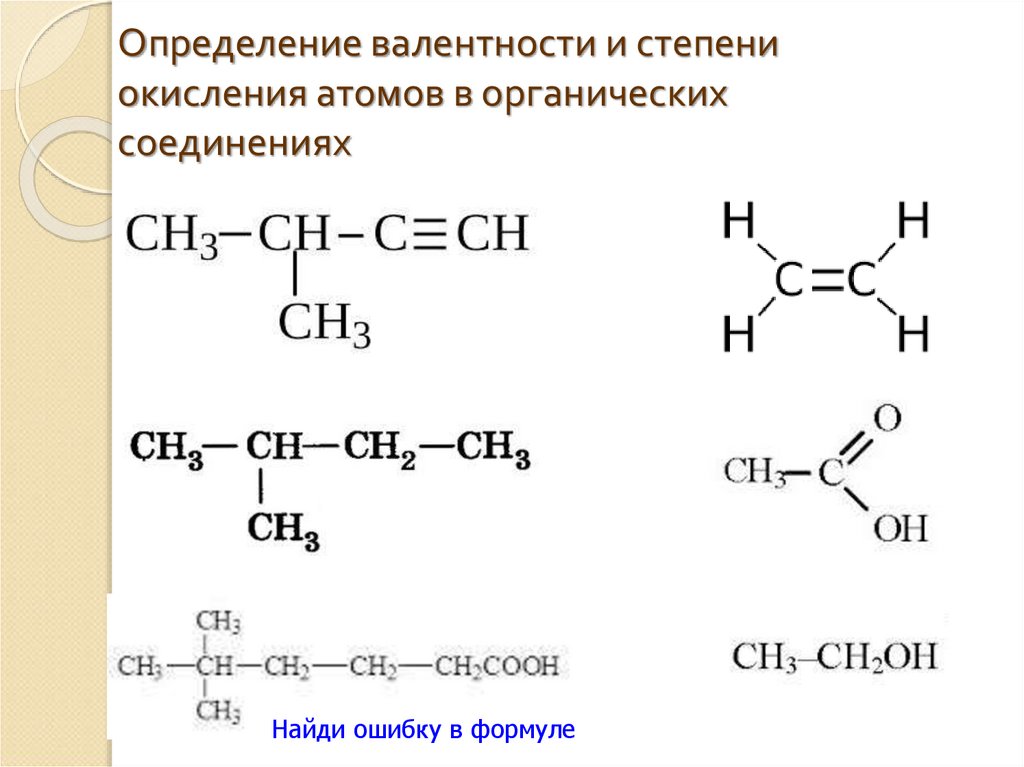
97. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях ,,hcooh, .
Ответ.
Степень
окисления – это условный заряд атома
в соединении, вычисленный из предположения,
что оно состоит только из ионов. Степень
окисления может принимать отрицательное,
положительное и нулевое значение.
Запишем структурные формулы указанных в условии соединений:
Как видно, во всех указанных соединениях валентность углерода равна 4, так как углерод связан 4 ковалентными связями с другими элементами.
Степень окисления атома углерода в соединениях разная:
В метане степень окисления углерода равна; в метанолестепень окисления углерода равна; в муравьиной кислотеHCOOH степень окисления углерода ; в диоксиде углеродастепень окисления углерода.
122. Рассчитайте ∆h , если известно, что:
, кДж;
, кДж;
, кДж.
Ответ.
Стандартной
теплотой образования называется тепловой
эффект реакции образования данного
соединения из простых веществ, отвечающих
наиболее устойчивому состоянию
рассматриваемого элемента при температуре
298 К и стандартном давлении.
Так, теплота образования 1 моль равна тепловому эффекту реакции образования сульфата цинка в данной его кристаллической модификации из металлического цинка, кристаллической серы и газообразного кислорода:
Термохимические расчеты проводят на основании закона Гесса: тепловой эффект реакции не зависит от пути, по которому протекает процесс, а определяется только природой исходных веществ и продуктов реакции и их физическим состоянием. Согласно закону Гесса, при расчетах с термохимическими уравнениями можно производить любые алгебраические действия, то есть переносить члены уравнений из одной части уравнения в другую, складывать, вычитать и т.д.
Имеем:
кДж
кДж
кДж
кДж
Нетрудно
заметить, что для получения уравнения
(5) необходимо к уравнению (1) прибавить
уравнение (2), вычесть умноженное на 2
уравнение (3) и прибавить умноженное на
2 уравнение (4), а полученный результат
разделить на 2. Такие же действия проведем
и с энтальпиями этих реакций, то есть
теплота образования сульфата цинка
будет равна:
Такие же действия проведем
и с энтальпиями этих реакций, то есть
теплота образования сульфата цинка
будет равна:
Подставляя значения, получим:
147. Определите расчетом, какие из реакций, уравнения которых:
а) ;
г) ;
будут протекать самопроизвольно в изолированной системе при стандартных условиях. Сделайте вывод о возможности протекания реакции.
Ответ.
В изолированной системе самопроизвольно протекают процессы, идущие с ростом энтропии (). Определяем изменении энтропии реакций согласно закона Гесса:
Как
видно из расчетов, самопроизвольно в
изолированной системе при стандартных
условиях могут протекать реакции (б) и
(г), для которых
.
Зная, что есть функция состояния и чтодля простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находимреакций (б) и (г):
Полученные значения указывают на возможность протекания реакций.
172. Исходные концентрации азота и водорода в реакции были (моль/л):,. К моменту наступления равновесия прореагировало 10% исходного количества азота. Вычислить давление газовой смеси в этот момент, если температура ее была 500°С.
Ответ.
Согласно условию, к моменту наступления равновесия прореагировало 10% исходного количества азота, то есть моль. В соответствии с уравнением реакции, 1 моль взаимодействует с 3 мольи при этом образуется 2 моль. Следовательно, 0,2 мольпрореагирует смольс образованиеммоль.
Таким образом, количества молей каждого газа и общее количество молей газов в 1 л смеси в момент равновесия равно:
Для вычисления давление газовой смеси в этот момент воспользуемся уравнением Менделеева-Клапейрона (уравнение состояния идеального газа), которое устанавливает соотношение между количеством вещества газа (, моль), температурой (T, К), давлением (, Па) и объемом (V, ):
где R – универсальная газовая постоянная,
равная 8,314 Дж/(моль∙К).
Отсюда давление газовой смеси определим по уравнению:
Подставляя значения и учитывая, что , а, получим:
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
| Ответ | Будем поочередно определять степень окисления серы в каждой из предложенных схем превращений, а затем выберем верный вариант ответа.
Изменение степени окисления серы: -2 → 0, т.е. шестой вариант ответа.
Изменение степени окисления серы: 0 → +6, т.е. четвертый вариант ответа.
1×2 +x+ 3×(-2) =0; Изменение степени окисления серы: +4 → 0, т.е. третий вариант ответа. |
| Задание | Валентность III и степень окисления (-3) азот проявляет в соединении: а) N 2 H 4 ; б) NH 3 ; в) NH 4 Cl; г) N 2 O 5 |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем поочередно определять валентность и степень окисления азота в предложенных соединениях. а) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 4-м (1×4 = 4). Разделим полученное значение на число атомов азота в молекуле: 4/2 = 2, следовательно, валентность азота равна II. Этот вариант ответа неверный. б) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 3-м (1×3 = 3). Разделим полученное значение на число атомов азота в молекуле: 3/1 = 2, следовательно, валентность азота равна III. Степень окисления азота в аммиаке равна (-3): Это верный ответ. |
| Ответ | Вариант (б) |
Степень окисления – это условный заряд атома в молекуле, он получает атом в результате полного принятия электронов, его вычисляют из предположения, что все связи представляют собой ионный характер. Как определить степень окисления?
Определение степени окисления
Существуют заряженные частицы ионы, положительный заряд которых равняется количеству электронов, получаемых от одного атома. Отрицательный заряд иона равняется числу электронов, принимаемых одним атомом химического элемента. К примеру, запись такого элемента как Ca2+ значит, что атомы элементов потеряли одного, двух или же трех элементов. Чтобы найти состав ионных соединений и соединений молекул нам необходимо знать, как определить степень окисления элементов. Степени окислений бывают отрицательными, положительными и нулевыми. Если учитывать числа атомов, то алгебраическая степень окисления в молекуле равна нулю.
Отрицательный заряд иона равняется числу электронов, принимаемых одним атомом химического элемента. К примеру, запись такого элемента как Ca2+ значит, что атомы элементов потеряли одного, двух или же трех элементов. Чтобы найти состав ионных соединений и соединений молекул нам необходимо знать, как определить степень окисления элементов. Степени окислений бывают отрицательными, положительными и нулевыми. Если учитывать числа атомов, то алгебраическая степень окисления в молекуле равна нулю.
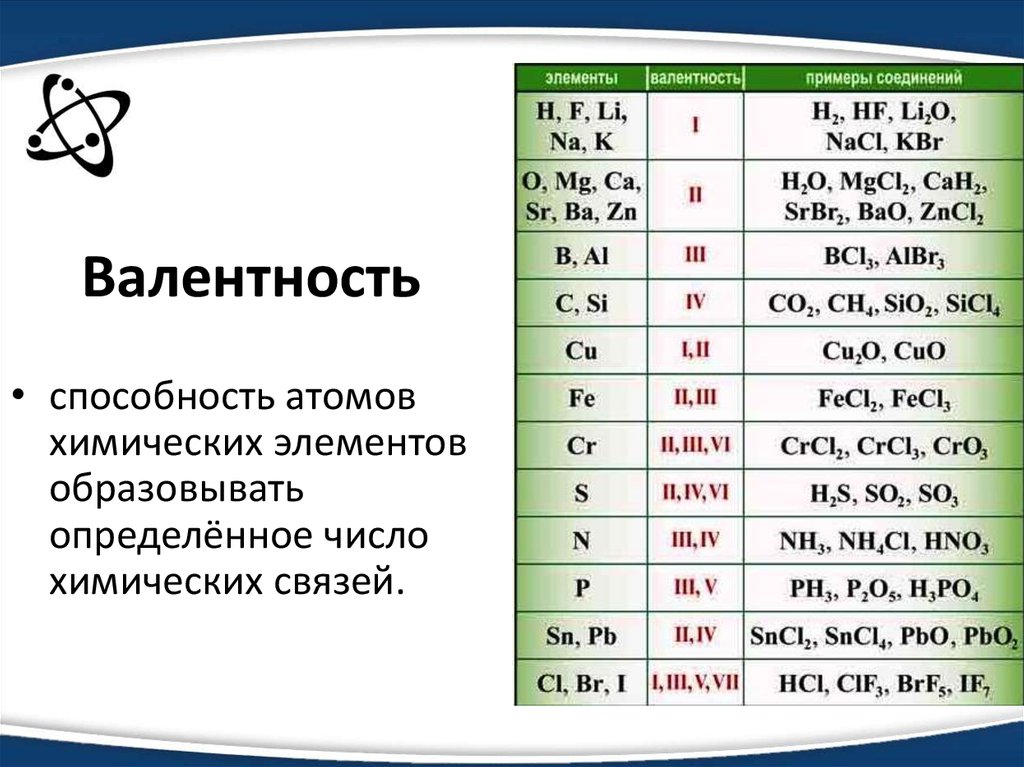
Чтобы определить степень окисления элемента нужно руководствоваться определёнными знаниями. Например, в соединениях металлов степень окисления положительная. А высшая степень окисления соответствует номеру группы периодической системы, где и находится элемент. У металлов степени окисления могут быть положительными и отрицательными. Это будет зависеть от того фактора, каким именно атомом соединен металл. Например, если соединен с атомом металла, то тогда степень будет отрицательной, если же соединен с неметаллом, то степень будет положительная.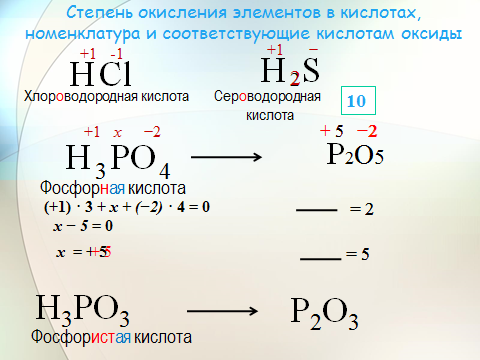
Отрицательную же высшую степень окисления металла определить можно вычитанием из цифры восемь номер группы, где находится необходимый элемент. Как правило, она бывает равна числу электронов, находящихся на внешнем слое. Число этих электронов тоже соответствует номеру группы.
Как рассчитать степень окисления
В большинстве случаев степень окисления атома конкретного элемента не совпадает с числом связей, которые он образует, то есть она не равна валентности этого элемента. Наглядно это можно увидеть на примере органических соединений.
Напомню, валентность углерода в органических соединениях равняется 4 (т.е образует 4 связи), но степень окисления углерода, например, в метаноле CH 3 OH равна -2, в CO 2 +4, в Ch5 -4, в муравьиной кислоте HCOOH +2. Валентность измеряется числом ковалентных химических связей, включая те, которые возникли по донорно-акцепторному механизму.
При определении степени окисления атомов в молекулах, электроотрицательный атом, при смещении в свою сторону одной электронной пары, приобретает заряд -1, если же две электронные пары то -2 будет заряд. На степень окисления не влияет связь между одинаковыми атомами. Например:
На степень окисления не влияет связь между одинаковыми атомами. Например:
- Связь атомов C-C равняется их нулевой степени окисления.
- Связь C-H – здесь, углероду как наиболее электроотрицательному атому будет соответствовать заряд -1.
- Связь C-O заряд углерода, как менее электроотрицательный, будет равняться +1.
Примеры определения степени окисления
- В такой молекуле как CH 3Cl три связи C-HC). Таким образом, степень окисления атома углерода в данном соединении будет равна:-3+1=-2.
- Найдем степень окисления атомов углерода в молекуле уксусного альдегида Cˉ³h4-C¹O-H. В данном соединении три связи C-H будут давать общий заряд на атоме C, который равен (Cº+3e→Cˉ³)-3. Двойная же связь C=O (здесь кислород будет забирать электроны у атома углерода, т.к кислород более электроотрицательный) дает заряд на атоме C, он равен +2 (Cº-2e→C²), связь же C-H заряд -1, значит общий заряд на атоме C равняется: (2-1=1)+1.
- Теперь найдем степень окисления в молекуле этанола: Cˉ³H-Cˉ¹h3-OH.
 Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1.
Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1.
Теперь Вы знаете, как определить степень окисления элемента. Если Вы имеете хотя бы базовые знания по химии, то для Вас данная задача будет не проблемой.
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Пример определения в серной кислоте
Формула данного соединения имеет вид H 2 SO 4 . У водорода степень окисления составит +1, у кислорода она равна -2.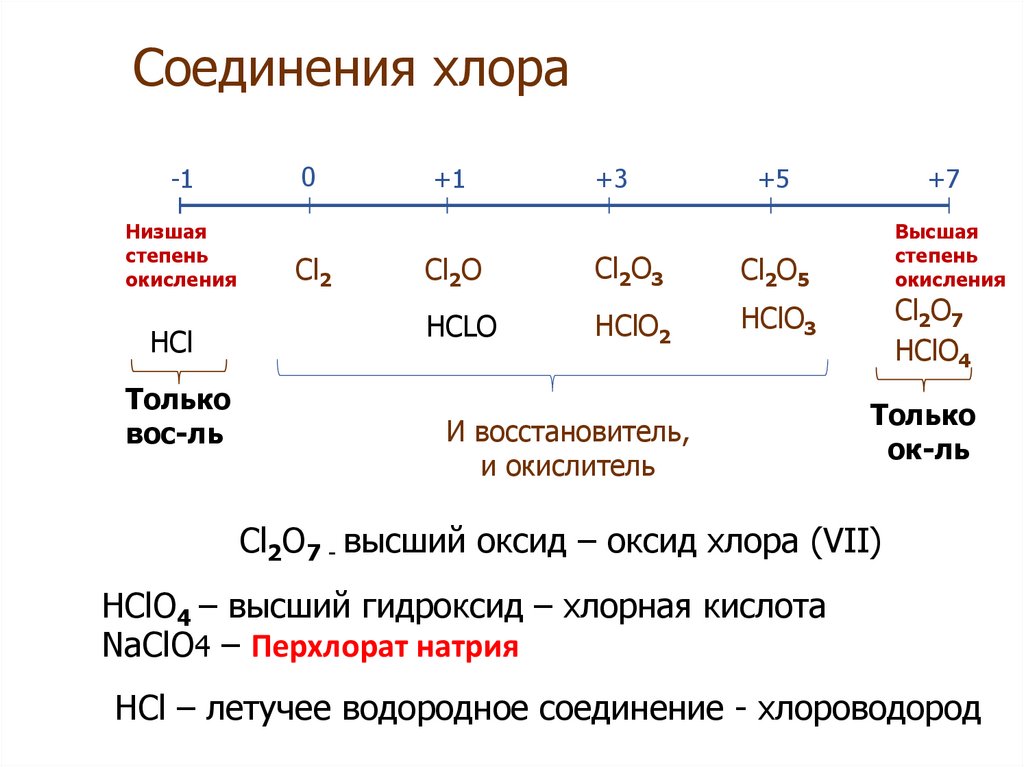 Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
404 Cтраница не найдена
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
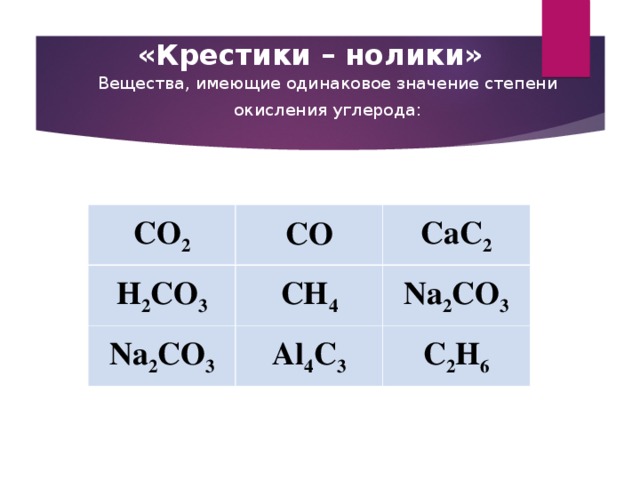
Определите валентность и степень окисления углерода в соединениях: co2, c2h6, hcooh, ch4on
23. 05.2019 15:40, Aminabr
05.2019 15:40, Aminabr
Похожие вопросы:
Химия, 27.02.2019 19:50
Серная кислота не реагирует с веществом: naoh na2sio3 sio2 mgo
Ответов: 2
Открыть
Химия, 28.02.2019 15:40
Расчитать колличество молекул веществ вступающих в реакцию и образующихся в результате реакции al(2)o(3)+3h(2)5o(4)=al(2)(so()+h(2 )
Ответов: 2
Открыть
Химия, 28.02.2019 20:30
.(При разложении 4.84 г смеси гидрокарбонатов калия и натрия образовалось 0.56л углекислого газа (н. у). определите состав взятой и полученной смеси. решение).
Ответов: 3
Открыть
Химия, 28.02.2019 22:20
Окаких элементах идет речь, если строение их атомной оболочки выражается следующим распределением электронов по слоям: а)2, 8, 1 б)2, 1 в)2, 8, 4 г)2, 3 д)2,8,8 е)2,8
Ответов: 3
Открыть
Химия, 01.03.2019 00:50
4. дайте характеристику элементу №12. план ответа: а) укажите «адрес» элемента, б) число протонов, электронов, нейтронов в его атоме, в) распределите электроны по энергетическим уровням, г) укажите: металлом или неметаллом
является данный элемент, д) укажите степень окисления его, е) запишите формулу высшего оксида и гидроксида.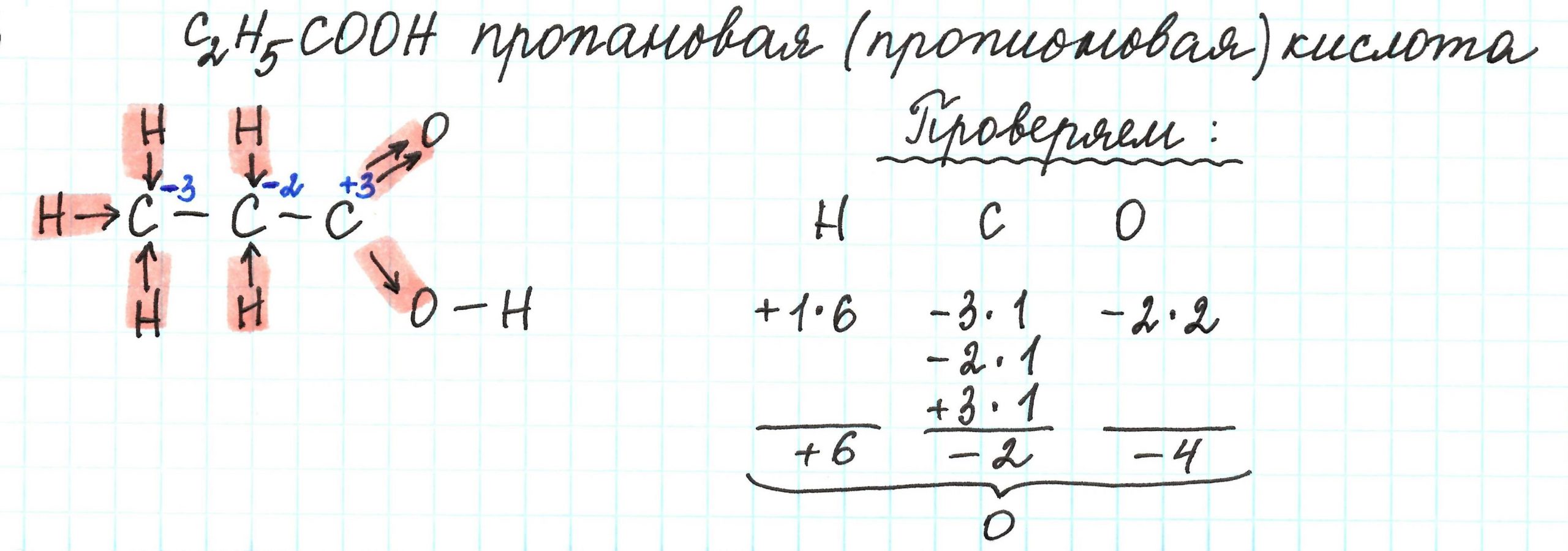 5. определите степень окисления элементов в соединениях: hcl, cucl2, fecl3, sio2, so2, so3, p2o5, p2o3, pbo, h3so4, hno3, h4po4, na2so4. 6. составьте
5. определите степень окисления элементов в соединениях: hcl, cucl2, fecl3, sio2, so2, so3, p2o5, p2o3, pbo, h3so4, hno3, h4po4, na2so4. 6. составьте
формулы соединений, образованных кислородом и следующими элементами: al, zn, n, ca, s, ba, p, mg, na. назовите вещества. 7. из ниже перечня формул выпишите отдельно формулы оксидов металлов, оксидов неметаллов и оснований; дайте им
названия: mgo, koh, co2, ca(oh)2, p2o5, cuo, naoh, n2o5, al2o3. 8. составьте формулы следующих солей: хлорид калия, нитрат натрия, сульфат алюминия, карбонат натрия, фосфат кальция. 9. назовите следующие соли: fe2(so4)3, na3po4, kno3, сaco3. 10. составьте уравнения
реакций: исходные вещества: оксид азота (iv), кислород и вода продукт реакции: азотная кислота уравнение реакции: 11. расставьте коэффициенты в уравнениях реакций и укажите тип реакции: cucl2+ fe = fecl2 + cu; mg+ h4po4 = м g3(po4)2+ h3 cuso4+ al =
al2(so4)3 + cu; fe+ cl2 = fecl3
Ответов: 2
Открыть
Химия, 01.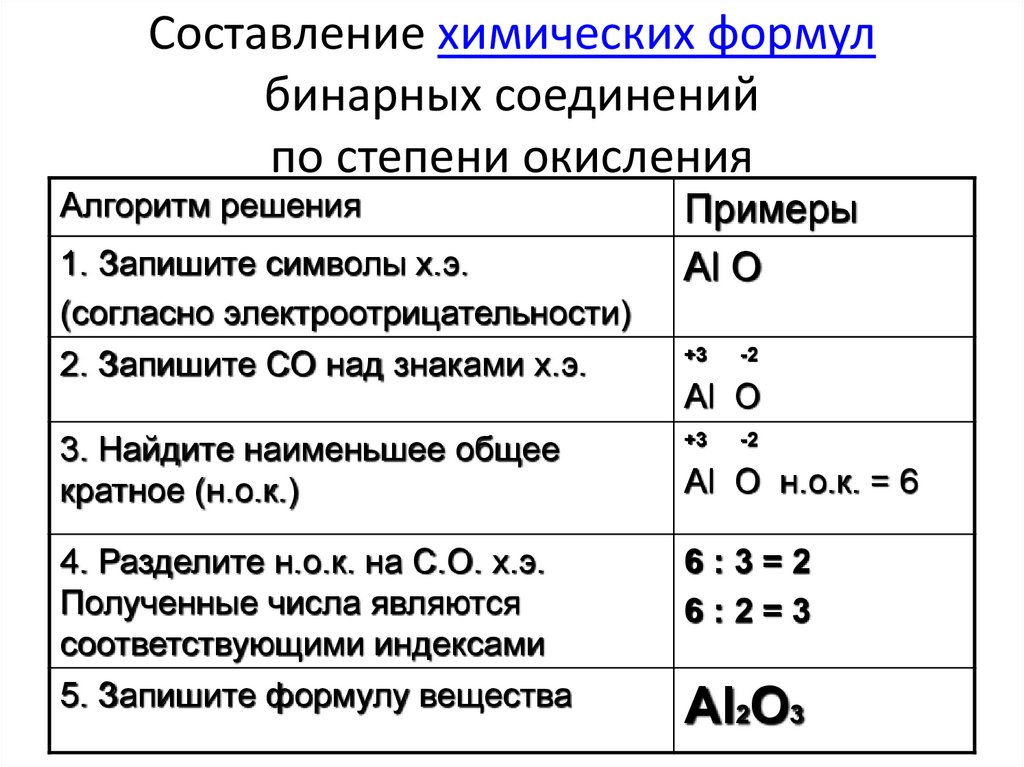 03.2019 03:00
03.2019 03:00
Решите две : 1) найдите молекулярную формулу углеводорода , массовая доля углерода в котором составляет 83,3 % . относительная плотность паров этого вещества по водороду равна 36 . 2) найдите молекулярную формулу углеводорода ,
массовая доля водорода в котором составляет 15,79 % . относительная плотность паров этого вещества по воздуху равна 3,93 .
Ответов: 3
Открыть
Химия, 01.03.2019 04:40
Пентен2: написать 3 структурных изомера разных видов
Ответов: 4
Открыть
Химия, 01.03.2019 22:40
Как, используя простые вещества — кальций, фосфор и кислород, можно получить фосфат кальция? напишите уравнения соответствующих реакций
Ответов: 4
Открыть
Химия, 02.03.2019 04:10
Определите объем 3,612 x 10 [в степени 23] молекул no[ тут маленькая цифра 2 снизу]
Ответов: 3
Открыть
Химия, 02.03.2019 04:10
Какой объём будет занимать кислород массой 150 грамм при нормальных условиях
Ответов: 2
Открыть
Химия, 02. 03.2019 05:00
03.2019 05:00
Li и cu с хлором, водой и соляной кислотой
Ответов: 4
Открыть
Химия, 02.03.2019 19:30
Напишите молекулярные и ионные уравнения реакций азотной кислоты с гидроксидом меди (ii), оксидом железа (iii), и карбонатом натрия
Ответов: 4
Открыть
Вопросы по другим предметам:
Математика, 21.05.2020 10:01
Картоплю розвезли у три магазини. У перший магазин завезли 240 кг. Маса картоплі завезеної у другий магазин становить 5/8 тієї,що у першому і 30% маси картоплі яка опинилася у трет…
Литература, 21.05.2020 10:01
Https://t. me/znanieh во и ответ ты только подпишись …
Математика, 21.05.2020 10:01
Овощной магазин реализовал 240кг картофеля. В первый день было продано 3/16 картофеля а во второй 7/16. Сколько картофеля магазин реализовал за два дня С
Р
О
Ч
Математика, 21.05.2020 10:01
45783т сколько тонн центнерови кг…
Русский язык, 21.05.2020 10:01
кто сможет одно задание 12. …
…
Математика, 21.05.2020 10:01
Запиши числовое выражение и найди его значение: произведение числа 844 и суммы чисел 642 и 33. Памагити…
Немецкий язык, 21.05.2020 10:01
!ОЧЕНЬ Контрольная работаКласс 8
Задание 1а. Прочитайте текст. Отметьте верные и неверные ответы.
Задание 1в. Выпиши предложения сложноподчиненные,…
Математика, 21.05.2020 10:01
Вычислите -1 4/5*(-15)…
Математика, 21.05.2020 10:01
3/11*2/3 дроби решите…
Русский язык, 21.05.2020 10:01
Как пишется слово? здано…
Еще вопросы по предмету: Химия Другие вопросы
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Фе | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
HCOOH Структура Льюиса, гибридизация, молекулярная геометрия и валентные углы
Химическая формула HCOOH представляет собой муравьиную кислоту. Соединение также называют «метановой кислотой». В чистом виде соединение представляет собой бесцветную жидкость с резким запахом и дымом. Растворим в воде и полярных растворителях. Муравьиная кислота существует в форме димера в паровой фазе, а также в углеводородах.
Соединение также называют «метановой кислотой». В чистом виде соединение представляет собой бесцветную жидкость с резким запахом и дымом. Растворим в воде и полярных растворителях. Муравьиная кислота существует в форме димера в паровой фазе, а также в углеводородах.
Муравьиная кислота получила свое название от латинского слова Formica, что переводится как муравьи. Некоторые муравьи и другие насекомые используют муравьиную кислоту для защиты от хищников или других угроз.
HCOOH можно получить несколькими способами. Реакция монооксида углерода с метанолом в присутствии метоксида натрия дает метилформиат. Этот посредник подвергается гидролизу с образованием муравьиной кислоты.
Ch4OH + CO → HCO2Ch4
HCO2Ch4 + h3O → HCOOH + Ch4OH
Вышеуказанная реакция требует избытка воды и может быть неэффективной. Некоторые производители обошли эту проблему, применив новые методы, такие как жидкостная экстракция, для отделения муравьиной кислоты от воды.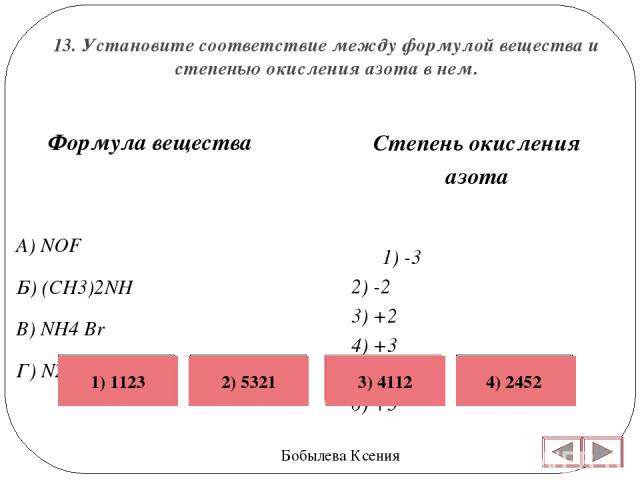
Муравьиная кислота также получается как побочный продукт при производстве уксусной кислоты путем окисления. Окисление биомассы, электрохимическое восстановление и биосинтез — другие методы, с помощью которых можно получить муравьиную кислоту.
HCOOH также является простейшей карбоновой кислотой. Он используется в основном в качестве консерванта для корма для скота. Он также используется в качестве припоя, дубильного вещества в кожевенной промышленности и в качестве альтернативы водороду в топливных элементах.
Муравьиная кислота может вызывать легкое раздражение и образование волдырей. Длительное воздействие может привести к хроническому заболеванию почек. Некоторые свойства HCOOH приведены ниже:
| Наименование молекулы | HCOOH | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Компания валентных электронов | (2 x 1) + (4 x 1) + (6 x 2) = 18 валентных электронов | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Гибридизация Центральный Atom | SP2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Углы связи | Приблизительно 120 ° (124-126) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярная геометрия HCOOH | 1111111111111111111111111111111 собой. 0966 HCOOH Валентные электроны 0966 HCOOH Валентные электроны Чтобы определить структуру Льюиса конкретного соединения, мы должны сначала определить количество доступных нам валентных электронов. Валентные электроны присутствуют во внешней оболочке атома и могут разрываться, образуя химические связи. Они используются для представления химических связей и октетов в структуре Льюиса. Теперь посчитаем количество валентных электронов, доступных нам в HCOOH. Углерод находится в группе 4 периодической таблицы с электронной конфигурацией [He] 2s22p2. Следовательно, один атом углерода вносит 4 x 1 = 4 валентных электрона. Водород имеет электронную конфигурацию 1s1. Следовательно, два атома водорода вносят 1 x 2 = 2 валентных электрона. Находясь в группе 6 периодической таблицы, кислород имеет шесть валентных электронов и имеет валентность -2. Электронная конфигурация кислорода 1s22s22p4. Следовательно, два атома кислорода, присутствующие в молекуле, вносят 6 x 2 = 12 валентных электронов. Следовательно, общее число валентных электронов в муравьиной кислоте (HCOOH): 4[C] + 2[H] + 12[O] = 18 валентных электронов HCOOH Структура ЛьюисаСтруктура Льюиса молекулы дает представление о ее различных свойствах. Некоторые из них включают молекулярную структуру и полярность. Помимо представления базовой структуры молекулы, это важный инструмент для классификации и визуализации. Чтобы получить структуру Льюиса HCOOH, мы должны сначала определить доступные валентные электроны. Выше было рассчитано, что это число равно 18. Углерод действует как центральный атом и облегчает связывание. Другие атомы окружают его. Есть два атома водорода и два атома кислорода. Один из них действует как гидроксильная (ОН) группа. Два валентных электрона размещаются между атомами, образуя ковалентные связи. Это представлено на рисунках ниже. Теперь, когда химические связи сформированы, октеты составляющих атомов должны быть заполнены. К атомам кислорода теперь присоединено 8 электронов. Атомы водорода также удовлетворяют требованиям внешней оболочки. У углерода 6 электронов, и поэтому ему нужно еще два валентных электрона, чтобы завершить свой октет. В этом случае мы можем переместить два валентных электрона от одинокого атома кислорода. Это приводит к двойной связи с центральным атомом углерода. Это показано ниже: В приведенной выше структуре можно наблюдать, что все составляющие атомы в структуре HCOOH удовлетворяют требованиям внешней оболочки/октета. У углерода теперь есть двойная связь с одиноким атомом кислорода, и у них есть 4 общих электрона. Это позволяет как углероду, так и кислороду соответствовать их требованиям октета, что приводит к стабильной структуре. Окончательная структура Льюиса для муравьиной кислоты (HCOOH) приведена ниже: Гибридизация HCOOH Гибридизацию центрального атома углерода можно определить, наблюдая структуру Льюиса. Это похоже на подсчет стерического числа. Стерическое число представляет собой количество атомов/неподеленных пар, присоединенных к атому. Стерические числа 2, 3 и 4 соответствуют sp, sp 2 и sp 3 , соответственно. В этом случае центральный атом углерода связан с атомом водорода, атомом кислорода и гидроксильной группой (ОН). Это дает ему стерическое число 3. Следовательно, гибридизация атома углерода в HCOOH представляет собой sp 2 . HCOOH Валентные углы В соответствии с теорией VSEPR составляющие атомы отталкиваются каждой парой, что приводит к тригональной плоской геометрии. Таким образом, валентный угол HCOOH теоретически составляет 120 °. Однако из-за большего отталкивания от двойной связи валентные углы несколько выше. Это представлено на рисунке ниже: HCOOH Молекулярная геометрия и формаЧтобы определить молекулярную геометрию муравьиной кислоты, мы должны наблюдать ее структуру Льюиса. Центральный атом углерода образует одинарные ковалентные связи с атомом водорода и гидроксильной группой. Существует также двойная связь с атомом кислорода. Это дает ему стерическое число 3 и предполагает треугольную плоскую форму. Согласно теории VSEPR, атом кислорода с двойной связью отталкивает другие атомы в молекуле. Мы также можем использовать концепцию A-X-N и ее таблицу для проверки и определения молекулярной геометрии HCOOH. «А» представляет собой центральный атом. Углерод является центральным атомом. Значение «A» здесь равно 1. «X» представляет собой количество атомов, связанных с центральным атомом. В этом случае с атомом углерода связаны три атома. Следовательно, X =3. «N» представляет собой количество неподеленных пар, присоединенных к центральному атому. В молекуле нет неподеленных пар. Следовательно, N=0. Следовательно, это дало бы нам обозначение AX3 для молекулы HCOOH. Из приведенной ниже таблицы A-X-N мы можем определить молекулярную геометрию.
Формула AX3 соответствует тригонально-плоской молекулярной геометрии. Следовательно, муравьиная кислота (HCOOH) имеет тригонально-плоскую молекулярную геометрию. Заключительные замечанияДавайте кратко суммируем характеристики и свойства муравьиной кислоты (HCOOH)
органическая химия — Какова правильная структура Льюиса для HCOOH?Спросил Изменено 4 года, 6 месяцев назад Просмотрено 32k раз $\begingroup$ Я попытался нарисовать структуру Льюиса $\ce{HCOOH}$, но не получил правильного представления. Как вы можете видеть на картинке ниже, по адресу №. 1 я поместил $\ce{C}$ в качестве центрального атома, потому что он имеет меньшую электроотрицательность, чем $\ce{O}$ ($\ce{H}$ не может быть центральным атомом). Я нарисовал структуру, но она неверна, потому что нарушает правило октетов. Затем я придумал другую структуру, как показано под номером . 2, и мне это казалось правильным, но когда я поискал в гугле правильную структуру, то обнаружил, что ошибаюсь.Почему нет структуры, которую я нарисовал? +2 неправильно, хотя формальные обвинения равны нулю? Как определить правильный порядок атомов в таких молекулах, как приведенная выше. Я имею в виду, откуда я знаю, что $\ce{C}$ будет иметь $\ce{H}$ слева и один $\ce{O}$ вверху и $\ce{O, H}$ на правая сторона?
$\endgroup$ $\begingroup$ При знакомстве вы поймете, что $\ce{COOH}$ в формуле обычно относится к группе карбоновой кислоты. Важно понимать, что карбоксильная группа НЕ является перекисью. Пероксиды имеют связи О-О. Вы также можете обобщить, что атомы кислорода в пероксидах имеют отрицательную степень окисления. Распространенной перекисью является перекись водорода, $\ce{h3O2}$ или $\ce{HOOH}$. Также обратите внимание, что углерод, как правило, четырехвалентен, т. е. обычно встречается в стабильных молекулах, так как имеет октет электронов. Кроме того, углерод обычно не имеет общего формального заряда. Таким образом, это говорит о том, что большую часть времени вы будете видеть углерод, образующий четыре связи — и так оно и есть в большинстве случаев. Эта конфигурация не дает углероду чистого формального заряда и заполняет его октет. Конечно, вы можете найти карбокатионы или карбоанионы, но карбокатионы крайне нестабильны и существуют лишь временно. Вышеизложенное, в дополнение к тому, что карбоновая кислота представляет собой кислоту Бренстеда/Лоури , т.е. донор протонов, должно позволить построить приемлемую структуру Льюиса. $\endgroup$ 3 $\begingroup$ Из формулы суммы типа $\ce{HCOOH}$ обычно невозможно построить структуру Льюиса. В этом случае есть некоторые очевидные моменты, почему ваши структуры не могут быть правильными.
Таким образом, на практике формулы сумм всегда должны сопровождаться названием или схематическим рисунком. Например, если вы попытаетесь сформулировать структуру Льюиса на основе формулы суммы $\ce{C2H6O}$, вы получите диметиловый эфир или этиловый спирт/этанол. $\endgroup$ 8 $\begingroup$ Официальные обвинения не говорят всей истории. Какие атомы с чем связаны, это первое, что вам нужно рассмотреть. Обратите внимание, что $\ce{HCOOH}$ дает вам подсказку, что $\ce{OH}$ идет вместе, а не 2-й $\ce{H}$ присоединяется к $\ce{C}$. (Хотя линейная формула по-прежнему вводит в заблуждение, поскольку оба атома $\ce{O}$ присоединены к $\ce{C}$, чего в формуле, по-видимому, нет). $\endgroup$ $\begingroup$ Физическая причина, по которой ответ 2 неверен, заключается в том, что он представляет класс соединений, которые очень реакционноспособны (карбен), и если бы соединения в (2) действительно существовали, они, вероятно, очень быстро перегруппировались бы в изомеры карбоновых кислот. $\endgroup$ 2 $\begingroup$
$\endgroup$ $\begingroup$ Кислород может иметь меньше октета. В резонансной структуре тройной связи $\ce{CO}$ $\ce{O}$ имеет 5 электронов вокруг себя, что дает формальный заряд +1. То же верно и для $\ce{O}$ справа в структуре 1. $\ce{O}$ имеет эквивалент 3 неподеленных пар электронов (то есть 6 электронов) для образования связи. Если он использует 1 неподеленную пару из 2,2,1,1 расположения $\ce{O}$ для образования одинарной связи (что он и делает), то $\ce{O}$ использовал 2 электрона для образования связь, оставляющая 4 несвязывающих электрона. Если вы разделите $\ce{O}$ и $\ce{C}$, разорвав связь, $\ce{O}$ будет иметь свои исходные 6. Он превышает октет, который недействителен для периода 2, не менее октета. 9-}$. Существует также небольшое количество нейтрального атомарного кислорода (который является бирадикалом). Карбкатионы существуют по той же причине, что и ионы кислорода с менее чем 8 электронами. Эта причина в том, что наличие менее октета не является недопустимым.$\endgroup$ 2 Твой ответЗарегистрируйтесь или войдите в системуЗарегистрируйтесь с помощью Google Зарегистрироваться через Facebook Зарегистрируйтесь, используя электронную почту и пароль Опубликовать как гостьЭлектронная почта Обязательно, но не отображается Опубликовать как гостьЭлектронная почта Требуется, но не отображается Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie . HCOOH Структура Льюиса, молекулярная геометрия, гибридизация и полярностьHCOOH известна как муравьиная кислота (обычное название) или метановая кислота (название IUPAC). Это органическое соединение и первый член семейства карбоновых кислот. Карбоновые кислоты представляют собой органические соединения с формулой RCOOH, где R может быть H (первый член) или алкильной группой (высшие члены). Муравьиная кислота была выделена из перегонки муравьиных тел в прежние времена, и ее также производят из метанола в промышленных масштабах. Молярная масса муравьиной кислоты составляет 46,03 г/моль, а ее температура кипения почти равна молекуле воды, т. е. 100,8°. Здесь мы обсудим химическую связь в муравьиной кислоте, нарисовав ее структуру Льюиса, поняв ее молекулярную геометрию и гибридизацию.
HCOOH Структура ЛьюисаСтруктуры Льюиса или структуры электронных точек представляют собой двумерные диаграммы, которые представляют связывающие электронные пары между атомами молекулы и неподеленные пары электронов на атоме, если они присутствуют. Связывающие и несвязывающие электроны представляют собой валентные электроны, которые присутствуют в самой внешней оболочке атома. В соответствии с правилом Льюиса или правилом октета атом имеет тенденцию связываться с другими атомами таким образом, что каждый атом имеет восемь электронов в своей валентной оболочке, кроме водорода и гелия. Рисунок структуры Льюиса состоит из следующих шагов: Шаг 1 : Подсчитайте общее количество валентных электронов в молекуле, записав электронную конфигурацию атома. Электронная конфигурация атомов углерода, водорода и кислорода: [He] 2s22p2, 1s1 и [He] 2s22p4 соответственно. В муравьиной кислоте два атома водорода и два атома кислорода. Следовательно, общее число валентных электронов в муравьиной кислоте равно 4 + (1 * 2) + (6 * 2) = 18 электронов. Шаг 2 : Наименее электроотрицательный атом с максимальным числом групповой валентности действует как центральный атом. Следовательно, атом углерода будет действовать как центральный атом. В скелетной структуре муравьиной кислоты атом углерода будет окружен группами H, O и OH. Шаг 3 : Расположите все валентные электроны в скелетной структуре молекулы. У нас есть 18 валентных электронов, которые нужно расположить в льюисовской структуре муравьиной кислоты. Прежде всего, начните с атома углерода, так как это центральный атом. Он завершит дуплет водорода, который присоединен непосредственно к атому углерода. Теперь атом кислорода, присоединенный к атому углерода, будет иметь четыре общих электрона или две пары связей электрона с атомом углерода. У него также будет две неподеленные пары электронов (четыре электрона), чтобы завершить его октет. Остальные шесть электронов будут распределены в группе ОН, связанной с атомом углерода. Таким образом, возможная структура Льюиса муравьиной кислоты будет следующей: Два связывающих электрона образуют одинарную связь, а четыре связывающих электрона образуют двойную связь. Следовательно, структуру Льюиса муравьиной кислоты можно изобразить следующим образом: Структура Льюиса представляет собой простое представление молекулы. Он не дает никакой информации о форме молекулы и гибридизации атома в молекуле. Для этого нам необходимо изучить теорию отталкивания пар электронов валентной оболочки (VSEPR) и теорию валентной связи (VBT).
HCOOH Молекулярная геометрияМолекулярную геометрию или форму можно предсказать с помощью теории VSEPR. Он рассматривает отталкивание между связывающими и несвязывающими (неподвижной парой) электронами валентной оболочки. Согласно структуре муравьиной кислоты по Льюису, атом углерода является центральным атомом и имеет три пары связей без какой-либо неподеленной пары электронов. В теории VSEPR двойная связь рассматривается как одна пара связей для предсказания формы молекулы. Следовательно, форму муравьиной кислоты можно легко предсказать по следующей таблице.
Следовательно, муравьиная кислота будет иметь тригональную плоскую геометрию вокруг атома углерода и тетраэдрическую геометрию вокруг атома кислорода, поскольку она имеет две неподеленные пары и две пары связей. Тригонально-плоская геометрия муравьиной кислоты вокруг атома углерода должна обеспечивать валентный угол (H-C-O или O-C-O) равным 120°, чтобы свести к минимуму отталкивание пар связей вокруг атома углерода . Однако фактический валентный угол немного отличается от 120°, поскольку между парой двойной связи и парой одинарной связи будет большее отталкивание. Следовательно, валентные углы H-C=O и O=CO больше 120°. Аналогично, валентный угол вокруг атома кислорода, т. е. C-O-H, должен составлять 109,5 °, имея тетраэдрическую геометрию. Но валентный угол C-O-H составляет 106 °, чтобы минимизировать отталкивание между двумя неподеленными парами, присутствующими на атоме кислорода . Длины связей, определенные с помощью рентгеновского дифрактометра, показаны на следующем рисунке: Гибридизацию атомов углерода и кислорода в муравьиной кислоте можно определить с помощью теории валентной связи (VBT) и стерического числа.
HCOOH ГибридизацияГибридизация – это процесс смешения атомных орбиталей и образования гибридных орбиталей эквивалентной энергии. Количество гибридных орбиталей равно количеству объединенных атомных орбиталей. Полученная гибридная орбиталь перекрывается либо с гибридной орбиталью других атомов, либо с атомной орбиталью, образуя ковалентную связь. Гибридизацию атома углерода в муравьиной кислоте можно определить следующим образом: Электронная конфигурация атома углерода в основном состоянии [He] 2s22p2. Один из электронов с 2s-орбитали будет возбужден на 2p-орбиталь атома углерода и приведет к конфигурации возбужденного состояния атома углерода как [He] 2s12p3. Поскольку атом углерода образует три сигма-связи с другими атомами и, следовательно, одна 2s-орбиталь и две 2p-орбитали атома углерода будут смешиваться и образовывать три sp2-гибридные орбитали, а одна из p-орбиталей останется негибридизированной, которые образуют pi связь с атомом кислорода. Из орбитальной диаграммы видно, что атом углерода находится в состоянии sp2-гибридизации, и один из атомов кислорода также находится в состоянии sp2-гибридизации, тогда как другой атом кислорода, связанный с атомом водорода и углерода, находится в состоянии sp3-гибридизации. Гибридизацию и форму также можно определить с помощью описанных выше методов или непосредственно по стерическому числу. Стерическое число равно сумме числа атомов, связанных с конкретным атомом, и числа неподеленных пар электронов у одного и того же атома. Если стерическое число равно 2, 3 и 4, то гибридизация будет sp, sp2 и sp3 соответственно. Гибридизация различных атомов в муравьиной кислоте объясняется в следующей таблице исходя из стерического числа.
HCOOH Полярность Суммарный дипольный момент и распределение зарядов определяют полярность молекулы. Значения электроотрицательности атома водорода, атома углерода, атома кислорода равны 2,5, 2,2 и 3,5 соответственно. Атом углерода является центральным атомом в муравьиной кислоте. Разность электроотрицательностей связи С-Н составляет 2,5 – 2,2 = 0,3, тогда как для связи С-О и О-Н 1,0 и 1,3 соответственно. Следовательно, связь C-H слабо полярна. Связи О-Н и С-О являются полярными ковалентными связями. Он создает диполь в связях CO с частичным положительным зарядом на углероде и частичным отрицательным зарядом на атоме кислорода. Точно так же связь OH также является дипольной. Это приводит к полярному характеру муравьиной кислоты. Заряды также неравномерно распределены в муравьиной кислоте и, следовательно, муравьиная кислота является полярной молекулой . Он хорошо растворим в воде и большинстве полярных растворителей из-за его полярной природы.
Заключение Муравьиная кислота – органическое соединение с резким запахом. В муравьиной кислоте атом углерода является центральным атомом. Все атомы, кроме водорода, следуют правилу октетов в структуре Льюиса муравьиной кислоты. Молекулярная геометрия у центрального атома углерода и гибридизация центрального атома представляют собой тригонально-плоскую и sp2-гибридизацию соответственно. Муравьиная кислота представляет собой полярную молекулу, что делает ее растворимой в полярных растворителях. Не стесняйтесь задавать вопросы относительно связывающей природы муравьиной кислоты. Спасибо. Счастливого обучения. Муравьиная кислота — Яватпойнт
[PDF] He I photoelectron spectroscopy of four isotopologues of formic acid: HCOOH, HCOOD, DCOOH and DCOOD
@inproceedings{Leach3003HeIP,
title={Фотоэлектронная спектроскопия He I четырех изотопологов муравьиной кислоты: HCOOH, HCOOD, DCOOH и DCOOD},
автор = {Сидней Лич, Мартин Швелл, Дабиа Талби, Гастон Бертье, Клаус Хоттманн, Х.
Взгляд через издатель LISA.U-PEC.FR The Phisperatormental Exceermental Phisperationalmentalmentalmentalmentalmentalmentalmental. валентная область.Теория функционала плотности и теория функционала плотности, зависящая от времени, используются для расчета энергий основного и возбужденного электронных состояний нейтральной и ионной муравьиной кислоты, а также их фрагментов и мод нормальных колебаний. Computation of Franck-Condon factors for many-atom systems: simulated photoelectron spectra of formic acid isotopologues
Formic and acetic acid: Valence threshold исследования полного выхода ионов фотоэлектронов и фотоионизации
Ro-вибрационная спектроскопия мономера муравьиной кислоты-d1, внедренного в нанокапли гелия
|

 10.18
10.18 Определение степени окисления в соединении
Определение степени окисления в соединении При определении степени окисления используют следующие правила:
При определении степени окисления используют следующие правила: Степень окисления атома серы в ионе SO равна +6.
Степень окисления атома серы в ионе SO равна +6. Все необходимое, чтобы решить часть 1 ЕГЭ по математике (первые 12 задач) и задачу 13 (тригонометрия). А это более 70 баллов на ЕГЭ, и без них не обойтись ни стобалльнику, ни гуманитарию.
Все необходимое, чтобы решить часть 1 ЕГЭ по математике (первые 12 задач) и задачу 13 (тригонометрия). А это более 70 баллов на ЕГЭ, и без них не обойтись ни стобалльнику, ни гуманитарию.
 Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3).
У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3). Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1.
Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1.

 Оставшиеся валентные электроны затем размещаются вокруг самых внешних атомов, заполняя их внешние оболочки. Это показано ниже:
Оставшиеся валентные электроны затем размещаются вокруг самых внешних атомов, заполняя их внешние оболочки. Это показано ниже: Мы можем просто подсчитать количество электронных доменов, присоединенных к углероду, чтобы определить гибридизацию. Неподеленные пары и сигма-связи являются примерами электронных доменов.
Мы можем просто подсчитать количество электронных доменов, присоединенных к углероду, чтобы определить гибридизацию. Неподеленные пары и сигма-связи являются примерами электронных доменов.
 Это можно наблюдать из приведенной выше структуры Льюиса.
Это можно наблюдать из приведенной выше структуры Льюиса.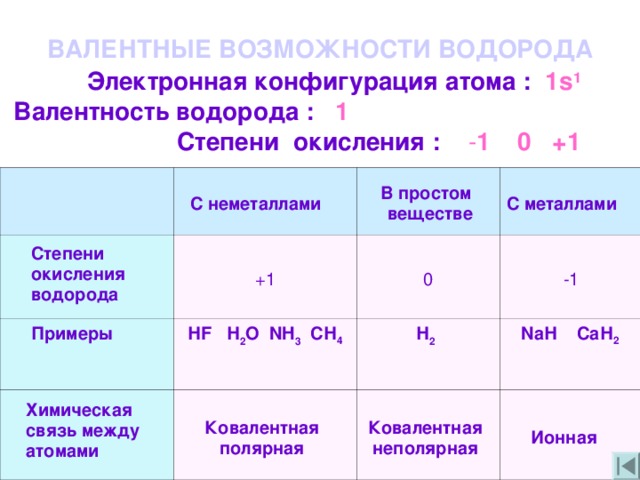 5
5
 Иногда вы также можете увидеть $\ce{CO_2H}$. Любой приемлем. Уксус, или уксусная кислота, является карбоновой кислотой. Его формула $\ce{Ch4COOH}$ или $\ce{h4CCOOH}$.
Иногда вы также можете увидеть $\ce{CO_2H}$. Любой приемлем. Уксус, или уксусная кислота, является карбоновой кислотой. Его формула $\ce{Ch4COOH}$ или $\ce{h4CCOOH}$. Также существуют карбоанионы; см. пример цианид-иона.
Также существуют карбоанионы; см. пример цианид-иона.
 Причина, по которой может произойти перегруппировка, заключается в силе связи (т. Е. Энергии, необходимой для гомолитического разрыва химической связи) — связи углерод-кислород прочнее, чем связи кислород-кислород. См. эту ссылку для приблизительных цифр по этому свойству
Причина, по которой может произойти перегруппировка, заключается в силе связи (т. Е. Энергии, необходимой для гомолитического разрыва химической связи) — связи углерод-кислород прочнее, чем связи кислород-кислород. См. эту ссылку для приблизительных цифр по этому свойству И вот почему:
И вот почему: Затем мы перейдем к полярной природе муравьиной кислоты.
Затем мы перейдем к полярной природе муравьиной кислоты.  Следовательно, валентные электроны в C, H и O равны 4, 1 и 6 соответственно.
Следовательно, валентные электроны в C, H и O равны 4, 1 и 6 соответственно. Атом углерода будет окружен восемью электронами в соответствии с правилом октета.
Атом углерода будет окружен восемью электронами в соответствии с правилом октета.


 Орбитальная диаграмма муравьиной кислоты, представляющая сигма-связи, показана ниже.
Орбитальная диаграмма муравьиной кислоты, представляющая сигма-связи, показана ниже.
 Это первый член семейства карбоновых кислот.
Это первый член семейства карбоновых кислот. 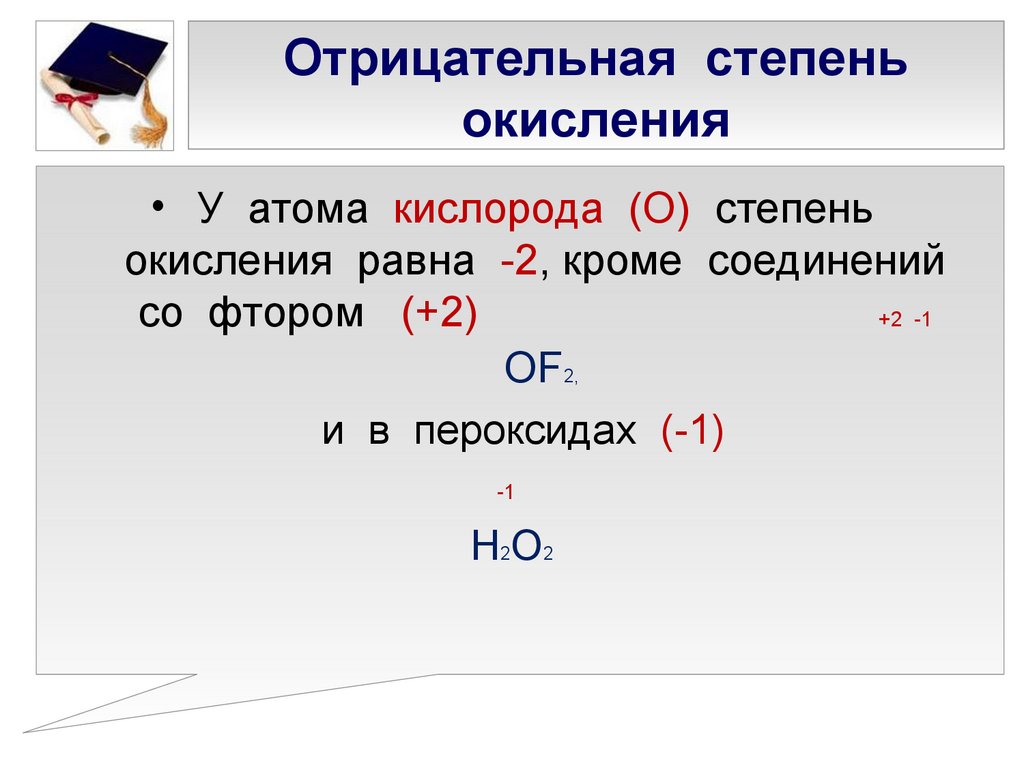 Он естественным образом содержится в яде муравьев и пчел и является важным промежуточным звеном в химическом синтезе. Зуд или жжение, которые мы чувствуем при укусах ос, медоносных пчел и т. д., вызваны попаданием в наш организм муравьиной кислоты. Кроме того, он также присутствует в небольших количествах в поте, моче и мясном экстракте.
Он естественным образом содержится в яде муравьев и пчел и является важным промежуточным звеном в химическом синтезе. Зуд или жжение, которые мы чувствуем при укусах ос, медоносных пчел и т. д., вызваны попаданием в наш организм муравьиной кислоты. Кроме того, он также присутствует в небольших количествах в поте, моче и мясном экстракте.

 Шаги описаны ниже:
Шаги описаны ниже: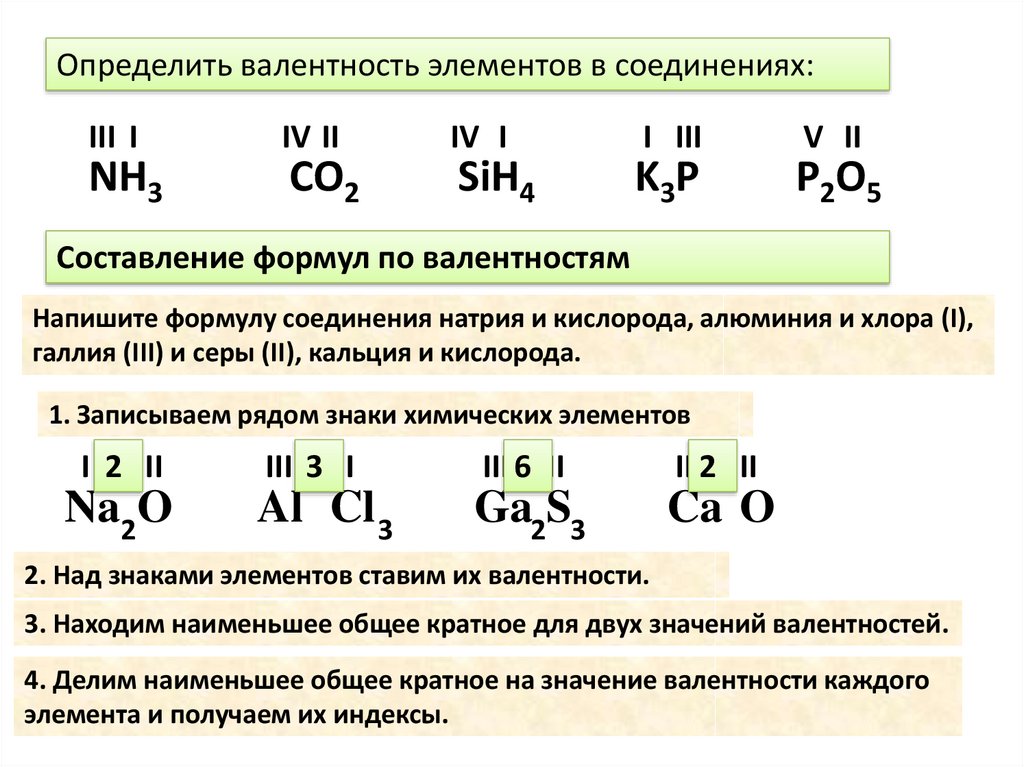
 В. Йохимс и Гельмут Баумг,
год = {2003}
}
В. Йохимс и Гельмут Баумг,
год = {2003}
}  Siggel-King, A. Yencha, G. King, A. Malins, Marie Eypper
Siggel-King, A. Yencha, G. King, A. Malins, Marie Eypper
 Leyh, K. Hottmann, H. Baumgärtel
Leyh, K. Hottmann, H. Baumgärtel Berkowitz
Berkowitz