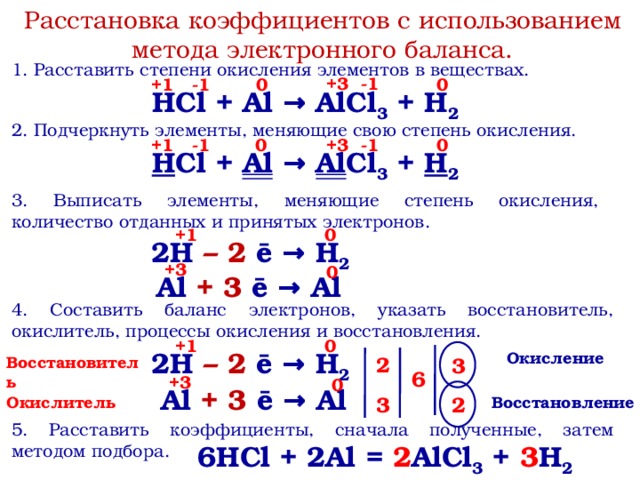
Название кислот и кислотных остатков и их формулы
0 Азамат #
16 сентября 2019 в 14:41
Вроде норм
Ответить
0 Гулина #
8 января 2020 в 10:02
где нитрид?
Ответить
0 Алексей #
6 сентября 2020 в 07:05
А где соляная ?
Ответить
6 сентября 2020 в 07:43
HCl Хлороводород (Соляная кислота) Cl- Хлорид
Ответить
0 we #
14 сентября 2020 в 14:50
А борная?
Ответить
0 Администратор#
14 сентября 2020 в 19:43
Добавили
Ответить
0 Лиза #
1 апреля 2021 в 15:08
а салициловая,яблочная?
Ответить
0 Администратор#
2 апреля 2021 в 10:00
Добавили
Ответить
0 Карина #
14 апреля 2021 в 16:05
а вольфрамовая кислота?
Ответить
0 Администратор#
15 апреля 2021 в 20:09
Добавили
Ответить
0 Капуста #
2 мая 2021 в 09:59
Ванадиевая кислота?
Ответить
0 Артём #
5 июля 2021 в 17:57
А где дифосфорная, тиосерная и тиоциановая
Ответить
0 Администратор#
8 июля 2021 в 17:21
Капуста:
Ванадиевая кислота?
Артём:
А где дифосфорная, тиосерная и тиоциановая
Добавили
Ответить
0 Виктор #
8 июля 2021 в 17:49
у вас нет:
марганцевистая — h3MnO4
цинковая — h3ZnO2
метафосфорная — HPO3
молибденовая — h3MoO4
ортокремнивая — h5SiO4
Ответить
0 1 #
1 августа 2021 в 11:08
А возможно ли скачать таблицу?
Ответить
0 Айдар кот #
11 марта 2022 в 18:14
Где метафосфорная кислота?
Ответить
0 Ваня Балда #
1 ноября 2022 в 05:59
А можно ли скачать таблиицу?
Ответить
| Ответ | Будем поочередно определять степень окисления серы в каждой из предложенных схем превращений, а затем выберем верный вариант ответа.
Изменение степени окисления серы: -2 → 0, т.е. шестой вариант ответа.
Изменение степени окисления серы: 0 → +6, т.е. четвертый вариант ответа.
1×2 +x+ 3×(-2) =0; Изменение степени окисления серы: +4 → 0, т.е. третий вариант ответа. |
| Задание | Валентность III и степень окисления (-3) азот проявляет в соединении: а) N 2 H 4 ; б) NH 3 ; в) NH 4 Cl; г) N 2 O 5 |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем поочередно определять валентность и степень окисления азота в предложенных соединениях.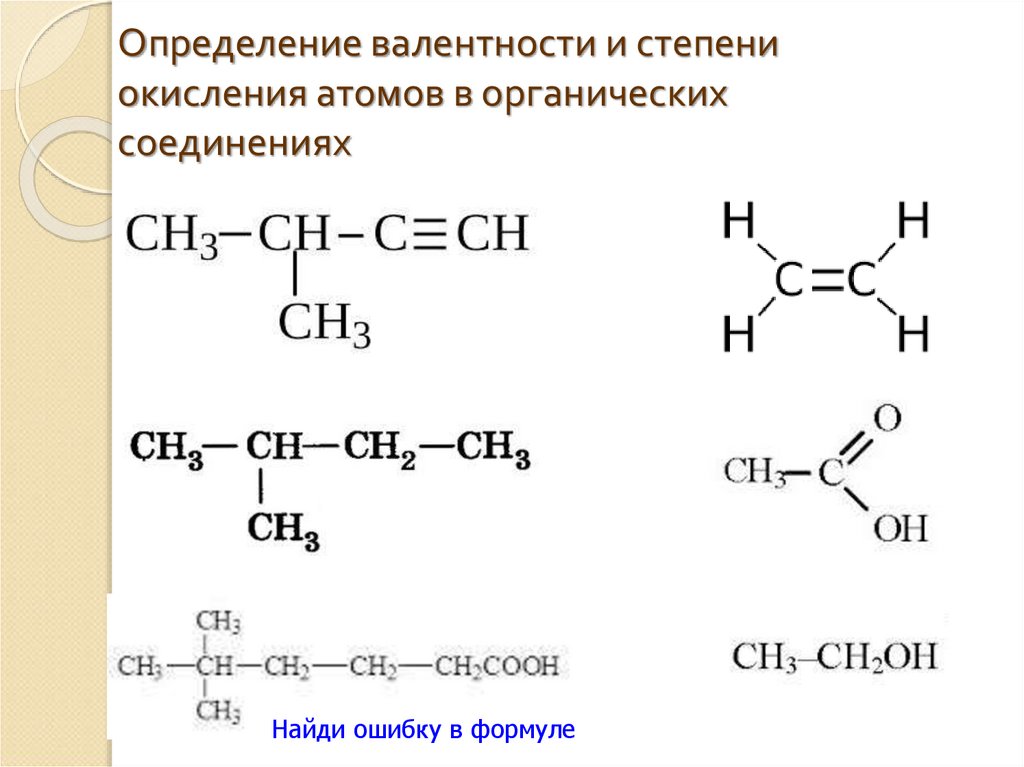 а) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 4-м (1×4 = 4). Разделим полученное значение на число атомов азота в молекуле: 4/2 = 2, следовательно, валентность азота равна II. Этот вариант ответа неверный. б) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 3-м (1×3 = 3). Разделим полученное значение на число атомов азота в молекуле: 3/1 = 2, следовательно, валентность азота равна III. Степень окисления азота в аммиаке равна (-3): Это верный ответ. |
| Ответ | Вариант (б) |
Цель: Продолжить изучение валентности. Дать понятие степени окисления. Рассмотреть виды степеней окисления: положительная, отрицательная, нулевой значение. Научиться правильно, определять степени окисления атома в соединении. Научить приемам сравнения и обобщения изучаемых понятий; отработать умения и навыки в определении степени окисления по химическим формулам; продолжить развитие навыков самостоятельной работы; способствовать развитию логического мышления.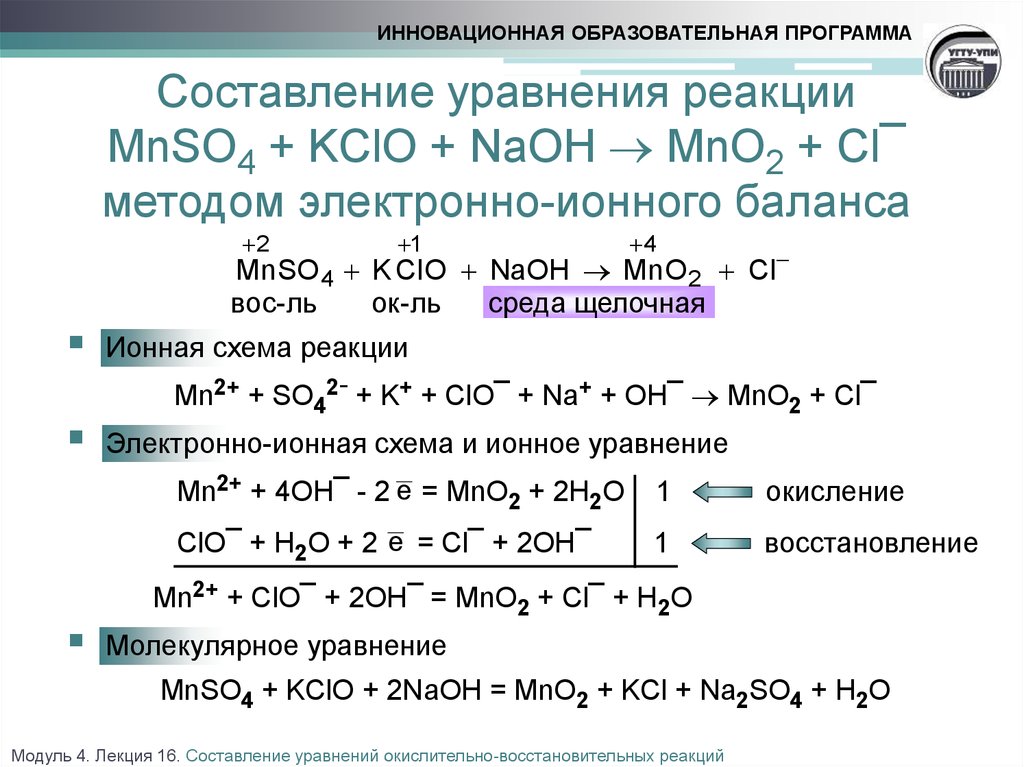 Формировать чувство толерантности (терпимости и уважения к чужому мнению) взаимопомощи; осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентаций).
Формировать чувство толерантности (терпимости и уважения к чужому мнению) взаимопомощи; осуществлять эстетическое воспитание (через оформление доски и тетрадей, при применении презентаций).
Ход урока
I . Организационный момент
Проверка учащихся к уроку.
II . Подготовка к уроку.
К уроку понадобятся: Периодическая система Д.И.Менделеева, учебник, рабочие тетради, ручки, карандаши.
III . Проверка домашнего задания .
Фронтальный опрос, некоторые будут работать у доски по карточкам, проведение теста, и подведением данного этапа будет интеллектуальная игра.
1. Работа с карточками.
1 карточка
Определить массовые доли (%) углерода и кислорода в углекислом газе (СО 2 ) .
2 карточка
Определить тип связи в молекуле Н 2 S. Написать структурную и электронную формулы молекулы.
2. Фронтальный опрос
- Что называется химической связью?
- Какие виды химических связей вы знаете?
- Какая связь называется ковалентной связью?
- Какие ковалентные связи выделяют?
- Что такое валентность?
- Как мы определяем валентность?
- Какие элементы (металлы и неметаллы) имеют изменчивую валентность?
3. Тестирование
Тестирование
1. В каких молекулах существует неполярная ковалентная связь?
2 . У какой молекулы при образовании ковалентно-неполярной связи образуется тройная связь?
3 . Как называется положительно заряженные ионы?
А) катионы
Б) молекулы
В) анионы
Г) кристаллы
4. В каком ряду располагаются вещества ионного соединения?
А) СН 4 , NН 3 , Мg
Б) СI 2 , МgО, NаСI
В) МgF 2 , NаСI, СаСI 2
Г) Н 2 S, НСI, Н 2 О
5 . Валентность определяются по:
А) по номеру группы
Б) по числу неспаренных электронов
В) по типу химической связи
Г) по номеру периода.
4. Интеллектуальная игра «Крестики-нолики »
Найдите вещества с ковалентно-полярной связь.
IV . Изучение нового материала
Степень окисления является важной характеристикой состояния атома в молекуле.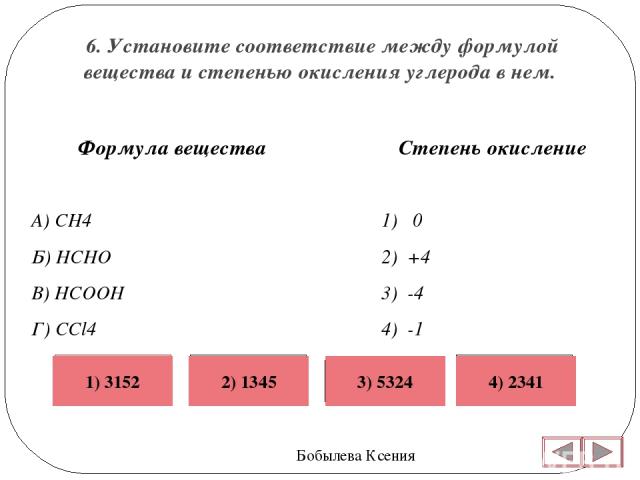 Валентность, определяется по числу неспаренных электронов в атоме, орбиталями с неподеленными электронными парами, только в процессе возбуждения атома. Высшая валентность элемента, как правило, равна номеру группы. Степень окисления в соединениях с разными химическими связями образуется неодинаково.
Валентность, определяется по числу неспаренных электронов в атоме, орбиталями с неподеленными электронными парами, только в процессе возбуждения атома. Высшая валентность элемента, как правило, равна номеру группы. Степень окисления в соединениях с разными химическими связями образуется неодинаково.
Как образуется степень окисления у молекул с разными химическими связями?
1) В соединениях с ионной связью степени окисления элементов равно зарядам ионов.
2) В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0.
Н 2 0 , С I 2 0 , F 2 0 , S 0 , AI 0
3) У молекул с ковалентно-полярной связью степень окисления определяется подобно молекулам с ионной химической связью.
Степень окисления элемента – это условный заряд его атома, в молекуле, если считать, что молекула состоит из ионов.
Степень окисления атома в отличие от валентности имеет знак. Она может быть положительной, отрицательной и нулевой.
Она может быть положительной, отрицательной и нулевой.
Валентность обозначатся римскими цифрами сверху символа элемента:
II | I | IV |
Fe | Cu | S , |
а степень окисления обозначается арабскими цифрами с зарядом над символам элемента (М g +2 , Са +2 , N а +1 , CI ˉ¹).
Положительная степень окисления – равна числу электронов, отданных данным атомам. Атом может отдать все валентные электроны (для главных групп это электроны внешнего уровня) соответствующее номеру группы, в котором находится элемент, проявляя при этом высшую степень окисления (исключение ОF 2).Например: высшая степень окисления главной подгруппы II группы равна +2 (Zn +2) Положительную степень проявляют как металлы и неметаллы, кроме F, He, Ne. Например: С+4 , Na +1 , Al +3
Например: С+4 , Na +1 , Al +3
Отрицательная степень окисления равна числу электронов, принятых данным атомом, ее проявляют только неметаллы. Атомы неметаллов присоединяют столько электронов, сколько их не хватает до завершения внешнего уровня, проявляя при этом отрицательную степень.
У элементов главных подгрупп IV-VII групп минимальная степень окисления численно равна
Например:
Значение степени окисления между высшим и низшим степенями окислений называется промежуточными:
Высшая | Промежуточные | Низшая |
С +3 , С +2 ,С 0 ,С -2 | ||
В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равно 0: Н 2 0 , С I 2 0 , F 2 0 , S 0 , AI 0
Для определения степени окисления атома в соединении следует учитывать ряд положений:
1.
Степень окисления F во всех соединениях равна « -1». Na +1 F -1 , H +1 F -1
2. Степень окисления кислорода в большинстве соединений равна (-2) исключение: О F 2 , где степень окисления О +2 F -1
3. Водород в большинстве соединений имеет степень окисления +1, кроме соединения с активными металлами, где степень окисления (-1) : Na +1 H -1
4.Степень окисления металлов главных подгрупп I , II , III групп во всех соединениях равна +1,+2,+3.
Элементы с постоянной степенью окисления это:
А) щелочные металлы (Li, Na, K, Pb, Si, Fr) — степень окисления +1
Б) элементы II главной подгруппы группы кроме (Hg): Be, Mg, Ca, Sr, Ra, Zn, Cd — степень окисления +2
В) элемент III группы: Al — степень окисления +3
Алгоритм составления формулы в соединениях:
1 способ
1 . На первом месте пишется элемент с меньшей электроотрицательностью, на втором с большей электроотрицательностью.
На первом месте пишется элемент с меньшей электроотрицательностью, на втором с большей электроотрицательностью.
2 . Элемент, написанный на первом месте имеет положительный заряд «+», а на втором с отрицательным зарядом «-».
3 . Указать для каждого элемента степень окисления.
4 . Найти общее кратное значение степеней окисления.
5. Разделить наименьшее общее кратное на значение степеней окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
6. Если степень окисления четное – нечетное, то они становятся рядом с символом справа внизу крест – накрест без знака «+» и «-»:
7. Если степень окисления имеет четное значение, то их сначала нужно сократить на наименьшее значение степени окисления и поставить крест – накрест без знака «+» и «-»: С +4 О -2
2 способ
1 . Обозначим степень окисления N через Х, указать степень окисления О: N 2 x O 3 -2
2 . Определить сумму отрицательных зарядов, для этого степень окисления кислорода умножаем на индекс кислорода: 3· (-2)= -6
Определить сумму отрицательных зарядов, для этого степень окисления кислорода умножаем на индекс кислорода: 3· (-2)= -6
3 .Чтобы молекула была электронейтральной нужно определить сумму положительных зарядов: Х2 = 2Х
4 .Составить алгебраическое уравнение:
N 2 + 3 O 3 –2
V . Закрепление
1) Проведение закрепления темы игрой, которое называется «Змейка».
Правила игры: учитель раздает карточки. На каждой карточке написан один вопрос и один ответ на другой вопрос.
Учитель начинает игру. Зачитает вопрос, ученик, у которого на карточке есть, ответ на мой вопрос поднимает руку и говорит ответ. Если ответ правильный, то он читает свой вопрос и у того ученика у которого есть ответ на этот вопрос поднимает руку и отвечает и т.д. Образуется змейка правильных ответов.
- Как и где обозначается степень окисления у атома химического элемента?
Ответ : арабской цифрой над символом элемента с зарядом «+» и «-».
- Какие виды степеней окисления выделяют у атомов химических элементов?
Ответ : промежуточная - Какую степень проявляет металлы?
Ответ : положительная, отрицательная, нулевая. - Какую степень проявляют простые вещества или молекулы с неполярной ковалентной связью.
Ответ : положительная - Какой заряд имеют катионы и анионы?
Ответ : нулевое. - Как называется степень окисления, которая стоит между положительным и отрицательным степенями окисления.
Ответ : положительный,отрицательный
2) Написать формулы веществ состоящих из следующих элементов
- N и H
- Р и О
- Zn и Cl
3) Найти и зачеркнуть вещества, не имеющие переменчивую степень окисления.
Na, Cr, Fe, K, N, Hg, S, Al, C
VI . Итог урока.
Выставление оценок с комментариями
VII . Домашнее задание
§23, стр. 67-72, задание после §23-стр 72 №1-4 выполнить.
67-72, задание после §23-стр 72 №1-4 выполнить.
HCOOH (муравьиная кислота) Структура Льюиса за 6 шагов
Итак, вы уже видели изображение выше, верно?
Позвольте мне вкратце объяснить приведенное выше изображение.
HCOOH (или муравьиная кислота или Ch3O2) Структура Льюиса имеет атом водорода (H), присоединенный к группе COOH. На обоих атомах кислорода (O) имеется 2 неподеленные пары.
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса HCOOH, то просто оставайтесь со мной, и вы получите подробное пошаговое объяснение по рисованию структуры Льюиса HCOOH (муравьиная кислота).
Итак, давайте перейдем к этапам рисования структуры Льюиса HCOOH (муравьиной кислоты).
Шаг 1: Найдите общее количество валентных электронов в молекуле HCOOH Чтобы найти общее количество валентных электронов в молекуле HCOOH, прежде всего, вы должны знать количество валентных электронов, присутствующих в атомах водорода, углерода и кислорода. атом.
атом.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны водорода, углерода и кислорода с помощью периодической таблицы.
Общее количество валентных электронов в молекуле HCOOH
→ Валентные электроны, определяемые атомом водорода:
Водород является элементом 1 группы периодической таблицы. Следовательно, валентный электрон, присутствующий в водороде, равен 1 .
Вы можете видеть, что в атоме водорода присутствует только 1 валентный электрон, как показано на изображении выше.
→ Валентные электроны, определяемые атомом углерода:
Углерод является элементом 14 группы периодической таблицы. Следовательно, валентных электронов, присутствующих в углероде, 9.0007 4 .
Вы можете видеть 4 валентных электрона, присутствующих в атоме углерода, как показано на изображении выше.
→ Валентные электроны от атома кислорода:
Кислород является элементом 16 группы периодической таблицы. Следовательно, валентных электронов, присутствующих в кислороде, 6 .
Вы можете видеть 6 валентных электронов, присутствующих в атоме кислорода, как показано на изображении выше.
Отсюда
Общее количество валентных электронов в молекуле HCOOH = валентные электроны от 2 атомов водорода + валентные электроны от 1 атома углерода + валентные электроны от 2 атомов кислорода = 1(2) + 4 + 6(2) = 18 .
Шаг 2: Выберите центральный атомПри выборе центрального атома вы должны помнить, что менее электроотрицательный атом остается в центре.
(Помните: Если в данной молекуле присутствует водород, то всегда кладите водород снаружи.)
Здесь данная молекула представляет собой HCOOH и содержит атомы водорода (H), атомы углерода (C) и атомы кислорода ( О).
Итак, согласно правилу, мы должны держать водород снаружи.
Теперь вы можете увидеть значения электроотрицательности атома углерода (C) и атома кислорода (O) в приведенной выше периодической таблице.
Если сравнить значения электроотрицательности углерода (С) и кислорода (О), то атом углерода менее электроотрицательный.
Итак, здесь атом углерода (C) является центральным атомом, а атомы кислорода (O) являются внешними атомами.
По-другому, также видно, что атом водорода присоединен с СООН функциональной группой .
Шаг 3: Соедините каждый атом, поместив между ними пару электроновТеперь в молекуле HCOOH вы должны поместить пары электронов между атомом углерода (C), атомом кислорода (O) и атомом водорода (H). атомы.
Это указывает на то, что эти атомы химически связаны друг с другом в молекуле HCOOH.
Шаг 4: Сделайте внешние атомы стабильными Теперь на этом этапе вы должны проверить стабильность внешних атомов.
Здесь на эскизе молекулы HCOOH вы можете видеть, что внешними атомами являются атомы водорода и атом кислорода.
Эти атомы водорода и атом кислорода образуют дуплет и октет соответственно и, следовательно, они стабильны.
Кроме того, на шаге 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле HCOOH.
Молекула HCOOH имеет в общей сложности 18 валентных электронов , и все эти валентные электроны используются в приведенном выше наброске HCOOH.
Следовательно, на центральном атоме не осталось электронных пар.
Итак, теперь давайте перейдем к следующему шагу.
Шаг 5: Проверьте октет центрального атома. Если у него нет октета, то сдвиньте неподеленную пару, чтобы образовать двойную связь или тройную связь.На этом этапе вы должны проверить, стабилен ли центральный атом углерода (C).
Чтобы проверить стабильность центрального атома углерода (С), мы должны проверить, образует ли он октет или нет.
К сожалению, здесь атом углерода не образует октет. У него всего 6 электронов, и он нестабилен.
Теперь, чтобы сделать этот атом углерода стабильным, вы должны сдвинуть электронную пару от внешнего атома кислорода, чтобы атом углерода мог иметь 8 электронов (т.е. октет).
После смещения этой электронной пары атом углерода получит еще 2 электрона, и, таким образом, его общее количество электронов станет равным 8.
Из рисунка выше видно, что атом углерода образует октет, поскольку у него 8 электронов.
Теперь давайте перейдем к последнему шагу, чтобы проверить, стабильна ли структура Льюиса HCOOH.
Шаг 6: Проверка стабильности структуры ЛьюисаТеперь вы подошли к последнему шагу, на котором вам нужно проверить стабильность структуры Льюиса HCOOH.
Стабильность структуры Льюиса можно проверить с помощью концепции формального заряда.
Короче говоря, теперь вам нужно найти формальный заряд атомов углерода (C), атомов водорода (H), а также атомов кислорода (O), присутствующих в молекуле HCOOH.
Для расчета формального сбора необходимо использовать следующую формулу;
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы HCOOH на изображении ниже.
Для атома водорода (H):
Валентный электрон = 1 (поскольку водород находится в группе 1)
Связывающие электроны = 2
Несвязывающие электроны = 0
Для атома углерода (C):
Валентные электроны = 4 (поскольку углерод находится в группе 14)
Связывающие электроны = 8
Несвязывающие электроны = 0
Валентные электроны = 6 (потому что кислород находится в группе 16)
Связывающие электроны = 4
.0012
From the above calculations of formal charge, you can see that атом углерода (C), атомы водорода (H), а также атомы кислорода (O) имеют «нулевой» формальный заряд.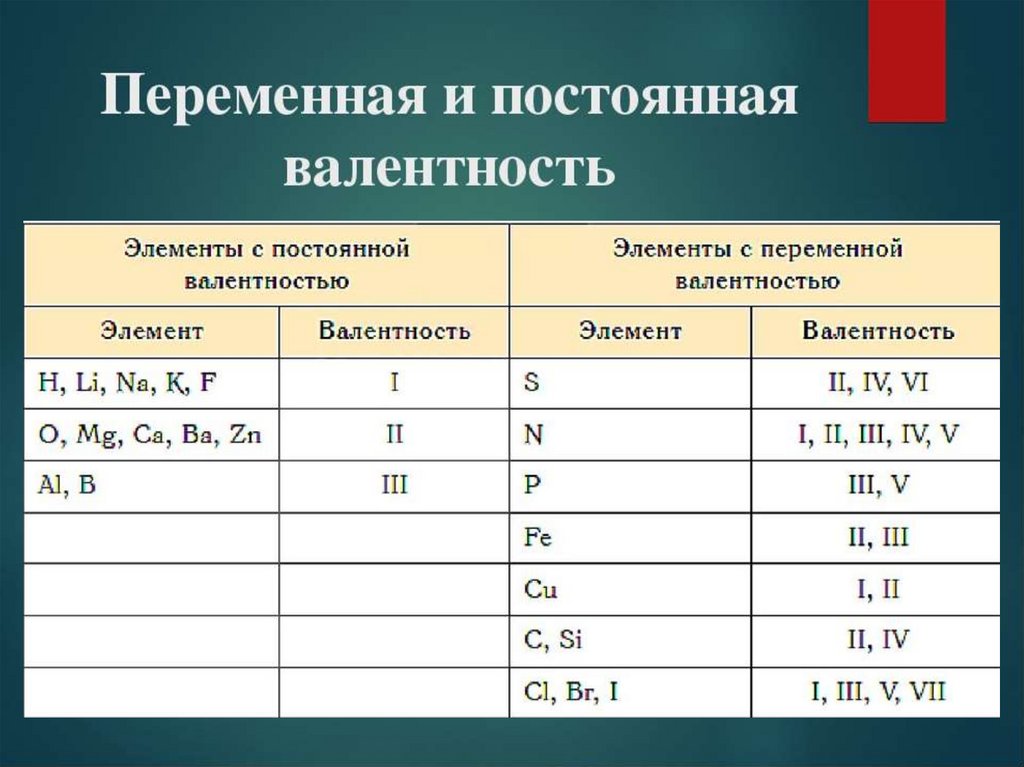
Это указывает на то, что приведенная выше структура Льюиса HCOOH стабильна и в приведенной выше структуре HCOOH нет дальнейших изменений.
В приведенной выше структуре точек Льюиса HCOOH вы также можете представить каждую пару связывающих электронов (:) как одинарную связь (|). Сделав это, вы получите следующую структуру Льюиса HCOOH.
Надеюсь, вы полностью поняли все вышеперечисленные шаги.
Для большей практики и лучшего понимания вы можете попробовать другие структуры Льюиса, перечисленные ниже.
Попробуйте (или хотя бы посмотрите) эти структуры Льюиса для лучшего понимания:
SBr2 Структура Льюиса в 6 шагов (с изображениями)
По Администратор / 13 июня 2022 г.
Итак, вы уже видели изображение выше, верно?
Позвольте мне вкратце объяснить приведенное выше изображение.
Структура Льюиса SBr2 имеет атом серы (S) в центре, который окружен двумя атомами брома (Br). Между атомом серы (S) и каждым атомом брома (Br) имеется 2 одинарные связи. Есть 2 неподеленные пары на атоме серы (S) и 3 неподеленные пары на обоих атомах брома (Br).
Между атомом серы (S) и каждым атомом брома (Br) имеется 2 одинарные связи. Есть 2 неподеленные пары на атоме серы (S) и 3 неподеленные пары на обоих атомах брома (Br).
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса SBr2 (дибромида серы), просто оставайтесь со мной, и вы получите подробное пошаговое объяснение по рисованию структуры Льюиса SBr2.
Итак, давайте перейдем к этапам рисования структуры Льюиса SBr2.
Шаг 1: Найдите общее количество валентных электронов в молекуле SBr2 Чтобы найти общее количество валентных электронов в молекуле SBr2 (дибромида серы), прежде всего, вы должны знать количество валентных электронов, присутствующих в атоме серы, а также в атоме брома. атом.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны серы и брома с помощью периодической таблицы.
Общее количество валентных электронов в молекуле SBr2
→ Валентные электроны, определяемые атомом серы:
Сера является элементом 16-й группы периодической таблицы. Следовательно, количество валентных электронов, присутствующих в сере, равно 6 .
Вы можете видеть 6 валентных электронов, присутствующих в атоме серы, как показано на изображении выше.
→ Валентные электроны от атома брома:
Бром является элементом 17-й группы периодической таблицы. Следовательно, количество валентных электронов, присутствующих в броме, составляет 7 .
Вы можете видеть 7 валентных электронов, присутствующих в атоме брома, как показано на изображении выше.
Следовательно,
Всего валентных электронов в молекуле SBr2 = валентных электронов, приходящихся на 1 атом серы + валентных электронов, приходящихся на 2 атома брома = 6 + 7(2) = 20 .
При выборе центрального атома вы должны помнить, что менее электроотрицательный атом остается в центре.
Здесь данная молекула представляет собой SBr2 (дибромид серы) и содержит атомы серы (S) и атомы брома (Br).
Вы можете увидеть значения электроотрицательности атома серы (S) и атома брома (Br) в приведенной выше периодической таблице.
Если сравнить значения электроотрицательности серы (S) и брома (Br), то атом серы менее электроотрицательный.
Итак, здесь атом серы (S) является центральным атомом, а атомы брома (Br) являются внешними атомами.
Шаг 3: Соедините каждый атом, поместив между ними электронную паруТеперь в молекуле SBr2 вы должны поместить электронные пары между атомами серы (S) и атомами брома (Br).
Это указывает на то, что сера (S) и бром (Br) химически связаны друг с другом в молекуле SBr2.
Шаг 4: Сделайте внешние атомы стабильными. Поместите оставшуюся пару валентных электронов на центральный атом.
Поместите оставшуюся пару валентных электронов на центральный атом. На этом этапе вам нужно проверить стабильность внешних атомов.
Здесь на эскизе молекулы SBr2 видно, что внешние атомы — это атомы брома.
Эти внешние атомы брома образуют октет и, следовательно, они стабильны.
Кроме того, на шаге 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле SBr2.
Молекула SBr2 имеет всего 20 валентных электронов и из них только 16 валентных электронов используются в приведенном выше скетче.
Таким образом, число оставшихся электронов = 20 – 16 = 4 .
Вы должны поместить эти 4 электронов на центральный атом серы в приведенном выше наброске молекулы SBr2.
Теперь давайте перейдем к следующему шагу.
Шаг 5: Проверьте октет центрального атома На этом шаге вы должны проверить, стабилен ли центральный атом серы (S).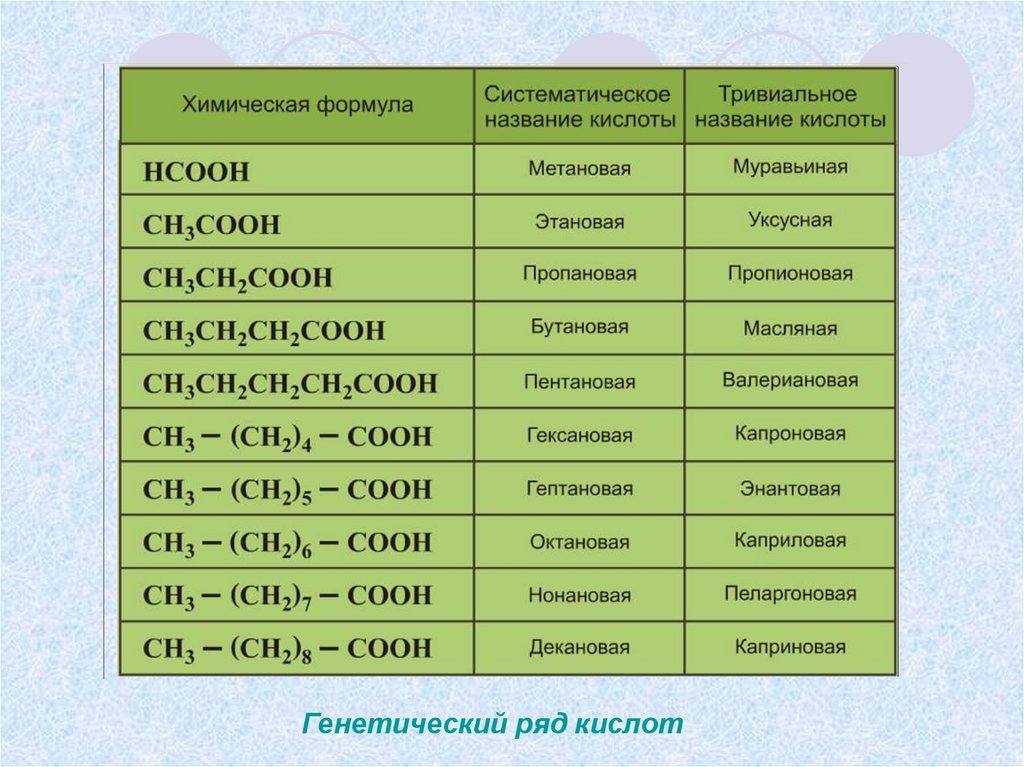
Чтобы проверить стабильность центрального атома брома (Br), мы должны проверить, образует ли он октет или нет.
На изображении выше видно, что атом серы образует октет. Это означает, что у него 8 электронов.
Следовательно, центральный атом серы стабилен.
Теперь давайте перейдем к последнему шагу, чтобы проверить, является ли структура Льюиса SBr2 стабильной или нет.
Шаг 6: Проверка стабильности структуры ЛьюисаТеперь вы подошли к последнему шагу, на котором вам нужно проверить стабильность структуры Льюиса SBr2.
Стабильность структуры Льюиса можно проверить с помощью концепции формального заряда.
Короче говоря, теперь вам нужно найти формальный заряд атомов серы (S), а также атомов брома (Br), присутствующих в молекуле SBr2.
Для расчета формального сбора необходимо использовать следующую формулу;
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы SBr2 на изображении, приведенном ниже.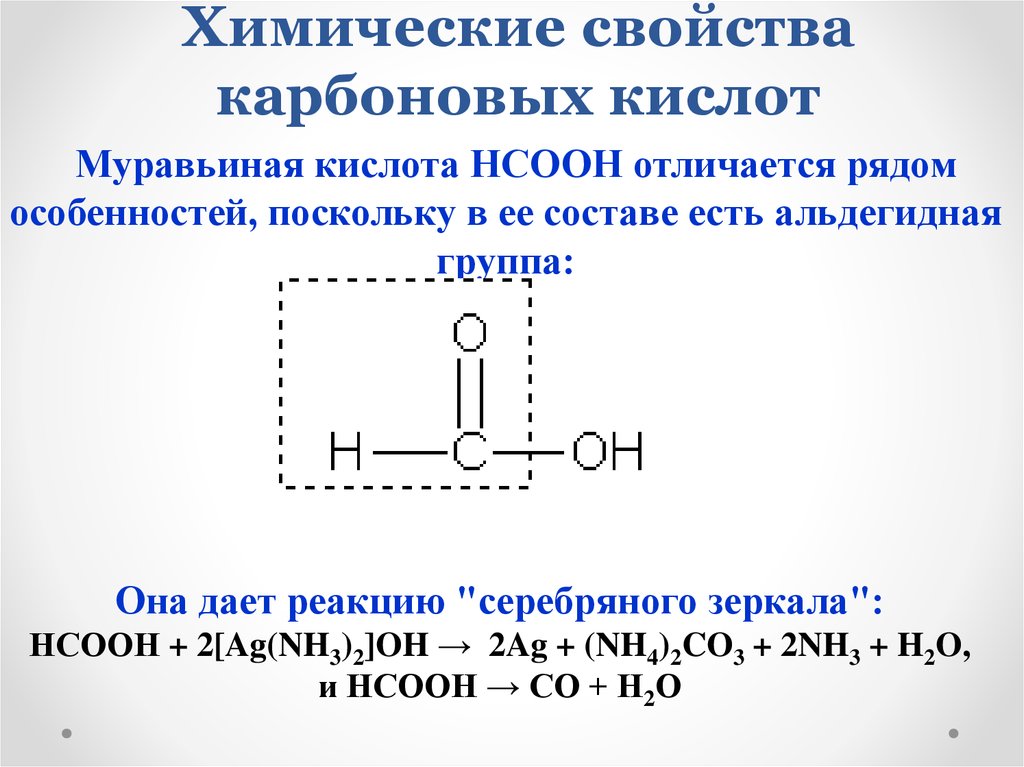
Для атома серы (S):
Валентные электроны = 6 (поскольку сера находится в группе 16)
Связывающие электроны = 4
Несвязывающие электроны = 4
Для атома брома (Br):
17)
Связывающие электроны = 2
Необеспеченные электроны = 6
| Формальный заряд | = | Electrons | .0007 (Bonding electrons)/2 | – | Nonbonding electrons | |||||
| S | = | 6 | – | 4/2 | – | 4 | = | 0 | ||
| Br | = | 7 | – | 2/2 | – | 6 | = | 0 |
From the above calculations of formal charge, вы можете видеть, что атом серы (S), а также атом брома (Br) имеет «ноль» формальное обвинение.

 Как определить степень окисления
Как определить степень окисления
 Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.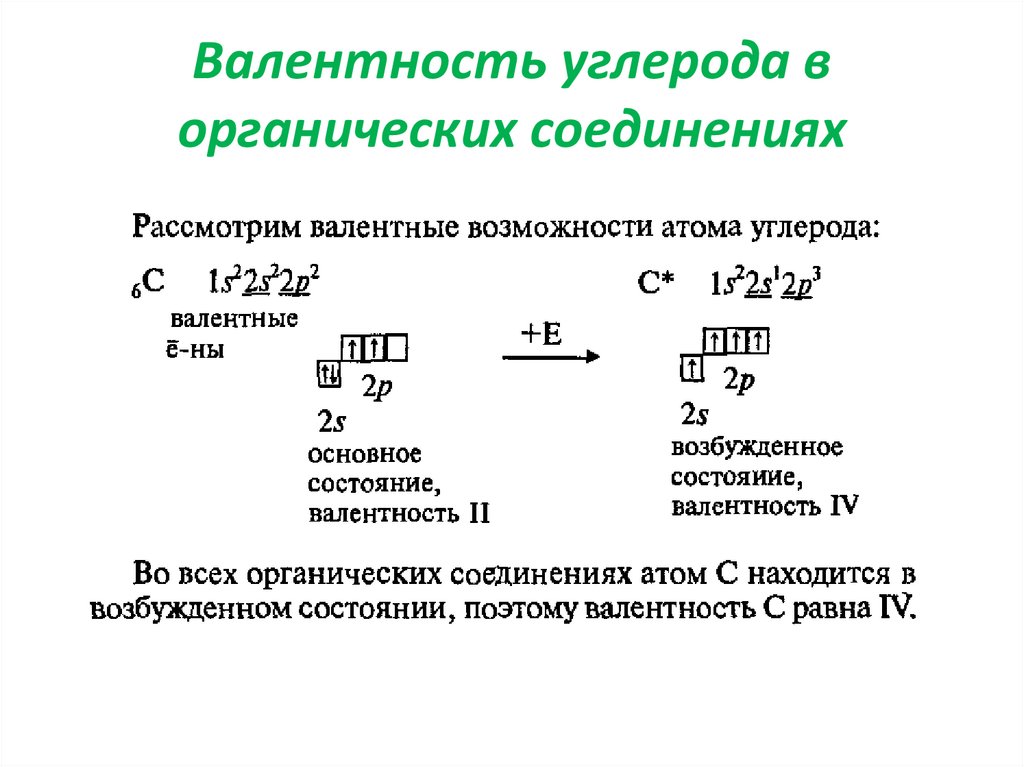 Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ. И. Менделеева, классы неорганических веществ, ионный обмен. Труднее всего дается восьмиклассникам определение степени окисления оксидов.
И. Менделеева, классы неорганических веществ, ионный обмен. Труднее всего дается восьмиклассникам определение степени окисления оксидов. Неметаллы в соединениях с кислородом чаще всего проявляют высшую валентность, которая соответствует номеру самой группы. Важно напомнить, что степень окисления химических элементов это показатель, предполагающий положительное (отрицательное) число.
Неметаллы в соединениях с кислородом чаще всего проявляют высшую валентность, которая соответствует номеру самой группы. Важно напомнить, что степень окисления химических элементов это показатель, предполагающий положительное (отрицательное) число. Данный показатель необходимо поделить по отдельности на числовое значение степени окисления, получая индексы для первого и второго компонентов двухэлементного вещества. Высшая степень окисления равна численно значению высшей валентности типичного неметалла, идентична номеру группы, где стоит неметалл в ПС.
Данный показатель необходимо поделить по отдельности на числовое значение степени окисления, получая индексы для первого и второго компонентов двухэлементного вещества. Высшая степень окисления равна численно значению высшей валентности типичного неметалла, идентична номеру группы, где стоит неметалл в ПС.
 Методика определения степеней окисления у каждого из составных частей в сложной соли такая же, как и в кислородсодержащих кислотах. Учитывая, что степень окисления элементов — это цифровой показатель, важно правильно обозначить степень окисления металла.
Методика определения степеней окисления у каждого из составных частей в сложной соли такая же, как и в кислородсодержащих кислотах. Учитывая, что степень окисления элементов — это цифровой показатель, важно правильно обозначить степень окисления металла. Решая данное уравнение, получаем, что X должен быть +5, это и есть
Решая данное уравнение, получаем, что X должен быть +5, это и есть

 В сложном ионе эта сумма равна заряду иона. Например, степень окисления атома хлора в молекуле HClO 4 , вычисленная исходя из суммарного заряда молекулы = 0, х – степень окисления атома хлора), равна +7. Степень окисления атома серы в ионе SO равна +6.
В сложном ионе эта сумма равна заряду иона. Например, степень окисления атома хлора в молекуле HClO 4 , вычисленная исходя из суммарного заряда молекулы = 0, х – степень окисления атома хлора), равна +7. Степень окисления атома серы в ионе SO равна +6.

 Степень окисления F во всех соединениях равна « -1». Na +1 F -1 , H +1 F -1
Степень окисления F во всех соединениях равна « -1». Na +1 F -1 , H +1 F -1 