Азотистая кислота — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Азотистая кислота
Азотистая кислота HNO2имеет слабый характер.
Весьма неустойчива, может быть
только в разбавленных растворах:
2HNO2
NO + NO2 + h3O.
2. Атом азота в азотистой кислоте имеет промежуточную степень окисления +3
в связи с этим он может быть иокислителем, и проявлять
восстановительные свойства:
HNO2 + HI = I2 + NO + h3O,
HNO2 + h3O2 = HNO3 + h3O,
KNO2 + KMnO4 + h3SO4 = KNO3 +
K2SO4 + MnSO4 + h3O.

Нагреваясь, раствор азотистой
кислоты распадается с
выделением NO и
образованием азотной кислоты
Запишите уравнение
4. Соли азотистой кислоты называются нитритами
Нитриты гораздо более устойчивы, чем HNO2,все они токсичны. Представляют собой
кристаллические вещества, хорошо
растворимые в воде (труднее других — AgNО2)
Свойства .
1) Как и HNО2, нитриты обладают окислительновосстановительной двойственностью:
KNО2 + Н2О2 = KNО3 + Н2O
3KNО2 + 2КМпO4 + Н2O = 3KNО3 + 2MnО2↓ + 2КОН
2KNО2 + 2KI + 2h3SO4 = 2NO + I2 + 2K2SO4 + 2Н2O
2) Нитрит аммония разлагается при нагревании:
Nh5NО2 = N2↑ + 2Н2O
Состав. Строение. Свойства.
H — O —N
O
O
степень окисления азота
валентность азота IV
+5
химическая связь
ковалентная полярная
Азотная кислота – бесцветная гигроскопичная жидкость,
c резким запахом, «дымит» на воздухе, неограниченно
растворимая в воде. tкип. = 83ºC.. При хранении на свету
разлагается на оксид азота (IV), кислород и воду,
приобретая желтоватый цвет: 4HNO3 = 4NO2 + O2 + 2h3O
Азотная кислота ядовита.

При разложении азотной кислоты
кислород, поэтому скипидар вспыхивает.
выделяется
Азотная кислота (HNO3)
Классификация
Азотная кислота по:
наличию кислорода:
основности:
растворимости в воде:
кислородсодержащая
одноосновная
растворимая
летучести:
летучая
степени электролитической
диссоциации:
сильная
Получение азотной кислоты в промышленности
Nh4
NO
NO2
1. Контактное окисление аммиака до
оксида азота (II):
4Nh4+ 5O2 = 4NO + 6h3O
2. Окисление оксида азота (II) в оксид
азота (IV):
2NO+O2 = 2NO2
3. Адсорбция (поглощение) оксида
азота (IV) водой при избытке кислорода
4NO2 + 2h3O + O2 = 4HNO3
HNO3
В лаборатории азотную кислоту получают действием
концентрированной серной кислоты на нитраты при
слабом нагревании.
Составьте уравнение реакции получения азотной кислоты.
NaNO3 + h3SO4 = NaHSO4 + HNO3
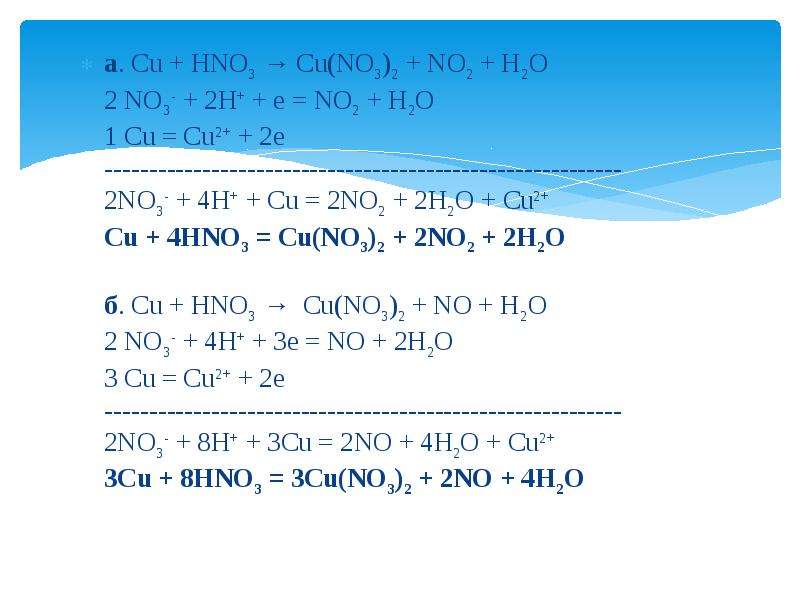
Химические свойства азотной кислоты
1. Типичные свойства кислот
2.
 Взаимодействие азотной кислоты с металлами
Взаимодействие азотной кислоты с металлами3. Взаимодействие азотной кислоты с неметаллами
Химические свойства азотной кислоты
Азотная кислота проявляет все типичные свойства
кислот.
Перечислите их:
Составьте уравнения реакций азотной кислоты:
1 с оксидом меди (II), оксидом алюминия;
3
c карбонатом аммония, силикатом натрия.
Дайте названия полученным веществам. Определите тип
реакции.
1
2HNO3 + CuO = Cu(NO3)2 + h3O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3h3O
2
HNO3 + NaOH = NaNO3 + h3O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2h3O
3
2HNO3 + (Nh5)2CO3 = 2Nh5NO3 + ↑CO2 + h3O
2HNO3 + Na2SiO3 = ↓h3SiO3 + 2NaNO3
Взаимодействие азотной кислоты с металлами
Как реагируют металлы с растворами кислот?
Металлы,
стоящие
в ряду активности
до кислоты
водорода,
вытесняют
Особенности
взаимодействия
азотной
с металлами:
его
изодин
кислот.
Металлы,
стоящие
после водорода
кислот его
1.
 Ни
Ниметалл
никогда
не выделяет
из азотнойизкислоты
не
вытесняют,
т.е. не взаимодействуют
с кислотами,
не
водород.
Выделяются
разнообразные соединения
азота:
растворяются
них. N2+1O, N20,
N+4O2, N+2вO,
N–3h4 (Nh5NO3)
N–3h5+
N20
N2+1O
N+2O
N+4O2
концентрация кислоты
активность металлов
2. С азотной кислотой реагируют металлы, стоящие до и
после водорода в ряду активности.
3. Азотная кислота не взаимодействует с Au, Pt
4. Концентрированная азотная кислота пассивирует металлы:
Al, Fe, Be, Cr, Ni, Pb и другие (за счет образования плотной
оксидной пленки). При нагревании и при разбавлении азотной
кислоты данные металлы в ней растворяются.
Найти закономерность при взаимодействии
азотной кислоты с металлами:
Единственная общая закономерность при
взаимодействии азотной кислоты с металлами: чем
более разбавленная кислота и чем активнее металл,
тем глубже восстанавливается азот:
Увеличение
конц.

Увеличение
активности
металла
Допишите схемы реакций:
1)
HNO3(конц.) + Cu → Cu(NO3)2 + … + h3O
2)
HNO3(разб.) + Cu → Cu(NO3)2 + … + h3O
Рассмотрите превращения в свете ОВР
1) 4HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + 2 N+4O2 + 2 h3O
окислитель
восстановитель
N+5 + 1e → N+4 1 2
Cu0 – 2e → Cu+2 2 1
восстановление
окисление
2) 8 HN+5O3(конц.) + 3 Cu0 = 3Cu+2(NO3)2 + 2 N+2O + 4 h3O
окислитель
восстановитель
N+5 + 3e → N+2 3 2
Cu0 – 2e → Cu+2 2 3
восстановление
окисление
Взаимодействие азотной кислоты с неметаллами
Азотная кислота как сильный окислитель
Окисляет неметаллы до соответствующих кислот.
Концентрированная (более 60%) азотная кислота восстанавливается до
NO2 , а если концентрация кислоты (15 – 20%), то до NO.
Расставьте в схемах коэффициенты методом электронного баланса.
4 HNO3 + С → СO2 + 2 h3O + 4 NO2
N+5 + 1e → N+4 1 4
С0 – 4e → С+4 4 1
HNO3 (за счет N+5) – окислитель, пр.
 восстановления
восстановленияC – восстановитель, процесс окисления
5 HNO3 + P → h4PO4 + 5 NO2 + h3O
N+5 + 1e → N+4 1 5 HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
P0 – 5e → P+5 5 1
5 HNO3 + 3 P + 2 h3O → 3 h4PO4 + 5 NO
N+5 + 3e → N+2 3 5 HNO3 (за счет N+5) – окислитель, пр. восстановления
P0 – 5e → P+5 5 3 P – восстановитель, процесс окисления
Применение азотной кислоты
1
Производство азотных и комплексных
удобрений.
2
Производство взрывчатых веществ
3
Производство красителей
4
Производство лекарств
5
Производство пленок,
нитролаков, нитроэмалей
6
Производство
искусственных волокон
7
Как компонент нитрующей
смеси, для траления
металлов в металлургии
Как называются соли азотной кислоты?
нитраты
Нитраты K, Na, Nh5+ называют селитрами
Составьте формулы перечисленных солей.
KNO3
NaNO3
Nh5NO3
Нитраты – белые кристаллические
вещества.
 Сильные электролиты, в
Сильные электролиты, врастворах полностью диссоциируют
на ионы. Вступают в реакции обмена.
Каким способом можно определить нитрат-ион в растворе?
К соли (содержащей нитрат-ион) добавляют серную
кислоту и медь. Смесь слегка подогревают. Выделение
бурого газа (NO2) указывает на наличие нитрат-иона.
Нитрат калия (калиевая селитра)
Бесцветные кристаллы Значительно
менее гигроскопична по сравнению с
натриевой, поэтому широко применяется в пиротехнике как окислитель.
При нагревании выше 334,5ºС
плавится, выше этой температуры
разлагается с выделением кислорода.
Нитрат натрия
Применяется как удобрение; в
стекольной,
металлообрабатывающей промышленности; для получения
взрывчатых
веществ,
ракетного
топлива и пиротехнических смесей.
Нитрат аммония
Кристаллическое
вещество
белого
цвета. Температура плавления 169,6 °C,
при нагреве выше этой температуры
начинается постепенное
разложение
вещества, а при температуре 210°С
происходит полное разложение.

При нагревании нитраты разлагаются тем полнее, чем
правее в электрохимическом ряду напряжений стоит металл,
образующий соль.
Li K Ba Ca Na
Mg Al Mn Zn Cr Fe Co Sn Pb Cu
нитрит + О2
оксид металла + NO2 + O2
Ag Hg Au
Ме + NO2 + O2
Составьте уравнения реакций разложения нитрата
натрия, нитрата свинца, нитрата серебра.
2NaNO3 = 2NaNO2 + O2
2Pb(NO3)2= 2PbO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
А
А) +5;
Б) +4;
В) -3.
2. При взаимодействии с какими веществами азотная кислота проявляет
особые свойства, отличающие её от других кислот:
Б
А) основными оксидами; Б) металлами;
В) основаниями.
3. В окислительно-восстановительной реакции азотная кислота может
А
участвовать в качестве:
А) окислителя; Б) восстановителя; В) окислителя и восстановителя.
4. Какое из данных соединений азота называют чилийской селитрой:
А) нитрат калия;
Б) нитрат кальция;
В) нитрат натрия;
5.
 Запишите уравнение взаимодействия меди с концентрированной
Запишите уравнение взаимодействия меди с концентрированнойазотной кислотой . Коэффициент перед формулой кислоты равен:
А) 2;
Б) 4;
В) 1.
6. Какое из перечисленных веществ не реагирует с разбавленной
азотной кислотой:
А) медь;
Б) гидроксид натрия;
В) бромид натрия.
7. Азотную кислоту получают в три стадии, окисляя атом азота по
следующей схеме:
А) N–3 →N+2 →N+4 → N+5
Б) N–3 →N0 →N+4 → N+5
В) N0 →N+2 →N+4 → N+5
В
Б
В
А
English Русский Правила
45. Азотистая кислота и ее соли.
Ответ. Азотистая кислота HNO2 — слабая одноосновная кислота,
существует только в разбавленных водных
растворах, окрашенных в слабый голубой
цвет, и в газовой фазе. Кислота весьма
токсична (в больших концентрациях). Соли
азотистой кислоты называются нитритами
или азотистокислыми. Нитриты гораздо
более устойчивы, чем HNO2, многие из них
— токсичны, канцерогенны. В газовой фазе
планарная молекула азотистой кислоты
существует в виде двух конфигураций:
цис- и транс-. При комнатной температуре
преобладает транс-изомер: эта структура
является более устойчивой. Так, для
цис-HNO2(г) ΔG°f = −42,59 кДж/моль, а для
транс-HNO2(г) ΔG°f = −44,65 кДж/моль. В водных
растворах существует равновесие: 2HNO2
↔ N2O3
+ h3O
↔ NO
+ NO2
+ h3O.
При нагревании раствора азотистая
кислота распадается с выделением NO и
образованием азотной кислоты: 3HNO2
↔ HNO3
+ 2 NO
+ h3O.
HNO2 является слабой кислотой. В водных
растворах диссоциирует (KD = 4,6⋅10−4),
немного сильнее уксусной кислоты. Легко
вытесняется более сильными кислотами
из солей: h3SO4 + 2 NaNO2 → Na2SO4 + 2HNO2. Азотистая
кислота проявляет как окислительные,
так и восстановительные свойства. При
действии более сильных окислителей
(пероксид водорода, хлор, перманганат
калия) окисляется в азотную кислоту:
HNO2 + h3O2 = HNO3 + h3O. HNO2
+ Cl2 + h3O = HNO3 + 2 HCl. 7HNO2 + 2 KMnO4 = 2 Mn(NO3)2 + 2 KNO3 +
3h3O + HNO3. В
то же время она способна окислять
вещества, обладающие восстановительными
свойствами: 2HNO2
+ 2 HI
= 2 NO
+ I2
+ 2 h3O.
При комнатной температуре
преобладает транс-изомер: эта структура
является более устойчивой. Так, для
цис-HNO2(г) ΔG°f = −42,59 кДж/моль, а для
транс-HNO2(г) ΔG°f = −44,65 кДж/моль. В водных
растворах существует равновесие: 2HNO2
↔ N2O3
+ h3O
↔ NO
+ NO2
+ h3O.
При нагревании раствора азотистая
кислота распадается с выделением NO и
образованием азотной кислоты: 3HNO2
↔ HNO3
+ 2 NO
+ h3O.
HNO2 является слабой кислотой. В водных
растворах диссоциирует (KD = 4,6⋅10−4),
немного сильнее уксусной кислоты. Легко
вытесняется более сильными кислотами
из солей: h3SO4 + 2 NaNO2 → Na2SO4 + 2HNO2. Азотистая
кислота проявляет как окислительные,
так и восстановительные свойства. При
действии более сильных окислителей
(пероксид водорода, хлор, перманганат
калия) окисляется в азотную кислоту:
HNO2 + h3O2 = HNO3 + h3O. HNO2
+ Cl2 + h3O = HNO3 + 2 HCl. 7HNO2 + 2 KMnO4 = 2 Mn(NO3)2 + 2 KNO3 +
3h3O + HNO3. В
то же время она способна окислять
вещества, обладающие восстановительными
свойствами: 2HNO2
+ 2 HI
= 2 NO
+ I2
+ 2 h3O.
 Нитриты
являются термически малоустойчивыми
соединениями. Так, без разложения могут
плавиться только нитриты щелочных
металлов, остальные же начинают
разлагаться при 250—300 °C с выделением
металла либо его оксида, азота, оксидов
азота и кислорода. Нитриты реагируют с
солями меди, образуя комплексный
гексонитритокупрат-анион, придающий
раствору характерный зелёный цвет, что
можно использовать в лаборатории как
качественную реакцию. CuSO4 + 6NaNO2 = Na2SO4 +
Na4[Cu(NO2)6]. Нитриты медленно разлагаются
под действием кислот с выделением газа
(продуктов разложения азотистой кислоты).
2NaNO2 + h3SO4 = Na2SO4 + NO + NO2 +h3O. В горячей воде
те же вещества реагируют с образованием
оксида азота (II) и азотной кислоты: 6NaNO2
+ 3h3SO4 = 3Na2SO4 + 2HNO3 + 4NO + 4h3О. Нитриты могут
выступать как окислителями, так и
восстановителями — в кислой среде они
окисляются до нитратов, в щелочной
способны восстанавливаться до оксида
азота NO. В промышленности нитриты
получают поглощением нитрозного газа
(NO + NO2) растворами гидроксида или карбоната
натрия с образованием раствора нитрита
натрия, из которого кристаллизацией
получают сухой продукт.
Нитриты
являются термически малоустойчивыми
соединениями. Так, без разложения могут
плавиться только нитриты щелочных
металлов, остальные же начинают
разлагаться при 250—300 °C с выделением
металла либо его оксида, азота, оксидов
азота и кислорода. Нитриты реагируют с
солями меди, образуя комплексный
гексонитритокупрат-анион, придающий
раствору характерный зелёный цвет, что
можно использовать в лаборатории как
качественную реакцию. CuSO4 + 6NaNO2 = Na2SO4 +
Na4[Cu(NO2)6]. Нитриты медленно разлагаются
под действием кислот с выделением газа
(продуктов разложения азотистой кислоты).
2NaNO2 + h3SO4 = Na2SO4 + NO + NO2 +h3O. В горячей воде
те же вещества реагируют с образованием
оксида азота (II) и азотной кислоты: 6NaNO2
+ 3h3SO4 = 3Na2SO4 + 2HNO3 + 4NO + 4h3О. Нитриты могут
выступать как окислителями, так и
восстановителями — в кислой среде они
окисляются до нитратов, в щелочной
способны восстанавливаться до оксида
азота NO. В промышленности нитриты
получают поглощением нитрозного газа
(NO + NO2) растворами гидроксида или карбоната
натрия с образованием раствора нитрита
натрия, из которого кристаллизацией
получают сухой продукт. Нитриты других
металлов получают обменной реакцией с
нитритом натрия либо восстановлением
соответствующих нитратов. Нитриты
используются при получении азокрасителей,
для получения капролактама, как окисляющие
и восстанавливающие реагенты в
резинотехнической, текстильной и
металлообрабатывающей промышленности.
Нитрит натрия используется как консервант.
Нитриты других
металлов получают обменной реакцией с
нитритом натрия либо восстановлением
соответствующих нитратов. Нитриты
используются при получении азокрасителей,
для получения капролактама, как окисляющие
и восстанавливающие реагенты в
резинотехнической, текстильной и
металлообрабатывающей промышленности.
Нитрит натрия используется как консервант.Нитрит
натрия также применяется при производстве
бетонных смесей в качестве ускорителя
твердения и противоморозной добавки.
Нитриты попадают в организм человека
двумя путями: прямым содержанием или
же нитратами, которые в пищеварительном
тракте (в основном в полости рта, также
желудке или кишечнике) человека
превращаются в нитриты под действием
фермента нитратредуктазы. Также нитриты
используются в производстве обработанных
мясных продуктов (колбасы, сосиски,
ветчина и пр.) Эпидемиологические
исследования высокого уровня потребления
нитратов из овощей выявили снижение
риска рака желудка, в то время как другие
исследования о потреблении нитратов/нитритов
из обработанных мясных продуктов, в
которых нитриты используются как
консерванты, показывают повышение
рисков. Механические исследования
показывают, что образование опасных
нитросоединений (таких как нитрозамины)
ускоряется в присутствии компонентов
мяса и подавляется витамином С и другими
антиоксидантами и фитонутриентами из
растительных продуктов. Таким образом,
нитриты ведут себя неодинаково в
зависимости от того, из каких источников
они поступают в организм. Нитриты,
добавляемые в мясные продукты для их
консервации, преобразуются в нитрозамины.
Нитриты, преобразовавшиеся из нитратов
из овощей и фруктов, далее превращаются
в оксид азота (II), которые способствует
расширению кровеносных сосудов и
нормализации кровяного давления. При
нормальном физиологическом состоянии
и поступлении нитритов в организм не
более допустимой суточной дозы,
утверждённой Министерством здравоохранения
в 0,2 мг/кг массы тела (за исключением
детей грудного возраста), в организме
человека образуется примерно 2 %
метгемоглобина, поскольку редуктазы
эритроцитов взрослого человека обладают
способностью превращать образовавшийся
метгемоглобин обратно в гемоглобин.
Механические исследования
показывают, что образование опасных
нитросоединений (таких как нитрозамины)
ускоряется в присутствии компонентов
мяса и подавляется витамином С и другими
антиоксидантами и фитонутриентами из
растительных продуктов. Таким образом,
нитриты ведут себя неодинаково в
зависимости от того, из каких источников
они поступают в организм. Нитриты,
добавляемые в мясные продукты для их
консервации, преобразуются в нитрозамины.
Нитриты, преобразовавшиеся из нитратов
из овощей и фруктов, далее превращаются
в оксид азота (II), которые способствует
расширению кровеносных сосудов и
нормализации кровяного давления. При
нормальном физиологическом состоянии
и поступлении нитритов в организм не
более допустимой суточной дозы,
утверждённой Министерством здравоохранения
в 0,2 мг/кг массы тела (за исключением
детей грудного возраста), в организме
человека образуется примерно 2 %
метгемоглобина, поскольку редуктазы
эритроцитов взрослого человека обладают
способностью превращать образовавшийся
метгемоглобин обратно в гемоглобин. В
Европейском Союзе допустимая суточная
доза нитритов принята в 0.1 мг/кг массы
(в пересчете на нитрит натрия). Продажа
нитритов для пищевых применений разрешена
в Евросоюзе только в смеси с пищевой
солью, с содержанием нитритов около 0,6
%, для уменьшения риска превышения
суточных норм.
В
Европейском Союзе допустимая суточная
доза нитритов принята в 0.1 мг/кг массы
(в пересчете на нитрит натрия). Продажа
нитритов для пищевых применений разрешена
в Евросоюзе только в смеси с пищевой
солью, с содержанием нитритов около 0,6
%, для уменьшения риска превышения
суточных норм.
Сбалансируйте следующее уравнение: $HI + HN{O_3} \to {I_2} + NO + {H_2}O$A. $6HI + 2HN{O_3} \to 3{I_2} + 2NO + 4{H_2}O$B. $6HI + 4HN{O_3} \to 3{I_2} + 2NO + {H_2}O$C. $3HI + 2HN{O_3} \to 2{I_2} + 2NO + 4{H_2}O$D. Ни один из этих
Подсказка: Мы можем сбалансировать это уравнение, используя метод степени окисления. Сначала мы записываем степени окисления каждого элемента, а затем уравновешиваем все элементы, кроме водорода и кислорода. Тогда мы можем уравнять степени восстановления и окисления. Наконец, мы можем добавить молекулы воды, чтобы сбалансировать кислород.
Полный пошаговый ответ:
Первым шагом в уравновешивании окислительно-восстановительных реакций является запись степени окисления каждого элемента над реакцией. Водород всегда имеет степень окисления $+1$, а кислород $-2$. Для нейтральных молекул (без заряда) сумма степеней окисления равна нулю. Поскольку все молекулы здесь нейтральны, сумма степеней окисления в этом случае всегда равна нулю.
Водород всегда имеет степень окисления $+1$, а кислород $-2$. Для нейтральных молекул (без заряда) сумма степеней окисления равна нулю. Поскольку все молекулы здесь нейтральны, сумма степеней окисления в этом случае всегда равна нулю.
В $HI$ водород имеет степень окисления $ + 1$. Следовательно, степень окисления йода получается вычитанием степени окисления водорода из нуля, то есть $0 — 1 = — 1$
В $HN{O_3}$ степень окисления водорода $ + 1$, кислорода $ — 2$. Поскольку атомов кислорода три, их суммарный вклад равен $(- 2 \times 3) = — 6$. Следовательно, степень окисления азота получается путем вычитания степеней окисления водорода и кислорода из нуля. Следовательно, он равен $0 — 1 — (- 6) = + 5$.
Так как ${I_2}$ является молекулой элемента в нормальном состоянии, то в этой молекуле степень окисления йода равна нулю.
В ${H_2}O$ степень окисления водорода $ + 1$, кислорода $ — 2$. 9{ — 2} $
Наш следующий шаг — сбалансировать элементы, кроме водорода и кислорода.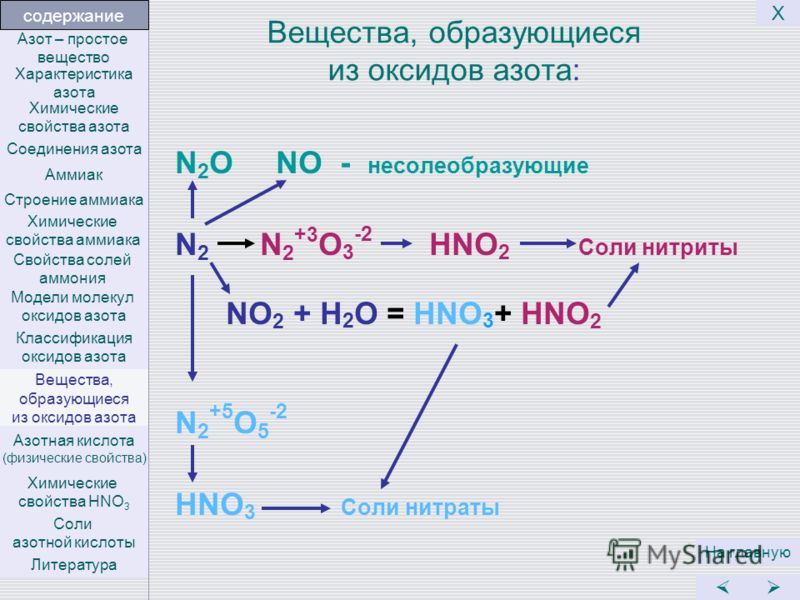 Это йод и азот. У обеих сторон есть по одному азоту, так что мы можем оставить это без внимания. В левой части находится только один йод, а в правой — два. Поэтому мы ставим $2$ рядом с $HI$:
Это йод и азот. У обеих сторон есть по одному азоту, так что мы можем оставить это без внимания. В левой части находится только один йод, а в правой — два. Поэтому мы ставим $2$ рядом с $HI$:
$2HI + HN{O_3} \to {I_2} + NO + {H_2}O$
Возвращаясь к нашим степеням окисления, мы видим, что степень окисления азота уменьшается. снижен с $+5$ до $+2$. Следовательно, он восстанавливается, и каждый атом азота претерпевает изменение $ + 5 — 2 = + 3$.
Йод окисляется (от $ — 1$ до $0$). Таким образом, изменение степени окисления составляет $ + 1$ на атом.
Мы должны уравнять изменения в процессах окисления и восстановления, чтобы сбалансировать уравнение. В процессе восстановления изменение составляет $ + 3$, а в процессе окисления — $2 \times ( + 1) = + 2$, так как участвуют две молекулы $HI$, как это получено из нашего предыдущего сбалансированного уравнения. Чтобы уравнять оба процесса, мы должны найти НОК обоих чисел, а затем соответственно умножить каждую молекулу. НОК $3$ и $2$ равен $6$. Отсюда умножаем молекулы процесса окисления ($HN{O_3}$ и $NO$) на $2$, так как $( + 3) \times 2 = 6$ и умножаем молекулы процесса окисления ($HI$ и ${I_2}$) с $3$, так как $( + 2) \times 3 = 6$ . Таким образом, мы получаем:
Отсюда умножаем молекулы процесса окисления ($HN{O_3}$ и $NO$) на $2$, так как $( + 3) \times 2 = 6$ и умножаем молекулы процесса окисления ($HI$ и ${I_2}$) с $3$, так как $( + 2) \times 3 = 6$ . Таким образом, мы получаем:
$6HI + 2HN{O_3} \to 3{I_2} + 2NO + {H_2}O$
Обратите внимание, что коэффициент $HI$ теперь становится $6$, так как ранее у нас уже было $2$.
Последним шагом является уравновешивание атомов кислорода путем добавления молекул воды там, где это необходимо. С левой стороны у нас есть шесть кислородов, а с правой стороны у нас есть три кислорода. Таким образом, мы добавляем три молекулы воды в правую часть. Поскольку с правой стороны уже есть молекула воды, общее количество молекул воды с правой стороны теперь будет четыре:
$6HI + 2HN{O_3} \to 3{I_2} + 2NO + 4{H_2}O$
Теперь мы должны сбалансировать атомы водорода. Но мы видим, что они уже уравновешены, так как с обеих сторон по восемь атомов водорода. Поскольку мы уравновесили все элементы, это окончательное уравновешенное уравнение:
$6HI + 2HN{O_3} \to 3{I_2} + 2NO + 4{H_2}O$
Итак, правильный ответ — Вариант A .
Примечание: Помимо метода степени окисления, мы также можем использовать метод полуреакции. В этом методе мы разделяем всю реакцию на половину окисления и половину восстановления и уравновешиваем их отдельно. В конце они объединяются, чтобы получить окончательное уравнение.
Обратите внимание, что окисление — это удаление электронов, а восстановление — это приобретение электронов.
Проблема разрешения в виде кислотно-основного
Проблема разрешения в виде кислотно-основного 006 1 из 22Верхний обрезанный слайд
Скачать для чтения офлайн
Образование
Разрешение de Problemas ácido-base (I)
Реклама
Реклама
Решение проблем в виде кислотно-основных
- ТЕМА 8.- РЕАКЦИИ ÁCIDO-BASE (I)
ÁCIDOS Y BASES DE BRØNSTED
1. Clasifica cada una de las siguientes especies como ácido o base de Brønsted, o
также амбо: а) h3O, б) OH-, в) h4O+, г) Nh4, д) Nh5+, е) Nh3-, ж) NO3-, з) СО32-, и) HBr,
к) ХСН.
 АСИДО ДЕ
БРЕНСТЕД
БАЗА ДЕ БРЕНСТЕД АНФОТЕРО
h4O+ OH- h3O
Кh5+ Кh3- Кh4
HBr NO3-
HCN CO32-
El NO3- (нитратный анион) представляет собой соединение основания HNO3 без содержания
пропьедадес ацидо-основа.
АСИДО ДЕ
БРЕНСТЕД
БАЗА ДЕ БРЕНСТЕД АНФОТЕРО
h4O+ OH- h3O
Кh5+ Кh3- Кh4
HBr NO3-
HCN CO32-
El NO3- (нитратный анион) представляет собой соединение основания HNO3 без содержания
пропьедадес ацидо-основа. - 3. Опишите формулу коньюгадо де када де лас сигуиентес по основаниям: а) HS-, б) HCO3-, c) CO32-, d) h3PO4-, e) HPO42-, f) PO43-, g) HSO4-, h) SO42-, i) SO32-. а) ГС-/ч3С б) HCO3- / h3CO3 в) СО32- / НСО3- г) h3PO4- / h4PO4 д) HPO42- / h3PO4- е) PO43-/HPO42- ж) HSO4-/h3SO4 з) SO42- / HSO4- и) SO32- / HSO3-
- рН: UNA MEDIDA DE LA ACIDEZ 4. Вычисление pH для основных растворов: а) HCl 0,0010 М, б) КОН. 0,76 М. а) HCl (ац) + h3O (ж) h4O+ (ац) + Cl- (ац) 𝒑𝑯 = − журнал [ 𝐻3 𝑂+ = — журнал [0,0010] = 𝟑 б) KOH (ас) K+ (ас) + OH- (ас) 𝒑𝑶𝑯 = − log [𝑂𝐻−] = − log [0,76] = 𝟎, 𝟏𝟐 𝑝𝐻 + 𝑝𝑂𝐻 = 14 ; 𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 𝟏𝟑, 𝟖𝟖
- 5. Эл. рОН растворимости 9,40. Расчет концентрации ионного водорода ла растворение. 𝑝𝑂𝐻 = 9,40 𝑝𝐻 + 𝑝𝑂𝐻 = 14 𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 14 − 9,40 = 𝟒, 𝟔𝟎 [𝑯 𝟑 𝑶+] = 10−4,6 = 𝟐, 𝟓 · 𝟏𝟎−𝟓 𝑴
- 6.
 Расчет числа молей KOH на 5,50 мл при растворении KOH
0,360 M. ¿Cuál es el pOH de la disolución?
𝒏 ( 𝑶𝑯−) = [ 𝑂𝐻−] · 𝑉 ( 𝑂𝐻−) = 0,360
𝑚𝑜𝑙
𝐿
· 5,50 · 10−3
𝐿 = 𝟏, 𝟗𝟖 · 𝟏𝟎−𝟑
𝒎𝒐𝒍
𝒑𝑶𝑯 = − log [𝑂𝐻−] = − log [0,360 ] = 𝟎, 𝟒𝟒
Расчет числа молей KOH на 5,50 мл при растворении KOH
0,360 M. ¿Cuál es el pOH de la disolución?
𝒏 ( 𝑶𝑯−) = [ 𝑂𝐻−] · 𝑉 ( 𝑂𝐻−) = 0,360
𝑚𝑜𝑙
𝐿
· 5,50 · 10−3
𝐿 = 𝟏, 𝟗𝟖 · 𝟏𝟎−𝟑
𝒎𝒐𝒍
𝒑𝑶𝑯 = − log [𝑂𝐻−] = − log [0,360 ] = 𝟎, 𝟒𝟒 - 7. Препарат для растворения 18,4 г HCl в 662 мл воды. Расчет эль pH де ла disolución. (Supón que el volumen permanece Constante.) [𝑯𝑪𝒍] = 18,4 𝑔 36,5 𝑔/𝑚𝑜𝑙 0,662 𝐿 = 𝟎, 𝟕𝟔𝟏𝟓 𝑴 𝒑𝑯 = − log [𝐻3 𝑂+] = − log [0,7615] = 𝟎, 𝟏𝟐
- ÁCIDOS DÉBILES Y LA CONSTANTE DE IONIZACIÓN DE UN ÁCIDO 8. ¿Cuál de las siguientes disoluciones tiene el pH más alto? а) HCOOH 0,40 М, б) HClO4 0,40 М, в) Ch4COOH 0,40 М. ДАТОС: pKa (HCOOH) = 3,77; рКа (Ch4COOH) = 4,8. а) HCOOH (а.с.) + h3O (ж) HCOO- (а.с.) + h4O+ (а.с.) 0,40 м — — 0,40 — х х х 𝐾𝑎 = [𝐻𝐶𝑂𝑂−] · [𝐻3 𝑂+ ] [𝐻𝐶𝑂𝑂𝐻] 1,7 · 10−4 «=» 𝑥2 0,40 − 𝑥 В равновесии: [НСООН) = 0,392 М; [HCOO-] = [h4O+] = 8,165·10-3 М 𝒑𝑯 = − log [𝐻3 𝑂+] = 𝟐, 𝟎𝟗 б) HClO4 (а.ч.) + h3O (ж) ClO4- (а.к.) + h4O+ (а.ч.) 𝒑𝑯 = − log [𝐻3 𝑂+] = − log [0,40] = 𝟎, 𝟒𝟎
- в)
Ch4COOH (а.
 к.) + h3O (ж) Ch4COO- (а.к.) + h4O+ (а.к.)
0,40 м — —
0,40 — х х х
𝐾𝑎 =
[𝐶𝐻3 𝐶𝑂𝑂−] · [𝐻3 𝑂+
]
[𝐶𝐻3 𝐶𝑂𝑂𝐻]
1,58 · 10−5
«=»
𝑥2
0,40 − 𝑥
«=»
𝑥2
0,40
В равновесии:
[Ch4COOH) = 0,394 М; [Ch4COO-] = [h4O+] = 6,28·10-3 М
𝒑𝑯 = − log [𝐻3 𝑂+] = 𝟐, 𝟐𝟎
к.) + h3O (ж) Ch4COO- (а.к.) + h4O+ (а.к.)
0,40 м — —
0,40 — х х х
𝐾𝑎 =
[𝐶𝐻3 𝐶𝑂𝑂−] · [𝐻3 𝑂+
]
[𝐶𝐻3 𝐶𝑂𝑂𝐻]
1,58 · 10−5
«=»
𝑥2
0,40 − 𝑥
«=»
𝑥2
0,40
В равновесии:
[Ch4COOH) = 0,394 М; [Ch4COO-] = [h4O+] = 6,28·10-3 М
𝒑𝑯 = − log [𝐻3 𝑂+] = 𝟐, 𝟐𝟎 - 9. Se disuelve una muestra de 0,0560 g de ácido acético en la cantidad suficiente de водный раствор для приготовления 50,0 мл. Расчет концентрации H+, Ch4COO- и Ch4COOH в равновесии. DATO: Ка (Ch4COOH) = 1,8·10-5. [𝐶𝐻3 𝐶𝑂𝑂𝐻] 𝑜 = 0,0560 𝑔 60 𝑔 𝑚𝑜𝑙 50,0 · 10−3 𝐿 = 0,0187 𝑀 Ch4COOH (а.к.) + h3O (ж) Ch4COO- (а.к.) + h4O+ (а.к.) 0,0187 М — — 0,0187 — х х х 1,8 · 10−5 «=» 𝑥2 0,0187 — 𝑥 [Ch4COOH]экв = 0,018129М [Ch4COO-]экв = 5,71·10-4 М [h4O+]экв = 5,71·10-4 М
- 10. ¿Cuál es la molaridad inicial de una disolución de ácido formico (HCOOH) cuyo pH, в равновесии, es de 3,26? DATO: Ка (НСООН) = 1,7·10-4. HCOOH (а.с.) + h3O (ж) HCOO- (а.с.) + h4O+ (а.с.) Ко — — Со — х х х Co – 5,5·10-4 5,5·10-4 М 5,5·10-4 М 1,7 · 10−4 «=» (5,5 · 10−4 )2 𝐶 𝑜 − 5,5 · 10−4 3,02 · 10−7 = 1,7 · 10−4 · 𝐶 𝑜 − 9,34 · 10−8 [𝑯𝑪𝑶𝑶𝑯] 𝒐 = 𝟐, 𝟑𝟐𝟔 · 𝟏𝟎−𝟑 𝑴
- 11.
 Ионизационный расчет растворения ацетилсалициловой кислоты
(аспирина) 0,20 М, как монопротез.
DATO: Ка (HA) = 3,0·10-4.
HA (а.с.) + h3O (ж) A- (а.с.) + h4O+ (а.с.)
0,20 м — —
0,20 · (1 – ) 0,20 · 0,20 ·
𝐾𝑎 =
[𝐴−] · [𝐻3 𝑂+
]
[𝐻𝐴]
3,0 · 10−4
«=»
0,202
· 𝛼2
0,20 · (1 − 𝛼)
𝜶 = 𝟎, 𝟎𝟑𝟖 (𝟑, 𝟖%)
Ионизационный расчет растворения ацетилсалициловой кислоты
(аспирина) 0,20 М, как монопротез.
DATO: Ка (HA) = 3,0·10-4.
HA (а.с.) + h3O (ж) A- (а.с.) + h4O+ (а.с.)
0,20 м — —
0,20 · (1 – ) 0,20 · 0,20 ·
𝐾𝑎 =
[𝐴−] · [𝐻3 𝑂+
]
[𝐻𝐴]
3,0 · 10−4
«=»
0,202
· 𝛼2
0,20 · (1 − 𝛼)
𝜶 = 𝟎, 𝟎𝟑𝟖 (𝟑, 𝟖%) - 12. Эль-рH дель jugo gástrico del estómago de cierto individuo es de 1,00. Después де haber ingerido algunas таблетки аспирина, ла концентрация ацидо ацетилсалицилико en su estómago es de 0,20 M. Calcula el porcentaje de ionización del ácido en esas условия. HA (а.с.) + h3O (ж) A- (а.с.) + h4O+ (а.с.) Co — 10-1 М Co · (1 – ) Co · 10-1 + Co · 0,20 м 3,0 · 10−4 «=» 0,1 · 𝐶 𝑜 · 𝛼 + 𝐶 𝑜 2 · 𝛼2 0,20 𝑦2 + 0,1 · 𝑦 − 6 · 10−5 = 0 ; 𝑦 = 6 · 10−4 𝜶 = 𝐶 𝑜 · 𝛼 𝐶 𝑜 = 𝟑 · 𝟏𝟎−𝟑 (𝟎, 𝟑%)
- BASES DÉBILES Y LA CONSTANTE DE IONIZACIÓN DE UNA BASE
13. ¿Cuál de las siguientes disoluciones tendrá un pH más alto? а) Nh4 0,20 М, б)
NaOH 0,20 М.
ДАТО: Kb (Nh4) = 1,8·10-5.
а)
Nh4 (ач) + h3O (ж) Nh5+ (ач) + OH- (ач)
0,20 м — —
0,20 — х х х
1,8 · 10−5
«=»
𝑥2
0,20 − 𝑥
«=»
𝑥2
0,20
; 𝒙 = 𝟏, 𝟗 · 𝟏𝟎−𝟑
𝑴
𝑝𝑂𝐻 = — журнал [𝑂𝐻-] = 2,72
𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 𝟏𝟏, 𝟐𝟖
б)
NaOH (а.
 с.) Na+ (а.с.) + OH- (а.с.)
𝑝𝑂𝐻 = − log [𝑂𝐻−] = 0,7
𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 𝟏𝟑, 𝟑
с.) Na+ (а.с.) + OH- (а.с.)
𝑝𝑂𝐻 = − log [𝑂𝐻−] = 0,7
𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 𝟏𝟑, 𝟑 - 14. Расчет pH для расчетных показателей растворов: a) Nh4 0,10 M, b) C5H5N (пиридина) 0,050 М. DATO: Kb (C5H5N) = 1,7·10-9. а) Nh4 (ач) + h3O (ж) Nh5+ (ач) + OH- (ач) 0,10 М — — 0,10 — х х х 1,8 · 10−5 «=» 𝑥2 0,10 − 𝑥 «=» 𝑥2 0,10 ; 𝒙 = 𝟏, 𝟑𝟒 · 𝟏𝟎−𝟑 𝑴 𝑝𝑂𝐻 = — журнал [𝑂𝐻-] = 2,87 𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 𝟏𝟏, 𝟏𝟑 б) C5H5N(а.к.) + h3O(ж) C5H5NH+(а.к.) + OH-(а.к.) 0,050 М — — 0,050 — х х х 1,7 · 10−9 «=» 𝑥2 0,050 − 𝑥 «=» 𝑥2 0,050 ; 𝒙 = 𝟗, 𝟐𝟐 · 𝟏𝟎−𝟔 𝑴 𝑝𝑂𝐻 = − log [𝑂𝐻−] = 5,04 𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 𝟖, 𝟗𝟔
- 15. pH растворения разбавленного основания 0,30 M es de 10,66. ¿Cuál es la Kb de la база? B (ач) + h3O (ж) HB+ (ач) + OH- (ач) 0,30 м — — 0,30 — х х х 10−3,34 𝑀 = 4,57 · 10−4 𝑀 𝐾𝑏 = [𝐻𝐵+] · [𝑂𝐻− ] [𝐵] 𝑲 𝒃 = (4,57 · 10−4 )2 0,30 − 4,57 · 10−4 = 𝟔, 𝟗𝟕 · 𝟏𝟎−𝟕
- 16. ¿Cuál es la molaridad inicial de una disolución de amoníaco cuyo pH es de 11,22? Nh4 (ач) + h3O (ж) Nh5+ (ач) + OH- (ач) Ко — — Со — х х х 1,8 · 10−5 «=» (1,66 · 10−3 )2 𝐶 𝑜 − 1,66 · 10−3 2,76 · 10−6 = 1,8 · 10−5 · 𝐶 𝑜 − 3 · 10−8 ; 𝑪 𝒐 = 𝟎, 𝟏𝟓𝟔 𝑴
- 17.
 Расторжение Nh4 0,080 M, ¿qué porcentaje Nh4 está presente como
Кh5+?
Nh4 (ач) + h3O (ж) Nh5+ (ач) + OH- (ач)
0,080 М — —
0,080 — х х х
1,8 · 10−5
«=»
𝑥2
0,080 — 𝑥
«=»
𝑥2
0,080
; 𝒙 = 𝟏, 𝟐 · 𝟏𝟎−𝟑
𝑴
𝜶 =
1,2 · 10−3
0,080
· 100 = 𝟏, 𝟓%
Расторжение Nh4 0,080 M, ¿qué porcentaje Nh4 está presente como
Кh5+?
Nh4 (ач) + h3O (ж) Nh5+ (ач) + OH- (ач)
0,080 М — —
0,080 — х х х
1,8 · 10−5
«=»
𝑥2
0,080 — 𝑥
«=»
𝑥2
0,080
; 𝒙 = 𝟏, 𝟐 · 𝟏𝟎−𝟑
𝑴
𝜶 =
1,2 · 10−3
0,080
· 100 = 𝟏, 𝟓% - PROPIEDADES ÁCIDO-BASE DE LAS SALES 18. Especifica cuáles de las siguientes sales se hidrolizan: KF, NaNO3, Nh5NO2, MgSO4, KCN, C6H5COONa, RbI, Na2CO3, CaCl2, HCOOK. а) КФ К+ + Ф- F- (ац) + h3O (ж) HF (ац) + OH- (ац) б) NaNO3 Не гидролизуется в) Nh5NO2 Nh5+ + NO2- Nh5+ (ач) + h3O (ж) Nh4 (ач) + h4O+ (ач) NO2- (а.с.) + h3O (ж) HNO2 (а.с.) + OH- (а.с.) г) MgSO4 Mg2+ + SO42- SO42- (а.с.) + h3O (ж) HSO4- (а.с.) + OH- (а.с.) д) KCN К+ + CN- CN- (ац) + h3O (ж) HCN (ац) + OH- (ац) е) C6H5COONa C6H5COO- + Na+ C6H5COO- (а.с.) + h3O (ж) C6H5COOH (а.с.) + OH- (а.с.) г) RbI Нет гидролиза час) Na2CO3 2 Na+ + CO32- CO32- (а.с.) + h3O (ж) HCO3- (а.с.) + OH- (а.с.)
- я)
CaCl2 Не гидролизуется
к)
HCOOK HCOO- + K+
HCOO- (а.с.) + h3O (ж) HCOOH (а.с.) + OH- (а.


 АСИДО ДЕ
БРЕНСТЕД
БАЗА ДЕ БРЕНСТЕД АНФОТЕРО
h4O+ OH- h3O
Кh5+ Кh3- Кh4
HBr NO3-
HCN CO32-
El NO3- (нитратный анион) представляет собой соединение основания HNO3 без содержания
пропьедадес ацидо-основа.
АСИДО ДЕ
БРЕНСТЕД
БАЗА ДЕ БРЕНСТЕД АНФОТЕРО
h4O+ OH- h3O
Кh5+ Кh3- Кh4
HBr NO3-
HCN CO32-
El NO3- (нитратный анион) представляет собой соединение основания HNO3 без содержания
пропьедадес ацидо-основа. Расчет числа молей KOH на 5,50 мл при растворении KOH
0,360 M. ¿Cuál es el pOH de la disolución?
𝒏 ( 𝑶𝑯−) = [ 𝑂𝐻−] · 𝑉 ( 𝑂𝐻−) = 0,360
𝑚𝑜𝑙
𝐿
· 5,50 · 10−3
𝐿 = 𝟏, 𝟗𝟖 · 𝟏𝟎−𝟑
𝒎𝒐𝒍
𝒑𝑶𝑯 = − log [𝑂𝐻−] = − log [0,360 ] = 𝟎, 𝟒𝟒
Расчет числа молей KOH на 5,50 мл при растворении KOH
0,360 M. ¿Cuál es el pOH de la disolución?
𝒏 ( 𝑶𝑯−) = [ 𝑂𝐻−] · 𝑉 ( 𝑂𝐻−) = 0,360
𝑚𝑜𝑙
𝐿
· 5,50 · 10−3
𝐿 = 𝟏, 𝟗𝟖 · 𝟏𝟎−𝟑
𝒎𝒐𝒍
𝒑𝑶𝑯 = − log [𝑂𝐻−] = − log [0,360 ] = 𝟎, 𝟒𝟒 к.) + h3O (ж) Ch4COO- (а.к.) + h4O+ (а.к.)
0,40 м — —
0,40 — х х х
𝐾𝑎 =
[𝐶𝐻3 𝐶𝑂𝑂−] · [𝐻3 𝑂+
]
[𝐶𝐻3 𝐶𝑂𝑂𝐻]
1,58 · 10−5
«=»
𝑥2
0,40 − 𝑥
«=»
𝑥2
0,40
В равновесии:
[Ch4COOH) = 0,394 М; [Ch4COO-] = [h4O+] = 6,28·10-3 М
𝒑𝑯 = − log [𝐻3 𝑂+] = 𝟐, 𝟐𝟎
к.) + h3O (ж) Ch4COO- (а.к.) + h4O+ (а.к.)
0,40 м — —
0,40 — х х х
𝐾𝑎 =
[𝐶𝐻3 𝐶𝑂𝑂−] · [𝐻3 𝑂+
]
[𝐶𝐻3 𝐶𝑂𝑂𝐻]
1,58 · 10−5
«=»
𝑥2
0,40 − 𝑥
«=»
𝑥2
0,40
В равновесии:
[Ch4COOH) = 0,394 М; [Ch4COO-] = [h4O+] = 6,28·10-3 М
𝒑𝑯 = − log [𝐻3 𝑂+] = 𝟐, 𝟐𝟎 Ионизационный расчет растворения ацетилсалициловой кислоты
(аспирина) 0,20 М, как монопротез.
DATO: Ка (HA) = 3,0·10-4.
HA (а.с.) + h3O (ж) A- (а.с.) + h4O+ (а.с.)
0,20 м — —
0,20 · (1 – ) 0,20 · 0,20 ·
𝐾𝑎 =
[𝐴−] · [𝐻3 𝑂+
]
[𝐻𝐴]
3,0 · 10−4
«=»
0,202
· 𝛼2
0,20 · (1 − 𝛼)
𝜶 = 𝟎, 𝟎𝟑𝟖 (𝟑, 𝟖%)
Ионизационный расчет растворения ацетилсалициловой кислоты
(аспирина) 0,20 М, как монопротез.
DATO: Ка (HA) = 3,0·10-4.
HA (а.с.) + h3O (ж) A- (а.с.) + h4O+ (а.с.)
0,20 м — —
0,20 · (1 – ) 0,20 · 0,20 ·
𝐾𝑎 =
[𝐴−] · [𝐻3 𝑂+
]
[𝐻𝐴]
3,0 · 10−4
«=»
0,202
· 𝛼2
0,20 · (1 − 𝛼)
𝜶 = 𝟎, 𝟎𝟑𝟖 (𝟑, 𝟖%) с.) Na+ (а.с.) + OH- (а.с.)
𝑝𝑂𝐻 = − log [𝑂𝐻−] = 0,7
𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 𝟏𝟑, 𝟑
с.) Na+ (а.с.) + OH- (а.с.)
𝑝𝑂𝐻 = − log [𝑂𝐻−] = 0,7
𝒑𝑯 = 14 − 𝑝𝑂𝐻 = 𝟏𝟑, 𝟑 Расторжение Nh4 0,080 M, ¿qué porcentaje Nh4 está presente como
Кh5+?
Nh4 (ач) + h3O (ж) Nh5+ (ач) + OH- (ач)
0,080 М — —
0,080 — х х х
1,8 · 10−5
«=»
𝑥2
0,080 — 𝑥
«=»
𝑥2
0,080
; 𝒙 = 𝟏, 𝟐 · 𝟏𝟎−𝟑
𝑴
𝜶 =
1,2 · 10−3
0,080
· 100 = 𝟏, 𝟓%
Расторжение Nh4 0,080 M, ¿qué porcentaje Nh4 está presente como
Кh5+?
Nh4 (ач) + h3O (ж) Nh5+ (ач) + OH- (ач)
0,080 М — —
0,080 — х х х
1,8 · 10−5
«=»
𝑥2
0,080 — 𝑥
«=»
𝑥2
0,080
; 𝒙 = 𝟏, 𝟐 · 𝟏𝟎−𝟑
𝑴
𝜶 =
1,2 · 10−3
0,080
· 100 = 𝟏, 𝟓%