HI+HNO2=I2+NO+h3O электрондық балланс әдісімен химиялық реакция теңдеуін теңестіру керек
Сайтты қолдану үшін FAQ танысып шығыңыз!
taken_ernurХимиясұрақ қойды | 7.7k қаралды
HI+HNO2=I2+NO+h3O электрондық балланс әдісімен химиялық реакция теңдеуін теңестіру керек
- есеп
- электронды баланс
1 жауап
Jurttyn_kyzyжауап берді
2HNO2 + 2HI = I2 + 2NO + 2h3O
N+3 +3e=N +2
2I+1 -2e=I2 0
Осылай теңеседі)
Ұқсас сұрақтар
1 жауап
Берілген реакцияны электрондық-баланс әдісімен теңестіріңіз: С+HNO3 → CO2+NO+h3O
Белгісіз
Химия
7.12.2020
сұрақ қойды
|
5. 5k қаралды
5k қаралды
- есеп
- химия
1 жауап
Реакция теңдеуін жазып, электрондық баланыс тәсілімен теңестіру
AitokaХимия 17.11.2012 сұрақ қойды | 3.1k қаралды
- химия
- реакция теңдеуі
- көмектессеңіздер
1 жауап
Реакция теңдеуін жазып, электрондық баланс тәсілімен теңестіру?
азаматикХимия 1.11.2012 сұрақ қойды | 5.6k қаралды
- химия
- реакция теңдеуі
- қазақша сұрақ
- тізбекті реакция
- экстра баланс
2 жауап
Химиялық байланыс типін анықтаңдар. N2, h3O, Ph4, F2, KCL, I2, h3S. ALF3, SIO2, Ca
leeХимия 7.09.2013 сұрақ қойды | 53.4k қаралды
- химиялық байланыс
- химия
1 жауап
Реакция теңдеуін аяқтап теңестіру?
TurganbekovaХимия 9.04.2020 сұрақ қойды | 1.8k қаралды
- химия
- реакция
- теңдеу
- есеп
- Санаттар
- Мектеп сұрақтары
29.
 2k
2k- Мектеп 9.0k
- Қазақ тілі 5.7k
- Математика 3.1k
- Химия 2.5k
- Информатика 627
- Аспан әлемі, Ғарыш 191
- Геометрия 1.4k
- Физика 2.6k
- Биология 901
- Психология 197
- География 822
- ҰБТ жайлы 987
- Үй тапсырмасы 1.1k
- Серпін-2050 жобасы 73
- Университет, колледж 4.1k
- Тарих сұрақтары 2.0k
- Компьютер, Интернет 16.5k
- Авто 1.1k
- Қаржы, Бизнес 2.1k
- Саясат, Мемлекет 1.7k
- Заң 2.0k
- Өмір, Тіршілік 4.9k
- Тағам, Аспаздық 990
- Жұмыс 1.4k
- Экология, Табиғат 1.4k
- Денсаулық 6.5k
- Спорт 3.1k
- Танысу, Махаббат 2.7k
- Көңіл-көтеру 1.7k
- Өнер 1.5k
- Қыдыру, Демалыс 453
- Кітап, Әдебиет 3.4k
- Құрылыс, Жобалау 391
- Музыка, Ән 5.8k
- Ұялы телефон 5.3k
- Әлеуметтік желі
1.
 6k
6k - Кино, Теледидар 3.1k
- Сурет, Видео 1.4k
- Тұлға, Адам 3.0k
- Салт-дәстүр 1.0k
- Логикалық сұрақтар 3.3k
- Жалпы сұрақ 14.0k
- Онлайн конференция 16
Азотистая кислота — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
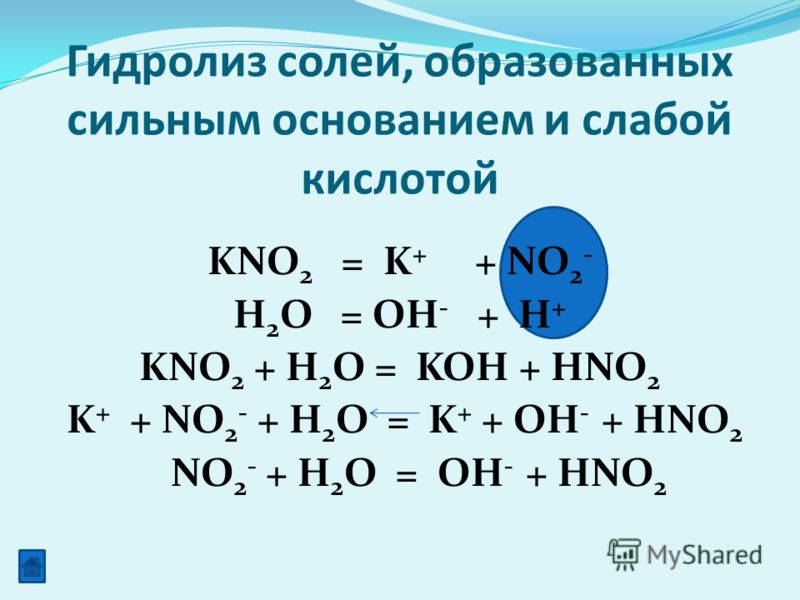
1. Азотистая кислота
Азотистая кислота HNO2имеет слабый характер.
Весьма неустойчива, может быть
только в разбавленных растворах:
2HNO2
NO + NO2 + h3O.
2. Атом азота в азотистой кислоте имеет промежуточную степень окисления +3
в связи с этим он может быть иокислителем, и проявлять
восстановительные свойства:
HNO2 + HI = I2 + NO + h3O,
HNO2 + h3O2 = HNO3 + h3O,
KNO2 + KMnO4 + h3SO4 = KNO3 +
K2SO4 + MnSO4 + h3O.

Нагреваясь, раствор азотистой
кислоты распадается с
выделением NO и
образованием азотной кислоты
Запишите уравнение
4. Соли азотистой кислоты называются нитритами
Нитриты гораздо более устойчивы, чем HNO2,все они токсичны. Представляют собой
кристаллические вещества, хорошо
растворимые в воде (труднее других — AgNО2)
Свойства .
1) Как и HNО2, нитриты обладают окислительновосстановительной двойственностью:
KNО2 + Н2О2 = KNО3 + Н2O
3KNО2 + 2КМпO4 + Н2O = 3KNО3 + 2MnО2↓ + 2КОН
2KNО2 + 2KI + 2h3SO4 = 2NO + I2 + 2K2SO4 + 2Н2O
2) Нитрит аммония разлагается при нагревании:
Nh5NО2 = N2↑ + 2Н2O
Состав. Строение. Свойства.
HNO3
H — O —N
O
O
степень окисления азота
валентность азота IV
+5
химическая связь
ковалентная полярная
Азотная кислота – бесцветная гигроскопичная жидкость,
c резким запахом, «дымит» на воздухе, неограниченно
растворимая в воде. tкип. = 83ºC.. При хранении на свету
разлагается на оксид азота (IV), кислород и воду,
приобретая желтоватый цвет: 4HNO3 = 4NO2 + O2 + 2h3O
Азотная кислота ядовита.
При разложении азотной кислоты
кислород, поэтому скипидар вспыхивает.
выделяется
Азотная кислота (HNO3)
Классификация
Азотная кислота по:
наличию кислорода:
основности:
растворимости в воде:
кислородсодержащая
одноосновная
растворимая
летучести:
летучая
степени электролитической
диссоциации:
сильная
Получение азотной кислоты в промышленности
Nh4
NO
NO2
1. Контактное окисление аммиака до
оксида азота (II):
4Nh4+ 5O2 = 4NO + 6h3O
2. Окисление оксида азота (II) в оксид
азота (IV):
2NO+O2 = 2NO2
3. Адсорбция (поглощение) оксида
азота (IV) водой при избытке кислорода
4NO2 + 2h3O + O2 = 4HNO3
HNO3
В лаборатории азотную кислоту получают действием
концентрированной серной кислоты на нитраты при
слабом нагревании.
Составьте уравнение реакции получения азотной кислоты.
NaNO3 + h3SO4 = NaHSO4 + HNO3
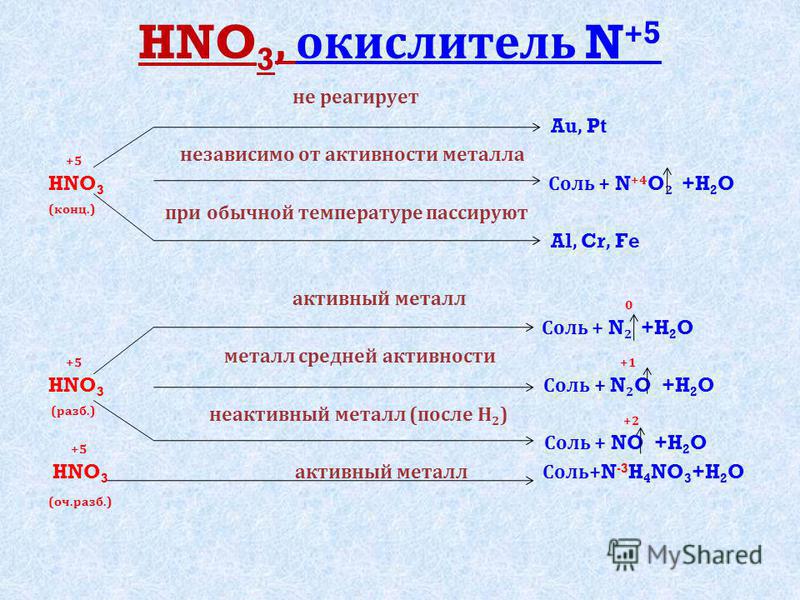
Химические свойства азотной кислоты
1. Типичные свойства кислот
2.
 Взаимодействие азотной кислоты с металлами
Взаимодействие азотной кислоты с металлами3. Взаимодействие азотной кислоты с неметаллами
Химические свойства азотной кислоты
Азотная кислота проявляет все типичные свойства
кислот.
Перечислите их:
Составьте уравнения реакций азотной кислоты:
1 с оксидом меди (II), оксидом алюминия;
2 c гидроксидом натрия, гидроксидом цинка;
3
c карбонатом аммония, силикатом натрия.
Дайте названия полученным веществам. Определите тип
реакции.
1
2HNO3 + CuO = Cu(NO3)2 + h3O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3h3O
2
HNO3 + NaOH = NaNO3 + h3O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2h3O
3
2HNO3 + (Nh5)2CO3 = 2Nh5NO3 + ↑CO2 + h3O
2HNO3 + Na2SiO3 = ↓h3SiO3 + 2NaNO3
Взаимодействие азотной кислоты с металлами
Как реагируют металлы с растворами кислот?
стоящие
в ряду активности
до кислоты
водорода,
вытесняют
Особенности
взаимодействия
азотной
с металлами:
его
изодин
кислот.
Металлы,
стоящие
после водорода
кислот его
1.
 Ни
Ниметалл
никогда
не выделяет
из азотнойизкислоты
не
вытесняют,
т.е. не взаимодействуют
с кислотами,
не
водород.
Выделяются
разнообразные соединения
азота:
растворяются
них. N2+1O, N20,
N+4O2, N+2вO,
N–3h4 (Nh5NO3)
N–3h5+
N20
N2+1O
N+2O
N+4O2
концентрация кислоты
активность металлов
2. С азотной кислотой реагируют металлы, стоящие до и
после водорода в ряду активности.
3. Азотная кислота не взаимодействует с Au, Pt
4. Концентрированная азотная кислота пассивирует металлы:
Al, Fe, Be, Cr, Ni, Pb и другие (за счет образования плотной
оксидной пленки). При нагревании и при разбавлении азотной
кислоты данные металлы в ней растворяются.
Найти закономерность при взаимодействии
азотной кислоты с металлами:
Единственная общая закономерность при
взаимодействии азотной кислоты с металлами: чем
более разбавленная кислота и чем активнее металл,
тем глубже восстанавливается азот:
Увеличение
конц.
 кислоты
кислотыУвеличение
активности
металла
Допишите схемы реакций:
1)
HNO3(конц.) + Cu → Cu(NO3)2 + … + h3O
2)
HNO3(разб.) + Cu → Cu(NO3)2 + … + h3O
Рассмотрите превращения в свете ОВР
1) 4HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + 2 N+4O2 + 2 h3O
окислитель
восстановитель
N+5 + 1e → N+4 1 2
Cu0 – 2e → Cu+2 2 1
восстановление
окисление
2) 8 HN+5O3(конц.) + 3 Cu0 = 3Cu+2(NO3)2 + 2 N+2O + 4 h3O
окислитель
восстановитель
Cu0 – 2e → Cu+2 2 3
восстановление
окисление
Взаимодействие азотной кислоты с неметаллами
Азотная кислота как сильный окислитель
Окисляет неметаллы до соответствующих кислот.
Концентрированная (более 60%) азотная кислота восстанавливается до
NO2 , а если концентрация кислоты (15 – 20%), то до NO.
Расставьте в схемах коэффициенты методом электронного баланса.
4 HNO3 + С → СO2 + 2 h3O + 4 NO2
N+5 + 1e → N+4 1 4
С0 – 4e → С+4 4 1
HNO3 (за счет N+5) – окислитель, пр.
 восстановления
восстановленияC – восстановитель, процесс окисления
5 HNO3 + P → h4PO4 + 5 NO2 + h3O
N+5 + 1e → N+4 1 5 HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
P0 – 5e → P+5 5 1
5 HNO3 + 3 P + 2 h3O → 3 h4PO4 + 5 NO
N+5 + 3e → N+2 3 5 HNO3 (за счет N+5) – окислитель, пр. восстановления
P0 – 5e → P+5 5 3 P – восстановитель, процесс окисления
Применение азотной кислоты
1
Производство азотных и комплексных
удобрений.
2
Производство взрывчатых веществ
3
Производство красителей
4
Производство лекарств
5
Производство пленок,
нитролаков, нитроэмалей
6
Производство
искусственных волокон
7
Как компонент нитрующей
смеси, для траления
металлов в металлургии
Соли азотной кислоты
Как называются соли азотной кислоты?
нитраты
Нитраты K, Na, Nh5+ называют селитрами
Составьте формулы перечисленных солей.
KNO3
NaNO3
Nh5NO3
Нитраты – белые кристаллические
вещества.
 Сильные электролиты, в
Сильные электролиты, врастворах полностью диссоциируют
на ионы. Вступают в реакции обмена.
Каким способом можно определить нитрат-ион в растворе?
К соли (содержащей нитрат-ион) добавляют серную
бурого газа (NO2) указывает на наличие нитрат-иона.
Нитрат калия (калиевая селитра)
Бесцветные кристаллы Значительно
менее гигроскопична по сравнению с
натриевой, поэтому широко применяется в пиротехнике как окислитель.
При нагревании выше 334,5ºС
плавится, выше этой температуры
разлагается с выделением кислорода.
Нитрат натрия
Применяется как удобрение; в
стекольной,
металлообрабатывающей промышленности; для получения
взрывчатых
веществ,
ракетного
топлива и пиротехнических смесей.
Нитрат аммония
Кристаллическое
вещество
белого
цвета. Температура плавления 169,6 °C,
при нагреве выше этой температуры
начинается постепенное
разложение
вещества, а при температуре 210°С
происходит полное разложение.
При нагревании нитраты разлагаются тем полнее, чем
правее в электрохимическом ряду напряжений стоит металл,
образующий соль.
Li K Ba Ca Na
Mg Al Mn Zn Cr Fe Co Sn Pb Cu
нитрит + О2
оксид металла + NO2 + O2
Ag Hg Au
Ме + NO2 + O2
Составьте уравнения реакций разложения нитрата
натрия, нитрата свинца, нитрата серебра.
2NaNO3 = 2NaNO2 + O2
2Pb(NO3)2= 2PbO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
1. Степень окисления азота в азотной кислоте равна:
А
А) +5;
Б) +4;
В) -3.
2. При взаимодействии с какими веществами азотная кислота проявляет
особые свойства, отличающие её от других кислот:
Б
А) основными оксидами; Б) металлами;
В) основаниями.
3. В окислительно-восстановительной реакции азотная кислота может
А
участвовать в качестве:
А) окислителя; Б) восстановителя; В) окислителя и восстановителя.
4. Какое из данных соединений азота называют чилийской селитрой:
А) нитрат калия;
Б) нитрат кальция;
В) нитрат натрия;
5.


 2k
2k 6k
6k