Окислительно-восстановительные и ионные реакции, уравнения реакций
Ионные уравнения реакций — это уравнения, в которых участвуют ионы. Когда вещество помещают в среду растворителя, происходит процесс распада вещества на ионы, т.е диссоциация. Ионы, имеющие заряд положительный (+) называются катионами, если заряд отрицательный (-), то какой ион называется анионом.
Рассмотрим в качестве растворителя воду, как наиболее изучаемую среду в рамках школьной программы. В водных растворах все электролиты, в той или иной степени ионизированы, поэтому и реакции протекают между ионами. При помещении кристаллов поваренной соли NaCl в воду мы наблюдаем растворение (физический процесс), далее происходит диссоциация соли, распад молекулы NaCl на ионы Na+ и Cl—. Реакция диссоциации записывается так: NaCl = Na+ + Cl—.
Чтобы узнать подвергается ли вещество диссоциации, нужно обратиться к таблице растворимости кислот, солей и оснований в воде. В таблице названия столбцов — это катионы, название строк — анионы, при пересечении ячеек находим окошко с буквой, в ней и скрыт ответ. Вещество нерастворимо, то есть не подвергается диссоциации — Н, вещество растворимо (диссоциирует на ионы) — Р, буква М обозначает, что вещество мало растворимо в воде, значит, если оно образуется в ходе реакции, т.е. находится в продуктах реакции в уравнении, то мы его считаем нерастворимым (осадком), на ионы не распадается, а если находится в исходных веществах, то диссоциации подвергается, смело записываем в виде ионов, что касается знака вопроса в таблице растворимости или прочерка, то это означает, что это вещество не может получиться в продукте реакции, значит реакция не ионного обмена, а окислительно-востановительная и идет с изменением степеней окисления. Если в исходных веществах и продуктах реакции все вещества растворимые, то такая реакция ионного обмена является обратимой.
В таблице названия столбцов — это катионы, название строк — анионы, при пересечении ячеек находим окошко с буквой, в ней и скрыт ответ. Вещество нерастворимо, то есть не подвергается диссоциации — Н, вещество растворимо (диссоциирует на ионы) — Р, буква М обозначает, что вещество мало растворимо в воде, значит, если оно образуется в ходе реакции, т.е. находится в продуктах реакции в уравнении, то мы его считаем нерастворимым (осадком), на ионы не распадается, а если находится в исходных веществах, то диссоциации подвергается, смело записываем в виде ионов, что касается знака вопроса в таблице растворимости или прочерка, то это означает, что это вещество не может получиться в продукте реакции, значит реакция не ионного обмена, а окислительно-востановительная и идет с изменением степеней окисления. Если в исходных веществах и продуктах реакции все вещества растворимые, то такая реакция ионного обмена является обратимой.
Обычно уравнения реакций мы записываем в молекулярном виде, опуская тот факт, что в реакции участвуют ионы. Для более подробного описания реакций существует запись в ионном виде (полное ионное уравнение и краткое ионное уравнение).
Для более подробного описания реакций существует запись в ионном виде (полное ионное уравнение и краткое ионное уравнение).
Нужна помощь репетитора по химии для подготовки к ЕГЭ? Загляните в каталог TutorOnline!
Составление уравнений реакций, протекающих в растворах электролитов1. Запишем реакцию в молекулярном виде: сначала левую часть уравнения реакции (исходные вещества через математический знак сложения), затем после знака равно правую часть (продукты реакции через знак «+», используя знания о химических свойствах реагирующих веществ).
NaCl + Pb(NO3)2 = PbCl2↓ + NaNO
2. Находим признак, протекаемой реакции. Если в результате реакции образуется газ, осадок, малодиссоциируемое вещество, вода, то такая реакция идет. Для нахождения осадка пользуемся таблицей растворимости, вещество нерастворимо — значит осадок.
В нашем случае, образуется осадок PbCl2↓, значит реакция идет.
3. Расставляем коэффициенты в уравнении реакции, используя правило, сначала уравниваем металлы, затем любые неметаллы, затем водород и проверяем всю реакцию по кислороду.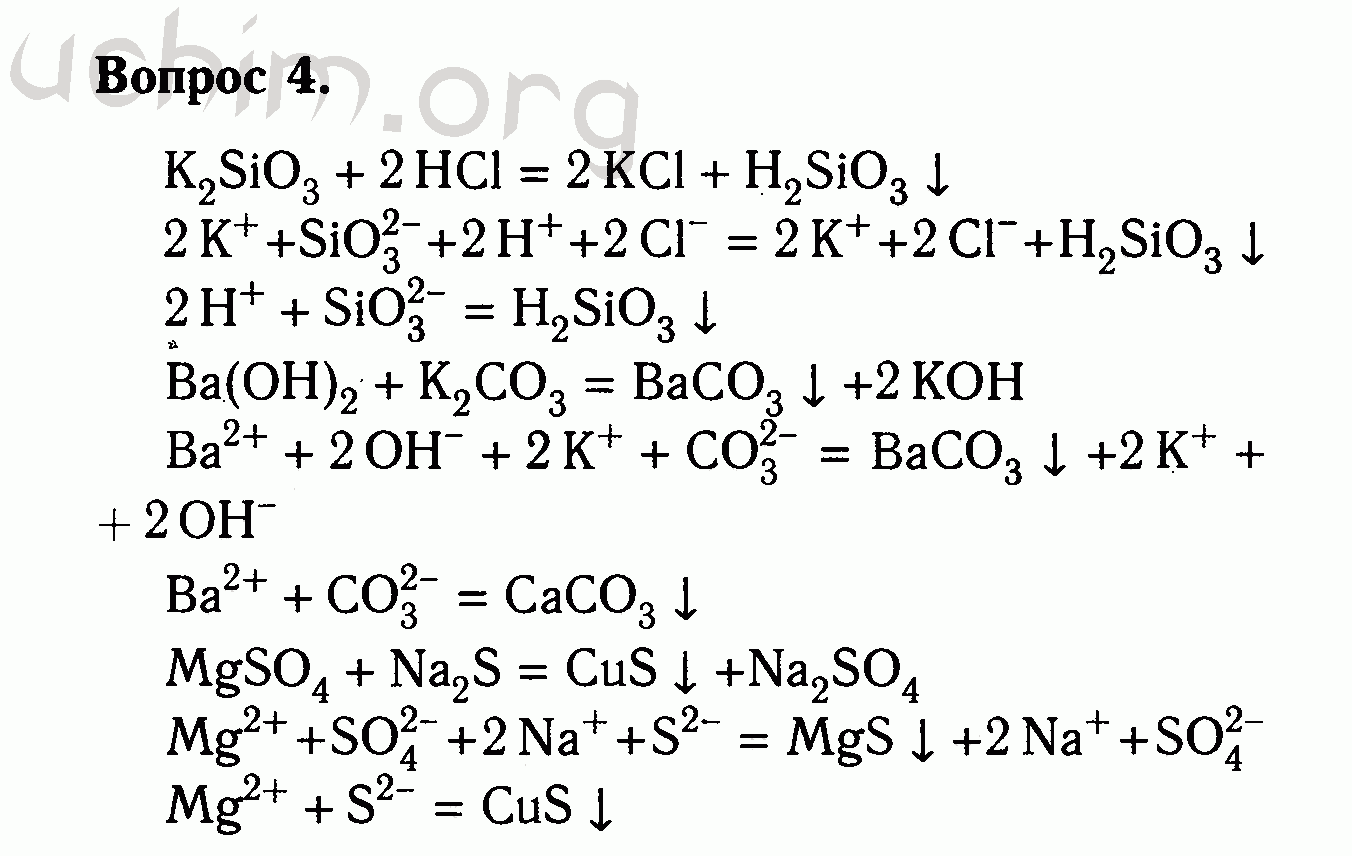
2NaCl + Pb(NO3)2 = PbCl2↓ + 2NaNO3
4. Запишем полное ионное уравнение реакции, учитывая стехиометрические коэффициенты: подвергнем диссоциации вещества, которые растворимы в воде. Вещества нерастворимые, газы, осадки, вода, оксиды диссоциации не подвергаются.
2Na+ + 2Cl— + Pb2+ + 2NO3— = PbCl2↓ + 2Na+ +2NO3—
Помним, что заряд иона пишется сначала цифра затем знак, а не наоборот как степень окисления.
5. Составим краткое ионное уравнение (в сокращенной ионной форме): сократим одинаковые ионы в левой и правой части.
2Na+ + 2Cl— + Pb2+ + 2NO3— = PbCl2↓ + 2Na+ + 2NO3—
6. Запишем краткое ионное уравнение (сначала катион, затем анион)
Pb2+ + 2Cl— = PbCl2↓
Окислительно-восстановительные реакции в растворахСуществует множество химических реакций, в которых происходит перенос электронов от одного вещества к другому, такие реакции называются окислительно-восстановительными, где атомы одного вещества принимают электроны, а другого отдают.
Окислительно-восстановительные реакции (ОВР) — это реакции, в которых происходит изменение степени окисления одного или нескольких атомов элементов.
Восстановитель — это вещество, которое отдает электроны, подвергается процессу окисления. Окислитель — это вещество, которое принимает электроны и подвергается процессу восстановления. Окислителем и восстановителем могут быть только исходные вещества. Частицы с промежуточной степенью окисления, в зависимости от условий могут проявлять как окислительные так и восстановительные свойства.
Составление окислительно-восстановительных реакций методом электронного баланса1. Составим уравнение реакции, расставляем стехиометрические коэффициенты:
2. Определяем степень окисления каждого атома:
3. Подчеркиваем атомы, которые меняли свою степень окисления:
4. Описываем изменения степеней окисления: помним, что перед подсчетом электронов нужно уравнять атомы в левой и правой части.
5. Отчеркиваем и переписываем значения электронов:
6. Отчеркиваем, находим общий множитель между этими цифрами:
7. Отчеркиваем, делим общий множитель на каждое из чисел:
8. Мы нашли базовые коэффициенты в уравнении реакции, ставим их перед наиболее простыми веществами в уравнении реакции:
9. Запишем названия процессов: магний электроны отдает, значит он подвергается процессу окисления, водород — принимает, процесс восстановление.
10. Расставляем коэффициенты, уравнивая атомы в левой и правой частях. В нашем случае, перед каждым веществом коэффициент 1.
11. Запишем, какое исходное вещество является окислителем, а какое восстановителем:
12. В итоге полная запись ОВР выглядит таким образом:
Метод электронно-ионного балансаМетод электронно-ионного баланса или метод полуреакций имеет отличие в том, что составляют два уравнения, используя молекулы или ионы, в состав которых входят окислитель, восстановитель и продукты реакции.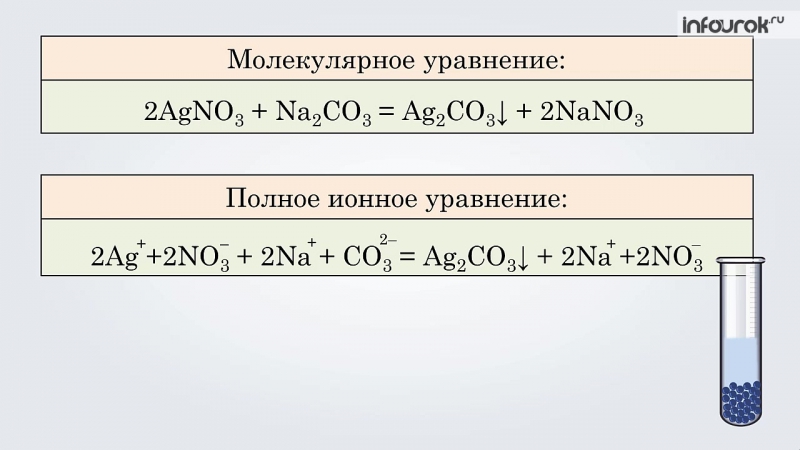
Пример, взаимодействие магния с концентрированной серной кислотой, где — окислитель за счет
Химические уравнения тест (8 класс) по химии онлайн
Последний раз тест пройден более 24 часов назад.
Для учителя
Вопрос 1 из 10
Реакция, уравнение которой H
2SO4 + CuS = CuSO4 + H2S является реакциейзамещения
разложения
обмена
соединения
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 2 из 10
Какое уравнение соответствует реакции замещения?
MgO + CO2 = MgCO3
2NaI + Cl2=2NaCl + I2
NaCl + AgNO3=NaNO3 + AgCl
СaСO3 = CO2 + CaO
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 3 из 10
Реакция, уравнение которой P
2O5 + 3H2O = 2H3PO4 является реакциейзамещения
разложения
обмена
соединения
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 4 из 10
Какое уравнение соответствует реакции обмена?
Na2CO3+ CO2 +H2O = 2NaHCO3
FeCl3+ 3NaOH = 3NaCl + Fe(OH)3
MgСO3 = CO2 + MgO
2Na + 2H2O = 2NaOH + H2
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 5 из 10
Реакция, уравнение которой 2H
2S + O2=2S + 2H2O является реакциейзамещения
разложения
- обмена
соединения
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 6 из 10
В соответствии с каким законом составляются уравнения химических реакций?
Закон постоянства состава вещества
Закон сохранения массы вещества
Периодический закон
Закон динамики
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 7 из 10
Взаимодействие серной кислоты и гидроксида алюминия: 3H
2SO4 + 2Al(OH)3 = Al2(SO4)3+ 6H2O относится к реакциизамещения
разложения
обмена
соединения
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 8 из 10
Реакция, уравнение которой 2KClO
3 = 2KCl + 3O2 является реакциейзамещения
разложения
обмена
соединения
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 9 из 10
Химическим уравнением называют:
Условную запись химической реакции
Условную запись состава вещества
Запись условия химической задачи
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 10 из 10
Реакция, уравнение которой 2HCl + Zn = ZnCl
2 + H2 является реакциейзамещения
разложения
обмена
соединения
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Доска почёта
Чтобы попасть сюда — пройдите тест.
Тесты «Химические уравнения» (8 класс) предназначены для подготовки учеников средней школы к занятиям по теме. Вопросы проверяют умение решать химические уравнения различной сложности, применяя знания о взаимодействии химических веществ. Представленные задания могут использовать ученики старших классов для повторения материала и подготовки к ЕГЭ по предмету. Решать задания можно онлайн. К тесту прилагаются правильные ответы, что позволяет сразу запоминать то, что «упущено».
Тест по химии «Уравнения реакций» – один из эффективных способов качественной подготовки к самостоятельным и контрольным работам, а также к текущим урокам.
Рейтинг теста
4.2
Средняя оценка: 4.2
Всего получено оценок: 4970.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Калькулятор чистого ионного уравнения — все шаги + примеры
Главная > Химические калькуляторы > Калькулятор чистого ионного уравнения
Калькулятор чистого ионного уравнения — это онлайн-инструмент, позволяющий «составить уравнение, отображающее только те молекулы или ионы, которые активно участвуют в реакции или те, которые претерпевают изменение». Калькулятор чистого ионного уравнения — отличный инструмент, чтобы увидеть активную молекулу в реакции.
Калькулятор чистого ионного уравнения — отличный инструмент, чтобы увидеть активную молекулу в реакции.
Суммарное ионное уравнение представляет только те ионы, которые фактически участвуют в химической реакции, исключая ионы-наблюдатели.
[Ионы-спектаторы — это ионы, которые не участвуют в химической реакции, а остаются неизменными как со стороны реагента, так и со стороны продукта полного ионного уравнения.] 20 важных уравнений, выберите любое из них, щелкнув раскрывающийся список, после выбора инструмент калькулятора чистого ионного уравнения покажет все шаги, связанные с вычислением чистого ионного уравнения для данного уравнения. Вы можете выполнить следующие простые шаги при расчете чистого ионного уравнения. Давайте разберемся с процессом написания суммарных ионных уравнений на примерах. Например, химическая реакция происходит между сульфатом меди (II) и хлоридом натрия в водной форме. Химическая формула сульфата меди (II) — CuSO 4 , а химическая формула хлорида натрия — NaCl. Химическая реакция между CuSO 4 и NaCl может быть представлена сбалансированным химическим уравнением, показанным ниже. Со стороны реагента CuSO 4 диссоциирует на ионы Cu 2+ и SO 4 2- в водном растворе. Аналогично 2 NaCl диссоциирует в водном растворе на 2 иона Na + и 2 Cl – . Со стороны продукта Na 2 SO 4 диссоциирует на 2 Na + и SO 4 2- , в то время как CuCl 2 представляет собой осадок (он находится в твердой форме), поэтому он не будет диссоциировать на соответствующие ионы и останется таким, какой он есть. Таким образом, приведенное выше химическое уравнение можно записать как полное ионное уравнение , как показано ниже. В уравнении выше видно, что 2 Na 9Ионы 0077 + и ион SO 4 2- остаются неизменными как со стороны реагента, так и со стороны продукта. Так как эти ионы не участвуют в химической реакции, они помечены как ионы-спектаторы. Убедитесь, что результирующее ионное уравнение является сбалансированным уравнением. Итак, сбалансированное результирующее ионное уравнение для этой реакции: расчет чистых ионных уравнений. Пример 1 кислота (НСl). Сбалансированное химическое уравнение реакции приведено ниже. NaOH диссоциирует на ионы Na + и OH – , а HCl диссоциирует на H + и Cl – на стороне реагента. В то время как со стороны продукта, NaCl также растворим в воде, поэтому он распадается на ионы Na + и Cl – в присутствии H 2 O. Таким образом, полное ионное уравнение для этой реакции: Это суммарное ионное уравнение показывает, что между водородом (H + ) и только ионы гидроксида (OH – ). Пример 2 Реакция нейтрализации происходит между гидроксидом магния Mg(OH) 2 и серной кислотой (H 2 SO 9 0065 4 ). Mg(OH) 2 диссоциирует на ионы Mg 2+ и 2 OH – при этом H 2 SO 4 диссоциирует на 2 H + и SO 4 2- на стороне реагента. В то время как со стороны продукта MgSO 4 образует водорастворимое ионное соединение, поэтому оно диссоциирует на ионы Mg 0065 3 ) 2 реагирует с йодидом калия (KI) с образованием нитрата калия и ярко-желтого осадка йодида свинца (PbI 2 ). Pb(NO 3 ) 2 диссоциирует на ионы Pb 2+ и 2 NO 3 – , а 2 KI диссоциирует на ионы Pb 2 иона K + и 2 I – на сторона реагента. gNO 3 ) с получением белого хлорида серебра ( AgCl ) выпадает в осадок, а нитрат натрия (NaNO 3 ) образуется в качестве побочного продукта. NaCl диссоциирует на ионы Na + и Cl – , а AgNO 3 диссоциирует на Ag + и NO 3 – 90 078 ионов на стороне реагента. NaNO 3 диссоциирует на ионы Na + и NO 3 – , в то время как AgCl остается неповрежденным на стороне продукта. Итак, полное ионное уравнение этой реакции:Ион 0077 – записывается в результирующем ионном уравнении. Это связано с тем, что по соглашению положительно заряженный катион записывается перед отрицательно заряженным ионом на стороне реагента при написании сводных ионных уравнений. Калькулятор чистого ионного уравнения 6 Как рассчитать результирующее ионное уравнение? 


 Сбалансированное химическое уравнение реакции приведено ниже.
Сбалансированное химическое уравнение реакции приведено ниже.  2 KNO 3 диссоциирует на 2 K + и 2 NO 3 – ионы, в то время как PbI 2 остается нетронутым со стороны продукта, так как представляет собой осадок. Таким образом, полное ионное уравнение этой реакции:
2 KNO 3 диссоциирует на 2 K + и 2 NO 3 – ионы, в то время как PbI 2 остается нетронутым со стороны продукта, так как представляет собой осадок. Таким образом, полное ионное уравнение этой реакции:
Вы также должны иметь в виду, что в дополнение к одинаковым молям элемента как со стороны реагента, так и со стороны продукта, положительные и отрицательные заряды также должны быть сбалансированы, в чем вы можете убедиться из любого из результирующих ионных уравнений, которые мы обсуждали в Эта статья.
Теперь давайте посмотрим на другой пример.
Пример 5
Хлорид меди (II) (CuCl 2 ) реагирует с фосфатом натрия (Na 3 PO 90 065 4 ) с образованием синего твердого осадка, известного как медь (II). фосфат и хлорид натрия. |
3 CuCl 2 диссоциирует на 3 Cu 2+ и 6 Cl – ионы 2 Na 3 PO 4 диссоциирует на 6 ионов Na + и 2 PO 4 3- на стороне реагента. 6 NaCl диссоциирует на ионы 6 Na + и 6 Cl – , в то время как Cu 3 (PO 4 ) 2 остается неизменным со стороны продукта. Таким образом, полное ионное уравнение для этой реакции:
Таким образом, полное ионное уравнение для этой реакции:
Положительные и отрицательные заряды в обеих частях ионного уравнения уравновешены.
Вы можете заметить, что положительные и отрицательные заряды также уравновешены в этом чистом ионном уравнении, то есть +6 и -6 соответственно в обеих частях уравнения.
Пример 6
Нитрат свинца Pb(NO 3 ) 2 реагирует с бромидом лития (LiBr). В результате образуются нитрат лития (LiNO 3 ) и бромид свинца (PbBr 2 ), как показано в химическом уравнении, приведенном ниже. |
Теперь в приведенном выше уравнении символы физического состояния всех реагентов и продуктов не указаны. В такой ситуации необходимо определить, какие из реагентов и продуктов растворимы в воде, а какие нет.
Применяя правила растворимости, мы определим, что бромид свинца появляется в виде белого твердого вещества при t. t.p. Он имеет очень низкую растворимость в воде, то есть 0,455 г на 100 г H 2 O . Следовательно, в описанной выше химической реакции образуется осадок PbBr 2 . Все остальные соединения растворимы в воде, поэтому они представляют собой водные растворы.
t.p. Он имеет очень низкую растворимость в воде, то есть 0,455 г на 100 г H 2 O . Следовательно, в описанной выше химической реакции образуется осадок PbBr 2 . Все остальные соединения растворимы в воде, поэтому они представляют собой водные растворы.
Pb(NO 3 ) 2 диссоциирует на Pb 2+ и 2 NO 3 – ионы, а 2 LiBr диссоциирует на 2 Li + и ионы 2 Br – со стороны реагента. 2 LiNO 3 диссоциирует на ионы 2 Li + и 2 NO 3 – , в то время как PbBr 2 остается недиссоциированным на стороне продукта. Таким образом, полное ионное уравнение этой реакции:
нитрат Ca(NO 3 ) 2 производит водный раствор нитрата натрия (NaNO 3 ) и йодида кальция (CaI 2 ).
Теперь в этой реакции не образуются осадки. Таким образом, все ионные соединения будут диссоциировать на свои ионы как на стороне реагента, так и на стороне продукта.
Таким образом, все ионные соединения будут диссоциировать на свои ионы как на стороне реагента, так и на стороне продукта.
2 NaI диссоциирует на 2 Na + и 2 I – , а Ca(NO 3 ) 2 диссоциирует на Ca 2+ и 2 NO 3 – ионов на стороне реагента. Со стороны продукта 2 NaNO 3 диссоциирует на ионы 2 Na + и 2 NO 3 – , в то время как CaI 2 распадается на ионы Ca 2+ и 2 I 90. 077 – ионов.
Все ионы здесь оказываются ионами-спектаторами, поэтому все ионы компенсируются. Значит, такой реакции нет. Так что никакого чистого ионного уравнения.
| Что представляет собой результирующее ионное уравнение? |
Суммарное ионное уравнение представляет только те ионы, которые фактически участвуют в химической реакции, исключая ионы-наблюдатели. |
| Что такое калькулятор чистого ионного уравнения? |
| Калькулятор чистого ионного уравнения представляет собой онлайн-инструмент, который показывает «химическое уравнение», «полное ионное уравнение», «Отмену ионов-спектаторов» и «Чистое ионное уравнение». |
| В чем разница между сбалансированным и чистым ионным уравнением? |
Сбалансированное уравнение показывает все подробности о видах, которые находятся в системе. Он дает фактическое количество молекул каждого реагента и продукта. В то время как итоговое ионное уравнение показывает только вещества, участвующие в реакции, оно не показывает ионы зрителя. Вы можете легко сбалансировать химическое уравнение, используя этот инструмент, указанный ниже – |
| 1 | Найдите число нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите число нейтронов | Fe | |
| 6 | Найдите число нейтронов | ТК | |
| 7 | Найти электронную конфигурацию | Х | |
| 8 | Найдите число нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Найдите количество протонов | Х | |
| 12 | Найдите число нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найти электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите число нейтронов | № | |
| 20 | Найдите число нейтронов | Золото | |
| 21 | Найдите число нейтронов | Мн | |
| 22 | Найдите число нейтронов | Ру | |
| 23 | Найти электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найдите числа окисления | Н_2О | |
| 28 | Найти электронную конфигурацию | К | |
| 29 | Найти электронную конфигурацию | Мг | |
| 30 | Найти электронную конфигурацию | Са | |
| 31 | Найдите число нейтронов | Рх | |
| 32 | Найдите число нейтронов | Нет | |
| 33 | Найдите число нейтронов | Пт | |
| 34 | Найдите число нейтронов | Быть | Быть |
| 35 | Найдите число нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите число нейтронов | Медь | |
| 41 | Найдите число нейтронов | С | |
| 42 | Найдите числа окисления | Х | |
| 43 | Весы | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите число нейтронов | Пн | |
| 47 | Найдите число нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найти электронную конфигурацию | Fe | |
| 51 | Найти электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите количество нейтронов | Н | |
| 56 | Найдите число нейтронов | Ли | |
| 57 | Найдите число нейтронов | В | |
| 58 | Найдите количество протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найти плотность на STP | Н_2О | |
| 63 | Найдите числа окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | Пд | |
| 70 | Найдите число нейтронов | рт. |
