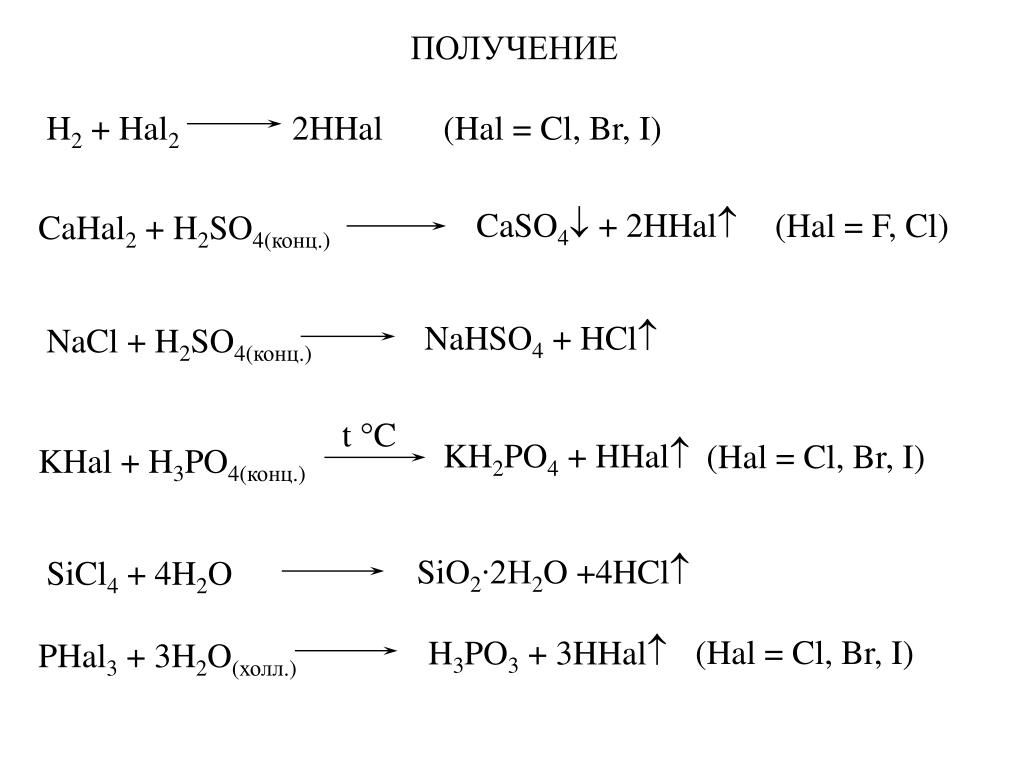
149 вариант 7 (1) MnSO4 + NaHSO4 + h3O + Cl2 MnO2 + NaCl + h3SO4 Mn+2 Cl20 Mn+4 Cl-
Контрольная работа, Химия Работа проверена: yanaNiK81 Время решения: 4 мин Сложность: 3.6
149 вариант
7 (1)
MnSO4 + NaHSO4 + h3O + Cl2 MnO2 + NaCl + h3SO4
Mn+2 Cl20 Mn+4 Cl-
Запишем полуреакции, при этом не забываем, что происходит в нейтральной среде, поэтому в полуреакции допишем воду.
Mn2+ + 2h3O -2e =>MnO2 + 4H+ 2 1 восстановитель, окисления
Cl20 +2e => 2Cl- 2 1 окислитель, восстановление
Просуммируем полуреакции
Mn2+ + 2h3O + Cl20 => MnO2 + 4H+ + 2Cl-
Дописываем недостающие ионы и составляем молекулярное уравнение, указываем переход электронов
MnSO4 + 2NaHSO4 + 2h3O + Cl2 => MnO2 + 2NaCl + 3h3SO4
2 e
Выпишем стандартные потенциалы полуреакций:
0 (MnO2 + 4H+ +2e / Mn2+ + 2h3O ) =1,23 В ( восстановитель)
0(Cl20 +2e/ 2Cl- ) = 1,359 В (окислитель)
Так как 0(окислителя) > 0( восстановителя) значит возможно ПРЯМОЕ направление данной реакции
Докажем термодинамическими расчетами.
 Схематически гальванический элемент будет записываться:
A (-) Pb | Pb2+ || Cu2+|| Cu (+) K
На электродах будут протекать следующие процессы:
АНОД: Pb0 – 2e => Pb+2 1 восстановитель, окисление
КАТОД: Cu2+ + 2e => Cu0 1 окислитель, восстановление
Токообразующая реакция :
Pb0 + Cu2+ => Pb2+ + Cu0
В данном гальваническом элементе свинец является восстановителем, а медь –окислителем.
ЭДС гальванического элемента рассчитывается по формуле:
ЭДС = Eкатода – Еанода
ЭДС = 0,337 – (-0,126) = 0,463 В
Изменение величины энергии Гиббса рассчитывается по формуле: ∆G0298 = -nFE , где
n- число электронов, принимающих участие в реакции;
F – постоянная Фарадея 96500 Кл
Е – ЭДС гальванического элемента
∆G0298 = – 2 * 96500 * 0,463 = – 89 359 Дж/моль = – 89,359 кДж/моль
Так как ∆G0298 < 0 , значит данная реакция протекает в прямом направлении ( слева направо), т.е. данная реакция (токообразующая) осуществима.
9 (17)
Электролиз раствора CuBr2
Бромид меди диссоциирует :
CuBr2 => Cu2+ + 2Br –
(-) катод (+) анод
Cu2+; h3O Br -; h3O
Eo(Cu2+/Cu) = 0,34 В Eo(O2/2h3O) =1,8 В
Eo(2h3О/h3) = -1,0 В Eo(Br20/2Br-) = 1,07В
Так как Eo(Cu2+/Cu) > Eo(2h3О/h3) идет процесс восстановления катионов меди Через 2-3 мин.
Схематически гальванический элемент будет записываться:
A (-) Pb | Pb2+ || Cu2+|| Cu (+) K
На электродах будут протекать следующие процессы:
АНОД: Pb0 – 2e => Pb+2 1 восстановитель, окисление
КАТОД: Cu2+ + 2e => Cu0 1 окислитель, восстановление
Токообразующая реакция :
Pb0 + Cu2+ => Pb2+ + Cu0
В данном гальваническом элементе свинец является восстановителем, а медь –окислителем.
ЭДС гальванического элемента рассчитывается по формуле:
ЭДС = Eкатода – Еанода
ЭДС = 0,337 – (-0,126) = 0,463 В
Изменение величины энергии Гиббса рассчитывается по формуле: ∆G0298 = -nFE , где
n- число электронов, принимающих участие в реакции;
F – постоянная Фарадея 96500 Кл
Е – ЭДС гальванического элемента
∆G0298 = – 2 * 96500 * 0,463 = – 89 359 Дж/моль = – 89,359 кДж/моль
Так как ∆G0298 < 0 , значит данная реакция протекает в прямом направлении ( слева направо), т.е. данная реакция (токообразующая) осуществима.
9 (17)
Электролиз раствора CuBr2
Бромид меди диссоциирует :
CuBr2 => Cu2+ + 2Br –
(-) катод (+) анод
Cu2+; h3O Br -; h3O
Eo(Cu2+/Cu) = 0,34 В Eo(O2/2h3O) =1,8 В
Eo(2h3О/h3) = -1,0 В Eo(Br20/2Br-) = 1,07В
Так как Eo(Cu2+/Cu) > Eo(2h3О/h3) идет процесс восстановления катионов меди Через 2-3 мин.
Часть выполненной работы
Fe Катод Mn анод
0Fe2+/Fe = -0,44В
Fe = 0. 11
2H+ +2e =h30
К = К0 – К
2H+/h3(на Fe) = 02H+/h3 =
= 0 – 0,2 = – 0,2 В 0Mn2+/Mn = -1,18В
Mn = 0.5
Mn0 -2e => Mn2+
А = А0 + A
Mn…
11
2H+ +2e =h30
К = К0 – К
2H+/h3(на Fe) = 02H+/h3 =
= 0 – 0,2 = – 0,2 В 0Mn2+/Mn = -1,18В
Mn = 0.5
Mn0 -2e => Mn2+
А = А0 + A
Mn…
Подробнее
Катодолюминесцентные свойства Gd2O3:Eu3+ в мезопористом SiO2
Дипломная работа, Электроника, электротехника, радиотехника
Выполнил: Zemi
№ 212 Реакции выражаются схемами а) K2Cr2O7 + Al + h3SO4 → K2SO4 + Cr2(SO4)3 + Al2(SO4)3 + h3O
Контрольная работа, Химия
Выполнил: vladmozdok
Так же вы можете купить уже выполненные похожие работы. Для удобства покупки работы размещены на независимой бирже. Подробнее об условиях покупки тут.
Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
»,сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
\\circ }{\\text{C}}$ D. Ничего из вышеперечисленногоДата последнего обновления: 14 апреля 2023
•
Всего просмотров: 275,1 тыс.
•
Просмотров сегодня: 5,45 тыс.
2 Ответ
Проверено
275,1 тыс.+ просмотров
Подсказка: Реакция хлорида металла и серной кислоты приводит к образованию соляной кислоты в качестве побочного продукта. Реакция протекает при низкой или нормальной температуре.
Полный ответ:
Хлорид металла реагирует с концентрированной серной кислотой с образованием соляного газа в качестве побочного продукта. 9\circ }{\text{C}}$ температуры, поэтому вариант (C) неверен.
Итак, правильный ответ (А).
Дополнительная информация: Соляная кислота также известна как хлорид гидроксония. Общее название соляной кислоты – соляная кислота. Это сильная кислота. Соляная кислота также присутствует в пищеварительном соке желудка человека.
Общее название соляной кислоты – соляная кислота. Это сильная кислота. Соляная кислота также присутствует в пищеварительном соке желудка человека.
Соляная кислота образуется в результате реакции газообразного водорода с газообразным хлором в присутствии солнечного света. Реакция выглядит следующим образом: 9\circ}{\text{C}}$ температура или выше.
Недавно обновленные страницы
Большинство эубактериальных антибиотиков получено из биологии ризобий класса 12 NEET_UG
Саламиновые биоинсектициды были извлечены из биологии класса 12 А 0002 Сточные воды или муниципальные канализационные трубы не должны быть непосредственно 12 класса биологии NEET_UG
Очистка сточных вод выполняется микробами A B Удобрения 12 класса биологии NEET_UG
Иммобилизация фермента – это конверсия активного фермента класса 12 биологии NEET_UG
Большинство эубактериальных антибиотиков получают из биологического класса Rhizobium 12 NEET_UG
Саламиновые биоинсектициды были извлечены из биологического класса А 12 NEET_UG
12 класс биологии NEET_UG
Канализационные или городские канализационные трубы не должны быть напрямую 12 класс биологии NEET_UG
Очистка сточных вод выполняется микробами A B Удобрения 12 класс биологии NEET_UG
Иммобилизация фермента — это преобразование активного фермента класса 12 в биологии NEET_UG
Тенденции сомнений
Первым этапом производства соды по методу Ле Блана является следование приведенной ниже реакции.
 сделано согласно. 2 NaCl + h3SO4 —> NaCl + NaHSO4 + HClПервым этапом производства соды по методу Ле Блана является реакция, механизм которой приведен ниже. сделано согласно. 2 NaCl + h3SO4 —> NaCl + NaHSO4 + HCl Количество 78%-ного h3SO4, используемого в реакции, на 8% больше теоретического количества, необходимого для реакции. подается в систему. Реакция протекает со 100% эффективностью и при расходе 1600 кг NaCl в сутки; а. Требуемое количество h3SO4, б. Количество произведенного NaHSO4
сделано согласно. 2 NaCl + h3SO4 —> NaCl + NaHSO4 + HClПервым этапом производства соды по методу Ле Блана является реакция, механизм которой приведен ниже. сделано согласно. 2 NaCl + h3SO4 —> NaCl + NaHSO4 + HCl Количество 78%-ного h3SO4, используемого в реакции, на 8% больше теоретического количества, необходимого для реакции. подается в систему. Реакция протекает со 100% эффективностью и при расходе 1600 кг NaCl в сутки; а. Требуемое количество h3SO4, б. Количество произведенного NaHSO4Вопрос
Первый шаг в производстве газированных напитков по методу Ле Блана состоит в том, чтобы следовать приведенной ниже реакции. сделано согласно. 2 NaCl + h3SO4 —> NaCl + NaHSO4 + HClПервым этапом производства соды по методу Ле Блана является реакция, механизм которой приведен ниже. сделано согласно. 2 NaCl + h3SO4 —> NaCl + NaHSO4 + HCl Количество 78%-ного h3SO4, используемого в реакции, на 8% больше теоретического количества, необходимого для реакции. подается в систему. Реакция протекает со 100% эффективностью и при расходе 1600 кг NaCl в сутки; а. Требуемое количество h3SO4, б. Количество произведенного NaHSO4
Требуемое количество h3SO4, б. Количество произведенного NaHSO4
Шаг за шагом Ответ:
Шаг 1/6
а. Требуемое количество h3SO4:
Этап 2/6
Сначала нам нужно рассчитать теоретическое количество h3SO4, необходимое для реакции. Из сбалансированного уравнения видно, что 2 моля NaCl реагируют с 1 молем h3SO4.
Шаг 3/6
Следовательно, для 1600 кг NaCl нам потребуется:
1600 кг NaCl x (1 моль NaCl/58,44 г NaCl) x (1 моль h3SO4/2 моль NaCl) x (98,08 г h3SO4/1 моль h3SO4) = 44 800 кг h3SO4
Это теоретическое количество h3SO4, необходимое для реакции. Однако нам говорят, что используется на 8% больше h3SO4, чем это количество. Таким образом, фактическое количество используемого 78% h3SO4 будет:
44 800 кг h3SO4 x 1,08 = 48 384 кг h3SO4
Рекомендация видео с лучшим совпадением:
Решено проверенным экспертом
У нас нет заданного вами вопроса, но вот рекомендуемое видео, которое может помочь.