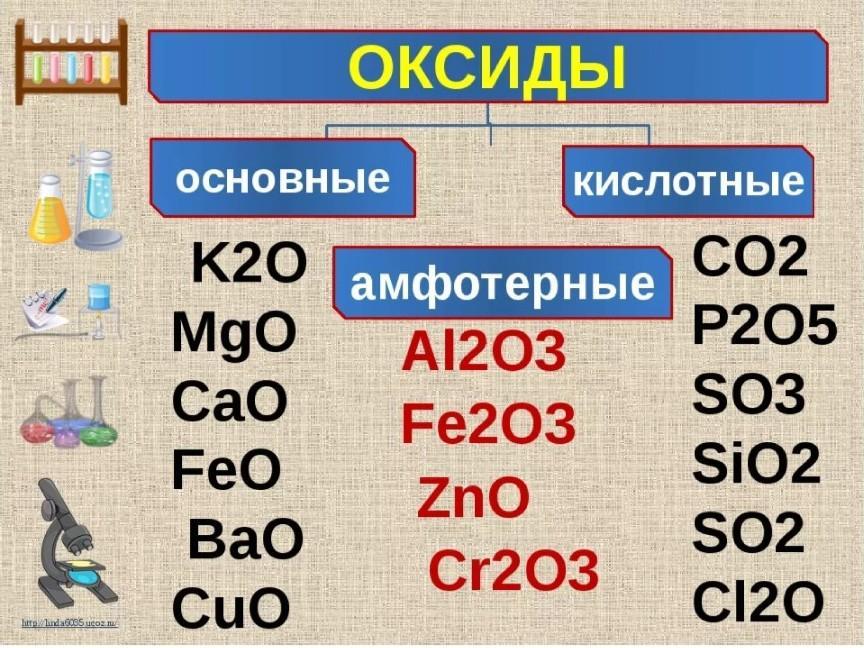
Формула оксида калия (K2O), свойства, риски и использование / химия | Thpanorama
оксид калия, также называется оксидом калия, ионная кислородно-калиевая соль, формула которой K2О. Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
К2Или это самый простой оксид калия, это очень реактивное и редко встречающееся соединение. Некоторые коммерческие материалы, такие как удобрения и цементы, испытывают, предполагая процентное содержание состава, которое будет эквивалентно смеси химических соединений K2О.
Оксид калия получают из гидроксида калия (едкого кали) и металлического калия при 450 ° C с образованием молекулярного водорода (ОКСИД КАЛИЯ K2O, S.F.) в соответствии с уравнением:
2K + 2KOH ⇌ 2K2O + H2 (450 ° С).
Его также получают путем восстановления пероксида калия в соответствии с реакцией:
2K2О2 → К2O + O2 (530 ° С).
Другим способом получения оксида калия является нагревание карбоната калия при высокой температуре, как показано следующей реакцией:
К2Колорадо3 ⇌ К2O + CO2 (Т> 1200 ° С).
Однако основным способом получения оксида калия является нагревание нитрата калия для получения молекулярного азота, как показано следующей реакцией:
2KNO3 + 10K → 6K2O + N2
индекс
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 3 использования
- 4 Ссылки
Оксид калия — это желтоватые тетраэдрические кристаллы без характерного аромата (Национальный центр биотехнологической информации, 2017). Его внешний вид показан на рисунке 2 (американские элементы, С.Ф.).
Соединение имеет молекулярную массу 94,2 г / моль и плотность 2,13 г / мл при 24 ° С. Он имеет температуру плавления 740 ° C, хотя начинает разлагаться при 300 ° C (Royal Society of Chemistry, 2015).
Соединение устойчиво к нагреванию и растворим в этаноле и эфире. К2Или он кристаллизуется в структуре антифторита. По этой причине положения анионов и катионов меняются местами относительно их положений в CaF. 2, с ионами калия, координированными до 4 оксидных ионов, и ионами оксида, скоординированными с 8 калиями.
2, с ионами калия, координированными до 4 оксидных ионов, и ионами оксида, скоординированными с 8 калиями.
К2Или это основной оксид и бурно реагирует с водой с образованием едкого гидроксида калия. Он распух и поглощает воду из атмосферы, инициируя эту энергичную реакцию.
Оксид калия обратимо окисляется до пероксида калия при 350 ° С, бурно реагирует с кислотами, такими как соляная кислота, с образованием солей калия в соответствии с реакцией:
К2O + 2HCl → 2KCl + H2О.
Соединение реагирует с диоксидом азота с образованием нитрата и нитрита калия при температуре от 150 до 200 ° C:
К2O + 2NO2 = КНО2 + KNO3
Оксид калия реагирует при низких температурах с аммиаком с образованием амидов и гидроксида калия в соответствии с реакцией:
К2O + NH3 (l) → KNH2↓ + KOH (-50 ° C).
Реактивность и опасностиОксид калия является нестабильным веществом. Он легко окисляется до других оксидов калия, пероксида или до окиси калия (KHO). Соединение не является горючим, но активно и экзотермически реагирует с водой с образованием гидроксида калия (KOH).
Он легко окисляется до других оксидов калия, пероксида или до окиси калия (KHO). Соединение не является горючим, но активно и экзотермически реагирует с водой с образованием гидроксида калия (KOH).
Раствор оксида калия в воде является сильным основанием, бурно реагирует с кислотой и вызывает коррозию. Бурно реагирует с водой, образующей гидроксид калия. Атакует многие металлы в присутствии воды (Национальный институт безопасности и гигиены труда, 2014).
Вещество разъедает глаза, кожу и дыхательные пути, а также при попадании в организм. Вдыхание аэрозоля может вызвать отек легких. Симптомы отека легких часто проявляются лишь через несколько часов и усиливаются при физической нагрузке..
В случае попадания в глаза вам следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза должны быть промыты проточной водой в течение не менее 15 минут с открытыми веками. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите жертву под безопасный душ.
Поместите жертву под безопасный душ.
Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, аккуратно и осторожно промойте кожу, загрязненную проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
Если контакт с кожей серьезный, его следует промыть дезинфицирующим мылом и покрыть кожу, загрязненную антибактериальным кремом..
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание серьезное, пострадавшего следует как можно скорее эвакуировать в безопасное место..
Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста.
Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
В случае проглатывания не вызывать рвоту. Ослабьте тесную одежду, такую как воротники рубашки, ремни или галстуки. Если пострадавший не дышит, проведите реанимацию из уст в уста. Во всех случаях следует немедленно обратиться за медицинской помощью (IPCS, S.F.).
приложенийХимическая формула К2O (или просто «K») используется в нескольких промышленных контекстах: числа N-P-K для удобрений, в формулах цемента и в формулах стекла.
Оксид калия часто не используется непосредственно в этих продуктах, но количество калия указывается в терминах K-эквивалентов.2Или для любого типа используемых соединений калия, таких как карбонат калия.
Оксид калия составляет около 83% калия по весу, а хлорид калия — только 52%. Хлорид калия обеспечивает меньше калия, чем равное количество оксида калия.
Поэтому, если удобрением является хлорид калия в количестве 30% по весу, его стандартный индекс калия, основанный на оксиде калия, будет составлять только 18,8%. Он производится и / или импортируется от 10 до 100 тонн в год этого вещества в Европейском экономическом пространстве.
Он производится и / или импортируется от 10 до 100 тонн в год этого вещества в Европейском экономическом пространстве.
Это вещество используется в лабораторных химикатах, удобрениях, полимерах и фитосанитарных продуктах. К2Или это имеет промышленное использование, которое приводит к производству другого вещества (использование промежуточных продуктов).
Оксид калия используется в областях приготовления смесей и / или переупаковки, а также в сельском хозяйстве, лесном хозяйстве и рыболовстве. Это вещество используется для производства химических продуктов, пластмассовых изделий и минеральных продуктов (например, гипса, цемента)..
Выброс в окружающую среду оксида калия, вероятно, произойдет для промышленного использования: в качестве промежуточного этапа при производстве другого вещества (использование промежуточных продуктов), составления смесей, в качестве вспомогательного средства для обработки и промышленной обработки на истирание с низкой скоростью. выпуска, резки, механической обработки или полировки металла).
Возможно, что другое высвобождение в окружающую среду этого вещества путем его использования во внутренних помещениях, например, моющих жидкостей / моющих средств, автомобильных средств по уходу, краски и покрытия или клеи, ароматизаторы и освежители воздуха..
Также для использования внутри помещений в закрытых системах с минимальным выбросом, таких как охлаждающие жидкости в холодильниках, электрические нагреватели на масляной основе.
Оксид калия используется на открытом воздухе в долговременных материалах с низкой скоростью высвобождения, например, в строительных материалах и конструкциях из металла, дерева и пластика..
В помещении он используется в долговечных материалах с низкой скоростью высвобождения, таких как мебель, игрушки, строительные материалы, занавески, обувь, кожгалантерея, бумажные и картонные изделия, электронное оборудование..
Это вещество можно найти в изделиях из камня, гипса, цемента, стекла или керамики (например, посуду, кастрюли / сковородки, контейнеры для хранения продуктов питания, строительные и изоляционные материалы) (Европейское химическое агентство, 2017).
Оксид калия является термостойким, крайне нерастворимым источником калия, подходящим для стекла, оптики и керамики. Оксидные соединения не приводят к электричеству.
Однако некоторые структурированные оксиды перовскита являются электронными проводниками, которые находят применение в катоде твердооксидных топливных элементов и системах генерации кислорода..
Они представляют собой соединения, которые содержат, по меньшей мере, один кислородный анион и один катион металла. Они чрезвычайно стабильны, что делает их полезными для изготовления керамических конструкций, таких как глиняные миски или для продвинутой электроники.
Он также используется в легких конструкционных компонентах в аэрокосмической и электрохимической промышленности, таких как топливные элементы, в которых они проявляют ионную проводимость..
Металлооксидные соединения являются основными ангидридами и поэтому могут вступать в реакцию с кислотами и сильными восстановителями в окислительно-восстановительных реакциях. .
.
- Американские элементы. (S.F.). Оксид калия. Восстановленный от americanelements.com.
- EMBL-EBI. (2016, 19 сентября). оксид калия. Взято из ЧЕБИ: ebi.ac.uk.
- Европейское химическое агентство. (2017, 12 января). Двуокись оксида. Получено с echa.europa.eu.
- (S.F.). ОКСИД КАЛИЯ . Восстановлено с inchem.org.
- Национальный центр биотехнологической информации … (2017, 29 апреля). База данных PubChem Compound; CID = 9989219. Получено из pubchem.ncbi.nlm.nih.gov.
- Национальный институт охраны труда и здоровья. (2014, 1 июля). ОКСИД КАЛИЯ. Восстановлено из cdc.gov.
- КАЛИЯ ОКСИД K2O. (S.F.). Получено с allreactions.com.
- Королевское химическое общество. (2015). Калий окись калия. .
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
h3s+o2=> so2+h3o помогите составить коэффициенты медотом ОВР
Плотность газообразного органического вещества такая же , как и плотность этана, а массовые доли углерода и кислорода в нем составляют соответственно. ..
..
Осуществите превращения: гексан→ 1,6-дихлоргексан → циклогексан → трихлорциклогексан.
Решено
определите тип химической связи в следующих веществах : F2, O2, HI, NaH, Ch5
Пользуйтесь нашим приложением
K2O (оксид калия)
| Ежемесячная техническая подсказка от Тони ХансенаSignUp | Нет отслеживания ! Нет объявлений ! Вот почему эта страница загружается быстро! |
Данные
| Коэффициент линейного расширения | 0,331 |
|---|---|
| FRIT SOFTENING POIT (50% диоксид кремния) | 398C |
Примечания
— Вместе с оксидами натрия и лития классифицируется как одна из щелочных групп. Цветные глазури, в составе флюса которых преобладает щелочь, имеют тенденцию быть визуально интенсивными, особенно при низком содержании глинозема.
-K 2 O считается вместе с натрием, так как они почти всегда встречаются вместе и имеют очень похожие свойства. Вместе они часто обозначаются как KNaO. K 2 O обычно способствует более высокой вязкости расплава, чем Na 2 O.
— Это важный вспомогательный флюс в высокотемпературных глазурях.
— Это тяжелый оксид, который обычно содержит самые яркие цвета из всех флюсов, кроме свинца. Его обычно предпочитают даже соде из-за более блестящей глянцевой глазури и большей дальности обжига. Очень хорошие цветные глазури могут быть получены с преобладающей формулой K 2 O-PbO-SiO 2 .
— Считается очень стабильным и предсказуемым оксидом.
— Как и натрий, он обладает очень высоким коэффициентом расширения, что в больших количествах способствует крейзингу, но не так сильно, как натрий. Таким образом, глазури с высоким содержанием щелочи почти всегда трескаются. Если от этого зависит цвет (например, медно-синий), то может потребоваться регулировка корпуса для устранения растрескивания (поскольку уменьшение содержания щелочи для уменьшения растрескивания будет означать потерю цвета).
— Щелочи могут повышать растворимость свинца.
Звенья
| Цвет глазури | Щелочные глазури с барием и небольшим количеством Mn могут давать розовый цвет. |
|---|---|
| Цвет глазури | Восстанавливающие глазури тэнмоку против черной ржавчины с содержанием железа 8-10% хорошо работают в глазури с высоким содержанием калия. |
| Краситель для глазури | 0,5-1,0% железа в глазури для восстановления калия может придать глазури оттенок от нежно-голубого до сине-зеленого. |
| Цвет глазури | Медно-красные восстановительные глазури лучше всего подходят для составов с высоким содержанием щелочи. Присутствие бора может дать более приятный красный цвет. |
| Цвет глазури | Окисляющий медно-голубой цвет лучше всего подходит для глазурей с высоким содержанием щелочи и низким содержанием глинозема. Увеличение содержания меди до 4-6% сместит цвет в сторону бирюзы. Увеличение содержания меди до 4-6% сместит цвет в сторону бирюзы. |
| Цвет глазури | Кобальтовый синий цвет может быть очень интенсивным в щелочных глазурях (до 2% кобальта). |
| Цвет глазури | Щелочные глазури с преобладанием щелочи будут давать фиолетовый, пурпурный, бордовый, красно-синий цвет с использованием диоксида марганца до 2%. |
| Автор: Тони Хансен Следуйте за мной на |
Расскажите нам, как улучшить эту страницу
Или задайте вопрос, и мы изменим эту страницу, чтобы лучше ответить на него.
Адрес электронной почты
Имя
Субъект
Сообщение
Сообщение Введите это, чтобы доказать, что вы не робот или Обновление
Оставьте следующее пустым
https://digitalfire.com, все права защищены
Политика конфиденциальности
Структура, формула, свойства и применение
Знаете ли вы, какой металл после натрия является наиболее активным? Нет? Это калий! Калий подобен натрию, т. е. очень реактивен, мягок и энергичен. Из-за своей реакционной способности его держат в керосине. Подобно натрию, калий также реагирует с кислородом и образует оксид калия. Но можете ли вы ответить, является ли оксид калия ионным или ковалентным? Является ли это соединение кислотным или основным? Каковы применения оксида калия?
е. очень реактивен, мягок и энергичен. Из-за своей реакционной способности его держат в керосине. Подобно натрию, калий также реагирует с кислородом и образует оксид калия. Но можете ли вы ответить, является ли оксид калия ионным или ковалентным? Является ли это соединение кислотным или основным? Каковы применения оксида калия?
Этот раздел позволит вам ответить на все подобные вопросы об оксиде калия.
Что такое оксид калия?
Оксид калия представляет собой соединение, образованное связью между кислородом и калием. Он также известен как дикалийоксид или монооксид калия. Это неорганическое соединение. Как и оксид натрия, оксид калия также является очень реакционноспособным и редко встречающимся соединением.
Легко догадаться, является ли оксид калия ионным или ковалентным. Во-первых, калий — это металл, а металлы электроположительны, а кислород — один из сильно электроотрицательных элементов. Итак, происходит поляризация, и образующееся соединение является ионным.
Во-вторых, это объясняется структурой Льюиса оксида калия, которая объясняется далее.
Структура и формула оксида калия
Молекулярная формула оксида калия – K₂O. В общих чертах оксид калия называют оксидом щелочного металла. Это простейшее соединение калия, обладающее высокой реакционной способностью.
Это соединение является ионным соединением. Это связано с тем, что калий имеет только один электрон на внешней оболочке, а кислороду не хватает двух электронов, чтобы получить заполненный октет. Следовательно, два атома калия будут отдавать свои электроны атому кислорода и образовывать ионные связи. В результате форма соединения также является ионной.
Структура Льюиса оксида калия представлена ниже:
Ион калия имеет заряд +1, тогда как ион кислорода имеет заряд -2. Для электрически нейтрального соединения заряды должны уравновешивать друг друга. Следовательно, два атома К необходимы, чтобы уравновесить заряд -2 на атоме О. В результате формула оксида калия — K₂O.
Получение оксида калия
Некоторые методы получения оксида калия:
1. С помощью пероксида калия:
- Полученный продукт представляет собой оксид калия при взаимодействии пероксида калия, т.е. K2O2, с металлическим калием.
K₂O₂ + 2K → 2K₂O
- При нагревании пероксида калия при 500°C он разлагается на чистый оксид калия и молекулы кислорода.
2K₂O₂ → 2K₂O + O₂ ↑
2. С помощью нитрата калия:
При обработке нитрата калия металлическим калием образуется оксид калия с выделением газообразного азота. Этот способ более выгоден, чем первый.
2KNO₃ + 10K → 6K₂O + N₂ ↑
3. С помощью гидроксида калия:
Гидроксид калия не может быть дополнительно дегидратирован до оксида. Но он может реагировать с расплавленным калием с образованием оксида калия и выделением водорода в качестве побочного продукта.
2KOH + 2K ⇌ 2K₂O + H₂ ↑
4. С помощью металлического калия:
При взаимодействии металлического калия с кислородом образуется оксид калия. Эта реакция представлена как
Эта реакция представлена как
4K + O₂ → 2K₂O
Физические свойства оксида калия
Калий является членом семейства натрия, т. е. группы I периодической таблицы. Он имеет тенденцию завершать свой октет, высвобождая электроны. Поэтому он очень реактивен в свободной форме. Когда он обрабатывается кислородом, он легко образует связь с атомом О и образует оксид калия. Некоторые физические свойства оксида калия:
- Это бледно-желтое или белое кристаллическое и твердое соединение.
- Молярная масса оксида калия составляет 9.4,2 г/моль.
- Широко используется как удобрение.
- Плотнее воды. А плотность оксида калия составляет 2,35 г/см³.
- Это соединение без запаха.
- Разлагается при 740°C.
- Растворим в этаноле и диэтиловом эфире.
- Теплоемкость оксида калия 83,62 Дж/моль·К.
- Молекулы оксида калия образуют антифлюоритную структуру.
Химические свойства оксида калия
Химические свойства соединения – это свойства, которые изменяют химический состав соединения. Поскольку калий является высокореактивным металлом, оксид калия является реакционноспособным соединением и может бурно реагировать.
Поскольку калий является высокореактивным металлом, оксид калия является реакционноспособным соединением и может бурно реагировать.
- Реакция оксида калия с избытком воды становится сильно коррозионной, и соединение образует гидроксид калия.
K₂O + H₂O → KOH
- Это оксид металла, и обычно оксиды металлов являются основными. Следовательно, он является основным или щелочным и очень агрессивным.
- Оксид калия при взаимодействии с сильными кислотами дает соль и воду. Эта реакция показывает, что оксид калия является основным соединением.
K2O + HCl → KCl + H2O
K2O + H2SO4 → K2SO4 + H2O
K2O + HNO3 → 2KNO3 + H2O
Эти реакции являются примерами реакций нейтрализации.
- При нагревании выше 300°C оксид калия превращается в пероксид калия и металлический калий.
2K₂O → K₂O₂ + 2K
Использование и применение оксида калия
Он очень активен и легко реагирует с влагой. Он используется для различных целей. Некоторые из них
Он используется для различных целей. Некоторые из них
- В сельском хозяйстве оксид калия широко используется в качестве удобрения.
- Он также используется в рецептурах для производства стекла и в цементной промышленности.
- Оксид калия нерастворим в воде и является очень стабильным соединением. Это свойство делает его удобным в керамической промышленности.
- Используется врачами-зоотехниками при лечении болезней животных.
- Как правило, он известен как чистый калий и используется для изготовления очков и мыла.
- В аэрокосмической промышленности оксид калия используется для изготовления конструкционных компаундов и облегченных чаш.
- Подобно зигомицетам и др., грибковым инфекциям, оксид калия используется для лечения таких инфекций.
- В небольших количествах оксид калия также используется в некоторых лекарствах.
Меры безопасности при использовании оксида калия
Оксид калия можно использовать для различных целей, но его высокая реакционная способность делает его опасным химическим веществом. Поэтому при работе с ним необходимо соблюдать меры предосторожности. Однако, если вы каким-либо образом соприкоснулись с оксидом калия, необходимо немедленно принять меры по оказанию первой помощи. это
Поэтому при работе с ним необходимо соблюдать меры предосторожности. Однако, если вы каким-либо образом соприкоснулись с оксидом калия, необходимо немедленно принять меры по оказанию первой помощи. это
1. При попадании в глаза оксида калия:
- Немедленно промыть глаза большим количеством воды в течение не менее 30 минут.
- Промойте глаза, поднимая и опуская веки.
- Во время промывания глаз, если вы носили контактные линзы, снимите их.
- Немедленно обратитесь за медицинской помощью.
2. При попадании на кожу оксида калия:
- Как можно быстрее снимите всю загрязненную одежду.
- Немедленно промойте зараженный участок большим количеством воды.
- Немедленно обратитесь за медицинской помощью.
3. Если вы вдохнули оксид калия:
- Удалите человека, подвергшегося воздействию оксида калия, с его места.
- Начните оказание первой помощи, обеспечив ему искусственное дыхание, если его дыхание остановилось.

- Если его сердце перестало работать, сделайте ему сердечно-легочную реанимацию.
- Срочно доставить в медицинское учреждение.
Заключение
Прочитав приведенную выше статью, вы теперь хорошо осведомлены об оксиде калия. Оксид калия представляет собой неорганическую кислоту с высокой реакционной способностью. Формула оксида калия K₂O. Он имеет основную или щелочную природу. Дает реакции нейтрализации при обработке сильными кислотами. Из-за своих различных свойств он используется в основном в качестве удобрения в сельском хозяйстве. Это полезно в стекольной, керамической и оптической промышленности. Он становится токсичным при проглатывании и вдыхании. Из-за его токсичности необходимо соблюдать меры предосторожности при работе с ним.
Часто задаваемые вопросы
1. Сколько типов оксидов образует калий на воздухе? A. Когда калий подвергается воздействию воздуха (то есть кислорода), он образует три типа оксидов. Образование оксида зависит от наличия кислорода во время реакции.
Образование оксида зависит от наличия кислорода во время реакции.
- Окись калия, K₂O
- Пероксид калия, K₂O₂
- Супероксид калия, KO₂
Реакция протекает как
8K + 4O₂ → 2K2O+ 2KO₂ + K₂O₂
2. Что такое супероксид калия?A. Супероксид калия представляет собой неорганическое соединение с химической формулой KO₂. Степень окисления кислорода в KO₂, супероксиде калия, равна -1. Это парамагнитное твердое вещество желтого цвета, разлагающееся во влажном воздухе. Он имеет другие химические и физические свойства, чем оксид калия или пероксид калия.
3. Опасен ли оксид калия для здоровья?A. Оксид калия представляет собой неорганическое соединение с химической формулой K₂O. Он очень коррозионно-активен во влаге и воздухе. Таким образом, во время химических реакций или при работе с ним необходимо обращаться с ним осторожно и безопасно. Некоторые опасности для здоровья, вызванные оксидом калия,
- При попадании на кожу может вызвать раздражение кожи.


 12.17
12.17