Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
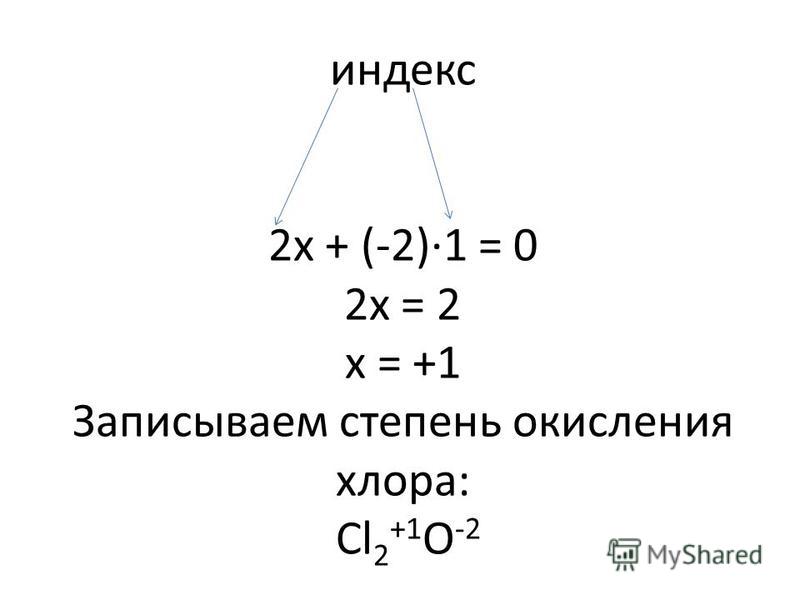 Вывод о том какие типы изомерии характерны для АЛКИНОВ?
Вывод о том какие типы изомерии характерны для АЛКИНОВ?Решено
Mg + HNO3(разб.) = ? Написать ОВР :
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Как изменится скорость реакции 2NO + O2 = 2NO2, если концентрации исходных веществ увеличить в 4 раза?
решите, пожалуйста. ( Электронный баланс, желательно подробно) Ch4-CH=CH-Ch4 + KMnO4 + h3SO4 = Ch4-COOH + MnSO4 + K2SO4 + h3O.
Пользуйтесь нашим приложением
Тест: Степень окисления и окислительно-восстановительные реакции
Тест: Степень окисления и окислительно-восстановительные реакции — Химия 8 классАнглийский язык
Астрономия
Белорусский язык
Биология
География
ИЗО
Информатика
История
Итальянский язык
Краеведение
Литература
Математика
Музыка
Немецкий язык
ОБЖ
Обществознание
Окружающий мир
ОРКСЭ
Русский язык
Технология
Физика
Физкультура
Химия
Черчение
Для учителей
Дошкольникам
VIP — доступ
- Предметы »
- Химия »
- 8 класс »
- Степень окисления и окислительно-восстановительные реакции
Степень окисления и окислительно-восстановительные реакции
Тест предназначен для проверки знаний учащихся по теме: «степень окисления» и ОВР.
Химия 8 класс | Автор: Гегер Н.А. | ID: 9657 | Дата: 31.8.2017
Помещать страницу в закладки могут только зарегистрированные пользователи
Зарегистрироваться
Вопрос №
1
Степень окисления фосфора в соединении P2O5 равна:
+6
+5
-3
+10
Вопрос №
2
Степень окисления +2 в соединениях характерна для:
металлов первой группы, главной подгруппы
галогенов
кальция, алюминия и железа
металлов второй группы, главной подгруппы
Вопрос №
3
Аатомы в свободном состоянии, а также атомы простых веществ имеют степень окисления
+1
+2
-1
0
Вопрос №
4
Соединение, в котором элементы имеют степени окисления +3 и -1
P2O3PF3
K3P
Н2О
Вопрос №
5
Окислительно-восстановительные реакции — это. ..
..
реакции, протекающие с отдачей электронов
реакции, протекающие с приемом электронов
реакции, протекающие с изменением степеней окисления элементов
реакции, протекающие с отдачей протонов
Вопрос №
6
Хлор имеет степень окисления равную нулю в соединении:
NaCl
HCL
Cl2O7
Cl2
Вопрос №
7
В соединении K2S степень окисления серы равна:
-2
+2
0
-1
Вопрос №
8
В гидридах металлов водород всегда проявляет степень окисления равную
0
-1
+1
+2
Вопрос №
9
В превращении N+5 —> N-3 количество принятых электронов равно:
3
5
8
2
Вопрос №
10
Низшую степень окисления азот имеет в соединении:
NO2
N20
Nh4
N2O3
Вопрос №
11
Дана химическая частица. Определите степени окисления элемента фосфора: K4P2O7
Определите степени окисления элемента фосфора: K4P2O7
-3
+5
+3
-5
Вопрос №
12
Укажите количество электронов, отданных или присоединенных атомом серы согласно схеме: S0 — > h3S
+2
-2
+4
-4
Показать ответы
Получение сертификата
о прохождении теста
Доступно только зарегистрированным пользователям
© TestEdu.ru 2013-2022
E-mail администратора: [email protected]
Какова формула сульфида калия?
Последняя обновленная дата: 6 января 2023
•
Общее представление: 188,1K
•
Просмотры сегодня: 1,87K
Ответ
Проверено
188,1K+ виды
Hint:
20202 соединение представляет собой общее число атомов в этой молекуле. {2-}$, когда сера получает 2 электрона, чтобы завершить свой октет, калий имеет положительную валентность 1, а сера имеет отрицательную валентность два 2. Химические формулы соединений записываются таким образом, чтобы компенсировать валентности или заряды, присутствующие в атомах элемента. Например, один положительный заряд, содержащий ионы, не может образовать соединение с элементом, имеющим отрицательный заряд два. Поэтому эти положительные ионы берутся в количестве двух, чтобы компенсировать валентность отрицательных ионов.
{2-}$, когда сера получает 2 электрона, чтобы завершить свой октет, калий имеет положительную валентность 1, а сера имеет отрицательную валентность два 2. Химические формулы соединений записываются таким образом, чтобы компенсировать валентности или заряды, присутствующие в атомах элемента. Например, один положительный заряд, содержащий ионы, не может образовать соединение с элементом, имеющим отрицательный заряд два. Поэтому эти положительные ионы берутся в количестве двух, чтобы компенсировать валентность отрицательных ионов.
Следовательно, чтобы сделать заряд -2 сульфида нейтральным, ионы калия берутся в количестве 2. Таким образом, формула сульфида калия принимает вид ${K_2}S$ .
Следовательно, формула сульфида калия ${K_2}S$.
Примечание:
Калий является высокореактивным металлом, так как он имеет только 1 электрон в своей валентной оболочке и находится в группе 1, поэтому он имеет групповую степень окисления +1. В то время как сера является неметаллом, который находится в группе 16 и имеет степень окисления группы +2 и +4. Сульфид калия представляет собой ионное соединение, которое может гидролизоваться в воде с образованием ионов гидроксида ОН и ионов HS.
Сульфид калия представляет собой ионное соединение, которое может гидролизоваться в воде с образованием ионов гидроксида ОН и ионов HS.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
фосфин получается из следующей руды A Calcium Class 12 Chemistry Jee_main
Трендовые сомнения
Что, как балансировать и часто задаваемые данные — Gambda Geeks
, написанная Neeloy Bhattachary Heam
. Реакция Defection Thet There Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Selection. показать определенное изменение цвета в продукте. Давайте посмотрим на такие прекрасные реакции и их свойства.
Реакция Defection Thet There Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Thate Selection. показать определенное изменение цвета в продукте. Давайте посмотрим на такие прекрасные реакции и их свойства.
Серная кислота, гигроскопичная и бесцветная, представляет собой лабораторный реагент, вызывающий коррозию по своей природе. Сульфид калия также является гигроскопичным и токсичным соединением, имеющим высокую растворимость в воде, но низкую в органических растворителях. Пыли сульфидов вредны для наших глаз и кожи. В результате реакции образуются продукты в различных состояниях.
В этой статье будет показано, как в результате реакции двух опасных соединений образуются продукты с различными свойствами.
Что является продуктом H 2 SO 4 и K 2 S? H 2 SO 4 и K 2 S вступают в реакцию с образованием сульфата калия, газообразного диоксида серы, молекулы серы и воды соответственно.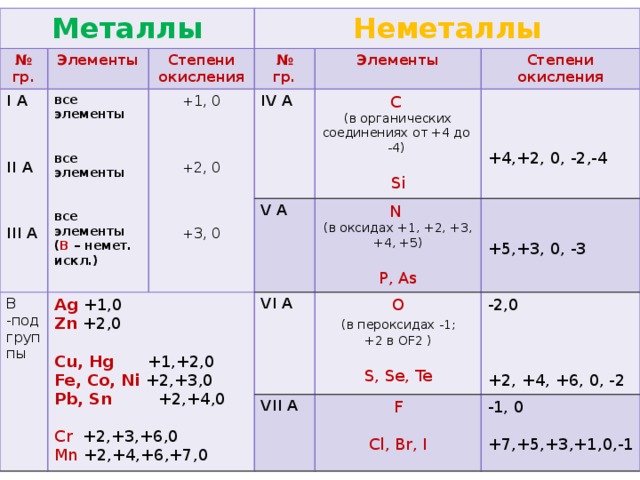 Уравнение реакции:
Уравнение реакции:
- 2H 2 SO 4 + K 2 S → K 2 SO 4 + SO 2 + S + 2H 2 O
Реакция H 2 SO 4 и K 2 S является реакцией диссоциации, поскольку образующиеся продукты диссоциируют на ионы в растворе.
Как сбалансировать H 2 SO 4 + K 2 S?These are the rules to equal the H 2 SO 4 + K 2 S reaction scheme:
- H 2 SO 4 + K 2 S → K 2 SO 4 + SO 2 + S + H 2 O
- Здесь и реакция, и продукт должны быть равны по атомам; умножьте H 2 SO 4 на 2, чтобы получить число атомов серы H 2 SO 4 .

- 2H 2 SO 4 + K 2 S → K 2 SO 4 + SO 2 + S + 2H 2 O
H 2 SO 4 + K 2 Титрование возможно и должно проводиться с осторожностью.
Аппаратура- Graduated burette
- Conical flask
- Volumetric flask
- Burette stands
- Sample beakers
- K 2 S is used as the titrant , концентрация которых известна.
- H 2 SO 4 – титр, концентрацию необходимо измерить.

Индикатор тимоловый синий используется для сильного кислотно-щелочного титрования, так как в кислой среде он становится желтоватым, а в щелочной – голубоватым.
Процедура- Стандартизированный раствор K 2 S известной концентрации заливается в бюретку и крепится к штативу.
- В коническую колбу после промывки добавляют неизвестную серную кислоту.
- Несколько капель индикатора тимолового синего (pH= 8,0-9.6) добавляется в раствор.
- В точке эквивалентности прореагировали равные моли кислоты и основания, что означает окончание титрования с соответствующим изменением цвета.
- The volume of base used is applied to measure the strength of the acid by the formula:
- V K2S S K2S = V h3SO4 S h3SO4
H 2 SO 4 + K 2 S Реакция имеет чистое ионическое уравнение,
- 2H +
7 ( (
9002- .
 4 2- (водн.) + 2K + (водн.) + S 2- (водн.) → 2K + (водн.) + SO 4 + 2- (SO + 90903 2-0) 2 (г) + S(г) + H + (водн.) + OH – (водн.)
4 2- (водн.) + 2K + (водн.) + S 2- (водн.) → 2K + (водн.) + SO 4 + 2- (SO + 90903 2-0) 2 (г) + S(г) + H + (водн.) + OH – (водн.) - .
H 2 SO 4 + K 2 S Реакция имеет следующие пары конъюгатов :
- 9
- Conjugate base of H 2 O= OH –
676666666666666666666666666666666666666666666666666666666666666666666666666666. SO 4 = HSO 4 –
H 2 SO 4 + K 2 S реакция имеет следующие межмолекулярные силы,
- H 2 SO 4 проявляет анионный характер в водной среде.

- K 2 S показывают слабые межмолекулярные силы, такие как силы Ван-дер-Ваальса.
- K 2 S более склонен к реакции с водой.
- S состоит из аллотропов ромбической и моноклинной формы.
H 2 SO 4 + K 2 Scection SO 4 + K 2 S RACEDY ARTALY. Информация о энтальпии заключается в следующем:
- Энтальпия формирования K 2 S = -406,2 кДж/моль
- Entalpy of Word of H 2 SO 4 = -814141414141414141414141414141414141414141414141414141414141414141414141414141414141477.
- Энтальпия образования H 2 O = -285.8 kJ/mol
- Enthalpy of Formation of K 2 SO 4 = -1437.
 7 kJ/mol
7 kJ/mol - Enthalpy of Formation of S = 0 (element)
- Энтальпия образования SO 2 = -296,8 кДж/моль
H 2 SO 4 + K 2 S не может быть сильным буферный раствор , потому что сильные кислоты, такие как серная кислота, не могут образовывать буфер.
Является ли H 2 SO 4 + K 2 S полной реакцией?Реакцию H 2 SO 4 + K 2 S можно назвать завершенной, так как при достижении равновесия продукты полностью образуются.
Является ли H 2 SO 4 + K 2 S экзотермической реакцией? H 2 SO 4 + K 2 Реакция S носит экзотермический характер, так как значение отрицательное.
Реакция h3SO4 и K 2 S является фактической окислительно-восстановительной реакцией, поскольку:
- Степень окисления серы изменяется от -2 до 0 в продуктах.
- К 2 С(-2) → S(0)
H 2 SO 4 + K 2 S не является реакцией осаждения, поскольку осадок не образуется. Вместо этого получают газообразные продукты.
Является ли H 2 SO 4 + K 2 S обратимой реакцией? H 2 SO 4 + K 2 Реакция S по своей природе необратима, так как конечными продуктами являются газы, которые не могут восстановиться.
H 2 SO 4 + K 2 S-реакция не является реакцией замещения, так как в продуктах не происходит замены ионов, в то время как реагенты разлагаются.
ЗаключениеH 2 SO 4 является одновременно хорошим окислителем и дегидратирующим агентом, невоспламеняющимся по своей природе. K 2 S, нерастворимый в эфире, является еще одним полезным лабораторным реагентом, который любит реагировать с водой. Кислотно-щелочное титрование отражает использование индикаторов для получения желаемого продукта.
Последние сообщения
ссылка на 15 фактов о h3SO4 + NaH: что и как сбалансировать и часто задаваемые вопросы h3SO4 — неорганическая кислота, а NaH — сильное основание.

 11.19
11.19

 4 2- (водн.) + 2K + (водн.) + S 2- (водн.) → 2K + (водн.) + SO 4 + 2- (SO + 90903 2-0) 2 (г) + S(г) + H + (водн.) + OH – (водн.)
4 2- (водн.) + 2K + (водн.) + S 2- (водн.) → 2K + (водн.) + SO 4 + 2- (SO + 90903 2-0) 2 (г) + S(г) + H + (водн.) + OH – (водн.) 
 7 kJ/mol
7 kJ/mol