What, How To Balance & FAQs —
By Моника Сайни
Туман олеума создается, когда H2SO4 и так3 через реакцию двойного замещения. Рассмотрим некоторые сведения о реакциях между H2SO4 и так3.
Серная кислота (H2SO4) имеет молекулярную массу 98.07 г/моль. Компоненты водород, кислород и сера составляют серную кислоту, также известную по химической формуле H.2SO4. Различные химические вещества и Кристаллические структуры можно найти в Sтриоксид серы ( SO3) в его многочисленных различных формах.
Триоксид серы (SO3) и вода объединяются с образованием серной кислоты (H2SO4). Давайте изучим факты и реакцию между H2SO4 + ТАК3 более подробно в разделе ниже.
Что является произведением H2SO4 и так3?Образование олеума/пиросерной кислоты (H2S2O7)/Дисульфуровая кислота происходит, когда Серная кислота (H2SO4) и триоксид серы (SO3)реагировать / сочетаться. Олеум представляет собой туман из мелких капель, образующихся из серной кислоты. и реакция выглядит следующим образом:
Олеум представляет собой туман из мелких капель, образующихся из серной кислоты. и реакция выглядит следующим образом:
H2SO4 (л) + ТАК3 (г) → Н2S2O7 (л)
Какой тип реакции Н2SO4 + ТАК3?H2SO4 + ТАК3 представляет собой реакцию синтеза или прямого соединения из-за движения ионов, которые производят серную кислоту, когда она соединяется с водой.
H2SO4 + ТАК3 → Н2S2O7
H2S2O7 (л) + H2O(L) → 2ч2SO4 (л)
Как сбалансировать H2SO4 + ТАК3?Эта реакция между H2SO4 + ТАК3 уже уравновешен,
- Написать Сбалансированное уравнение: Ч2SO4 + ТАК3 → Н2S2O7
- Количество молекул элементов 2H, 2S и 7O присутствует на стороне реагента, что означает, что реакция между H2SO4 и так3 уже находится в равновесии.

- Сторона продукта содержит атомы 2S, 7O и 2H.
- Метод исключения Гаусса используется для определения всех коэффициентов и переменных, поскольку результатом является коэффициент 1:1:1.
- Сбалансированное химическое уравнение: H2SO4 + ТАК3 → Н2S2O7
Компания Bариум-торин метод титрования можно использовать для титрования между H2SO4 и так3.
Требуется аппаратНеобходимо иметь пипетки мерные (10 мл, 100 мл), бюретки (50 мл), колбы Эрленмейера (250 мл), мерные цилиндры (100 мл), капельницы, стеклянные палочки, воронки, бюретки. стоит.
ИндикаторныеИндикатор барий-торин используется во время титрования между H2SO4 и так3 Решение.
- Встряхните бутылку с фильтром и раствор изопропанола.
- Аликвоту образца следует взять через несколько минут, если фильтр расслаивается.
- 100 мл этого раствора пипеткой переносят в колбу Эрленмейера вместимостью 250 мл, добавляют 2-4 капли барий-торинового индикатора и титруют 0.0100 н стандартным раствором бария до получения розового цвета.
- титрование следует проводить со второй аликвотой образца, а значения титрования следует усреднять.
- Повторное титрование должно быть в пределах 1% от первого.
- Метод следует повторить трижды для получения достоверных результатов.
- Необходимое количество можно рассчитать по формуле N1V1 = N2V2.
H2SO4 + ТАК3 иметь следующую сеть ионный уравнение,
2H+(L) + ТАК42-(L) + ТАК3 (г) → 2ч+(L) + S2O7 (л)
- Шаги должны быть предприняты для достижения чистого ионного уравнения.

- Создайте сбалансированное химическое уравнение и включите физическое представление состояний реагентов и продуктов.
- H2SO4 (л) + ТАК3 (г) → Н2S2O7 (л)
- Чистая субстанция и молекулы не могут диссоциировать на ионы, как это делают соли, кислоты и основания.
- Окончательное чистое ионное уравнение:
- 2H+(L) + ТАК42-(L) + ТАК3 (г) → 2ч+(L) + ХСО3+(L) + ХСО4–(L)
H2SO4 + ТАК3 имеет следующие сопряженные пары,
- H2SO4 представляет собой сопряженную пару оснований (HSO4–).

- SO3 не имеет сопряженная кислотно-основная пара потому что это газ.
H2SO4 + ТАК3 имеет следующее межмолекулярные силы,
- H2SO4 и Водородная связь, дисперсионные силы и диполь-дипольные взаимодействия.
- Есть только слабые дисперсионные силы между молекулами SO3 благодаря своей симметричности.
H2SO4 + ТАК3 реакция имеет Стандартная энтальпия реакции -125кДж/моль. Реагенты и продукты реакции имеют стандартные энтальпии образования
Реагенты и продукты реакции имеют стандартные энтальпии образования
| Молекулы | реакция энтальпия (в кДж/моль) |
| H2SO4 | -814.4 |
| SO3 | -191 |
| H2S2O7 | -880 |
- ΔH⁰f(реакция) = ΣΔH⁰f(продукты) – ΣΔH⁰f(реагенты)=-ve
- H2SO4 (л) + ТАК3 (г)→ Н2S2O7 (л)
- ΔH⁰f(реакция) = [-880 – (-191 – 814.4) ] = -125 кДж/моль.
H2SO4 + ТАК3 реакция не является Буферный раствор потому что он содержит сильную кислоту, а скорее слабую кислоту. Кислота Льюиса статус для SO3 происходит из-за его способности служить акцептором электронов, но его неспособности противостоять изменениям рН.
Кислота Льюиса статус для SO3 происходит из-за его способности служить акцептором электронов, но его неспособности противостоять изменениям рН.
H2SO4 + ТАК3 реакция завершена, потому что H2SO4 и так3 производят дымящуюся пиросерную кислоту или олеум. Олеум(Н2S2O7) реагирует с водой, дает желаемую концентрацию серной кислоты ( H2SO4).
Н2SO4 + ТАК3 экзотермическая или эндотермическая реакция?H2SO4 + ТАК3 реакция представляет собой экзотермический один, потому что тепло выделяется, когда SO3 пузырится через H2SO4 и в результате получается серная кислота/олеум. При образовании продукта значение энтальпии образования также отрицательно.
При образовании продукта значение энтальпии образования также отрицательно.
H2SO4 + ТАК3 реакция не является Окислительно-восстановительная реакция, потому что это реакция присоединения. Кроме того, степени окисления атомов не меняются.
Н2SO4 + ТАК3 реакция осаждения?H2SO4 + ТАК3 реакция не является Реакция на осаждение поскольку серная кислота используется для поглощения SO3, а потому что ТАК3, или триоксид серы, является кислым оксидом, реакция с водой очень экзотермична и проявляется реакцией гидратации.
H2SO4 + ТАК3 реакция Обратимый потому что ТАК3 поглощается серной кислотой во время реакции с водой, в результате чего образуется олеум, к которому затем медленно добавляют воду для риформинга серной кислоты. Обратимая реакция
Н2SO4 + ТАК3 реакция смещения?H2SO4 + ТАК3 реакция — это Двойная реакция смещения. Двойная реакция смещения
H2SO4 + ТАК3 закончили свою реакцию через реакцию двойного замещения. Олеум производится, когда H2SO4 пузырьки с SO3 а затем объединяется для создания высокореактивной жидкости с сильным запахом H2S2O7. Определение H2SO4 и газообразный SO2 выбросы от стационарных источников.
Олеум производится, когда H2SO4 пузырьки с SO3 а затем объединяется для создания высокореактивной жидкости с сильным запахом H2S2O7. Определение H2SO4 и газообразный SO2 выбросы от стационарных источников.
3.Абсорбция триоксида серы.
Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. nSO3 + h3O = h3SO4 + (n-1)SO3+Q………(3) если n>1, то получается олеум (раствор SO3 в h3SO4) если n=1 , то получается моногидрат (98,3% h3SO4) если n0
Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу, при этом загрязняется окружающая среда и возрастают потери серной кислоты.
Высказанные
соображения позволяют решить вопрос о
выборе абсорбента.
Оптимальным
абсорбентом является 98,3%-ная серная
кислота (техническое название –
моногидрат), соответствующая азеотропному
составу. Действительно, над этой
кислотой практически нет ни паров воды,
ни паров
SO3. Протекающий при этом
процесс можно условно описать уравнением
реакции:
Действительно, над этой
кислотой практически нет ни паров воды,
ни паров
SO3. Протекающий при этом
процесс можно условно описать уравнением
реакции:
SO3 + nh3SO4 + h3O= (n+1) h3SO4
Использование в качестве поглотителя менее концентрированной серной кислоты может привести к образованию сернокислотного тумана, а над 100%- ной серной кислотой или олеумом в паровой фазе довольно велико равновесное парциальное давление SO3, поэтому он будет абсорбироваться не полностью. Однако если в качестве одного из продуктов процесса необходимо получить олеум, можно совместить абсорбцию олеумом (1-й абсорбер) и абсорбцию 98,3%-ной кислотой (2-й абсорбер).
В принципе
при высоких температурах над 98,3%-ной
кислотой может быть значительным
парциальное давление паров самой
кислоты, что также будет снижать степень
абсорбции SO3. Ниже 100*С равновесное
давление паров
h3SO4 очень мало и поэтому
может быть достигнута практически
100%-ная степень абсорбции.
Таким образом, для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100*С. Однако в процессе абсорбции SO3 происходит закрепление кислоты (повышение ее концентрации) и в силу экзотермичности реакции увеличивается температура. Для уменьшения тормозящего влияния этих явлений абсорбцию ведут так, чтобы концентрация h3SO4 при однократном прохождении абсорбера повышалась только на 1-1,5%, закрепившуюся серную кислоту разбавляют в сборнике до концентрации 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая высокую кратность циркуляции.
Задание для расчета
Вариант №3
Стадии производства серной кислоты:
1. подготовка сырья: очистка и плавление серы; очистка, сушка и дозировка воздуха;
2. сжигание серы: S + O2 = SO2 (1) .Процесс ведут с избытком воздуха;
3. контактное окисление SO2 в SO3: SO2 + 0,5O2 = SO3
(2).Процесс идет на ванадиевом катализаторе
при температуре 420-550*С;
контактное окисление SO2 в SO3: SO2 + 0,5O2 = SO3
(2).Процесс идет на ванадиевом катализаторе
при температуре 420-550*С;
4. абсорбция SO3 : SO3 + h3O = h3SO4 (3). Абсорбционная колонна орошается 98,3% h3SO4. Перед отправкой на склад кислота разбавляется до ~93% h3SO4 в соответствии с требованиями ГОСТа.
Исходные данные для расчета
|Показатель |Значения | |Степень превращения |92.0 | |серы в SO2, % | | |Степень превращения |99.0 | |SO2 в SO3, % | | |Степень абсорбции SO3, % |99.8 | |Содержание SO2 в газе, поступающем в |8.0 | |контактный аппарат, % (по объему) | | |Содержание h3SO4 в целевом продукте, %|92.5 | |по массе | | |Базис расчета, кг h3SO4 |2000 |
Выполнение расчета.
1.Составляем блок-схему производства.
03
01112
23 302
012
301
011 — Сера жидкая
012 — Воздух
12. — SO2
содерж. газ
— SO2
содерж. газ
23 — SO3 содерж. газ
3. — Вода
301. — Выхлопные газы
302. – Серная кислота
2. Составление уравнений по каждому узлу.
1.Составляем уравнения по первому узлу:
0.92*N011=N12SO2
N12SO2=N12*0.08 N011=X1
0.92*N011=N12*0.08 N12=X3
0.92*X1=X3*0.08 (1)
2. Составляем уравнения по второму узлу:
а) 0,99*N12SO2=N23SO3
0.99*N12*0.08=N23SO3 N23SO3=X4
0.99*X3*0.08=X4 (2)
б) N12*(0.21-0.08)=2N23SO3
X*(0.21-0.08)=2X4 (3)
3.Составляем уравнение по третьему узлу:
а) G302*0.925=2000 базисное уравнение G302=X7
X7*0.925=2000 (4)
б) 0.998*N23SO3=2000/Mr(h3SO4)
0. 998*X4=2000/98
(5)
998*X4=2000/98
(5)
в) N301=N301SO2 + N301N2 + N301SO3 + N301O2
N301SO2=N12SO2*(1-0.99)=N12SO2*0.01=N12*0.08*0.01
N301N2= 0.79*N012
N301SO3=N23SO3*(1-0.998)=0.002*N23SO3
N301O2=N12*(0.21-0.08)-1/2*N12*(0.21-0.08)=N12*0.13*(1-
1/2)=0.13/2*N12
N301=N12*0.08*0.01+0.79*N012+0.002*N23SO3+0.065*N12
N301=0.0658*N12+0.79*N012+0.002*N23SO3
X6=0.0658*X3+0.79*X2+0.002*X1 (6)
N012=X2
N301=X6
Но надо учесть , что N12=N012 ,т.е. X2=X3 (7)
6 неизвестных и 7 уравнений. Выбрасываем уравнение (3) и получаем систему уравнений:
0,92*X1=0.08*X3
0.99*0.08*X3=X4
0.925*X7=2000
0.998*X4=20.41
X6=0.0658*X3+0.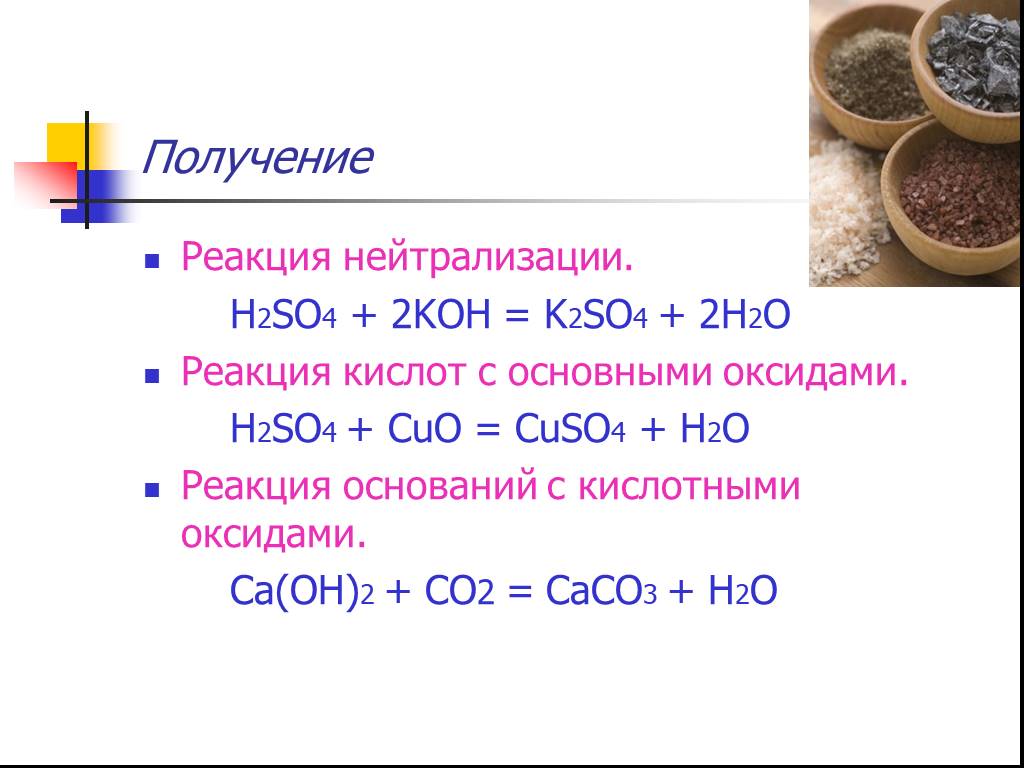 79*X2+0.002*X4
79*X2+0.002*X4
X3=X2
0.92*X1-0.08*X3=0
0.0792*X3-X4=0
X7=2162.2
X4=20.45
0.8558*X3+0.002*X4- X6=0
0.92*X1-0.08*X3=0
0.0792*X3-20.45=0
X7=2162.2
X4=20.45
0.8558*X3+0.002*20.45-X6=0
0.92*X1-0.08*X3=0
X3=257.23
X7=2162.2
X4=20.45
0.8558*X3+0.041-X6=0
0.92*X1=0.08*257.23
X3=257.23
X7=2162.2
X4=20.45
0.8558*257.23+0.041-X6=0
X1=22.37=N011
X3=257.23=X2=N12=N012
X7=2162.2=G301
X4=20.45=N23SO3
X6=220.18=N301
1. Количество
целевого продукта:
Количество
целевого продукта:
X7=G301=2162.2 кг 92.5% серной кислоты
2. Расход серы:
X1=N011=22.37 кмоль ms=Ns*MS=22.37*32=715.84 кг
GSнач=715,84/0,92=778,1 кг было введено в систему
3. Расход воздуха:
X2=X3=N012=257.23 кмольGвозд=Nвозд*Mвозд=257,23*29=7459,67 кг
4.Определение расхода кислорода и азота
GO2=7459,67*0,21=1566,7 кг
GN2=7459,67*0,79=5893,1 кг
5. Определяем количество SO2, содержащегося в газе:
X3=N12=257.23 кмоль
N12SO2=257.23*0.08=20.58 кмоль
GSO2=NSO2*MSO2=20.58*64=1317 кг
6. Определение SO3, содержащегося в газе:
X4=N23SO3=20.45 кмоль
GSO3=NSO3*MSO3=20.45*80=1636 кг
7. Расход
воды на абсорбцию:
Расход
воды на абсорбцию:
G03=G301*Mh3O/Mh3SO4=2162.2*18/98=397 кг
8. Выхлопные газы:
X6=N301=220.18 кмоль
G301=G301SO2+G301N2+G301SO3+G301O2=1317*0.01+5893.1+
0.002*1636+0.065*7459.67=13.17+5893.1+3.27+484.88=
6394.42 кг
3.Материальный баланс.
|Введено |Получено | |Реагенты |кг |% масс |Продукты |кг |%масс | |Сера |778,1 |9 |Серная |2162,2 |25 | | | | |кислота: | | | |Вода |397 |4,6 |h3SO4 |2000 |23,2 | |Воздух: |7459,67 |86,4 |h3O |162,2 |1,8 | |21% О2 |1566,7 |18,1 |Выхлопные |6394,42 |74,1 | | | | |газы: | | | |79%N2 |5893,1 |69,3 |SO2 |13,17 |0,15 | | | | |N2 |5893,1 |68,25 | | | | |SO3 |3,27 |0,06 | | | | |O2 |484,88 |5,64 | | | | |Невязка |78,15 |0,9 | | | | | | | | |Всего |8634,77 |100 |Всего |8634,77 |100 |
Список литературы.
1.
Г.Н. Кононова, В.В. Сафонов, Н. Г. Чабан.
Разработка алгоритма и расчет материального
баланса химико-технологической системы.
Москва. 1995.
Г. Чабан.
Разработка алгоритма и расчет материального
баланса химико-технологической системы.
Москва. 1995.
2. Учебник для химико-технологических специальностей ВУЗов под редакцией проф. И.П. Мухленова. Общая химическая технология. Часть
2 « Важнейшие химические производства». Москва «Высшая школа»1984.
3. А.М. Кутепов, Т.И. Бондарева, М.Г. Беренгартен. Общая химическая технология. Издание второе исправленное и дополненное. Москва
«Высшая школа» 1990.
4. Конспект лекций (лектор: Г.Н. Кононова) ———————— Колчедан
Na2SO3
Сульфитная целлюлоза
Нитрозный способ
h3SO4
Производство сульфатов Na, K, Fe, Cu, Zn, Al и др.
Производство K2Cr2O7 и Na2Cr2O7
Взрывчатые вещества
Получение
спиртов, эфиров и др.
Органические красители
Производство патоки и глюкозы
Химические волокна, текстильная промышленность
Очистка нефтепродуктов и минеральных масел
Минеральные пигменты
Минеральные кислоты HF, h4PO4, h4BO3
Металлургия: Al, Mg, Cu, Hg, Co, Ni, Au и др.
Сульфат аммония (Nh5)2SO4
Травление металлов
Минеральные удобрения
Процессы сульфирования
SO3
Контактный
способ
гипс
Нет
кислоты, которая была бы нужнее и
применялась бы чаще, чем серная.
Главным образом ее применяют в качестве
полуфабриката; многочисленные предприятия
по производству серной кислоты
перерабатывают ее далее в различных
процессах.
Почти половину всей
производимой в ГДР серной кислоты (это
составляет около полумиллиона тонн в
год) потребляют две отрасли хозяйства: производство
синтетических волокон и суперфосфата. Серная кислота также необходима для
получения красителей,
взрывчатых веществ, средств для
консервирования, ядохимикатов,
медикаментов и моющих
средств.
Почти
всем предприятиям металлургической и
горнодобывающей промышленности серная
кислота необходима для обогащения
руд.
В промышленности концентрированную
серную кислоту используют для сушки
газов (нам это также известно из лабораторных
опытов), а из нефти с помощью серной
кислоты можно удалить
примеси.
Наконец, серная кислота служит
электролитом в свинцовых аккумуляторах.
Не
случайно перспективные планы развития
химической промышленности каждой страны
предусматривают увеличение производства
серной кислоты и числа требующихся для
этого многочисленных установок.
В
настоящее время серную кислоту получают
на 13 предприятиях ГДР. Самыми известными
среди них являются химический комбинат
в Биттерфельде, предприятия по производству
серной кислоты и суперфосфата в Косвиге,
завод а Магдебурге, свннцовоплавильный
завод во Фрайберге комбинат им.
Серная кислота также необходима для
получения красителей,
взрывчатых веществ, средств для
консервирования, ядохимикатов,
медикаментов и моющих
средств.
Почти
всем предприятиям металлургической и
горнодобывающей промышленности серная
кислота необходима для обогащения
руд.
В промышленности концентрированную
серную кислоту используют для сушки
газов (нам это также известно из лабораторных
опытов), а из нефти с помощью серной
кислоты можно удалить
примеси.
Наконец, серная кислота служит
электролитом в свинцовых аккумуляторах.
Не
случайно перспективные планы развития
химической промышленности каждой страны
предусматривают увеличение производства
серной кислоты и числа требующихся для
этого многочисленных установок.
В
настоящее время серную кислоту получают
на 13 предприятиях ГДР. Самыми известными
среди них являются химический комбинат
в Биттерфельде, предприятия по производству
серной кислоты и суперфосфата в Косвиге,
завод а Магдебурге, свннцовоплавильный
завод во Фрайберге комбинат им. Вильгельма.
Пика в Малсфельде и, наконец, предприятия
по производству искусственных волокон
и искусственного шелка в Шварце и
Премнине. В республике работают три
установки, построенные польскими
специалистами. Производство серной
кислоты на душу населения составляет
в ГДР более 60 кг в год.
Вильгельма.
Пика в Малсфельде и, наконец, предприятия
по производству искусственных волокон
и искусственного шелка в Шварце и
Премнине. В республике работают три
установки, построенные польскими
специалистами. Производство серной
кислоты на душу населения составляет
в ГДР более 60 кг в год.
Стандартное изменение энтальпии для Reaciton SO3 (G) с H3O (…
Недавние каналы
- Общая химия
Химия
- Общая химия
- Органическое химии
- Аналитическая химии
- 7 700077
- . Химия
- Биохимия
Биология
- Общая биология
- Микробиология
- Анатомия и физиология
- Генетика
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Financial Accounting
Social Sciences
- Psychology
Начните вводить текст, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия8. ТермохимияЗакон Гесса
7:18
минуты
Задача 106
Вопрос из учебника
Проверенное решение
Наши преподаватели рекомендовали это видео-решение как полезное для описанной выше задачи.
397просмотров
Было ли это полезно?
Смотреть дальше
Мастер Закон Гесса с кратким видео-объяснением от Жюля Бруно
Начать обучение
Похожие видео0005
Ben’s Chem Video
121Views
Алекс — Использование Закона Hess для расчета чистой энтальпии реакции
Тони Сент
Практическая задача: Закон Гесса
Профессор Дэйв объясняет
174views
Энтальпия реакции
Наука Бозмана
94views
Вопрос о юридической трюке Hess. Вы должны знать
Melissa Maribel
156Views
Закон HESS и HEATS of Formation
Профессор Дейв объясняет
124Views
Законодательство Hess. Пример 1
Пример 1
Жюль Брюно
312просмотров
Закон Гесса
Жюль Брюно
306просмотров
Закон Гесса Пример 2
Jules Bruno
204Views
Закон HESS
Pearson
73Views
Инфракрасные спектры поглощения H3SO4, SO3, SO2 и H3O на 300C и 350C (DataSet), SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3, SO3 и H3O. при 300C и 350C (набор данных) | ОСТИ.GOV
перейти к основному содержанию
- Полная запись
- Другие родственные исследования
Среднеинфракрасные спектры поглощения серной кислоты (h3SO4), триоксида серы (SO3), диоксида серы (SO2) и воды (h3O) собирали в высокотемпературной газовой ячейке, работающей при 300°C или 350°C. Спектры были собраны с использованием перестраиваемых квантово-каскадных лазеров с внешним резонатором (ECQCL), которые были способны работать в диапазоне длин волн примерно от 7 микрон до 9 микрон, где h3SO4 и SO3 имеют самые сильные характеристики поглощения. Спектры можно использовать в качестве библиотеки для разработки газовых сенсоров.
Спектры были собраны с использованием перестраиваемых квантово-каскадных лазеров с внешним резонатором (ECQCL), которые были способны работать в диапазоне длин волн примерно от 7 микрон до 9 микрон, где h3SO4 и SO3 имеют самые сильные характеристики поглощения. Спектры можно использовать в качестве библиотеки для разработки газовых сенсоров.
- Авторов:
- Крисель, Джейсон; Дунаевский, Илья
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория энергетических технологий (NETL), Питтсбург, Пенсильвания, Моргантаун, Западная Вирджиния, и Олбани, Орегон (США).
 обмен энергетическими данными; Национальная лаборатория энергетических технологий (NETL), Питтсбург, Пенсильвания, Моргантаун, Западная Вирджиния (США)
обмен энергетическими данными; Национальная лаборатория энергетических технологий (NETL), Питтсбург, Пенсильвания, Моргантаун, Западная Вирджиния (США)
- Организация-спонсор:
- Управление ископаемой энергии Министерства энергетики США (FE)
- Идентификатор ОСТИ:
- 1899775
- Номер(а) отчета:
- а0а54дф5-3д43-48ф5-9077-7аа6417еа724
- Номер контракта Министерства энергетики:
- ФЕ0031560
- Тип ресурса:
- Данные
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- инфракрасное поглощение; лазерная спектроскопия поглощения; сера; триоксид серы; серная кислота
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Крисель, Джейсон, и Дунаевский, Илья. Спектры инфракрасного поглощения h3SO4, SO3, SO2 и h3O при 300°С и 350°С . США: Н. П., 2022.
Веб. дои: 10.18141/1899775.
Спектры инфракрасного поглощения h3SO4, SO3, SO2 и h3O при 300°С и 350°С . США: Н. П., 2022.
Веб. дои: 10.18141/1899775.
Копировать в буфер обмена
Крисель Джейсон и Дунаевский Илья. Спектры инфракрасного поглощения h3SO4, SO3, SO2 и h3O при 300°С и 350°С . Соединенные Штаты. https://doi.org/10.18141/1899775
Копировать в буфер обмена
Крисель, Джейсон, и Дунаевский, Илья. 2022.
«Инфракрасные спектры поглощения h3SO4, SO3, SO2 и h3O при 300°C и 350°C». Соединенные Штаты. https://doi.org/10.18141/1899775. https://www.osti.gov/servlets/purl/1899775.
Копировать в буфер обмена
@статья{osti_1899775,
title = {Инфракрасные спектры поглощения h3SO4, SO3, SO2 и h3O при 300°C и 350°C},
автор = {Кризель, Джейсон и Дунаевский, Илья},
abstractNote = {Средние инфракрасные спектры поглощения серной кислоты (h3SO4), триоксида серы (SO3), диоксида серы (SO2) и воды (h3O) были собраны в высокотемпературной газовой ячейке, работающей при 300C или 350C. Спектры были собраны с использованием перестраиваемых квантово-каскадных лазеров с внешним резонатором (ECQCL), которые были способны работать в диапазоне длин волн примерно от 7 микрон до 9 мкм.микрон, где h3SO4 и SO3 обладают наиболее сильными абсорбционными свойствами. Спектры можно использовать в качестве библиотеки для разработки газовых сенсоров.},
Спектры были собраны с использованием перестраиваемых квантово-каскадных лазеров с внешним резонатором (ECQCL), которые были способны работать в диапазоне длин волн примерно от 7 микрон до 9 мкм.микрон, где h3SO4 и SO3 обладают наиболее сильными абсорбционными свойствами. Спектры можно использовать в качестве библиотеки для разработки газовых сенсоров.},
дои = {10.18141/1899775},
URL-адрес = {https://www.osti.gov/biblio/1899775},
журнал = {},
номер =,
объем = ,
место = {США},
год = {2022},
месяц = {4}
}
Копировать в буфер обмена
Просмотр набора данных
https://doi.org/10.18141/1899775
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.




 обмен энергетическими данными; Национальная лаборатория энергетических технологий (NETL), Питтсбург, Пенсильвания, Моргантаун, Западная Вирджиния (США)
обмен энергетическими данными; Национальная лаборатория энергетических технологий (NETL), Питтсбург, Пенсильвания, Моргантаун, Западная Вирджиния (США)