Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Напишите изомеры пентановой кислоты изомеры пентаналя
Решено
Очень прошу Вашей помощи! 1) P + HNO3(конц) = HPO3 + 2) Mg + h3SO4(конц) = 3) Ni +HNO3(конц) = 4) KI + KMnO4 + HCLO4 = KIO3 + 5) K2S + KMnO4 + KOH = K2SO4 + 6) I2 + K2Cr2O7 + h3SO4 = HIO3 +
Mg h3SO4 ->MgSO4 S h3O
электронный баланс Nh4+O2=NO+h3O
Пользуйтесь нашим приложением
Напишите как получить из S SO2; из S ZnS; из ZnS SO2;из S.
 .. -reshimne.ru
.. -reshimne.ruНовые вопросы
Ответы
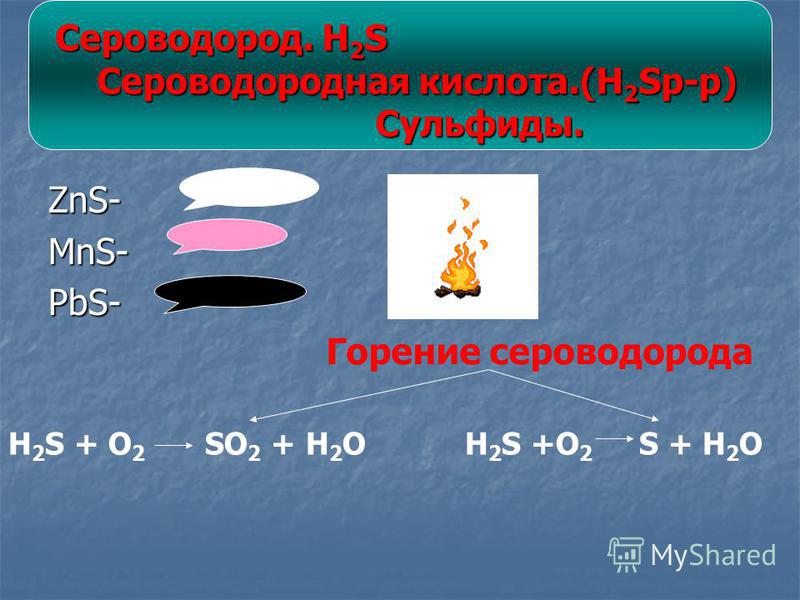
S + O2 = SO2
S + Zn = ZnS
2ZnS + 3O2 = 2ZnO + 2SO2
h3 + S = h3S
Похожие вопросы
Назовите главное отличие/отличия в свойствах натурального и синтетического каучука….
Пооооооооооооомогите…
Имеется 50 г – 5% раствора соли. Какова масса растворенной в ней соли?…
Проспрягайте оборот etre en retard…
1.при нагревании 193 г алюминия с серой образуется неизвестное количество сульфида алюминия.
2. термохимическое уравнение реакции горения сероводорода 2h3S+3O2=2SO2+2h3O+350 кДж при сгорании 21,89 л (н.у) сероводорода выделится теплоты?
термохимическое уравнение реакции горения сероводорода 2h3S+3O2=2SO2+2h3O+350 кДж при сгорании 21,89 л (н.у) сероводорода выделится теплоты?
3.Масса осадка, образовавшегося при нагревании 180 г хлорида бария с сульфатом кальция равна?
Сколько грамм весят 4 моль хлорида серебра AgCL…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
МузыкаПраво
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Использование серной кислоты для восстановления Zinc
СОДЕРЖАНИЕ
- Экспериментальные процедуры
- Результаты и обсуждение
- Изотермические тесты
- Стехиометрия реакции
- Скорость реакции
- Разделение реакционных продуктов
- Очистка и электролиз.

- Резюме
Это расследование было проведено Горнорудным бюро в поддержку его общих целей, заключающихся в содействии поддержанию достаточных запасов полезных ископаемых и металлов для будущих национальных нужд с минимальными отходами и ухудшением состояния окружающей среды. Цель исследования заключалась в разработке гидрометаллургического способа получения цинка из ZnS (сфалеритовых) концентратов без сопутствующего образования (диоксида серы) , что требует использования средств контроля загрязнения воздуха. Искали экспериментальные условия для получения элементарной серы при атмосферном давлении одновременно с высоким извлечением цинка.
В настоящее время цинк в промышленных масштабах производится путем обжига концентратов ZnS на воздухе с получением ZnO и SO2. ZnO в кальцинате выщелачивается оборотным электролитом, содержащим разбавленный H3SO4 (серная кислота). Различные процессы очистки используются для извлечения кадмия и серебра и удаления вредных примесей перед электрохимическим извлечением цинка. SO2, полученный при обжиге, преобразуется в h3SO4. Поставки h3SO4 увеличились в последние годы в результате принятия правил по борьбе с загрязнением, которые требуют контроля выбросов SO2 из промышленных источников. Серная кислота может не продаваться в том географическом районе, где она производится, а транспортные расходы снижают ее ценность как побочного продукта. Если бы серу можно было извлекать в элементарной форме, ее рыночный потенциал увеличился бы.
SO2, полученный при обжиге, преобразуется в h3SO4. Поставки h3SO4 увеличились в последние годы в результате принятия правил по борьбе с загрязнением, которые требуют контроля выбросов SO2 из промышленных источников. Серная кислота может не продаваться в том географическом районе, где она производится, а транспортные расходы снижают ее ценность как побочного продукта. Если бы серу можно было извлекать в элементарной форме, ее рыночный потенциал увеличился бы.
Более 60% внутреннего первичного спроса на цинк удовлетворяется за счет импорта; доля США в мировом производстве цинка снизилась с 27 % в 1960 г. до 9 % в 1974 г. Один из способов переломить эту тенденцию — разработать более совершенную технологию производства цинка, особенно технологию, не требующую дорогостоящих средств борьбы с загрязнением.
Исследовано прямое выщелачивание концентратов сульфидов металлов с помощью H3SO4. Маккей и Халперн изучали окисление пирита кислородом в кислых растворах и наблюдали двухстадийную реакцию; на первом этапе образовывались h3S (сероводород) и элементарная сера, на втором – SO2 и h3SO4. Другие исследователи определили влияние многих переменных на реакцию и ее продукты. Бьорлинг сообщил о подобных экспериментах с синтетическим ZnS и h3SO4; была получена элементарная сера, но скорость реакции была очень низкой. Используя природный ZnS, Форвард смог извлечь 95% содержащегося цинка за 4 часа при 115°C и давлении кислорода 20 фунтов/кв.дюйм. Сера образовала твердые гранулы и окклюдировала часть ZnSO4. Stanczyk и Rampacek в аналогичных экспериментах образовали h3SO4 при 200°C. Другие исследователи определили кинетику реакции растворения ZnS в разбавленном h3SO4, что приводит к образованию h3S.
Другие исследователи определили влияние многих переменных на реакцию и ее продукты. Бьорлинг сообщил о подобных экспериментах с синтетическим ZnS и h3SO4; была получена элементарная сера, но скорость реакции была очень низкой. Используя природный ZnS, Форвард смог извлечь 95% содержащегося цинка за 4 часа при 115°C и давлении кислорода 20 фунтов/кв.дюйм. Сера образовала твердые гранулы и окклюдировала часть ZnSO4. Stanczyk и Rampacek в аналогичных экспериментах образовали h3SO4 при 200°C. Другие исследователи определили кинетику реакции растворения ZnS в разбавленном h3SO4, что приводит к образованию h3S.
Исходным материалом для испытаний был типичный концентрат ZnS штата Миссури. Химический анализ и гранулометрический анализ головного образца приведены в таблицах 1 и 2 соответственно. Кальций и магний присутствуют в концентрате в основном в виде карбонатов. Концентраты, содержащие такие заметные количества карбонатов, перед обжигом обычно предварительно выщелачивают разбавленной H3SO4 для удаления Mg и CO2; однако концентрат, используемый в настоящем исследовании, не подвергался предварительному выщелачиванию.
Реактор периодического действия объемом 1000 мл использовали для реакции 200-граммовых образцов концентрата ZnS с 250 мл раствора H3SO4. Реактор изолировали от атмосферы, и газы, выделяющиеся в результате реакции, собирали и измеряли над водой с минимальной площадью контакта между газами и водой. Анализ воды показал, что количество растворенных газов незначительно. Образцы выделяющихся газов удаляли с помощью небольшого газового шприца через перегородку в реакторе. Состав газа определяли методом газовой хроматографии с использованием колонки Porapak Q при 25°С для разделения воздуха, СО2, h3S и SO2.
Образцы ZnS нагревали в реакторе при 130°С в течение 30 мин для удаления всей влаги перед испытанием. После добавления кислоты смесь перемешивали и постепенно повышали температуру до желаемого уровня. После реакции смесь охлаждали, затем фильтровали или центрифугировали, чтобы выделить умеренно концентрированный H3SO4. Затем твердые вещества выщелачивали горячей разбавленной H3SO4 (имитация обедненного электролита) или водой для растворения ZnSO4. После фильтрации или центрифугирования образуется остаток, состоящий из элементарной серы, нерастворимых частей концентрата и непрореагировавшего ZnS. Фильтрат охлаждали, ZnSO4·7h3O выкристаллизовывали и фильтровали.
После фильтрации или центрифугирования образуется остаток, состоящий из элементарной серы, нерастворимых частей концентрата и непрореагировавшего ZnS. Фильтрат охлаждали, ZnSO4·7h3O выкристаллизовывали и фильтровали.
В других тестах скорость реакции определяли путем взаимодействия 200 граммов ZnS с 250 мл 83-процентного H3SO4 при приблизительно постоянной температуре. Небольшие образцы реакционной смеси периодически отбирали и гасили водой. Нерастворимый остаток отфильтровывали, сушили, взвешивали и анализировали на цинк.
Изотермические испытания проводились в колбе вместимостью 1000 мл, поддерживаемой при постоянной температуре на масляной бане. Пятиграммовые образцы ZnS добавляли через воздушный шлюз в герметичную колбу, содержащую 50 мл раствора h3SO4 и воздух. Газы в колбе отбирали и анализировали хроматографически, и рассчитывали объем сернистых газов при стандартных условиях.
Результаты и обсуждение Изотермические испытания Желаемая реакция заключалась в объединении ZnS и h3SO4 с получением ZnSO4, S и h3O. Были проведены изотермические испытания при нескольких температурах и концентрациях кислоты для определения изменений относительных количеств h3S и SO2, выделяющихся во время реакции. Использовали избыток кислоты, что поддерживало концентрацию кислоты во время реакции почти постоянной. На рисунках 1 и 2 показаны количества газов, выделяющихся при различных концентрациях кислоты и двух температурах. Во всех испытаниях первоначально образовалось некоторое количество h3S, которое затем реагировало со смесью с образованием серы. По мере протекания реакции выделялся диоксид серы. Реакция чувствительна к изменению концентрации h3SO4; 75-процентная доля h3SO4 давала большое количество h3S (рис. 2), а 87,5-процентная кислота в основном давала SO2 (рис. 1). В этих испытаниях с использованием избытка кислоты оптимальная концентрация кислоты для минимизации выделения сернистого газа составляла около 80 pct.
Были проведены изотермические испытания при нескольких температурах и концентрациях кислоты для определения изменений относительных количеств h3S и SO2, выделяющихся во время реакции. Использовали избыток кислоты, что поддерживало концентрацию кислоты во время реакции почти постоянной. На рисунках 1 и 2 показаны количества газов, выделяющихся при различных концентрациях кислоты и двух температурах. Во всех испытаниях первоначально образовалось некоторое количество h3S, которое затем реагировало со смесью с образованием серы. По мере протекания реакции выделялся диоксид серы. Реакция чувствительна к изменению концентрации h3SO4; 75-процентная доля h3SO4 давала большое количество h3S (рис. 2), а 87,5-процентная кислота в основном давала SO2 (рис. 1). В этих испытаниях с использованием избытка кислоты оптимальная концентрация кислоты для минимизации выделения сернистого газа составляла около 80 pct.
Эволюция h3S и SO2 объяснялась следующими обобщенными реакциями:
ZnS + h3SO4 → ZnSO4 + h3S………………………………………………………………… …………(1)
и ZnS + 4h3SO4 → ZnSO4 + 4SO2 + 4h3O……………………………………………………. (2)
(2)
На рисунках 3 и 4 показаны количества газов, выделяющихся при различных температурах и двух концентрациях кислоты. Повышение температуры привело к увеличению количества SO2. В большинстве тестов количество произведенного SO2 со временем стабилизировалось; после этого было произведено мало или совсем не было произведено. Это свидетельствует о том, что SO2 и реакционная смесь находились почти в равновесии. Рисунки 1
–4 показывают, что концентрация кислоты является более важным фактором, чем температура, при определении того, образуется ли в первую очередь H3S или SO2.
Установлено, что сероводород исчезает из системы по реакции первого порядка при 120–185°С. Энергия активации реакции по Аррениусу +13 ккал/моль определена по графику (рис. 5) логарифмы зависящей от температуры константы скорости как функции обратной температуры (1/T). Скорость исчезновения h3S из системы равна
где T — температура, R — газовая постоянная, Ph3s — давление h3S.
Энергия активации исчезновения h3S +13 ккал/моль указывает на то, что реакция не контролировалась диффузией. (Реакции, контролируемые диффузией, имеют энергию активации порядка 1 ккал/моль.) Вероятно, h3S реагировал с SO2 в паровой фазе.
Концентрат ZnS содержал некоторое количество карбонатов кальция и магния, которые при контакте с кислотой выделяют CO2. Большое начальное выделение h3S, вероятно, связано с тем, что CO2 вымывает h3S из реакционной смеси.
В таблице 3 показаны результаты испытаний, в которых h3S барботировали через растворы h3SO4 с двух разных глубин. Температура кислоты составляла 180°C, а скорость потока h3S составляла 100 мл/мин. Процентное содержание h3S, которое вступало в реакцию с образованием элементарной серы, увеличивалось по мере увеличения пройденной глубины и концентрации кислоты. Если бы ZnS вводили на дно реакционного сосуда, количество образующегося h3S было бы меньше по мере увеличения глубины залегания кислоты.
Стехиометрия реакции В таблице 4 приведены результаты периодических испытаний, в которых использовался гораздо меньший избыток кислоты и условия были близки к оптимальным для образования элементарной серы. Начальная концентрация кислоты колебалась от 83 до 85%, и производилось лишь небольшое количество сернистых газов. Средний выход серы составил 1,33 моля на моль прореагировавшего ZnS. Стехиометрия реакции представлена формулой
Начальная концентрация кислоты колебалась от 83 до 85%, и производилось лишь небольшое количество сернистых газов. Средний выход серы составил 1,33 моля на моль прореагировавшего ZnS. Стехиометрия реакции представлена формулой
3ZnS + 4h3SO4 → 4S° + 3ZnSO4 + 4h3O………………………………………(4)
Влияние температуры реакции на стехиометрию было незначительным. Более высокие температуры ускорили реакцию и, как следствие, скорость выделения тепла из умеренно экзотермической реакции. При длительных временах реакции, как в тестах 7 и 8 (таблица 4), извлечения цинка приближались к 100 pct. Высокая температура и длительное время реакции (испытание 8) привели к уменьшению извлечения серы; это было связано с окислением элементарной серы h3SO4 следующим образом:
S° + 2h3SO4 → 3SO2 + 2h3O………………………………………………………….(5 )
Образование SO2 в результате реакции ZnS и h3SO4 не может быть подтверждено из-за почти полного отсутствия непрореагировавшего ZnS после первых 2 часов реакции.
Была проведена серия испытаний на выщелачивание, в которых варьировались время реакции и температура. Концентрация непрореагировавшего ZnS была рассчитана по весу и анализу остатка после выщелачивания с использованием эмпирически полученного уравнения, а логарифмы этих значений были построены как функция времени (рис. 6). Приблизительная линейность графиков указывает на то, что реакции были приблизительно первого порядка в зависимости от концентрации ZnS. Константы скорости определяли по наклонам. Экстраполированные линии не проходят через одну точку, поскольку для стабилизации температуры на желаемых значениях требовалось разное время. Тонкоизмельченный ZnS, реагирующий с избытком раствора кислоты, представляет собой псевдогомогенную смесь. Интегральное уравнение скорости реакции первого порядка имеет вид
[ZnS] = [ZnS]t = 0 exp(-kTt)…………………………………………………………(6)
где kT зависит от температуры константа скорости, а [ZnS] — концентрация непрореагировавшего ZnS в момент времени t.
Следующее уравнение Аррениуса использовалось для определения влияния температуры на константу скорости реакции:
kT = Ao exp(-E°/RT)……………………………………………… ……….(7)
где Ao – коэффициент частоты, а E° – аррениусовская энергия активации реакции. Рассчитанные значения составляют 4,2 x 10 6 мин-1 для коэффициента частоты и 17,4 ккал/моль для энергии активации. Время реакции, необходимое для получения 9Расчетное время превращения ZnS 8,0% при 200°C составляет 1,3 часа; при 180°С потребуется 3,2 часа. Эти расчетные значения удовлетворительно сравниваются с экспериментальными извлечениями цинка, приведенными в таблице 4.
Разделение продуктов реакции Прореагировавшая смесь содержала ZnSO4, h3SO4, S и непрореагировавшие твердые вещества. В одном подходе нерастворимый остаток удаляли выщелачиванием растворимых компонентов водой и фильтрованием. Фильтрат содержал h3SO4 и ZnSO4. Кислота должна быть отделена от ZnSO4, чтобы использовать процесс электролитического цинкования, для очистки которого требуется нейтральный раствор сульфата цинка.
Технологическая схема на рисунке 7 иллюстрирует лабораторный метод, предназначенный для минимизации потерь цинка и разбавления кислотных потоков, а также для получения нейтрального сульфата цинка для электролиза. Для извлечения умеренно концентрированной кислоты при начальном разделении прореагировавшую смесь ZnSO4-h3SO4 фильтровали или центрифугировали, а затем промывали смешанными промывками (смешивали с твердыми веществами) или элюирующими промывками. Были опробованы различные комбинации этих операций; результаты приведены в таблице 5. Последний процесс в таблице 5 был выбран для большей части лабораторных работ.
Для выщелачивания твердых частиц на стадии центрифугирования использовали раствор отработанного цинкового электролита. Затем использовали фильтрацию для отделения серы и непрореагировавших твердых веществ от раствора ZnSO4-h3SO4. Анализ типичного остатка после выщелачивания приведен в таблице 6. Фильтрат охлаждали для кристаллизации ZnSO4·7h3O. Выход зависел от конечной температуры раствора, и до 80% ZnSO4 кристаллизовалось при -10°C. Концентрация h3SO4 в кристаллическом растворе увеличивалась по мере кристаллизации ZnSO4·7h3O из-за гидратационной воды в кристаллы. Выщелачивающие растворы с начальным содержанием h3SO4 22% содержали 40% h3SO4 после кристаллизации ZnSO4-7h3O; такая концентрация приводит к значительному снижению затрат на рециркуляцию кислоты обратно на стадию выщелачивания.
Выход зависел от конечной температуры раствора, и до 80% ZnSO4 кристаллизовалось при -10°C. Концентрация h3SO4 в кристаллическом растворе увеличивалась по мере кристаллизации ZnSO4·7h3O из-за гидратационной воды в кристаллы. Выщелачивающие растворы с начальным содержанием h3SO4 22% содержали 40% h3SO4 после кристаллизации ZnSO4-7h3O; такая концентрация приводит к значительному снижению затрат на рециркуляцию кислоты обратно на стадию выщелачивания.
Растворимость ZnSO4 в растворе h3SO4 уменьшается с понижением температуры и увеличением концентрации кислоты. Кристаллическая форма ZnSO4 в равновесии с раствором ZnSO4 представляет собой ZnSO4·7h3O до 38°C и ZnSO4·6h3O от 38° до 60°C. Выше 60°C кристаллы сульфата цинка менее гидратированы. Увеличение концентрации h3SO4 снижает температуру дегидратации и растворимость ZnSO4. Тройная точка равновесия между ZnSO4·7h3O и ZnSO4·6h3O возникает при 18°C и 25% h3SO4; раствор содержит 21,3% ZnSO4.
Продукт состоял из плотных зернистых кристаллов ZnSO4·7h3O, которые легко осаждались из маточного раствора. Однако после фильтрации на кристаллах оставалось значительное количество кислоты. Элюирующая промывка в колонке с внутренним диаметром 2 см и длиной 50 см 20-процентным раствором ZnSO4 при 0°C удаляла прилипшую кислоту. В таблице 7 приведены результаты испытаний элюирования-промывки; 99,5% кислоты было удалено путем промывки нейтральным раствором ZnSO4 в количестве, эквивалентном приблизительно 10% количества, полученного в процессе. Кристаллы ZnSO4 растворяли в воде, раствор очищали и подвергали электролизу. Кислотный фильтрат из кристаллизаторов концентрируют выпариванием и возвращают в цикл. Материальный баланс, полученный в результате серии из 12 испытаний, приведен в таблице 8.
Однако после фильтрации на кристаллах оставалось значительное количество кислоты. Элюирующая промывка в колонке с внутренним диаметром 2 см и длиной 50 см 20-процентным раствором ZnSO4 при 0°C удаляла прилипшую кислоту. В таблице 7 приведены результаты испытаний элюирования-промывки; 99,5% кислоты было удалено путем промывки нейтральным раствором ZnSO4 в количестве, эквивалентном приблизительно 10% количества, полученного в процессе. Кристаллы ZnSO4 растворяли в воде, раствор очищали и подвергали электролизу. Кислотный фильтрат из кристаллизаторов концентрируют выпариванием и возвращают в цикл. Материальный баланс, полученный в результате серии из 12 испытаний, приведен в таблице 8.
ZnSO4 со стадии кристаллизации растворяли в воде с образованием почти насыщенного раствора с концентрацией около 200 г/л для электролиза. Железо удаляли осаждением в виде Fe(OH)3 (гидроксид железа) из нейтрального раствора после окисления KMnO4 (перманганат калия). Перманганат также вызывал осаждение марганца в растворе в виде MnO2 (диоксид марганца). Осаждение железа также эффективно для удаления следов сурьмы, которая вредна для электролиза цинка.
Перманганат также вызывал осаждение марганца в растворе в виде MnO2 (диоксид марганца). Осаждение железа также эффективно для удаления следов сурьмы, которая вредна для электролиза цинка.
До 2 г/л CuSO4 (сульфат меди) и 20 мг/л As2O3 (триоксид мышьяка) добавляли к раствору после его нагревания до 90°C. Затем добавляли высокочистую цинковую пыль при интервалы в течение 1 часа для цементирования Cu, Co, As и Ni. Благодаря этой обработке содержание кобальта и никеля было снижено с примерно 400 ч./млн до менее чем 1 ч./млн. Избыточное количество марганца в растворе мешало полной цементации кобальта. В некоторых случаях осаждение железа и добавление цинковой пыли приходилось повторять для получения растворов, достаточно чистых для электролиза. Чрезмерное количество кобальта и никеля в растворе вызывает повторное растворение отложений цинка после нескольких часов электролиза.
Очищенные растворы подвергали электролизу в испытательных ячейках с использованием алюминиевых катодов и платиновых анодов при плотности тока от 5 до 10 А/дм². В ходе 24-часовых испытаний были получены плотные когерентные отложения цинка. Текущие КПД превышали 90%, растворения отложений не наблюдалось.
В ходе 24-часовых испытаний были получены плотные когерентные отложения цинка. Текущие КПД превышали 90%, растворения отложений не наблюдалось.
При непрерывной работе незначительные загрязнения часто накапливаются до высоких уровней. Промежуточные продукты анализировали для определения распределения примесей из концентрата ZnS (таблица 9).). Большая часть Cu, Pb и Ca и около половины Fe остались в серном остатке. Кадмий, который часто является побочным продуктом переработки цинка, не теряется и может быть извлечен с помощью обычно используемых процессов очистки. Железо, кобальт и никель также удаляются стандартными процедурами очистки. Магний будет накапливаться в технологических потоках, и его придется удалять путем предварительного выщелачивания разбавленной кислотой.
Резюме Концентраты сфалерита подвергали реакции при атмосферном давлении с серной кислотой с получением ZnSO4 и S. Серу получали в соотношении 4 моля на 3 моля ZnS, прореагировавшего в оптимальных условиях. Газообразный диоксид серы образовывался, когда концентрация кислоты была избыточной, а h3S образовывался, когда кислота была разбавлена. Когда использовали от 80 до 85% h3SO4, в ходе реакции образовывались небольшие переменные количества SO2 и h3S; количество менялось в зависимости от температуры. Скорость реакции тонкоизмельченного концентрата ZnS зависит от температуры, а энергия активации реакции составляет 17,4 ккал/моль. Более 98% цинка было извлечено в виде растворимого ZnSO4 путем реакции при 175°C в течение 3 часов.
Газообразный диоксид серы образовывался, когда концентрация кислоты была избыточной, а h3S образовывался, когда кислота была разбавлена. Когда использовали от 80 до 85% h3SO4, в ходе реакции образовывались небольшие переменные количества SO2 и h3S; количество менялось в зависимости от температуры. Скорость реакции тонкоизмельченного концентрата ZnS зависит от температуры, а энергия активации реакции составляет 17,4 ккал/моль. Более 98% цинка было извлечено в виде растворимого ZnSO4 путем реакции при 175°C в течение 3 часов.
Растворимые продукты реакции отделяли от серы и других нерастворимых остатков выщелачиванием оборотными электролизными растворами, содержащими 12-15 ч.ч. H3SO4. Сульфат цинка отделяли от h3SO4 путем кристаллизации при -10°C в виде ZnSO4·7h3O, которая удаляет воду из выщелачивающего раствора и концентрирует h3SO4 до 40%. Затем H3SO4 можно концентрировать до 80% путем выпаривания и повторно использовать для реакции со свежим концентратом ZnS. Нейтральный ZnSO4·7h3O получали элюирующей промывкой кристаллов насыщенным раствором ZnSO4.
окислительно-восстановительный — Почему можно увидеть ZnS, когда раствор подщелачивается? Объясните реакциями
Задавать вопрос
Изменено 2 года назад
Просмотрено 1к раз
$\begingroup$
В моей книге есть выдержка, которую я не могу получить. В нем говорится:
Поместите полоску металлического цинка в водный раствор нитрата меди примерно на один час. Вы можете заметить, что полоска покрывается металлической медью красноватого цвета, а синяя окраска раствора исчезает. Об образовании ионов Zn2+ среди продуктов легко судить по исчезновению синей окраски раствора, обусловленной Cu2+. Если через бесцветный раствор, содержащий ионы Zn2+, пропустить газ h3S, то при подщелачивании раствора аммиаком можно наблюдать появление белого сульфида цинка, ZnS. 9{2-}}$$
9{2-}}$$
Так черная составляющая осадка исчезнет, и вы сможете увидеть белый цвет нерастворимого $\ce{ZnS}$.
$\endgroup$
$\begingroup$
Вы видите разницу между металлом, который может быть осажден сероводородом в кислом растворе, и металлом, который требует, чтобы содержащий сульфид раствор был щелочным или, по крайней мере, не таким кислым. В мои студенческие годы (1970-1980-е годы) в качественном анализе они назывались металлами группы II и группы III, хотя это могло измениться. 9+}$
С медью сульфид имеет настолько низкую константу диссоциации, что константа равновесия для осаждения достигает очень высоких значений, и сульфид меди более или менее полностью осаждается даже в сильнокислых растворах.
На втором этапе у вас есть просто раствор, сцеженный из твердой меди. Для цинка вместо меди константа равновесия вышеуказанной реакции не так высока, и вам необходимо потреблять ионы водорода, чтобы ускорить осаждение сульфида цинка.

 02.15
02.15