Урок 15. Моляльность и молярность – HIMI4KA
Архив уроков › Основные законы химии
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом. Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом. В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Содержание
- Растворитель и растворенное вещество
- Расчет концентрации раствора
- Молярная концентрация
- Моляльная концентрация
- Разбавление растворов
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости. В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество. Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
- См = n/V, моль/л
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (Nh5)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.
 е 1,74 М (NH4)2SO4
е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
- m = n/m
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Урок 16. Кислоты и основания →
← Урок 14. Выход продукта реакции
Урок 15.
 Моляльность и молярность – HIMI4KA
Моляльность и молярность – HIMI4KAАрхив уроков › Основные законы химии
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом. Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом. В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Содержание
- Растворитель и растворенное вещество
- Расчет концентрации раствора
- Молярная концентрация
- Моляльная концентрация
- Разбавление растворов
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости. В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество. Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
- См = n/V, моль/л
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (Nh5)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.
 е 1,74 М (NH4)2SO4
е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
- m = n/m
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Урок 16. Кислоты и основания →
← Урок 14. Выход продукта реакции
Урок 15.
 Моляльность и молярность – HIMI4KA
Моляльность и молярность – HIMI4KAАрхив уроков › Основные законы химии
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом. Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом. В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Содержание
- Растворитель и растворенное вещество
- Расчет концентрации раствора
- Молярная концентрация
- Моляльная концентрация
- Разбавление растворов
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости. В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество. Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
- См = n/V, моль/л
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным.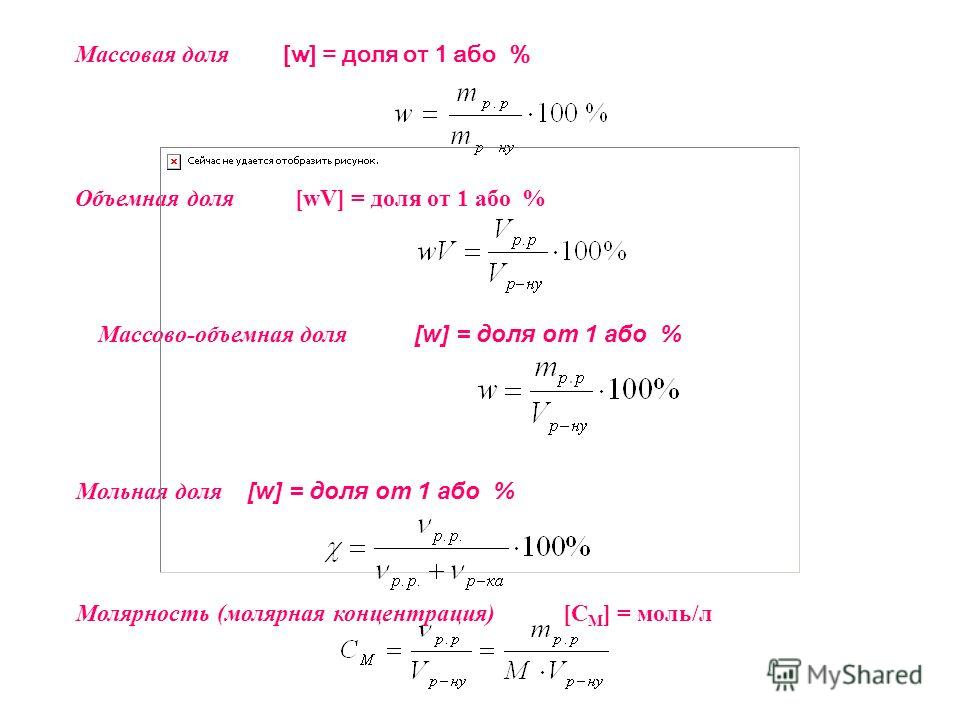 Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (Nh5)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.
 е 1,74 М (NH4)2SO4
е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
- m = n/m
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Урок 16. Кислоты и основания →
← Урок 14. Выход продукта реакции
Определение молярной концентрации и формулы для её расчёта » Kupuk.
 net
netВ природе практически невозможно найти вещество в чистом виде. Тела соприкасаются, перемешиваются образуя смеси. Одним из видов описания растворов является молярная концентрация. Это важное понятие в химии, характеризующее количественную часть. Выражается чаще всего эта величина через массовую долю, показывающую чистоту раствора. Измеряется она в единичных долях или процентах и находится по химической формуле.
Основные понятия и определения
Под раствором в химии понимают твёрдую или жидкую однородную систему, состоящую из нескольких компонентов. Вещества образующие раствор разделяются на растворители и растворённые.
Например, сахар, находящийся в воде — такая смесь называется двухгомогенная. Если же в сахарную воду добавить уксус, то полученный раствор уже будет трёхгомогенный. Количество в смеси того или иного разжиженного компонента называется концентрацией. Изменяться она может в широких пределах.
Существует несколько способов выражения концентрации растворов:
 Обозначается латинской буквой P и определяется количеством растворённого вещества в 100 граммах смеси. Для нахождения массовой концентрации используется формула: P = (n / (n + m)) * 100%, где: n — масса растворяемого вещества, m — масса растворителя, (n + m) — масса раствора. Сумма веществ выражается произведением объёма раствора на его плотность, то есть (n + m) = p * V и измеряется в граммах. Например, 25% раствор обозначает, что в 100 граммах смеси содержится 25 грамм вещества n.
Обозначается латинской буквой P и определяется количеством растворённого вещества в 100 граммах смеси. Для нахождения массовой концентрации используется формула: P = (n / (n + m)) * 100%, где: n — масса растворяемого вещества, m — масса растворителя, (n + m) — масса раствора. Сумма веществ выражается произведением объёма раствора на его плотность, то есть (n + m) = p * V и измеряется в граммах. Например, 25% раствор обозначает, что в 100 граммах смеси содержится 25 грамм вещества n. Обозначается символом Cэ и находится по формуле Cэ = n / Mэкв * V дм³. Например, 0,1 HCl означает, что 0,1 моль эквивалента соляной кислоты содержится в 1 дм³ раствора.
Обозначается символом Cэ и находится по формуле Cэ = n / Mэкв * V дм³. Например, 0,1 HCl означает, что 0,1 моль эквивалента соляной кислоты содержится в 1 дм³ раствора.Молярная масса и доли
Для измерения массы используются граммы, килограммы, тонны, но для обозначения количества вещества они не подходят. В химических процессах принимают участие различные частицы, такие как молекулы, атомы, ионы. Поэтому для того чтобы определить, сколько вещества содержится в той или иной смеси, ввели специальную единицу — моль. Иными словами — это множество, в котором объединены масса с числом.
Концентрация — это значение количества объёма раствора к растворенному в нём телу. Наиболее часто для измерения применяется массовая доля разжиженного вещества, молярная и нормальная концентрация. Массовая часть — это неизмеряемая величина. Складывается она из двух масс:
- растворителя — вещества способного ослаблять другие тела;
- растворимого — разжижающегося состава, поглощаемого растворителем.
Способность же вещества поглощаться другим называют растворимостью. При определении результата взаимодействия растворов находится массовая доля каждого из них.
Молярная масса показывает массу одного моль вещества и измеряется в граммах, делённых на моль. Если необходимо отмерить один моль, то нужно будет взять столько граммов вещества, сколько их содержится в относительной атомной массе или же, относительной молекулярной массе. Один моль всегда содержит постоянное число молекул, называемое константой Авогадро. Равно оно: N = 6 * 1023. Для того чтобы рассчитать число молекул в определённом веществе используют формулу:
Равно оно: N = 6 * 1023. Для того чтобы рассчитать число молекул в определённом веществе используют формулу:
N = Na * n, где Na — постоянная Авогадро, n — количество вещества. То есть моль — это количество в котором содержится 6 * 1023 молекул. Молярная концентрация определяет, сколько моль разжиженного вещества содержится в одном литре раствора.
Считается, что в единице объёма находится некая величина, определяемая числом молекул. Записывается это определение как n = N / V и называется концентрацией молекул. Измеряется она в м3. Важно отметить, что концентрация связана с плотностью соотношением: n = p / m0 и показывает число структурных молекул, находящихся в единице объёме. Поэтому плотность используется при нахождении массы на единицу объёма, а концентрация при вычислении количества молекул.
Массовая доля растворимого часто называется процентной концентрацией. При этом вместо процентного определения используется молярная концентрация. Другими словами, отношение количества к объёму в литрах. Зная число молей в одном литре довольно просто подобрать необходимое число молей используя специальную посуду.
Зная число молей в одном литре довольно просто подобрать необходимое число молей используя специальную посуду.
Формулы перехода
Расчёт количества той или иной части концентрированной смеси, возможно, выполнить в различных единицах. Но между тем существуют формулы перехода от одних выражений к другим. При пересчёте происходит округление знака после запятой, поэтому при переходе с одной величины на другую появляется определённая погрешность.
Конвертация от массовой доли к молярной массе выполняется по формуле: Cb = (p * ɷb) / M (B), где: Cb — молярная концентрация, p — плотность, ɷb — массовая доля, M (B) — молярная масса. При этом когда плотность раствора изначально обозначается в грамм на миллилитр, а молярная в грамм на моль, то ответ необходимо умножить на 1 тыс. мл/л. Если же значение доли указано в процентах, то ответ необходимо разделить на 100%.
Для перехода от молярной к нормальной концентрации (молярной концентрации эквивалента), используется выражение: c * ((1 / z) * B) = Cb * z. Где молярность измеряется в моль на литр, а z — число эквивалентности (сопоставимое с одним молем катионов водорода в проходящей реакции). В определённых ситуациях выполняется и перевод массовой доли к титру. Выполняют это по формуле: T = p * ɷ, где p — плотность, измеряемая в граммах, делённых на миллилитры, а ɷ — массовая часть растворённого, в долях.
Перевести можно и молярность к титру. Используют для этого следующую формулу перехода: Т = Cb * M, в которой М — молярная масса разжиженного вещества. В случае же когда концентрация выражается в моль на литр, а масса в грамм на моль, ответ нужно разделить на 1 тыс. миллилитров на литр. Молярность связана с моляльностью формулой: mb = Cb / p, где р — плотность раствора, измеряемая в граммах, делённых на миллилитры.
Самый же сложный перевод происходит при конвертации моляльности к мольной доле. Для решения такой задачи используется формула для мольного элемента: Yb = mb / (mb + 1/ M (A)). В выражении mb обозначает моляльность, а M (A) — молярную массу растворителя. Чтобы ответ получился в одинаковых единицах измерения, цифра один в формуле представляется как 1000 г/кг. Это необходимо, когда моляльность подставляется в моль на килограмм, а масса в грамм на моль.
Для решения такой задачи используется формула для мольного элемента: Yb = mb / (mb + 1/ M (A)). В выражении mb обозначает моляльность, а M (A) — молярную массу растворителя. Чтобы ответ получился в одинаковых единицах измерения, цифра один в формуле представляется как 1000 г/кг. Это необходимо, когда моляльность подставляется в моль на килограмм, а масса в грамм на моль.
Вычисление концентрации
Чтобы получить раствор, необходимо между собой смешать растворитель и растворимое. Для того чтобы вычислить концентрацию, нужно знать или найти общий объём смеси, который будет равен сумме элементов, используемых при создании раствора. Измеряться концентрация может в различных величинах. Основные из них:
- грамм на литр (г/л) — отношение массы к объёму;
- молярность (моль) — содержание растворенных элементов к объёму раствора;
- миллионная часть (г / единица раствора) — соотношение растворённых веществ к одному миллиону единиц смеси;
- проценты (%) — ответ выражается в количестве растворённой доли в граммах к ста частям раствора.

Найти молярность, характеризуемую числом доли растворенных элементов, зная массу и формулу вещества несложно. Если количество растворённой части задано в других единицах, то их преобразуют в граммы.
Каждый элемент характеризуется молярной массой и определяется отношением массы к числу моль. Равна она атомной массе, которую можно взять из таблицы Менделеева. Для нахождения молярной величины нужно сложить все атомные числа элементов, смешанных в растворе.
Найдя молекулярное значение можно перейти к вычислению количества молей. Делается это с помощью формулы для молярной концентрации: масса растворённого вещества умножается на обратную молярную часть. Результат должен получиться в моль. На следующем этапе находится молярность. Полученное число молей делится на объём, измеряемого в литрах раствора. Обычно объёмом растворённой части пренебрегают.
По аналогии вычисляется концентрация и в процентном составе. Для этого нужно найти массу частей, составляющих раствор. На первом этапе все единицы измерения переводятся в граммы. Находится плотность, затем она умножается на объём и получается масса вещества в граммах. Вычисление концентрации в процентном составе находится как масса растворённого вещества, делённая на сумму массы растворяемого и растворителя, а после результат умножается на сто.
На первом этапе все единицы измерения переводятся в граммы. Находится плотность, затем она умножается на объём и получается масса вещества в граммах. Вычисление концентрации в процентном составе находится как масса растворённого вещества, делённая на сумму массы растворяемого и растворителя, а после результат умножается на сто.
Так как проценты являются сотой долей, то для получения ответа в миллионной доле результат нужно умножить ещё на 10 тысяч.
Примеры расчёта
Определением молярности раствора занимается химия. В процессах участвуют различные частицы, количество которых даже в малых объёмах велико. Значение молярной концентрации определяется не только количественным, но и качественным составом. Самые простые задачи связаны с нахождением молярной массы. Например, для соединения Ch5 она наводится следующим образом:
Мr (Ch5) = Ar + 4Ar (H) = 12 + 4 =16
Получается, что масса метана содержит 16 г/моль или 6,02Ч * 1023 молекул. Буква «Ч» используется для обозначения части.
Буква «Ч» используется для обозначения части.
Теперь можно найти массу в объёмном количестве. Например, нужно определить массу метана смешанном в количестве двух моль. Так как для метана его масса составляет 16 г/моль, то ответом будет:
м (метан) = 2 * 16 = 32 г
Много задач встречается на нахождение массовой доли в растворе. Например, в 200 грамм соли добавили 80 грамм воды. Чтобы определить часть соли в полученной смеси необходимо найти первоначальную её долю в растворе: M1 = w * m = 0,14 * 200 = 28 гамм. Затем вычислить массу нового раствора: М2 = 200 + 80 = 280 грамм. И воспользовавшись формулой получить ответ: W = M1 / M2 = 28 / 280 = 0,100.
Немного сложнее задачи на расчёт грамм-эквивалента. Пусть нужно найти нормальность серной кислоты, смешанной с раствором щёлочи. При смешении образуется соединение: NaSO4. Так как при реакции серная кислота нейтрализует гидросульфат натрия только частично то можно записать: Н2SO4 + NaOH = NaHSO4 + Н2О. Серная кислота представляет основу равную единице, поэтому и фактор эквивалентности также будет составлять единицу.
Серная кислота представляет основу равную единице, поэтому и фактор эквивалентности также будет составлять единицу.
Экв (h3SO4) =1 * ф = 1/1 = 1
Отсюда следует, что значение молярности эквивалента кислоты:
Мэкв (h3SO4) = M * Ф = M/1 = 98/1 = 98 г/экв
Нужно найти массовую часть и молярность эквивалента смеси, полученной при смешивании 400 мл раствора серной кислоты (p =1, 18 г/мл) и 400 мл восьмипроцентного раствора серной кислоты (p = 1,05 г/мл).
Вначале следует вычислить массу первого раствора и содержание в нём серной кислоты:
m (р-ра) = p (р-ра) * V (р-ра) = 1,18 * 400 = 720 г
m (h3SO4) = V (h3SO4) * м (h3SO4)= С (h3SO4) * V (р-ра) * М (h3SO4) = 720 * 0,2 — 98 = 46 г
Затем определить массу второго раствора и содержание в нём количества серной кислоты:
m (р-ра) = р (р-ра) * V (р-ра) = 1,05 * 400 = 420 г
m = m (р-ра) * (h3SO4)= 420 * 0,08 = 24 г
Часть полученного раствора находится по формуле:
ɷ (h3SO4) = m (h3SO4) / m (р-ра) = (46 + 24) / (720+420) = 0,146
Ответ удобнее записать в процентном соотношении — 14,6%.
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.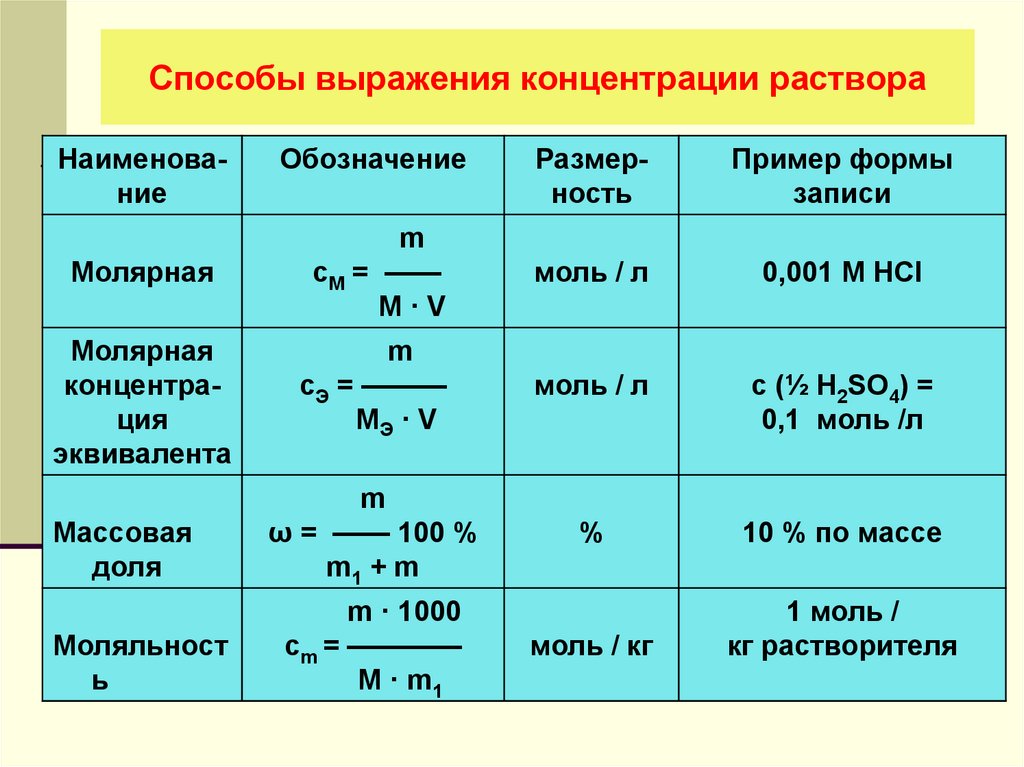
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Определение молярной концентрации и формулы для её расчёта
В природе практически невозможно найти вещество в чистом виде. Тела соприкасаются, перемешиваются образуя смеси. Одним из видов описания растворов является молярная концентрация. Это важное понятие в химии, характеризующее количественную часть. Выражается чаще всего эта величина через массовую долю, показывающую чистоту раствора. Измеряется она в единичных долях или процентах и находится по химической формуле.
Содержание
- Основные понятия и определения
- Молярная масса и доли
- Формулы перехода
- Вычисление концентрации
- Примеры расчёта
Основные понятия и определения
Под раствором в химии понимают твёрдую или жидкую однородную систему, состоящую из нескольких компонентов. Вещества образующие раствор разделяются на растворители и растворённые.
Вещества образующие раствор разделяются на растворители и растворённые.
Например, сахар, находящийся в воде — такая смесь называется двухгомогенная. Если же в сахарную воду добавить уксус, то полученный раствор уже будет трёхгомогенный. Количество в смеси того или иного разжиженного компонента называется концентрацией. Изменяться она может в широких пределах.
Существует несколько способов выражения концентрации растворов:
 Показывает количество моль разжиженного тела в одном кубическом дециметре. Обозначается характеристика латинскими символами Cb и находится из выражения: Cb = v моль / V дм³. То есть запись: 0,6 M NaCl будет означать, что 0,6 моль NaCl растворено в одном кубическом дециметре смеси.
Показывает количество моль разжиженного тела в одном кубическом дециметре. Обозначается характеристика латинскими символами Cb и находится из выражения: Cb = v моль / V дм³. То есть запись: 0,6 M NaCl будет означать, что 0,6 моль NaCl растворено в одном кубическом дециметре смеси. Измеряется в граммах: Т = n / V см³.
Измеряется в граммах: Т = n / V см³.Молярная масса и доли
Для измерения массы используются граммы, килограммы, тонны, но для обозначения количества вещества они не подходят. В химических процессах принимают участие различные частицы, такие как молекулы, атомы, ионы. Поэтому для того чтобы определить, сколько вещества содержится в той или иной смеси, ввели специальную единицу — моль. Иными словами — это множество, в котором объединены масса с числом.
Концентрация — это значение количества объёма раствора к растворенному в нём телу. Наиболее часто для измерения применяется массовая доля разжиженного вещества, молярная и нормальная концентрация. Массовая часть — это неизмеряемая величина. Складывается она из двух масс:
- растворителя — вещества способного ослаблять другие тела;
- растворимого — разжижающегося состава, поглощаемого растворителем.

Способность же вещества поглощаться другим называют растворимостью. При определении результата взаимодействия растворов находится массовая доля каждого из них.
Молярная масса показывает массу одного моль вещества и измеряется в граммах, делённых на моль. Если необходимо отмерить один моль, то нужно будет взять столько граммов вещества, сколько их содержится в относительной атомной массе или же, относительной молекулярной массе. Один моль всегда содержит постоянное число молекул, называемое константой Авогадро. Равно оно: N = 6 * 1023. Для того чтобы рассчитать число молекул в определённом веществе используют формулу:
N = Na * n, где Na — постоянная Авогадро, n — количество вещества. То есть моль — это количество в котором содержится 6 * 1023 молекул. Молярная концентрация определяет, сколько моль разжиженного вещества содержится в одном литре раствора.
Считается, что в единице объёма находится некая величина, определяемая числом молекул.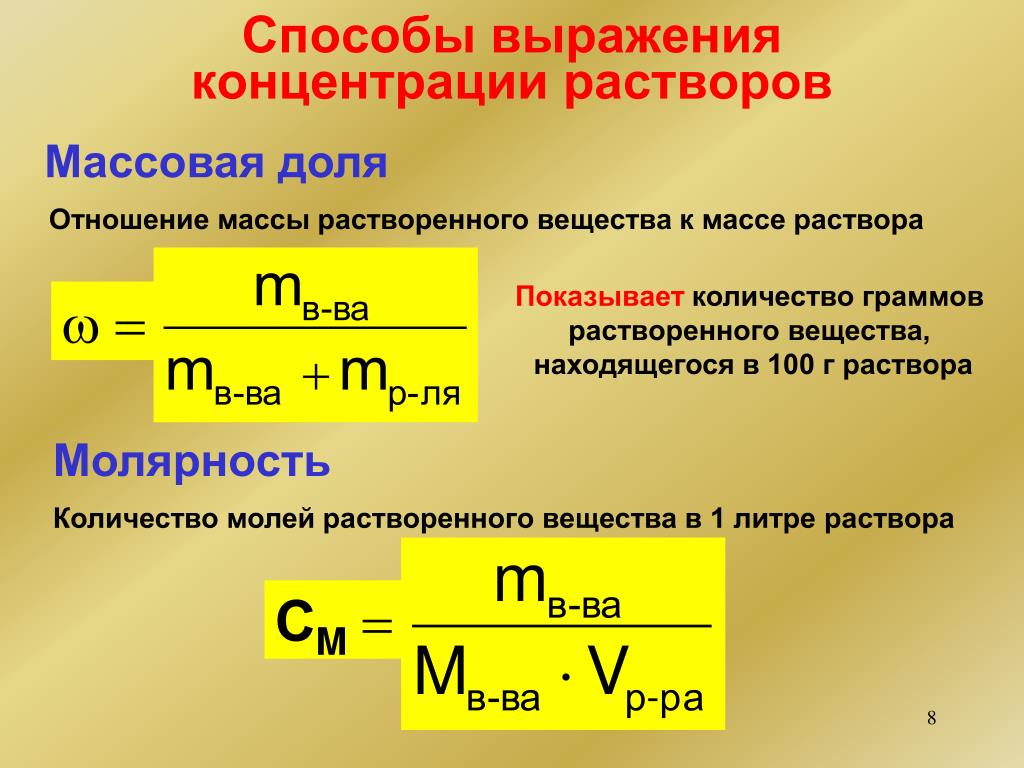 Записывается это определение как n = N / V и называется концентрацией молекул. Измеряется она в м3. Важно отметить, что концентрация связана с плотностью соотношением: n = p / m0 и показывает число структурных молекул, находящихся в единице объёме. Поэтому плотность используется при нахождении массы на единицу объёма, а концентрация при вычислении количества молекул.
Записывается это определение как n = N / V и называется концентрацией молекул. Измеряется она в м3. Важно отметить, что концентрация связана с плотностью соотношением: n = p / m0 и показывает число структурных молекул, находящихся в единице объёме. Поэтому плотность используется при нахождении массы на единицу объёма, а концентрация при вычислении количества молекул.
Массовая доля растворимого часто называется процентной концентрацией. При этом вместо процентного определения используется молярная концентрация. Другими словами, отношение количества к объёму в литрах. Зная число молей в одном литре довольно просто подобрать необходимое число молей используя специальную посуду.
Формулы перехода
Расчёт количества той или иной части концентрированной смеси, возможно, выполнить в различных единицах. Но между тем существуют формулы перехода от одних выражений к другим. При пересчёте происходит округление знака после запятой, поэтому при переходе с одной величины на другую появляется определённая погрешность.
При пересчёте происходит округление знака после запятой, поэтому при переходе с одной величины на другую появляется определённая погрешность.
Конвертация от массовой доли к молярной массе выполняется по формуле: Cb = (p * ɷb) / M (B), где: Cb — молярная концентрация, p — плотность, ɷb — массовая доля, M (B) — молярная масса. При этом когда плотность раствора изначально обозначается в грамм на миллилитр, а молярная в грамм на моль, то ответ необходимо умножить на 1 тыс. мл/л. Если же значение доли указано в процентах, то ответ необходимо разделить на 100%.
Для перехода от молярной к нормальной концентрации (молярной концентрации эквивалента), используется выражение: c * ((1 / z) * B) = Cb * z. Где молярность измеряется в моль на литр, а z — число эквивалентности (сопоставимое с одним молем катионов водорода в проходящей реакции). В определённых ситуациях выполняется и перевод массовой доли к титру. Выполняют это по формуле: T = p * ɷ, где p — плотность, измеряемая в граммах, делённых на миллилитры, а ɷ — массовая часть растворённого, в долях.
Перевести можно и молярность к титру. Используют для этого следующую формулу перехода: Т = Cb * M, в которой М — молярная масса разжиженного вещества. В случае же когда концентрация выражается в моль на литр, а масса в грамм на моль, ответ нужно разделить на 1 тыс. миллилитров на литр. Молярность связана с моляльностью формулой: mb = Cb / p, где р — плотность раствора, измеряемая в граммах, делённых на миллилитры.
Самый же сложный перевод происходит при конвертации моляльности к мольной доле. Для решения такой задачи используется формула для мольного элемента: Yb = mb / (mb + 1/ M (A)). В выражении mb обозначает моляльность, а M (A) — молярную массу растворителя. Чтобы ответ получился в одинаковых единицах измерения, цифра один в формуле представляется как 1000 г/кг. Это необходимо, когда моляльность подставляется в моль на килограмм, а масса в грамм на моль.
Вычисление концентрации
Чтобы получить раствор, необходимо между собой смешать растворитель и растворимое. Для того чтобы вычислить концентрацию, нужно знать или найти общий объём смеси, который будет равен сумме элементов, используемых при создании раствора. Измеряться концентрация может в различных величинах. Основные из них:
Для того чтобы вычислить концентрацию, нужно знать или найти общий объём смеси, который будет равен сумме элементов, используемых при создании раствора. Измеряться концентрация может в различных величинах. Основные из них:
- грамм на литр (г/л) — отношение массы к объёму;
- молярность (моль) — содержание растворенных элементов к объёму раствора;
- миллионная часть (г / единица раствора) — соотношение растворённых веществ к одному миллиону единиц смеси;
- проценты (%) — ответ выражается в количестве растворённой доли в граммах к ста частям раствора.
Найти молярность, характеризуемую числом доли растворенных элементов, зная массу и формулу вещества несложно. Если количество растворённой части задано в других единицах, то их преобразуют в граммы.
Каждый элемент характеризуется молярной массой и определяется отношением массы к числу моль. Равна она атомной массе, которую можно взять из таблицы Менделеева. Для нахождения молярной величины нужно сложить все атомные числа элементов, смешанных в растворе.
Для нахождения молярной величины нужно сложить все атомные числа элементов, смешанных в растворе.
Найдя молекулярное значение можно перейти к вычислению количества молей. Делается это с помощью формулы для молярной концентрации: масса растворённого вещества умножается на обратную молярную часть. Результат должен получиться в моль. На следующем этапе находится молярность. Полученное число молей делится на объём, измеряемого в литрах раствора. Обычно объёмом растворённой части пренебрегают.
По аналогии вычисляется концентрация и в процентном составе. Для этого нужно найти массу частей, составляющих раствор. На первом этапе все единицы измерения переводятся в граммы. Находится плотность, затем она умножается на объём и получается масса вещества в граммах. Вычисление концентрации в процентном составе находится как масса растворённого вещества, делённая на сумму массы растворяемого и растворителя, а после результат умножается на сто.
Так как проценты являются сотой долей, то для получения ответа в миллионной доле результат нужно умножить ещё на 10 тысяч.
Примеры расчёта
Определением молярности раствора занимается химия. В процессах участвуют различные частицы, количество которых даже в малых объёмах велико. Значение молярной концентрации определяется не только количественным, но и качественным составом. Самые простые задачи связаны с нахождением молярной массы. Например, для соединения Ch5 она наводится следующим образом:
Мr (Ch5) = Ar + 4Ar (H) = 12 + 4 =16
Получается, что масса метана содержит 16 г/моль или 6,02Ч * 1023 молекул. Буква «Ч» используется для обозначения части.
Теперь можно найти массу в объёмном количестве. Например, нужно определить массу метана смешанном в количестве двух моль. Так как для метана его масса составляет 16 г/моль, то ответом будет:
м (метан) = 2 * 16 = 32 г
Много задач встречается на нахождение массовой доли в растворе. Например, в 200 грамм соли добавили 80 грамм воды. Чтобы определить часть соли в полученной смеси необходимо найти первоначальную её долю в растворе: M1 = w * m = 0,14 * 200 = 28 гамм. Затем вычислить массу нового раствора: М2 = 200 + 80 = 280 грамм. И воспользовавшись формулой получить ответ: W = M1 / M2 = 28 / 280 = 0,100.
Например, в 200 грамм соли добавили 80 грамм воды. Чтобы определить часть соли в полученной смеси необходимо найти первоначальную её долю в растворе: M1 = w * m = 0,14 * 200 = 28 гамм. Затем вычислить массу нового раствора: М2 = 200 + 80 = 280 грамм. И воспользовавшись формулой получить ответ: W = M1 / M2 = 28 / 280 = 0,100.
Немного сложнее задачи на расчёт грамм-эквивалента. Пусть нужно найти нормальность серной кислоты, смешанной с раствором щёлочи. При смешении образуется соединение: NaSO4. Так как при реакции серная кислота нейтрализует гидросульфат натрия только частично то можно записать: Н2SO4 + NaOH = NaHSO4 + Н2О. Серная кислота представляет основу равную единице, поэтому и фактор эквивалентности также будет составлять единицу.
Экв (h3SO4) =1 * ф = 1/1 = 1
Отсюда следует, что значение молярности эквивалента кислоты:
Мэкв (h3SO4) = M * Ф = M/1 = 98/1 = 98 г/экв
Нужно найти массовую часть и молярность эквивалента смеси, полученной при смешивании 400 мл раствора серной кислоты (p =1, 18 г/мл) и 400 мл восьмипроцентного раствора серной кислоты (p = 1,05 г/мл).
Вначале следует вычислить массу первого раствора и содержание в нём серной кислоты:
m (р-ра) = p (р-ра) * V (р-ра) = 1,18 * 400 = 720 г
m (h3SO4) = V (h3SO4) * м (h3SO4)= С (h3SO4) * V (р-ра) * М (h3SO4) = 720 * 0,2 — 98 = 46 г
Затем определить массу второго раствора и содержание в нём количества серной кислоты:
m (р-ра) = р (р-ра) * V (р-ра) = 1,05 * 400 = 420 г
m = m (р-ра) * (h3SO4)= 420 * 0,08 = 24 г
Часть полученного раствора находится по формуле:
ɷ (h3SO4) = m (h3SO4) / m (р-ра) = (46 + 24) / (720+420) = 0,146
Ответ удобнее записать в процентном соотношении — 14,6%.
Предыдущая
ХимияСвойства металлов — общие химические и физические свойства
Следующая
ХимияХром (Cr) — химические и физические свойства, формула, применение
Как рассчитать молярность раствора?
Молярность используется для измерения концентрации раствора. Он используется для расчета объема растворителя или количества растворенного вещества. Молярность – это концентрация раствора или вещества в растворе, измеряемая как количество молей растворенного вещества на литр раствора. Обозначается заглавной буквой «М». Мельчайшая частица вещества, которая может принять участие в химической реакции, называется атомом. Молекула состоит из двух или более атомов, тесно связанных друг с другом. Моль — это основная единица СИ. Используется для измерения количества вещества. Моль любого вещества (атома, молекулы и т. д.) равна 6,022 × 10 23 молекулы. Молекулярная масса определяется как сумма атомных масс всех атомов в молекуле вещества. Он выражается в атомной единице массы (u). Например,
Он используется для расчета объема растворителя или количества растворенного вещества. Молярность – это концентрация раствора или вещества в растворе, измеряемая как количество молей растворенного вещества на литр раствора. Обозначается заглавной буквой «М». Мельчайшая частица вещества, которая может принять участие в химической реакции, называется атомом. Молекула состоит из двух или более атомов, тесно связанных друг с другом. Моль — это основная единица СИ. Используется для измерения количества вещества. Моль любого вещества (атома, молекулы и т. д.) равна 6,022 × 10 23 молекулы. Молекулярная масса определяется как сумма атомных масс всех атомов в молекуле вещества. Он выражается в атомной единице массы (u). Например,
2H + + O 2 ⇢ H 2 O = 1×2 +16 = 18u
Разбавление – это процесс, при котором в раствор добавляют больше растворителя, чтобы сделать его менее концентрированный. Концентрация раствора – это количество растворенного вещества в растворе. Существует разница между молярностью и молярной массой, молярность — это количество молей растворенного вещества на литр раствора, а молярная масса — это количество граммов на моль некоторого вещества.
Существует разница между молярностью и молярной массой, молярность — это количество молей растворенного вещества на литр раствора, а молярная масса — это количество граммов на моль некоторого вещества.
Расчет молярности
Молярность определяется как количество молей растворенного вещества, растворенного в одном литре раствора. Она также известна как молярная концентрация и обозначается буквой «М».
Формула молярности
77779930M = N/V
, где
9
- M обозначает молярную концентрацию
- N обозначает количество молей
- V обозначает общий объем раствора в литерах
- Чтобы найти молярность раствора, мы делим количество молей растворенного вещества на общий объем литров раствора.

- Если количество растворенного вещества указано в граммах, то мы должны сначала найти или рассчитать количество молей растворенного вещества.
- Чтобы найти количество молей растворенного вещества, мы можем вычислить его путем деления на молекулярную массу растворенного вещества. Таким образом, когда его делят на общий объем, ответом является молярность.
- Объем удельной массы в заданных граммах раствора также можно рассчитать с помощью процесса, найдя количество молей растворенного вещества, как указано выше. Затем разделить на молярность, чтобы найти общий объем раствора.
Примеры задач
Задача 1. Какова молярность раствора при растворении 42,5 г H 2 SO 4 в 1 литре раствора?
Раствор :
Масса = 42,5 г, объем раствора = 1 л приведенная масса/молекулярная масса
n = 42,5 г/98,076 г моль -1
n = 0,43 моля
Теперь разделите число.
молей к общему объему раствора.
M = 0,43 моль/л
M = 0,43
Молярность H 2 SO 4 равна 0,43M.
Задача 2: Если морская вода содержит 40 г хлорида натрия на 500 мл, то какова молярность раствора?
Раствор :
Масса = 40 г, объем раствора = 500 мл
По формуле
M = n/v
но мы должны найти число молей
n = данная масса/молекулярная масса
n = 40 г/58,443 г моль -1
n = 0,68 моль
900 . молей к общему объему раствора
Перевести мл в л
M = 0,68 г/0,500 л
M = 1,36
Молярность NaCl равна 1,36M.
Задача 3: Сколько молей Na 2 CO 3 содержится в 15 л 2М раствора?
Решение:
При заданных M = 2, v = 15L и n = ?
с использованием формулы
M = N/V
2m = N/15L
n = 2m × 15L
n = 30 молей
Есть 30 молей Na 2 CO 3 Присутствует в 15 л 2М раствора.
Задача 4. Сколько молей содержится в 20,0 мл 2,0 М раствора HCL?
Решение:
Дано: M = 2,0, v = 20,0 мл и n = ?
Преобразование миллилитров в литры
По формуле
В 20,0 мл 2,0 М раствора HCl содержится 0,040 молей.
Задача 5: Сколько граммов H 2 SO 4 по весу требуется для приготовления 950 мл 0,500 М раствора?
Решение:
Дано: M = 0,500, v = 950 мл
M = n/v
Чтобы найти массу (граммы),
Mv = n
Где n = масса/молекулярная масса
Mv = масса/молекулярная масса
0,500M × 0,950L = x/98,0768 г моль -1
x = 0,500 м × 0,950L × 98,0768 г моль -1
x = 46,6 г
46,6 Грамм H 2 SO 4 в весах, требуемом для получения 950ml из 0,500 м. .
Задача 6: Сколько граммов Ca(OH) 2 необходимо для приготовления 250 мл 0,350 М раствора?
Решение:
Указано M = 0,350, V = 250 мл
M = N/V
для поиска массы (грамм),
MV = N
N = масса/молекулярная масса
N = x/74.
0918 г моль -1
MV = x/74.0918 г моль -1
x = 0,350 м × 0,250L × 74,0918 г -1
x = 6,48G
6,48G. Ca(OH) 2 необходимы для приготовления 250 мл 0,350 М раствора.
Задача 7: Какой общий объем в мл 10,0 М HCl требуется, чтобы содержать 5,00 моль раствора HCl?
Решение:
При заданных M = 10,0, n = 5,00 молей и v = ?
с использованием формулы,
M = N/V
V = N/M
V = 5,00 молей/10,00 м
V = 0,500L
Следовательно, необходимо 500 мл объема, чтобы 10,0 М HCl содержало 5,00 моль раствора HCl.
Задача 8. Какова молярность 25 г раствора NaCl, растворенного в воде для получения 2 л раствора?
Решение:
Данная масса = 25 г, v = 2 л и M = ?
Сначала мы должны перевести граммы в моли, разделив на молекулярную массу NaCl 58,4 г/моль.
M = n/v
n = приведенная масса/молекулярная масса
n = 25 г/58,4 г моль -1
n = 0,42 моль.
Теперь разделите номер. молей при общем объеме раствора
М = 0,42 моль/2 л
М = 0,2
Молярность NaCl составляет 0,2 М.
ChemTeam: Молярность
ChemTeam: МолярностьМолярность
Десять примеров
Вернуться в меню решений
Перейти к заданиям на молярность #1-10
Перейти к задачам на молярность #11-25
Перейти к задачам на молярность #26-35
Как следует из названия, молярность включает родинки. Мальчик, получается!
Молярность раствора рассчитывается путем деления молей растворенного вещества на литры раствора.
моль растворенного вещества Молярность = –––––––––––––– литра раствора
Наверное, проще всего это объяснить на примерах.
Пример #1:
Предположим, у нас есть 1,00 моль сахарозы (ее масса составляет около 342,3 грамма) и мы начали смешивать ее с небольшим количеством воды. Он растворялся и превращался в сахарную воду. Мы продолжаем добавлять воду, растворяя и перемешивая, пока не исчезнет все твердое вещество. Затем мы убедились, что когда все хорошо перемешано, получается ровно 1,00 литра раствора.Какой должна быть молярность этого раствора?
Решение:
1,00 моль Молярность = ––––––– 1,00 л
Ответ: 1,00 моль/л. Обратите внимание, что обе единицы моль и L остаются. Ни отменяет.
Часто используется символ моль/л. Это заглавная М.
В некоторых учебниках буква М выделяется курсивом, а в некоторых ставится тире, например: 1.00- М. Когда вы пишете от руки; печатная буква М просто прекрасна.
Когда вы произносите это вслух, говорите так: «Одно очко моляра». Вам не нужно произносить тире (если оно есть). Кстати, вы иногда видите 1,00 М так: 1,00-моль. Тире обычно используется, когда вы пишете слово «моляр».
И никогда не забывайте об этом: заменяйте M на моль/л при расчетах. М — это символ молярности, моль/л — это единица измерения, используемая в расчетах.
Пример #2: Предположим, вы растворили 2,00 моль растворенного вещества в 1,00 л раствора. Какая молярность?
Решение:
2,00 моль Молярность = ––––––– 1,00 л
Ответ: 2,00 М.
Обратите внимание, что конкретное вещество вообще не упоминается. Молярность будет одинаковой. Неважно, сахароза это, хлорид натрия или любое другое вещество. Один моль сахарозы, хлорида натрия или чего-либо еще содержит одинаковое количество химических единиц. И это число 6,022 х 10 23 единиц, называемых числом Авогадро.
Пример #3: Какова молярность, когда 0,750 моль растворяется в 2,50 л раствора?
Решение:
0,750 моль Молярность = ––––––––– = 0,300 М 2,50 л
Теперь давайте перейдем от молей к граммам. Это гораздо более распространено. В конце концов, химики используют весы для взвешивания, а весы дают граммы, а НЕ моли.
В конце концов, химики используют весы для взвешивания, а весы дают граммы, а НЕ моли.
Пример #4: Предположим, у вас есть 58,44 грамма NaCl, и вы растворили его ровно в 2,00 л раствора. Какова будет молярность раствора?
Решение:
Есть два шага к решению этой проблемы. В конце концов, два шага будут объединены в одно уравнение.
Шаг первый: переведите граммы в моли.Шаг второй: разделите моли на литры, чтобы получить моляльность.
В приведенной выше задаче 58,44 г/моль — это молярная масса NaCl. (Есть термин «формульная масса» и термин «молекулярная масса». Между ними есть техническое различие, которое сейчас не важно. Термин «молярная масса» является более общим термином.) Чтобы решить проблему:
Шаг первый: деление 58,44 г на 58,44 г/моль дает 1,00 моль.Второй этап: деление 1,00 моль на 2,00 л дает 0,500 моль/л (или 0,500 М).
Комментарий: помните, что иногда в книге пишется слово «молярный», например, 0,500-молярный.
Пример #5: Рассчитайте молярность 25,0 г KBr, растворенного в 750,0 мл.
Решение:
1) Перевести граммы в моли:
25,0 г –––––––––– = 0,210 моль 119,9 г/моль
2) Рассчитайте молярность:
0,210 моль –––––––– = 0,280 М 0,750 л
Пример #6: 80,0 г глюкозы (C 6 H 12 O 6 , молекулярная масса = 180 г/моль) растворяют в воде, достаточном для получения 1,00 л раствора. Какова его молярность?
Какова его молярность?
Решение:
1) Перевести граммы в моли:
80,0 г –––––––––– = 0,444 моль 180,0 г/моль
2) Рассчитайте молярность:
0,444 моль –––––––– = 0,444 М 1,00 л
Обратите внимание, как постоянно появляется фраза «решения». Определение молярности основано на объеме раствора, а НЕ на объеме использованной чистой воды. Например, чтобы сказать так:
Например, чтобы сказать так:
«Одномолярный раствор готовят добавлением одного моля растворенного вещества к одному литру воды».
совершенно неверно. Это «один литр раствора», а не «один литр воды».
Правильно:
«Одномолярный раствор готовят добавлением одного моля растворенного вещества к количеству воды, достаточному для получения одного литра раствора».
Наиболее типичная задача молярности выглядит так:
Какова молярность _____ грамм [химического вещества], растворенного в _____ мл (или л) раствора.
Чтобы решить эту проблему, вы переводите массу (в граммах) в моли, а затем делите на объем, например:
масса ––––––––– = моль молярная масса
моль –––––– = молярность объем
Два только что упомянутых шага можно объединить в одно уравнение. Во-первых, я изменю второе уравнение (с M для молярности и V для объема):
Во-первых, я изменю второе уравнение (с M для молярности и V для объема):
моля = МВ
Поскольку количество молей в первом уравнении равно количеству молей во втором уравнении, я могу написать так:
масса МВ = ––––––––– молярная масса
Пример #7: При растворении 2,50 г KMnO 4 (молярная масса = 158,0 г/моль) в 100 мл раствора какая молярность получается?
2,50 г (х) (0,100 л) = –––––––––– 158,0 г/моль x = 0,158 M (до трех знаков)
Следующий пример является наиболее распространенным типом, который вы увидите:
Пример #8: Сколько граммов KMnO 4 необходимо для приготовления 500 мл 0,200 М раствора?
х (0,200 моль/л) (0,500 л) = –––––––––– 158,0 г/моль х = 15,8 г (до трех цифр)
Обратите внимание на использование моль/л.
В реальных расчетах используйте моль/л, а не M.
Пример #9: 10,0 г уксусной кислоты (CH 3 COOH) растворяют в 500 мл раствора. Какая молярность получается?
10,0 г (х) (0,500 л) = –––––––––– 60,05 г/моль x = 0,333 M (до трех цифр)
Убедитесь, что в этом уравнении всегда используются литры. Никогда мл или см 3 или что-то еще. Только литры. Или, если хотите, дм 3 .
Пример #10: Сколько мл раствора получится при растворении 15,0 г H 2 SO 4 с получением 0,200 М раствора?
15,0 г (0,200 моль/л) (х) = –––––––––– 98,07 г/моль х = 0,765 л (до трех знаков инжира)
В требуемом объеме 76,5 мл.
Дополнительный пример: Четыреххлористый углерод (CCl 4 ) имеет плотность 1,59 кг/л. Какова концентрация (в моль/л) чистого CCl 4 ?
Решение:
Предположим, что имеется 1,00 л CCl 4 .(1,59 кг/л) (1,00 л) = 1,59 кг
(1,59 кг) (1000 г/кг) = 1590 г
1590 г / 153,823 г/моль = 10,336556 моль
10,336556 моль/1,00 л = 10,3 М (до трех знаков фиг.)
Перейти к заданиям на молярность #1-10
Перейти к задачам на молярность #11-25
Перейти к задачам на молярность #26-35
Вернуться в меню решений
Формула молярности и расчет молярности
Степень растворения растворенного вещества в растворе выражается концентрацией раствора .
Расчет молярности. Как найти молярность раствора > Концентрация чаще всего выражается как молярность (M).
-или-
Формула молярностипрактика, практика. Итак, давайте теперь перейдем к некоторым примерам молярности.
Готов? Итак, приступим…
— — — — —
пример: Рассчитайте молярность раствора, полученного растворением 11,5 г твердого NaOH в количестве воды, достаточном для получения 1,50 л раствора.
________
ответ:
Молярность = моль NaOH / л раствора
➞ у нас уже есть «л раствор» ➞ 1,50 л
➞ мы можем рассчитать «моль NaOH» найдите молярность…
Преобразование граммов в моли Хорошо , так что теперь у нас есть и наш числитель, 0,288 моль NaOH , и у нас всегда был наш знаменатель (данный), 1,50 л . Давайте разделим два и найдем молярность: 92+ и
1,0 м no₃-
—-
Ex: Рассчитайте количество молей хлорида в 1,75 л. –5 молей NaCl 9–4 л крови (раствор).
–5 молей NaCl 9–4 л крови (раствор).
Вот это лучше…
Расчет молярности сыворотки крови— — — — —
пример: Химику требуется 1,00 л водного 0,200 М раствора K₂Cr₂O₇. Сколько твердого K₂Cr₂O₇ ему нужно взвесить?
________
Ответ:
Мы имеем [x «L» y «M» ] ➞ L*M = L*(моль/л) = моль
моль . 1,00 л/1) (0,200 моль K₂Cr₂O₇/1 л) = 0,200 моль K₂Cr₂O₇ ➞ (0,200 моль k₂cr₂o₇ / 1) (294 г k₂cr₂o₇ / 1 моль K₂cr₂o₇) = 58,8 г k₂cr₂o₇ Вот легкая версия вышеупомянутых вычислений молярности: ========== Люди используют термины разбавленный и концентрированный каждый день для описания содержимого жидкости качественно . разбавленный = «разбавленный водой» Обычно высококонцентрированные «исходные растворы» закупаются лабораторией, и химики добавляют воду для достижения желаемой молярности (концентрации). Уравнение разбавления: M = молярность (моль/л) являются НЕ изменены с положения 1 (M₁V₁) на положение 2 (M₂V₂). — — — — — пр: Какой объем 16 М серной кислоты необходимо использовать для приготовления 1,5 л 0,10 М раствора H₂SO4? Итак, имеем: М₁ = 16 М M₂ = 0,10 м ➞ M₁V₁ = M₂V₂ ➞ (16 м) (x l) = (0,10 м) (1,5 л) ➞ (16x) моль = 0,15 моль ➞ x = 0,0094 л или 9,4 мл Вот лучше посмотрите на все это… Чтобы приготовить 1,5 л 0,10 М раствора H₂SO4, химик должен добавить 9,4 мл 16 М H, а затем 9₄SO0021 добавьте столько воды, чтобы общий конечный объем составил 1,5 л. ========== Далее в различные типы химических реакций… ========== Мой блог дает вам только первые 3 видео из каждого из 20 разделов (глав). 60 Видео в блоге против Все 143 видео внутри. Хм… Хотите получить полный доступ к ВСЕМ 143 видеоурокам? ДА ПОЖАЛУЙСТА 〉 Первоначально: https://chemistrynotes.com Другим способом выражения концентрации является количество молей растворенного вещества на единицу объема раствора. Из всех количественных мер концентрации химики чаще всего используют молярность. 9+} \right]\) относится к молярности иона серебра в растворе. Концентрации растворов, выраженные в молярности, проще всего выполнить в расчетах, но труднее всего произвести в лаборатории. Такие единицы концентрации полезны для обсуждения химических реакций, в которых растворенное вещество является продуктом или реагентом. Затем можно использовать молярную массу в качестве коэффициента преобразования для преобразования количеств в молях в количества в граммах. Важно помнить, что «моль» в этом выражении относится к молям растворенного вещества, а «л» — к литрам раствора. Например, если в 0,500 л раствора растворено 1,5 моля NaCl, его молярность равна 9.0005 \[\mathrm{\dfrac{1,5\: моль\: NaCl}{0,500\: L\: раствор}=3,0\: M\: NaCl} \номер \] Иногда (водн. Обязательно обратите внимание, что молярность рассчитывается как общий объем всего раствора , а не только объем растворителя! Растворенное вещество вносит свой вклад в общий объем. Если количество растворенного вещества указано в единицах массы, вы должны преобразовать единицы массы в молярные единицы, прежде чем использовать определение молярности для расчета концентрации. Например, какова молярная концентрация раствора 22,4 г HCl, растворенного в 1,56 л? Шаг 1. Сначала переведите массу растворенного вещества в моли, используя молярную массу HCl (36,5 г/моль): \[22,4\отменить{gHCl}\times \dfrac{1\: моль\: HCl}{36,5\отменить{gHCl}}=0,614\, моль\; HCl \номер\] Шаг 2: Теперь мы можем использовать определение молярности для определения концентрации: \[M \: =\: \dfrac{0,614\: моль\: HCl}{1,56 л\: раствор}=0,394\, M HCl \номер \] Прежде чем можно будет рассчитать молярную концентрацию, количество растворенного вещества должно быть выражено в молях, а объем раствора должен быть выражен в литрах, как показано в следующем примере. Раствор готовят путем растворения \(42,23 \: \text{g}\) \(\ce{NH_4Cl}\) в воде, достаточной для получения \(500,0 \ : \text{мл}\) раствора. Вычислите его молярность. Дано: Масса \(= 42,23 \: \text{g} \: \ce{NH_4Cl}\) Объем раствора \(= 500,0 \: \text{мл} = 0,5000 \: \text{л}\) Найти: Молярность = ? М 1. Массу хлорида аммония сначала переводят в моли. 2. Затем рассчитывается молярность путем деления на литры. Обратите внимание, что данный объем был преобразован в литры. \(\mathrm{M=\dfrac{mol\: NH_4Cl}{L\: раствор}} \) Теперь подставьте известные величины в уравнение и решите. \(\begin{align*} 42,23 \\cancel{\text{g} \: \ce{NH_4Cl}} \times \dfrac{1 \: \text{mol} \: \cancel{\ce{NH_4Cl} }}{53,50 \: \text{g} \: \ce{NH_4Cl}} &= 0,7893 \: \text{моль} \: \ce{NH_4Cl} \\ \dfrac{0,7893 \: \text{моль} \: \ce{NH_4Cl}}{0,5000 \: \text{L раствор}} &= 1,579 \: \text{M} \end{align*}\) Какова молярность раствора, полученного при 66,2 г C 6 H 12 O 6 растворяют, чтобы получить 235 мл раствора? 1,57 M C 6 H 12 O 6 Какова концентрация в \(\text{моль/л}\), где \(137 \: \text{g}\) \(\ce{ NaCl}\) был растворен в достаточном количестве воды, чтобы получилось \(500 \: \text{мл}\) раствора? 4,69 М NaCl Концентрация может быть коэффициентом преобразования количества растворенного вещества в количество раствора или растворителя (в зависимости от определения единицы концентрации). Таким образом, концентрации могут быть полезны в различных задачах стехиометрии. Простым примером использования единицы концентрации в качестве коэффициента преобразования является тот, в котором мы используем определение единицы концентрации и переставляем; мы можем сделать расчет снова как преобразование единиц, а не как определение. Например, предположим, что мы спрашиваем, сколько молей растворенного вещества содержится в 0,108 л 0,887 М раствора NaCl. . Поскольку 0,887 М означает 0,887 моль/л, мы можем использовать это второе выражение для концентрации в качестве коэффициента преобразования: \[0,108\отменить{л\, NaCl}\раз \dfrac{0,887\, моль\, NaCl}{\отменить{1л\, раствор}}=0,0958\, моль\, NaCl \ nonumber \] Если бы мы использовали подход определения, мы получили бы тот же ответ, но теперь мы используем навыки коэффициента преобразования. Как и любой другой коэффициент пересчета, который связывает два разных типа единиц, обратное значение концентрации может также использоваться в качестве коэффициента пересчета. Используя концентрацию в качестве коэффициента пересчета, сколько литров 2,35 М CuSO 4 необходимо для получения 4,88 моль CuSO 4 ? Это одношаговое преобразование, но концентрация должна быть записана как обратная единица измерения: dfrac{1\, L\, solution}{2,35\cancel{mol\, CuSO_{4}}}=2,08\, L\, of \, solution \nonumber \] В лабораторных условиях химик должен часто приготовить заданный объем растворов известной молярности. Задача состоит в том, чтобы рассчитать массу растворенного вещества, которое необходимо. Уравнение молярности можно изменить для решения в молях, которые затем можно преобразовать в граммы. Следующий пример иллюстрирует это. Химику нужно приготовить \(3,00 \: \text{L}\) \(0,250 \: \text{M}\) раствора перманганата калия \ (\слева(\ce{KMnO_4} \справа)\). Какая масса \(\ce{KMnO_4}\) нужна ей для приготовления раствора? Дано: Молярность \(= 0,250 \: \text{M}\) Объем \(= 3.00 \: \text{L}\) Найти: Масса \(\ce{KMnO_4} = ? \: \text{g}\) Молярная масса \(\ce{KMnO_4} = 158,04 \: \text{г/моль}\) 0,250 моль KMnO 4 на 1 л KMnO 4 решение Теперь подставьте известные величины в уравнение и решите. \(\begin{align*} \text{mol} \: \ce{KMnO_4} = 0,250 \: \text{M} \: \ce{KMnO_4} \times 3,00 \: \text{L} &= 0,750 \: \text{моль} \: \ce{KMnO_4} \\ \cancel{3.00 \: L \: раствор} \times \dfrac{0.250 \: \cancel{\text{моль} \: \ce{KMnO_4} }}{1\cancel{L \: раствор}} \times \dfrac{158.04 \: \text{g} \: \ce{KMnO_4}}{1 \: \cancel{\text{mol} \: \ce {KMnO_4}}} &= 119\: \text{g} \: \ce{KMnO_4} \end{align*}\) Используя концентрацию в качестве коэффициента пересчета, сколько литров 0,0444 M CH 2 O необходимо для получения 0,0773 моль CH 2 О? 1,74 л Ответьте на приведенные ниже задачи, используя концентрацию в качестве коэффициента преобразования. 6,12 г 183 мл или 0,183 л Посмотрите, как научно-технический персонал Флинна демонстрирует «Как готовить растворы». Важно отметить, что существует множество различных способов составления и решения химических уравнений. ПОД ЛИЦЕНЗИЕЙ Нет ничего лучше расслабляющего, чем стаканчик приятного лимонада в жаркий летний день. Но знаете ли вы, что на самом деле занимаетесь химией, когда делаете это? Количество порошка лимонада, которое вы насыпаете в стакан, в сочетании с количеством воды, которое вы наливаете, чтобы получить идеальную концентрацию, — это молярность в действии! Молярность – это концентрация растворенного вещества в растворе, выраженная в молях на литр. Молярность или молярная концентрация описывает концентрацию количества вещества, растворенного в жидкости. Мы называем вещество, которое мы растворяем, растворенным веществом, а жидкость — растворителем. В частности, молярность определяется количеством молей на литр: моль/л. Растворенные вещества могут состоять из всего, что растворяется в жидкости; они могут быть твердыми телами, другими жидкостями или даже газами. Вы можете узнать больше о них в нашей статье о растворах и смесях. Если вы знаете количество растворенного вещества в молях и объем растворителя, в котором оно растворено, найти молярность несложно! К счастью, стандартное уравнение молярности очень простое! Это: Три переменные определяются как: Часто задачи на молярность не так просты, как деление молей растворенного вещества на литры раствора. Вместо задачи, которая просто дает вам моли, она может дать вам общее количество частиц растворенного вещества, массу использованного растворенного вещества или реакцию, которая создает растворенное вещество. Давайте рассмотрим задачу: она может показаться сложной , но помните вашу конечную цель — вам нужно только найти общее количество молей растворенного вещества и общий объем раствора. Ученик готовит вкусную тарелку супа, найдите молярность соли (NaCl), если это рецепт: 1,5 л воды 60 г соли 0,5 кг макарон 0,75 л куриного бульона 200 г соленого масла (3% соли по весу) Несмотря на то, что эта проблема состояла из множества шагов, пока вы помните о своей конечной цели, работать над решением будет легко! Всегда помните, что вам нужно найти общее количество растворенного вещества и общий объем раствора. Если вы столкнетесь с какими-либо проблемами при выполнении любого из этих шагов, это может помочь освежить ваши знания о родинках и молекулярной массе в целом. При взаимодействии с химическими веществами почти всегда используются растворы. В общем, очень сложно реагировать на два сухих химиката, поэтому один или оба ваших реагента должны находиться в растворе. Как и в любой химической реакции, ключевыми игроками являются моли, даже если реакция происходит в растворе. Поэтому вам, вероятно, также необходимо рассчитать молярные отношения. К счастью, эти молярные отношения даже не нужно вычислять с помощью молей, их можно напрямую рассчитать с помощью молярности. Поскольку молярность всегда выражается по отношению к одному литру, молярное соотношение остается неизменным. Если у вас есть молярность раствора и объем раствора, очень легко вычислить количество молей в этом растворе. Просто умножьте обе части молярного уравнения на объем, чтобы получить: . Используя эту реакцию, найдите объем 1,2 М раствора KI (водн.) , необходимый для образования 1,5 моль PbI 2 при взаимодействии с избыточным количеством Pb(NO 3 ) 2 (водн.) . Эта задача является простым примером того, как молярность используется в реальных химических реакциях. Это важнейший компонент почти каждой реакции Если вам когда-либо придется делать раствор в лаборатории или вы просто хотите сдать экзамен по химии, вам нужно будет привыкнуть к молярность. Исходный раствор представляет собой стандартизированный раствор с точно известной молярной концентрацией, который можно найти в лабораториях в больших объемах. . Однако обычно вам потребуются более низкие концентрации HCl, примерно 0,1 М или около того, чтобы провести реакцию. Чтобы создать этот раствор с более низкой концентрацией, вы должны разбавить исходный раствор, добавив больше растворителя. В некоторых экспериментах, таких как титрование, более эффективны низкие концентрации кислот и оснований, поскольку их легче контролировать. К счастью, есть простой способ рассчитать необходимые разведения, просто используйте это уравнение: M 1 и V 1 относятся к объему и молярности исходного раствора соответственно. Обычно вы оставляете V 1 в качестве переменной, поскольку пытаетесь найти объем необходимого вам раствора. При проведении экспериментов независимая переменная всегда должна изменяться. Тестирование в широком диапазоне концентраций раствора может показать, влияет ли концентрация на зависимую переменную. В качестве эксперимента вы хотите проверить, влияет ли концентрация соли в воде на ее способность проводить электричество. Чтобы проверить это, вы хотите создать растворы с молярностью 5M и 1M, каждый из которых имеет общий объем 2 л. Сначала создайте раствор 5M NaCl с твердой солью, затем создайте 1M раствор, разбавив 5M раствор. Сначала создайте 5М раствор, Найдите необходимое количество соли в граммах Моли соли будут равны 5М*2л=10моль требуется Соль весит 58,55 г/моль, 10 моль умножить на 10, поэтому потребуется 585,5 г. Добавьте это количество соли к 2 л воды, чтобы получить 5М раствор. Во-вторых, разбавьте 5М раствор, чтобы получить 2 л 1М раствора Используйте уравнение Решите для V 1 , (1M*2L)/5M=0,4L Добавьте 0,4L 5M в химический стакан, затем добавьте столько воды, чтобы общий объем равнялся 2L. Это означает, что вам нужно будет добавить только 1,6 л воды. Помните, что общий объем должен составлять 2 л, а не количество добавляемой воды. Итак, резюмируем: для первого раствора потребуется 585,5 г соли и 2 л воды для второго раствора потребуется 0,4 л 5М раствора и 1,6 л воды 
концентрированный = содержит «много» ингредиентов, которые можно попробовать на вкус.
V = объем (соответствующие единицы, часто мл или л)
________
ответ:
В₁ = ??
V₂ = 1,5 л
13.6: Определение концентрации раствора – молярность
Цели обучения

 ) добавляют, когда растворителем является вода, например, «3,0 М NaCl (водн.)». Это читается как «3,00 молярный раствор хлорида натрия», что означает, что в одном литре раствора растворено 3,00 моля NaOH.
) добавляют, когда растворителем является вода, например, «3,0 М NaCl (водн.)». Это читается как «3,00 молярный раствор хлорида натрия», что означает, что в одном литре раствора растворено 3,00 моля NaOH.
Пример \(\PageIndex{1}\)
Решение
Действия по устранению неполадок Определите «данную» информацию и то, что проблема просит вас «найти». Перечислите другие известные количества. Молярная масса \(\ce{NH_4Cl} = 53,50 \: \text{г/моль}\) Спланируйте задачу. 
Отмена единиц и расчет. Подумайте о своем результате. Молярность равна \(1,579 \: \text{M}\), что означает, что литр раствора будет содержать \(1,579 \: \text{моль} \: \ce{NH_4Cl}\).  Уместны четыре значащие цифры.
Уместны четыре значащие цифры. Упражнение \(\PageIndex{1A}\)
Упражнение \(\PageIndex{1B}\)
Использование молярности в расчетах
 Во многих случаях лучше использовать исходное определение единицы концентрации; именно это определение обеспечивает коэффициент преобразования.
Во многих случаях лучше использовать исходное определение единицы концентрации; именно это определение обеспечивает коэффициент преобразования. Пример \(\PageIndex{2}\): определение молей растворенного вещества с учетом концентрации и объема раствора
Раствор

Пример \(\PageIndex{3}\): определение объема раствора по концентрации и молям растворенного вещества
Решение

Пример \(\PageIndex{4}\)
Решение
Действия по устранению неполадок Определите «данную» информацию и то, что проблема просит вас «найти». Перечислите другие известные количества. Спланируйте задачу. 
Отмена единиц и расчет. Подумайте о своем результате. Когда \(119 \: \text{g}\) перманганата калия растворяют в воде, чтобы получить \(3,00 \: \text{L}\) раствора, молярность составляет \(0,250 \: \text{M }\). Упражнение \(\PageIndex{4A}\)
Упражнение \(\PageIndex{4B}\)

Как указать концентрацию
 Некоторые учащиеся предпочитают отвечать на многошаговые вычисления одним длинным шагом, в то время как другие предпочитают прорабатывать каждый шаг по отдельности. Ни один из методов не обязательно лучше или хуже, чем другой метод — в зависимости от того, какой из них имеет наибольший смысл для вас , вам следует использовать. В этом тексте мы обычно будем использовать модульный анализ (также называемый анализом измерений или факторным анализом).
Некоторые учащиеся предпочитают отвечать на многошаговые вычисления одним длинным шагом, в то время как другие предпочитают прорабатывать каждый шаг по отдельности. Ни один из методов не обязательно лучше или хуже, чем другой метод — в зависимости от того, какой из них имеет наибольший смысл для вас , вам следует использовать. В этом тексте мы обычно будем использовать модульный анализ (также называемый анализом измерений или факторным анализом). Авторы и авторство

Молярность: значение, примеры, использование и уравнение
Определение молярности

Уравнение молярности
Как находить моли в задачах на молярность
 Это только один шаг к более сложным проблемам. Начальные шаги могут включать в себя много разных вещей, но все они приведут к окончательному нахождению количества растворенного вещества в молях и объема в литрах!
Это только один шаг к более сложным проблемам. Начальные шаги могут включать в себя много разных вещей, но все они приведут к окончательному нахождению количества растворенного вещества в молях и объема в литрах! 
 Давайте используем это уравнение в простой реакции осаждения с двумя растворами KI( водный) → 2 KNO 3 (водный) + PbI 2 (s)
Давайте используем это уравнение в простой реакции осаждения с двумя растворами KI( водный) → 2 KNO 3 (водный) + PbI 2 (s) Как рассчитать разведения с использованием молярности
 Одним из лучших применений молярности является быстрый расчет разведения! В лаборатории у нас обычно есть только пара растворов, созданных с определенной молярностью. Эти растворы называются стоковыми.
Одним из лучших применений молярности является быстрый расчет разведения! В лаборатории у нас обычно есть только пара растворов, созданных с определенной молярностью. Эти растворы называются стоковыми. V 2 и M 2 относятся к молярности и объему раствора, который вы пытаетесь приготовить. Давайте посмотрим на пример, чтобы показать, как это будет работать в лаборатории:
V 2 и M 2 относятся к молярности и объему раствора, который вы пытаетесь приготовить. Давайте посмотрим на пример, чтобы показать, как это будет работать в лаборатории:
Иногда вам может понадобиться найти концентрацию двух растворов после их смешивания. Это может показаться сложным, но помните шаги к исходному решению задачи: 1-й — найти общее количество молей и 2-й — найти общий объем!
Предположим, у вас есть несколько решений с несколькими томами. Вы должны хранить это решение в течение длительного времени, но у вас есть только один подходящий контейнер для всего этого. Вы решаете смешать их все вместе, но вам нужно выяснить общий объем и конечную молярность всего этого.
Вы решаете смешать их все вместе, но вам нужно выяснить общий объем и конечную молярность всего этого.
Раствор 1 — 3,0 М, и у вас есть 0,5 л.
Раствор 2 1,5 М и у вас есть 0,75 л
и Раствор 3 0,75 М и у вас есть 1,0 л
Найдите конечную молярность после смешивания всех трех растворов.
Для начала вам нужно найти общее количество молей растворенного вещества, которое будет в конечной смеси.
Это легко сделать, сложив моли растворенного вещества в каждом растворе.
Для раствора 1 это будет M 1 V 1 =n 1
3,0M(0,5 л)=1,5 моль =n 2
1,5 М (0,75 л) = 1,125 моль
Для раствора 3 это будет М 3 V 3 = N 3
0,75 м (1,0 л) = 0,75MOL
для общего числа. 1.125mol+0.75mo=3.375mol
Теперь найдите общий объем, который будет V 1 +V 2 +V 3
0.5L+0.75L+1.0L=2.25L
0 как и прежде, разделите общее количество молей на общий объем
3,375 моль/2,25 л = 1,5 М
Таким образом, из примера легко увидеть, каким должно быть уравнение при смешивании любого количества растворов с одним и тем же растворенным веществом. Разделите общее количество молей на общий объем!
Разделите общее количество молей на общий объем!
Всего молей в растворе будет n 1 +n 2 +n 3+… , но это будет M 1 V 1 +M 219 V 2
0 M 3 V 3 +….
Общий объем равен просто V 1 +V 2 +V 3 +….
Молярность — основные выводы
- Запомните уравнение молярности: M=n/V
- Поймите, как преобразовать уравнение в формы MV=n и V=n/M
- Всегда определяйте шаги, необходимые для определения общего количества молей растворенного вещества и общего объема растворителя
- Упрощайте сложные задачи до более мелких шагов для их решения
Формула молярности | Science Trends
Формула молярности является одним из строительных блоков для понимания химии и химических реакций. Умение рассчитать концентрацию раствора является важным и основным знанием для химика. Расчет молярности раствора или использование уравнения для молярности для определения количества растворенного вещества , которое необходимо взвесить, чтобы приготовить раствор соответствующей концентрации, — это то, что химик делает несколько раз в день.
Молярность – это значение, выражающее концентрацию растворенного вещества в растворе. Концентрация раствора зависит от количества растворенного вещества, добавленного к объему растворителя . В химии молярность всегда выражается как количество молей растворенного вещества, содержащихся в одном литре растворителя. Формула для расчета молярности показана ниже:
Что такое решение?
Раствор представляет собой смесь двух или более веществ, в которой все компоненты полностью растворены и смесь имеет однородный состав. Полностью однородную смесь называют гомогенной смесью или раствором.
Что такое растворитель?
Растворитель – это просто вещество, в котором растворено растворенное вещество. Растворитель может быть твердым или газообразным, но обычно представляет собой жидкость. Растворителем обычно является тот компонент смеси, который присутствует в наибольшем количестве. В водном растворе вода является растворителем. При расчете молярности объем растворителя измеряется в литрах (л).
Что такое растворенное вещество?
Растворенное вещество представляет собой химический компонент смеси, растворенный в растворителе. Примером растворенного вещества является сахароза , когда ее растворяют в воде для получения сахарной воды. При расчете молярности количество растворенного вещества измеряется в молях (моль).
Что такое крот?
Крот — это число в том же смысле, что и дюжина. Одна дюжина равна двенадцати. Один моль равен 6,02 x 10 23 , что немного больше двенадцати. Число 6,02 х 10 23 называется числом Авогадро и часто записывается в экспоненциальном представлении, чтобы занимать меньше места. Полностью выписанное число Авогадро равно 602 000 000 000 000 000 000 000, или 602 с двадцатью одним нулем. Это большое число, но что именно оно представляет?
Моль атомов углерода составляет 6,02 x 10 23 атомов, и это число атомов весит двенадцать граммов, потому что относительная атомная масса углерода равна двенадцати, как указано в периодической таблице. Для других атомов, таких как кислород, моль будет весить другое количество (в случае кислорода моль атомов кислорода весит шестнадцать граммов). Моль также может состоять из нескольких молекул. Вода представляет собой молекулу, состоящую из двух атомов водорода (относительная атомная масса одного атома водорода) и одного атома кислорода (относительная атомная масса шестнадцати), а моль молекул воды весит восемнадцать граммов.
Для других атомов, таких как кислород, моль будет весить другое количество (в случае кислорода моль атомов кислорода весит шестнадцать граммов). Моль также может состоять из нескольких молекул. Вода представляет собой молекулу, состоящую из двух атомов водорода (относительная атомная масса одного атома водорода) и одного атома кислорода (относительная атомная масса шестнадцати), а моль молекул воды весит восемнадцать граммов.
Как рассчитывается молярность?
Молярность рассчитывается путем деления количества растворенного вещества, которое должно быть выражено в молях, на количество растворителя, которое должно быть выражено в литрах. Ниже приведены несколько примеров, иллюстрирующих, как рассчитывается молярность.
- Пример 1: Если у вас есть 2,5 моля сахара, и вы растворяете сахар в 0,5 л воды, какова молярность сахарной воды?
Молярность = моль растворенного вещества/литры растворителя
= 2,5 моль/0,5 литра
= 5 моль/литр = 5 моль/л = 5 М
Как видно из приведенного выше примера, если исходить из молей, расчет выполняется достаточно просто. Однако моли нельзя измерить напрямую, поэтому химики часто начинают с граммов вещества.
Однако моли нельзя измерить напрямую, поэтому химики часто начинают с граммов вещества.
- Пример 2: Если у вас есть 200 граммов соли (NaCl) и вы растворяете соль в 0,5 л воды, какова концентрация соленой воды?
Молярность = моли растворенного вещества/литры растворителя, так как же мы можем получить моли NaCl из граммов? Мы используем молярную массу NaCl для преобразования массы в граммах в количество молей. Это преобразование возможно, потому что молярная масса соединения, подобного NaCl, рассчитывается с использованием относительной атомной массы каждого атома из таблицы Менделеева и говорит нам, сколько весит один моль NaCl.
Молярная масса NaCl = атомная масса Na + атомная масса Cl = 23,0 + 35,4 = 58,4 г/моль
При делении массы NaCl, которую мы растворяем в воде, на молярную массу NaCl, граммы в обоих числах сокращаются, и у нас остаются только моли.
Грамм NaCl в моль NaCl: 200 грамм / 58,4 г/моль = 3,42 моля
Молярность = моль/литр = 3,42 моль/0,5 литра = 6,84 моль/л
В чем разница между молярностью и моляльностью?
Если молярность – это количество молей растворенного вещества в одном литре растворителя, то моляльность – это количество молей растворенного вещества в одном килограмме растворителя. Единицы моляльности – моль/кг. Поскольку на объем вещества могут влиять температура и давление, использование массы для передачи количества может обеспечить более точную концентрацию.
Единицы моляльности – моль/кг. Поскольку на объем вещества могут влиять температура и давление, использование массы для передачи количества может обеспечить более точную концентрацию.
- Пример расчета моляльности: Если 2 моля сахара растворить в 0,5 л воды, какова моляльность раствора?
Моляльность = моли растворенного вещества/килограммы растворителя
Поскольку плотность воды равна 1 кг/л, 0,5 литра воды равняется 0,5 кг воды. Однако плотность растворителей не всегда равна 1 кг/л, поэтому обратите внимание при расчете перевода единиц измерения.
Моляльность = 2 моля сахара/0,5 кг воды
= 4 моль/кг
Моляльность может быть выражена как моль/кг или строчной буквой m.
В чем разница между молярностью и нормальностью?
Нормальность очень похожа на молярность, за исключением того, что это число молярных эквивалентов в одном литре растворителя. Нормальность используется специально для выражения концентраций кислот или оснований.

 е 1,74 М (NH4)2SO4
е 1,74 М (NH4)2SO4 е 1,74 М (NH4)2SO4
е 1,74 М (NH4)2SO4 е 1,74 М (NH4)2SO4
е 1,74 М (NH4)2SO4
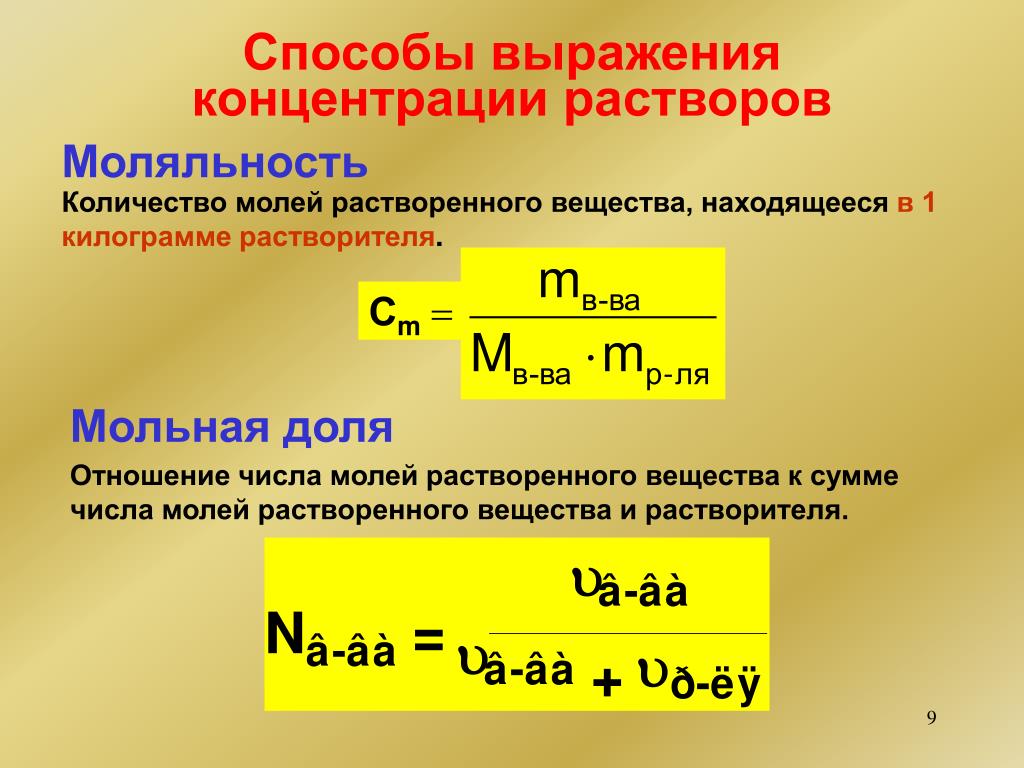

 молей к общему объему раствора.
молей к общему объему раствора.
 0918 г моль -1
0918 г моль -1