Физики из России узнали, как часто нейтроны «сбегают» из атомов
17 августа, 2017 17:11
Источник: РИА Новости
Физики из России и Франции выяснили, как часто происходят распады ядер легких элементов, при которых один из их нейтронов совершает «побег», сведения о чем помогут космологам раскрыть тайны химической эволюции Вселенной, говорится в статье, опубликованной в журнале Physical Review C.
«Эти данные позволяют определить вероятность образования легких элементов, количество протонов в атомных ядрах которых варьируется от 10 до 70. Эта характеристика распада имеет большое значение при изучении процесса синтеза тяжелых элементов в недрах звезд в астрофизике», — рассказал Юрий Пенионжкевич из Объединенного института ядерных исследований РАН в Дубне, чьи слова приводит пресс-служба Российского научного фонда.
Все ядра элементов тяжелее водорода состоят из двух типов элементарных частиц – протонов, заряженных положительно, и нейтронов, не имеющих заряда. То, как много протонов и нейтронов содержит атом, определяет то, насколько стабильным он является. При избытке и того, и другого типа частиц ядро старается избавиться от «лишних» протонов или нейтронов, превращая один из нейтронов в протон или наоборот, трансмутируя протон в нейтрон.
В некоторых редких случаях, когда в атоме содержится гораздо больше нейтронов, чем протонов, подобные распады приводят к выделению свободных нейтронов или пар нейтронов и электронов. Пока ученые не знают, как часто происходят подобные события и не знают, какие именно процессы заставляют нестабильное ядро вести себя таким образом, что мешает точному определению того, какие элементы формируются в звездах и как подобные нейтроны влияют на поведение топлива в ядерных реакторах.
Ситуация осложняется тем, что существует целый набор элементов с определенным количеством протонов и нейтронов, так называемым «магическим числом», которые обладают заметно более высокой стабильностью, чем предсказывает теория, и не распадаются подобным образом. Как полагают сегодня ученые, понимание принципов нейтронного распада ядер позволит нам вычислять подобные «магические числа» теоретически, а не искать их вслепую.
Как полагают сегодня ученые, понимание принципов нейтронного распада ядер позволит нам вычислять подобные «магические числа» теоретически, а не искать их вслепую.
Как отмечает Пенионжкевич, ответ на этот вопрос найти крайне сложно, так как нейтроны, в отличие от других продуктов распада нестабильных элементов, гораздо сложнее увидеть и «поймать» из-за отсутствия у них положительного или отрицательного заряда.
Российские ученые решили эту проблему, создав детектор TETRA, способный «видеть» подобные нейтроны, замедляя их и заставляя их взаимодействовать с атомами гелия-3. Эти взаимодействия порождают потоки заряженных частиц, обладающих уникальными чертами, благодаря которым физики могут отличать следы «сбежавших» нейтронов от частиц, попавших в детектор случайно.
Фото : ОИЯИ, пресс-служба РНФ
Детектор TETRA, созданный физиками из ОИЯИ РАН в Дубне
Этот детектор Пенионжкевич и его коллеги подключили к ускорительной установке ALTO в городе Орсэ во Франции, способной вырабатывать пучки ионов трех изотопов галлия – галлия-82, галлия-83 и галлия-84. Все эти три версии этого металла могут распадаться по двум сценариям – путем «обычного» бета-распада, в ходе которого нейтрон превращается в протон и остается внутри атома, и путем нейтронного распада, когда еще один нейтрон покидает ядро вместе с электроном, возникшим в ходе подобного превращения.
Все эти три версии этого металла могут распадаться по двум сценариям – путем «обычного» бета-распада, в ходе которого нейтрон превращается в протон и остается внутри атома, и путем нейтронного распада, когда еще один нейтрон покидает ядро вместе с электроном, возникшим в ходе подобного превращения.
Ученых интересовало то, как часто происходят распады по этим двум сценариям, и то, как соотношение числа нейтронов и протонов, а также расстояние до «магического числа», влияют на вероятность «побега» нейтрона из атома галлия при его превращении в германий.
Как показали эти наблюдения, вероятность подобного распада зависит от особых коллективных колебаний нейтронов и протонов в ядре атома, так называемого малого резонанса Гамова-Теллера, в существовании которого многие ученые сомневались. К примеру, в пользу этого говорит то, что вероятность нейтронного распада более тяжелого галлия-84 была меньше, а не выше, чем у галлия-83, что нельзя объяснить иным путем.
Открытие его следов, как считает Пенионжкевич, поможет ученым не только понять, как возникла Земля и другие планеты и звезды Вселенной, но и поможет открыть новые «магические числа», в том числе характерные для сверхтяжелых элементов в пока не открытом «острове стабильности».
Теги
СМИ о Фонде, Физика и космос, Спецпроект
Как измерить непредставимое и представить неизмеримое / Наука / Независимая газета
Точное измерение характерного размера протона принципиально важно для расчета уровней энергии и частот излучения атомов. Иллюстрация с сайта www.jlab.org
Журнал Nature опубликовал небольшую статью с результатами эксперимента, проведенного в лаборатории Томаса Джефферсона Министерства энергетики США «A small proton charge radius from an electron-proton scattering experiment» («Малый радиус заряда протона, полученный из эксперимента по электрон-протонному рассеянию»). Почему это важно.
Протон вместе с нейтронами входит в состав ядер всех известных химических элементов. С параметрами протона напрямую связаны некоторые фундаментальные физические постоянные. В частности, постоянная Ридберга, используемая для расчета уровней энергии и частот излучения атомов.
Протон почти не виден
Польскому поэту и философу Станиславу Ежи Лецу принадлежит замечательный афоризм: «И размеры Вселенной могут быть военной тайной». Недаром английский астрофизик Стивен Хокинг в 1990 году подчеркивал: «Очень трудно доказать беспредельность Вселенной, но если мы это сделаем, то сможем объяснить все во Вселенной, основываясь на гипотезе о ее беспредельности, и я думаю, что такая теория будет более экономной и более естественной». Но как минимум неменьшая тайна – размеры объектов на другом конце шкалы масштабов: атомы, не говоря уже об элементарных частицах. И квантовая физика, изучающая эти объекты, существование которых зачастую и представить можно только в виде математической формулы, тоже претендует на объяснение всего во Вселенной.
Действительно, если астрофизические события и объекты мы можем наблюдать и/или визуализировать непосредственно, хотя и с задержкой, порой в миллиарды лет, то получить изображение элементарных частиц не удается принципиально. Не удавалось…
Не удавалось…
Еще каких-то 10 лет назад можно было, не покривив против «истины» (беру в кавычки, так как абсолютная истина – это все-таки идеальная модель), сказать: «До сих пор считалось, что сфотографировать атом водорода нет никакой технической и технологической возможности. Недаром в современных учебных пособиях для студентов можно прочитать, что «…атомы лежат за пределами нашего восприятия, их нельзя ни увидеть, ни услышать. Атомистические представления не могут возникнуть и из мифа, поскольку миф всегда использует наглядные образы» (см. «НГ-науку» от 24.11.10).
Но как раз в 2010 году физики из Токийского университета сумели впервые в истории сфотографировать отдельный атом водорода. Достижение феноменальное и, казалось, предельное. Проще атома водорода вроде бы природа ничего не создала. Ядро, роль которого играет положительно заряженная элементарная частица, – протон, а вокруг «размыт» по орбите отрицательно заряженный электрон. Диаметр атома водорода примерно 10–8 см, размеры ядра – 10–13 см. Представьте себе, что электрон вращается вокруг шпиля Московского государственного университета им. М.В. Ломоносова с диаметром орбиты вращения 1 км. Тогда размеры ядра атома на шпиле – не более горошины.
Диаметр атома водорода примерно 10–8 см, размеры ядра – 10–13 см. Представьте себе, что электрон вращается вокруг шпиля Московского государственного университета им. М.В. Ломоносова с диаметром орбиты вращения 1 км. Тогда размеры ядра атома на шпиле – не более горошины.
И вот в минувшем ноябре журнал Nature сообщает очередную порцию новостей об… устройстве этой самой «горошины».
До 2010 года измерения радиуса протона проводились двумя методами: рассеяния электронов и атомной спектроскопии. В экспериментах по рассеянию электронов радиус заряда протона определяется по изменению пути электронов после того, как они отразились или рассеялись от протона (упругое электрон-протонное рассеяние). В измерениях методом атомной спектроскопии фиксируются переходы между энергетическими уровнями электронов, вращающихся вокруг ядра водорода или дейтерия. Оба эти метода давали значение радиуса протона около 0,88 фемтометра.
|
Для постановки нового эксперимента по измерению радиуса протона пришлось существенно модернизировать ускоритель непрерывных электронных пучков CEBAF.  Фото с сайта www.jlab.org |

При этом протон и электрон в атоме водорода гравитационно притягиваются с силой, которая составляет всего лишь 4 х 10–40 от силы их электростатического притяжения.
А пятому – не бывать!
Надо сказать, что подготовка к новому эксперименту по разгадыванию этой головоломки заняла у американских ученых семь лет.
В 2012 году группа ученых под руководством Ашота Гаспаряна из Университета штата Северная Каролина собралась в лаборатории Томаса Джефферсона Министерства энергетики США, чтобы доработать метод рассеяния электронов. Эксперимент получил название PRad («Протонный радиус»). Специально была проведена модернизация ускорительного комплекса CEBAF (Continuous Electron Beam Accelerator Facility – ускоритель непрерывных электронных пучков). Методика PRad предусматривала три нововведения.
Во-первых, был разработан новый тип мишени. Охлажденный газообразный водород направлялся прямо в поток ускоренных электронов с энергией 1,1 и 2,2 ГэВ, что позволило рассеянным электронам двигаться почти беспрепятственно в детекторы.
Во-вторых, для детектирования рассеянных электронов, возникающих в результате попадания электронов на протоны или электроны водорода, применили калориметр, а не традиционный магнитный спектрометр. Гибридный калориметр HyCal измерял энергию и положение рассеянных электронов, в то время как газовый электронный детектор GEM, специально построенный для этого эксперимента, определял позиции электронов, но с высокой точностью. Данные обоих детекторов сравнивались в реальном времени. Это дало возможность экспериментаторам понять, какое событие они обнаружили: электрон-электронное или электрон-протонное рассеяние. Понятно, что это значительно повысило точность эксперимента.
Были применены и еще некоторые, сугубо технологические, ухищрения, про которые можно сказать – искусство эксперимента.
В итоге полученный по новой методике радиус протона составляет 0,831 ± 0,007 фемтометра. Это самое точное значение на сегодняшний день. Оно меньше, чем предыдущее значение, полученное методом рассеяния электронов (0,88 фемтометра), и неплохо согласуется с результатами мюонной атомной спектроскопии (0,84 фемтометра).
«Мы рады, что годы напряженной работы нашего сотрудничества заканчиваются хорошим результатом, который поможет в решении так называемой головоломки протонного радиуса», – приводит слова Ашота Гаспаряна пресс-релиз Министерства энергетики США.
В самой статье авторы подчеркивают: «Кроме того, наш вывод согласуется с пересмотренным значением (объявленным в 2019 году. – «НГ-наука») для постоянной Ридберга – одной из наиболее точно оцененных фундаментальных констант в физике».
«Это было самое сложное измерение, которое когда-либо пыталась сделать наша лаборатория. Мы добились высочайшего уровня точности в измерении радиуса протона, – отметил ведущий автор исследования, сотрудник департамента физики и астрономии Йоркского университета Эрик Хессельс.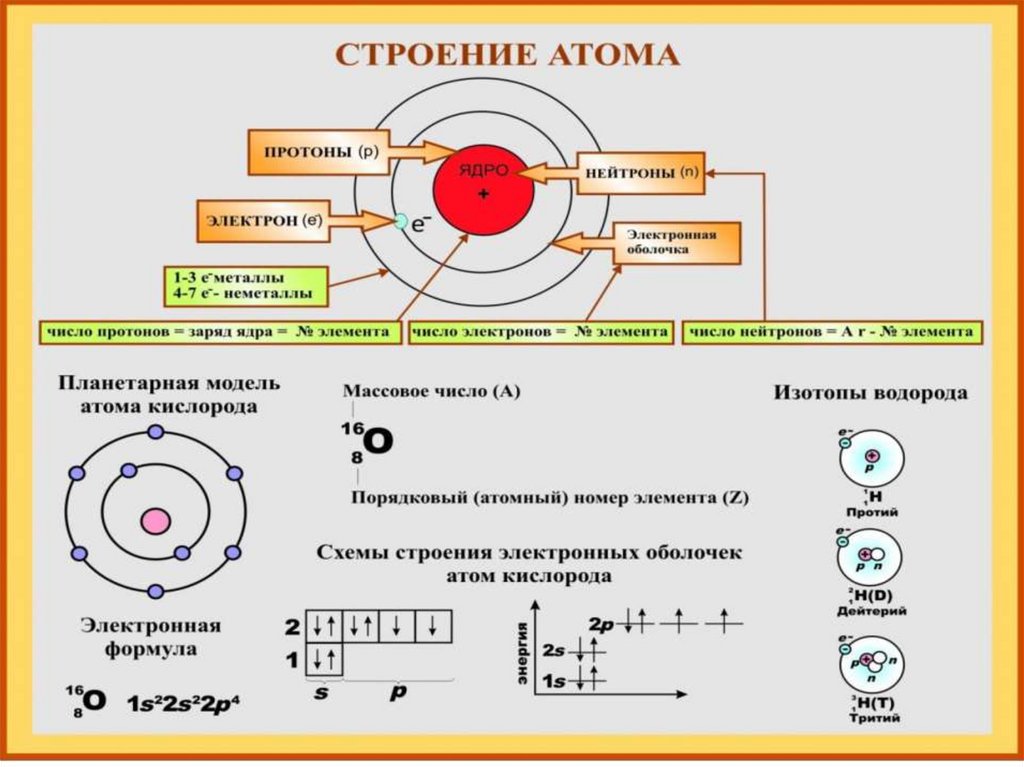 – После восьми лет работы над этим экспериментом мы все же смогли провести такое высокоточное измерение, которое помогает решить головоломку протонного радиуса».
– После восьми лет работы над этим экспериментом мы все же смогли провести такое высокоточное измерение, которое помогает решить головоломку протонного радиуса».
Поиск решения этой загадки имеет далеко идущие последствия для понимания законов физики, таких как теория квантовой электродинамики, которая описывает, как взаимодействуют свет и материя.
Опять же это важно хотя бы потому, что разброс в измерениях радиуса протона привел к появлению гипотезы о существовании некоей новой фундаментальной силы природы (отсюда и разговоры о «новой физике»), по-разному действующей на электроны и мюоны. Напомним, сегодня известны четыре фундаментальных взаимодействия в природе: сильное, электромагнитное, слабое и гравитационное. А пятому – не бывать! По крайней мере пока.
Тотальная визуализация
Но достижение американских физиков имеет не только сугубо естественно-научное значение – хотя, подчеркнем еще раз, даже сами по себе экспериментальная техника и методология просто удивительны, – но и мировоззренческое, философское значение.
«Человек способен понять вещи, которые он уже не в силах вообразить», – отмечал в свое время нобелевский лауреат Лев Ландау, рассуждая о квантовой механике. И все-таки перевести объекты в изображения – это неистребимая потребность физиков. Соответственно, изобразить нечто, непредставимое в образах принципиально, считалось невозможным. Вернее, эти изображения не могут нести никакого физического смысла и не соответствуют реальному физическому объекту. В общем, материя – это то, что поддается записи математическими формулами. И это – давняя философская традиция. Иммануил Кант, например, считал, что «…в любом частном учении о природе можно найти науки в собственном смысле лишь столько, сколько имеется в ней математики».
«…Начиная с середины 1980-х годов некоторые наиболее интересные и значимые изображения в науке оказываются совершенно неадекватными тем объектам, которые они пытаются репрезентировать… репрезентируют скорее породившую их математику, чем любые изображаемые объекты в пространстве, – пишет профессор Чикагского института искусств Джеймс Элкинс в эссе «Бесполезная визуализация квантовой механики» («Исследуя визуальный мир», Вильнюс, 2010). – В моем визуальном воображении нет ничего соответствующего бариону с его валентностью и морским кварком. Также я не имею ментального изображения электрона, даже оставляя в стороне дозволенные количества спиновых моментов импульсов».
– В моем визуальном воображении нет ничего соответствующего бариону с его валентностью и морским кварком. Также я не имею ментального изображения электрона, даже оставляя в стороне дозволенные количества спиновых моментов импульсов».
И тем не менее магистральная линия в науке (не только в физике) – визуализация концептов, результатов, гипотез. Хрестоматийный пример «визуализации» непредставимого, но измеримого – ньютоновский закон всемирного тяготения. Ньютону удалось сделать главное – найти образ, который стал наглядным, а потому и запоминающимся, визуальным символом новой загадочной силы – гравитации. Этот образ и материализовался в падающем яблоке…
Вот и с электронами интересная получается картинка…
В 2011 году физики из Имперского колледжа Лондона сообщили, что им удалось определить форму электрона с точностью, которая на много порядков превосходит точность всех сделанных ранее измерений.
Электрон – элементарная частица, отвечающая за перенос электромагнитного взаимодействия. Существующие теории предполагают, что электрон должен иметь практически идеальную сферическую форму. Однако провести точные измерения этого параметра невероятно сложно. Как отмечалось в пресс-релизе Имперского колледжа Лондона, подготовка и проведение эксперимента заняли около 10 лет. С помощью лазерной системы ученые измеряли малейшие колебания, которые совершали находящиеся в молекулах фторида иттербия электроны. В итоге было установлено, что отклонения от идеальной сферической формы в электроне не превышают 10–28 см. Если увеличить размер электрона до размеров Солнечной системы, то размер отклонений окажется меньше толщины человеческого волоса.
Существующие теории предполагают, что электрон должен иметь практически идеальную сферическую форму. Однако провести точные измерения этого параметра невероятно сложно. Как отмечалось в пресс-релизе Имперского колледжа Лондона, подготовка и проведение эксперимента заняли около 10 лет. С помощью лазерной системы ученые измеряли малейшие колебания, которые совершали находящиеся в молекулах фторида иттербия электроны. В итоге было установлено, что отклонения от идеальной сферической формы в электроне не превышают 10–28 см. Если увеличить размер электрона до размеров Солнечной системы, то размер отклонений окажется меньше толщины человеческого волоса.
В 2015 году международная команда исследователей из России, Дании, Бельгии и Канады под руководством Ганса Якоба Вернера из Высшей технической школы в Цюрихе смогла проследить движение электронов в молекуле с временным разрешением 100 аттосекунд и показала, что этими электронами можно управлять. (Приставка «атто» означает 10–18 с. )…
)…
Итак, фотографию атома водорода мы уже давно имеем. Шарообразность электрона подтверждена с умопомрачительной точностью; само движение электрона отслежено с не менее обескураживающими подробностями. Возможно, нынешнее беспрецедентное измерение характерного размера протона станет тем рубежом в истории науки, пройдя который придется вообще отказаться от понятия «принципиально неизобразимый объект (явление)». Или по крайней мере значительно раздвинет пределы репрезентации физических концептов. Теперь это не только математические формулы, но и картинки. Недаром древние греки не различали понятий «видеть» и «знать».
Структура атома – Введение в химию
ЛюменОбучение
Обзор атомной структуры
Атомы состоят из частиц, называемых протонами, нейтронами и электронами, которые отвечают за массу и заряд атомов.
ЦЕЛИ ОБУЧЕНИЯ
Обсудить электронные и структурные свойства атома
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- Атом состоит из двух областей: ядра, которое находится в центре атома и содержит протоны и нейтроны, и внешней области атома, которая удерживает электроны на орбите вокруг ядро.

- Протоны и нейтроны имеют примерно одинаковую массу, примерно 1,67 × 10 -24 грамм, которую ученые определяют как одну атомную единицу массы (а.е.м.) или один дальтон.
- Каждый электрон имеет отрицательный заряд (-1), равный положительному заряду протона (+1).
- Нейтроны — это незаряженные частицы, находящиеся внутри ядра.
Ключевые термины
- : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, состоящий из ядра, окруженного электронами.
- : Положительно заряженная субатомная частица, входящая в состав ядра атома и определяющая атомный номер элемента. Он весит 1 а.е.м.
- : Субатомная частица, входящая в состав ядра атома. У него нет заряда. По массе он равен протону или весит 1 а.е.м.
Атом — наименьшая единица вещества, сохраняющая все химические свойства элемента. Атомы объединяются, образуя молекулы, которые затем взаимодействуют, образуя твердые тела, газы или жидкости. Например, вода состоит из атомов водорода и кислорода, которые, объединившись, образуют молекулы воды. Многие биологические процессы посвящены повторной сборке молекул в другие, более полезные молекулы.
Например, вода состоит из атомов водорода и кислорода, которые, объединившись, образуют молекулы воды. Многие биологические процессы посвящены повторной сборке молекул в другие, более полезные молекулы.
Атомные частицы
Атомы состоят из трех основных частиц: протонов, электронов и нейтронов. Ядро (центр) атома содержит протоны (положительно заряженные) и нейтроны (без заряда). Самые внешние области атома называются электронными оболочками и содержат электроны (отрицательно заряженные). Атомы обладают различными свойствами в зависимости от расположения и количества их основных частиц.
Элементы, такие как гелий, изображенные здесь, состоят из атомов. Атомы состоят из протонов и нейтронов, расположенных внутри ядра, с электронами на орбиталях, окружающих ядро. Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Это можно определить, используя атомный номер и массовое число элемента (см. понятие об атомных числах и массовых числах).
Атомная масса
Протоны и нейтроны имеют примерно одинаковую массу, примерно 1,67×10 -24 грамм. Ученые определяют это количество массы как одну атомную единицу массы (аму) или один дальтон. Несмотря на то, что протоны имеют одинаковую массу, они заряжены положительно, а нейтроны заряда не имеют. Следовательно, количество нейтронов в атоме вносит значительный вклад в его массу, но не в его заряд.
Электроны намного меньше по массе, чем протоны, и весят всего 9,11 × 10 -28 грамм, или около 1/1800 атомной единицы массы. Следовательно, они не вносят большого вклада в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, основываясь только на числе протонов и нейтронов.
Электроны вносят большой вклад в заряд атома, поскольку каждый электрон имеет отрицательный заряд, равный положительному заряду протона. Ученые определяют эти заряды как «+1» и «-1». В незаряженном нейтральном атоме число электронов, вращающихся вокруг ядра, равно числу протонов внутри ядра. В этих атомах положительные и отрицательные заряды компенсируют друг друга, что приводит к атому без суммарного заряда.
В этих атомах положительные и отрицательные заряды компенсируют друг друга, что приводит к атому без суммарного заряда.
Изучение свойств электронов: сравните поведение электронов с поведением других заряженных частиц, чтобы узнать свойства электронов, такие как заряд и масса.
Объем атомов
С учетом размеров протонов, нейтронов и электронов большая часть объема атома — более 99 процентов — это, по сути, пустое место. Несмотря на все это пустое пространство, твердые объекты не просто проходят друг через друга. Электроны, окружающие все атомы, заряжены отрицательно и заставляют атомы отталкиваться друг от друга, не позволяя атомам занимать одно и то же пространство. Эти межмолекулярные силы не позволяют вам провалиться сквозь такой объект, как ваш стул.
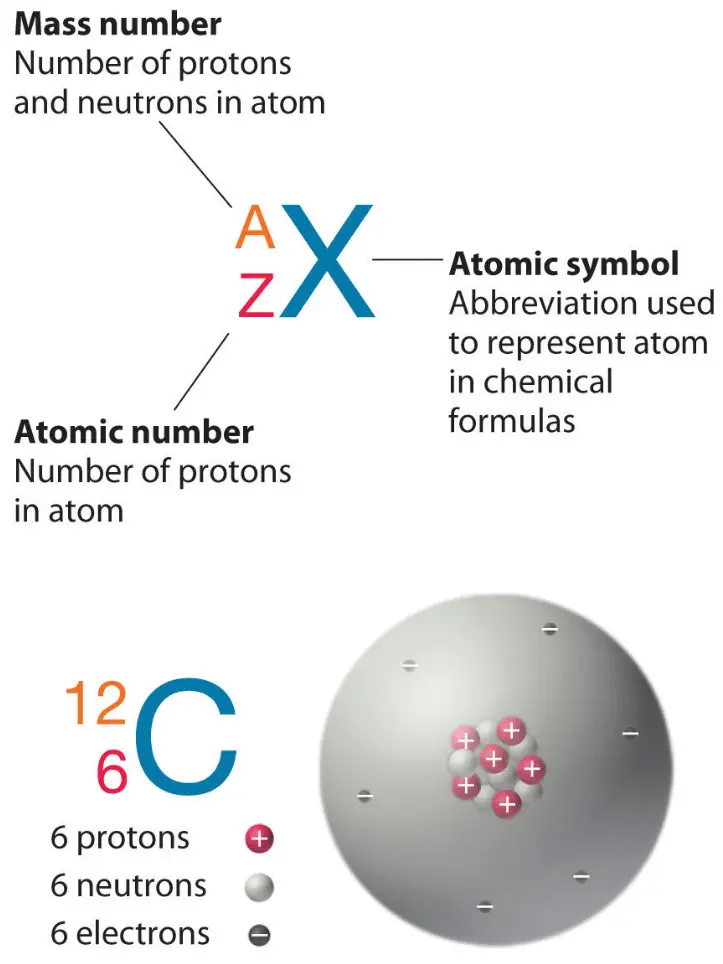
Атомный номер и массовое число
Атомный номер — это количество протонов в элементе, а массовое число — это количество протонов плюс количество нейтронов.
ЦЕЛИ ОБУЧЕНИЯ
Определить соотношение между массовым числом атома, его атомным номером, его атомной массой и числом субатомных частиц
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- Нейтральные атомы каждого элемента содержат равное количество протонов и электронов.
- Число протонов определяет атомный номер элемента и используется для отличия одного элемента от другого.
- Количество нейтронов изменчиво, в результате чего изотопы, которые представляют собой разные формы одного и того же атома, различаются только количеством нейтронов, которыми они обладают.
- Вместе количество протонов и количество нейтронов определяют массовое число элемента.
- Поскольку изотопы элемента имеют немного разные массовые числа, атомная масса рассчитывается путем получения среднего значения массовых чисел для его изотопов.
Ключевые термины
- : Сумма числа протонов и числа нейтронов в атоме.

- : Количество протонов в атоме.
- : Средняя масса атома с учетом всех его природных изотопов.
Атомный номер
Нейтральные атомы элемента содержат равное количество протонов и электронов. Количество протонов определяет атомный номер элемента (Z) и отличает один элемент от другого. Например, атомный номер углерода (Z) равен 6, потому что у него 6 протонов. Количество нейтронов может варьироваться для получения изотопов, которые представляют собой атомы одного и того же элемента, имеющие разное количество нейтронов. Количество электронов также может быть разным в атомах одного и того же элемента, что приводит к образованию ионов (заряженных атомов). Например, железо Fe может существовать в нейтральном состоянии или в ионных состояниях +2 и +3.
Массовый номер
Массовое число элемента (А) представляет собой сумму числа протонов и числа нейтронов. Небольшой вклад массы от электронов не учитывается при вычислении массового числа. Это приближение массы можно использовать, чтобы легко вычислить, сколько нейтронов имеет элемент, просто вычитая количество протонов из массового числа. Протоны и нейтроны весят примерно одну атомную единицу массы (а.е.м.). Изотопы одного и того же элемента будут иметь одинаковый атомный номер, но разные массовые числа.
Это приближение массы можно использовать, чтобы легко вычислить, сколько нейтронов имеет элемент, просто вычитая количество протонов из массового числа. Протоны и нейтроны весят примерно одну атомную единицу массы (а.е.м.). Изотопы одного и того же элемента будут иметь одинаковый атомный номер, но разные массовые числа.
Ученые определяют атомную массу, вычисляя среднее значение массовых чисел для встречающихся в природе изотопов. Часто полученное число содержит десятичную дробь. Например, атомная масса хлора (Cl) составляет 35,45 а.е.м., поскольку хлор состоит из нескольких изотопов, некоторые из которых (большинство) имеют атомную массу 35 а.е.м. (17 протонов и 18 нейтронов), а некоторые — 37 а.е.м. (17 протонов и 20 нейтронов).
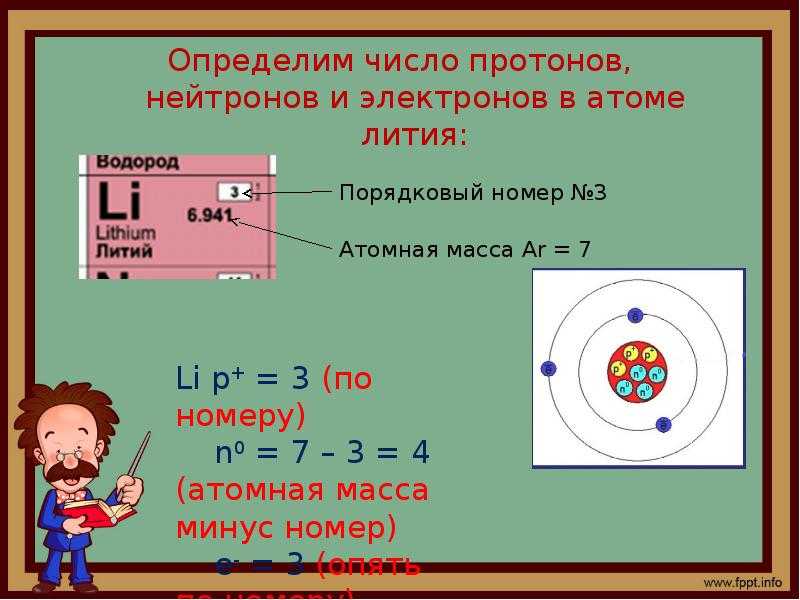
Зная атомный номер (Z) и массовое число (A), вы можете найти количество протонов, нейтронов и электронов в нейтральном атоме. Например, атом лития (Z=3, A=7 а.е.м.) содержит три протона (определено из Z), три электрона (поскольку число протонов равно числу электронов в атоме) и четыре нейтрона (7 – 3 = 4).
Например, атом лития (Z=3, A=7 а.е.м.) содержит три протона (определено из Z), три электрона (поскольку число протонов равно числу электронов в атоме) и четыре нейтрона (7 – 3 = 4).
Изотопы
Изотопы — это различные формы элемента, которые имеют одинаковое количество протонов, но разное количество нейтронов.
ЦЕЛИ ОБУЧЕНИЯ
Обсудить свойства изотопов и их использование в радиометрическом датировании
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- Изотопы — это атомы одного и того же элемента, содержащие одинаковое количество протонов, но разное количество нейтронов.
- Несмотря на разное количество нейтронов, изотопы одного и того же элемента имеют очень похожие физические свойства.
- Некоторые изотопы нестабильны и подвергаются радиоактивному распаду, превращаясь в другие элементы.
- Предсказуемый период полураспада различных распадающихся изотопов позволяет ученым датировать материал на основе его изотопного состава, например, с помощью датирования по углероду-14.

Ключевые термины
- : Любая из двух или более форм элемента, в которых атомы имеют одинаковое количество протонов, но разное количество нейтронов в ядрах.
- : Время, за которое половина исходной концентрации изотопа распадается обратно в более стабильную форму. 9{14}\text{C}[/latex] в атмосфере можно определить количество еще не распавшегося изотопа. На основе этого количества можно точно рассчитать возраст материала, если считается, что возраст материала составляет менее 50 000 лет. Этот метод называется радиоуглеродным датированием, или сокращенно углеродным датированием. Возраст углеродсодержащих останков возрастом менее 50 000 лет, таких как этот карликовый мамонт, можно определить с помощью углеродного датирования. (кредит: Билл Фолкнер, NPS) 9{235}\text{U}[/latex] (уран-235) имеет период полураспада около 700 миллионов лет. Ученые часто используют эти другие радиоактивные элементы для датирования объектов старше 50 000 лет (предел углеродного датирования).
 С помощью радиометрического датирования ученые могут изучать возраст окаменелостей или других остатков вымерших организмов.
С помощью радиометрического датирования ученые могут изучать возраст окаменелостей или других остатков вымерших организмов.ЛИЦЕНЗИИ И АВТОРСТВО
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, ПРЕДОСТАВЛЕННОЕ РАНЕЕ
- Курирование и пересмотр. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, КОНКРЕТНОЕ АВТОРСТВО
- Колледж OpenStax, биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Сунил Кумар Сингх, Основные типы сил. 27 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m14044/latest/. Лицензия : CC BY: Attribution
- нейтрон.
 Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/neutron. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/neutron. Лицензия : CC BY-SA: Attribution-ShareAlike - электрон. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/electron. Лицензия : CC BY-SA: Attribution-ShareAlike
- атом. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/atom. Лицензия : CC BY-SA: Attribution-ShareAlike
- протон. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/proton. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Биология. 30 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.
 org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution - Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Attribution
- атомный номер. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/atomic_number. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Химия уровня A/OCR/Атомы, связи и группы/Атомы и реакции/Атомы.
 Предоставлено : Wikibooks. Расположен по адресу : http://en.wikibooks.org/wiki/A-level_Chemistry/OCR/Atoms,_Bonds_and_Groups/Atoms_and_Reactions/Atoms. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikibooks. Расположен по адресу : http://en.wikibooks.org/wiki/A-level_Chemistry/OCR/Atoms,_Bonds_and_Groups/Atoms_and_Reactions/Atoms. Лицензия : CC BY-SA: Attribution-ShareAlike - Безграничный. Предоставлено : Безграничное обучение. Расположен по адресу : http://www.boundless.com//biology/definition/atomic-mass–2. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Биология. 30 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.
 org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Attribution
org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Attribution - Колледж OpenStax, Биология. 27 октября 2013 г. Предоставлено : OpenStaxCNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Радиоуглеродный анализ. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Radiocarbon_dating. Лицензия : CC BY-SA: Attribution-ShareAlike изотоп
- . Предоставлено : Викисловарь. Расположен по адресу : http://en.
 wiktionary.org/wiki/isotope. Лицензия : CC BY-SA: Attribution-ShareAlike
wiktionary.org/wiki/isotope. Лицензия : CC BY-SA: Attribution-ShareAlike - Углерод-12. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Carbon-12. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Биология. 30 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Атрибуция
- Колледж OpenStax, Биология. 27 октября 2013 г. Предоставлено : OpenStax CNX.
 Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution - Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_03.jpg. Лицензия : CC BY: Attribution
Эта глава является адаптацией главы «Структура атома» из книги Boundless Chemistry компании LumenLearning и распространяется под лицензией CC BY-SA 4.0.
субатомных частиц, ядра и изотопов
Chemguide: Core Chemistry 14–16
Субатомные частицы, ядра и изотопы
На этой странице кратко рассматриваются три субатомные частицы, о которых мы говорим на этом уровне (протоны, нейтроны и электроны), а затем продолжается рассмотрение того, как вычисляется количество протонов и нейтронов в ядре.
 Он заканчивается рассмотрением существования изотопов элементов.
Он заканчивается рассмотрением существования изотопов элементов.Протоны, нейтроны и электроны
В таблице приведены основные факты об этих частицах.
относительная масса relative charge proton 1 +1 neutron 1 0 electron 1/1836 -1 На что следует обратить внимание:
Большая часть массы атома приходится на протоны и нейтроны. По сравнению с этим масса электронов пренебрежимо мала.
Протон несет положительный заряд; электрон несет равный отрицательный заряд. Нейтроны нейтральны — у них нет заряда.
Ядро
Ядро находится в центре атома и содержит протоны и нейтроны.
 Протоны и нейтроны вместе известны как нуклонов. Маловероятно, что вы встретите этот термин на этом вводном уровне.
Протоны и нейтроны вместе известны как нуклонов. Маловероятно, что вы встретите этот термин на этом вводном уровне.Практически вся масса атома сосредоточена в ядре, потому что электроны так мало весят.
Расчет числа протонов и нейтронов
Количество протонов = АТОМНЫЙ НОМЕР атома
Атомный номер также имеет более описательное название номер протона и связан с положением элемента в периодической таблице.
Количество протонов + количество нейтронов = МАССОВОЕ ЧИСЛО атома
Массовое число также называют нуклонным числом — опять же, вы, вероятно, не встретите его на этом уровне.
На примере фтора эту информацию можно представить просто в виде:
Сколько протонов и нейтронов у этого атома?
Атомный номер означает количество протонов (9).
Массовое число рассчитывается как протоны + нейтроны (19).

Если есть 9 протонов, должно быть 10 нейтронов, чтобы в сумме получилось 19.
Атомный номер связан с положением элемента в периодической таблице, поэтому количество протонов определяет, о каком элементе идет речь. Итак, если атом имеет 8 протонов (атомный номер = 8), это должен быть кислород. Если атом имеет 12 протонов (атомный номер = 12), это должен быть магний.
Точно так же каждый атом аргона (атомный номер = 18) имеет 18 протонов; каждый атом урана (атомный номер = 92) имеет 92 протона.
Другой пример — расчет количества протонов и нейтронов в Бр-79
Бр-79 это еще один способ записи 79 Бр. Итак, бром-79 — это атом брома с массовым числом 79.
Сначала вам нужно найти бром, Br, в таблице Менделеева. Вам действительно нужна печатная версия этого, и вы найдете простую загружаемую версию с этого сайта.
Бром имеет атомный номер 35, поэтому имеет 35 протонов.
Вам сказали, что массовое число равно 79, значит, всего 79 протонов плюс нейтроны.

Следовательно, должно быть (79 — 35) нейтронов = 44 нейтрона.
Некоторые предупреждения!
Периодические таблицыобычно дают вам два числа для каждого элемента. Атомный номер — это меньшее число — не путайте эти два числа.
Другое число НЕ массовое число — это относительная атомная масса элемента, которая в большинстве случаев не будет совпадать с массовым числом.
В периодической таблице, такой как та, которую я предложил, которая дает относительную атомную массу с точностью до одного десятичного знака, очевидно, что число, подобное 79,9 (которое дано для брома в этой таблице), не может быть массовым числом. Общее количество протонов плюс нейтронов должно быть целым числом.
За исключением одного распространенного примера, который вы должны помнить, на экзамене вам обычно дают массовое число атома, если вам это нужно — как я сделал в начале этого примера.
Чуть позже мы еще поговорим об относительной атомной массе.

Изотопы
Число нейтронов в атоме может варьироваться в небольших пределах. Например, существует три вида атомов углерода: 12 C, 13 C и 14 C. Все они имеют одинаковое количество протонов, но количество нейтронов различается.
протоны нейтроны массовое число carbon-12 6 6 12 carbon-13 6 7 13 carbon-14 6 8 14 Эти различные атомы углерода называются изотопами . Тот факт, что они имеют различное число нейтронов, не имеет никакого значения для химических реакций углерода.

Изотопы — это атомы с одинаковым атомным номером, но разными массовыми числами. У них одинаковое количество протонов, но разное количество нейтронов.
Изотопы и относительная атомная масса
Это не должно быть правильным введением в понятие относительной атомной массы — просто краткий обзор того, как оно связано с изотопами.
Пример использования хлора
Это тот пример, когда числа настолько просты, что вполне можно ожидать, что вы их запомните.
Хлор имеет два изотопа, Cl-35 и Cl-37, а обычный хлор содержит их в соотношении 3 атома Cl-35 на каждый 1 атом Cl-37 (достаточно хорошее приближение для наших целей).
Если у вас есть образец хлора, он будет содержать невероятно большое количество атомов хлора, и полезно иметь возможность дать среднее значение массы атома хлора. В среднем 35 и 37 равно 36, но это не учитывает того факта, что атомов Cl-35 в три раза больше, чем атомов Cl-37.
Относительная атомная масса представляет собой средневзвешенную (часто называемую средневзвешенной) масс изотопов.
 Это среднее значение, которое учитывает различные пропорции различных изотопов.
Это среднее значение, которое учитывает различные пропорции различных изотопов.Предположим, у вас есть четыре типичных атома хлора — 3 атома Cl-35 и 1 атом Cl-37.
Общая масса четырех атомов будет (3 х 35) + (1 х 37) = 142
Таким образом, «средняя» масса одного атома равна 142/4 = 35,5
.Если вы посмотрите на периодическую таблицу, вы обнаружите, что 35,5 — это число, указанное как относительная атомная масса хлора.
Если вас интересуют единицы относительной атомной массы — их нет! Он измеряется по шкале, по которой изотоп углерода-12 имеет массу ровно 12 единиц. Вам не нужно беспокоиться об этом в данный момент.
Примечание: Вы найдете правильное обсуждение относительной атомной массы в разделе расчетов этого сайта на этой странице.
Куда бы вы хотели отправиться сейчас?
На следующую страницу в этом разделе об электронах.


 С помощью радиометрического датирования ученые могут изучать возраст окаменелостей или других остатков вымерших организмов.
С помощью радиометрического датирования ученые могут изучать возраст окаменелостей или других остатков вымерших организмов. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/neutron. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/neutron. Лицензия : CC BY-SA: Attribution-ShareAlike  org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution  Предоставлено : Wikibooks. Расположен по адресу : http://en.wikibooks.org/wiki/A-level_Chemistry/OCR/Atoms,_Bonds_and_Groups/Atoms_and_Reactions/Atoms. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikibooks. Расположен по адресу : http://en.wikibooks.org/wiki/A-level_Chemistry/OCR/Atoms,_Bonds_and_Groups/Atoms_and_Reactions/Atoms. Лицензия : CC BY-SA: Attribution-ShareAlike  org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Attribution
org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Attribution  wiktionary.org/wiki/isotope. Лицензия : CC BY-SA: Attribution-ShareAlike
wiktionary.org/wiki/isotope. Лицензия : CC BY-SA: Attribution-ShareAlike  Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution  Он заканчивается рассмотрением существования изотопов элементов.
Он заканчивается рассмотрением существования изотопов элементов. Протоны и нейтроны вместе известны как нуклонов. Маловероятно, что вы встретите этот термин на этом вводном уровне.
Протоны и нейтроны вместе известны как нуклонов. Маловероятно, что вы встретите этот термин на этом вводном уровне.



 Это среднее значение, которое учитывает различные пропорции различных изотопов.
Это среднее значение, которое учитывает различные пропорции различных изотопов.