Углекислота (h3CO3) свойства, использование и значение / химия | Thpanorama
углекислота, ранее называемая воздушной кислотой или воздушной кислотой, она является единственной неорганической кислотой углерода и имеет формулу h3CO3.
Соли карбоновых кислот называются бикарбонатами (или гидрокарбонатами) и карбонатами (База данных метаболома человека, 2017). Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
Говорят, что углекислота образуется из углекислого газа и воды. Углекислота встречается только через соли (карбонаты), соли кислот (гидрокарбонаты), амины (карбаминовая кислота) и хлориды кислот (карбонилхлорид) (MeSH, 1991).
Соединение не может быть выделено в виде чистой или твердой жидкости, поскольку продукты его разложения, углекислый газ и вода, намного более стабильны, чем кислота (Royal Society of Chemistry, 2015).
Углекислота находится в организме человека, CO2, присутствующий в крови, соединяется с водой, образуя углекислоту, которая затем выделяется легкими в виде газа.
Это также найдено в скалах и пещерах, где известняки могут быть растворены. h3CO3 также можно найти в угле, метеоритах, вулканах, кислотных дождях, подземных водах, океанах и растениях (формула углекислоты, S.F.).
индекс
- 1 Углекислота и карбонатные соли
- 2 «Гипотетический» углекислый газ и водная кислота
- 3 Физические и химические свойства
- 4 использования
- 5 Важность
- 6 Ссылки
Углекислота образуется в небольших количествах, когда ее ангидрид, углекислый газ (CO2), растворяется в воде.
CO2 + h3O ⇌ h3CO3
Преобладающими видами являются просто гидратированные молекулы CO2. Можно считать, что угольная кислота является дипротоновой кислотой, из которой могут образовываться две серии солей, а именно гидрокарбонаты или бикарбонаты, содержащие HCO3-, и карбонаты, содержащие CO32.-.
h3CO3 + h3O ⇌ h4O + + HCO3-
HCO3- + h3O ⇌ h4O + + CO32-
Однако кислотно-основное поведение углекислоты зависит от различных скоростей некоторых участвующих реакций, а также от ее зависимости от рН системы. Например, при pH ниже 8 основными реакциями и их относительной скоростью являются следующие:
Например, при pH ниже 8 основными реакциями и их относительной скоростью являются следующие:
- CO2 + h3O ⇌ h3CO3 (медленно)
- h3CO3 + OH- ⇌ HCO3- + h3O (быстро)
При pH выше 10 важны следующие реакции:
- CO2 + OH- ⇌ HCO3- (медленно)
- HCO3- + OH- ⇌ CO32- + h3O (быстро)
При значениях рН от 8 до 10 все вышеуказанные равновесные реакции являются значительными (Zumdahl, 2008).
«Гипотетическая» углекислота и водная кислотаДо относительно недавнего времени ученые были убеждены, что углекислота не существует как стабильная молекула..
В журнале Angewandte Chemie немецкие исследователи представили простой пиролитический метод получения газофазной углекислоты, который позволил провести спектроскопическую характеристику газофазной углекислоты и ее монометилового эфира (Angewandte Chemie International Edition, 2014)..
Углекислота существует только в течение небольшой доли секунды, когда углекислый газ растворяется в воде, прежде чем он станет смесью протонов и бикарбонат-анионов. .
.
Однако, несмотря на свою короткую жизнь, углекислота оказывает длительное воздействие на атмосферу и геологию Земли, а также на организм человека..
Из-за короткого срока службы детальная химия углекислоты была завуалирована тайной. Исследователи, такие как Berkeley Lab. И Калифорнийский университет в Калифорнии (UC), помогают поднять эту завесу через серию уникальных экспериментов..
В своем последнем исследовании они показали, как молекулы газообразного диоксида углерода сольватируются водой, чтобы инициировать химию переноса протона, которая производит углекислоту и бикарбонат (Yarris, 2015).
В 1991 году ученым из Центра космических полетов имени Годдарда (США) НАСА удалось получить твердые образцы h3CO3. Они сделали это, подвергая замороженную смесь воды и углекислого газа воздействию высокоэнергетического протонного излучения, а затем нагревая ее, чтобы удалить избыток воды..
Оставшаяся углекислота характеризовалась инфракрасной спектроскопией. Тот факт, что углекислота была приготовлена облучением твердой смеси h3O + CO2 или даже облучением только сухого льда.
Это привело к предположениям, что h3CO3 можно найти в космическом пространстве или на Марсе, где можно найти мороженое h3O и CO2, а также космические лучи (Ханна, 1991)..
Физико-химические свойстваУглекислота существует только в водном растворе. Не удалось выделить чистое соединение. Это решение легко узнаваемо, потому что оно имеет газообразный диоксид углерода, выделяющийся из водной среды..
Он имеет молекулярную массу 62,024 г / моль и плотность 1668 г / мл. Углекислота является слабой и нестабильной кислотой, которая частично диссоциирует в воде на ионы водорода (H +) и бикарбонат-ионы (HCO3-), чья pKa составляет 3,6.
Будучи дипротоновой кислотой, она может образовывать соли двух типов: карбонаты и бикарбонаты. Добавление основания к избытку углекислоты дает соли бикарбоната, в то время как добавление основания к углекислоте дает соли карбоната (Национальный центр биотехнологической информации., 2017).
Углекислота не считается токсичной или опасной и присутствует в организме человека. Однако воздействие высоких концентраций может вызвать раздражение глаз и дыхательных путей..
Однако воздействие высоких концентраций может вызвать раздражение глаз и дыхательных путей..
По словам Мишель Макгуайр в Науки о питании иУглекислота содержится в сброженных продуктах в виде отходов, образующихся в результате бактерий, которые питаются разлагающимися продуктами..
Газовые пузырьки, образующиеся в пище, обычно являются углекислым газом углекислоты и признаком того, что пища бродит. Примерами обычно употребляемых ферментированных продуктов являются соевый соус, суп мисо, квашеная капуста, корейское кимчи, темпе, кефир и йогурт.
Ферментированные зерна и овощи также содержат полезные бактерии, которые могут контролировать потенциально патогенные микроорганизмы в кишечнике и улучшать выработку витаминов B-12 и K.
Углекислота, раствор диоксида углерода или дигидрокарбонат образуются в процессе карбонизации воды. Он отвечает за шипучий аспект безалкогольных и безалкогольных напитков, как указано в словаре пищевой науки и технологии.
Углекислота способствует высокой кислотности соды, но содержание рафинированного сахара и фосфорной кислоты является основной причиной указанной кислотности (DUBOIS, 2016).
Углекислота также используется во многих других областях, таких как фармацевтика, косметика, удобрения, пищевая промышленность, анестетики и т. Д..
важностьУглекислота обычно содержится в водах океанов, морей, озер, рек и дождей, потому что она образуется, когда широко распространенный в атмосфере углекислый газ вступает в контакт с водой..
Он даже присутствует во льду ледников, хотя и в меньших количествах. Углекислота является очень слабой кислотой, хотя со временем она может способствовать эрозии.
Увеличение содержания углекислого газа в атмосфере привело к образованию большего количества углекислого газа в океанах и, отчасти, является причиной небольшого повышения кислотности океанов за последние сто лет..
Углекислый газ, продукт клеточного метаболизма, содержится в тканях в относительно высоких концентрациях. Он диффундирует в крови и попадает в легкие, которые удаляются выдыхаемым воздухом..
Он диффундирует в крови и попадает в легкие, которые удаляются выдыхаемым воздухом..
Углекислый газ гораздо более растворим, чем кислород, и легко диффундирует в эритроциты. Реагирует с водой с образованием углекислоты, которая при щелочном рН крови появляется в основном в виде бикарбоната (Robert S. Schwartz, 2016).
Углекислый газ попадает в кровь и ткани, потому что его местное парциальное давление превышает его парциальное давление в крови, которая течет через ткани. Когда диоксид углерода попадает в кровь, он соединяется с водой, образуя углекислоту, которая диссоциирует на ионы водорода (H +) и бикарбонат-ионы (HCO3-)..
Естественное превращение диоксида углерода в углекислоту является относительно медленным процессом. Тем не менее, карбоангидраза, белковый фермент, присутствующий в эритроцитах, катализирует эту реакцию достаточно быстро, чтобы она достигалась всего за доли секунды..
CO2 + h3O ⇌ h3CO3
Поскольку фермент присутствует только внутри эритроцитов, бикарбонат накапливается в эритроцитах в гораздо большей степени, чем в плазме. .
.
Способность крови транспортировать углекислый газ в виде бикарбоната усиливается ионной транспортной системой в мембране эритроцитов, которая одновременно вытесняет бикарбонатный ион из клетки в плазму в обмен на хлорид-ион.
Одновременный обмен этими двумя ионами, известный как хлоридный обмен, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда плазмы или эритроцитов..
Только 26 процентов от общего содержания углекислого газа в крови существует в виде бикарбоната внутри эритроцитов, в то время как 62 процента присутствует в плазме в виде бикарбоната; однако большинство бикарбонат-ионов сначала образуется внутри клетки, а затем транспортируется в плазму..
Обратная последовательность реакций происходит, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови. Реакция, катализируемая карбоангидразой, переворачивается в легких, где она превращает бикарбонат обратно в CO2 и позволяет его изгнать (Neil S. Cherniack, 2015).
Cherniack, 2015).
- Angewandte Chemie International Edition. (2014, 23 сентября). Углекислота — и все же она существует! Получено с chemviews.org.
- Углекислота Формула. (S.F.). Восстановлено от softschools.com.
- Дюбуа, С. (2016, 11 января). Углекислота в продуктах питания. Получено с livestrong.com.
- EMBL-EBI. (2016, 27 января). углекислота Восстановлено с ebi.ac.uk.
- База данных метаболома человека. (2017, 2 марта). Углекислота. Получено с hmdb.ca.
- Ханна М. М. (1991). Инфракрасные и масс-спектральные исследования протонно-облученного льда h3O + CO2: доказательства наличия углекислоты. Spectrochimica Acta Part A: Молекулярная спектроскопия, том 47, выпуск 2, 255-262. Получено с сайта science.gsfc.nasa.gov.
- (1991). Углекислота Получено от ncbi.nlm.nih.
- Национальный центр биотехнологической информации … (2017, 11 марта). База данных PubChem Compound; CID = 767. Получено из pubchem.ncbi.nlm.nih.
 gov.
gov. - Neil S. Cherniack, e. а. (2015, 20 марта). Дыхание человека Восстановлено с britannica.com.
- Роберт С. Шварц, К. Л. (2016, 29 апреля). Кровь. Восстановлено с britannica.com.
- Королевское химическое общество. (2015). Углекислота. Получено с: chemspider.com.
- Яррис Л. (2015, 16 июня). Раскрытие тайн угольной кислоты. Получено с: newscenter.lbl.gov.
- Zumdahl, S.S. (2008, 15 августа). Оксикислоты. Получено с: britannica.com.
Ответы на тему «Соединения углерода»
1. Заполните таблицу 7.
2. Опишите физиологическое действие угарного газа на организм человека
Связывает необратимо гемоглобил
Объясните, что является противоядием при отравлении угарным газом
Свежий воздух
3. Запишите не менее двух уравнений реакций, в результате которых образуется:
а) угарный газ б) углекислый газ
Для двух ОВР составьте электронный баланс, а для реакции обмена ионные уравнения.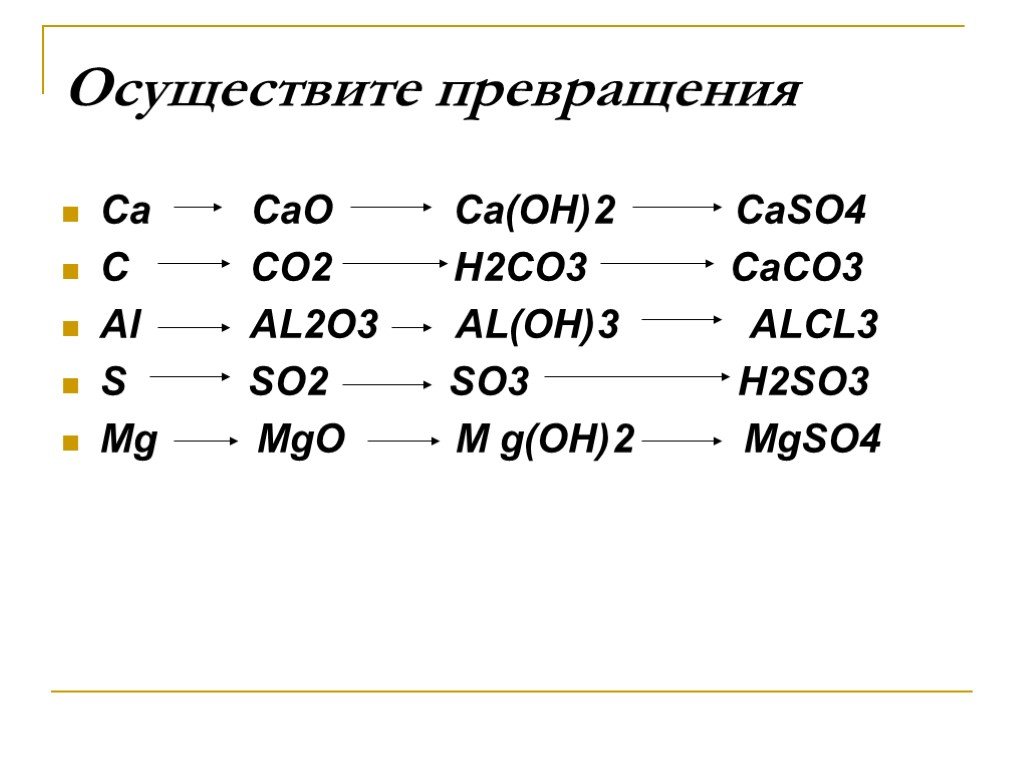
4. Изобразите прибор (рис. 9), в котором можно получить и собрать углекислый газ. Подпишите формулы исходных веществ и продуктов реакции.
Опишите два способа обнаружения выделяющегося углекислого газа?
1) с Ca(OH)2 образует осадок CaCO3
2) CaCO3 + CO2 + h3O -> Ca(HCO3)2 Осадок далее переходит в прозрачный раствор
5. Изготовьте на отдельном листе бумаги формата А4 коллаж «Применение углекислого газа» или «Применение угарного газа» (по выбору). — Самостоятельно
6. Составьте уравнение реакции образования угольной кислоты
1) Na2CO3 + h3SO4 -> Na2SO4 + CO2 + h3O
2) CO2 + h3O h3CO3
Укажите тип записанной реакции:
1) По числу и составу исходных веществ и продуктов реакции: соединение
2) По обратимости: обратимая
3) По изменению степеней окисления элементов: не ОВР
4) По использованию катализатора: некаталитическая
7. Дайте характеристику угольной кислоте, вписав пропущенные слова и словосочетания, формулы.
Дайте характеристику угольной кислоте, вписав пропущенные слова и словосочетания, формулы.
1. Формула h3CO3
2. Тип вещества — Сложное. Класс вещества — Кислота. Характеристика вещества: 1) По наличию кислорода — кислородная; 2) По основности — двухосновная; 3) По растворимости в воде — растворимая; 4) По степени электролитической диссоциации — слабая; 5) По стабильности — нестабильная.
3. Физические свойства — Очень нестойкая кислота, легко разлагается с образованием CO2 и h3O
4. Химические свойства — Взаимодействует с карбонатами, щелочами
5. Применение — Применяется для получения карбонатов, гидрокарбонатов, «дым» на сцене, тушения пожаров.
8. Заполните схему 10 формулами и названиями соединений.
Карбонаты: Na2CO3 — карбонат натрия; BaCO3 — карбонат бария
Гидрокарбонаты: NaHCO3 — гидрокарбонат натрия; Ca(HCO3)2 — гидрокарбонат кальция
9. Составьте уравнения реакций соответствующие схеме:
Составьте уравнения реакций соответствующие схеме:
CO2 -> CaCO3 Ca(HCO3)2 -> CO2
1) CO2 + CaO -> CaCO3
2) CaCO3 + CO2 + h3O -> Ca(HCO3)2
3) Ca(HCO3)2 ->(t) CaCO3 + CO2 + h3O
Объясните, где в природе происходят превращения, уравнения реакций которых вы составили.
1) Растворение солей Ca в h3O
2) Образование сталактитов и сталагмитов
10. Составьте опорный конспект «Жесткость воды» — Самостоятельно
Как рассчитать HCO3 из CO2
••• Comstock/Comstock/Getty Images
Обновлено 25 апреля 2017 г. ставка. Точка, в которой наступает это равновесие, определяется термодинамикой или, точнее, количеством высвобождаемой энергии и изменением энтропии, связанным с процессом. При заданных условиях температуры и давления соотношение реагентов и продуктов представляет собой константу, называемую константой равновесия. Вы можете использовать константы равновесия для расчета концентрации HCO3- в растворе, если знаете парциальное давление двуокиси углерода, CO2.
При равновесии и прямая, и обратная реакции протекают с одинаковой скоростью. Предоставленная самой себе, система, подобная открытой банке из-под кока-колы, вскоре достигнет равновесия между парциальным давлением CO2, концентрацией угольной кислоты и концентрацией бикарбоната.
Напишите химические уравнения реакций, которые превращают растворенный диоксид углерода в угольную кислоту, бикарбонат и карбонат. Уравнения следующие:
h3O + CO2 <=> h3CO3 <=> H+ и HCO3- <=> еще один H+ и CO3 с зарядом -2.
Все реакции в этом ряду двусторонние, т. е. реакция может идти как в прямом, так и в обратном направлении. Вы можете рассчитать концентрацию бикарбоната, HCO3, при равновесии, используя константы равновесия.
Предположим, что система имеет комнатную температуру и стандартное атмосферное давление, что карбонат присутствует только в незначительных количествах и что в растворе преобладают бикарбонат и угольная кислота. Это правильное предположение, если рН 8 или 9 или ниже — другими словами, в нейтральных и кислых растворах. В сильнощелочных растворах можно сделать обратное предположение, что угольная кислота присутствует лишь в незначительных количествах, тогда как бикарбонаты и карбонаты являются преобладающими частицами. 92) / (концентрация угольной кислоты)
Решите для X, умножив обе части на концентрацию угольной кислоты, затем извлекая квадратный корень из обеих частей. Вашим ответом будет расчетная концентрация бикарбоната.
Вашим ответом будет расчетная концентрация бикарбоната.
Связанные статьи
Ссылки
- «Химические принципы, поиск знаний, 4-е издание»; Питер Аткинс и Лоретта Джонс; 2008
- Университет штата Юта: двуокись углерода и углекислота
Об авторе
Джон Бреннан живет в Сан-Диего и пишет о науке и окружающей среде с 2006 года. Ридер», «Санта-Барбара Индепендент» и «Ежемесячник Ист-Бэй». Бреннан имеет степень бакалавра биологических наук Калифорнийского университета в Сан-Диего.
Photo Credits
Comstock/Comstock/Getty Images
Углекислый газ растворяется в воде в соответствии с уравнениями: CO2…
Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- Biochemistry
Biology
- General Biology
- Микробиология
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Financial Accounting
Общественные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия16. Химическое равновесиеПринцип Ле Шателье
2:17
минут
Задача 130b
Вопрос из учебника
Проверенные решения
Наши преподаватели рекомендовали это видео-решение как полезное для решения указанной выше задачи.
1835просмотров
Было ли это полезно?
Смотреть дальше
Мастер Термодинамика с небольшим видео-объяснением от Жюля Бруно
Начать обучение
Related Videos
Related Practice
Le Châtelier’s Principle
Pearson
110views
Le Châtelier’s Principle
Pearson
104views
An Equilibrium View of Le Chatelier’s Principle
00π productions
106views
Thermodynamics
Жюль Брюно
391просмотр
Принцип Ле Шателье
Репетитор по органической химии
270просмотр
15.

 gov.
gov.