Как найти карбонат кальция?
Как найти карбонат кальция?
Получение в промышленности CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl. Этим же способом можно получить карбонат кальция и в лаборатории. Кроме того, его можно получить при пропускании углекислого газа через известковую воду: Са(ОН)2 + СО2 = СаСО3 ↓ + Н2О.
Чем полезен карбонат кальция?
CALCIUM CARBONATE (КАЛЬЦИЯ КАРБОНАТ) Антацидное средство, нейтрализует свободную соляную кислоту в желудке. Кальций — макроэлемент, участвующий в формировании костной ткани, процессе свертывания крови, необходим для поддержания стабильной сердечной деятельности, осуществления процессов передачи нервных импульсов.
Как получить карбонат кальция из углекислого газа?
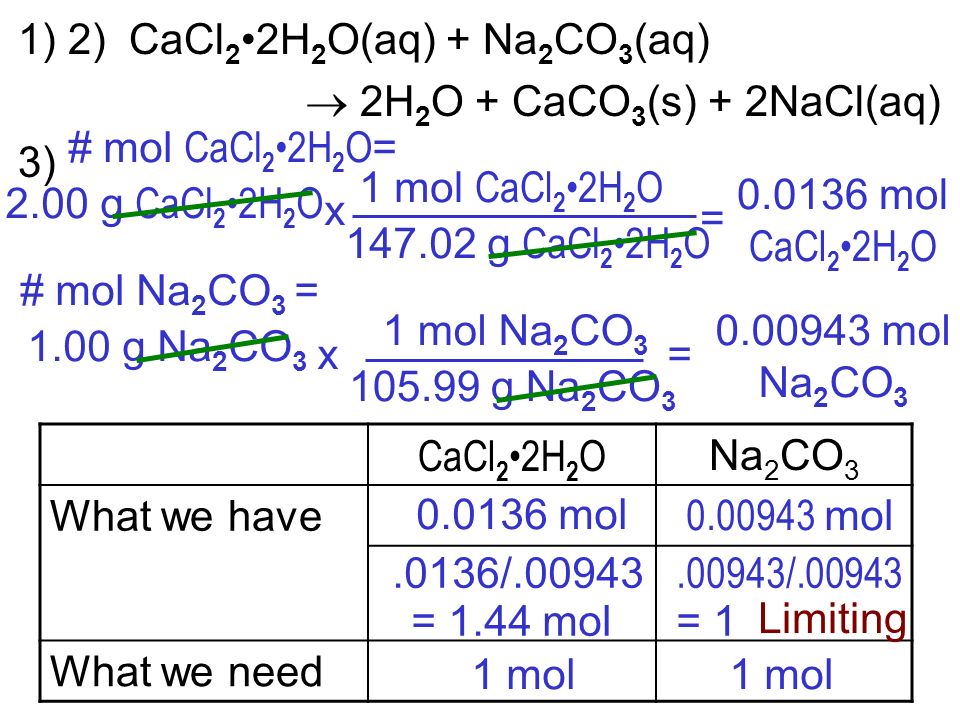
Получим углекислый газ (CO2 ) при взаимодействии разбавленной соляной кислоты и карбоната кальция — мрамора.
- СаCO3 + 2HCl = CaCl2 + CO2 ↑х +h3O.
- CO2 + h3O ↔ h3CO3
- h3CO3 + Ca(OH)2 = CaCO3 ↓ + 2h3O.

Как экспериментально доказать наличие углекислого газа?
Нужно поджечь лучинку (палочку), потом опускаешь её в закрытый сосуд (колбу), если лучина потухла, значит в колбе содержится углекислый газ. При наличии большого количества углекислого газа горение не возможно.
Каким еще способом можно доказать наличие углекислого газа?
наличие CO2 в сосуде проверяется, так- в сосуд поднести горящую пламенем свечу. Если свеча погаснет значит есть CO2, если будет продолжать гореть то там О2.
Как получить CO2 в лаборатории?
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона. В лабораторных условиях небольшие количества СО 2 получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например, мрамора, мела или соды с соляной кислотой.
Как получить углекислый газ в лабораторных условиях?
Углекислый газ в лаборатории получают разложением карбоната кальция при нагревании.
Как в лабораторных условиях получить углекислый газ?
водород получают при взаимодействии кислоты с металлом, а углекислый газ — при взаимодействии кислоты с мелом или мрамором. В лаборатории газы собирают в сосуд двумя способами: вытеснением воздуха или вытеснением воды.
Чем опасен углекислый газ?
Углекислый газ очень негативно влияет на организм человека и является канцерогеном. Нахождение в помещении с высокой концентрацией СО2 может вызывать слабость, сонливость, головные боли, проблемы с концентрацией внимания, или даже негативные изменения в крови.
Каким оксидом является CO2?
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
Какие химические свойства проявляет углекислый газ?
Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния.
Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния.
Какие вещества реагируют с CO2?
Диоксид углерода проявляет кислотные свойства, а значит ответ на вопрос «с чем реагирует CO2» упрощается: с основными и амфотерными оксидами, основаниями, амфотерными гидроксидами и некоторыми солями.
Какие свойства проявляет углерод в реакциях?
Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами. 1.
Что является реактивом на углекислый газ?
То есть вещество, с помощью которого проводят качественную реакцию, называется реактивом на определяемое вещество. В нашем случае известковая вода является реактивом на углекислый газ и углекислый газ является реактивом на известковую воду. … Реактивом на углекислый газ является известковая вода и наоборот.
… Реактивом на углекислый газ является известковая вода и наоборот.
Сколько процентов составляет количество углекислого газа в выдыхаемом воздухе в атмосфере?
Воздух содержит 78% (78,1) азота, 21% (20,93) кислорода и 1% других газов, из которых углекислый газ составляет 0,03-0,04%. В выдыхаемом воздухе кислорода меньше на 25%, а углекислого газа в 100 раз больше.
Сколько углекислого газа в воздухе который человек выдыхает?
Согласно «Основам теплогазоснабжения и вентиляции» [2] человек в час вдыхает и выдыхает в среднем 500 л воздуха. Выдыхаемый воздух содержит в процентах по объему кислорода – 15 %, азота – 79 %, углекислоты – 5 %, прочих газов – 1 %. Углекислота не является вредной даже при содержании ее в воздухе до 4 % по объему.
Как выглядит молекула углекислого газа?
Формула углекислого газа выглядит так – CO₂. … Молекула углекислого газа. Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха.
Также он не имеет и запаха.
Карбонат кальция — хим. свойства и получение CHEMEGE.RU
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция, образуется карбонат кальция и хлорид натрия:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
CaO + CO2 = CaCO3
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Ca(OH)2 + СO2 = CaСO3 + H2O
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
CaCO3 = CaO + CO2
2. Карбонат кальция вступает в реакцию со многими сложными веществами:
Карбонат кальция вступает в реакцию со многими сложными веществами:
2.1. Карбонат кальция реагирует с оксидами:
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
CaCO3 + SiO2 = CaSiO3 + CO2
2.2. Карбонат кальция реагирует с кислотами:
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой. Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
CaCO3 + 2HF = CaF2↓ + CO2↑ + H2O
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
CaCO3 + H2S = CaS + H2O + CO2
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Понравилось это:
Нравится Загрузка.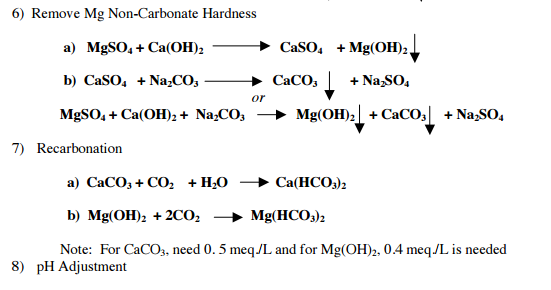 ..
..
Предотвращение осаждения карбоната кальция из глушильной жидкости хлорида кальция в насыщенных CO2 пластах | Западная региональная конференция SPE
Skip Nav Destination
- Цитировать
- Посмотреть эту цитату
- Добавить в менеджер цитирования
- Делиться
- Твиттер
- MailTo
Получить разрешения
- Поиск по сайту
Цитирование
Капельке М.С. и Е.П. Кабальеро. «Предотвращение осаждения карбоната кальция из глушильной жидкости хлорида кальция в формациях, насыщенных CO2». Документ представлен на Калифорнийской региональной конференции SPE, Лонг-Бич, Калифорния, 19 апреля.84. doi: https://doi.org/10.2118/12752-MS
Документ представлен на Калифорнийской региональной конференции SPE, Лонг-Бич, Калифорния, 19 апреля.84. doi: https://doi.org/10.2118/12752-MS
Скачать файл цитаты:
- Ris (Zotero)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- КонецПримечание
- РефВоркс
- Бибтекс
Расширенный поиск
Члены SPE-AIME
Abstract
Вода, содержащая высокие концентрации хлорида кальция, теперь может эффективно использоваться в качестве жидкости глушения в добывающих скважинах с сильно насыщенными углекислым газом пластами. Это исследование показало, что количество отложений карбоната кальция, обычно образующихся в этих условиях, может быть уменьшено за счет увеличения парциального давления двуокиси углерода и увеличения давления в трубе, выходящей из кольцевого пространства обсадной колонны.
Введение
Расширенное использование диоксида углерода (CO2) в проектах повышения нефтеотдачи породило опасения по поводу образования отложений карбоната кальция (CaCO3). Образование CaCO3 становится серьезной проблемой, когда вода с высоким содержанием хлорида кальция (CaCl2) используется для преодоления забойного давления добывающих скважин во время операций капитального ремонта. Вода, утяжеленная CaCl2, оказалась одним из лучших вариантов жидкости глушения из-за ее относительно низкой стоимости и высокого удельного веса (1,39).
Экспериментальные результаты показывают, что образования CaCO3 можно избежать, увеличив парциальное давление CO2. Парциальное давление CO2. Повышение парциального давления может быть достигнуто в добывающих скважинах за счет повышения давления в НКТ, ведущей к затрубному пространству обсадной колонны. Этот метод был успешно использован Champlin Petroleum Company на месторождении Уилмингтон, где давление в НКТ, ведущее к затрубному пространству, было увеличено с 90 фунтов на кв.
ХИМИЧЕСКИЙ ОБРАЗОВАНИЕ КАРБОНАТА КАЛЬЦИЯ
Химия, описывающая образование CaCO3, состоит из нескольких стадий. Во-первых, газообразный CO2 попадает в воду или рассол и образует угольную кислоту (h3CO3), как показано в реакции (1):
(1)
Реакция (1) подтверждается снижением pH при барботировании CO2 через воду.
Угольная кислота диссоциирует, как показано в реакциях (2) и (3), с образованием бикарбонатных (HCO3-) и карбонатных (CO3=) анионов. Кальций реагирует с образованием карбоната кальция, как показано в реакциях (4) и (5).
(2)
(3)
(4)
(5)
где K1 =
и K2 =
Поскольку константа ионизации k2 очень мала, количество CaCO3, образующееся по реакции (4 ) незначительно по сравнению с количеством CaCO3, образующегося по реакции (5). Таким образом, реакцией (4) можно пренебречь, а реакция (5) показывает, что осаждение CaCO3 происходит по мере того, как раствор становится пересыщенным из-за снижения парциального давления CO2.
ЛАБОРАТОРНЫЕ ЭКСПЕРИМЕНТЫ
В лабораторных экспериментах измерялось влияние изменения давления на образование CaCO3 при барботировании углекислого газа через раствор, насыщенный CaCl2. Лабораторная процедура требовала введения процедуры, требующей введения насыщенного раствора CaCl2 в камеру высокого давления с контролируемой температурой, в которой давление находилось под давлением и перемешивалось в течение двух часов, чтобы обеспечить давление и перемешивание в течение двух часов для обеспечения газожидкостного равновесия.
С. 255
Ключевые слова:
жидкость глушения, повышение давления, камера давления, бикарбонат, производственный контроль, фунтов на квадратный дюйм, кислотная стимуляция, мониторинг производства, наблюдение за резервуаром, spe 12752
Предметы:
Наблюдение и мониторинг за скважинами и резервуарами, Внутрискважинные работы
Этот контент доступен только в формате PDF.
Вы можете получить доступ к этой статье, если купите или потратите загрузку.
У вас еще нет аккаунта? регистр
Просмотр ваших загрузок
Преподаетсялучших тем по химии для выпускных экзаменов в школе |
В MyTutor у нас есть много преданных своему делу репетиторов по химии по всей Великобритании, которым нравится помогать подросткам достигать лучших результатов, когда приближаются экзамены. С момента основания в 2013 году мы предоставили более 250 000 индивидуальных уроков и более 1 миллиона школьников воспользовались нашим онлайн ресурсным центром. Со временем мы смогли получить четкое представление о темах по каждому предмету, с которыми детям, как правило, нужна дополнительная помощь.
Вот три основных темы по химии , с которыми наши ученики борются чаще всего, а также несколько примеров ответов, которые могут стать удобными конспектами для вашего ребенка, чтобы подготовить их к повторению.
Баланс химического состава Уравнение реакции карбоната кальция с соляной кислотой: CaCO3+ HCl -> CaCl2 + CO2 + h3O
Сбалансируйте следующее уравнение: C3H8 +O2 —> CO2 + h3O (В символах состояний не будет необходимости.)
Сбалансируйте уравнение восстановления MnO4- до Mn2+
Объясните, почему хлор (Cl2) является газом при комнатной температуре, а хлорид натрия (NaCl) — твердым веществом при комнатной температуре.
В чем разница между ионной, ковалентной и металлической связью?
1. Составьте химическое уравнение реакции карбоната кальция с соляной кислотой: CaCO3+ HCl -> CaCl2 + CO2 + h3O
Чтобы сбалансировать химические уравнения, нам нужно рассмотреть каждый элемент по отдельности в обеих частях уравнения.
Для начала мы можем сложить элементы, чтобы увидеть, какие из них не сбалансированы.
Есть один атом кальция слева и один атом кальция справа, так что это сбалансировано.
1 атом углерода слева и 1 атом углерода справа, так что это сбалансировано.
Есть 3 атома кислорода слева и 3 атома кислорода справа, так что это сбалансировано.
Слева 1 атом водорода, а справа 2, так что это несбалансировано. Поэтому нам нужно сбалансировать его, используя 2 молекулы HCl:
Наконец, нам нужно проверить, что хлор сбалансирован, и, как мы видим, теперь их по 2 с каждой стороны. Поэтому теперь это сбалансированное уравнение.
Всякий раз, когда мы балансируем уравнение, вы должны изменить количество используемых молекул, представленных большими числами перед молекулой, например, 2HCl. Вы не можете изменить нижние (маленькие) числа, так как это количество каждого элемента в молекуле, и в конечном итоге вы создадите свою собственную молекулу, которая не имеет смысла. Например, вы не могли сделать h3Cl!
Самый простой способ сбалансировать уравнения — выполнять их шаг за шагом и каждый раз, когда вы вносите изменения, проверять, как они влияют на остальную часть уравнения.
2. Уравновесьте следующее уравнение:
C3H8 +O2 —> CO2 + h3O. (В символах состояний не будет необходимости.)Прежде всего, чтобы сбалансировать эти уравнения, перечислите число каждого атома для обеих частей уравнения. В этом примере это будет:
Углерод: 3 Углерод: 1
Водород: 8 Водород: 2
Кислород: 2 Кислород: 3
Первым шагом будет балансировка углерода на стороне продуктов путем умножения CO2 на 3. Новое уравнение будет таким: , углероды сбалансированы, мы посмотрим на водороды. Мы можем умножить количество воды на стороне продукта на 4, чтобы получить 4 молекулы h30. Это дает обеим сторонам уравнения 8 атомов водорода. Далее мы можем проверить наш кислород. Со стороны продуктов будет 10 атомов кислорода и 2 со стороны реагентов, поэтому, чтобы сбалансировать их, мы умножим 02 на стороне реагентов на 5.
Окончательное уравнение будет
C3H8 + 502 —> 3CO2 + 4h30
3.
 Сбалансируйте уравнение восстановления MnO4- до Mn2+
Сбалансируйте уравнение восстановления MnO4- до Mn2+Уравнения баланса обычно довольно просты. Однако некоторые из них включают несколько этапов.
Возможно, вы сталкивались с уравнениями баланса в буклетах с данными, которые выглядят устрашающе. Сбалансированное уравнение восстановления Mn7+ до Mn2+ является одним из таких уравнений.
Сначала можно было бы написать:
Хотя это уравнение технически сбалансировано (поскольку состояние Mn в MnO4 равно +7), оно не представляет полной реакции, которая происходит с участием молекул O и ионов H
Полностью сбалансированное уравнение:
Чтобы сбалансировать это, необходимо выполнить следующие шаги:
Шаг 1: Запишите только то, что дано.
Шаг 2: Сбалансируйте все атомы, кроме H и O.
Шаг 3: Сбалансируйте атом кислорода, добавив H3O в сторону, где требуется больше атомов кислорода. На данном этапе у нас есть 4 атома O с левой стороны и нужно 4 справа. Одна молекула воды содержит один атом О, поэтому нам нужно 4 молекулы воды.
Одна молекула воды содержит один атом О, поэтому нам нужно 4 молекулы воды.
Обратите внимание, что теперь у нас есть 4 атома O с каждой стороны и 8 атомов H с правой стороны.
Шаг 4: Сбалансируйте атомы H, добавив необходимое количество ионов H+ на сторону, на которой меньше атомов H. На этом этапе у нас есть (4 x 2) 8 атомов H в правой части и ни одного в левой части.
Уравновесить заряды, добавив электрон, например. На этом этапе LHS имеет заряд (-1 +8) +7. RHS имеет заряд +2. Если мы добавим 5e к LHS, заряд станет 7 – 5 = +2·9.0003
К концу шага 5 мы получили полностью сбалансированное уравнение.
Вы можете сбалансировать любое уравнение, используя эти шаги, однако иногда необходимо внести небольшую корректировку в шаг 4.
В кислых растворах, чтобы сбалансировать атомы H, вы просто добавляете H к стороне, в которой отсутствуют атомы H, но в щелочном растворе присутствует незначительное количество H+.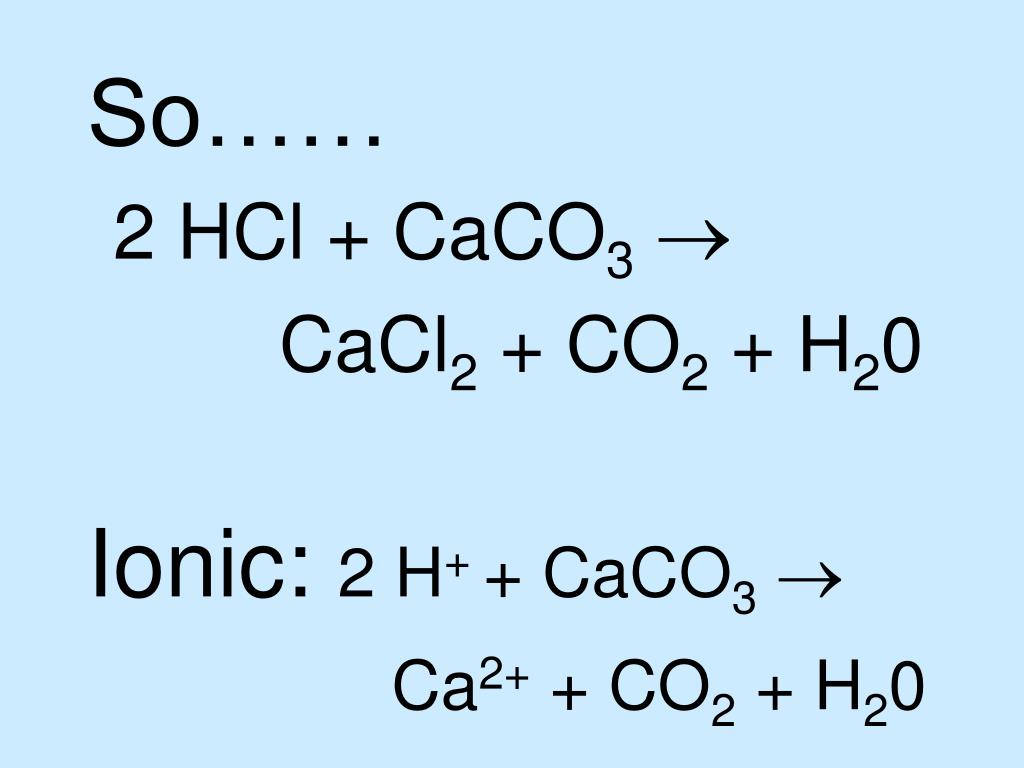 Вместо этого OH- в изобилии. В этом случае вы добавляете h3O на сторону, в которой отсутствует атом(ы) H, и OH- на противоположной стороне.
Вместо этого OH- в изобилии. В этом случае вы добавляете h3O на сторону, в которой отсутствует атом(ы) H, и OH- на противоположной стороне.
Чистый эффект заключается в том, что вы добавляете 1 атом H к стороне, которой не хватает атома H. Если на стороне не хватает «n» атомов H, добавьте «n» молекул h3O на эту сторону и «n» ионов OH- на противоположную сторону.
4. Объясните, почему хлор (Cl2) при комнатной температуре представляет собой газ, а хлорид натрия (NaCl) при комнатной температуре находится в твердом состоянии.
Температура плавления/кипения вещества определяет, какое состояние вещества оно принимает при определенной температуре.
В Cl2 существуют ковалентные связи между атомами, образующими простые молекулы. Между молекулами Cl2 существует слабое притяжение, что означает, что для разрушения этих сил притяжения требуется мало энергии, и поэтому Cl2 имеет низкую температуру кипения.
NaCl, с другой стороны, обладает сильными электростатическими силами притяжения между положительно заряженным ионом Na и отрицательно заряженным ионом Cl. NaCl образует гигантскую ионную решетку, для разрушения которой требуется большое количество энергии, и поэтому имеет высокую температуру плавления.
NaCl образует гигантскую ионную решетку, для разрушения которой требуется большое количество энергии, и поэтому имеет высокую температуру плавления.
5. В чем разница между ионной, ковалентной и металлической связью?
Ионная связь возникает при переносе электронов. Один атом (или молекула) отдает один или несколько электронов другому. Поскольку электроны имеют отрицательный заряд, это оставляет атом-донор с дефицитом электронов (+ve заряженный ион), а другой атом богат электронами (-ve заряженный ион). Затем ионы притягиваются друг к другу за счет электростатических сил притяжения, поскольку они заряжены противоположно.
Ковалентная связь возникает, когда атомы/молекулы имеют общую пару электронов.
Металлическая связь — это связь, возникающая в металлах. Это приводит к гигантским структурам атомов металлов, расположенных в регулярном порядке. Электроны внешней оболочки металлов делокализованы (свободны в перемещении), поэтому металлическая структура представляет собой правильное расположение +5 заряженных ионов с отрицательными электронами между ними, удерживаемых вместе электростатическими силами взаимодействия.

