Оксид Серы IV и VI
Оксид серы(IV) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
ПОЛУЧЕНИЕ Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2. В лабораторных условиях и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота h3SO3 сразу разлагается на SO2 и h3O: Na2SO3 + h3SO4 = Na2SO4 + h3SO3 h3SO3 = h3O + SO2. Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании: Cu + 2h3SO4
= CuSO4 + SO2 + 2h3O.
ХИМИЧЕСКИЕ СВ-ВА Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима): SO2 + h3O = h3SO3. Со щелочами образует сульфиты: 2NaOH + SO2 = Na2SO3 + h3O. Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается: SO2 + Br2 + 2h3O = h3SO4 + 2HBr, SO2 + I2 + 2h3O = h3SO4 + 2HI, 2SO2 + O2 = 2SO3, 3SO2 + 2KMnO4 + 2h3O =2h3SO4 + 2MnO2 + K2SO4, Fe2(SO4)3 + SO2 + 2h3O = 2FeSO4+ 2h3SO4. Предпоследняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора). В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II): SO2
+ 2CO =
2CO2 + S. Или для получения фосфорноватистой кислоты: Ph4 + SO2 = h4PO2 + S.
ПРИМЕНЕНИЕ Большая часть оксида серы(IV) используется для производства сернистой кислоты. Используется также в виноделии в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы(IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, h3O, и как следствие присутствия воды h3SO4 и h3SO3. Их удаляют пропусканием через растворитель концентрированной h3SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре. Оксид серы(IV) применяется также для получения различных солей сернистой кислоты.
ТОКСИЧНОСТЬ SO2 очень токсичен. Симптомы при отравлении сернистым газом
— насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле. Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Оксид серы (VI) — SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3
ПОЛУЧЕНИЕ Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или NaVO3 или оксид железа(III) Fe2O3):
Можно получить термическим разложением сульфатов: Fe2(SO4)3 = Fe2O3 + 3SO3 или взаимодействием SO2 с озоном: SO2 + O3 = SO3 + O2 Для окисления SO2 используют также NO2: SO2 + NO2 = SO3 + NO Эта реакция лежит в основе исторически первого, нитрозного
способа получения серной кислоты.
ХИМИЧЕСКИЕ СВ-ВА 1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту: SO3 + h3O = h3SO4 Однако в данной реакции серная кислота образуется в виде аэрозоля, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями: 2KOH + SO3 = K2SO4 + h3O и оксидами: CaO + SO3 = CaSO4 SO3 растворяется в 100%-й серной кислоте, образуя олеум.
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида: 5SO3 + 2P = P2O5 + 5SO2 3SO3 + h3S = 4SO2 + H_O 2SO3 + 2KI = SO2 + I2 + K2SO4 3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота: SO3 + HCl = HSO3Cl Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид: SO3 + Cl2 + 2SCl2 = 3SOCl2 |
Серная кислота: получение и химические свойства
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H 2SO4·nSO3. nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.

- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H+ + HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H+ + SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 + MgO → MgSO4 + H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
Или с силикатом натрия:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв. ) + H2SO4 → NaHSO4 + HCl
) + H2SO4 → NaHSO4 + HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
H2SO4 + NH3 → NH4HSO4
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц. ) + Hg → HgSO4 + SO2 ↑ + 2H2O
) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц. ) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
Понравилось это:
Нравится Загрузка…
2NaOH + h3SO4 rarr Na2SO4 + 2h3O Он ведет себя как …………………………..
ICSE-СЕРНАЯ КИСЛОТА-РАБОЧИЙ ЛИСТ-2
20 видеоРЕКЛАМА
Ab Padhai каро бина объявления ке
Khareedo DN Про и дехо сари видео бина киси объявление ки рукаават ке!
Ответить
Пошаговое решение, разработанное экспертами, чтобы помочь вам в решении вопросов и получении отличных оценок на экзаменах.
Стенограмма
привет всем заданный вопрос вопрос определите свойство серной кислоты участвовать в следующей реакции реакция 2 + h3 S o4 + 2 x 2 близнецы реакция напишите реакцию кошелек который в два раза больше любого который + h3 S o4 сообщите s4c, что ваш гидроксид гидроксида натрия и ядро пожертвованы Audi Proton Donor
Протонное вещество, раствору которого дается реакция с ионами водорода, следовательно, оно действует так же, как и в данной пище. ↑
↑
203458141
В реакции 2NAOH + H_3PO_4 TO NA_2HPO_4 + 2H_2O, эквивалентный вес кислоты составляет
637868080
в реакции 2CUCL_2 + 2H_2O + SO_2 RARR A + H_2SCLE A + HI_2SCLI_2SCLI_ 2H_2SCLI_2SCLI_2SCLI_2H_2SCLI_2SCLI_2SCLI_2SLI_2SLI_20003
639944221
Роль SO2 в следующей реакции соответственно:
(a)Fe2(SO4)3+SO2+2h3O→2FeSO4+h3SO4,
(b) 2h3S+SO2→2h3O+3S
6429250307 В 9 реакция, 2Ag + H_2SO_4 rarr Ag_2SO_4 + 2H_2O + SO_2, H_2SO_4 это:
643010526
Укажите свойство серной кислоты участвовать в следующих реакциях:
NaCl+h3SO4→Na2SO4+HCl
Она ведет себя как ….. ……………..
643554220
Определите свойство серной кислоты участвовать в следующих реакциях:
HCOOH+h3SO4(Conc.)→CO↑⏐+h3O
Ведет себя как …………….
643554221
Определите свойство серной кислоты, связанное со следующими реакции : CuSO_4.5H_2O + оверсет(H_2SO_4 Delta) rarr CuSO_4 + 5H_2O Он ведет себя как
643554222
Определите свойство серной кислоты, участвующее в следующие реакции : CuSO_4. 5H_2O + оверсет(H_2SO_4 Delta ) rarr CuSO_4 + 5H_2O ведет себя как…………………
5H_2O + оверсет(H_2SO_4 Delta ) rarr CuSO_4 + 5H_2O ведет себя как…………………
643554223
Некоторые свойства серной кислоты перечислены ниже. Выберите свойство A, B, C или D, которое отвечает за реакцию: NaCl + H_2SO_4 rarr NaHSO_4 +HCl
643554304
Некоторые свойства серной кислоты перечислены ниже. Выберите свойство A, B, C или D, отвечающее за реакцию: CuO +H_2SO_4 rarr CuSO_4 + H_2O
643554305
Некоторые свойства серной кислоты перечислены ниже. Выберите свойство A, B, C или D, которое отвечает за реакции с (i) по (v). Некоторые свойства могут повторяться: Na_2CO_3 + H_2SO_4 rarr Na_2SO_4 + H_2O + CO_2
643554306
Некоторые свойства серной кислоты перечислены ниже. Выберите роль серной кислоты в виде A, B, C или D, которая отвечает за реакции.
Zn+2h3SO4(конц.)→ZnSO4+SO2+2h3O
643554339
Укажите тип реакции Na_2CO_3 + 2H_2O в 2NaOH + H_2CO_3
643924975
3 A 9 Zn + H_2SO_4 или ZnSO_4 + 2H_2O + SO_2 . 2C_2H_5OH + H_2SO_4 или C_2H_5-O-C_2H_5 + H_2O. 2NaOH + H_2SO_4 или Na_2SO_4 + 2H_2O . HCOOH + H_2SO_4 или H_2O + CO . 3H_2S + H_2SO_4 или 4H_2O + 4S . 2P + 5H_2SO_4 rarr 2H_3PO_4 + 2H_2O + 5SO_2. Классифицируйте реакции на 3 группы на основе следующих свойств H_2SO_4: — Окисляющее свойство.
2C_2H_5OH + H_2SO_4 или C_2H_5-O-C_2H_5 + H_2O. 2NaOH + H_2SO_4 или Na_2SO_4 + 2H_2O . HCOOH + H_2SO_4 или H_2O + CO . 3H_2S + H_2SO_4 или 4H_2O + 4S . 2P + 5H_2SO_4 rarr 2H_3PO_4 + 2H_2O + 5SO_2. Классифицируйте реакции на 3 группы на основе следующих свойств H_2SO_4: — Окисляющее свойство.
645097643
KMnO4 + h3SO4 + Na2SO3 = K2SO4 + MnSO4 + Na2SO4 + h3O
16 июня 2020 г. Трубка для обучения Химическая реакция
Сульфит натрия реагирует с перманганатом калия и серной кислотой. Сульфит натрия, перманганат калия и серная кислота (KMnO4 h3SO4 Na2SO3) — очень распространенные и хорошо известные химические вещества во всем мире. Он также доступен почти во всех химических лабораториях. Они реагируют с образованием сульфата калия, сульфата марганца (II), воды, а также сульфата натрия. С другой стороны, реакция является окислительно-восстановительной реакцией.
О KMnO4 Na2SO3 h3SO4
Перманганат калия – это неорганическое химическое соединение и лекарство. Это сильный окислитель. KMnO 4 представляет собой соль, состоящую из ионов K + и MnO 4 -1 , и имеет химическую формулу KMnO 4 . Он растворяется в воде с образованием интенсивно розовых или фиолетовых растворов. В твердом состоянии образует призматические пурпурно-черные блестящие кристаллы.
Это сильный окислитель. KMnO 4 представляет собой соль, состоящую из ионов K + и MnO 4 -1 , и имеет химическую формулу KMnO 4 . Он растворяется в воде с образованием интенсивно розовых или фиолетовых растворов. В твердом состоянии образует призматические пурпурно-черные блестящие кристаллы.
Сульфит натрия (сульфит натрия) представляет собой растворимую натриевую соль сернистой кислоты (сульфит) с химической формулой Na2SO3. Это продукт очистки от диоксида серы, часть процесса сероочистки дымовых газов. Он также используется в качестве консерванта для предотвращения обесцвечивания сухофруктов и для консервирования мяса. Он также используется так же, как тиосульфат натрия, для преобразования элементарных галогенов в соответствующие галогеноводородные кислоты, в фотографии и для снижения уровня хлора в бассейнах.
Серная кислота – минеральная кислота с молекулярной формулой H₂SO₄. Это бесцветная сиропообразная жидкость без запаха, растворимая в воде. В этой реакции он действует только как кислая среда.
Это бесцветная сиропообразная жидкость без запаха, растворимая в воде. В этой реакции он действует только как кислая среда.
Сульфит натрия реагирует с перманганатом калия и серной кислотой
Сульфит натрия реагирует с перманганатом калия и серной кислотой с образованием сульфата калия, сульфата марганца (II), воды, а также сульфата натрия. Скелетная реакция –
KMnO 4 + H 2 SO 4 + NA 2 SO 3 = K 2 SO 4 + MNSO 4 + NA 2 SO 4 + H 2 2 SO 4 + H 2 2 . используя ионно-электронный метод, мы можем сбалансировать реакцию окисления-восстановления.
Ионно-электронный метод
Ионно-электронный метод является очень эффективным методом балансировки уравнений окислительно-восстановительных реакций.
из реакции скелета мы видим, что –
Здесь,
The Oxidizing agent: KMnO 4 or MnO 4 -1
The Reducing agent: SO 3 2-
Reduction Half Reaction:
MnO 4 -1 +5e + 8H + = Mn 2- + 4H 2 O … …. …. …. (1)
Половина реакции окисления:
SO 3 2- – 2e + O 2- = SO 4 2- …………… (2)
Теперь,
Уравнение (1) x2 + (2) X5,
2MNO 4 -1 9011 + 10e + 16H + = 2Mn 2- + 8H 2 O
5SO 2 2- – 10e + 5O 2- = 5SO 4 -2
2MnO 4 -1 + 16H + + 5SO 3 2- + 5O 2- = 2Mn 2- + 8H 2 O + 5SO 4 -2
⇒ 2MnO 4 -1 + 6H + +10H + + 5O 2- + 5SO 3 2- = 2MN 2- + 8H 2 O + 5SO 4 -2
⇒ Добавляйте необходимые of и Radicals We Get We, Get We, Get We, Get We, Get We, Get We Get We,
3
⇒.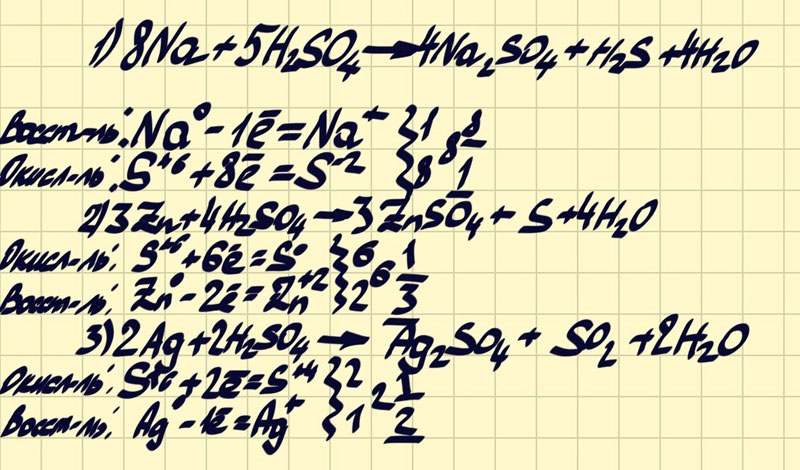



 При вдыхании сернистого газа более высокой концентрации — удушье, расстройство
речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При вдыхании сернистого газа более высокой концентрации — удушье, расстройство
речи, затруднение глотания, рвота, возможен острый отёк лёгких.
 Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС
Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС