Li2O+h3 =LiOH???? Если не правильно ,то составьте ура… -reshimne.ru
Новые вопросы
Ответы
Li2O+h3=2LiOH должно так получится, коэффициента в правой и левой части должны быть равны
Похожие вопросы
Рассчитайте массу бертолетовой соли необходимой для получения порции кислорода массой 40 г…
Какой обьем кислорода что измерялся при 20С и давлении 740 мм рт. ст., является необходимым для окисления 6,2 г фосфора к оксиду Фосфор(V)…
Помогите, пожалуйста, с химией. Массовая доля галогена в его высшем оксиде составляет 38,80%. Определите галоген….
ХИМИЯ!КОЭФФЕЦИЕНТЫ!
Расставьте коэффициенты в следующих схемах реакций. ..
..
Розібрати елемент Флуор…
Помогите умоляю .Напишите полные сокращенные уравнения следующих реакций…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
ХимияФизика
Биология
Другие предметы
История
Обществознание
Окружающий мир
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Исследование геометрического строения молекул Н2О, Li2O, LiOH методом двухатомных фрагментов в молекулах
Исследование геометрического строения молекул Н2О, Li2O, LiOH методом двухатомных фрагментов в молекулах
ЖСХ, т. 19, №5, 1978, стр.771
19, №5, 1978, стр.771
- Статья поступила: 24.04.1977 г.
- УДК 539.193
- Просмотров: 783
© Немухин А.В., Степанов Н.Ф.
Московский государственный университет им. М.В. Ломоносова, Россия
В рамках приближения двухатомных фрагментов в молекулах рассчитаны поверхности потенциальной энергии основных состояний симметрии 1А′ молекул Н2О, Li2О, LiOH. Использованный набор многоатомных базисных функций описывает атомные состояния Н( 2S), Li(2S), O(3Р, 1D) и в случае LiOH — Li+(1S), O‾(2Р). Соответствующие потенциальные кривые двухатомных фрагментов построены на основании данных современных неэмпирических расчётов. При использовании только состояний нейтральных атомов правильно предсказывается угловая геометрическая конфигурация молекулы Н2O и линейная — молекулы Li2O. Для молекулы LiOH получить правильную линейную геометрическую конфигурацию удается в рамках ионной модели.
Соответствующие потенциальные кривые двухатомных фрагментов построены на основании данных современных неэмпирических расчётов. При использовании только состояний нейтральных атомов правильно предсказывается угловая геометрическая конфигурация молекулы Н2O и линейная — молекулы Li2O. Для молекулы LiOH получить правильную линейную геометрическую конфигурацию удается в рамках ионной модели.
Ключевые слова:
| 2019 | 2020 | |||
|
Импакт-фактор |
0.745 | ↑ | 1.071 | |
| Срок опубликования |
6 мес |
(на правах рекламы)
Уважаемые авторы и подписчики “Журнала структурной химии”,
в свободном доступе
архив ЖСХ до 2018 года («Номера»).
Разместить рекламу в ЖСХ
Спецвыпуски
ЖСХ, т.51, №7, 2010
Методы исследования состава и структуры функциональных…
ЖСХ, т.55, №8, 2014
Самоорганизация молекулярных и супрамолекулярных структур
ЖСХ, т.56, №7, 2015
Структура органических соединений: расчёты и эксперименты
ЖСХ, т.46, №7, 2005
Супрамолекулярная химия и инженерия кристаллов
ЖСХ, т.45, №7, 2004
Труды X семинара Aзиатско-тихоокеанской академии материалов…
ЖСХ, т.52, №7, 2011
Рентгеновские и электронные спектры и химическая связь
ЖСХ, т.48, №7, 2007
ЖСХ, т. 47, №7, 2006
47, №7, 2006
Структура и свойства жидкостей
ЖСХ, т.49, №7, 2008
Рентгеновская и рентгеноэлектронная спектроскопия
ЖСХ, т.55, №7, 2014
Кристаллографии связующая нить
ЖСХ, т.56, №8, 2015
Строение и свойства координационных соединений
ЖСХ, т.50, №7, 2009
Тенденции в современной кристаллохимии
Обзоры
Самое интересное
Статьи, к которым чаще всего обращаются посетители
Из всех статейВ последнем номереВ текущем году
Рубрики
Теория строения молекул и химической связи (1232)
Исследование строения молекул физическими методами (1094)
Структура жидкостей и растворов (416)
Кристаллохимия (1636)
Структура функциональных материалов (18)
Супрамолекулярные соединения и наноразмерные системы (236)
Структура биологически активных систем (119)
Обзоры (241)
Краткие сообщения (3579)
Хроника (29)
Дискуссии (1)
Письма в редакцию (3)
— Без рубрики — (2913)
КОНФЕРЕНЦИИ, СИМПОЗИУМЫ, СЕМИНАРЫ: (0)
Материалы 3-й Всероссийской научной конференции «Методы… (4)
Материалы Третьей российской конференции «ГРАФЕН:… (13)
XVII симпозиум по межмолекулярному взаимодействию… (4)
Школа для молодых ученых «Терморентгенография… (7)
Вторая российская конференция «Графен: молекула и… (24)
Кузнецовские чтения – 2017. IV семинар по проблемам… (16)
IV семинар по проблемам… (16)
Материалы XVII симпозиума по межмолекулярному взаимодействию… (7)
Материалы конференции «Методы исследования состава… (25)
Материалы конференции «Рентгеновские и электронные… (17)
Материалы XVI Симпозиума по межмолекулярному взаимодействию… (5)
Материалы XV Симпозиума по межмолекулярному взаимодействию… (13)
Материалы XIV Симпозиума по межмолекулярному взаимодействию… (23)
Материалы XIII симпозиума по межмолекулярному взаимодействию… (10)
Материалы XII симпозиума по межмолекулярному взаимодействию… (13)
Труды X семинара Aзиатско-тихоокеанской академии материалов… (28)
Материалы XI симпозиума по межмолекулярному взаимодействию… (9)
Материалы семинара СО РАН — УрО РАН «Термодинамика… (15)
Материалы XIV Семинара по межмолекулярному взаимодействию… (16)
Материалы X симпозиума по межмолекулярному взаимодействию… (12)
Материалы XV научной школы-семинара «Рентгеновские… (29)
Материалы XIII семинара по межмолекулярному взаимодействию… (24)
Материалы конференции по теории строения и спектров… (17)
Материалы XII Международного семинара по межмолекулярному… (13)
Материалы конференции по теории строения и спектров… (28)
Материалы III Сессии по прикладной кристаллохимии… (18)
II Сибирский семинар по молекулярной электронике (6-7… (13)
Материалы IX Всесоюзного совещания «Физические… (14)
Вторая Всесоюзная конференция по квантовой химии твердого… (9)
Материалы Юбилейного семинара по изучению структуры… (33)
Материалы II Всесоюзного совещания по изучению структур… (30)
Конференции, симпозиумы, научные школы: Решения конференций (5)
Поправки к статьям (8)
Подать статью
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/vOuj6t2Zyeg» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Характеристика химического элемента-металла на основании его положения в ПСХЭ Д.И.Менделеева
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Характеристика химического элемента-металла на основании его положения в ПСХЭ Д.И.Менделеева
2.
 Цели урока• Дать план общей характеристики хим.
Цели урока• Дать план общей характеристики хим.Элемента по его положению в ПСХЭ
• Повторить строение атома, типы хим.
связи, классификацию неорганических
веществ и их свойства в свете ТЭД и
ОВР, генетическую связь между
классами неорганических веществ
• Познакомить учащихся с задачами на
выход продукта реакции
3. План характеристики ХЭ по его положению в ПСХЭ
1. Адрес ХЭ2. Строение атома, проявляемые
свойства, сравнение с соседними
элементами
3. Физические свойства простого
вещества
4. Оксид, образуемый этим ХЭ и его
свойства, тип и схема хим. связи
5. Гидроксид, образуемый этим ХЭ, его
свойства, тип связи
6. Водородное соединение, его свойства
7. Соли и их свойства
4. Дадим характеристику элемента ЛИТИЯ
• Порядковый номер 3, 2 период (малый),1 группа, главная подгруппа (IA)
• +3
n=2
S
n=1
S
2 1
p
1S 2 2 S 1
Li .
+
S
• Металлический элемент Li0 – 1 e Li +
• Восстановитель
окисление
5.
 Сравним свойства атома лития с соседними ХЭ по группе и периоду• В группе : Литий — Натрий
Сравним свойства атома лития с соседними ХЭ по группе и периоду• В группе : Литий — Натрий• На внешней оболочке – по 1 электрону
(сходство)
• Количество оболочек: у натрия на 1 оболочку
больше, следовательно, радиус атома натрия
больше, чем у лития, металлические и
восстановительные свойства натрия сильнее
• В периоде: Литий – Бериллий
• Количество оболочек – по 2 (сходство)
• Количество внешних электронов: у лития 1e,
а у натрия – 2 e, следовательно, радиус атома
лития больше, чем у бериллия, металлические
и восстановительные свойства лития сильнее
6. Литий – простое вещество
• Щелочной металл серебристого цвета,очень легкий, хранится под слоем
керосина, не встречается в природе в
свободном виде, малиновый цвет пламени
• Т пл. = 180,60, Т кип. = 13420, плотность 0,534
г/ cм3
• Металлическая кристаллическая решетка
• Металлическая хим. связь
• Li0 – 1 e
Li +
атом
ион
Электропроводность, теплопроводность, ковкость, пластичность,
металлический блеск, режется ножом, но на срезе быстро
окисляется и темнеет из-за своей активности
• Химические свойства: реагирует с водой и
неметаллами (кислородом, азотом,
галогенами, водородом и др.
 ) – составить
) – составитьуравнения реакций
7. Оксид лития – Li2O
• Солеобразующий, основный• Ионная связь (записать схему
образования связи)
• Белый цвет
• Химические свойства:
Запишите реакции оксида лития с
водой, оксидом углерода (IV), соляной
кислотой
Получение: Li2O2 + 2 Li = 2 Li2O
пероксид лития оксид лития
8. Гидроксид лития — LiOH
• Li+ — OHионная связь• Li+ — простой ион, OH- — сложный ион
• OH- — КПС
• Белый гигроскопичный порошок, мылкий на
ощупь, едкий
• Химические свойства: запишите реакции
гидроксида лития с серной кислотой,
сульфатом меди (II), оксидом углерода (IV),
исключение – разложение при нагревании
• Получение: электролиз расплавов
галогенсодержащих солей
2 LiCl
2 Li + Cl2
9. Водородное соединение – LiH гидрид лития
Твердый
Белый
Гигроскопичен
Используется как восстановитель
Cоли лития
Проверить растворимость солей лития
в воде по таблице растворимости
10.
 Открытие лития• А.Арфведсон, 1817 г. – признал
Открытие лития• А.Арфведсон, 1817 г. – призналлитий новым щелочным металлом
• Впервые выделен из слоистого
силикатного минерала петалита
LiAlSi4O10
• Название – от греческого «камень»
• Г.Дэви, 1818 г., электролиз
расплавленного оксида лития
11. Генетический ряд металла
Вспомните признаки генетического
ряда:
1) Один и тот же химический элементметалл
2) Разные формы существования этого
элемента-металла (простое веществооксид-основание-соль)
3) Взаимопревращения веществ разных
классов
12. Генетический ряд металла лития
• Li Li2O LiOH LiCl,Li2SO4,
LiNO3
Задание: осуществить цепочку
превращений (составить
уравнения реакций)
13. Задачи на примеси и выход продукта реакции
• Найдите объем углекислого газа (н.у.),который можно получить
взаимодействием 250 г известняка,
содержащего 20% примесей, с избытком
азотной кислоты.
• Можно ли получить весь 100%-ный
объем?
• Найти объем углекислого газа, если
выход газа составил 75% от
теоретически возможного.

14. Запомните формулы!
• η – выход продуктаm пр. V пр.
η = —— = ——m теор. V теор.
15. Домашнее задание
• § 1, упражнения• Решить задачу.
• При взаимодействии 800 мг 30%-ного
раствора едкого натра с избытком
раствора медного купороса (сульфата
меди (II)) было получено 196 мг осадка.
Каков его выход в % от теоретически
возможного?
English Русский Правила
1) li -> li2o 2) li2o -> lioh
11.09.2019 02:20, oktemba851
Всего ответов: 2
Посмотреть ответы
Похожие вопросы:
Химия, 01.03.2019 05:20
Рассчитаете массу карбоната натррия , необходиммого для осаждения всех ионнов кальция из раствора хлорида кальция массой 260 г с массовой долей 0,1.
Ответов: 3
Открыть
Химия, 01.03.2019 07:40
Определите молекулярную формулу углеводорода, массовая доля в котором равна 85,71%. относительная плотность паров вещества по воздуху составляет 1,93.
относительная плотность паров вещества по воздуху составляет 1,93.
Ответов: 2
Открыть
Химия, 01.03.2019 12:50
Запишите уравнение реакций, с которых можно осуществлять следующие превращения: а)метан-> ацетилен-> бензол-> хлоробензол б)карбонот кальция-> оксид кальция-> карбид кальция-> ацетилен-> бензол-> нитробензол.
Ответов: 2
Открыть
Химия, 02.03.2019 08:20
№1: для синтеза 30 кг муравьиной кислоты окислением метана (при выходе продукта 50%) потребуется метан объёмом (1. 2,9 м3). № 2: для нейтрализации 200 г. 9%-ого раствора уксусной кислоты потребуется гидроксид натрия массой (3. 12,0 p. s.:
нужны решения. можно в виде картинки (скана).
Ответов: 4
Открыть
Химия, 02.03.2019 13:00
С1. а) к 400г. раствора массовая доля гидроксида калия в котором 0,45, добавлено 100г. воды. какова массовая доля (%) щелочи в полученном растворе? б)в 200г. 2%-ного раствора повареной соли растворили 20г. хлорида натрия. какова массовая
хлорида натрия. какова массовая
доля хлорида натрия в полученном растворе?
Ответов: 3
Открыть
Химия, 02.03.2019 17:00
Масса раствора хлорида калия равна 220 г. после полного выпаривания воды образуется сухой остаток массой 40 г. определите массу воды в исходном растворе. если можно то распешите всю
Ответов: 3
Открыть
Химия, 02.03.2019 23:40
При обработке технической меди, содержащей 4% инертных примесей, разбавленной азотной кислотой, выделилось 33,6 л (н. у.) газа. определите массу технической меди.
Ответов: 2
Открыть
Химия, 03.03.2019 05:00
1. каким веществом рекомендуется деактивировать пролитую соляную или серную кислоту? а) щёлочью; б) водой; в) содой. 1. в каком варианте в состав каждого из соединений входят только ионы с электронной конфигурацией 1s22s22p63s23p6?
а) cao, kbr; б) mgs, nacl; в) cas, kcl; г) ki, kcl; 1. раствор, находящийся в контакте с кристаллами растворённого вещества, называется: а) ненасыщенный; б) насыщенный; в) перенасыщенный; г) концентрированный; д) крепкий. 1. в каком из веществ
1. в каком из веществ
атомы связаны между собой ионной связью? а) железо; б) поваренная соль; в) сахароза; г) вода; д) этиловый спирт. 1. какие из ниже процессов представляют собой окисление? а) mno2→mno42- б) 2h+→h3 в) br2→2br- г) cl-→clo3‑ д) s0→s2- 2. расположите
в порядке увеличения полярности связей следующие соединения: 1) albr3; 2) hbr; 3) kbr; 4) br2 ? а) 4123; б) 4213; в) 4231; г) 4312; д) 4321. 1. при прокаливании 100 г карбоната какого металла масса твёрдого осадка будет наибольшей? а) магния; б) кальция;
в) бария; г) стронция; д) цинка. прошу — ! завтра уже нужно сдавать.
Ответов: 3
Открыть
Химия, 03.03.2019 05:30
Научите как вообще определять степень окисления элементов в
Ответов: 2
Открыть
Химия, 03.03.2019 06:20
Вводе массой 120г растворили при нагревании 5 г оксида фосфора (5) .рассчитайте массу, количество вещества и массовую долю ортофосфорной кислоты в полученном растворе.
Ответов: 2
Открыть
Химия, 03. 03.2019 07:20
03.2019 07:20
Напишите уравнения всех реакции с которых можно осуществить следующие превращения: хлорид алюминия —> гидроксид алюминия > оксид алюминия —> сульфат алюминия.
Ответов: 2
Открыть
Химия, 03.03.2019 08:50
Вычислите массу осадка, образовавшегося при взаимодействии сульфата натрия и 47 г хлорида бария? !
Ответов: 2
Открыть
Вопросы по другим предметам:
Химия, 30.04.2020 14:31
Составить уравнения всех возможных химических реакций между веществами: кальций, оксид углерода(Iv)? гидроксид натрия, кислород, соляная кислота, карбонат кальция. Составить полные…
Другие предметы, 30.04.2020 14:31
Художні твори, що стали надбанням не лише національної, а й світової літератури, в яких порушуються питання, актуальні в будь-яких час – це ……
Математика, 30.04.2020 14:31
Знайдіть висоту прямокутного паралелипіпеда, якщо площа його основи дорівнює 18,5см, а обєм 7,4см3…
Українська література, 30. 04.2020 14:31
04.2020 14:31
Враження від твору «Назар Стодоля» Т. Шевченко…
Математика, 06.05.2020 12:29
40 БАЛЛОВ!!! решить нужно 11,12,14.
внутри фото!…
Физика, 06.05.2020 12:29
Розрахуйте, скільки коштує електроенергія, витрачена на роботу електричної праски за 2 год? Сила струму 4 А, напруга 220 В, тариф — 90 коп. за 1 кВтгод. …
Алгебра, 06.05.2020 12:29
АЛГЕБРА 8 КЛАСС Решить неполное квадратное уравнение: а) -125 +5×2 =0 ; б) 3×2 – 12x =0.
2. Решить уравнение: а) x2 -2x -3 =0; б) х2-8х +5=0; в)2х2 –х – 3 =0; г) х2- 5х +9 =0…
Қазақ тiлi, 06.05.2020 12:29
плз. я в казахскому тапочек))…
Русский язык, 30.04.2020 16:16
1) Оформляя перевод Андрей задержался, и, когда вышел на улицу было совсем темно.
2) Девушка овладела собой, и, когда она заговорила, голос её звучал беспечно и шутливо.
Математика, 30.04.2020 16:16
Пересечением называют множество, состоящее из элементов, входящих в одно из данных множеств ответ да или нет. ..
..
Еще вопросы по предмету: Химия Другие вопросы
Литий реферат по биологии | Сочинения Биология
Скачай Литий реферат по биологии и еще Сочинения в формате PDF Биология только на Docsity! Литий Литий (лат. Lithium), Li, химический элемент с атомным номером 3, атомная масса 6,941. Химический символ Li читается так же, как и название самого элемента. Литий встречается в природе в виде двух стабильных нуклидов 6Li (7,52% по массе) и 7Li (92,48%). В периодической системе Д. И. Менделеева литий расположен во втором периоде, группе IA и принадлежит к числу щелочных металлов. Конфигурация электронной оболочки нейтрального атома лития 1s22s1. В соединениях литий всегда проявляет степень окисления +1. Металлический радиус атома лития 0,152 нм, радиус иона Li+ 0,078 нм. Энергии последовательной ионизации атома лития 5,39 и 75,6 эВ. Электроотрицательность по Полингу 0,98, самая большая у щелочных металлов. В виде простого вещества литий — мягкий, пластичный, легкий, серебристый металл. Физические и химические свойства: из металлов литий самый легкий, его плотность 0,534 г/см3. Температура плавления 180,5°C, температура кипения 1326°C. При температурах от –193°C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а = 0,350 нм. Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний (Mg). Литий химически очень активен. Он способен взаимодействовать с кислородом (O) и азотом (N) воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия: 4Li + O2 = 2Li2O, 6Li + N2 = 2Li3N При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию (Mg), нагретый литий способен гореть в CO2: 4Li + CO2 = C + 2Li2O Стандартный электродный потенциал Li/Li+ имеет наибольшее отрицательное значение (E°298 = –3,05 B) по сравнению со стандартными электродными потенциалами других металлов.
Физические и химические свойства: из металлов литий самый легкий, его плотность 0,534 г/см3. Температура плавления 180,5°C, температура кипения 1326°C. При температурах от –193°C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а = 0,350 нм. Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний (Mg). Литий химически очень активен. Он способен взаимодействовать с кислородом (O) и азотом (N) воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия: 4Li + O2 = 2Li2O, 6Li + N2 = 2Li3N При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию (Mg), нагретый литий способен гореть в CO2: 4Li + CO2 = C + 2Li2O Стандартный электродный потенциал Li/Li+ имеет наибольшее отрицательное значение (E°298 = –3,05 B) по сравнению со стандартными электродными потенциалами других металлов. Это обусловлено большой энергией гидратации маленького иона Li+, что значительно смещает равновесие в сторону ионизации металла: Li-твердый <> Li+раствор + e– Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов. Соединения лития — соли — как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния (Mg) или кальция (Ca). Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 — это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313,5 г LiClO3). Оксид лития Li2O — белое твердое вещество — представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH. Этот гидроксид получают электролизом водных растворов LiCl: 2LiCl + 2h3O = 2LiOH + Cl2 + h3 LiOH — сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов.
Это обусловлено большой энергией гидратации маленького иона Li+, что значительно смещает равновесие в сторону ионизации металла: Li-твердый <> Li+раствор + e– Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов. Соединения лития — соли — как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния (Mg) или кальция (Ca). Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 — это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313,5 г LiClO3). Оксид лития Li2O — белое твердое вещество — представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH. Этот гидроксид получают электролизом водных растворов LiCl: 2LiCl + 2h3O = 2LiOH + Cl2 + h3 LiOH — сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов. Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду: 2LiOH = Li2O + h3O Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом (H): 2Li + h3 = 2LiH LiH — ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2,8 м3 h3): LiH + h3O = LiOH + h3 Он также находит применение при синтезе различных гидридов, например, борогидрида лития: BCl3 + 4LiH = Li[Bh5] + 3LiCl. Литий образует соединения с частично ковалентной связью Li—C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция: C6H5I + 2Li = C6H5Li + LiI.
Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду: 2LiOH = Li2O + h3O Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом (H): 2Li + h3 = 2LiH LiH — ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2,8 м3 h3): LiH + h3O = LiOH + h3 Он также находит применение при синтезе различных гидридов, например, борогидрида лития: BCl3 + 4LiH = Li[Bh5] + 3LiCl. Литий образует соединения с частично ковалентной связью Li—C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция: C6H5I + 2Li = C6H5Li + LiI.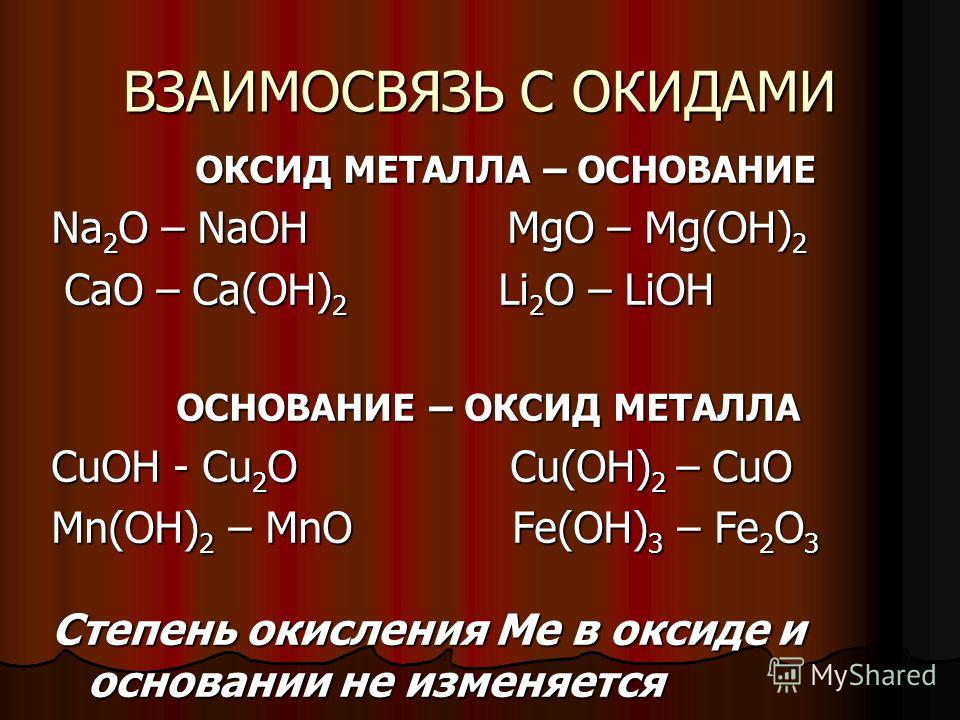 Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов. История открытия: литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10]. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos — камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х. Г. Гмелин в 1818 году. В этом же году английский химик Г. Дэви электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида: 2LiCl = 2Li + Cl2 Получение: в настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl.
Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов. История открытия: литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10]. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos — камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х. Г. Гмелин в 1818 году. В этом же году английский химик Г. Дэви электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида: 2LiCl = 2Li + Cl2 Получение: в настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции. Нахождение в природе: литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10–3% по массе. Как уже упоминалось, основные минералы, содержащие литий, — это петалит (содержит 3,5-4,9 % Li2O), сподумен (6-7 % Li2O), лепидолит (4-6 % Li2O) и амблигонит LiAl[PO4] — 8-10 % Li2O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10–5 % лития. Применение: из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6Li получают радиоактивный тритий: 63Li + 10n = 31H + 42He. Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и
Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции. Нахождение в природе: литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10–3% по массе. Как уже упоминалось, основные минералы, содержащие литий, — это петалит (содержит 3,5-4,9 % Li2O), сподумен (6-7 % Li2O), лепидолит (4-6 % Li2O) и амблигонит LiAl[PO4] — 8-10 % Li2O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10–5 % лития. Применение: из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6Li получают радиоактивный тритий: 63Li + 10n = 31H + 42He. Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и
Равновесные давления h3O(g) в системе Li2O(т)-LiOH(т)
ScienceDirect Корпоративный входВход/регистрация , декабрь 1993 г. , стр. 92-97
, стр. 92-97
https://doi.org/10.1016/0022-3115(93)
Равновесное парциальное давление водяного пара над Li 2 O(s Систему )-LiOH(s) измеряли методом транспирации. Равновесное давление водяного пара, PH 2 O , для реакции 2LiOH(s)/ai Li 2 O(s) + H 2 O(g) выражается следующим образом: log 1 PH 3 9 O [ Па ] = (11,706–6781/ T ) ± 0,008, T = 570–690 K .
В сочетании с другими термодинамическими данными результаты дают 135,4 ± 0,2 кДж / моль для теплоты реакции третьего закона при 298,15 К. Разумное соответствие между теплотой реакции второго и третьего закона указывает на справедливость методика эксперимента, использованная в данной работе.
Ссылки (14)
- F.D. Россини и др.
Отдельные значения химических термодинамических свойств
- T.
 Terai et al.
Terai et al. J. Nucl. Матер.
(1991)
- М. Тетенбаум и др.
J. Nucl. Матер.
(1984)
- К. Сако и др.
JAERI-M 5502
(1973)
- H. Takeshita et al.
JAERI-M 86-02
(1986)
- С.З. Грегори и др.
Дж. Ам. хим. соц.
(1955)
- M.W.Chase и др. МВт Чейз и др.
J. Phys. хим. Ссылка Данные
(1985)
В полной текстовой версии этой статьи доступно больше ссылок.
Теоретические исследования начального окисления металлических литиевых анодов
2021, Applied Surface Science
Благодаря высокой теоретической удельной емкости и низкому электрохимическому потенциалу литий-металлические аноды являются идеальными кандидатами для будущих поколений аккумуляторов с высокой плотностью энергии для успешного внедрения электрической мобильности в больших масштабах.
 К сожалению, высокая реакционная способность лития по отношению к атмосферным загрязнениям представляет собой высокий риск для безопасности, что может ограничить коммерческое применение металлических литиевых анодов. На примере окисления лития в этой работе показано образование скоординированных кластеров на поверхности металлического лития, которые демонстрируют поразительное сходство с субоксидами класса соединений. Показано, что кластеры оказывают решающее влияние на поглощение, диссоциацию и диффузию на поверхности металла и дают представление о механизме начальной реконструкции, наблюдаемой для литиевых анодов.
К сожалению, высокая реакционная способность лития по отношению к атмосферным загрязнениям представляет собой высокий риск для безопасности, что может ограничить коммерческое применение металлических литиевых анодов. На примере окисления лития в этой работе показано образование скоординированных кластеров на поверхности металлического лития, которые демонстрируют поразительное сходство с субоксидами класса соединений. Показано, что кластеры оказывают решающее влияние на поглощение, диссоциацию и диффузию на поверхности металла и дают представление о механизме начальной реконструкции, наблюдаемой для литиевых анодов.Изменение структуры гальки Li
2 TiO3 с избытком Li в атмосфере водяного пара при повышенных температурах2016, Ядерные материалы и энергетика
Второй пик рассмотрен в результате разложения LiOH. Равновесное давление паров воды в системе Li2O-h3O-LiOH показано на рис. 8 в зависимости от температуры [7–9]. На этом рисунке нанесена начальная точка второго пика в каждом состоянии.

Галька Li 2 TiO 3 с избытком Li, которая находится на стадии разработки в JAEA (Японское агентство по атомной энергии) в качестве передового материала для воспроизводства трития, подвергалась воздействию водяного пара при повышенных температурах. В процессе повышения температуры от комнатной до 900 °C распределение пор и площадь поверхности по БЭТ в значительной степени изменились. Площадь поверхности постепенно уменьшалась за счет эффекта спекания при выдерживании при температуре 900 °C в течение длительного времени. Выделение водяного пара наблюдали примерно при 450 °C за счет разложения LiOH в дополнение к выделению адсорбированной воды в начале нагревания. Большой пик выброса CO 2 наблюдали при 700 °C. Это вызвано разложением Li 2 CO 3 . Заметный слой расплава образовался на поверхности гальки при температуре более 700 °C в результате плавления Li 2 CO 3 . Изменение структуры гальки и влияние LiOH и Li 2 CO 3 необходимо учитывать при обсуждении поведения разбавленного трития из гальки Li 2 TiO 3 .

Кинетическое измерение и прогноз выделения водорода из поликристаллической системы LiH/Li
2 O/LiOH2005, Journal of Nuclear Materials
Вполне вероятно, что DRIFT-измерение толщины LiOH на отожженной соли не так чувствительно, как измерение на основе масс-спектрометра, используемое для обожженной соли. Но из-за низкого равновесного давления h3O в системе Li2O/LiOH [6] также возможно, что отжиг соли для превращения LiOH в Li2O в сухой среде с несколькими ppm h3O не так эффективен, как в среде сверхвысокого вакуума. (в случае с печеной солью). После откачки контейнеры помещали в печи с разной температурой.
Из-за экзотермической реакции соли гидрида лития (LiH) с водой во время транспортировки и обработки на поверхности LiH всегда присутствует тонкая пленка гидроксида лития (LiOH). В сухом или вакуумном хранилище эта тонкая пленка LiOH медленно разлагается. Метод температурно-программируемой реакции/разложения (ТПВ) был использован в сочетании с изоконверсионным методом термического анализа для определения кинетики дегазации H 2 O из чистого LiOH и H 2 и H 2 O из этой тонкой пленки LiOH.
 Получение H 2 по реакции LiH с LiOH с образованием прослойки оксида лития (Li 2 O) термодинамически выгодно, скорость дальнейшей реакции ограничивается диффузией через Li 2 O и стабильностью разлагающийся LiOH. Гидроксид лития на границе раздела LiOH/вакуум также легко разлагается до Li 2 O, высвобождая H 2 O, который впоследствии реагирует с LiH в закрытой системе с образованием H 2 . В начале сухого разложения, где преобладающим продуктом является H 2 , энергия активации газовыделения из тонкой пленки LiOH ниже, чем для объемного LiOH. Однако по мере протекания реакций на границах LiH/Li 2 O/LiOH и на границах LiOH/вакуум общий энергетический барьер активации для дегазации приближается к барьеру разложения объемного LiOH. Разработанная здесь кинетика предсказывает профиль выделения водорода, хорошо согласующийся с выделением водорода, наблюдаемым при длительном изотермическом хранении.
Получение H 2 по реакции LiH с LiOH с образованием прослойки оксида лития (Li 2 O) термодинамически выгодно, скорость дальнейшей реакции ограничивается диффузией через Li 2 O и стабильностью разлагающийся LiOH. Гидроксид лития на границе раздела LiOH/вакуум также легко разлагается до Li 2 O, высвобождая H 2 O, который впоследствии реагирует с LiH в закрытой системе с образованием H 2 . В начале сухого разложения, где преобладающим продуктом является H 2 , энергия активации газовыделения из тонкой пленки LiOH ниже, чем для объемного LiOH. Однако по мере протекания реакций на границах LiH/Li 2 O/LiOH и на границах LiOH/вакуум общий энергетический барьер активации для дегазации приближается к барьеру разложения объемного LiOH. Разработанная здесь кинетика предсказывает профиль выделения водорода, хорошо согласующийся с выделением водорода, наблюдаемым при длительном изотермическом хранении.
Влияние изотопов водорода на термодинамическое равновесие в системе Li
2 O(т)-LiOH(т)-H2 O(г)1994 г., Journal of Nuclear Materials
Измерения равновесных парциальных давлений H 2 O(g) и D 2 O(g) над Li 2 O(s)-LiOH(s) и Li 2 Представлены системы O(s)-LiOD(s). Измерения проводились отдельно для каждого изотопа водорода на одном и том же образце и методиках эксперимента в интервале температур от 59от 0 до 670 K. Для данной температуры равновесные парциальные давления для реакций 2LiOX(s) ai Li 2 O(s)+X 2 O(g), [X = H, D], были в порядке P D 2 равновесное парциальное давление выражается следующим образом: . Из этой степени парциального давления разность теплот образования LiOD(s) и LiOH(s), Δ f H o [LiOD(s)]− Δ f H o [LiOH(s)] было оценено как -2,4±0,1 кДж/моль при 629K
АТОМИСТИЧЕСКИЕ ИССЛЕДОВАНИЯ ПО Коррозии лития, индуцированной водой
2022, CHEMSUSCHEM
Статья
Термодинамический анализ Хромийной растворимости.
 ядерных материалов, том 465, 2015, с. 674-681
ядерных материалов, том 465, 2015, с. 674-681Математический аппарат описания взаимодействия растворенных веществ в разбавленных растворах хрома и азота в жидком литии применен для расчета температурной зависимости растворимости хрома в жидком лития с различным содержанием азота. Показано, что полученные уравнения полезны для понимания взаимосвязи между термодинамическими свойствами и локальным упорядочением в расплаве Li–Cr–N. Сравнение теории и литературных данных по растворимости хрома в жидком литии, загрязненном азотом, позволило объяснить причины отклонения экспериментальной полулогарифмической зависимости содержания хрома в жидком литии от обратной температуры от прямая линия.
Исследовательская статья
«Испарение жидкого эвтектического сплава Pb-Li от 1000K до 1200K – высокотемпературное масс-спектрометрическое исследование»
Journal of Nuclear Materials, Volume 497, 2017, pp. давление паров/активность лития в жидком эвтектическом сплаве Pb-Li были экспериментально определены с использованием метода Эффузии Кнудсена в недавней статье.
 Однако взаимодействие сплава с графитом контейнера не учитывалось, что приводило к существенно меньшим значениям измеряемых давлений пара.
Однако взаимодействие сплава с графитом контейнера не учитывалось, что приводило к существенно меньшим значениям измеряемых давлений пара.Научная статья
Влияние модификации конструкции бланкета ВКЛЖ на потери давления в МГД
Fusion Engineering and Design, Volume 124, 2017, pp. 948-952
В 2008–2009 гг. магнитогидродинамические (МГД) течения в масштабной модели свинцово-литиевого бланкета (HCLL), охлаждаемого гелием. В целях повышения механической жесткости модулей экранов HCLL позже была изменена конструкция пластины жесткости между двумя гидравлически связанными нерестилищами (BU). В первой конструкции жидкий металл переходил из одного БУ в соседний, перетекая через узкую щель, протянувшуюся по всей ширине БУ. В самой последней конструкции это отверстие было заменено серией более мелких зазоров. Поэтому скорость локально возрастает из-за уменьшения поперечного сечения вдоль пути потока, а жидкий металл сжимается и расширяется вдоль силовых линий магнитного поля, попадая в соседний БУ.
 Известно, что эти условия потока создают дополнительные потери давления на МГД. Чтобы оценить влияние изменений конструкции на МГД-расход и перепад давления, предыдущий участок испытаний был адаптирован к новой конструкции. Экспериментальные результаты показывают, что модификации конструкции у первой стенки приводят к увеличению перепада давления у первой стенки в 3-3,5 раза. Как следствие, общее падение давления становится больше. Явления трехмерной МГД, возникающие на первой стенке, по-видимому, в основном связаны с эффектами инерции, которые ограничены слоями, параллельными магнитному полю.
Известно, что эти условия потока создают дополнительные потери давления на МГД. Чтобы оценить влияние изменений конструкции на МГД-расход и перепад давления, предыдущий участок испытаний был адаптирован к новой конструкции. Экспериментальные результаты показывают, что модификации конструкции у первой стенки приводят к увеличению перепада давления у первой стенки в 3-3,5 раза. Как следствие, общее падение давления становится больше. Явления трехмерной МГД, возникающие на первой стенке, по-видимому, в основном связаны с эффектами инерции, которые ограничены слоями, параллельными магнитному полю.Исследовательская статья
Ионный транспорт в (нано)композитах для топливных элементов
International Journal of Hydrogen Energy, Volume 41, Issue 18, 2016, pp. <25 нм) и LiAlO 2 (размер частиц >1 мкм). Оксиды объединяли со смесью Na 2 CO 3 и Li 2 CO 3 (эвтектический состав) и обжигали при температурах в диапазоне 600–700 °C (в некоторых случаях с помощью вакуума).
 . Композиты охарактеризованы методами сканирующей электронной микроскопии, рентгеноструктурного анализа и спектроскопии импеданса на воздухе в интервале температур 300–600 °С. Независимо от состава и размера зерен все образцы показали одинаковую зависимость электропроводности от температуры с резким изменением, близким к температуре эвтектики карбонатов. При T > 500 °C все материалы имеют одинаковую проводимость, что указывает на то, что расплавленные карбонаты преобладают в электрических характеристиках. Однако при низкой температуре (300–450 °C) во всех композитах можно заметить значительные различия, при этом наилучшие характеристики наблюдаются у композитов на основе церия с более крупным размером зерна (около 135 нм).
. Композиты охарактеризованы методами сканирующей электронной микроскопии, рентгеноструктурного анализа и спектроскопии импеданса на воздухе в интервале температур 300–600 °С. Независимо от состава и размера зерен все образцы показали одинаковую зависимость электропроводности от температуры с резким изменением, близким к температуре эвтектики карбонатов. При T > 500 °C все материалы имеют одинаковую проводимость, что указывает на то, что расплавленные карбонаты преобладают в электрических характеристиках. Однако при низкой температуре (300–450 °C) во всех композитах можно заметить значительные различия, при этом наилучшие характеристики наблюдаются у композитов на основе церия с более крупным размером зерна (около 135 нм).Исследовательская статья
Об электрофоретической подвижности сукциногликана, моделируемого как сферический полиэлектролит: от теории Германса-Фуджиты к регулированию заряда в многокомпонентных электролитах
Journal of Colloid and Interface Science, Volume 482, 2016, pp.
 131 -134
131 -134Литературные интерпретации электрофоретической подвижности сферических полиэлектролитов пересматриваются с использованием данных капиллярного электрофореза Duval et al. (2006) для внеклеточного полисахарида сукциногликана в качестве примера. Тонкие изменения в подвижности полиэлектролитов недавно были приписаны новым электрокинетическим теориям, которые включают многокомпонентные электролиты, регулирование заряда и так называемые явления поляризации и релаксации. Однако эти расчеты демонстрируют несколько необычных тенденций, которые еще предстоит объяснить, поэтому выводы, сделанные на их основе, противоречивы. Здесь независимые расчеты подкрепляют выводы, сделанные на основе исходной модели Дюваля и др., т. е. расхождения между экспериментами и всеми доступными в настоящее время электрокинетическими теориями отражают изменения конформации сукциногликана, возникающие при изменении pH и ионной силы электролита.
Исследовательская статья
Исследования по (SR
1- x CA x ) MNO 3 (0,0≤ x ≤1,0) Ceramics с отрицательной магнитизацией 9006 22 x ≤1,0).
 Материалы, том 354, 2014, стр. 303-308
Материалы, том 354, 2014, стр. 303-308В данной работе описаны структурные и магнитные свойства ≤1,0) керамика в объемном виде, синтезированная методом химического соосаждения. Мы наблюдали, что увеличение концентрации кальция в манганите стронция изменяет симметрию кристалла с моноклинной на орторомбическую. (Ср 1- x Ca x ) MnO 3 (0,0≤ x ≤1,0) керамика показывает отрицательную намагниченность ниже ~42 К; выше этой температуры он проявляет парамагнитную природу, а ниже — антиферромагнитную природу. Отрицательная намагниченность в этом оксиде, по-видимому, является результатом конкуренции одноионной магнитокристаллической анизотропии и антисимметричных взаимодействий Дзялошинского-Мория.
- 1
Текущий адрес: Nuclear Fuel Industries, Ltd., Tokai Works, 3135-41 Muramatsu, Tokai-mura, Ibaraki 319-11, Япония.
Copyright © 1993 Опубликовано Elsevier B. V.
%
5 0 объект >
ручей
application/pdfdoi:10.1038/nmat3784
V.
%
5 0 объект >
ручей
application/pdfdoi:10.1038/nmat3784
 40.9Nature Materials 12, 1130 (2013). дои: 10.1038/nmat3784
2013-11-08T13:51:19+05:302013-11-08T13:51:19+05:30
40.9Nature Materials 12, 1130 (2013). дои: 10.1038/nmat3784
2013-11-08T13:51:19+05:302013-11-08T13:51:19+05:30 )
эндообъект
18 0 объект
>
эндообъект
21 0 объект
(\376\377\000R\000e\000a\000l\000-\000t\000i\000m\000e\000\040\000d\000e\000t\000e\000c\000t\000i\000o\000n\000\040 \000o\000f\000\040\000t\000h\000e\000\040\000R\000u\000-\000c\000o\000n\000t\000a\000i\000n\000i\000n\000g\000\040\ 000p\000h\000a\000s\000e\000s\000.)
эндообъект
22 0 объект
>
эндообъект
25 0 объект
(\376\377\000I\000d\000e\000n\000t\000i\000f\000y\000i\000n\000g\000\040\000t\000h\000e\000\040\000s\000o\000u\000r\ 000c\000e\000s\000\040\000o\000f\000\040\000t\000h\000e\000\040\000`\000a\000d\000d\000i\000t\000i\000o\000n\000a\000l \000\040\000c\000a\000p\000a\000c\000i\000t\000y\000’\000\040\000b\000y\000\040\000N\000M\000R\000\040\000s\000p\ 000e\000c\000t\000r\000o\000s\000c\000o\000p\000y\000.)
эндообъект
26 0 объект
>
эндообъект
290 объект
(\376\377\000M\000e\000t\000h\000o\000d\000s)
эндообъект
30 0 объект
>
эндообъект
33 0 объект
(\376\377\000M\000a\000t\000e\000r\000i\000a\000l\000s\000.)
эндообъект
34 0 объект
>
эндообъект
37 0 объект
(\376\377\000X\000-\000r\000a\000y\000\040\000d\000i\000f\000f\000r\000a\000c\000t\000i\000o\000n\000/\000P\000D\ 000F\000\040\000a\000n\000d\000\040\000X\000A\000S\000\040\000c\000h\000a\000r\000a\000c\000t\000e\000r\000i\000z\000a\ 000т\000и\000о\000н\000.
)
эндообъект
18 0 объект
>
эндообъект
21 0 объект
(\376\377\000R\000e\000a\000l\000-\000t\000i\000m\000e\000\040\000d\000e\000t\000e\000c\000t\000i\000o\000n\000\040 \000o\000f\000\040\000t\000h\000e\000\040\000R\000u\000-\000c\000o\000n\000t\000a\000i\000n\000i\000n\000g\000\040\ 000p\000h\000a\000s\000e\000s\000.)
эндообъект
22 0 объект
>
эндообъект
25 0 объект
(\376\377\000I\000d\000e\000n\000t\000i\000f\000y\000i\000n\000g\000\040\000t\000h\000e\000\040\000s\000o\000u\000r\ 000c\000e\000s\000\040\000o\000f\000\040\000t\000h\000e\000\040\000`\000a\000d\000d\000i\000t\000i\000o\000n\000a\000l \000\040\000c\000a\000p\000a\000c\000i\000t\000y\000’\000\040\000b\000y\000\040\000N\000M\000R\000\040\000s\000p\ 000e\000c\000t\000r\000o\000s\000c\000o\000p\000y\000.)
эндообъект
26 0 объект
>
эндообъект
290 объект
(\376\377\000M\000e\000t\000h\000o\000d\000s)
эндообъект
30 0 объект
>
эндообъект
33 0 объект
(\376\377\000M\000a\000t\000e\000r\000i\000a\000l\000s\000.)
эндообъект
34 0 объект
>
эндообъект
37 0 объект
(\376\377\000X\000-\000r\000a\000y\000\040\000d\000i\000f\000f\000r\000a\000c\000t\000i\000o\000n\000/\000P\000D\ 000F\000\040\000a\000n\000d\000\040\000X\000A\000S\000\040\000c\000h\000a\000r\000a\000c\000t\000e\000r\000i\000z\000a\ 000т\000и\000о\000н\000. )
эндообъект
38 0 объект
>
эндообъект
41 0 объект
(\376\377\000N\000M\000R\000\040\000c\000h\000a\000r\000a\000c\000t\000e\000r\000i\000z\000a\000t\000i\000o\000n\000. )
эндообъект
42 0 объект
>
эндообъект
45 0 объект
(\376\377\000F\000i\000r\000s\000t\000-\000p\000r\000i\000n\000c\000i\000p\000l\000e\000s\000\040\000c\000a\000l\000c \000u\000l\000a\000t\000i\000o\000n\000s\000.)
эндообъект
46 0 объект
>
эндообъект
490 объект
(\376\377\000F\000i\000g\000u\000r\000e\000\040\0001\000\040\000I\000n\000\040\000s\000i\000t\000u\000\040\000P\ 000D\000F\000\040\000a\000n\000a\000l\000y\000s\000e\000s\000\040\000o\000f\000\040\000t\000h\000e\000\040\000R\000u\ 000O\0002\000/\000L\000i\000\040\000s\000y\000s\000t\000e\000m\000\040\000r\000e\000v\000e\000a\000l\000\040\000t\000h \000e\000\040\000c\000h\000a\000n\000g\000e\000s\000\040\000i\000n\000\040\000p\000h\000a\000s\000e\000\040\000c\000o \000m\000p\000o\000s\000i\000t\000i\000o\000n\000\040\000f\000o\000l\000l\000o\000w\000i\000n\000g\000\040\000b\000a\000t \000t\000e\000r\000y\000\040\000d\000i\000s\000c\000h\000a\000r\000g\000e\000.
)
эндообъект
38 0 объект
>
эндообъект
41 0 объект
(\376\377\000N\000M\000R\000\040\000c\000h\000a\000r\000a\000c\000t\000e\000r\000i\000z\000a\000t\000i\000o\000n\000. )
эндообъект
42 0 объект
>
эндообъект
45 0 объект
(\376\377\000F\000i\000r\000s\000t\000-\000p\000r\000i\000n\000c\000i\000p\000l\000e\000s\000\040\000c\000a\000l\000c \000u\000l\000a\000t\000i\000o\000n\000s\000.)
эндообъект
46 0 объект
>
эндообъект
490 объект
(\376\377\000F\000i\000g\000u\000r\000e\000\040\0001\000\040\000I\000n\000\040\000s\000i\000t\000u\000\040\000P\ 000D\000F\000\040\000a\000n\000a\000l\000y\000s\000e\000s\000\040\000o\000f\000\040\000t\000h\000e\000\040\000R\000u\ 000O\0002\000/\000L\000i\000\040\000s\000y\000s\000t\000e\000m\000\040\000r\000e\000v\000e\000a\000l\000\040\000t\000h \000e\000\040\000c\000h\000a\000n\000g\000e\000s\000\040\000i\000n\000\040\000p\000h\000a\000s\000e\000\040\000c\000o \000m\000p\000o\000s\000i\000t\000i\000o\000n\000\040\000f\000o\000l\000l\000o\000w\000i\000n\000g\000\040\000b\000a\000t \000t\000e\000r\000y\000\040\000d\000i\000s\000c\000h\000a\000r\000g\000e\000. )
эндообъект
50 0 объект
>
эндообъект
53 0 объект
(\376\377\000F\000i\000g\000u\000r\000e\000\040\0002\000\040\000I\000n\000\040\000s\000i\000t\000u\000\040\000X\ 000A\000S\000\040\000a\000n\000a\000l\000y\000s\000e\000s\000\040\000o\000f\000\040\000t\000h\000e\000\040\000R\000u\ 000O\0002\000/\000L\000i\000\040\000s\000y\000s\000t\000e\000m\000\040\000r\000e\000v\000e\000a\000l\000\040\000t\000h \000e\000\040\000c\000h\000a\000n\000g\000e\000s\000\040\000i\000n\000\040\000t\000h\000e\000\040\000a\000v\000e\000r \000a\000g\000e\000\040\000o\000x\000i\000d\000a\000t\000i\000o\000n\000\040\000s\000t\000a\000t\000e\000\040\000o\000f \000\040\000r\000u\000t\000h\000e\000n\000i\000u\000m\000,\000\040\000p\000h\000a\000s\000e\000\040\000c\000o\000m\ 000p\000o\000s\000i\000t\000i\000o\000n\000\040\000a\000n\000d\000\040\000b\000o\000n\000d\000\040\000l\000e\000n\000g\ 000т\000ч\000с\000.)
эндообъект
54 0 объект
>
эндообъект
57 0 объект
(\376\377\000F\000i\000g\000u\000r\000e\000\040\0003\000\040\000T\000r\000a\000c\000k\000i\000n\000g\000\040\000t\ 000h\000e\000\040\000e\000v\000o\000l\000u\000t\000i\000o\000n\000\040\000o\000f\000\040\000d\000i\000f\000f\000e\000r\ 000e\000n\000t\000\040\000c\000h\000e\000m\000i\000c\000a\000l\000\040\000s\000p\000e\000c\000i\000e\000s\000\040\000a\ 000t\000\040\000d\000i\000f\000f\000e\000r\000e\000n\000t\000\040\000s\000t\000a\000t\000e\000s\000\040\000o\000f\000\ 040\000c\000h\000a\000r\000g\000e\000\040\000i\000n\000\040\000t\000h\000e\000\040\000R\000u\000O\0002\000/\000L\000i \000\040\000b\000a\000t\000t\000e\000r\000y\000\040\000s\000y\000s\000t\000e\000m\000.
)
эндообъект
50 0 объект
>
эндообъект
53 0 объект
(\376\377\000F\000i\000g\000u\000r\000e\000\040\0002\000\040\000I\000n\000\040\000s\000i\000t\000u\000\040\000X\ 000A\000S\000\040\000a\000n\000a\000l\000y\000s\000e\000s\000\040\000o\000f\000\040\000t\000h\000e\000\040\000R\000u\ 000O\0002\000/\000L\000i\000\040\000s\000y\000s\000t\000e\000m\000\040\000r\000e\000v\000e\000a\000l\000\040\000t\000h \000e\000\040\000c\000h\000a\000n\000g\000e\000s\000\040\000i\000n\000\040\000t\000h\000e\000\040\000a\000v\000e\000r \000a\000g\000e\000\040\000o\000x\000i\000d\000a\000t\000i\000o\000n\000\040\000s\000t\000a\000t\000e\000\040\000o\000f \000\040\000r\000u\000t\000h\000e\000n\000i\000u\000m\000,\000\040\000p\000h\000a\000s\000e\000\040\000c\000o\000m\ 000p\000o\000s\000i\000t\000i\000o\000n\000\040\000a\000n\000d\000\040\000b\000o\000n\000d\000\040\000l\000e\000n\000g\ 000т\000ч\000с\000.)
эндообъект
54 0 объект
>
эндообъект
57 0 объект
(\376\377\000F\000i\000g\000u\000r\000e\000\040\0003\000\040\000T\000r\000a\000c\000k\000i\000n\000g\000\040\000t\ 000h\000e\000\040\000e\000v\000o\000l\000u\000t\000i\000o\000n\000\040\000o\000f\000\040\000d\000i\000f\000f\000e\000r\ 000e\000n\000t\000\040\000c\000h\000e\000m\000i\000c\000a\000l\000\040\000s\000p\000e\000c\000i\000e\000s\000\040\000a\ 000t\000\040\000d\000i\000f\000f\000e\000r\000e\000n\000t\000\040\000s\000t\000a\000t\000e\000s\000\040\000o\000f\000\ 040\000c\000h\000a\000r\000g\000e\000\040\000i\000n\000\040\000t\000h\000e\000\040\000R\000u\000O\0002\000/\000L\000i \000\040\000b\000a\000t\000t\000e\000r\000y\000\040\000s\000y\000s\000t\000e\000m\000. )
эндообъект
58 0 объект
>
эндообъект
61 0 объект
(\376\377\000F\000i\000g\000u\000r\000e\000\040\0004\000\040\000S\000u\000m\000m\000a\000r\000y\000\040\000o\000f\ 000\040\000t\000h\000e\000\040\000r\000e\000a\000c\000t\000i\000o\000n\000\040\000p\000a\000t\000h\000w\000a\000y\000, \000\040\000e\000v\000o\000l\000u\000t\000i\000o\000n\000\040\000o\000f\000\040\000p\000h\000a\000s\000e\000\040\000d \000i\000s\000t\000r\000i\000b\000u\000t\000i\000o\000n\000\040\000a\000n\000d\000\040\000r\000e\000l\000e\000v\000a\000n \000t\000\040\000e\000x\000p\000e\000r\000i\000m\000e\000n\000t\000a\000l\000\040\000e\000v\000i\000d\000e\000n\000c\000e \000\040\000o\000f\000\040\000t\000h\000e\000\040\000R\000u\000O\0002\000/\000L\000i\000\040\000b\000a\000t\000t\ 000e\000r\000y\000\040\000s\000y\000s\000t\000e\000m\000.)
эндообъект
62 0 объект
>
эндообъект
65 0 объект
(\376\377\000R\000e\000f\000e\000r\000e\000n\000c\000e\000s)
эндообъект
66 0 объект
>
эндообъект
690 объект
(\376\377\000A\000c\000k\000n\000o\000w\000l\000e\000d\000g\000e\000m\000e\000n\000t\000s)
эндообъект
70 0 объект
>
эндообъект
73 0 объект
(\376\377\000A\000u\000t\000h\000o\000r\000\040\000c\000o\000n\000t\000r\000i\000b\000u\000t\000i\000o\000n\000s)
эндообъект
74 0 объект
>
эндообъект
77 0 объект
(\376\377\000A\000d\000d\000i\000t\000i\000o\000n\000a\000l\000\040\000i\000n\000f\000o\000r\000m\000a\000t\000i\000o\ 000н)
эндообъект
78 0 объект
>
эндообъект
81 0 объект
(\376\377\000C\000o\000m\000p\000e\000t\000i\000n\000g\000\040\000f\000i\000n\000a\000n\000c\000i\000a\000l\000\040\ 000i\000n\000t\000e\000r\000e\000s\000t\000s)
эндообъект
82 0 объект
>
эндообъект
113 0 объект >
ручей
х
)
эндообъект
58 0 объект
>
эндообъект
61 0 объект
(\376\377\000F\000i\000g\000u\000r\000e\000\040\0004\000\040\000S\000u\000m\000m\000a\000r\000y\000\040\000o\000f\ 000\040\000t\000h\000e\000\040\000r\000e\000a\000c\000t\000i\000o\000n\000\040\000p\000a\000t\000h\000w\000a\000y\000, \000\040\000e\000v\000o\000l\000u\000t\000i\000o\000n\000\040\000o\000f\000\040\000p\000h\000a\000s\000e\000\040\000d \000i\000s\000t\000r\000i\000b\000u\000t\000i\000o\000n\000\040\000a\000n\000d\000\040\000r\000e\000l\000e\000v\000a\000n \000t\000\040\000e\000x\000p\000e\000r\000i\000m\000e\000n\000t\000a\000l\000\040\000e\000v\000i\000d\000e\000n\000c\000e \000\040\000o\000f\000\040\000t\000h\000e\000\040\000R\000u\000O\0002\000/\000L\000i\000\040\000b\000a\000t\000t\ 000e\000r\000y\000\040\000s\000y\000s\000t\000e\000m\000.)
эндообъект
62 0 объект
>
эндообъект
65 0 объект
(\376\377\000R\000e\000f\000e\000r\000e\000n\000c\000e\000s)
эндообъект
66 0 объект
>
эндообъект
690 объект
(\376\377\000A\000c\000k\000n\000o\000w\000l\000e\000d\000g\000e\000m\000e\000n\000t\000s)
эндообъект
70 0 объект
>
эндообъект
73 0 объект
(\376\377\000A\000u\000t\000h\000o\000r\000\040\000c\000o\000n\000t\000r\000i\000b\000u\000t\000i\000o\000n\000s)
эндообъект
74 0 объект
>
эндообъект
77 0 объект
(\376\377\000A\000d\000d\000i\000t\000i\000o\000n\000a\000l\000\040\000i\000n\000f\000o\000r\000m\000a\000t\000i\000o\ 000н)
эндообъект
78 0 объект
>
эндообъект
81 0 объект
(\376\377\000C\000o\000m\000p\000e\000t\000i\000n\000g\000\040\000f\000i\000n\000a\000n\000c\000i\000a\000l\000\040\ 000i\000n\000t\000e\000r\000e\000s\000t\000s)
эндообъект
82 0 объект
>
эндообъект
113 0 объект >
ручей
хБольшое удлинение формируемых in situ нанопроволок Li2O с помощью луча
Abstract
В качестве важного компонента интерфейса твердого электролита в литий-ионных батареях и эффективного воспроизводящего материала в термоядерном реакторе механические свойства Li 2 O представляет большой интерес, но недостаточно изучен. Здесь мы показываем, что поликристаллические нанопроволоки Li 2 O были сформированы in situ путем касания и вытягивания гидроксида лития под электронным (электронно-лучевым) освещением. Ли 2 O нанопроволоки выдержали повышенное удлинение (от 80% до 176%) при низкодозном облучении пучком электронов вблизи комнатной температуры по сравнению с удлинением (от 51% до 57%) без облучения пучком электронов. Чрезвычайно высокая деформируемость может быть объяснена быстрой диффузией Li 2 O при облучении электронным пучком и в условиях растягивающего напряжения. Большое удлинение без облучения электронным пучком означает, что наноструктурированный Li 2 O пластичен при температуре около комнатной.
Здесь мы показываем, что поликристаллические нанопроволоки Li 2 O были сформированы in situ путем касания и вытягивания гидроксида лития под электронным (электронно-лучевым) освещением. Ли 2 O нанопроволоки выдержали повышенное удлинение (от 80% до 176%) при низкодозном облучении пучком электронов вблизи комнатной температуры по сравнению с удлинением (от 51% до 57%) без облучения пучком электронов. Чрезвычайно высокая деформируемость может быть объяснена быстрой диффузией Li 2 O при облучении электронным пучком и в условиях растягивающего напряжения. Большое удлинение без облучения электронным пучком означает, что наноструктурированный Li 2 O пластичен при температуре около комнатной.
Введение
Являясь одним из простейших ионных оксидов, оксид лития (Li 2 O) является важным компонентом поверхностного слоя твердого электролита (SEI) в анодах литий-ионных аккумуляторов 1 и эффективным промотором для материалы для хранения водорода 2 . Электрические и механические свойства слоя SEI определяют производительность и срок службы литий-ионных аккумуляторов. Между тем, Li 2 O является основным продуктом анодов из литированного оксида металла 9.0232 3,4 . После литирования исходные электроды из оксида металла превратятся в частицы металла или сплава лития и металла, диспергированные в матрице Li 2 O. Таким образом, механические свойства Li 2 O имеют решающее значение для целостности электродов и будут влиять на возможность повторного использования литий-ионных аккумуляторов.
Электрические и механические свойства слоя SEI определяют производительность и срок службы литий-ионных аккумуляторов. Между тем, Li 2 O является основным продуктом анодов из литированного оксида металла 9.0232 3,4 . После литирования исходные электроды из оксида металла превратятся в частицы металла или сплава лития и металла, диспергированные в матрице Li 2 O. Таким образом, механические свойства Li 2 O имеют решающее значение для целостности электродов и будут влиять на возможность повторного использования литий-ионных аккумуляторов.
Еще более привлекательным является то, что его высокая температура плавления (1711 K) и свойства воспроизводства трития сделали Li 2 O востребованным материалом воспроизводства бланкета в термоядерном реакторе 5 , служащий возможным будущим энергетическим ресурсом для людей. Тем не менее, безопасное использование ядерной энергии поставило перед инженерами задачу разработки соответствующих материалов, работающих в радиационной среде, где было обнаружено, что механическое поведение отличается от аналога без излучения. Например, Кинер и др. указали, что на предел текучести облученных нейтронами медных наностолбиков влияет взаимодействие дислокаций с дефектами, вызванными облучением 6 . В этом свете важное значение имеет фундаментальное понимание механических свойств Li 2 O с высокоэнергетическим излучением и без него.
Например, Кинер и др. указали, что на предел текучести облученных нейтронами медных наностолбиков влияет взаимодействие дислокаций с дефектами, вызванными облучением 6 . В этом свете важное значение имеет фундаментальное понимание механических свойств Li 2 O с высокоэнергетическим излучением и без него.
Кроме того, перспектива уменьшения критических размеров элементов современных электронных и механических устройств способствовала обширным исследованиям наноразмерных материалов. Поскольку размер образца уменьшается до нанометрового диапазона, механическое поведение может сильно отличаться от поведения объемного аналога. Например, недавняя работа показала, что кремний 7 и германиевые 8 нанопроволоки (ННК) действительно пластичны, в то время как их объемные аналоги обычно хрупкие. Что касается наноразмерных оксидов, было показано, что электронный луч (e-beam) является полезным инструментом для эффективной настройки механических свойств. В частности, пластичность ННК SiO 2 может быть значительно повышена за счет облучения электронным пучком низкой интенсивности 9 . Кроме того, облучение электронным пучком может увеличить модуль Юнга ННК оксида цинка-олова 10 . Тем не менее механический отклик наноструктурированного Li 2 O, который имел бы значение для разработки наноэлектролитов и наноэлектродов для литий-ионных аккумуляторов 11 , редко обсуждался. В этом письме мы сообщаем о простом подходе к изготовлению свежих поликристаллических ННК Li 2 O внутри просвечивающего электронного микроскопа. Соответствующее механическое поведение с облучением электронным пучком и без него было исследовано при комнатной температуре.
В частности, пластичность ННК SiO 2 может быть значительно повышена за счет облучения электронным пучком низкой интенсивности 9 . Кроме того, облучение электронным пучком может увеличить модуль Юнга ННК оксида цинка-олова 10 . Тем не менее механический отклик наноструктурированного Li 2 O, который имел бы значение для разработки наноэлектролитов и наноэлектродов для литий-ионных аккумуляторов 11 , редко обсуждался. В этом письме мы сообщаем о простом подходе к изготовлению свежих поликристаллических ННК Li 2 O внутри просвечивающего электронного микроскопа. Соответствующее механическое поведение с облучением электронным пучком и без него было исследовано при комнатной температуре.
Результаты
Мы обнаружили, что наноструктуры Li 2 O могут быть синтезированы облучением гидроксида лития (LiOH) электронным пучком, что подтверждает предыдущие экспериментальные результаты 12 . Поликристаллические ННК Li 2 O были успешно изготовлены путем касания поверхности LiOH с последующим вытягиванием золотым наконечником (рис. 1а). ННК были изготовлены в результате диффузии Li 2 O от подложки к золотому наконечнику под действием электронного пучка. Выбранные картины дифракции электронов (SAED) показывают, что подложка представляет собой поликристаллическую фазу LiOH (JCPDS 76-09).11, тетрагональный, a = 0,355 нм, c = 0,433 нм) (рис. 1b), а выделенный NW — Li 2 O (JCPDS 77-2144, кубический, a = 0,462 нм) (рис. 1c, см. также рис. С1). На рисунке 1d показаны спектры спектроскопии потерь энергии электронов (EELS) края Li-K и края O-K в LiOH (красная кривая) и Li 2 O (черная кривая). В LiOH краевые пики Li-K повышаются при 58,2, 62,7 и 75 эВ, а краевые пики O-K повышаются при 529,4 и 535,1 эВ; в то время как в Li 2 O краевые пики Li-K появляются при 58,2 и 62,7 эВ, а краевые пики O-K появляются при 526,1, 532,4 и 545,9 эВ.
Поликристаллические ННК Li 2 O были успешно изготовлены путем касания поверхности LiOH с последующим вытягиванием золотым наконечником (рис. 1а). ННК были изготовлены в результате диффузии Li 2 O от подложки к золотому наконечнику под действием электронного пучка. Выбранные картины дифракции электронов (SAED) показывают, что подложка представляет собой поликристаллическую фазу LiOH (JCPDS 76-09).11, тетрагональный, a = 0,355 нм, c = 0,433 нм) (рис. 1b), а выделенный NW — Li 2 O (JCPDS 77-2144, кубический, a = 0,462 нм) (рис. 1c, см. также рис. С1). На рисунке 1d показаны спектры спектроскопии потерь энергии электронов (EELS) края Li-K и края O-K в LiOH (красная кривая) и Li 2 O (черная кривая). В LiOH краевые пики Li-K повышаются при 58,2, 62,7 и 75 эВ, а краевые пики O-K повышаются при 529,4 и 535,1 эВ; в то время как в Li 2 O краевые пики Li-K появляются при 58,2 и 62,7 эВ, а краевые пики O-K появляются при 526,1, 532,4 и 545,9 эВ. эВ. Различная тонкая структура краев Li и O-K указывает на различное электронное окружение в LiOH и Li 2 O 13 . Впоследствии мы провели испытания на растяжение на месте отдельных СНК, при этом весь процесс деформации напрямую записывался с помощью потокового видео.
эВ. Различная тонкая структура краев Li и O-K указывает на различное электронное окружение в LiOH и Li 2 O 13 . Впоследствии мы провели испытания на растяжение на месте отдельных СНК, при этом весь процесс деформации напрямую записывался с помощью потокового видео.
In situ приготовление свежего Li 2 O NW из субстрата LiOH.
(a) ПЭМ-изображение экспериментальной установки, показывающее изготовление Li 2 O СЗ под электронно-лучевым облучением. Картины SAED, показывающие преобладающие фазы субстрата и экстрагированного ННК, являются поликристаллическими (b) LiOH и (c) Li 2 O соответственно. Дифракционное кольцо {200} с чрезвычайно низкой интенсивностью не видно на картине SAED. ( d ) Спектры EELS края Li-K и края O-K в LiOH (красная кривая) и Li 2 O (черная кривая) с вычетом фона перед краем.
Изображение полного размера
Во время испытаний на растяжение мы намеренно уменьшили плотность тока пучка, чтобы подавить массоперенос от подложки к корню СНК. На рисунках 2a-2e показано типичное испытание Li 9 на растяжение.0020 2 O NW (см. Дополнительные фильмы S1 – S2 онлайн) с плотностью тока 1,83 × 10 −3 A/см 2 . Начальная длина НЗ оценивалась в 5010 нм, как показано на рис. 2а. Когда мы тянули, сегмент между двумя надрезами на поверхности (указанный стрелками на рис. 2b–2e), который имеет постоянный диаметр около 323 нм, значительно удлинился, пока длина СЗ не достигла 13816 нм (рис. 2e). наконец-то сформировался, не ломаясь! Из-за ограниченного радиуса действия манипулятора мы не могли тянуть СЗ дальше. Следовательно, удлинение ~176% является нижней границей. Кроме того, процесс образования шейки, который уменьшил диаметр с исходных 323 нм (рис. 2b) до 190 нм (рис. 2д) визуализировался непосредственно. Сильный дифракционный контраст, который быстро возникал и исчезал, часто наблюдался в процессе образования шейки (указанный стрелками на рис. 2в и 2г), свидетельствующий о массивной дислокационной активности при растяжении НЗ.
На рисунках 2a-2e показано типичное испытание Li 9 на растяжение.0020 2 O NW (см. Дополнительные фильмы S1 – S2 онлайн) с плотностью тока 1,83 × 10 −3 A/см 2 . Начальная длина НЗ оценивалась в 5010 нм, как показано на рис. 2а. Когда мы тянули, сегмент между двумя надрезами на поверхности (указанный стрелками на рис. 2b–2e), который имеет постоянный диаметр около 323 нм, значительно удлинился, пока длина СЗ не достигла 13816 нм (рис. 2e). наконец-то сформировался, не ломаясь! Из-за ограниченного радиуса действия манипулятора мы не могли тянуть СЗ дальше. Следовательно, удлинение ~176% является нижней границей. Кроме того, процесс образования шейки, который уменьшил диаметр с исходных 323 нм (рис. 2b) до 190 нм (рис. 2д) визуализировался непосредственно. Сильный дифракционный контраст, который быстро возникал и исчезал, часто наблюдался в процессе образования шейки (указанный стрелками на рис. 2в и 2г), свидетельствующий о массивной дислокационной активности при растяжении НЗ. В наноструктурных материалах границы зерен (ГЗ) и свободная поверхность могут служить местом зарождения, а также местом аннигиляции дислокаций, как показано как теоретическими 14 , так и экспериментальными работами 15,16 . Между тем, Фигуры. На S2–S4 показаны еще три примера, свидетельствующие о большом удлинении ННК Li 2 O при облучении электронным пучком со скоростью деформации 4,1×10 −3 , 4,3×10 −3 и 1,4×10 − 3 с −1 соответственно. Общее удлинение составляет ~ 80% (рис. S2), ~ 105% (рис. S3) и ~ 110% (рис. S4) соответственно. Во время этих испытаний мы намеренно уменьшили плотность тока до порядка 10 −4 А/см 2 , что еще больше подавляло процесс атомной диффузии и, таким образом, приводило к меньшему удлинению по сравнению с указанным на рис. 2 (176%). разрушение СЗ (рис. S2–S4).
В наноструктурных материалах границы зерен (ГЗ) и свободная поверхность могут служить местом зарождения, а также местом аннигиляции дислокаций, как показано как теоретическими 14 , так и экспериментальными работами 15,16 . Между тем, Фигуры. На S2–S4 показаны еще три примера, свидетельствующие о большом удлинении ННК Li 2 O при облучении электронным пучком со скоростью деформации 4,1×10 −3 , 4,3×10 −3 и 1,4×10 − 3 с −1 соответственно. Общее удлинение составляет ~ 80% (рис. S2), ~ 105% (рис. S3) и ~ 110% (рис. S4) соответственно. Во время этих испытаний мы намеренно уменьшили плотность тока до порядка 10 −4 А/см 2 , что еще больше подавляло процесс атомной диффузии и, таким образом, приводило к меньшему удлинению по сравнению с указанным на рис. 2 (176%). разрушение СЗ (рис. S2–S4).
Сверхудлинение a Li 2 O NW под облучением электронным пучком.
(a–e) Последовательные ПЭМ-изображения, показывающие удлинение Li 2 O NW при одноосной растягивающей нагрузке со скоростью деформации 4,1×10 −3 с −1 . Промежуток времени от (а) до (д) составляет 0, 279, 494, 829 и 1232 с соответственно. Стрелки указывают на надрезы на поверхности, а стрелки отмечают дифракционный контраст, вызванный дислокационной активностью.
Изображение в натуральную величину
Чтобы проиллюстрировать влияние облучения электронным пучком на характер деформации, после формирования ННК Li 2 O с одинаковым диаметром мы заглушили пучок (рис. 3а), а затем вытянули НВ, делать снимки, периодически включая луч примерно на 1 секунду каждые 3 минуты. Было получено полное удлинение ~51% (рис. 3б–3в). Следует отметить, что диффузия Li 2 O от подложки к СЗ был пренебрежимо мал без облучения пучком, о чем свидетельствует достаточно стабильная реперная точка, отмеченная стрелками (рис. 3а–3в). Другое испытание на растяжение, показывающее удлинение ~57% в Li 2 O NW без облучения электронным пучком, показано на рис. S5.
Другое испытание на растяжение, показывающее удлинение ~57% в Li 2 O NW без облучения электронным пучком, показано на рис. S5.
Ограниченное удлинение Li 2 O СЗ с закрытым электронным лучом.
(a–c) ПЭМ-изображения, демонстрирующие ограниченное удлинение Li 2 O NW с гашением электронного луча во время растягивающей нагрузки со скоростью деформации 4,7×10 −4 с −1 . Промежуток времени от (а) до (с) составляет 0, 540 и 1080 с соответственно. Стрелки указывают на ступени поверхности, служащие опорными точками.
Изображение полного размера
Обсуждение
Хорошо видно, что облучение электронным пучком может эффективно увеличить удлинение поликристаллических ННК Li 2 O. Без облучения электронным пучком пластичность ННК могла бы быть обусловлена зарождением и последующей аннигиляцией дислокаций на ГЗ и свободных поверхностях. При электронно-лучевом облучении, помимо активности дислокаций, пластичности может способствовать быстрая диффузия атомов, чему способствуют динамические смещения составляющих атомов 17 . Основная идея состоит в том, что входящие электроны могут отклоняться кулоновским полем каждого атомного ядра. Энергия, передаваемая от налетающего электрона атомному ядру, определяется выражением 18 :
При электронно-лучевом облучении, помимо активности дислокаций, пластичности может способствовать быстрая диффузия атомов, чему способствуют динамические смещения составляющих атомов 17 . Основная идея состоит в том, что входящие электроны могут отклоняться кулоновским полем каждого атомного ядра. Энергия, передаваемая от налетающего электрона атомному ядру, определяется выражением 18 :
, где θ — угол отклонения электрона в поле атомного ядра, E max — максимальная энергия, которая может E 0 — энергия налетающего электрона (в эВ), а A — атомный массовый номер. Как только переданная энергия превышает энергию, необходимую для смещения составляющих атомов, может произойти смещение атомов. В данном случае максимальная энергия, передаваемая от электронного пучка 100 кэВ литию и кислороду, составляет 80 и 15 эВ соответственно. Поскольку литий и кислород являются легкими элементами, считается, что такие высокие энергии способны вызывать смещение атомов и, следовательно, массоперенос.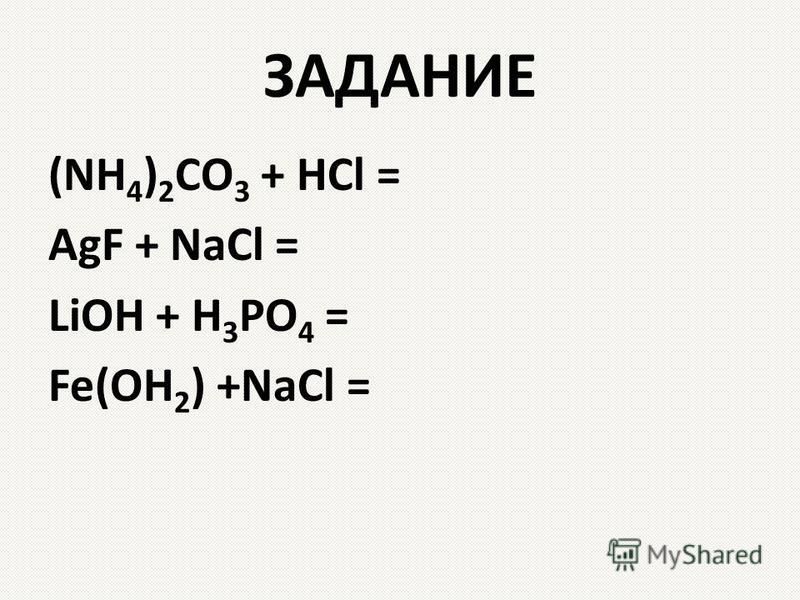 Именно по этому механизму были изготовлены свежие ННК (диффузия Li 2 O от подложки до золотого наконечника). Быстрая диффузия способствовала уничтожению дефектов, таких как трещины, зародившиеся во время механического нагружения, и, таким образом, способствовала пластичности.
Именно по этому механизму были изготовлены свежие ННК (диффузия Li 2 O от подложки до золотого наконечника). Быстрая диффузия способствовала уничтожению дефектов, таких как трещины, зародившиеся во время механического нагружения, и, таким образом, способствовала пластичности.
В то же время плотность тока, применяемого для получения изображений ПЭМ, варьировалась от 3,2×10 -4 до 0,1 А/см 2 , что на несколько порядков ниже, чем те, которые использовались ранее в области наноинженерии 19 . Кроме того, золотой наконечник представляет собой материал с высокой теплопроводностью (300 Вт/мК) и поэтому способен быстро отводить тепло. Максимальный подъем температуры в Li 9Таким образом, ожидается, что 0020 2 O NWs будет меньше 10 K 18 (подробную информацию см. в методах). По сравнению с его высокой температурой плавления (1711 K) такое небольшое повышение температуры мало повлияло бы на его механическое поведение. Кроме того, ожидается, что деформация ползучести, которая может стать заметной при высокой температуре 20 , не будет доминирующей во время текущих испытаний на растяжение.
Следует отметить, что в предыдущих работах 21,22 было продемонстрировано образование коллоидов металлического лития в Li 2 Кристалл O, облученный электронным пучком с энергией 1 МэВ. Чтобы прояснить возможное влияние электронного луча на структуру Li 2 O NW, мы записали in situ паттернов SAED одиночного NW при длительном облучении электронным пучком (см. Дополнительный фильм S3 онлайн). Картины могут быть последовательно проиндексированы на основе чистой поликристаллической фазы Li 2 O (рис. S1), как показано на рис. 1c, подразумевая, что коллоиды Li не были созданы при облучении электронным пучком низкой энергии (т. Е. 100 кэВ) .
Таким образом, было обнаружено, что облучение электронным пучком значительно повышает пластичность поликристаллических ННК Li 2 O во время растягивающей нагрузки, что можно хорошо понять по быстрой диффузии, вызванной облучением электронным пучком при растягивающем напряжении. . Большое удлинение (51% и 57%) без облучения электронным пучком указывает на то, что ННК Li 2 O пластичны и могут выдерживать большие механические напряжения, а это означает, что наноаноды из литированного оксида металла в литий-ионном аккумуляторе могут не легко ломается при езде на велосипеде. Наши результаты имеют важное значение для применения Li 2 O наноструктур в ядерной среде и иллюстрирует, что облучение электронным пучком может быть выдающимся подходом в области наноинженерии посредством адаптации механических свойств материалов.
. Большое удлинение (51% и 57%) без облучения электронным пучком указывает на то, что ННК Li 2 O пластичны и могут выдерживать большие механические напряжения, а это означает, что наноаноды из литированного оксида металла в литий-ионном аккумуляторе могут не легко ломается при езде на велосипеде. Наши результаты имеют важное значение для применения Li 2 O наноструктур в ядерной среде и иллюстрирует, что облучение электронным пучком может быть выдающимся подходом в области наноинженерии посредством адаптации механических свойств материалов.
Методы
Эксперименты проводились в просвечивающем электронном микроскопе FEI Tecnai F30 с полевой эмиссией, работающем при 100 кВ, с платформой Nanofactory TEM – сканирующая туннельная микроскопия (СТМ) 16 . Кристаллы LiOH были прикреплены к золотому стержню с помощью электропроводящего клея на основе эпоксидной смолы, наполненного серебром, CW2400 Circuit Works от ITW Chemtronics. Впоследствии золотой стержень был вставлен в один конец платформы TEM-STM. Чтобы успешно приготовить свежий Li 2 O NW внутри TEM мы сначала выровняли золотой наконечник, чтобы он касался подложки LiOH. Затем область контакта облучали электронным пучком с размерами от 200 до 1000 нм (соответствующая плотность тока составляет от 0,5 до 12 А/см 2 ) для формирования кристаллов Li 2 O в подложке. Время облучения зависит от силы тока. Чем выше сила тока, тем меньше времени требуется для зарождения фазы Li 2 O. Обычно при плотности тока 12 А/см 2 , Li 2 O будет сформирован после 10-секундного облучения электронным пучком. При небольшом прижатии наконечника СТМ к подложке часть кристаллов Li 2 O прикрепилась к наконечнику СТМ. Наконец, наконечник был отведен назад, чтобы сформировать Li 2 O NW, который подвергся дальнейшей растягивающей нагрузке (рис. 1а).
Чтобы успешно приготовить свежий Li 2 O NW внутри TEM мы сначала выровняли золотой наконечник, чтобы он касался подложки LiOH. Затем область контакта облучали электронным пучком с размерами от 200 до 1000 нм (соответствующая плотность тока составляет от 0,5 до 12 А/см 2 ) для формирования кристаллов Li 2 O в подложке. Время облучения зависит от силы тока. Чем выше сила тока, тем меньше времени требуется для зарождения фазы Li 2 O. Обычно при плотности тока 12 А/см 2 , Li 2 O будет сформирован после 10-секундного облучения электронным пучком. При небольшом прижатии наконечника СТМ к подложке часть кристаллов Li 2 O прикрепилась к наконечнику СТМ. Наконец, наконечник был отведен назад, чтобы сформировать Li 2 O NW, который подвергся дальнейшей растягивающей нагрузке (рис. 1а).
Повышение температуры при облучении можно рассчитать по модели Фишера 23 :
где I – ток пучка, κ – коэффициент теплопроводности, e — заряд электрона (1,6×10 −19 Кл), b — радиус образца, r 0 — радиус пучка и ΔE — полная потеря энергии на электрон в образец толщиной d . Поскольку потери энергии в образце малы по сравнению с начальной энергией, равной 100 кэВ, член ΔE/d равен тормозной способности для электронов dE/dx , которую можно рассчитать из уравнения Бете-Блоха 24 :
Поскольку потери энергии в образце малы по сравнению с начальной энергией, равной 100 кэВ, член ΔE/d равен тормозной способности для электронов dE/dx , которую можно рассчитать из уравнения Бете-Блоха 24 :
где Z — атомный номер целевого элемента, ρ — атомная плотность, ε 0 — диэлектрическая проницаемость (8,85×10 −12 4/м2), 0 — масса покоя электрона (9,3×10 −31 кг), υ — скорость электрона, c — скорость света (3×10 8 м/с), E — энергия электрона , I e — средняя энергия возбуждения электронов в мишени и β = υ/c .
В настоящее время ускоряющее напряжение составляет 100 кВ, таким образом, β = 0,548 и υ = 1,64×10 8 м/с. Для Li 2 O, ρ = 4,04×10 28 м −3 (массовая плотность 2013 кг/м 3 ), температура плавления 1711 K 25 27 κ 2 . Максимальное повышение температуры оценивается примерно в 1 К при I = 3,7 нА, b = 1,5 мм, r 0 = 4 мкм.
Максимальное повышение температуры оценивается примерно в 1 К при I = 3,7 нА, b = 1,5 мм, r 0 = 4 мкм.
Ссылки
Liu, X.H. et al. Анизотропное набухание и разрушение кремниевых нанопроволок при литировании. Нано Летт. 11, 3312–3318 (2011).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Hu, Y.H. & Ruckenstein, E. Высокоэффективный Li2O/Li3N со сверхбыстрой кинетикой для хранения h3. Инд.Инж. хим. Рез. 43, 2464–2467 (2004).
КАС Статья Google ученый
Huang, J.Y. et al. Наблюдение in situ за электрохимическим литированием одиночного электрода из нанопроволоки SnO2. Наука 330, 1515–1520 (2010).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Этачери В., Маром Р., Элазари Р.
 , Салитра Г. и Аурбах Д. Проблемы разработки передовых литий-ионных аккумуляторов: обзор. Энергетическая среда. науч. 4, 3243 (2011).
, Салитра Г. и Аурбах Д. Проблемы разработки передовых литий-ионных аккумуляторов: обзор. Энергетическая среда. науч. 4, 3243 (2011).КАС Статья Google ученый
Mattas, R. F. & Billone, M. C. Материалы для племенных одеял. Дж. Нукл. Матер. 233–237, 72–81 (1996).
ОБЪЯВЛЕНИЕ Статья Google ученый
Кинер, Д., Хосеманн, П., Малой, С. А. и Минор, А. М. Испытания на нанокомпрессии облученной меди in situ. Nature Mater 10, 608–613 (2011).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Ван, Л., Чжэн, К., Чжан, З. и Хан, X. Прямая визуализация в атомном масштабе о механизмах сверхбольшого изгиба в нанопроволоках кремния. Nano Lett 11, 2382–2385 (2011).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Смит, Д. А., Холмберг, В.
 К. и Коргель, Б. А. Гибкие германиевые нанопровода: идеальная прочность, пластичность при комнатной температуре и сгибаемая полупроводниковая ткань. ACS Nano 4, 2356–2362 (2010).
К. и Коргель, Б. А. Гибкие германиевые нанопровода: идеальная прочность, пластичность при комнатной температуре и сгибаемая полупроводниковая ткань. ACS Nano 4, 2356–2362 (2010).КАС Статья Google ученый
Zheng, K. et al. Электронно-лучевое сверхпластическое формование наноразмерного аморфного кремнезема. Нац. коммун. 1, 1–8 (2010).
КАС ПабМед Центральный Google ученый
Занг, Дж., Бао, Л., Уэбб, Р. А. и Ли, X. Электронно-лучевое облучение укрепляет нанопроволоки из оксида цинка и олова. Nano Lett 11, 4885–4889 (2011).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Арико А.С., Брюс П., Скросати Б., Тараскон Ж.-М. и ван Шалквейк, В. Наноструктурные материалы для передовых устройств преобразования и хранения энергии. Nature Mater 4, 366–377 (2005).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Hu, Y.
 & Ruckenstein, E. Наноструктурированный Li2O из LiOH с помощью электронного облучения. хим. физ. лат. 430, 80–83 (2006).
& Ruckenstein, E. Наноструктурированный Li2O из LiOH с помощью электронного облучения. хим. физ. лат. 430, 80–83 (2006).ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Ван, Ф. и др. Химическое распределение и связывание лития в интеркалированном графите: идентификация с помощью оптимизированной спектроскопии потерь энергии электронов. ACS Nano 5, 1190–1197 (2011).
КАС Статья Google ученый
Ямаков В., Вольф Д., Салазар М., Филпот С. Р. и Гляйтер Х. Эффекты масштаба длины при зарождении протяженных дислокаций в нанокристаллическом алюминии с помощью молекулярно-динамического моделирования. Acta Mater. 49, 2713–2722 (2001).
КАС Статья Google ученый
Шан, З. и др. Динамика дислокаций в нанокристаллическом никеле. физ. Преподобный Летт. 98, 095502 (2007).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Zheng, H.
 et al. Дискретная пластичность в кристаллах золота размером менее 10 нм. Нац. коммун. 1, 144 (2010).
et al. Дискретная пластичность в кристаллах золота размером менее 10 нм. Нац. коммун. 1, 144 (2010).ОБЪЯВЛЕНИЕ Статья Google ученый
Мур, Н.В., Луо, Дж., Хуанг, Дж.Ю., Мао, С.С. и Хьюстон, Дж.Э. Сверхпластичные нанопроволоки, извлеченные из поверхности поваренной соли. Нано Летт. 9, 2295–2299 (2009).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Эгертон, Р. Радиационные повреждения в ПЭМ и РЭМ. Микрон 35, 399–409 (2004).
КАС Статья Google ученый
Сюй, С. и др. Модификация в нанометровом масштабе и сварка кремниевых и металлических нанопроволок высокоинтенсивным электронным пучком. Малый 1, 1221–1229 (2005).
КАС Статья Google ученый
Йошида Х., Икухара Ю. и Сакума Т. Сопротивление ползучести при высоких температурах в мелкозернистом Al2O3, легированном редкоземельными элементами.
 Дж. Матер. Рез. 13, 2597–2601 (1998).
Дж. Матер. Рез. 13, 2597–2601 (1998).ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Вайда, П. и Бенеу, Ф. Повреждение электронным излучением и создание литий-коллоида в Li2O. физ. Rev. B 53, 5335 (1996).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Прем, М., Крекснер, Г., Бенеу, Ф. и Вайда, П. Металлические коллоиды в оксиде лития после электронного облучения. Physica B 350, E999–E1002 (2004).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Фишер, С. Б. О повышении температуры в фольге, облученной электронами. Радиат. Эфф. Дефекты Твердые тела 5, 239 (1970).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Дженчич, И., Бенч, М.В., Робертсон, И.М. и Кирк, М.А. Электронно-лучевая кристаллизация изолированных аморфных областей в Si, Ge, GaP и GaAs.
 Дж. Заявл. физ. 78, 974–982 (1995).
Дж. Заявл. физ. 78, 974–982 (1995).ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Ортман М.С. и Ларсен Э.М. Получение, характеристика и температура плавления высокочистого оксида лития. Варенье. Керам. соц. 66, 645–648 (1983).
КАС Статья Google ученый
Абу-Сена, А., Йинг, А. и Абдоу, М. Эффективная теплопроводность литий-керамических камешков для одеял Fusion: обзор. Фьюжн наук. Технол. 47, 1094–1100 (2005).
КАС Статья Google ученый
Ссылки на скачивание
Благодарности
J.W. хотел бы поблагодарить за финансовую поддержку программы 973 (2011CB933300), Национального фонда естественных наук Китая (51071110, 40972044, J0830310), программы Министерства образования Китая NCET (NCET-07-0640), Фонда докторантуры Министерства образования (200
110059) и Фонда фундаментальных исследований. Фонды центральных университетов. С.М. хотел бы отметить NSF CMMI 08 010934 через Университет Питтсбурга и Национальную лабораторию Sandia. Эта работа была выполнена частично в Центре интегрированных нанотехнологий, пользовательском объекте Управления фундаментальных энергетических наук Министерства энергетики США. Sandia National Laboratories — многопрофильная лаборатория, управляемая корпорацией Sandia, входящей в состав компании Lockheed-Martin, для Министерства энергетики США по контракту № DE-AC04-9.4АЛ85000. Х.З. хотел бы поблагодарить Китайский стипендиальный совет за финансовую поддержку.
Фонды центральных университетов. С.М. хотел бы отметить NSF CMMI 08 010934 через Университет Питтсбурга и Национальную лабораторию Sandia. Эта работа была выполнена частично в Центре интегрированных нанотехнологий, пользовательском объекте Управления фундаментальных энергетических наук Министерства энергетики США. Sandia National Laboratories — многопрофильная лаборатория, управляемая корпорацией Sandia, входящей в состав компании Lockheed-Martin, для Министерства энергетики США по контракту № DE-AC04-9.4АЛ85000. Х.З. хотел бы поблагодарить Китайский стипендиальный совет за финансовую поддержку.
Информация об авторе
Авторы и организации
Школа физики и технологий, Центр электронной микроскопии и Ключевая лаборатория искусственных микро- и наноструктур МЧС, Уханьский университет, Ухань, 430072, Китай
He Zheng & Jianbo Wang
Центр интегрированных нанотехнологий, Sandia National Laboratories, Альбукерке, Нью-Мексико, 87185, США
Yang Liu & Jian Yu Huang
Department of Mechanical Engineering & Materials Science, University of Pittsburgh, Pittsburgh, Pennsylvania, 15261, USA
He Zheng & Scott X.
 Mao
Mao
Authors
- He Zheng
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Yang Liu
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Scott X. Mao
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jianbo Wang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jian Yu Huang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Взносы
Х.З. провел эксперименты с ТЕМ и написал статью. Х.З., Ю.Л. и С.М. участвовал в анализе данных. Д.И.Х. и Дж.В. пересмотрел бумагу. Проект был разработан J. W. и Дж.Ю.Х.
W. и Дж.Ю.Х.
Декларация этики
Конкурирующие интересы
Авторы не заявляют о конкурирующих финансовых интересах.
Дополнительные электронные материалы
Дополнительная информация
Фильм 1
Дополнительная информация
Фильм 2
Дополнительная информация
Фильм 3
Дополнительная информация
Дополнительный материал
Права и разрешения Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by-nc-nd/3.0/
Перепечатки и разрешения
Об этой статье
Дополнительная литература
Гибкая сварка нанопроволок SiOx с макропористой углеродной пленкой и новые идеи
- Цзянбин Су
- Чживэй Ван
- Сяньфан Чжу
SN Прикладные науки (2021)
Осаждение и зачистка металлического лития в твердотельной батарее с помощью ползучести Кобла
- Юминг Чен
- Цзыцян Ван
- Джу Ли
Природа (2020)
In situ исследование механических свойств переносимых по воздуху частиц дымки
- Мин Шуай Дин
- Вэйчжун Хань
- ЧжиВэй Шань
Наука Китай Технологические науки (2015)
Неупругость сдвоенных нанопроволок CuO
- Хуапин Шэн
- Хэ Чжэн
- Цзяньбо Ван
Исследования в области нанотехнологий (2015)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Кинетическое измерение и прогноз выделения водорода из поликристаллической системы LiH/Li2O/LiOH
Показаны 1-4 из
33 страницы в этой статье.
PDF-версия также доступна для скачивания.
Описание
Из-за экзотермической реакции соли гидрида лития (LiH) с водой во время транспортировки и обработки на поверхности LiH всегда присутствует тонкая пленка гидроксида лития (LiOH). В сухом или вакуумном хранилище эта тонкая пленка LiOH медленно разлагается. Мы использовали температурно-программируемую реакцию/разложение (TPR) в сочетании с изоконверсионным методом термического анализа, чтобы определить кинетику выделения H{sub 2}O из чистого LiOH и H{sub 2} и H{sub 2}O из это тонкая пленка LiOH. Производство H{sub 2} в результате реакции LiH с LiOH, образующей промежуточный слой оксида лития (Li{sub 2}O), является термодинамически выгодным, с … продолжение ниже
Физическое описание
PDF-файл: 33 страницы; размер: 4,1 Мбайт
Информация о создании
Дин, Л. Н.; Грант, Д.М.; Шильдбах, Массачусетс; Смит, Р.А.; Зикхаус, WJ; Балаш, Б. и соавт.
6 апреля 2005 г.
Н.; Грант, Д.М.; Шильдбах, Массачусетс; Смит, Р.А.; Зикхаус, WJ; Балаш, Б. и соавт.
6 апреля 2005 г.
Контекст
Этот артикул входит в состав сборника под названием:
Управление научно-технической информации Технические отчеты
а также
предоставлено отделом государственных документов библиотек ЕНТ
к
Электронная библиотека ЕНТ,
цифровой репозиторий, размещенный на
Библиотеки ЕНТ.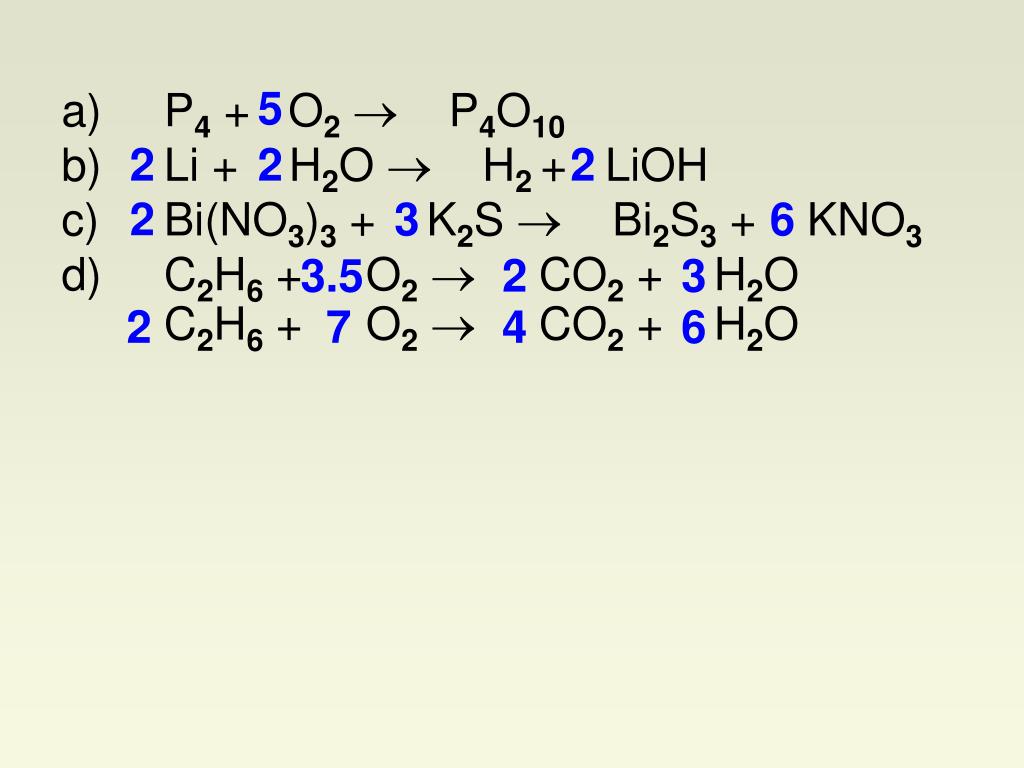 Его просмотрели 114 раз.
Более подробную информацию об этой статье можно посмотреть ниже.
Его просмотрели 114 раз.
Более подробную информацию об этой статье можно посмотреть ниже.
Поиск
Открытый доступ
Кто
Люди и организации, связанные либо с созданием этой статьи, либо с ее содержанием.
Авторы
- Дин, Л.
 Н.
Н. - Грант, Д. М.
- Шильдбах, М. А.
- Смит, Р.А.
- Зикхаус, В.
 Дж.
Дж. - Балаш, Б.
- Леки, Дж. Х.
- Киркпатрик, Дж.
- Маклин II, В.

- Соединенные Штаты. Министерство энергетики.
Издатель
- Ливерморская национальная лаборатория Лоуренса
Информация об издателе: Ливерморская национальная лаборатория Лоуренса (LLNL), Ливермор, Калифорния
Место публикации: Ливермор, Калифорния
Предоставлено
Библиотеки ЕНТ Отдел государственных документов
Являясь одновременно федеральной и государственной депозитарной библиотекой, отдел государственных документов библиотек ЕНТ хранит миллионы единиц хранения в различных форматах. Департамент является членом Программы партнерства по контенту FDLP и Аффилированного архива Национального архива.
Департамент является членом Программы партнерства по контенту FDLP и Аффилированного архива Национального архива.
О | Просмотрите этого партнера
Свяжитесь с нами
Исправления и проблемы Вопросы
какая
Описательная информация, помогающая идентифицировать эту статью. Перейдите по ссылкам ниже, чтобы найти похожие элементы в электронной библиотеке.
Описание
Из-за экзотермической реакции соли гидрида лития (LiH) с водой во время транспортировки и обработки на поверхности LiH всегда присутствует тонкая пленка гидроксида лития (LiOH). В сухом или вакуумном хранилище эта тонкая пленка LiOH медленно разлагается. Мы использовали температурно-программируемую реакцию/разложение (TPR) в сочетании с изоконверсионным методом термического анализа, чтобы определить кинетику выделения H{sub 2}O из чистого LiOH и H{sub 2} и H{sub 2}O из это тонкая пленка LiOH. Производство H{sub 2} в результате реакции LiH с LiOH, образующей прослойку оксида лития (Li{sub 2}O), является термодинамически выгодным, при этом скорость дальнейшей реакции ограничивается диффузией через Li{sub 2}O и стабильность разлагающегося LiOH. Гидроксид лития на границе раздела LiOH/вакуум также легко разлагается до Li{sub 2}O, высвобождая H{sub 2}O, который впоследствии реагирует с LiH в закрытой системе с образованием H{sub 2}. В начале сухого разложения, где H{sub 2} является преобладающим продуктом, энергия активации выделения газа из тонкой пленки LiOH ниже, чем для объемного LiOH. Однако по мере протекания реакций на границах раздела LiH/Li{sub 2}O/LiOH и на границах раздела LiOH/вакуум общий энергетический барьер активации для дегазации приближается к барьеру разложения объемного LiOH. Разработанная здесь кинетика предсказывает профиль выделения водорода, хорошо согласующийся с выделением водорода, наблюдаемым при длительном изотермическом хранении.
Производство H{sub 2} в результате реакции LiH с LiOH, образующей прослойку оксида лития (Li{sub 2}O), является термодинамически выгодным, при этом скорость дальнейшей реакции ограничивается диффузией через Li{sub 2}O и стабильность разлагающегося LiOH. Гидроксид лития на границе раздела LiOH/вакуум также легко разлагается до Li{sub 2}O, высвобождая H{sub 2}O, который впоследствии реагирует с LiH в закрытой системе с образованием H{sub 2}. В начале сухого разложения, где H{sub 2} является преобладающим продуктом, энергия активации выделения газа из тонкой пленки LiOH ниже, чем для объемного LiOH. Однако по мере протекания реакций на границах раздела LiH/Li{sub 2}O/LiOH и на границах раздела LiOH/вакуум общий энергетический барьер активации для дегазации приближается к барьеру разложения объемного LiOH. Разработанная здесь кинетика предсказывает профиль выделения водорода, хорошо согласующийся с выделением водорода, наблюдаемым при длительном изотермическом хранении.
Физическое описание
PDF-файл: 33 страницы; размер: 4,1 Мбайт
Предметы
Ключевые слова
- Энергия активации
- Дегазация
- Распространение
- Прогнозирование
- Водород
- Кинетика
- Гидриды лития
- Гидроксиды лития
- Оксиды лития
- Производство
- Стабильность
- Хранилище
- Термический анализ
- Тонкие пленки
- Вода
Тематические категории ИППП
- 08 Водород
- 36 Материаловедение
Источник
- Название журнала: Журнал ядерных материалов; Объем журнала: 347
Язык
- Английский
Тип вещи
- Статья
Идентификатор
Уникальные идентификационные номера для этой статьи в электронной библиотеке или других системах.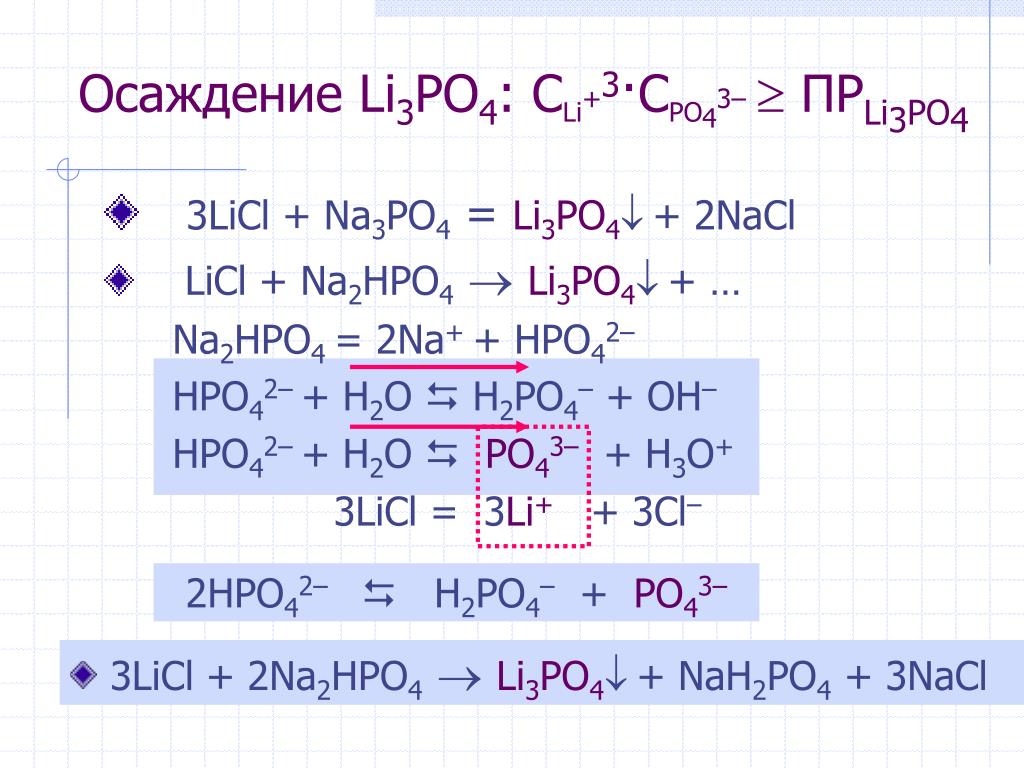
- Отчет № : UCRL-JRNL-211246
- Номер гранта : W-7405-ENG-48
- Отчет Управления научной и технической информации № : 877777
- Архивный ресурсный ключ : ковчег:/67531/metadc874466
Коллекции
Эта статья является частью следующего сборника связанных материалов.
Управление научно-технической информации Технические отчеты
Отчеты, статьи и другие документы, собранные в Управлении научной и технической информации.
Управление научной и технической информации (OSTI) — это офис Министерства энергетики (DOE), который собирает, сохраняет и распространяет результаты исследований и разработок (НИОКР), спонсируемых Министерством энергетики, которые являются результатами проектов НИОКР или другой финансируемой деятельности в DOE. лаборатории и объекты по всей стране, а также получатели грантов в университетах и других учреждениях.
О | Просмотрите эту коллекцию
Какие обязанности у меня есть при использовании этой статьи?
Цифровые файлы
- 33 файлы изображений доступны в нескольких размерах
- 1
файл
(.
 pdf)
pdf) - API метаданных: описательные и загружаемые метаданные, доступные в других форматах
Когда
Даты и периоды времени, связанные с этой статьей.
Дата создания
- 6 апреля 2005 г.

Добавлено в цифровую библиотеку ЕНТ
- 21 сентября 2016 г., 2:29
Описание Последнее обновление
- 9 ноября 2020 г.
 , 15:15
, 15:15
Статистика использования
Когда эта статья использовалась в последний раз?
Вчерашний день: 0
Последние 30 дней: 0
Всего использовано: 114
Дополнительная статистика
Взаимодействие с этой статьей
Вот несколько советов, что делать дальше.
Поиск внутри
Поиск
Начать чтение
PDF-версия также доступна для скачивания.
- Все форматы
Цитаты, права, повторное использование
- Ссылаясь на эту статью
- Обязанности использования
- Лицензирование и разрешения
- Связывание и встраивание
- Копии и репродукции
Международная структура взаимодействия изображений
Мы поддерживаем IIIF Презентация API
Распечатать/поделиться
Полезные ссылки в машиночитаемом формате.
Архивный ресурсный ключ (ARK)
- ERC Запись: /ark:/67531/metadc874466/?
- Заявление о стойкости: /ark:/67531/metadc874466/??
Международная структура совместимости изображений (IIIF)
- IIIF Манифест: /ковчег:/67531/metadc874466/манифест/
Форматы метаданных
- УНТЛ Формат:
/ark:/67531/metadc874466/metadata.
 untl.xml
untl.xml - DC RDF: /ark:/67531/metadc874466/metadata.dc.rdf
- DC XML: /ark:/67531/metadc874466/metadata.dc.xml
- OAI_DC : /oai/?verb=GetRecord&metadataPrefix=oai_dc&identifier=info:ark/67531/metadc874466
- МЕТС :
/ark:/67531/metadc874466/metadata.
 mets.xml
mets.xml - Документ OpenSearch: /ark:/67531/metadc874466/opensearch.xml
Картинки
- Миниатюра: /арк:/67531/metadc874466/миниатюра/
- Маленькое изображение: /ковчег:/67531/metadc874466/маленький/
URL-адреса
- В текст:
/ark:/67531/metadc874466/urls.
 txt
txt
Статистика
- Статистика использования: /stats/stats.json?ark=ark:/67531/metadc874466
Дин, Л.Н.; Грант, Д.М.; Шильдбах, Массачусетс; Смит, Р.А.; Зикхаус, WJ; Балаш, Б. и соавт.
Кинетическое измерение и прогноз выделения водорода из поликристаллической системы LiH/Li2O/LiOH,
статья,
6 апреля 2005 г .;
Ливермор, Калифорния.
(https://digital.library.unt.edu/ark:/67531/metadc874466/:
по состоянию на 25 сентября 2022 г.),
Библиотеки Университета Северного Техаса, цифровая библиотека ЕНТ, https://digital.library.unt.edu;
зачисление отдела государственных документов библиотек ЕНТ.
Savannah Resources Plc — Обзор лития
Цена акций на 16:28
LSE AIM: SAV2.40 GBX
-0,05 — -2,04% относительно распространенный металлический элемент и широко распространен в очень малых концентрациях в различных минеральных соединениях и солях в земной коре и в морской воде.
Литий никогда не встречается в природе в чистом виде из-за его реакционной способности, но встречается в более чем 100 различных минеральных соединениях, не представляющих опасности для здоровья. Геологическая служба США оценила мировые запасы лития в 14 миллионов тонн в 2018 году, однако месторождения, которые экономически выгодны для разработки, относительно редки и делятся на две широкие категории: твердые породы (включая глины) и рассолы.
Распространенные литийсодержащие минералы
В категории твердых пород сподумен, найденный на литиевом проекте Баррозу в Саванне в Португалии, на сегодняшний день является наиболее распространенным литийсодержащим минералом, разрабатываемым на экономически рентабельных месторождениях. . Сподумен обычно встречается в пегматитах, которые представляют собой магматические породы, близкие по минеральному составу к гранитам, но с очень крупными зернами. Проект Barroso Lithium будет производить минерал сподумен, а не элементарный литий. Сподумен не токсичен и не вступает в реакцию.
. Сподумен обычно встречается в пегматитах, которые представляют собой магматические породы, близкие по минеральному составу к гранитам, но с очень крупными зернами. Проект Barroso Lithium будет производить минерал сподумен, а не элементарный литий. Сподумен не токсичен и не вступает в реакцию.
Mineral name | Chemical formula | Li Content (Li%) | Notes |
|---|---|---|---|
| Spodumene | |||
Сподумен | LiAlSi 2 O 6 | 3,7 | Самый распространенный Li-содержащий минерал, такой как Mina и Portugal |
| Amblygonite | |||
Amblygonite | (LI, NA) Alpo 4 (F, OH) | 6 .||
| Eucrytite | |||
Eucrytite | Lialsio 4 | .||
| Hectorite | |||
Hectorite | Na 0.3 (Mg,Li) 3 Si 4 O 10 (OH) 2 | 0.5 | Минерал смектитовой глины в настоящее время оценивается как потенциальный экономический источник лития. |
| Джадарит | |||
Джадарит | LiNaSiB 3 O 7 (OH) | 7,3 | Обнаружен в Сербии в 2007 г. В настоящее время не используется, но оценивается как потенциальный экономический источник лития. |
| Lepidolite | |||
Lepidolite | K 2 (Li, Al) 5-6 {Si 6 -7Al 2 -1O 2 0} | 1,4–3,6 | Необычная форма слюды, встречающаяся в пегматитах. |
| Petalite | |||
Petalite | LiAlSi 4 O 10 | 1.6-2.3 | Often occurs with lepidolite in pegmatites. |
| Zinnwaldite | |||
Zinnwaldite | KLIFEAL (ALSI 3 ) O 10 (F, OH) 2 3 ). пегматитовые и кварцевые жилы. |
Источник: Британская геологическая служба, компания
Рассолы (жидкости, содержащие растворенные твердые вещества) потенциально могут содержать экономически целесообразные концентрации лития. Континентальные рассолы, обнаруженные в плохо дренируемых внутренних бассейнах, стали крупными центрами производства лития, особенно там, где высокая скорость солнечного испарения может использоваться в качестве недорогого средства увеличения концентрации лития, когда рассол находится на поверхности перед последующей обработкой. Также ведутся работы по оценке возможности извлечения лития из рассолов, связанных с геотермально активными районами и нефтяными месторождениями, где рассолы извлекаются как отходы из подземных пластов вместе с нефтью и газом.
Континентальные рассолы, обнаруженные в плохо дренируемых внутренних бассейнах, стали крупными центрами производства лития, особенно там, где высокая скорость солнечного испарения может использоваться в качестве недорогого средства увеличения концентрации лития, когда рассол находится на поверхности перед последующей обработкой. Также ведутся работы по оценке возможности извлечения лития из рассолов, связанных с геотермально активными районами и нефтяными месторождениями, где рассолы извлекаются как отходы из подземных пластов вместе с нефтью и газом.
Deposit class | Deposit type | Description | Typical grade | Examples |
|---|---|---|---|---|
| Hard rock | ||||
Каменная порода | Пегматиты | Крупнозернистая магматическая порода, образовавшаяся при поздней стадии кристаллизации магм | 1,0-4% Li 2 O | Зеленые кусты, Австралия; Mina Do Barroso, Portugal |
Гекторт | линзы глины для схейта в ассоциации с вулканическими центрами | 0. | ||
Джадарит | Altered basinal sediments | 1.5% Li 2 O | Jadar, Serbia | |
| Brine | ||||
Brine | Continental | Salt pans/salars in enclosed бассейны с обогащенными растворами лития | 0,04-0,15% Li | Clayton Valley, США; Салар де Атакама, Чили; Салар де Омбре Муэрто, Аргентина |
Geothermal | Enriched lithium bearing solutions associated with geothermally active areas | 0. | Salton Sea area, USA | |
Месторождение | Обогащенные литием растворы, удаляемые как отходы с действующих месторождений | 0,01-0,05% Li | Нефтяное месторождение Смаковер, США |
Источник: British Geological Survey, Company
Торговля литием в основном сосредоточена вокруг основного литиевого сырья и химических веществ, таких как сподуменовый концентрат, карбонат лития и гидроксид лития, которые значительно различаются по содержанию лития. . Параллельно с этим справочные данные, относящиеся к содержаниям лития в минеральных пробах и рудных ресурсах, а также запасы для проектов с твердыми породами и рассолами, также сообщаются с использованием ряда различных единиц измерения, например. частей на миллион (ppm) Li и процентное содержание Li, Li 2 O или карбонат лития. Чтобы нормализовать эти данные, участники рынка часто также сообщают данные в терминах «эквивалент карбоната лития» или «LCE», чтобы информацию можно было легко сравнивать на основе сопоставимых данных. Преобразование в LCE основано на формулах, приведенных в таблице ниже.
частей на миллион (ppm) Li и процентное содержание Li, Li 2 O или карбонат лития. Чтобы нормализовать эти данные, участники рынка часто также сообщают данные в терминах «эквивалент карбоната лития» или «LCE», чтобы информацию можно было легко сравнивать на основе сопоставимых данных. Преобразование в LCE основано на формулах, приведенных в таблице ниже.
Чтобы преобразовать из | Химическая формула | 5 Умножить на 51940 | ||
|---|---|---|---|---|
Lithium (Li) content | Lithium Oxide (Li 2 0) content | Lithium carbonate Equivalent (LCE) | ||
| Lithium | ||||
Lithium | LI | 1 | 2,153 | 5. |
Lithium Oxide | Li 2 O | 0.464 | 1 | 2.473 |
| Lithium carbonate | ||||
Lithium carbonate | Li 2 CO 3 | 0,188 | 0,404 | 1 |
| Monohydrate1507 | ||||
Lithium hydroxide monohydrate | LiOH. | 0.165 | 0.356 | 0.880 |
Source: British Geological Survey
Despite its rapid рост в последние годы, рынок лития остается рынком специальной химии небольшого размера, а цены на литиевые продукты остаются относительно непрозрачными по сравнению с гораздо более крупными и более ликвидными рынками драгоценных, неблагородных и массовых металлов.
Однако несколько поставщиков публикуют цены на сподумен и ряд литиевых химикатов, включая карбонат лития, гидроксид лития и хлорид лития. Эти цены указаны в различных валютах и основаны на отправке или доставке в ряд соответствующих мест, например, в г. Австралия, Китай, Европа.
Большая часть литиевого материала покупается и продается в соответствии с долгосрочными договорными соглашениями с формулами цен, основанными на опубликованных ценах, скорректированных с учетом различных факторов, включая качество продукции и место доставки/отгрузки. Торговля на спотовом рынке в настоящее время относительно незначительна, но это может измениться, если рынок значительно расширится в течение следующего десятилетия, как ожидается.
Торговля на спотовом рынке в настоящее время относительно незначительна, но это может измениться, если рынок значительно расширится в течение следующего десятилетия, как ожидается.
Цены на карбонат лития, гидроксид лития и сподумен химической чистоты, 2018-21 гг. (долл. США за метрическую тонну):
- Сподумен (правая сторона)
- Карбонат лития (левая часть)
- Гидроксид лития (левая часть)
4 Источники : SP Angel/AsiaMetals
? => LiOH (гидроксид лития)
| Поиск |
= гидроксид лития
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| jpg» substance-weight=»18.01528 ± 0.00044″> H 2 O | + | Li 2 O | → 74 | 7 02 | |
| вода | Литий оксид; оксидилитий; Oxybislithium | lithium hydroxide | |||
| 1 | 1 | 2 | Hệ số | ||
| Nguyên — Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении H
2 O + Li 2 O → 2LiOHВ каких условиях происходит реакция h3O (вода) с Li2O (оксид лития; оксидилитий; оксибислитий)?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции и образовываться LiOH (гидроксид лития)?
Явление после реакции h3O (воды) с Li2O (оксидом лития; оксидилитием; оксибислитием)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта LiOH (гидроксид лития), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов Li2O (оксид лития; оксидилитий; оксибислитий), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Другие вопросы, связанные с химическими реакциями H
2 O + Li 2 O → 2LiOHВопросы, связанные с реагентом h3O (вода)
Каковы химические и физические характеристики h3O (воды)? реакции, в которых в качестве реагента используется h3O (вода)?
Вопросы, связанные с реагентом Li2O (оксид лития; оксидилитий; оксибислитий)
Каковы химические и физические характеристики Li2O (оксид лития; оксидилитий; оксибислитий)? В каких химических реакциях используется Li2O (оксид лития; оксидилитий; оксибислитий) в качестве реагента?
Вопросы, связанные с продуктом LiOH (гидроксид лития)
Каковы химические и физические характеристики LiOH (оксид лития; оксидилитий; оксибислитий)? Каковы химические реакции, в которых LiOH (гидроксид лития) является продуктом?
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
Реакция h3O (nước) реакция с Li2O (лити-оксит) с образованием LiOH (лити-гидроксит)
Реакция с образованием вещества h3O (nước) (вода)
3BaO + 2H 3 PO 4 → 3H 2 O + Ba 3 (PO 4 ) 2 NAOH + C 6 H 5 BR → C 6 H 5 ONA + H 2 O + NABR 2H 2 S + 3O 2 → 2H 2 1 O + 2SO 2
Реакция, в результате которой образуется вещество Li2o (liti oxit) (оксид лития; оксидилитий; oxybislithium)
4li + o 2 → 2li 2 o 2lioh → H 2 O + Li 2 O C + Li 2 121212121212121212121212121212121212121212121212121212121212121212121212121212121212121 2 2 O C + LI 2 12112121212121212121212121212121 2 3 .

 Terai et al.
Terai et al.  К сожалению, высокая реакционная способность лития по отношению к атмосферным загрязнениям представляет собой высокий риск для безопасности, что может ограничить коммерческое применение металлических литиевых анодов. На примере окисления лития в этой работе показано образование скоординированных кластеров на поверхности металлического лития, которые демонстрируют поразительное сходство с субоксидами класса соединений. Показано, что кластеры оказывают решающее влияние на поглощение, диссоциацию и диффузию на поверхности металла и дают представление о механизме начальной реконструкции, наблюдаемой для литиевых анодов.
К сожалению, высокая реакционная способность лития по отношению к атмосферным загрязнениям представляет собой высокий риск для безопасности, что может ограничить коммерческое применение металлических литиевых анодов. На примере окисления лития в этой работе показано образование скоординированных кластеров на поверхности металлического лития, которые демонстрируют поразительное сходство с субоксидами класса соединений. Показано, что кластеры оказывают решающее влияние на поглощение, диссоциацию и диффузию на поверхности металла и дают представление о механизме начальной реконструкции, наблюдаемой для литиевых анодов.
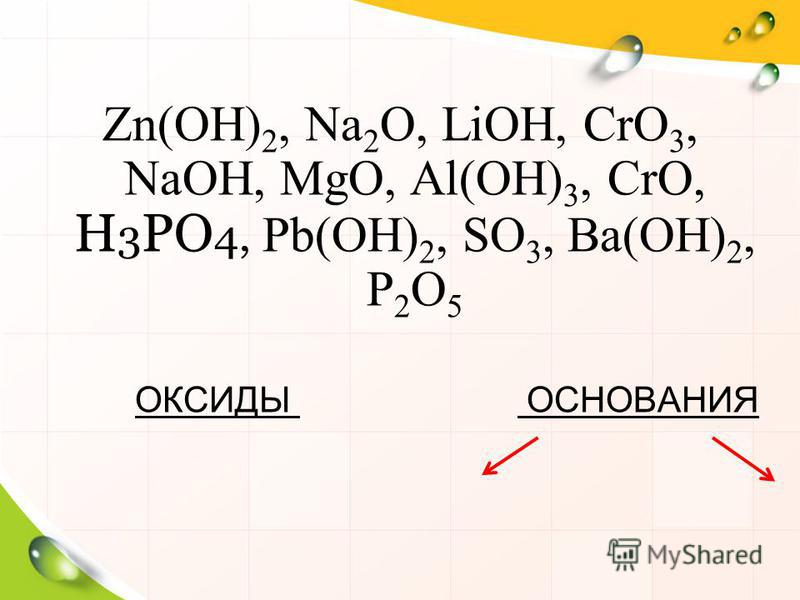
 Получение H 2 по реакции LiH с LiOH с образованием прослойки оксида лития (Li 2 O) термодинамически выгодно, скорость дальнейшей реакции ограничивается диффузией через Li 2 O и стабильностью разлагающийся LiOH. Гидроксид лития на границе раздела LiOH/вакуум также легко разлагается до Li 2 O, высвобождая H 2 O, который впоследствии реагирует с LiH в закрытой системе с образованием H 2 . В начале сухого разложения, где преобладающим продуктом является H 2 , энергия активации газовыделения из тонкой пленки LiOH ниже, чем для объемного LiOH. Однако по мере протекания реакций на границах LiH/Li 2 O/LiOH и на границах LiOH/вакуум общий энергетический барьер активации для дегазации приближается к барьеру разложения объемного LiOH. Разработанная здесь кинетика предсказывает профиль выделения водорода, хорошо согласующийся с выделением водорода, наблюдаемым при длительном изотермическом хранении.
Получение H 2 по реакции LiH с LiOH с образованием прослойки оксида лития (Li 2 O) термодинамически выгодно, скорость дальнейшей реакции ограничивается диффузией через Li 2 O и стабильностью разлагающийся LiOH. Гидроксид лития на границе раздела LiOH/вакуум также легко разлагается до Li 2 O, высвобождая H 2 O, который впоследствии реагирует с LiH в закрытой системе с образованием H 2 . В начале сухого разложения, где преобладающим продуктом является H 2 , энергия активации газовыделения из тонкой пленки LiOH ниже, чем для объемного LiOH. Однако по мере протекания реакций на границах LiH/Li 2 O/LiOH и на границах LiOH/вакуум общий энергетический барьер активации для дегазации приближается к барьеру разложения объемного LiOH. Разработанная здесь кинетика предсказывает профиль выделения водорода, хорошо согласующийся с выделением водорода, наблюдаемым при длительном изотермическом хранении.
 ядерных материалов, том 465, 2015, с. 674-681
ядерных материалов, том 465, 2015, с. 674-681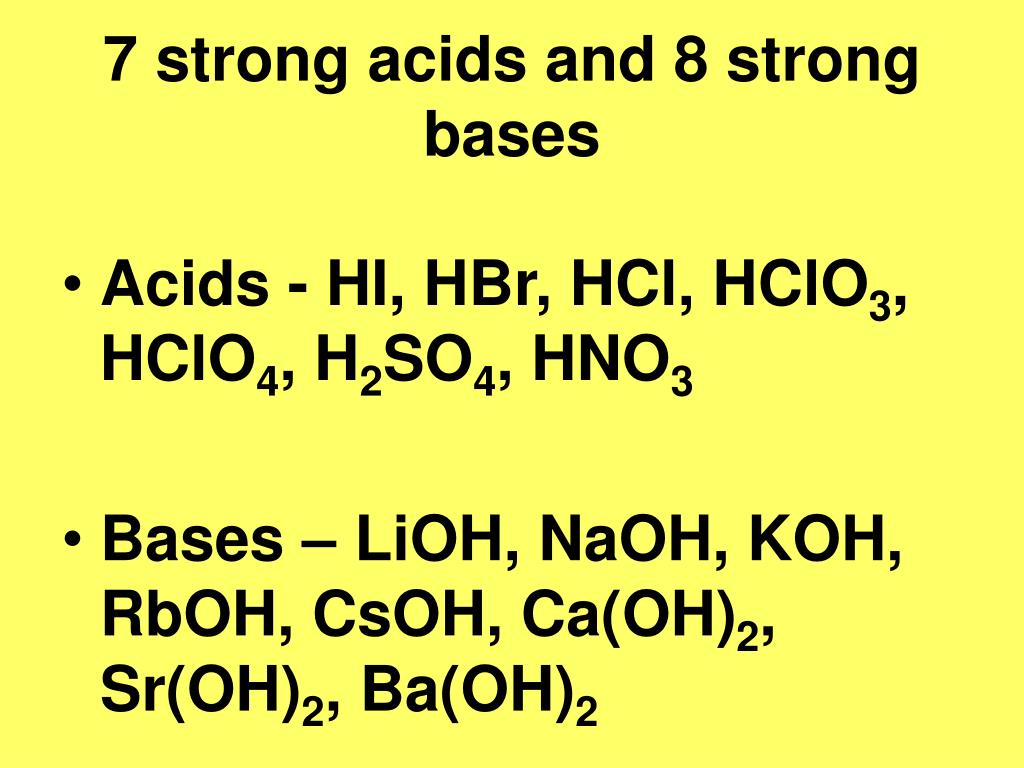 Однако взаимодействие сплава с графитом контейнера не учитывалось, что приводило к существенно меньшим значениям измеряемых давлений пара.
Однако взаимодействие сплава с графитом контейнера не учитывалось, что приводило к существенно меньшим значениям измеряемых давлений пара. Известно, что эти условия потока создают дополнительные потери давления на МГД. Чтобы оценить влияние изменений конструкции на МГД-расход и перепад давления, предыдущий участок испытаний был адаптирован к новой конструкции. Экспериментальные результаты показывают, что модификации конструкции у первой стенки приводят к увеличению перепада давления у первой стенки в 3-3,5 раза. Как следствие, общее падение давления становится больше. Явления трехмерной МГД, возникающие на первой стенке, по-видимому, в основном связаны с эффектами инерции, которые ограничены слоями, параллельными магнитному полю.
Известно, что эти условия потока создают дополнительные потери давления на МГД. Чтобы оценить влияние изменений конструкции на МГД-расход и перепад давления, предыдущий участок испытаний был адаптирован к новой конструкции. Экспериментальные результаты показывают, что модификации конструкции у первой стенки приводят к увеличению перепада давления у первой стенки в 3-3,5 раза. Как следствие, общее падение давления становится больше. Явления трехмерной МГД, возникающие на первой стенке, по-видимому, в основном связаны с эффектами инерции, которые ограничены слоями, параллельными магнитному полю. . Композиты охарактеризованы методами сканирующей электронной микроскопии, рентгеноструктурного анализа и спектроскопии импеданса на воздухе в интервале температур 300–600 °С. Независимо от состава и размера зерен все образцы показали одинаковую зависимость электропроводности от температуры с резким изменением, близким к температуре эвтектики карбонатов. При T > 500 °C все материалы имеют одинаковую проводимость, что указывает на то, что расплавленные карбонаты преобладают в электрических характеристиках. Однако при низкой температуре (300–450 °C) во всех композитах можно заметить значительные различия, при этом наилучшие характеристики наблюдаются у композитов на основе церия с более крупным размером зерна (около 135 нм).
. Композиты охарактеризованы методами сканирующей электронной микроскопии, рентгеноструктурного анализа и спектроскопии импеданса на воздухе в интервале температур 300–600 °С. Независимо от состава и размера зерен все образцы показали одинаковую зависимость электропроводности от температуры с резким изменением, близким к температуре эвтектики карбонатов. При T > 500 °C все материалы имеют одинаковую проводимость, что указывает на то, что расплавленные карбонаты преобладают в электрических характеристиках. Однако при низкой температуре (300–450 °C) во всех композитах можно заметить значительные различия, при этом наилучшие характеристики наблюдаются у композитов на основе церия с более крупным размером зерна (около 135 нм). 131 -134
131 -134 Материалы, том 354, 2014, стр. 303-308
Материалы, том 354, 2014, стр. 303-308 , Салитра Г. и Аурбах Д. Проблемы разработки передовых литий-ионных аккумуляторов: обзор. Энергетическая среда. науч. 4, 3243 (2011).
, Салитра Г. и Аурбах Д. Проблемы разработки передовых литий-ионных аккумуляторов: обзор. Энергетическая среда. науч. 4, 3243 (2011). К. и Коргель, Б. А. Гибкие германиевые нанопровода: идеальная прочность, пластичность при комнатной температуре и сгибаемая полупроводниковая ткань. ACS Nano 4, 2356–2362 (2010).
К. и Коргель, Б. А. Гибкие германиевые нанопровода: идеальная прочность, пластичность при комнатной температуре и сгибаемая полупроводниковая ткань. ACS Nano 4, 2356–2362 (2010). & Ruckenstein, E. Наноструктурированный Li2O из LiOH с помощью электронного облучения. хим. физ. лат. 430, 80–83 (2006).
& Ruckenstein, E. Наноструктурированный Li2O из LiOH с помощью электронного облучения. хим. физ. лат. 430, 80–83 (2006). et al. Дискретная пластичность в кристаллах золота размером менее 10 нм. Нац. коммун. 1, 144 (2010).
et al. Дискретная пластичность в кристаллах золота размером менее 10 нм. Нац. коммун. 1, 144 (2010). Дж. Матер. Рез. 13, 2597–2601 (1998).
Дж. Матер. Рез. 13, 2597–2601 (1998).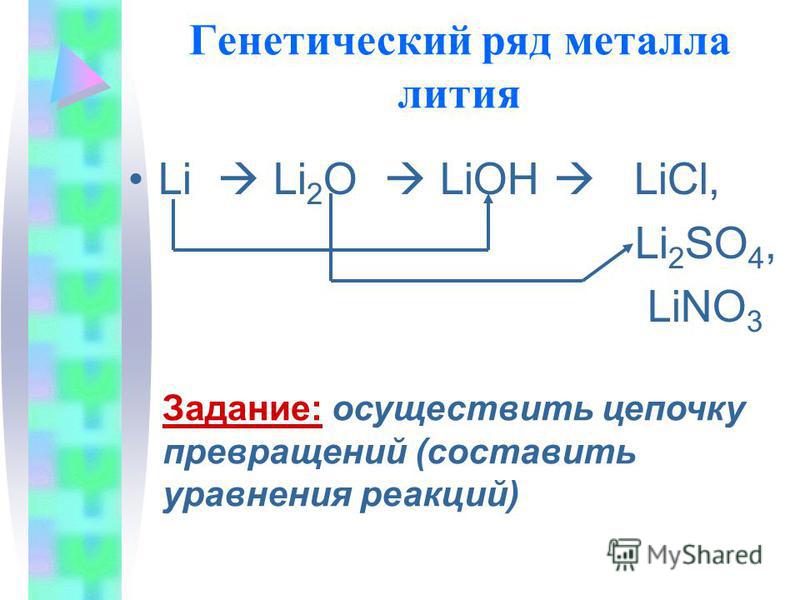 Дж. Заявл. физ. 78, 974–982 (1995).
Дж. Заявл. физ. 78, 974–982 (1995). Mao
Mao Н.
Н. Дж.
Дж.
 pdf)
pdf)
 , 15:15
, 15:15 untl.xml
untl.xml mets.xml
mets.xml txt
txt 4.777.7.77 9003 9000 3 9000 3 9000 3 9000 3 9007.77.77.77 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9.
4.777.7.77 9003 9000 3 9000 3 9000 3 9000 3 9007.77.77.77 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9003 9.
 4% LIT0120120120120120120120115115115115115115115115115115115115115115111111118. Сонора, Мексика
4% LIT0120120120120120120120115115115115115115115115115115115115115115111111118. Сонора, Мексика 01-0.035% Li
01-0.035% Li 323
323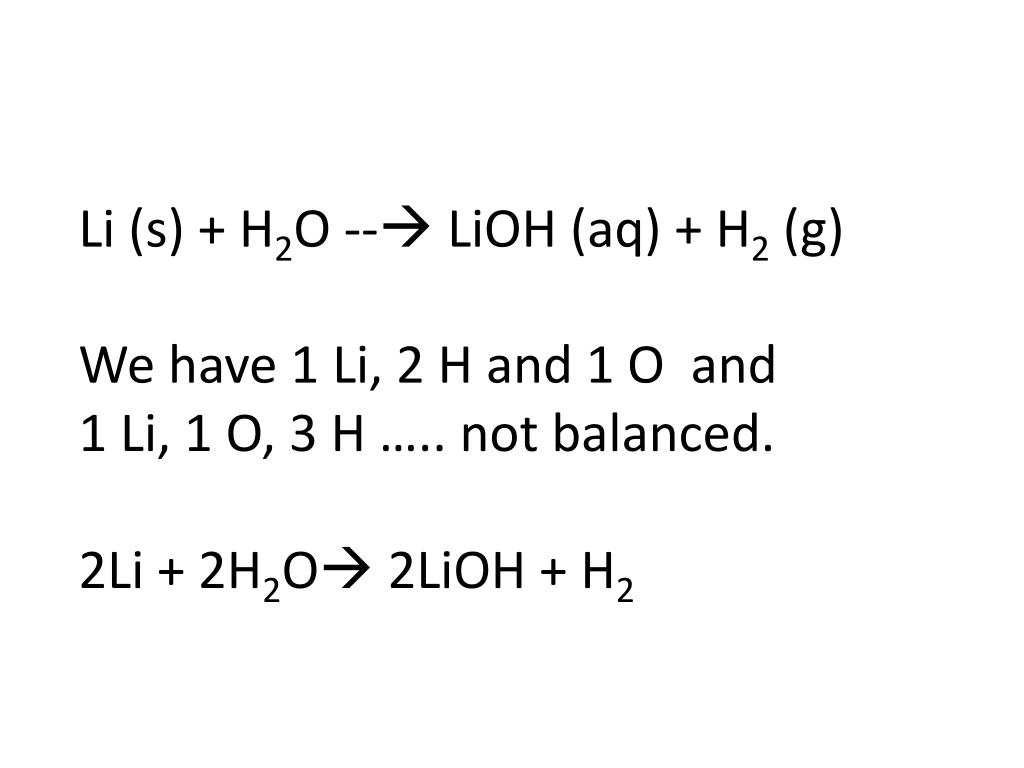 H 2 0
H 2 0